Lymfedém po operacích na spádových lymfatických uzlinách pro karcinom prsu
Lymphoedema Following Regional Lymph Node Surgery for Breast Cancer
Background:
The treatment of breast cancer is based on the multimodal principle and surgery of regional lymph nodes is an inseparable part of this. Indication criteria are changing constantly folowing advances in other modalities. It is necessary to consider not only the diagnostic or therapeutic benefit but also to take into account adverse effects. Previous studies have demonstrated that axillary dissection (ALND) is burdened by a high frequency of chronic lymphoedema of the arm or chest wall; however, a considerable percentage of patients may also suffer from lymphoedema after sentinel lymph node biopsy (SLNB).
Aim:
This paper focuses on the pathophysiology of lymphoedema, its potential predictive factors, and its complications. Furthermore, it presents an overview of published studies comparing the incidences of lymphoedema after current axillary surgery for breast cancer together with current trends designed to radically reduce the number of these operations. It also briefly refers to the possibilities of implementing preventive or therapeutic operations for lymphoedema.
Conclusions:
Both ALND and SLNB are burdened by a clinically significant risk of lymphoedema. This risk is more serious after ALND. In the medium term, approximately 7–59% of operated patients suffer from lymphoedema. The incidence of lymphoedema after SLNB, considered a very gentle method, is also not negligible (0–14%). As the number of patients surviving breast cancer treatment continues to increase, monitoring the undesirable effects of axillary surgery over the long term will become more important. The results of published studies support research into treatment methods that have the potential to reduce the radicality of axillary surgery while preserving or improving total medical effectiveness.
Key words:
breast neoplasms – sentinel lymph node biopsy – axillary dissection – adverse effects – breast cancer lymphedema
This work was supported by the grants MEYS – NPS I – LO1413 and MH CZ – DRO (MMCI, 00209 - 805).
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted:
7. 11. 2016
Accepted:
5. 12. 2016
Authors:
P. Vrtělová 1; O. Coufal 1,2
; V. Fait 1,2; L. Gabrielová 1; O. Zapletal 1
Authors‘ workplace:
Klinika operační onkologie, Masarykův onkologický ústav, Brno
1; Lékařská fakulta MU, Brno
2
Published in:
Klin Onkol 2017; 30(1): 34-40
Category:
Review
doi:
https://doi.org/10.14735/amko201734
Overview
Východiska:
Léčba karcinomu prsu je zásadně multimodální a její nedílnou součástí jsou chirurgické výkony na spádových mízních uzlinách. Indikační kritéria operací se v návaznosti na rozvoj ostatních modalit neustále vyvíjejí. Je třeba zvažovat nejen diagnostický či léčebný benefit, ale přihlížet i k riziku nežádoucích účinků. Předchozí studie prokázaly, že axilární disekce (axillary lymph node dissection – ALND) je zatížena vysokou frekvencí chronického lymfedému paže a hrudní stěny, nicméně určité procento pacientek jím může trpět i po sentinelové biopsii (SLNB).
Cíl:
Sdělení se věnuje patofyziologii lymfedému, jeho možným prediktivním faktorům a komplikacím. Dále předkládá přehled publikovaných studií srovnávajících incidenci lymfedému po současných výkonech na spádových uzlinách pro karcinom prsu spolu s aktuálními trendy snižování radikality těchto operací a stručně zmiňuje možnosti preventivních či léčebných chirurgických výkonů pro lymfedém.
Závěr:
Jak ALND, tak SLNB jsou zatíženy klinicky významným rizikem lymfedému. Toto riziko je závažnější po ALND. Ve střednědobém horizontu trpí cca 7–59 % operovaných pacientů lymfedémem. Incidence lymfedému po SLNB, považované za velmi šetrnou metodu, však také není zanedbatelná (0–14 %). Vzhledem ke stále narůstajícímu počtu pacientek přežívajících po léčbě mamárního karcinomu je žádoucí, aby nežádoucí účinky axilárních operací byly v praxi dlouhodobě sledovány. Výsledky publikovaných studií podporují výzkum léčebných metod, které by umožnily snižování chirurgické radikality, tedy další eliminaci chirurgických výkonů v axile při zachování či zlepšování celkové léčebné účinnosti.
Klíčová slova:
nádory prsu – biopsie sentinelové lymfatické uzliny – disekce axily – nežádoucí účinky – lymfedém po mastektomii
Úvod
Léčba karcinomu prsu je zásadně multimodální a její nedílnou součástí jsou chirurgické výkony na spádových mízních uzlinách. V současnosti je význam těchto operací u převážné většiny pacientek spíše diagnostický. Informace o rozsahu lymfatických metastáz slouží k upřesnění stadia (tzv. stagingu) a prognózy nemoci a řadí se mezi důležitá indikační kritéria adjuvantní radioterapie a chemoterapie. Standardní chirurgickou procedurou k zjištění stavu spádových uzlin byla dříve u všech léčených pacientek disekce axily (axillary lymph node dissection – ALND). V 90. letech 20. století byla u pacientek bez klinických známek uzlinových metastáz nahrazena sentinelovou biopsií (sentinel lymph node biopsy – SLNB) [1,2] s disekcí vyhrazenou jen pro případy s nálezem metastáz v sentinelové uzlině (sentinel lymph node – SLN). Indikační kritéria operací se však, v návaznosti na rozvoj ostatních modalit, neustále vyvíjejí. Nyní se do klinické praxe postupně prosazuje vynechávání disekce po pozitivní SLNB (studie ACOSOG Z0011, IBCSG 23-01) [3,4], řazení SLNB až do období po neoadjuvantní léčbě (studie ACOSOG Z1071, SENTINA) [5,6], nahrazování ALND radioterapií (studie EORTC 10981-22023 AMAROS) [7], a zkoumá se dokonce možnost úplného vynechání výkonu na spádových uzlinách (studie SOUND) [8]. Jedním z hlavních důvodů snižování chirurgické radikality je riziko vzniku lymfedému ipsilaterální paže [9,10] a hrudní stěny [11,12] po ALND. Proti původnímu předpokladu byl lymfedém dokumentován i u určitého procenta pacientek po SLNB [13].
Klinický obraz
Sekundární lymfedém je způsoben chronickým městnáním tkáňového moku v intersticiu v důsledku neadekvátní centripetální lymfatické drenáže příslušné tributární oblasti [14]. V iniciální tekutinové fázi (tzv. pitting edema – kompresí tkání lze vytlačit důlek) dochází ke zvětšení objemu epifasciálního prostoru v důsledku stagnace intersticiální tekutiny se zvýšenou koncentrací vysokomolekulárních proteinů a dalších makromolekul, které osmoticky poutají vodu. Pod místem obstrukce dochází k postupnému šíření lymfedému distálním směrem v důsledku prvotní lymfatické hypertenze zbylých kolektorů, která posléze přechází v lymfangiektázii a valvulární insuficienci způsobující retrográdní tok lymfy z podkoží do dermálního plexu [15,16]. Stěny lymfatických cév fibrotizují, dochází v nich k ukládání fibrinových trombů s obliterací dalších lymfatických kanálů a tvorbou lymfo-venózních shuntů. Pokud není lymfedém adekvátně léčen, stav progreduje do solidní fáze (tzv. non-pitting edema) charakterizované hromaděním tukové tkáně a ireverzibilní fibrotizací. Protrahovaný vysokoproteinový otok totiž vede k aktivaci adipocytů, fibroblastů a makrofágů s následnou zvýšenou tvorbou kolagenových depozit v intersticiu, destrukcí elastických vláken a produkcí fibrosklerotické tkáně. Posléze se tyto pevné složky podílejí na nárůstu objemu z 90 % [14,17]. Epidermis je v příslušné oblasti ztluštělá, dochází k hyperkeratinizaci a tvorbě bradavičnatých útvarů (tzv. papilomatosis cutis lymphostatica). Současně jsou přítomny četné ragády doprovázené lymforhoeou, které jsou vstupní bránou infekce kůže a podkoží. Často je patrný obraz tzv. peau d‘orange způsobený kongescí dermálních lymfatik [18].
Dělení stadií lymfedému paže dle International Society of Lymphology [19] je následující:
- 0. stadium – latentní s narušením lymfatické drenáže, ale dosud bez patrného otoku;
- 1. stadium – otok není trvalý, akumulace tekutiny se zmírňuje při elevaci paže;
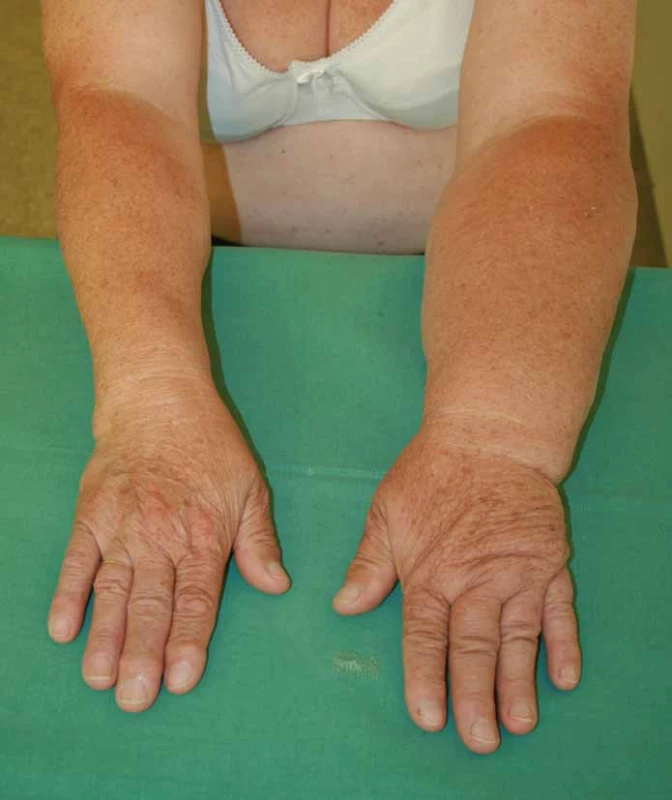
- 2. stadium – otok není zmírněn při elevaci paže, zpočátku při tlaku palce na postiženou partii se tvoří důlek, pozdější změny vedou k absenci tohoto příznaku (obr. 1);
- 3. stadium – deformace postižených partií s fibrotizací podkoží, nejtěžším stadiem je elefantiáza.
Lokální imunologické poruchy
Chronická lymfostáza vede k narušení fyziologické lokální imunitní odpovědi. Tato porucha představuje predispozici k recidivujícím zánětům kůže a podkoží, jako je erysipel [20,21], celulitida [22,23] a lymfangioitida [21], které se samy o sobě dále podílejí na dalším zhoršování lymfedému, a ekzematizace nebo mykózy [18].
Dalším závažným důsledkem jsou sekundární malignity, na jejichž vzniku se vedle narušení imunitních reakcí v postižené oblasti podílí stimulace angiogeneze s proliferací krevních a lymfatických kolaterál [24]. Mezi maligní tumory asociované s chronickým lymfedémem končetin patří relativně vzácný, ale vysoce maligní lymfangiosarkom (tzv. Stewartův-Trevesův syndrom) [25,26], popsány byly i případy Kaposiho sarkomu, kožního lymfomu, maligního melanomu, bazocelulární a spinocelulární karcinomy a karcinom z Merkelových buněk [27].
Srovnání morbidity ALND a SLNB
Dosavadní studie na téma morbidity po chirurgických výkonech v axile dospěly převážně k výsledku, že ALND je zatížena významně vyšší frekvencí lymfedému než SLNB. Výsledky dosažené v jednotlivých studiích se však často výrazně liší v konkrétních hodnotách. Situace je komplikovaná tím, že neexistuje jednoduchá a standardizovaná metoda k hodnocení přítomnosti a závažnosti lymfedému. Do dnešní doby bylo na dané téma publikováno 22 prospektivních studií [4,28–53], z toho devět bylo randomizovaných [4,34,39,41,43,45,48,49,51]. Interpretace výsledků je problematická z důvodu celé řady metodologických odlišností, jako je design studie, délka sledování, definice lymfedému, způsob jeho stanovení (objektivní, či subjektivní hodnocení, odlišné hraniční hodnoty). V některých studiích chybí srovnání se stavem před operací [4,30,33,34,45,49] či s kontralaterální stranou [36,42], což mohlo výsledky podstatně ovlivnit [46], jedná se o malý počet pacientů [28,30,35,38,40], chybí opakování měření v předem definovaných časových odstupech [4,28,30,31,33,38,46,47] nebo jsou slučovány výsledky kontrolních měření v příliš širokém časovém rozpětí dohromady [4,28,30,31,42,46,47,49]. Problémem analýzy randomizovaných studií dle původního léčebného záměru (tzv. intention-to-treat) bylo zahrnutí výsledků části pacientek s pozitivní SLNB a následně doplněnou disekcí (17,4–40,0 %) [39,41,45,48] a/nebo ozářením celé axily (0,7 – 6,9 %) [41,51] do kohorty SLNB. Tyto skutečnosti mohly způsobit nadhodnocení výskytu obtíží po SLNB. Odlišnosti v léčbě ve skupině ALND mohly rovněž vést k ovlivnění výsledků. Ve většině studií pacientky podstoupily disekci I. a II. etáže, nicméně ve třech studiích byla u 80,6–100 % elektivně disekována i III. etáž [34,41,45]. Naopak k podhodnocení výsledků mohlo dojít ve studii ALMANAC tím, že 25 % žen v kontrolní skupině s ALND podstoupilo pouze axilární sampling [41]. Do několika analýz po ALND byly zahrnuty rovněž pacientky s ozářením všech etáží axily (1,1–83,0 %) [36,40,42,50–52]. Zmíněná nekonzistence vychází ze skutečnosti, že striktní randomizace a unifikace klinických postupů jen z důvodu posuzování četnosti nežádoucích účinků je z etického hlediska nepřijatelná.
Frekvence objektivně měřitelného lymfedému v dosavadních studiích široce kolísala. Hodnoty po SLNB se pohybovaly mezi 1 a 6 % a po ALND mezi 7 a 37 % [29,34,42,43,45,53]. Široké rozmezí pramení z absence standardizované metody, kterou by byl lymfedém spolehlivě diagnostikován a re - producibilně posuzována jeho závažnost [54,55]. Metoda měření obvodu je jednoduchá a při zohlednění obvodu i druhostranné končetiny eliminuje možné změny BMI v čase. Opakovaná měření v předem definovaných oblastech s orientací pomocí různých kostních protuberancí byla použita v řadě studií [29,30,32,34,37,42,43,45,46] a její výsledky korelují s hodnotami získanými pomocí volumometrie [56,57]. Studie, které srovnávaly střednědobé rozdíly ve výpočtu objemu paže na základě měření obvodů horní končetiny [31,37,48–50] či pomocí výtlaku vody [29,44,51,53], rovněž ve většině případů konstatovaly signifikantně lepší výsledky po SLNB. Pouze v případě dvou randomizovaných studií nebyly rozdíly statisticky významné [39,41].
Měření obvodů či výpočet objemu končetiny však neumožňuje rozlišení mezi změnami v zastoupení jednotlivých typů měkkých tkání (tuk, svaly, extracelulární tekutina), což může výsledky poněkud zkreslovat. Toto rozlišení je možné např. pomocí bioimpedanční metody, která je na základě měření odporu tkání při průchodu střídavého proudu schopna detekovat zvýšenou akumulaci tekutiny v intersticiu a zachytit tak počínající rozvoj lymfedému ještě před jeho klinickou manifestací, tj. nárůstem objemu končetiny [58,59]. To by mělo klinický význam, neboť časná diagnóza a zahájení léčby ještě před rozvojem výrazného otoku a fibrózy účinněji napomáhají jeho redukci [12,60,61]. Bioimpedanční metoda však nebývá v klinické praxi běžně dostupná.
Klinicky relevantní je ale také subjektivní hodnocení lymfedému, tedy pocit vnímání otoku končetiny samotným pacientem. Při subjektivním hodnocení byl jeho výskyt ještě četnější (0–14 % po SLNB vs. 7–59 % po ALND) [28,33,38,40,41,43,44]. Někteří autoři soudí, že subjektivně udávané hodnoty mohou být nepatřičně nadhodnoceny záměnou s jinými pocity, jako je bolest či snížená citlivost v důsledku přerušení senzitivních nervů [40,46,47]. Ze studie Czerniec et al nicméně vyplynulo, že subjektivní pocit otoku velmi dobře koreloval s výsledky dosaženými pomocí bioimpedanční metody [59]. To je v souladu s nálezy, že subjektivně vnímaný otok je dobrým prediktorem následného rozvoje klinicky patrného lymfedému [12,59], protože pacientem je vnímán zvyšující se tlak v intersticiu již v době, kdy není technicky měřitelný [62]. V klinické praxi by tedy subjektivní stesky neměly být podceňovány, resp. měla by jim být věnovaná náležitá pozornost. Ve třech randomizovaných studiích (ALMANAC, ACOSOG Z0011 a podskupina pN0 případů ve studii Purushotham et al) byly zjištěny statisticky významné rozdíly ve frekvenci subjektivně posuzovaného lymfedému, zatímco výsledky klinického měření obvodu nebo objemu horní končetiny v období 12 měsíců nebyly prokázány [39,41,43].
Co se týká vývoje lymfedému v čase, nepřinášejí dosavadní studie jednoznačné závěry. Ve studii Pain et al vznikl lymfedém u většiny pacientek v období prvního roku po operaci [61], zatímco Petrek et al pozorovali, že 77 % všech případů lymfedému vzniklo v období do 3 let po operaci s dalším meziročním růstem o 1 % [63].
Z faktorů, které se mohou na dlouhodobých nežádoucích následcích podílet, zmiňme rozsah axilárního metastatického postižení [64]. Dalším významným faktorem může být i radioterapie na oblast spádové lymfatické oblasti, která dle literárních údajů prokazatelně zvyšuje incidenci lymfedému [36,37,43,50, 51,65,66].
Chemoterapie dle některých studií může také lymfedém ovlivňovat [10,50, 65], ve většině prací se však její vliv ne - ukázal statisticky významný [30,33,66,67].
Rovněž rozsah výkonu na prsu může být z hlediska lymfedému významný, v metaanalýze Tsai et al byla zaznamenána vyšší četnost lymfedému u pa - cientů po totální mastektomii ve srovnání s lumpektomií [64].
Řada studií potvrdila spojitost lymfedému a obezity [68,69].
Vznik lymfedému pouze u určitého procenta pacientek po ALND je také někdy vysvětlován přítomností konkrétní anatomické varianty lymfatické drenáže horní končetiny. Hlavní rozdíl spočívá v průběhu laterálního provazce lymfatických kolektorů paže. Ten může ústit buď do axilárních uzlin, nebo směřovat přímo do supraklavikulární či infraklavikulární oblasti. Druhá možnost představuje obchvatovou cestu drenáže, která je schopna zabránit rozvoji lymfedému. Výsledná úroveň postižení pak dále záleží na výskytu spojek s radiálním svazkem předloktí. Pokud jsou přítomny (tzv. dlouhý typ), je možné, že bude lymfedému ušetřena celá končetina. V opačném případě (tzv. krátký typ) může být drénována oblast paže, ale lokalizovaný edém postihne předloktí. Kromě anatomických změn končetiny s otevřením lymfo-lymfatických spojek [70] byla popisována i možnost vzniku lymfo-venózních anastomóz s přesměrováním toku lymfy distálně od oblasti poškození [70,71]. Funkční adaptaci na patologický stav pak představuje zvýšená proteolytická aktivita makrofágů s degradací makromolekul na nízkomolekulární peptidy a fragmenty proteinů schopné pronikat z intersticia do žilního oběhu [72]. Dokládal to mimo jiné experiment s bilaterální subkutánní aplikací radioaktivně značeného imunoglobulinu před a 3 měsíce po ALND. Ve srovnání s kontralaterální končetinou bylo na paži operované strany detekováno signifikantní zvýšení vychytávání radioizotopu ve venózní krvi [70,71].
Snahy o prevenci lymfedému
Jednou z metod navržených ke snižování incidence lymfedému po operacích v axile je reverzní mapování lymfatik (axillary reverse mapping – ARM). Jeho podstatou je peroperační identifikace a cílené šetření lymfatické drenáže horní končetiny při průběhu axilou během ALND či SLNB. K vizualizaci lze použít patentní modř, radioizotop či fluorescenční činidlo. Prospektivní studie Yue et al prokázala na souboru 265 pacientek s RAME příznivý vliv ARM na redukci lymfedému horní končetiny (z 33,0 % v kontrolní skupině na 5,9 % po ARM; p < 0,001) [73]. K obdobnému zjištění posléze dospěla i metaanalýza Han et al z roku 2016, která uvádí souhrnnou frekvenci lymfedému paže po všech zákrocích v axile 4,1 % (95% CI 2,9–5,9 %). Rovněž ale vyslovila závěry, že úspěšnost identifikace drenáže horní končetiny je relativně uspokojivá pouze u ALND (82,8 %, 95% CI 78,0–86,6 %), zatímco u SLNB má její použití omezené možnosti (úspěšnost detekce lymfatické drenáže paže pouze v 38,2 % případů, 95% CI 32,9–43,8 %). Dalším, podstatně závažnějším problémem je ale onkologická bezpečnost tohoto postupu. Na případech SLNB bylo demonstrováno, že v 19,6 % (95% CI 14,4–26,1 %) byla SLN totožná s uzlinou vizualizovanou při reverzním mapování (tzv. crossover rate), přičemž v 16,9 % (95% CI 14,2–20,1 %) již byla metastaticky postižena [74]. Tato čísla jsou alarmující, neboť riziko opomenutí exstirpace infiltrované SLN převyšuje samotnou pravděpodobnost vzniku lymfedému po SLNB [75]. In vivo zjištěnou skutečnost, že se drenáž prsu a horní končetiny mohou skutečně překrývat, potvrdila i anatomická studie pražských autorů Pavlišty a Elišky na kadaverech. Mediální kolektory paže směřující do distální části axily v 10,8 % ústily do SLN pro oblast prsu a v dalších 13,0 % do uzliny v její těsné blízkosti [76]. A v neposlední řadě tuto skutečnost dokumentují i dva dosud nepublikované případy z našeho pracoviště, kdy v SLN pro karcinom prsu byla nalezena metastáza melanomu lokalizovaného na příslušné horní končetině. V rámci snahy o prevenci lymfedému využil Boccardo et al v 19 případech peroperační vizualizace aferentních kolektorů paže k provedení okamžitých lymfatiko-venózních anastomóz (LVA) s žilními přítoky v. axillaris. U žádné z pacientek se lymfedém v období 6 a 12 měsíců po ALND nevyskytl. V dané oblasti je nicméně potřeba dalších studií, které by na velkých souborech řádně ověřily onkologickou bezpečnost a také skutečnou schopnost redukovat lymfedém [77].
Občasně jsou některými pracovišti referovány endoskopické ALND [78,79] či SLNB [78,80]. Tuto metodu však nelze považovat za opodstatněnou, neboť je příliš technicky a časově náročná a nebyla potvrzena její onkologická bezpečnost [80,81]. Slibné výsledky předložila rozsáhlá prospektivní randomizovaná multicentrická studie čínských autorů s 1 027 pacientkami, která dokumentovala statisticky významné snížení otoku paže, četnosti bolestí a dysestézií v axile a peroperační krevní ztráty (p < 0,001) při endoskopické operaci ve srovnání s klasickým přístupem. Současně způsob provedení prokazatelně neovlivnil bezpříznakové přežití (p = 0,88), ani celkové přežití (p = 0,95) [79]. Nicméně je známo, že některé chirurgické postupy specifické pro Asii jsou obtížně realizovatelné v euro-americké populaci.
Léčba lymfedému
Léčba již vzniklého lymfedému představuje celoživotní problém. Zahajuje se komplexní dekongestivní terapií, jejímž účelem je podpora dosud zachované resorpční a transportní funkce lymfatického systému v postižené oblasti a snaha o následné udržení dosažené redukce objemu. Řadí se sem manuální lymfodrenáže či intermitentní pneumatická komprese, bandáže a návleky s graduovanou kompresí a fyzioterapie. Nezbytnou součástí úspěšné léčby jsou i režimová opatření, mezi něž patří redukce tělesné hmotnosti a péče o kožní kryt, snaha o prevenci poranění končetiny, případné ošetření ran, eliminace působení horka či chladu, přetěžování končetiny, měření krevního tlaku či odběrů krve na postižené straně, odstranění prstenů, hodinek či příliš těsného oblečení [12,70,82,83]. Účinná farmakoterapie neexistuje, proteolytické enzymy či venofarmaka mají pouze podpůrný charakter [69,83]. Z některých pracovišť jsou referována chirurgická řešení. Operace určené pro časné stadium, kdy je dosud zachována peristaltika lymfatických cév distálně od obstrukce, představují přímé či nepřímé mikrochirurgické rekonstrukční výkony. Z přímých se nejčastěji jedná o lymfatiko-venózní anastomózy [84,85]. Nepřímý postup představuje mikrochirurgický transfer volného transplantátu lymfatických uzlin s jeho cévním zásobením do oblasti postižené lymfedémem. Nejčastěji je využíván lalok z laterální poloviny třísla zásobovaný a. a v. circumflexa ilium superficialis a jeho anastomóza s a. radialis a v. cephalica v oblasti zápěstí [86], předloktí [87] nebo arterio-venózním svazkem a. circumflexa scapullae v axile [88]. Symptomatické výkony jako liposukce [89,90] a resekce lipohypertrofické tkáně [91,92] jsou určeny pro pokročilá stadia lymfedému. Současným předmětem zájmu jsou experimenty s prolymfangiogenními faktory (VEGF-C, ANG-2) [93,94] a kmenovými buňkami [95,96].
Závěr
Lze konstatovat, že jak SLNB, tak ALND jsou i v době současných operačních technik a moderních rehabilitačních přístupů zatíženy klinicky významným rizikem lymfedému. Toto riziko je závažnější po ALND ve srovnání se SLNB. Pokud bychom shrnuli konkrétní dokumentovaná data, lze říci, že ve středně až dlouhodobém horizontu trpí lymfedémem 7–59 % pacientek po ALND. Incidence lymfedému po SLNB, považované za velmi šetrnou metodu, však také není zanedbatelná (uváděna v rozmezí 0–14 %). Nekonkluzivní závěry studií mohou souviset s různorodostí metodiky, která se k vyhodnocování lymfedému použije. Je žádoucí, aby pacientky po obou typech axilárních operací byly dlouhodobě sledovány nejen kvůli záchytu případné recidivy, ale i s ohledem na počínající projevy lymfedému a včasnou intervenci. Vedle klinicky měřitelných změn objemu končetiny je třeba věnovat pozornost i subjektivním symptomům popisovaným samotným pacientem. Vhodná by byla standardizace diagnostických metod v praxi. Závěry publikovaných studií podporují výzkum léčebných metod, které by u karcinomu prsu umožnily eliminaci chirurgických výkonů v axile při zachování celkové léčebné účinnosti.
Práce byla podpořena projektem MŠMT – NPU I – LO1413 a MZ ČR – RVO (MOÚ, 00209 - 805).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Obdrženo: 7. 11. 2016
Přijato: 5. 12. 2016
MUDr. Pavlína Vrtělová
Klinika operační onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: vrtelova@mou.cz
Sources
1. Krag DN, Weaver DL, Alex JC et al. Surgical resection and radiolocalization of the sentinel lymph node in breast cancer using a gamma probe. Surg Oncol 1993; 2 (6): 335–339.
2. Giuliano AE, Kirgan DM, Guenther JM et al. Lymphatic mapping and sentinel lymphadenectomy for breast cancer. Lymphatic mapping and sentinel lymphadenectomy for breast cancer. Ann Surg 1994; 220 (3): 391–398.
3. Giuliano AE, Hunt KK, Ballman KV et al. Axillary dissection vs no axillary dissection in women with invasive breast cancer and sentinel node metastasis: a randomized clinical trial. JAMA 2011; 305 (6): 569–575. doi: 10.1001/jama.2011.90.
4. Galimberti V, Cole BF, Zurrida S et al. Axillary dissection versus no axillary dissection in patients with sentinel-node micrometastases (IBCSG 23-01): a phase 3 randomised controlled trial. Lancet Oncol 2013; 14 (4): 297–305. doi: 10.1016/S1470-2045 (13) 70035-4.
5. Boughey JC, Suman VJ, Mittendorf EA et al. Sentinel lymph node surgery after neoadjuvant chemotherapy in patients with node-positive breast cancer: the ACOSOG Z1071 (Alliance) clinical trial. JAMA 2013; 310 (14): 1455–1461. doi: 10.1001/jama.2013.278932.
6. Kuehn T, Bauerfeind I, Fehm T et al. Sentinel-lymph-node biopsy in patients with breast cancer before and after neoadjuvant chemotherapy (SENTINA): a prospective, multicentre cohort study. Lancet Oncol 2013; 14 (7): 609–618. doi: 10.1016/S1470-2045 (13) 70166-9.
7. Donker M, van Tienhoven G, Straver ME et al. Radiotherapy or surgery of the axilla after a positive sentinel node in breast cancer (EORTC 10981-22023 AMAROS): a randomised, multicentre, open-label, phase 3 non-inferiority trial. Lancet Oncol 2014; 15 (12): 1303–1310. doi: 10.1016/S1470-2045 (14) 70460-7.
8. Gentilini O, Veronesi U. Abandoning sentinel lymph node biopsy in early breast cancer? A new trial in progress at the European Institute of Oncology of Milan (SOUND: sentinel node versus observation after axillary UltraSouND). Breast 2012; 21 (5): 678–681. doi: 10.1016/j.breast.2012.06.013.
9. DiSipio T, Rye S, Newman B et al. Incidence of unilateral arm lymphoedema after breast cancer: a systematic review and meta-analysis. Lancet Oncol 2013; 14 (6): 500–515. doi: 10.1016/S1470-2045 (13) 70076-7.
10. Soares EW, Nagai HM, Bredt LC et al. Morbidity after conventional dissection of axillary lymph nodes in breast cancer patients. World J Surg Oncol 2014; 12 : 67. doi: 10.1186/1477-7819-12-67.
11. Křížová H, Wald M, Barkmanová J. Lymfoscintigrafie u pacientek s nekončetinovým lymfedémem po disekci axily a radioterapii. Klin Onkol 2006; 19 (5): 252–254.
12. Degnim AC, Miller J, Hoskin TL et al. A prospective study of breast lymphedema: frequency, symptoms, and quality of life. Breast Cancer Res Treat 2012; 134 (3): 915–922. doi: 10.1007/s10549-012-2004-x.
13. Verbelen H, Gebruers N, Eeckhout FM et al. Shoulder and arm morbidity in sentinel node-negative breast cancer patients: a systematic review. Breast Cancer Res Treat 2014; 144 (1): 21–31. doi: 10.1007/s10549-014-2846-5.
14. Benda K. Lymfedém končetin v ordinaci praktického lékaře. Med Pro Praxi 2006; 6 : 276–279.
15. Mayrovitz HN. The standard of care for lymphedema: current concepts and physiological considerations. Lymphat Res Biol 2009; 7 (2): 101–108. doi: 10.1089/lrb.2009.0006.
16. Chen C, Crooks S, Keeley V et al. BLS clinical definitions. Sevenoaks: British Lymphology Society: 2001.
17. Granzow JW, Soderberg JM, Kaji AH et al. Review of current surgical treatments for lymphedema. Ann Surg Oncol 2014; 21 (4): 1195–1201. doi: 10.1245/s10434-014-3518-8.
18. Narushima M, Mihara M, Yamamoto Y et al. The intravascular stenting method for treatment of extremity lymphedema with multi-configuration lymphaticovenous anastomoses. Plast Reconstr Surg 2010; 125 (3): 935–943. doi: 10.1097/PRS.0b013e3181cb64da.
19. International Society of Lymphology. The diagnosis and treatment of peripheral lymphedema: 2013 Consensus Document of the International Society of Lymphology. Lymphology 2013; 46 (1): 1–11.
20. Masmoudi A, Maaloul I, Turki H et al. Erysipelas after breast cancer treatment (26 cases). Dermatol Online J 2005; 11 (3): 12.
21. Pereira de Godoy JM, Azoubel LM, Guerreiro Godoy M de F. Erysipelas and lymphangitis in patients undergoing lymphedema treatment after breast-cancer therapy. Acta Dermatovenerol Alp Pannonica Adriat 2009; 18 (2): 63–65.
22. Park SI, Yang EJ, Kim DK et al. Prevalence and epidemiological factors involved in cellulitis in Korean patients with lymphedema. Ann Rehabil Med 2016; 40 (2): 326–333.
23. Hughes LL, Styblo TM, Thoms WW et al. Cellulitis of the breast as a complication of breast-conserving surgery and irradiation. Am J Clin Oncol 1997; 20 (4): 338–341.
24. Ruocco V, Schwartz RA, Ruocco E. Lymphedema: an immunologically vulnerable site for development of neoplasms. J Am Acad Dermatol 2002; 47 (1): 124–127.
25. Stewart FW, Treves N. Lymphangiosarcoma in postmastectomy lymphedema; a report of six cases in elephantiasis chirurgica. Cancer 1948; 1 (1): 64–81.
26. Sharma A, Schwartz RA. Stewart-Treves syndrome: pathogenesis and management. J Am Acad Dermatol 2012; 67 (6): 1342–1348. doi: 10.1016/j.jaad.2012.04.028.
27. Lee R, Saardi KM, Schwartz RA. Lymphedema-related angiogenic tumors and other malignancies. Clin Dermatol 2014; 32 (5): 616–620. doi: 10.1016/j.clindermatol.2014.04.008.
28. Schrenk P, Rieger R, Shamiyeh A et al. Morbidity following sentinel lymph node biopsy versus axillary lymph node dissection for patients with breast carcinoma. Cancer 2000; 88 (3): 608–614.
29. Sener SF, Winchester DJ, Martz CH et al. Lymphedema after sentinel lymphadenectomy for breast carcinoma. Cancer 2001; 92 (4): 748–752.
30. Burak WE, Hollenbeck ST, Zervos EE et al. Sentinel lymph node biopsy results in less postoperative morbidity compared with axillary lymph node dissection for breast cancer. Am J Surg 2002; 183 (1): 23–27.
31. Haid A, Kuehn T, Konstantiniuk P et al. Shoulder-arm morbidity following axillary dissection and sentinel node only biopsy for breast cancer. Eur J Surg Oncol 2002; 28 (7): 705–710.
32. Temple LK, Baron R, Cody HS 3rd et al. Sensory morbidity after sentinel lymph node biopsy and axillary dissection: a prospective study of 233 women. Ann Surg Oncol 2002; 9 (7): 654–662.
33. Swenson KK, Nissen MJ, Ceronsky C et al. Comparison of side effects between sentinel lymph node and axillary lymph node dissection for breast cancer. Ann Surg Oncol 2002; 9 (8): 745–753.
34. Veronesi U, Paganelli G, Viale G et al. A randomized comparison of sentinel-node biopsy with routine axillary dissection in breast cancer. N Engl J Med 2003; 349 (6): 546–553.
35. Peintinger F, Reitsamer R, Stranzl H et al. Comparison of quality of life and arm complaints after axillary lymph node dissection vs sentinel lymph node biopsy in breast cancer patients. Br J Cancer 2003; 89 (4): 648–652.
36. Rietman JS, Dijkstra PU, Geertzen JH et al. Treatment-related upper limb morbidity 1 year after sentinel lymph node biopsy or axillary lymph node dissection for stage I or II breast cancer. Ann Surg Oncol 2004; 11 (11): 1018–1024.
37. Rietman JS, Geertzen JH, Hoekstra HJ et al. Long term treatment related upper limb morbidity and quality of life after sentinel lymph node biopsy for stage I or II breast cancer. Eur J Surg Oncol 2006; 32 (2): 148–152.
38. Barranger E, Dubernard G, Fleurence J et al. Subjective morbidity and quality of life after sentinel node biopsy and axillary lymph node dissection for breast cancer. J Surg Oncol 2005; 92 (1): 17–22.
39. Purushotham AD, Upponi S, Klevesath MB et al. Morbidity after sentinel lymph node biopsy in primary breast cancer: results from a randomized controlled trial. J Clin Oncol 2005; 23 (19): 4312–4321.
40. Rönkä R, von Smitten K, Tasmuth T et al. One-year morbidity after sentinel node biopsy and breast surgery. Breast 2005; 14 (1): 28–36.
41. Mansel RE, Fallowfield L, Kissin M et al. Randomized multicenter trial of sentinel node biopsy versus standard axillary treatment in operable breast cancer: the ALMANAC Trial. J Natl Cancer Inst 2006; 98 (9): 599–609.
42. Langer I, Guller U, Berclaz G et al. Morbidity of sentinel lymph node biopsy (SLN) alone versus SLN and completion axillary lymph node dissection after breast cancer surgery: a prospective Swiss multicenter study on 659 patients. Ann Surg 2007; 245 (3): 452–461.
43. Lucci A, McCall LM, Beitsch PD et al. Surgical complications associated with sentinel lymph node dissection (SLND) plus axillary lymph node dissection compared with SLND alone in the American College of Surgeons Oncology Group Trial Z0011. J Clin Oncol 2007; 25 (24): 3657–3663.
44. Husted Madsen A, Haugaard K, Soerensen J et al. Arm morbidity following sentinel lymph node biopsy or axillary lymph node dissection: a study from the Danish Breast Cancer Cooperative Group. Breast 2008; 17 (2): 138–147.
45. Del Bianco P, Zavagno G, Burelli P et al. Morbidity comparison of sentinel lymph node biopsy versus conventional axillary lymph node dissection for breast cancer patients: results of the sentinella-GIVOM Italian randomised clinical trial. Eur J Surg Oncol 2008; 34 (5): 508–513.
46. McLaughlin SA, Wright MJ, Morris KT et al. Prevalence of lymphedema in women with breast cancer 5 years after sentinel lymph node biopsy or axillary dissection: objective measurements. J Clin Oncol 2008; 26 (32): 5213–5219. doi: 10.1200/JCO.2008.16.3725.
47. McLaughlin SA, Wright MJ, Morris KT et al. Prevalence of lymphedema in women with breast cancer 5 years after sentinel lymph node biopsy or axillary dissection: patient perceptions and precautionary behaviors. J Clin Oncol 2008; 26 (32): 5220–5226. doi: 10.1200/JCO.2008.16.3766.
48. Gill G, SNAC Trial Group of the Royal Australasian College of Surgeons (RACS) and NHMRC Clinical Trials Centre. Sentinel-lymph-node-based management or routine axillary clearance? One-year outcomes of sentinel node biopsy versus axillary clearance (SNAC): a randomized controlled surgical trial. Ann Surg Oncol 2009; 16 (2): 266–275. doi: 10.1245/s10434-008-0229-z.
49. Helms G, Kühn T, Moser L et al. Shoulder-arm morbidity in patients with sentinel node biopsy and complete axillary dissection – data from a prospective randomised trial. Eur J Surg Oncol 2009; 35 (7): 696–701. doi: 10.1016/j.ejso.2008.06.013.
50. Kootstra JJ, Hoekstra-Weebers JE, Rietman JS et al. A longitudinal comparison of arm morbidity in stage I–II breast cancer patients treated with sentinel lymph node biopsy, sentinel lymph node biopsy followed by completion lymph node dissection, or axillary lymph node dissection. Ann Surg Oncol 2010; 17 (9): 2384–2394. doi: 10.1245/s10434-010-0981-8.
51. Ashikaga T, Krag DN, Land SR et al. Morbidity results from the NSABP B-32 trial comparing sentinel lymph node dissection versus axillary dissection. J Surg Oncol 2010; 102 (2): 111–118. doi: 10.1002/jso.21535.
52. Kootstra JJ, Dijkstra PU, Rietman H et al. A longitudinal study of shoulder and arm morbidity in breast cancer survivors 7 years after sentinel lymph node biopsy or axillary lymph node dissection. Breast Cancer Res Treat 2013; 139 (1): 125–134. doi: 10.1007/s10549-013-2509-y.
53. Sagen A, Kaaresen R, Sandvik L et al. Upper limb physical function and adverse effects after breast cancer surgery: a prospective 2.5-year follow-up study and preoperative measures. Arch Phys Med Rehabil 2014; 95 (5): 875–881. doi: 10.1016/j.apmr.2013.12. 015.
54. Armer JM, Stewart BR. A comparison of four diagnostic criteria for lymphedema in a post-breast cancer population. Lymphat Res Biol 2005; 3 (4): 208–217.
55. Gerber LH. A review of measures of lymphedema. Cancer 1998; 83 (12 Suppl American): 2803–2804.
56. Karges JR, Mark BE, Stikeleather SJ et al. Concurrent validity of upper-extremity volume estimates: comparison of calculated volume derived from girth measurements and water displacement volume. Phys Ther 2003; 83 (2): 134–145.
57. Taylor R, Jayasinghe UW, Koelmeyer L et al. Reliability and validity of arm volume measurements for assessment of lymphedema. Phys Ther 2006; 86 (2): 205–214.
58. Cornish BH, Chapman M, Hirst C et al. Early diagnosis of lymphedema using multiple frequency bioimpedance. Lymphology 2001; 34 (1): 2–11.
59. Czerniec SA, Ward LC, Refshauge KM et al. Assessment of breast cancer-related arm lymphedema – comparison of physical measurement methods and self-report. Cancer Invest 2010; 28 (1): 54–62. doi: 10.3109/07357900902918494.
60. Ramos SM, O‘Donnell LS, Knight G. Edema volume, not timing, is the key to success in lymphedema treatment. Am J Surg 1999; 178 (4): 311–315.
61. Pain SJ, Purushotham AD. Lymphoedema following surgery for breast cancer. Br J Surg 2000; 87 (9): 1128–1141.
62. Rockson SG, Miller LT, Senie R et al. American Cancer Society Lymphedema workshop. Workgroup III: diag - nosis and management of lymphedema. Cancer 1998; 83 (12 Suppl American): 2882–2885.
63. Petrek JA, Senie RT, Peters M et al. Lymphedema in a cohort of breast carcinoma survivors 20 years after diagnosis. Cancer 2001; 92 (6): 1368–1377.
64. Tsai RJ, Dennis LK, Lynch CF et al. The risk of developing arm lymphedema among breast cancer survivors: a meta-analysis of treatment factors. Ann Surg Oncol 2009; 16 (7): 1959–1972. doi: 10.1245/s10434-009 - 0452-2.
65. Vieira RA, da Costa AM, de Souza JL et al. Risk factors for arm lymphedema in a cohort of breast cancer patients followed up for 10 years. Breast Care (Basel) 2016; 11 (1): 45–50. doi: 10.1159/000442489.
66. Schijven MP, Vingerhoets AJ, Rutten HJ et al. Comparison of morbidity between axillary lymph node dissection and sentinel node biopsy. Eur J Surg Oncol 2003; 29 (4): 341–350.
67. Crane-Okada R, Wascher RA, Elashoff D et al. Long-term morbidity of sentinel node biopsy versus complete axillary dissection for unilateral breast cancer. Ann Surg Oncol 2008; 15 (7): 1996–2005. doi: 10.1245/s10434-008-9909-y.
68. Helyer LK, Varnic M, Le LW et al. Obesity is a risk factor for developing postoperative lymphedema in breast cancer patients. Breast J 2010; 16 (1): 48–54. doi: 10.1111/j.1524-4741.2009.00855.x.
69. Paskett ED, Dean JA, Oliveri JM et al. Cancer-related lymphedema risk factors, diagnosis, treatment, and impact: a review. J Clin Oncol 2012; 30 (30): 3726–3733. doi: 10.1200/JCO.2012.41.8574.
70. Földi E, Földi M. Lymfostatické nemoci. In: Földi M, Földi E (eds). Lymfologie. 7th ed. Praha: Grada 2014 : 189–280.
71. Pain SJ, Barber RW, Solanki CK et al. Short-term effects of axillary lymph node clearance surgery on lymphatic physiology of the arm in breast cancer. J Appl Physiol 2005; 99 (6): 2345–2351.
72. Casley-Smith JR, Morgan RG, Piller NB. Treatment of lymphedema of the arms and legs with 5,6-benzo-[alpha]-pyrone. N Engl J Med 1993; 329 (16): 1158–1163.
73. Yue T, Zhuang D, Zhou P et al. A prospective study to assess the feasibility of axillary reverse mapping and evaluate Its effect on preventinglymphedema in breast cancer patients. Clin Breast Cancer 2015; 15 (4): 301–306. doi: 10.1016/j.clbc.2015.01.010.
74. Han C, Yang B, Zuo WS et al. The feasibility and oncological safety of axillary reverse mapping in patients with breast cancer: A systematic review and meta-analysis of prospective studies. PLoS One 2016; 11 (2): e0150285. doi: 10.1371/journal.pone.0150285.
75. Bedrosian I, Babiera GV, Mittendorf EA et al. A phase I study to assess the feasibility and oncologic safety of axillary reverse mapping in breast cancer patients. Cancer 2010; 116 (11): 2543–2548. doi: 10.1002/cncr.25096.
76. Pavlista D, Eliska O. Relationship between the lymphatic drainage of the breast and the upper extremity: a postmortem study. Ann Surg Oncol 2012; 19 (11): 3410–3415. doi: 10.1245/s10434-012-2363-x.
77. Boccardo F, Casabona F, De Cian F et al. Lymphedema microsurgical preventive healing approach: a new technique for primary prevention of arm lymphedema after mastectomy. Ann Surg Oncol 2009; 16 (3): 703–708. doi: 10.1245/s10434-008-0270-y.
78. Yamashita K, Shimizu K. Endoscopic video-assisted breast surgery: procedures and short-term results. J Nippon Med Sch 2006; 73 (4): 193–202.
79. Luo C, Guo W, Yang J et al. Comparison of mastoscopic and conventional axillary lymph node dissection in breast cancer: long-term results from a randomized, multicenter trial. Mayo Clin Proc 2012; 87 (12): 1153–1161. doi: 10.1016/j.mayocp.2012.07.022.
80. Hussein O, El-Nahhas W, El-Saed A et al. Video-assisted axillary surgery for cancer: non-randomized comparison with conventional techniques. Breast 2007; 16 (5): 513–519.
81. Aponte-Rueda ME, Saade Cárdenas RA, Saade Aure MJ. Endoscopic axillary dissection: a systematic review of the literature. Breast 2009; 18 (3): 150–158. doi: 10.1016/j.breast.2009.05.001.
82. Coufal O, Fait V. Rehabilitační péče o pacientky s karcinomem prsu. In: Coufal O, Fait V (eds). Chirurgická léčba karcinomu prsu. Praha: Grada Publishing 2011 : 389–396.
83. Vítová, V, Vítová H, Hrubá D. Péče o komplikovaný lymfedém provázející specifické malignity žen – vybrané kazuistiky. Interní Med 2011; 13 (5): 214–218.
84. Chang DW. Lymphaticovenular bypass for lymphedema management in breast cancer patients: a prospective study. Plast Reconstr Surg 2010; 126 (3): 752–758. doi: 10.1097/PRS.0b013e3181e5f6a9.
85. Damstra RJ, Voesten HG, van Schelven WD et al. Lymphatic venous anastomosis (LVA) for treatment of secondary arm lymphedema: a prospective study of 11 LVA procedures in 10 patients with breast cancer related lymphedema and a critical review of the literature. Breast Cancer Res Treat 2009; 113 (2): 199–206.
86. Lin CH, Ali R, Chen SC et al. Vascularized groin lymph node transfer using the wrist as a recipient site for management of postmastectomy upper extremity lymphedema. Plast Reconstr Surg 2009; 123 (4): 1265–1275. doi: 10.1097/PRS.0b013e31819e6529.
87. Gharb BB, Rampazzo A, Spanio di Spilimbergo S et al. Vascularized lymph node transfer based on the hilar perforators improves the outcome in upper limb lymphedema. Ann Plast Surg 2011; 67 (6): 589–593. doi: 10.1097/SAP.0b013e3181f88e8a.
88. Becker C, Assouad J, Riquet M et al. Postmastectomy lymphedema: long-term results following microsurgical lymph node transplantation. Ann Surg 2006; 243 (3): 313–315.
89. Damstra RJ, Voesten HG, Klinkert P et al. Circumferential suction-assisted lipectomy for lymphoedema after surgery for breast cancer. Br J Surg 2009; 96 (8): 859–864. doi: 10.1002/bjs.6658.
90. Schaverien MV, Munro KJ, Baker PA et al. Liposuction for chronic lymphoedema of the upper limb: 5 years of experience. J Plast Reconstr Aesthet Surg 2012; 65 (7): 935–942. doi: 10.1016/j.bjps.2012.01.021.
91. Cormier JN, Rourke L, Crosby M et al. The surgical treatment of lymphedema: a systematic review of the contemporary literature (2004–2010). Ann Surg Oncol 2012; 19 (2): 642–651. doi: 10.1245/s10434-011-2017-4.
92. van der Walt JC, Perks TJ, Zeeman BJ et al. Modified Charles procedure using negative pressure dressings for primary lymphedema: a functional assessment. Ann Plast Surg 2009; 62 (6): 669–675.
93. Baker A, Kim H, Sempleh JL et al. Experimental assessment of pro-lymphangiogenic growth factors in the treatment of post-surgical lymphedema following lymphadenectomy. Breast Cancer Res 2010; 12 (5): R70.
94. Visuri MT, Honkonen KM, Hartiala P et al. VEGF-C and VEGF-C156S in the pro-lymphangiogenic growth factor therapy of lymphedema: a large animal study. Angiogenesis 2015; 18 (3): 313–326. doi: 10.1007/s10456-015-9469-2.
95. Yan A, Avraham T, Zampell JC et al. Adipose-derived stem cells promote lymphangiogenesis in response to VEGF-C stimulation or TGF-β1 inhibition. Future Oncol 2011; 7 (12): 1457–1473. doi: 10.2217/fon.11.121.
96. Kanapathy M, Kalaskar D, Mosahebi A et al. Development of a tissue-engineered lymphatic graft using nanocomposite polymer for the treatment of secondary lymphedema. Artif Organs 2016; 40 (3): E1–E11. doi: 10.1111/aor.12604.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2017 Issue 1
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Safety and Tolerance of Metamizole in Postoperative Analgesia in Children
-
All articles in this issue
- Analytická interference může vést k diagnostice lymfoproliferativního onemocnění
- Daratumumab – naděje pro myelomové pacienty, výzva pro klinické laboratoře
- Epitelo-mezenchymální tranzice v nádorové tkáni a její role při metastatickém šíření karcinomů
- Možnosti chemoterapie v léčbě karcinomu prostaty
- Lymfedém po operacích na spádových lymfatických uzlinách pro karcinom prsu
- Rozdiely vo vekovej distribúcii, onkologických diagnózach a štádiu ochorenia medzi rómskymi a nerómskymi onkologickými pacientmi registrovanými na ambulantnom onkologickom oddelení v Poprade v rokoch 2014 a 2015 – retrospektívna štúdia
- Rozdiely v incidencii a biologických charakteristikách karcinómu prsníka medzi rómskymi a nerómskymi pacientkami na Slovensku
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Lymfedém po operacích na spádových lymfatických uzlinách pro karcinom prsu
- Daratumumab – naděje pro myelomové pacienty, výzva pro klinické laboratoře
- Epitelo-mezenchymální tranzice v nádorové tkáni a její role při metastatickém šíření karcinomů
- Možnosti chemoterapie v léčbě karcinomu prostaty
