Maligní melanom – od klasické histologie k molekulárně genetickému testování
Malignant Melanoma – from Classical Histology towards Molecular Genetic Testing
Background:
Malignant melanoma is – in comparison with other skin tumors – a relatively rare malignant neoplasm with highly aggressive biologic behavior and variable prognosis. Recent data in pathology and molecular diagnostics indicate that malignant melanoma is in fact not a single entity but a group of different neoplasms with variable etiopathogenesis, biologic behavior and prognosis. New therapeutic options using targeted treatment blocking MAPK signaling pathway require testing of BRAF gene mutation status. This helps to select patients with highest probability of benefit from this treatment.
Aim:
This article summarizes information on the correlation of morphological findings with genetic changes, discusses the representation of individual genetic types in various morphological subgroups and deals with the newly proposed genetic classification of melanoma and the current possibilities, pitfalls and challenges in BRAF testing of malignant melanoma. It also describes the current testing situation in the Czech Republic – the methods used, the representation of BRAF mutations in the tested population and the future of testing. It also shows the limitations of the BRAF and MEK targeted treatment concept resulting from the heterogeneity of the tumor population. Mechanisms of acquired resistance to MAPK pathway inhibitors, possibilities of their detection, and issues of combination of targeted therapy and immunotherapy are discussed.
Key words:
malignant melanoma – BRAF – mutation – molecular targeted therapy – tumor microenvironment – tumor heterogeneity
This work was supported by projects PROGRES Q40/11, BBMRICZ LM2015089, SVV 260398 and GACR 17-10331S.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted:
28. 3. 2017
Accepted:
16. 5. 2017
:
A. Ryška 1; O. Horký 2; J. Berkovcová 2; I. Tichá 3; M. Kalinová 4; M. Matějčková 5; Á. Bóday 6; J. Drábek 7; P. Martínek 8; J. Šimová 9; K. Sieglová 1; H. Vošmiková 1
:
Fingerlandův ústav patologie, LF UK a FN Hradec Králové
1; Oddělení onkologické patologie, Masarykův onkologický ústav, Brno
2; Ústav patologie, 1. LF UK a VFN v Praze
3; Ústav patologie a molekulární medicíny, 2. LF UK a FN Motol, Praha
4; Oddělení patologie a molekulární medicíny, Thomayerova nemocnice, Praha
5; Oddělení lékařské genetiky, Laboratoře AGEL, Nový Jičín
6; Laboratoř experimentální medicíny, FN Olomouc
7; Bioptická laboratoř, s. r. o., Plzeň
8; CGB laboratoř, a. s., Ostrava
9
:
Klin Onkol 2017; 30(3): 182-189
:
Review
prolekare.web.journal.doi_sk:
https://doi.org/10.14735/amko2017182
Východiska:
Maligní melanom je – v porovnání s ostatními nádory kůže – relativně vzácný, avšak vysoce agresivní maligní nádor s variabilním klinickým chováním. Recentní poznatky na poli patologie a molekulární diagnostiky ukazují, že se ve skutečnosti jedná o skupinu různých nádorů s rozdílnou etiopatogenezí, biologickým chováním i prognózou. Nové možnosti terapie cílené na blokádu MAPK signální dráhy vyžadují testování mutačního stavu genu BRAF pro identifikaci pacientů z této léčby nejvíce profitujících.
Cíl:
Článek podává souhrnné informace o korelaci morfologického nálezu s genetickými změnami, diskutuje zastoupení jednotlivých genetických typů u různých morfologických podskupin a věnuje se také nově navržené genetické klasifikaci melanomu a současným možnostem, úskalím a výzvám v testování BRAF u maligního melanomu. Popisuje také současnou situaci testování v České republice – používaným metodám, zastoupení BRAF mutací v testované populaci a budoucnosti testování. Ukazuje rovněž limitace konceptu cílené léčby inhibicí BRAF a MEK vyplývající z heterogenity nádorové populace. Jsou diskutovány mechanizmy získané rezistence na inhibitory MAPK dráhy, možnosti jejich detekce a otázky kombinace cílené léčby a imunoterapie.
Klíčová slova:
maligní melanom – BRAF – mutace – cílená léčba – nádorové mikroprostředí – nádorová heterogenita
Úvod
Maligní melanom je nádor vznikající z pigmentovaných buněk (melanocytů), a to nejčastěji v kůži, méně často na sliznicích (dutina ústní, dutina nosní, vulva, anus, ještě vzácněji i jinde), oku (uveální melanom, melanom řasnatého tělesa či spojivky) a raritně i v dalších lokalizacích (meningy apod.). Pomineme-li adnexální kožní tumory, které představují široké spektrum raritních jednotek, je maligní melanom nejméně častou primární kožní malignitou [1]. Jedná se ale zároveň o nádor, který je považován za jeden z nejagresivnějších lidských novotvarů vůbec. V ČR je maligní melanom s incidencí 11,61 a mortalitou 2,1 (www.svod.cz – údaje pro rok 2010) momentálně sedmým nejčastějším zhoubným nádorem. V posledních 30 letech tak jeho incidence vzrostla zhruba trojnásobně [2]. Melanom je nádor s variabilní etiologií, za nejčastější příčinu vzniku nádoru je dnes obecně přijímána expozice slunečnímu, resp. UVA záření, u řady případů (zejména u nádorů vznikajících v partiích, kde lze expozici UV záření vyloučit) je ale etiologie doposud neznámá [3].
Klasické histopatologické vyšetření
Pro prognózu nemocného je zásadní zejména stadium, ve kterém je nádor diagnostikován, a dále kompletnost chirurgického odstranění primárního ložiska a případně sentinelové uzliny. Kožní excize s nádorem musí být vyšetřena tak, aby bylo možné zodpovědět na všechny klinicky relevantní otázky – tj. stanovení správné a přesné diagnózy, stupně pokročilosti a přítomnosti či nepřítomnosti dalších prognostických či prediktivních faktorů spolurozhodujících o dalším terapeutickém postupu. Diagnóza melanomu je založena na korelaci klinických parametrů (makroskopického vzhledu nádoru, rychlosti a charakteru růstu, doprovodných příznaků, známek rozsevu apod.) a výsledků erudovaného histopatologického vyšetření. Je doporučováno, aby suspektní melanocytární léze byly odstraněny in toto s dostatečným lemem zdravé tkáně. Dle současných poznatků je za dostatečný považován lem v šířce alespoň 2 mm nepostižené kůže. Samozřejmostí je uvedení všech základních klinických údajů na průvodce (věk, lokalizace, rychlost růstu, klinická diferenciálně diagnostická rozvaha), optimálně pak jednotlivé klinické parametry dle pravidel ABCDE (asymmetry, border, color, diameter, evolution).
Současná WHO klasifikace definuje následující „běžné“ typy kožního maligního melanomu – povrchově se šířící melanom, nodulární melanom, akrolentiginózní melanom, lentigo maligna melanom (obr. 1 a 2). Dále jsou popisovány méně časté typy melanomu – desmoplastický, melanom vznikající v modrém névu, melanom vznikající v kongenitálním névu, spitzoidní melanom, névoidní (také označovaný jako minimal deviation) melanom, melanom dětského věku a perzistující melanom.
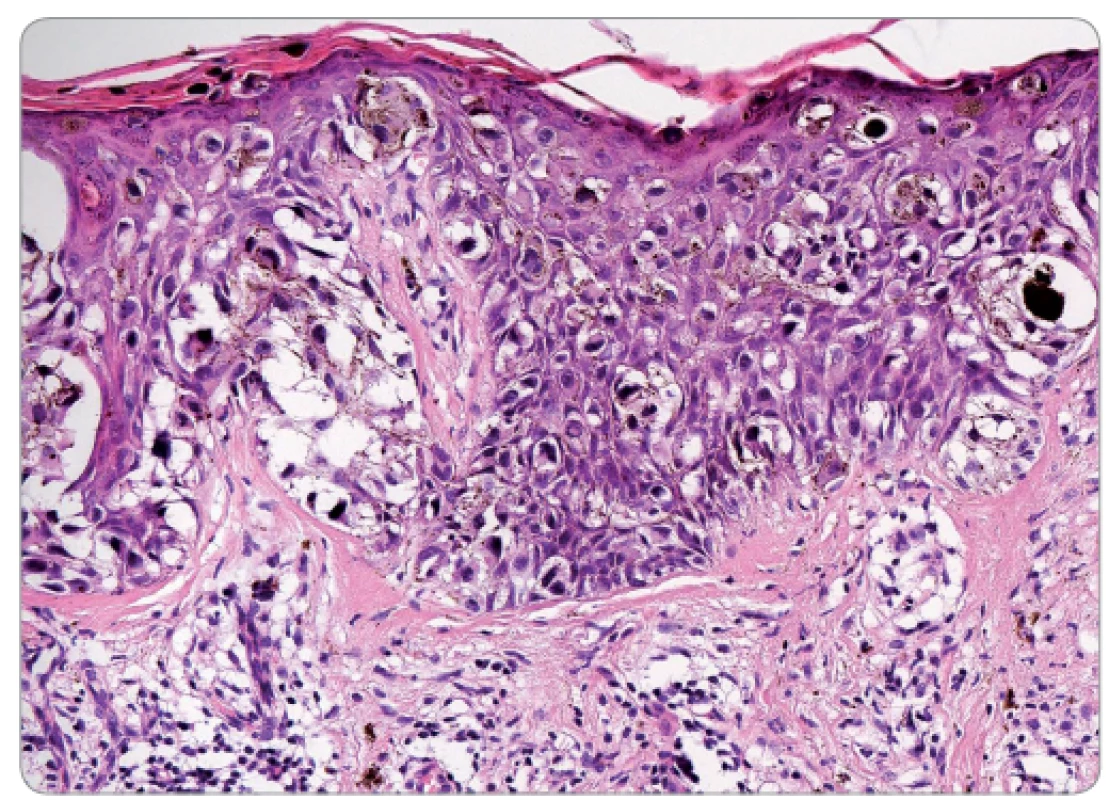
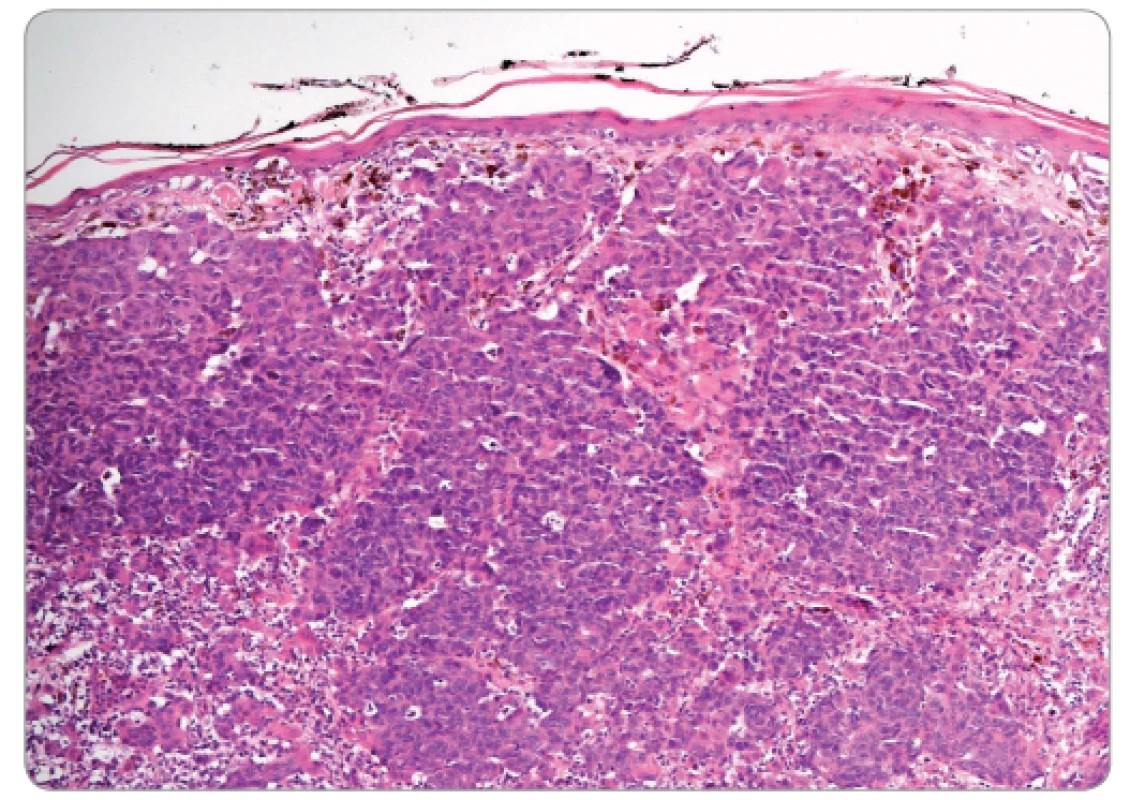
Nepredikovatelná biologie melanomu
Biologické chování maligního melanomu je velice variabilní a je bohužel do značné míry nepredikovatelné. Platí samozřejmě, tak jako u jiných nádorů, že prognóza onemocnění víceméně souvisí se stupněm jejich pokročilosti (stadiem – stage) popsaným dle kritérií TNM. U melanomu byly jako významné prognostické faktory prokázány hloubka invaze (charakterizovaná kategorií dle Clarka) a celková tloušťka nádoru (hodnocení dle Breslowa), absence či přítomnost ulcerace nádoru a také přítomnost chronické zánětlivé infiltrace (lymfocytární lem) na periferii nádorového ložiska. Všechny výše uvedené parametry ukazují statisticky významnou prognostickou váhu, přesto však u jednotlivého individuálního pacienta vývoj a případnou progresi či recidivu nádorového onemocnění předpovědět prakticky nelze. Již v době diagnózy má zhruba polovina nemocných (a to i u časných melanomů) detekovatelné cirkulující nádorové buňky v krevním oběhu a v lymfatických uzlinách i jinde se vyskytují izolované tzv. dormant cells (spící buňky). Ty dále neproliferují a jsou kontrolovány protinádorovou aktivitou imunitního systému. V případě selhání imunitního dozoru pak může prakticky kdykoli dojít k expanzi těchto elementů a vzniku klinicky manifestních metastáz (obr. 3A a 3B). Maligní melanom metastazuje jak lymfogenně do spádových regionálních uzlin, později i do uzlin vzdálenějších, tak hematogenně, a to v podstatě do kteréhokoli orgánu – vedle typických míst, jako jsou plíce, játra, CNS či kostní dřeň navíc také do poměrně raritních lokalizací (srdce, slezina, štítná žláza apod.).
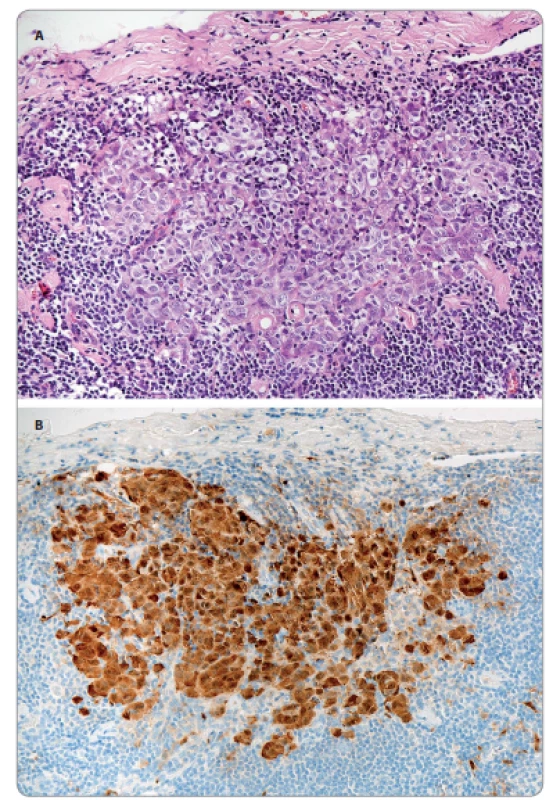
Kromě jiných cílových struktur může melanom metastazovat také do kůže. Kožní metastázy jsou u tohoto nádoru poměrně časté, vzácně (zhruba v 5 % případů) mohou představovat i první příznak onemocnění, zejména při regresi primárního nádoru. Kožní metastázy se mohou vyskytnout kdekoli na těle, jak solitárně, tak vícečetně. Kožní metastázy jsou vždy známkou min. III. stadia nádoru. Rozlišujeme a) tzv. satelitní metastázy – ložiska větší než 0,3 mm, která se vyskytují v blízkosti primárního nádoru (do 5 cm od primárního ložiska); b) tzv. in-tranzitní metastázy, kožní ložiska vznikající ve vzdálenosti nad 5 cm od primárního nádoru, a to v oblasti povodí spádových uzlin příslušících primárnímu nádoru a c) vzdálené kožní metastázy – všechny ostatní. Satelitní a intranzitní metastázy nejsou z prognostického hlediska rozlišovány, odpovídají klasifikaci pN2c, zatímco vzdálené kožní metastázy jsou již hodnoceny jako M1a. Případy, kdy nádorové buňky metastatického melanomu v kůži vykazují známky epidermotropizmu, mohou představovat poměrně závažný diagnostický problém a odlišení primární povahy nádoru od metastázy není vždy snadné a jednoznačné. Vyskytují se i vzácné případy, kdy kožní metastázy mohou napodobovat benigní melanocytární léze, jako jsou např. komplexový (smíšený) pigmentový névus či névus Spitzové.
Stoupající incidence maligního melanomu a do nedávné doby také nedostupnost dostatečně efektivní systémové terapie pro nemocné s generalizovaným onemocněním představují výzvu pro zlepšení diagnostiky i terapie tohoto nádorového onemocnění. Klíčem k obojímu je lepší porozumění biologické podstatě vzniku a rozvoje melanomu. Všeobecně přijímaným axiomem je kauzální vztah mezi expozicí slunečnímu záření a vznikem nádoru. Novější poznatky však ukazují, že toto tvrzení je přinejmenším velkým zjednodušením celé problematiky [3–6].
Korelace etiopatogeneze a molekulárních změn
Je nepochybnou skutečností, že v etiopatogenezi většiny kožních melanomů hraje zásadní roli expozice slunečnímu záření, resp. UV záření, přičemž výrazně nebezpečnější je složka UVA. Například u bělochů, zejména se světlou barvou kůže (fototypy I a II), u kterých se maligní melanom vyskytuje nejčastěji, nevzniká tento nádor zpravidla na těch částech těla, které jsou nejvíce vystaveny slunečnímu záření (obličej, dorza rukou apod.), ale na místech s intermitentní expozicí, jako jsou trup, paže, dolní končetiny apod. Několik studií také prokazuje, že více ohrožené jsou osoby pracující uvnitř budov – tedy nevystavené působení UV záření trvale – než pracovníci trvale vystavení slunečnímu svitu (zemědělci apod.) [7].
Z hlediska působení UV záření na kůži tak lze melanomy rozdělit do dvou hlavních skupin – nádory vznikající v důsledku poškození DNA dlouhodobým působením malých dávek slunečního záření (chronic sun exposure damage – CSD) a nádory vzniklé po jednorázové nadlimitní expozici – spálení kůže (non-CSD) [3–6]. V neposlední řadě je třeba vyzdvihnout skutečnost, že část melanomů vzniká v partiích bez jakékoli expozice slunečním paprskům, jako jsou dlaně, plosky nohou, sliznice dutiny ústní, genitálu či anu.
Maligní melanom již v dnešní době není chápán jako jedno nádorové onemocnění, ale jako skupina morfologicky podobných nádorů, které se však liší nejen svou histologií, charakterem a dynamikou růstu a šíření, ale zejména svojí etiopatogenezí, molekulárními změnami, signálními dráhami, které jsou aktivovány, či naopak potlačeny a interakcí mezi nádorovými buňkami a hostitelským organizmem [6,8,9].
Z těchto poznatků vychází také snaha o využití molekulárních charakteristik do přesnější typizace melanomu a překonání limitací výhradně morfologické klasifikace těchto nádorů [10].
Melanomy vznikající v terénu chronického solárního poškození se typicky vyskytují v pozdním věku a jsou často sdruženy s dalšími prekancerózami či nádory, u kterých hraje expozice slunečnímu záření etiologickou roli, jako jsou např. solární keratóza, cornu cutaneum, bazaliom či dlaždicobuněčný (spinocelulární) karcinom kůže [6]. U nemocných s melanomem v terénu bez chronického solárního poškození se naopak často vyskytují pigmentové névy, ale ostatní nádory podmíněné UV zářením jen vzácně; jedná se také o statisticky významně mladší pacienty [11].
Obdobné rozdíly lze pozorovat v molekulárním profilu nádorů ve vztahu k dávce slunečního záření. Melanomy vznikající na kůži pouze intermitentně exponované UV záření jsou charakterizovány velmi častým výskytem mutací BRAF a častými ztrátami chromozomu 10, zatímco u melanomů z chronického solárního poškození je výskyt mutací BRAF vzácný a vyskytuje se zde typicky zvýšený počet kopií genu CCND1 [12–14]. Velmi zajímavá je také významná podobnost genetických charakteristik (mutačního profilu) melanomů bez vztahu k chronickému solárnímu poškození a pigmentových névů týchž pacientů v obdobné lokalizaci – obě léze sdílejí právě častý výskyt mutace BRAF [15–17]. Epidemiologické studie a experimentální práce ukazují, že u osob se zvýšeným rizikem vzniku melanomu (světlé fototypy) spadá rizikové období pro poškození DNA melanocytů a vznik mutace BRAF pravděpodobně do časného – zpravidla dětského – věku. Naopak u osob bez zvýšeného rizika vzniku melanomu (tmavé fototypy) musí pro poškození melanocytů dojít k akumulaci dostatečně vysoké dávky UV záření a melanomy zde vznikají zpravidla jinou dráhou než cestou mutace BRAF [18].
Na základě analýzy genového expresního profilu (zjednodušeně řečeno – analýza stavu exprese sady genů vybraných na základě matematické analýzy) lze maligní melanomy rozdělit do čtyř nezávislých genomických skupin – akrální melanom (vyskytující se typicky na akrech rukou a nohou, v oblasti nehtových lůžek apod.), slizniční melanom (dutina ústní, nosní, anogenitální sliznice), melanom kůže bez chronického solárního poškození (typicky trup, paže, dolní končetiny) a melanom kůže s chronickým solárním poškozením (obličej, ušní boltce, dorzální strana krku) [9]. Ty se od sebe liší jak spektrem chromozomálních aberací, tak frekvencí mutací jednotlivých specifických genů. Tato skutečnost svědčí pro odlišnou molekulární patogenezi jednotlivých skupin (typů) melanomu. Jak slizniční, tak i akrální melanomy jsou charakterizovány vysokým výskytem amplifikací a delecí a liší se tak od melanomů vznikajících v terénu chronického solárního poškození kůže [18–20]. I akrální a slizniční melanomy se od sebe ve spektru chromozomálních aberací dále liší, což znamená, že také tyto dvě skupiny melanomů je nutné považovat za individuální, na sobě nezávislé kategorie [8].
Další možností je klasifikace maligních melanomů čistě na základě mutací řídících genů bez ohledu na histologické charakteristiky nádoru. Rozsáhlá mezinárodní skupina The Cancer Genome Atlas Network (TCGA) navrhuje čtyři základní genomoické subtypy melanomu – BRAF mutovaný, RAS mutovaný, NF1 mutovaný a triple wild type [21].
Význam molekulární klasifikace pro volbu terapie
Porozumění genetickým rozdílům mezi jednotlivými typy melanomu může být velmi přínosné při lepší identifikaci pacientů pro jednotlivé typy molekulárně cílené systémové léčby. Skupina nádorů v terénu kůže bez chronického solárního poškození, která představuje největší podmnožinu maligních melanomů, vykazuje často mutaci BRAF spolu se ztrátou PTEN, případně samotnou mutaci NRAS. Proto zde budou podstatně častěji zastoupeny nádory s možností terapeutického ovlivnění příslušnou cílenou léčbou. Naproti tomu nádory spadající do ostatních tří kategorií (melanomy v terénu s chronickým solárním poškozením, akrální melanomy, slizniční melanomy) vykazují přítomnost mutace BRAF či NRAS jen vzácně, místo toho se u nich vyskytuje zvýšený počet kopií genů CCND1 či CDK4, případně u slizničních melanomů mutace genu KIT [12,18,20,22–25].
Platí přitom, že mutace BRAF a mutace NRAS se prakticky nikdy nevyskytují v nádoru současně, resp. jsou navzájem se vylučující. Právě jejich vzájemná výlučnost vede k v současnosti přijímané hypotéze, že obě mutace mají podobný biologický efekt, tj. aktivaci MAPK signální dráhy. Signální dráha mitogenem aktivované proteinové kinázy (MAPK) zahrnující kaskádu RAS-RAF-MEK-ERK je pro růst většiny maligních melanomů kritická. BRAF je serin/treoninová proteinová kináza aktivovaná fosforylovanou formou RAS proteinu. Nejčastější mutací BRAF je T1799A mutace v exonu 15 vedoucí k V600E (Val600Glu) substituci aminokyselin v proteinu. Mutace V600E představuje přes 90 % všech BRAF mutací v melanomu [22,26]. Dalšími – vzácnějšími – typy mutací BRAF jsou V600K (záměna valinu za lysin) a V600R (záměna valinu za arginin) [27].
Aktivační mutace NRAS, KRAS a HRAS vedoucí ke konstituční aktivaci signální dráhy RAS byly popsány u celé řady lidských maligních nádorů (melanom, karcinomy plic, kolorekta, pankreatu, močového měchýře apod.) [28]. V melanomu jsou nejčastější mutace NRAS, konkrétně Q61R (CAA/CGA) a Q61K (CAA/AAA), které se nacházejí v kodonu 61. Mutace dalších dvou genů rodiny RAS – tedy HRAS a KRAS – jsou zde, na rozdíl od jiných nádorů, vzácné [22].
U pacientů s generalizovaným maligním melanomem s přítomností mutace BRAFV600E vykazuje nasazení cílené terapie BRAF inhibitory (přesněji inhibitory MAPK signální dráhy či MAPK inhibitory), jako jsou vemurafenib či dabrafenib, velmi slibné výsledky [29,30]. Hlavní otázkou tak je, jak vybrat pro tuto léčbu optimálně vhodné nemocné s vysokou pravděpodobností odpovědi na léčbu. Pro její zodpovězení je nezbytné porozumění biologii maligního melanomu a roli řídících mutací v jeho etiopatogenezi.
Jak prokazuje metaanalýza autorů Lee et al shrnující výsledky studií z let 1989–2010 a analyzující téměř 4 500 pacientů s maligním melanomem, mutace BRAF se vyskytují u 41 % (hodnoty v jednotlivých studiích se pohybují v rozmezí 22–72 %) a mutace NRAS u 18 % (0–50 %) kožních melanomů [24]. Zastoupení mutací není rozdílné v různých věkových skupinách, nejsou rovněž rozdíly dle pohlaví. Naopak, různé jsou frekvence mutací u různých histologických typů – BRAF mutace jsou častější u povrchově se šířících melanomů (a to zejména u nádorů s hloubkou invaze pod 1 mm) a u nádorů v terénu bez chronického solárního poškození, mutace NRAS naopak u nodulárních melanomů, ale také v nádorech u chronického solárního poškození. Dle této metaanalýzy 19 publikovaných studií se mutace BRAF vyskytly v celkem 49 % povrchově se šířících melanomů, 41 % nodulárních melanomů, ale jen ve 22 % lentigo maligna melanomů a 20 % akrálních lentiginózních melanomů. Vztah histologického typu a mutace genu NRAS byl analyzován v 16 studiích, NRAS byl mutován v 27 % nodulárních melanomů, 19 % akrálních lentiginózních melanomů, 17 % povrchově se šířících melanomů a 14 % lentigo maligna melanomů [24].
Předpoklad souvislosti výskytu BRAF mutací s intermitentní expozicí UV záření je rovněž podpořen výsledky výše uvedené metaanalýzy 19 studií – incidence BRAF mutací je nejvyšší u melanomů trupu (57 %), následovaná melanomy končetin (46 %), obličeje a kštice (28 %). Vztahem výskytu mutací NRAS a lokalizací primárního nádoru se zabývalo 11 studií a z jejich metaanalýzy vyplývá, že incidence mutací NRAS je nejvyšší v melanomech na končetinách (25 %), následují obličej, kštice a trup (vše shodně 18 %) [24].
Intraindividuální molekulární heterogenita melanomu
Vzhledem k tomu, že cílená léčba BRAF inhibitory je mířená na metastatickou nádorovou populaci, je zcela zásadní, zda zůstává přítomnost mutace BRAF, která vzniká v časných fázích vzniku tohoto nádoru [16,17,31], v metastázách zachována, či nikoli. Studie zabývající se srovnáním mutačního stavu BRAF, případně dalších řídících genů mezi primárním nádorovým ložiskem a metastázami, podávají poměrně kontroverzní výsledky. Zatímco někteří autoři udávají velmi vysoký podíl konkordantních případů přesahující 95 % [16,32], jiní autoři udávají zastoupení pacientů s diskordancí mutačního stavu mezi primárním nádorem a metastázami až ve výši kolem 30–40 % [14,33,34].
Existují dvě možná vysvětlení pro přítomnost diskordance mutace BRAF – buď se jedná o vznik mutace de novo v průběhu progrese již existujícího melanomu (změna z BRAF wild type primárního nádoru na BRAF mutovanou metastázu), případně vymizení této mutace (opačná sekvence) nebo jde o důsledek klonální selekce v rámci progrese heterogenního nádorového onemocnění (obr. 4A a 4B). První z nabízených možností je velmi málo pravděpodobná, protože mutace BRAF je mutací řídící, tedy přímo zodpovědnou za vznik a rozvoj melanomu a jako taková vzniká již v časné fázi tumorigeneze [15,16,35]. Naproti tomu druhé vysvětlení, tedy selekce jednoho z klonů původně heterogenního nádoru, je vysoce pravděpodobné [32,34,36]; s obdobnými situacemi se setkáváme nejen u melanomu, ale i u celé řady dalších nádorových onemocnění (karcinom plic, karcinom prostaty, hematologické malignity apod.).
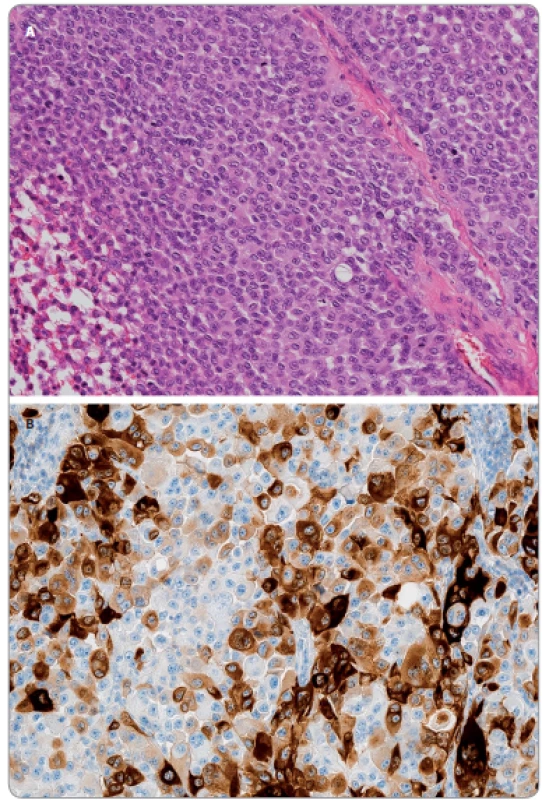
Citlivými molekulárními metodami testování mutace V600E lze prokázat heterogenitu intratumorální (různé oblasti téhož primárního nádoru) i intertumorální (primární tumor vs. metastáza) [34].
Diskordance mezi přítomností mutace BRAF v primárním nádoru a jeho metastázami není vzácná a dosahuje více než 30 % [33], přičemž pravděpodobnost diskordance je vyšší u žen než u mužů a častěji se také vyskytuje u extranodálních metastáz. Tato skutečnost naznačuje vhodnost testování mutačního stavu nádoru v metastázách, a to – vzhledem k dynamice nárůstu heterogenity nádorové populace – nejlépe až v době, kdy je zvažováno nasazení terapie na tuto mutaci cílené.
Velmi zajímavá data přináší analýza nemocných, u kterých došlo k recidivě či progresi při terapii MAPK inhibitory (vemurafenib, dabrafenib), ať již v monoterapii, či v kombinaci s MEK inhibitorem (trametinib). V práci Johnsona et al kompilující data od celkem 100 nemocných bylo možné mechanizmus rezistence odhalit u nadpoloviční většiny případů (58 %) [37]. Nejčastěji byla rezistence zapříčiněna obnovením signalizace v MAPK signální dráze – v důsledku amplifikace BRAF (13 %) nebo vzniku alternativní sestřihové varianty genu (16 %), vznikem mutace KRAS nebo NRAS (20 %), mutací MEK1/2 (7 %), případně aktivací receptorové tyrozinkinázy bez prokazatelné mutace – nejčastěji v důsledku patologické overexprese receptoru (11 %), např. EGFR [38]. Dalším mechanizmem může být obejití signální dráhy MAPK aktivací alternativní signální dráhy PI3K-PTEN-AKT. Ztráta PTEN je poměrně časným fenoménem u melanomu, ať již v důsledku ztráty heterozygozity, mutace či metylace a vyskytuje se často současně s mutací BRAF. Sama o sobě však nepostačuje pro vznik rezistence, k té dochází zpravidla v důsledku následné aktivace AKT. Studie také potvrdila, že v průběhu cílené terapie dochází k akumulaci mutací. U nemocných, u kterých byly v průběhu terapie odebrány dva vzorky s časovým odstupem, byl signifikantně vyšší počet mutací v pozdějším vzorku. Velmi nepříjemným zjištěním je rovněž skutečnost, že u dvou vzorků odebraných jednomu nemocnému se mohou lišit mechanizmy rezistence v různých ložiscích nádoru [38].
Prediktivní diagnostika BRAF mutací v ČR
Vyšetření mutačního stavu BRAF se provádí vždy výhradně na základě žádosti onkologa u nemocných, kde je zvažována cílená léčba BRAF inhibitorem. Pro vyšetření lze využít tkáň nádoru archivovanou na pracovišti patologie ve formě tzv. parafinového bločku. V ČR bylo testování mutací BRAF pro prediktivní účely zavedeno již v roce 2011, jednalo se však spíše o jednotlivé případy, o plošném testování lze hovořit teprve od roku 2012. V průběhu let dochází k postupnému nárůstu počtu testovaných pacientů. Zatímco v roce 2012 bylo v celé ČR testováno pouze 58 případů, v roce 2013 to bylo již 252 melanomů a v následujících letech se počty ustálily na počtu mezi 350 a 380 případy ročně. Zastoupení nádorů s mutací BRAF se v rámci testované kohorty postupně navyšovalo z 31,7 % (2013) přes 39,9 % (2014), 43,7 % (2015) až na 47,7 % (2016). Zastoupení mutovaných případů se mezi jednotlivými laboratořemi pohybuje v rozmezí 37,8–50 % (data z roku 2016), rozdíly jsou velmi pravděpodobně (vzhledem k stále relativně malému číslu případů na laboratoř) vzniklé rozdílným složením kohort, pokud jde o jednotlivé typy melanomu. Pokud jde o metody testování, jednotlivé laboratoře používají různé certifikované metody, dominuje RT-PCR vyšetření kitem cobas (Roche) následovaný hybridizací na stripech (StripAssay ViennaLab), používána je rovněž klasická Sangerova sekvenace. Každá z laboratoří má pro rutinní diagnostiku validovány minimálně dva různé postupy tak, aby byla v případě potřeby k dispozici možnost konfirmace výsledku druhou nezávislou metodou.
Alternativní možnosti testování
Molekulární diagnostika zůstává „zlatým standardem“ pro detekci mutací BRAF, jako slibná alternativa se nabízí imunohistochemická detekce pomocí specifické diagnostické primární protilátky VE1 cílené proti mutantnímu epitopu proteinu BRAF. Publikované výsledky ukazují na vysokou konkordanci obou metod u nádorů s wild type BRAF a s mutací V600E, která představuje 80–90 % všech mutovaných případů [39]. Naproti tomu u nádorů s dalšími vzácnějšími mutacemi BRAF, jako jsou V600K (představují asi 8–12 % mutovaných případů), případně V600D, V600R a V600‘E2’ (celkem do 5 % mutovaných případů) nedokáže imunohistochemie tyto případy detekovat [39].
Vzhledem k této limitaci nelze bohužel i přes nižší cenu a menší časovou náročnost imunohistochemie tuto metodu používat jako rutinní screeningové vyšetření pro vyloučení nádorů bez mutace a pouze pozitivní případy následně ověřovat molekulárně genetickým vyšetřením, jako je tomu např. u detekce prediktivních markerů u karcinomu plic (ALK, ROS1), prsu či žaludku (HER2). Zatím neuzavřenou otázkou zůstává, zda by měly být na přítomnost mutací testovány vzorky z primárního nádoru, nebo z jeho metastázy [26,33,36].
Vyhlídky do budoucnosti
V souvislosti se spontánní i terapií indukovanou (či přesněji urychlenou) heterogenitou nádorové populace se nabízí otázka, nakolik je koncept cílené terapie zaměřené na jednu konkrétní signální dráhu u natolik plastického nádoru, jako je maligní melanom, vůbec smysluplný. Doposud publikované práce ukazují, že od molekulárně cílené léčby generalizovaného onemocnění nelze očekávat kurativní výsledky. Efekt léčby u pacientů správně vybraných na základě molekulárního profilu nádoru je zpravidla velmi rychlý a klinicky výrazný. V horizontu několika měsíců však u naprosté většiny nemocných vzniká rezistence a léčba dříve či později selhává a dochází k recidivě. Budoucnost tak zřejmě bude patřit kombinaci několika různých přístupů – např. již klinicky ověřené kombinaci BRAF a MEK inhibitoru, která se stává de facto novým standardem molekulárně cílené léčby (vemurafenib či dabrafenib a trametinib) [40–42]. Další možností je simultánní či sekvenční použití cílené terapie a následné imunoterapie, protože maligní melanom je nepochybně nádorem, kde odblokování utlumené protinádorové imunitní odpovědi pomocí checkpoint inhibitorů doposud přináší jedny z nejslibnějších výsledků. Řada studií ukazuje, že tento kombinovaný postup využívající synergického efektu obou přístupů, tedy eliminaci větší části nádorové masy zablokováním signálních drah, na nichž jsou nádorové buňky bytostně závislé, a následné odstranění zbytků nádorové populace posíleným imunitním systémem by pravděpodobně mohlo být řešením, které překoná limitace obou individuálních přístupů a nemocným s melanomem tak poskytne naději na signifikantní prodloužení celkového přežití [43–48].
Při cílené terapii melanomu MAPK inhibitory dochází ke zvýšené prezentaci melanocytárních antigenů a zvýšené infiltraci CD8 lymfocyty. Je však třeba upozornit i na skutečnost, že u části nemocných, u kterých došlo k progresi při užití cílené léčby (monoterapie BRAF inhibitorem či kombinací s MEK inhibitorem), může docházet ke vzniku rezistence také mechanizmem úniku či vyčerpání odpovědi cytotoxických CD8 T lymfocytů [38]. Z tohoto důvodu je nezbytné ověření efektu imunoterapie navazující na předchozí léčbu MAPK inhibitory a hledání prediktorů identifikujících nemocné, kteří z takové léčby profitovat nebudou.
Práce byla částečně podpořena projekty PROGRES Q40/11, BBMRICZ LM2015089, SVV 260398 a GAČR 17-10331S.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
prof. MUDr. Aleš Ryška, Ph.D.
Fingerlandův ústav patologie LF UK a FN Hradec Králové
Sokolovská 581
500 05 Hradec Králové
e-mail: ryskaale@gmail.com
Obdrženo: 28. 3. 2017
Přijato: 16. 5. 2017
Sources
1. Dusek L, Muzik J, Maluskova D et al. Cancer incidence and mortality in the Czech Republic. Klin Onkol 2014; 27 (6): 406–423. doi: 10.14735/amko2014406.
2. Pavlik T, Majek O, Buchler T et al. Trends in stage-specific population-based survival of cancer patients in the Czech Republic in the period 2000–2008. Cancer Epidemiol 2014; 38 (1): 28–34. doi: 10.1016/j.canep.2013.11.002.
3. Kelly JW, Rivers JK, MacLennan R et al. Sunlight: a major factor associated with the development of melanocytic nevi in Australian schoolchildren. J Am Acad Dermatol 1994; 30 (1): 40–48.
4. MacKie RM, Aitchison T. Severe sunburn and subsequent risk of primary cutaneous malignant melanoma in scotland. Br J Cancer 1982; 46 (6): 955–960.
5. Noonan FP, Recio JA, Takayama H et al. Neonatal sunburn and melanoma in mice. Nature 2001; 413 (6853): 271–272.
6. Whiteman DC, Watt P, Purdie DM et al. Melanocytic nevi, solar keratoses, and divergent pathways to cutaneous melanoma. J Natl Cancer Inst 2003; 95 (11): 806–812.
7. Beral V, Robinson N. The relationship of malignant melanoma, basal and squamous skin cancers to indoor and outdoor work. Br J Cancer 1981; 44 (6): 886–891.
8. Bastian BC, Olshen AB, LeBoit PE et al. Classifying melanocytic tumors based on DNA copy number changes. Am J Pathol 2003; 163 (5): 1765–1770.
9. Curtin JA, Fridlyand J, Kageshita T et al. Distinct sets of genetic alterations in melanoma. N Engl J Med 2005; 353 (20): 2135–2147.
10. Viros A, Fridlyand J, Bauer J et al. Improving melanoma classification by integrating genetic and morphologic features. PLoS Med 2008; 5 (6): e120. doi: 10.1371/journal.pmed.0050120.
11. Yazdi AS, Palmedo G, Flaig MJ et al. Mutations of the BRAF gene in benign and malignant melanocytic lesions. J Invest Dermatol 2003; 121 (5): 1160–1162.
12. Maldonado JL, Fridlyand J, Patel H et al. Determinants of BRAF mutations in primary melanomas. J Natl Cancer Inst 2003; 95 (24): 1878–1890.
13. Sauter ER, Yeo UC, von Stemm A et al. Cyclin D1 is a candidate oncogene in cutaneous melanoma. Cancer Res 2002; 62 (11): 3200–3206.
14. Shinozaki M, Fujimoto A, Morton DL et al. Incidence of BRAF oncogene mutation and clinical relevance for primary cutaneous melanomas. Clin Cancer Res 2004; 10 (5): 1753–1757.
15. DeLuca AM, Srinivas A, Alani RM. BRAF kinase in melanoma development and progression. Expert Rev Mol Med 2008; 10: e6. doi: 10.1017/S1462399408000604.
16. Omholt K, Platz A, Kanter L et al. NRAS and BRAF mutations arise early during melanoma pathogenesis and are preserved throughout tumor progression. Clin Cancer Res 2003; 9 (17): 6483–6488.
17. Pollock PM, Harper UL, Hansen KS et al. High frequency of BRAF mutations in nevi. Nat Genet 2003; 33 (1): 19–20.
18. Platz A, Egyhazi S, Ringborg U et al. Human cutaneous melanoma; a review of NRAS and BRAF mutation frequencies in relation to histogenetic subclass and body site. Mol Oncol 2008; 1 (4): 395–405. doi: 10.1016/j.molonc.2007.12.003.
19. Bastian BC, Kashani-Sabet M, Hamm H et al. Gene amplifications characterize acral melanoma and permit the detection of occult tumor cells in the surrounding skin. Cancer Res 2000; 60 (7): 1968–1973.
20. Wong CW, Fan YS, Chan TL et al. BRAF and NRAS mutations are uncommon in melanomas arising in diverse internal organs. J Clin Pathol 2005; 58 (6): 640–644.
21. Cancer Genome Atlas Network. Genomic Classification of Cutaneous Melanoma. Cell 2015; 161 (7): 1681–1696. doi: 10.1016/j.cell.2015.05.044.
22. Goydos JS, Mann B, Kim HJ et al. Detection of B-RAF and N-RAS mutations in human melanoma. J Am Coll Surg 2005; 200 (3): 362–370.
23. Kumar R, Angelini S, Hemminki K. Activating BRAF and N-Ras mutations in sporadic primary melanomas: an inverse association with allelic loss on chromosome 9. Oncogene 2003; 22 (58): 9217–9224.
24. Lee JH, Choi JW, Kim YS. Frequencies of BRAF and NRAS mutations are different in histological types and sites of origin of cutaneous melanoma: a meta-analysis. Br J Dermatol 2011; 164 (4): 776–784. doi: 10.1111/j.13652133.2010.10185.x.
25. Curtin JA, Busam K, Pinkel D et al. Somatic activation of KIT in distinct subtypes of melanoma. J Clin Oncol 2006; 24 (26): 4340–4346.
26. Libra M, Malaponte G, Navolanic PM et al. Analysis of BRAF mutation in primary and metastatic melanoma. Cell Cycle 2005; 4 (10): 1382–1384.
27. Melis C, Rogiers A, Bechter O et al. Molecular genetic and immunotherapeutic targets in metastatic melanoma. Virchows Arch. In press 2017. doi: 10.1007/s00428-017-2113-3.
28. Davies H, Bignell GR, Cox C et al. Mutations of the BRAF gene in human cancer. Nature 2002; 417 (6892): 949–954.
29. Hauschild A, Grob JJ, Demidov LV et al. Dabrafenib in BRAF-mutated metastatic melanoma: a multicentre, open-label, phase 3 randomised controlled trial. Lancet 2012; 380 (9839): 358–365. doi: 10.1016/S0140-6736 (12) 60868-X.
30. Chapman PB, Hauschild A, Robert C et al. Improved survival with vemurafenib in melanoma with BRAF V600E mutation. N Engl J Med 2011; 364 (26): 2507–2516. doi: 10.1056/NEJMoa1103782.
31. Thomas NE, Edmiston SN, Alexander A et al. Number of nevi and early-life ambient UV exposure are associated with BRAF-mutant melanoma. Cancer Epidemiol Biomarkers Prev 2007; 16 (5): 991–997.
32. Menzies AM, Lum T, Wilmott JS et al. Intrapatient homogeneity of BRAFV600E expression in melanoma. Am J Surg Pathol 2014; 38 (3): 377–382. doi: 10.1097/PAS.0000000000000136.
33. Saroufim M, Habib RH, Gerges R et al. Comparing BRAF mutation status in matched primary and metastatic cutaneous melanomas: implications on optimized targeted therapy. Exp Mol Pathol 2014; 97 (3): 315–320. doi: 10.1016/j.yexmp.2014.09.008.
34. Yancovitz M, Litterman A, Yoon J et al. Intra-and inter-tumor heterogeneity of BRAF (V600E)) mutations in primary and metastatic melanoma. PLoS One 2012; 7 (1): e29336. doi: 10.1371/journal.pone.0029336.
35. Dadzie OE, Yang S, Emley A et al. RAS and RAF muta-tions in banal melanocytic aggregates contiguous with primary cutaneous melanoma: clues to melanomagenesis. Br J Dermatol 2009; 160 (2): 368–375. doi: 10.1111/j.1365-2133.2008.08887.x.
36. Busam KJ, Hedvat C, Pulitzer M et al. Immunohistochemical analysis of BRAF (V600E) expression of primary and metastatic melanoma and comparison with mutation status and melanocyte differentiation antigens of metastatic lesions. Am J Surg Pathol 2013; 37 (3): 413–420. doi: 10.1097/PAS.0b013e318271249e.
37. Johnson DB, Menzies AM, Zimmer L et al. Acquired BRAF inhibitor resistance: A multicenter meta-analysis of the spectrum and frequencies, clinical behaviour, and phenotypic associations of resistance mechanisms. Eur J Cancer 2015; 51 (18): 2792–2799. doi: 10.1016/j.ejca.2015.08.022.
38. Manzano JL, Layos L, Buges C et al. Resistant mechanisms to BRAF inhibitors in melanoma. Ann Transl Med 2016; 4 (12): 237. doi: 10.21037/atm.2016.06.07.
39. Fisher KE, Cohen C, Siddiqui MT et al. Accurate detection of BRAF p.V600E mutations in challenging melanoma specimens requires stringent immunohistochemistry scoring criteria or sensitive molecular assays. Hum Pathol 2014; 45 (11): 2281–2293. doi: 10.1016/j.humpath.2014.07.014.
40. Mai R, Zhou S, Zhong W et al. Therapeutic efficacy of combined BRAF and MEK inhibition in metastatic melanoma: a comprehensive network meta-analysis of randomized controlled trials. Oncotarget 2015; 6 (29): 28502–28512. doi: 10.18632/oncotarget.4375.
41. Queirolo P, Spagnolo F. BRAF plus MEK-targeted drugs: a new standard of treatment for BRAF-mutant advanced melanoma. Cancer Metastasis Rev 2017; 36 (1): 35–42. doi: 10.1007/s10555-017-9660-6.
42. Simeone E, Grimaldi AM, Festino L et al. Combination Treatment of Patients with BRAF-Mutant Melanoma: A New Standard of Care. BioDrugs 2017; 31 (1): 51–61. doi: 10.1007/s40259-016-0208-z.
43. Deken MA, Gadiot J, Jordanova ES et al. Targeting the MAPK and PI3K pathways in combination with PD1 blockade in melanoma. Oncoimmunology 2016; 5 (12): e1238557. doi: 10.1080/2162402X.2016.1238557.
44. Hermel DJ, Ott PA. Combining forces: the promise and peril of synergistic immune checkpoint blockade and targeted therapy in metastatic melanoma. Cancer Metastasis Rev 2017; 36 (1): 43–50. doi: 10.1007/s10555-017-9656-2.
45. Hu-Lieskovan S, Mok S, Homet Moreno B et al. Improved antitumor activity of immunotherapy with BRAF and MEK inhibitors in BRAF (V600E) melanoma. Sci Transl Med 2015; 7 (279): 279ra241. doi: 10.1126/scitranslmed.aaa4691.
46. Kim T, Amaria RN, Spencer C et al. Combining targeted therapy and immune checkpoint inhibitors in the treatment of metastatic melanoma. Cancer Biol Med 2014; 11 (4): 237–246. doi: 10.7497/j.issn.2095-3941.2014.04.002.
47. Pasquali S, Chiarion-Sileni V, Rossi CR et al. Immune checkpoint inhibitors and targeted therapies for metastatic melanoma: A network meta-analysis. Cancer Treat Rev 2017; 54 : 34–42. doi: 10.1016/j.ctrv.2017.01.006.
48. Prieto PA, Reuben A, Cooper ZA et al. Targeted Therapies Combined With Immune Checkpoint Therapy. Cancer J 2016; 22 (2): 138–146. doi: 10.1097/PPO.0000000000000182.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2017 Issue 3
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Safety and Tolerance of Metamizole in Postoperative Analgesia in Children
-
All articles in this issue
- Molecular Aspects of Thyroid Tumors with Emphasis on MicroRNA and Their Clinical Implications
- Recent Overview of Kidney Cancer Diagnostics and Treatment
- Malignant Melanoma – from Classical Histology towards Molecular Genetic Testing
- New Drugs in the Treatment of Acute Myeloid Leukemia in the Elderly
- Breast Cancer in Young Women – Correlation of Clinical Histomorphological, and Molecular-genetic Features of Breast Carcinoma in Women Younger than 35 Years of Age
- Isolated Perfusion of the Upper Extremity with TNF-α – Double Venous Cannulation
- Basal Cell Carcinoma Multiplicity – a Retrospective Analysis of 899 Biopsy-proven Patients from a Single Institute
- Durable Complete Response of Colorectal Cancer Metastasis after Biochemotherapy
- SAMPUS, MELTUMP and THIMUMP – Diagnostic Categories Characterized by Uncertain Biological Behavior
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Recent Overview of Kidney Cancer Diagnostics and Treatment
- SAMPUS, MELTUMP and THIMUMP – Diagnostic Categories Characterized by Uncertain Biological Behavior
- Malignant Melanoma – from Classical Histology towards Molecular Genetic Testing
- Breast Cancer in Young Women – Correlation of Clinical Histomorphological, and Molecular-genetic Features of Breast Carcinoma in Women Younger than 35 Years of Age
