Kontroverze v pooperační léčbě low-grade gliomů
Controversy in the Postoperative Treatment of Low-grade Gliomas
Background:
The optimal treatment for low-grade gliomas remains controversial. Neurosurgery, radiotherapy, and chemotherapy are the main treatment options. Despite advances in oncology, there are still a lot of uncertainties, and the optimal sequences, combinations, and timings of these procedures have not yet been optimized. It is still unclear whether temozolomide can replace effective, but toxic PCV chemotherapy (procarbazine, lomustine, vincristine) and whether temozolomide can be used upfront alone instead of radiotherapy alone. Mature results from phase III trials (CODEL, EORTC 22033-26033) will provide answers to these questions. Correlative analyses of survival data and molecular marker findings (1p/19q codeletion, IDH1/2 mutation, and MGMT promoter methylation status) are essential. Due to slow progressive nature of the disease, all clinical trials with low-grade gliomas are complicated by the need for long-term follow-up to obtain valid mature data, which makes any new treatment procedures or developments in basic research developed during the course of closed clinical trials difficult to apply in daily clinical practice. An example is the recently published RTOG 9802 study evaluating the role of adjuvant PCV in combination with radiotherapy for the treatment of high-risk low-grade glioma patients where the recruitment of patients was initiated almost two decades ago. Health-related quality of life after treatment of patients with expected long-term survival is also very important and its maintenance is currently the focus of considerable interest.
Aim:
The main objective of the present review is to summarize the results of key clinical trials and highlight controversial issues that could have an impact on future daily practice. Another aim is to discuss these issues in the light of newly established molecular markers from the new 2016 WHO Classification of Tumors of the Central Nervous System.
Key words:
glioma – astrocytoma – radiotherapy – temozolomide – PCV – cognition
This work was supported by MH CZ – RVO (MMCI, 00209805) and by project of the Ministry of Education, Youths and Sports of the Czech Republic CEITEC 2020 (LQ1601).
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted:
21. 2. 2017
Accepted:
20. 3. 2017
:
T. Kazda 1,2; R. Lakomý 3; A. Poprach 3; P. Pospíšil 1
; R. Jančálek 4; P. Šlampa 1
:
Klinika radiační onkologie LF MU a Masarykův onkologický ústav, Brno
1; CEITEC – Středoevropský technologický institut, MU, Brno
2; Klinika komplexní onkologické péče LF MU a Masarykův onkologický ústav, Brno
3; Neurochirurgická klinika LF MU a FN U sv. Anny v Brně
4
:
Klin Onkol 2017; 30(5): 337-342
:
Review
prolekare.web.journal.doi_sk:
https://doi.org/10.14735/amko2017337
Východiska:
Optimální léčba low-grade gliomů je stále kontroverzní. K hlavním léčebným metodám patří chirurgie, radioterapie a chemoterapie. Přes pokroky v onkologii stále neznáme ani optimální sekvenci a kombinaci léčebných metod, ani jejich správné načasování. Pořád není jasné, zda temozolomid může nahradit efektivní, ale příliš toxický režim PCV (prokarbazin, lomustin, vinkristin) a zda může být použit v 1. linii léčby místo radioterapie. Na tyto otázky nám možná odpoví zralá data z dalších studií fáze III (CODEL, EORTC 22033-26033). Analýza přežití v korelaci s molekulárními markery (kodelece 1p/19q, mutace genu pro IDH1/2 a metylace promotoru genu pro MGMT) je nezbytná. Obecným problémem všech klinických studií zabývajících se low-grade gliomy je nutnost dlouhodobého sledování pro získání validních dat. Jedná se totiž o pomalu progredující onemocnění. V mezidobí jsou však k dispozici nové léčebné postupy a poznatky ze základního výzkumu a zralá data proběhlých klinických studií jsou tak těžko uplatnitelná v klinické praxi. Příkladem je nedávno publikovaná studie RTOG 9802 hodnotící význam přidání adjuvantní chemoterapie PCV k radioterapii u vysokorizikových pacientů s low-grade gliomy, kde nábor pacientů probíhal před téměř dvěma dekádami. Kvalita života po léčbě u pacientů s pravděpodobným dlouhodobým přežitím je také velmi důležitá a na její zachování je kladen čím dál větší důraz.
Cíl:
Cílem sdělení je shrnout výsledky z klíčových klinických studií a poukázat na řadu sporných otázek, se kterými se budeme potýkat v běžné klinické praxi. Cílem je také diskutovat tuto problematiku ve světle nově etablovaných molekulárních markerů z nové WHO klasifikace mozkových nádorů.
Klíčová slova:
gliom – astrocytom – radioterapie – temozolomid – PCV – kognitivní funkce
Úvod
Low-grade gliomy (LGG) představují cca 5–10 % všech primárních mozkových nádorů u dospělých. Nejčastěji postihují mladé pacienty ve 3. a 4. dekádě jejich života. Téměř u všech pacientů dochází během několika roků k progresi onemocnění, s postupnou neurologickou deteriorací a následným předčasným úmrtím. K základním léčebným metodám stále patří neurochirurgický výkon, radioterapie (RT) a chemoterapie (CHT). Možnosti jednotlivých metod, stejně jako diagnostiky se v posledních letech významně zlepšily. Pacientům jsme tak schopni nabídnout radikálnější operační výkony, modernější RT techniky či méně toxickou CHT. Jejich optimální sekvence, kombinace, ale i načasování jsou však stále kontroverzní a jsou předmětem dalšího výzkumu [1–3]. Cílená léčba nebo moderní imunoterapie s checkpoint inhibitory se v léčbě LGG zatím neuplatnily. S přibývajícími znalostmi z oblasti molekulární biologie a genetiky můžeme již lépe predikovat biologické chování onemocnění a jeho prognózu, což se také odráží v nové WHO klasifikaci z roku 2016 [4,5]. Je jen otázkou času, kdy budeme znát u LGG nejen prognostické, ale i prediktivní molekulární markery a budeme mít také k dispozici nové terapeutické cíle. Naše léčba pak bude efektivnější, což se projeví v lepších léčebných výsledcích se zachováním dobré kvality života těchto převážně mladých pacientů. Cílem sdělení je shrnout základní informace o jednotlivých léčebných metodách a především poukázat na sporné otázky, se kterými se potýkáme v běžné klinické praxi.
Optimální čas zahájení pooperační léčby
Rozsah resekčního výkonu a jeho vliv na parametry přežití byl předmětem řady retrospektivních analýz. Podobně jako u high-grade gliomů, i u LGG pacienti profitují z maximální možné a časné resekce [6–10]. Pomineme-li konkrétní operační techniku a taktiku, zůstávají významnější nejasnosti u primárně radikálně inoperabilních LGG, kde se praxe liší mezi jednotlivými pracovišti vč. použití neoadjuvantní léčby temozolomidem (TMZ) [11,12]. Složitější je otázka zahájení pooperační léčby u pomalu progredujících nádorů. Odložením RT se snažíme vyhnout pozdní neurologické toxicitě, kterou popsali Douw et al u pacientů s LGG po RT v porovnání s RT naivními pacienty [11]. Navíc odložená RT vs. časná RT nemá dle velké klinické studie (EORTC 22845, tzv. Non-Believers Trial) významný rozdíl v celkovém přežití (overall survival – OS), i když časná RT signifikantně prodlužuje čas bez progrese onemocnění [13,14]. Bohužel tato studie nehodnotila kvalitu života pacientů a dat z jiných prospektivních studií je málo. Zda je tedy odklad RT i dnes správná volba, není úplně jasné, protože je jisté, že se na deterioraci kognitivních funkcí podílejí i jiné faktory, kdy tím nejdůležitějším může být (brzy progredující) tumor samotný [15,16]. Objektivně zhodnotit vliv samotné progrese nádoru na kognitivní funkce má za úkol observační studie RTOG 0925. Toxicita s využitím moderních technik RT totiž nemusí být tak významná jako dříve (např. radioprotekce kontralaterálního, event. i ipsilaterálního hipokampu či jiných struktur mozku) [17–19]. Navíc pacienti ve zmiňované studii Douw et al nebyli randomizováni (pacienti s RT měli závažnější, větší tumory) a ti, kteří podstoupili RT, absolvovali mnohem vyšší dávku (průměrně 56,5 Gy), než je v současné době doporučovaných 45–50,4 Gy à 1,8 Gy [11]. Srovnáním dávky pooperační RT u LGG se zabývala druhá velká studie (EORTC 22844, tzv. Believers Trial) srovnávající 45 vs. 59,4 Gy, kdy vyšší dávka nevedla ani k lepšímu OS, ani PFS, naopak způsobovala vyšší únavu a emoční labilitu [20,21]. Pokud jde o vhodný interval pro zahájení adjuvantní CHT, tak zde je ještě méně jednoznačných doporučení. Ve většině studií byla léčba s CHT zahájena do 12 týdnů od operace. Podobně i délka adjuvantní CHT není pevně stanovena, neměla by však přesáhnout 12 měsíců [22]. Určité spekulace nabízí post hoc analýza nedávno publikované randomizované studie fáze III RTOG 9802 srovnávající samotnou RT s RT + PCV (prokarbazin, lomustin, vinkristin) u high-risk LGG [23,24]. Celkem 77 % pacientů, kteří měli progresi v rameni se samotnou RT, bylo dále léčeno CHT. V této podskupině jde tedy de facto o srovnání RT + brzká CHT vs. RT + opožděná CHT při progresi. Jistě tak ale nelze interpretovat základní pozorovaný rozdíl v OS 13,3 vs. 7,8 roku. Iniciální léčba RT + PCV se ale zdá účinnější než primární RT a salvage (záchranná) CHT až v době progrese [23,25]. Jako další důležitý nezávislý negativní prognostický faktor se ukazuje rychlost růstu nádoru (parametr velocity), jež je asociována s časnější maligní progresí [26].
CHT a její kontroverze v léčbě high-risk LGG
Samotná CHT nebo kombinace či sekvence s RT
Odložení RT a primární užití CHT, nejlépe s TMZ, je často diskutované téma. Srovnáním CHT vs. RT v 1. linii léčby se zabývaly dvě velké klinické studie fáze III – NOA-04 u anaplastických gliomů (PCV nebo TMZ vs. RT) a studie EORTC 22033-26033 u low-grade gliomů (TMZ vs. RT) [22,27,28]. U studie NOA-04 byl medián přežití bez progrese (progression-free survival – PFS) v rameni s CHT 31 měsíců (18,2 měsíce pro anaplastické astrocytomy, 52,7 měsíce pro anaplastické oligodendrogliomy). U studie EORTC 22033-26033 byl medián PFS u CHT s TMZ 39 měsíců (55 měsíců s kodelecí 1p/19q a 30 měsíců bez kodelece). V ramenech se samotnou iniciální RT bylo PFS u NOA-04 30,6 měsíce, EORTC 22033-26033 46 měsíců a u RTOG 9802 48 měsíců. Žádný výsledek se ani zdaleka neblíží PFS u kombinace RT + PCV u studie RTOG 9802 (10,4 roku) [23]. V současné době tedy není k dispozici žádný důkaz potvrzující lepší výsledky samotné CHT v porovnání se samotnou RT [29]. Ačkoli může být takovéto srovnání zkresleno zařazováním různých pacientů do jednotlivých studií (grade 3, resp. grade 2 gliomy), ve světle aktuální WHO klasifikace z roku 2016 se zdá být důležitější molekulární profil konkrétního nádoru, a zastoupení jednotlivých nádorů ve zmiňovaných studiích (NOA-04, EORTC 22033-26033 a RTOG9802) tak mohlo být dosti podobné (už jen zařazování pacientů s diagnózou „oligoastrocytom“ je dle klasifikace WHO 2016 jednoznačně zdrojem bias). Tak např. studie EORTC 22033-26033 naznačila, že u prognosticky příznivé skupiny LGG definované molekulárně-biologickými markery (IDHmt a 1p/19q kodelece) nebude CHT TMZ horší, z pohledu parametru PFS, než samotná RT, a tím by se část pacientů mohla RT a její potenciální neurologické toxicitě vyhnout, resp. ji alespoň oddálit. Bude ale třeba ještě vyčkat na data týkající se OS. Podobné výsledky přinášejí i další dvě velké studie fáze III s anaplastickými oligodendrogliomy s kodelecí 1p/19q (RTOG 9402, EORTC 26951). I zde byla kombinace RT + PCV lepší než sekvence (CHT až v době progrese) a data PFS predikovala výsledek OS [30,31]. Zatím nelze jednoznačně doporučit režim kombinující TMZ s RT (Stuppův režim), protože se nedá vyloučit potenciace pozdních neurologických následků RT [32]. Předběžné výsledky jednoramenné klinické studie RTOG 0424 fáze II s konkomitantní a adjuvantní CHT s TMZ a RT 54 Gy/30 frakcí u high-risk LGG (tři a více rizikové faktory) ale ukazují, že TMZ prodlužuje OS ve srovnání s historickými kontrolami se samotnou RT (p < 0,001). Při mediánu sledování 4,1 roku nebyl zatím medián OS dosažen, 3leté OS bylo 73,1 % a 3leté PFS 59,2 % [33]. Pokud je tedy u informovaného pacienta s LGG na základě multidisciplinární rozvahy indikována další onkologické léčba, pak by měla podle současné medicíny založené na důkazech (evidence-based medicine – EBM) sestávat z RT následované PCV CHT. Samotná indikace je ale v praxi problematická. Je možné řídit se ve světle poznatků z EORTC 22033-26033 o významu molekulární charakterizace (a s vědomím velké interobservační variability v histologické diagnostice grade 2 gliomů) striktně vstupními kritérii studie RTOG 9802 (věk 18–39 let po neradikální resekci nebo věk ≥ 40 roků s jakoukoli resekcí) ? Pak by byla stejná léčba indikována pro 45letého pacienta po radikální resekci LGG – IDHmt oligodendrogliomu s 1p/19q kodelecí a pro 45letého pacienta s radikálně resekovaným triple-negativním astrocytomem (bez 1p/19q kodelece, IDHwt a TERTwt) [34]. Oba splňují indikační kritéria pro zařazení do RTOG 9802. Označení high-risk, tak jak bylo použito ve studii RTOG 9802, může být ve finále matoucí. Bez ohledu na zmíněné kontroverze v definici high-risk pacientů (a tedy indikace k pooperační onkologické terapii) zůstává neoddiskutovatelnou skutečností, že neselektovaní pacienti splňující kritéria pro zařazení do RTOG 9802 mají naprosto bezprecedentní prodloužení OS o 5,5 roku při léčbě RT + PCV ve srovnání s RT samotnou, a to bez ohledu na histologické nebo molekulární varianty tumoru. Jako taková splňuje studie RTOG 9802 kritéria důkazu úrovně 1 a je právem mnohými označována jako „practice changing“ ve světě EBM. Důvodem, proč léčíme podle zásad EBM, je skutečnost, že nikdo nedokáže dostatečně přesně predikovat účinnost nebo toxicitu dané léčby bez EBM [2]. Tak např. dokáže někdo odhadnout, zda by při antiangiogenní terapii LGG byla pozorována vyšší invazivita recidivy, jako bylo popsáno u high-grade gliomů? Změna charakteru růstu nemusí být problém u rychle rostoucích a progredujících glioblastomů, ale u pomalu rostoucích LGG u pacientů s prognózou ≥ 10 let by se již mohlo jednat o vážný problém [35].
Nejlepší CHT režim – PCV nebo TMZ
Oligodendrogliomy jsou obecně více chemosenzitivní než astrocytomy, zvláště pokud je přítomná kodelece 1p/19q a IDHmt. Optimální CHT režim však stále neznáme. PCV režim byl vytvořen v polovině 80. let minulého století na základě kombinace cytostatik působících v odlišných fázích buněčného cyklu. Režim byl velmi populární pro vysokou četnost léčebných odpovědí u rekurentních oligodendrogliomů. V poslední dekádě je ale režim často nahrazován méně toxickým a snadněji aplikovatelným TMZ [36]. Bohužel zatím nelze říci, že TMZ je stran účinnosti rovnocenná alternativa, nemáme data ze studií přímo porovnávajících oba režimy v primární léčbě u LGG. Pouze orientační srovnání obou režimů je zatím možné jen u anaplastických gliomů ve studii NOA-04, kde TMZ potvrdil svoji nižší toxicitu [27]. Dle recentní publikace ze studie NOA-04 vycházející z dlouhodobého sledování pacientů není rozdíl v PFS a OS mezi RT a CHT (TMZ nebo PCV) [28]. Jak u RT, tak i u CHT byl zaznamenán delší PFS u pacientů s IDH1mt a metylací promotoru genu MGMT (O6-metylguanin-metyltransferázy). Pokud jde o CHT, tak pacienti s CIMP (hypermetylační stav ostrůvků cytozin-guanin nádorového genomu) a kodelecí 1p/19q měli PFS delší u režimu PCV než u TMZ (HR 0,39; p = 0,031). Výsledky je ale třeba brát jen jako orientační, protože cílem studie nebylo přímé srovnání režimů CHT [28]. Na obě otázky – náhrada PCV za TMZ a indikace konkomitantní a adjuvantní CHT/RT s TMZ nám možná odpoví studie CODEL fáze III u anaplastických gliomů a LGG s kodelecí 1p/19q. Cílem studie je srovnat RT + PCV (šest cyklů) vs. konkomitantní a adjuvantní CHT/RT s TMZ (adjuvantně šest až dvanáct cyklů), studie aktuálně běží (NCT00887146).
Molekulární prognostické a prediktivní markery u LGG
Ve studiích s PCV u anaplastických oligodendrogliomů (RTOG 9402, EORTC 26951) byl jasný benefit CHT prokázán u pacientů s kodelecí 1p/19q a/nebo IDHmt [37]. Vztah k IDH naznačuje třetí studie v pořadí – RTOG 9802. K dalším příznivým markerům se dnes řadí CIMP a metylační stav promotoru genu MGMT [38]. Stejné výsledky nám přinesly také retrospektivní analýzy souborů pacientů s low-grade oligodendrogliomy. I zde je kodelece 1p/19q pozitivní prognostický a prediktivní faktor [39,40]. Bohužel ve studii RTOG 9802 toto nemohlo být pro nedostatek nádorové tkáně potvrzeno [23]. Většina nádorů s kodelecí 1p/19q má také IDH1mt a tato mutace je často spojena právě s fenotypem CIMP. Silná asociace mezi CIMP a metylací promotoru MGMT naznačuje, že metylační stav promotoru MGMT je součástí komplexního, prognosticky příznivého genomového stavu, který kromě chemosenzitivity může mít vztah i k relativní radiosenzitivitě těchto gliálních nádorů. IDHmt je charakteristická pro LGG a je přítomna u více než 80 % těchto tumorů, zvláště u oligodendrogliomů [41,42]. Dle studie EORTC 22033-26033 měli nejlepší prognózu pacienti s IDHmt a kodelecí 1p/19q. Naopak nejhorší výsledky měli pacienti IDHwt. IDHwt nádory mají pravděpodobně blíže k jiným histologickým jednotkám (nejčastěji glioblastom) a je potřeba je blíže popsat [22]. MGMT testování u IDHmt nádorů nepřináší další prognostický či prediktivní přínos (metylace MGMT je u většiny IDHmt pacientů). Význam ale může mít u IDHwt pacientů, což bylo potvrzeno u IDHwt anaplastických gliomů, kde metylace MGMT měla prediktivní význam pro efekt léčby CHT [38,43]. Vyšetření stavu IDH a 1p/19q je v rámci stanovení tzv. integrované diagnózy již součástí nové WHO klasifikace mozkových nádorů z roku 2016 [5,44,45]. Zdá se, že molekulární profil tumoru může být v mnoha případech důležitější než výsledek tradičního histopatologického vyšetření.
Studie s LGG a problematické srovnání jejich výsledků
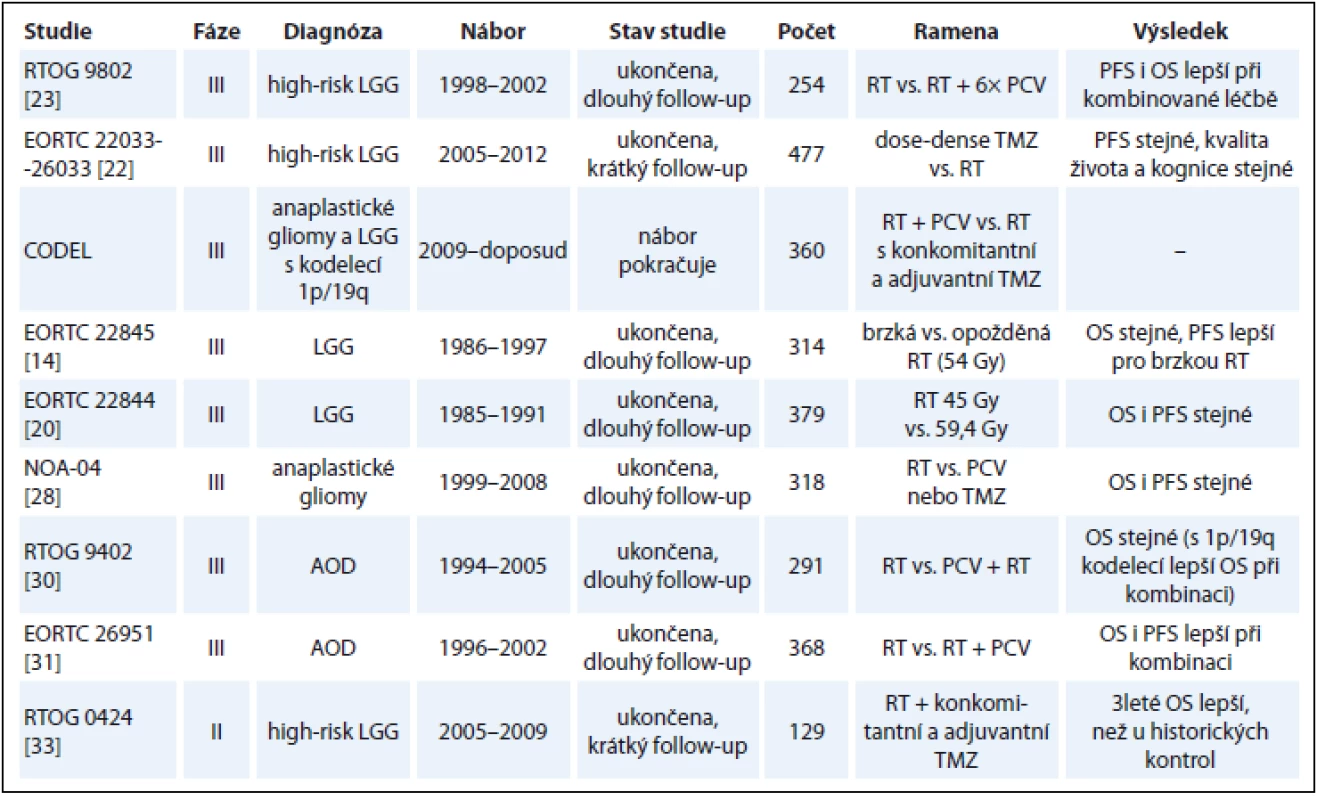
LGG jsou pomalu progredující onemocnění. Abychom získali zralá data z pohledu OS, musíme čekat téměř dvě dekády. Pokrok v medicíně jde během této doby kupředu, což v konečném důsledku znemožní srovnání výsledků starších a nových studií. Studie se pak často liší v základních parametrech, jako jsou jejich cíle či klasifikace high-risk skupiny pacientů. Navíc parametry PFS a OS mohou být v novějších studiích delší také díky lepší diagnostice a pokrokům v chirurgii, RT a CHT. Za zlatý standardní parametr pro hodnocení účinnosti léčby v onkologii stále považujeme OS pacientů, nicméně čekat dvě dekády na zralá data ze studií s LGG je do budoucna také nereálné. Proto je třeba dále hledat zástupné markery (surrogates) korelující s léčebnou odpovědí a potažmo s OS, jako je např. kontrola průvodní epilepsie nebo PFS [46]. Interpretace dat týkajících se PFS je ale u nádorů mozku problematická, protože hodnocení a srovnávání progrese na zobrazovacích metodách u pacientů po RT, v rámci vzniklých poradiačních změn, a po CHT je nesnadné. Pro exaktní hodnocení PFS bude nutné standardizované hodnocení MRI, k čemuž je nutná teprve nedávno stanovená standardizace akvizičních parametrů gliomových MRI protokolů [47,48]. Základní informace výše diskutovaných nejvýznamnějších studií jsou shrnuty v tab. 1.
Diskuze
Problematika pooperační léčby u LGG je stále velmi složitá. Výsledky nedávno publikovaných klinických studií a poznatky z oblasti molekulárních markerů, které jsou součástí WHO klasifikace z roku 2016, nás nutí ke zjednodušení a vytvoření nových léčebných algoritmů použitelných v běžné klinické praxi [4,5,22,23]. Z tohoto pohledu bychom mohli u pacientů s IDHmt a kodelecí 1p/19q doporučovat RT + PCV [23,36]. U pacientů s IDHwt by pro jejich podobu s glioblastomy byla vhodná konkomitantní CHT/RT s TMZ (nebo podobně jako u IDHwt anaplastických astrocytomů bude mít prediktivní význam MGMT predikující benefit přidání alkylační CHT). U pacientů IDHmt, bez kodelece 1p/19q, by pravděpodobně byla indikována samotná RT, situace však není tak jasná, (schéma 1) [22,36]. Musíme si být vědomi, že rozhodování jen na základě molekulárního profilu může být zatíženo chybou. V úvahu totiž musíme brát i další parametry jako věk, komorbidity, přítomnost symptomů, kontrolu epilepsie, rozsah resekce, růstovou kinetiku nádoru a samozřejmě také vedlejší účinky použité metody, zvláště pozdní toxicitu RT. Kvalita života se dnes stává významným faktorem pro hodnocení úspěšnosti léčby, i když je její hodnocení pomocí různých dotazníků na mnoha pracovištích z časových důvodů stále opomíjeno [36]. Dalším úskalím je proveditelnost velkých klinických studií u LGG. Vzhledem k dlouhé délce života většiny pacientů s LGG je nutný k dosažení definitivních závěrů dlouhý follow-up. Vývoj v medicíně však mezitím značně postoupí a získaná data je pak problematické uplatnit v praxi. Z tohoto pohledu se budeme v budoucnu pravděpodobně stále více spoléhat na informace získané ze společných mezinárodních databází pacientů s LGG a menší randomizované klinické studie budou zaměřeny na řešení jen dílčích problémů [36].
![Schéma 1. Algoritmus léčby LGG podle molekulárních markerů [36].](https://pl-master.mdcdn.cz/media/image/e439f62a3a138a823006e773233dd75f.png?version=1537797343)
Závěr
I přes pokroky v chirurgii, RT a CHT zůstávají LGG inkurabilním onemocněním. S přibývajícími znalostmi z oblasti molekulární biologie a genetiky jsme již schopni lépe odhadnout prognózu pacienta, problémy však stále máme v predikci léčebné odpovědi. Bez těchto znalostí je problematické stanovit optimální léčebné algoritmy. Situaci navíc komplikuje variabilita celé řady klinických faktorů a samozřejmě i snaha o dosažení co nejlepší kvality života po léčbě. Velké naděje jsou dnes vkládány do mezinárodních klinických databází, které nám mohou poskytnout řadu relevantních informací, a to dříve než klasické klinické studie s mnohaletým sledováním.
Práce byla podpořena MZ ČR – RVO (MOÚ, 00209805) a projektem Ministerstva školství, mládeže a tělovýchovy České republiky CEITEC 2020 (LQ1601).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Radek Lakomý, Ph.D.
Klinika komplexní onkologické péče LF MU a Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: lakomy@mou.cz
Obdrženo: 21. 2. 2017
Přijato: 20. 3. 2017
Sources
1. Tandon A, Schiff D. Therapeutic decision making in patients with newly diagnosed low grade glioma. Curr Treat Options Oncol 2014; 15 (4): 529–538. doi: 10.1007/s11864-014-0304-6.
2. Laack NN, Sarkaria JN, Buckner JC. Radiation Therapy Oncology Group 9802: Controversy or Consensus in the Treatment of Newly Diagnosed Low-Grade Glioma? Semin Radiat Oncol 2015; 25 (3): 197–202. doi: 10.1016/j.semradonc.2015.02.004.
3. Polívka J Jr, Polívka J, Rohan V et al. Aktuální pohled na management nízkostupňových gliových nádorů centrálního nervového systému. Cesk Slov Neurol N 2016; 79/112 (5): 534–540. doi: 10.14735/amcsnn2016534.
4. Brat DJ, Verhaak RG, Aldape KD et al. Comprehensive, Integrative Genomic Analysis of Diff use Lower-Grade Gliomas. N Engl J Med 2015; 372 (26): 2481–2498.
5. Louis DN, Perry A, Reifenberger G et al. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathol 2016; 131 (6): 803–820. doi: 10.1007/s00401-016-1545-1.
6. Ius T, Isola M, Budai R et al. Low-grade glioma surgery in eloquent areas: volumetric analysis of extent of resection and its impact on overall survival. A single-institution experience in 190 patients: clinical article. J Neurosurg 2012; 117 (6): 1039–1052. doi: 10.3171/2012.8.JNS12393.
7. Duffau H, Taillandier L. New concepts in the management of diffuse low-grade glioma: proposal of a multistage and individualized therapeutic approach. Neuro Oncol 2015; 17 (3): 332–342. doi: 10.1093/neuonc/nou153.
8. Smith JS, Chang EF, Lamborn KR et al. Role of extentof resection in the long-term outcome of low-grade hemispheric gliomas. J Clin Oncol 2008; 26 (8): 1338–1345. doi: 10.1200/JCO.2007.13.9337.
9. Jakola AS, Unsgard G, Myrmel KS et al. Surgical strategy in grade II astrocytoma: a population-based analysis of survival and morbidity with a strategy of early resection as compared to watchful waiting. Acta Neurochir 2013; 155 (12): 2227–2235. doi: 10.1007/s00701-013-1869-8.
10. Aghi MK, Nahed BV, Sloan AE et al. The role of surgery in the management of patients with diffuse low grade glioma: A systematic review and evidence-based clinical practice guideline. J Neurooncol 2015; 125 (3): 503–530. doi: 10.1007/s11060-015-1867-1.
11. Douw L, Klein M, Fagel SS et al. Cognitive and radiological effects of radiotherapy in patients with low-grade glioma: long-term follow-up. Lancet Neurol 2009; 8 (9): 810–818. doi: 10.1016/S1474-4422 (09) 70204-2.
12. Jo J, Williams B, Smolkin M et al. Effect of neoadjuvant temozolomide upon volume reduction and resection of diffuse low-grade glioma. J Neurooncol 2014; 120 (1): 155–161. doi: 10.1007/s11060-014-1538-7.
13. Ryken TC, Parney I, Buatti J et al. The role of radiotherapy in the management of patients with diffuse low grade glioma: A systematic review and evidence-based clinical practice guideline. J Neurooncol 2015; 125 (3): 551–583. doi: 10.1007/s11060-015-1948-1.
14. van den Bent MJ, Afra D, de Witte O et al. Long-term efficacy of early versus delayed radiotherapy for low-grade astrocytoma and oligodendroglioma in adults: the EORTC 22845 randomised trial. Lancet 2005; 366 (9525): 985–990.
15. Klein M, Heimans JJ, Aaronson NK et al. Effect of radiotherapy and other treatment-related factors on mid-term to long-term cognitive sequelae in low-grade gliomas: a comparative study. Lancet 2002; 360 (9343): 1361–1368.
16. Scoccianti S, Detti B, Cipressi S et al. Changes in in neurocognitive functioning and quality of life in adult patients with brain tumors treated with radiotherapy. J Neurooncol 2012; 108 (2): 291–308. doi: 10.1007/s11060-012-0821-8.
17. Kazda T, Jancalek R, Pospisil P et al. Why and how to spare the hippocampus during brain radiotherapy: the developing role of hippocampal avoidance in cranial radiotherapy. Radiat Oncol 2014; 9 : 139. doi: 10.1186/1748-717X-9-139.
18. Kazda T, Pospisil P, Vrzal M et al. Volumetric modulated arc therapy for hippocampal-sparing radiotherapy in transformed low-grade glioma: A treatment planning case report. Cancer Radiother 2015; 19 (3): 187–191. doi: 10.1016/j.canrad.2014.11.013.
19. Laack NN, Brown PD, Ivnik RJ et al. Cognitive function after radiotherapy for supratentorial low-grade glioma: a North Central CancerTreatment Group prospective study. Int J Radiat Oncol Biol Phys 2005; 63 (4): 1175–1183.
20. Karim AB, Maat B, Hatlevoll R et al. A randomized trial on dose-response in radiation therapy of low-grade cerebral glioma: European Organization for Research and Treatment of Cancer (EORTC) Study 22844. Int J Radiat Oncol Biol Phys 1996; 36 (3): 549–556.
21. Kiebert GM, Curran D, Aaronson NK et al. Quality of life after radiation therapy of cerebral low-grade gliomas of the adult: results of a randomised phase III trial on dose response (EORTC trial 22844). EORTC Radiotherapy Co-operative Group. Eur J Cancer 1998; 34 (12): 1902–1909.
22. Baumert BG, Hegi ME, van den Bent MJ et al. Temozolomide chemotherapy versus radiotherapy in high-risk low-grade glioma (EORTC 22033-26033): a randomised, open-label, phase 3 intergroup study. Lancet Oncol 2016; 17 (11): 1521–1532. doi: 10.1016/S1470-2045 (16) 30313-8.
23. Buckner JC, Shaw EG, Pugh SL et al. Radiation plus procarbazine, CCNU, and vincristine in low-grade glioma. N Engl J Med 2016; 374 (14): 1344–1355. doi: 10.1056/NEJMoa1500925.
24. Lakomy R, Kazda T, Poprach A et al. Postavení chemoterapie v pooperační léčbě low-grade gliomů. Klin Onkol 2017; 30 (5): 343–348. doi: 10.14735/amko2017343.
25. Třebický F, Kubeš J, Bartoš R et al. Treatment for volume upgrading of the low-grade supratentorial glioma after the subtotal neurosurgical resection. Klin Onkol 2012; 25 (4): 294–298.
26. Gozé C, Blonski M, Le Maistre G et al. Imaging growth and isocitrate dehydrogenase 1 mutation are independent predictors for diffuse low-grade gliomas. Neuro Oncol 2014; 16 (8): 1100–1109. doi: 10.1093/neuonc/ nou085.
27. Wick W, Hartmann C, Engel C et al. NOA-04 randomized phase III trial of sequential radiochemotherapy of anaplastic glioma with procarbazine, lomustine, and vincristine or temozolomide. J Clin Oncol 2009; 27 (35): 5874–5880. doi: 10.1200/JCO.2009.23.6497.
28. Wick W, Roth P, Hartmann C et al. Long-term analysis of the NOA-04 randomized phase III trial of sequential radiochemotherapy of anaplastic glioma with PCV or temozolomide. Neuro Oncol 2016; 18 (11): 1529–1537.
29. van den Bent MJ. Chemotherapy for low-grade glioma: when, for whom, which regimen? Curr Opin Neurol 2015; 28 (6): 633–638. doi: 10.1097/WCO.0000000000000257.
30. Cairncross G, Wang M, Shaw E et al. Phase III trial of chemoradiotherapy for anaplastic oligodendroglioma: long-term results of RTOG 9402. J Clin Oncol 2013; 31 (3): 337–343. doi: 10.1200/JCO.2012.43.2674.
31. van den Bent MJ, Brandes AA, Taphoorn MJ et al. Adjuvant procarbazine, lomustine, and vincristine chemotherapy in newly diagnosed anaplastic oligodendroglioma: long-term follow-up of EORTC Brain Tumor Group study 26951. J Clin Oncol 2013; 31 (3): 344–350. doi: 10.1200/JCO.2012.43.2229.
32. Stupp R, Mason WP, van den Bent MJ et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med 2005; 352 (10): 987–996.
33. Fisher BJ, Hu C, Macdonald DR et al. Phase 2 study of temozolomide-based chemoradiation therapy for high-risk low-grade gliomas: preliminary results of radiation therapy oncology group 0424. Int J Radiat Oncol Biol Phys 2015; 91 (3): 497–504. doi: 10.1016/j.ijrobp.2014.11.012.
34. Eckel-Passow JE, Lachance DH, Molinaro AM et al. Glioma Groups Based on 1p/19q, IDH, and TERT Promoter Mutations in Tumors. N Engl J Med 2015; 372 (26): 2499–2508. doi: 10.1056/NEJMoa1407279.
35. Fabian M, Jezberová M, Pružincová L et al. Vplyv rýchlosti rastu supratentoriálnych grade II gliómov na ich prognózu. Cesk Slov Neurol N 2015; 78/111 (3): 274–281.
36. Mandonnet E, Wager M, Almairac F et al. Survey on current practice within the European Low-Grade Glioma Network: where do we stand and what is the next step? Neuro Oncol Practice. In press 2017. doi: 10.1093/nop/npw031.
37. Cairncross JG, Wang M, Jenkins RB et al. Benefit from procarbazine, lomustine, and vincristine in oligodendroglial tumors is associated with mutation of IDH. J Clin Oncol 2014; 32 (8): 783–790. doi: 10.1200/JCO.2013.49.3726.
38. van den Bent MJ, Erdem-Eraslan L, Idbaih A et al. MGMT-STP27 methylation status as predictive marker for response to PCV in anaplastic oligodendrogliomas and oligoastrocytomas. A report from EORTC study 26951. Clin Cancer Res 2013; 19 (19): 5513–5522. doi: 10.1158/1078-0432.CCR-13-1157.
39. Jenkins RB, Blair H, Ballman KV et al. A t (1; 19) (q10; p10) mediates the combined deletions of 1p and 19q and predicts a better prognosis of patients with oligodendroglioma. Cancer Res 2006; 66 (20): 9852–9861.
40. Polivka J Jr, Polivka J, Repik T et al. Co-deletion of 1p/19q as Prognostic and Predictive Biomarker for Patients in West Bohemia with Anaplastic Oligodendroglioma. Anticancer Res 2016; 36 (1): 471–476.
41. Suzuki H, Aoki K, Chiba K et al. Mutational landscape and clonal architecture in grade II and III gliomas. Nat Genet 2015; 47 (5): 458–468. doi: 10.1038/ng.3273.
42. Yan H, Parsons DW, Jin G et al. IDH1 and IDH2 mutations in gliomas. N Engl J Med 2009; 360 (8): 765–773. doi: 10.1056/NEJMoa0808710.
43. Wick W, Meisner C, Hentschel B et al. Prognostic or predictive value of MGMT promoter methylation in gliomas depends on IDH1 mutation. Neurology 2013; 81 (17): 1515–1522. doi: 10.1212/WNL.0b013e3182a95 680.
44. Lhotská H, Zemanová Z, Kramář F et al. Molecular cytogenetic analysis of chromosomal aberrations in cells of low grade gliomas and its contribution for tumour classification. Klin Onkol 2014; 27 (3): 183–191. doi: 10.14735/amko2014183.
45. Reifenberger G, Wirsching HG, Knobbe-Thomsen CB et al. Advances in the molecular genetics of gliomas – implications for classification and therapy. Nat Rev Clin Oncol 2016; 14 (7): 434–452. doi: 10.1038/nrclinonc.2016.204.
46. Avila EK, Chamberlain M, Schiff D et al. Seizure control as a new metric in assessing efficacy of tumor treatment in low-grade glioma trials. Neuro Oncol 2017; 19 (1): 12–21. doi: 10.1093/neuonc/now190.
47. van den Bent MJ, Wefel JS, Schiff D et al. Response assessment in neuro-oncology (a report of the RANO group): assessment of outcome in trials of diffuse low-grade gliomas. Lancet Oncol 2011; 12 (6): 583–593. doi: 10.1016/S1470-2045 (11) 70057-2.
48. Ellingson BM, Bendszus M, Boxerman J et al. Consensus recommendations for a standardized Brain Tumor Imaging Protocol in clinical trials. Neuro Oncol 2015; 17 (9): 1188–1198. doi: 10.1093/neuonc/nov095.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2017 Issue 5
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Safety and Tolerance of Metamizole in Postoperative Analgesia in Children
-
All articles in this issue
- Potential of Using Vitamin D as an Adjuvant Treatment of Malignant Melanoma
- Controversy in the Postoperative Treatment of Low-grade Gliomas
- The Role of Chemotherapy in the Treatment of Low-grade Gliomas
- Evaluation of Anti-cancer Therapies with Reimbursement Limited to Comprehensive Cancer Centres Using the European Society for Medical Oncology Magnitude of Clinical Benefit Scale
- Treatment Refusal in Pediatric Oncology
- Isocitrate Dehydrogenase Mutations are Better Prognostic Marker than O6-methylguanine-DNA Methyltransferase Promoter Methylation in Glioblastomas – a Retrospective, Single-centre Molecular Genetics Study of Gliomas
- The Anti-apoptotic Mechanism of Metformin Against Apoptosis Induced by Ionizing Radiation in Human Peripheral Blood Mononuclear Cells
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Controversy in the Postoperative Treatment of Low-grade Gliomas
- The Role of Chemotherapy in the Treatment of Low-grade Gliomas
- Isocitrate Dehydrogenase Mutations are Better Prognostic Marker than O6-methylguanine-DNA Methyltransferase Promoter Methylation in Glioblastomas – a Retrospective, Single-centre Molecular Genetics Study of Gliomas
- Treatment Refusal in Pediatric Oncology
