Ascitická tekutina u nádoru vaječníků může poskytnout informace vhodné pro diagnostiku
Ascites May Provide Useful Information for Diagnosis of Ovarian Cancer
Background:
Ovarian cancer is the most lethal gynecological cancer, almost 80% of all patients succumb the disease within 5 years of diagnosis. High mortality is caused especially by nonspecific symptoms, diagnosis in late stages and the absence of a specific biomarker. Currently, the most common diagnostic biomarkers are the membrane glycoprotein Cancer Antigen 125 (CA 125), the Human Epididymal Protein 4 (HE4) and the Carcinoembryonic Antigen (CAE). None of these biomarkers is specific only for ovarian cancer and increased levels may be caused by other diseases. Therefore, current research is focused on finding new biomarkers for diagnosis and prognosis of ovarian cancer. Interesting clinical material is ascites, the fluid accumulated in abdominal cavity, which is typical for ovarian cancer and it is present in almost 90% of all cases of stage III and IV.
Material and Methods:
For this study, samples of ascites from patients with benign and malignant ovarian tumors were used. For full glycomic and proteomic analysis, only 5 µL of ascites were used. Glycans were released from proteins by the enzyme PNGase F and proteins were digested to peptides by trypsin. Samples were purified and measured using a mass spectrometer.
Results:
Glycan and protein profiles of patients with benign and malignant ovarian cancer were compared. In patient with a benign tumor, more simple glycans with low m/z were increased while in the patient with a malignant tumor, higher, more complex glycans were increased. In the malignat tumor in comparison to benign tumor, 127 unique proteins were identified, especially proteins of the annexin, mucin and peroxiredoxin families.
Conclusion:
This investigation is a pilot study focused on comparison of protein and glycan composition of ascites in patients with benign and malignant ovarian cancer. Significant differences were found on both glycan and protein levels. Results will be verified on a larger set of patients and compared with a set of control samples.
Key words:
glycomics – proteomics – ascitic fluid – ovarian cancer
This study was supported by projects of the Ministry of Education Youth and Sports – National Sustainability Program I – LO1413; Ministry of Health, Czech Republic – conceptual development of research organization (MMCI, 00209805); Czech Science Foundation 16-04496S.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted:
13. 3. 2017
Accepted:
26. 3. 2017
:
E. Stuchlíková 1; M. Zahradníková 1; R. Nenutil 1,2; D. Valík 1,3; B. Vojtěšek 1; M. Novotný 1; L. Hernychová 1
:
RECAMO, Masarykův onkologický ústav, Brno
1; Oddělení onkologické patologie, Masarykův onkologický ústav, Brno
2; Oddělení laboratorní medicíny, Masarykův onkologický ústav, Brno
3
:
Klin Onkol 2017; 30(Supplementum1): 187-190
:
Article
Východiska:
Rakovina vaječníků je onkogynekologické onemocnění s nejvyšší úmrtností, téměř 80 % pacientek podlehne onemocnění do 5 let od diagnózy. Vysoká úmrtnost je způsobena především nespecifickými příznaky, diagnózou v pozdních stadiích a absencí specifického biomarkeru. V současné době jsou nejčastěji využívanými diagnostickými biomarkery membránový glykoprotein Cancer Antigen 125 (CA 125), Human Epididymal Protein 4 (HE4) a Carcinoembryonic Antigen (CAE). Žádný z těchto biomarkerů není specifický pouze pro rakovinu vaječníků, zvýšené hodnoty mohou být vyvolány i jinými onemocněními, proto se současné výzkumy zaměřují na hledání nových biomarkerů pro diagnostiku a prognostiku rakoviny vaječníků. Zajímavým klinickým materiálem se stává ascites, tekutina hromadící se v dutině břišní, která je typická pro rakovinu vaječníků a vyskytuje se téměř v 90 % případů III. a IV. stadia onemocnění.
Materiál a metody:
Pro studii byly použity vzorky ascitických tekutin od pacientek s benigním a maligním nádorem vaječníků. Pro kompletní glykomickou a proteomickou analýzu bylo použito 5 µl ascitické tekutiny. Glykanové struktury byly odštěpeny z proteinů pomocí enzymu PNGáza F, proteiny byly následně štěpeny na peptidy pomocí trypsinu. Vzorky byly purifikovány a měřeny pomocí hmotnostního spektrometru.
Výsledky:
Ve studii byly porovnávány glykanové a proteinové profily pacientek s benigním a maligním nádorem vaječníků. U pacientky s benigním nádorem byly zvýšeny jednodušší glykany s nízkým m/z, naopak u pacientky s maligním nádorem byly zvýšeny vyšší, komplexní glykany. U maligního nádoru bylo identifikováno 127 unikátních proteinů, především proteiny rodiny annexinů, mucinů a peroxiredoxinů.
Závěr:
Práce je pilotní studií zabývající se srovnáním glykanového a proteinového složení ascitické tekutiny mezi pacientkou s benigním a maligním nádorovým onemocněním vaječníků. Na glykanové i proteinové úrovni byly patrné signifikantně významné rozdíly. Výsledky budou ověřeny na větším souboru pacientek a porovnány se sadou kontrolních vzorků.
Klíčová slova:
glykomika – proteomika – ascitická tekutina – nádory vaječníků
Východiska
Rakovina vaječníků je šestá nejčastější příčina úmrtí na nádorová onemocnění u žen. Více než 70 % případů je diagnostikováno ve III. a IV. klinickém stadiu, kdy 5leté přežití klesá pouze na 25 % [1,2]. Onemocnění se projevuje nespecifickými příznaky, jako jsou nadýmání, poruchy trávení, bolesti hlavy, nepravidelná menstruace nebo únava. Příznaky se projevují u více než 80 % pacientek již v I. stadiu onemocnění, jsou však často zaměňovány s příznaky méně závažných chorob. Pouze 20 % případů rakoviny vaječníků je diagnostikováno v době, kdy je nádor lokalizován pouze ve vaječnících, a nejsou vytvořeny metastázy [3].
Téměř v 90 % případů II. a III. klinického stadia vzniká ascitická tekutina, která se hromadí v dutině břišní a může způsobovat bolesti a zvětšení objemu břicha nebo dýchací obtíže. Přítomnost ascitické tekutiny koreluje s rozšířením nádoru vaječníků do břišní dutiny a je asociovaná se špatnou prognózou onemocnění. U maligního nádoru se v ascitické tekutině hromadí prozánětlivé a nádor stimulující látky, které vytvářejí mikroprostředí pro vývoj nádorových buněk. Subpopulace těchto buněk vykazují fenotyp podobný rakovinným kmenovým buňkám, které způsobují zvýšenou rezistenci k léčbě a možnost šíření metastáz [4]. Tato studie se zabývá proteomickou analýzou ascitické tekutiny u benigního a maligního nádoru vaječníků. Identifikací jak proteinů, tak i glykanů přítomných v tekutinách byly zjištěny zásadní rozdíly, které by mohly v budoucnosti poskytnout zajímavé informace o stavu nádorového onemocnění a případné léčby.
Materiál a metody
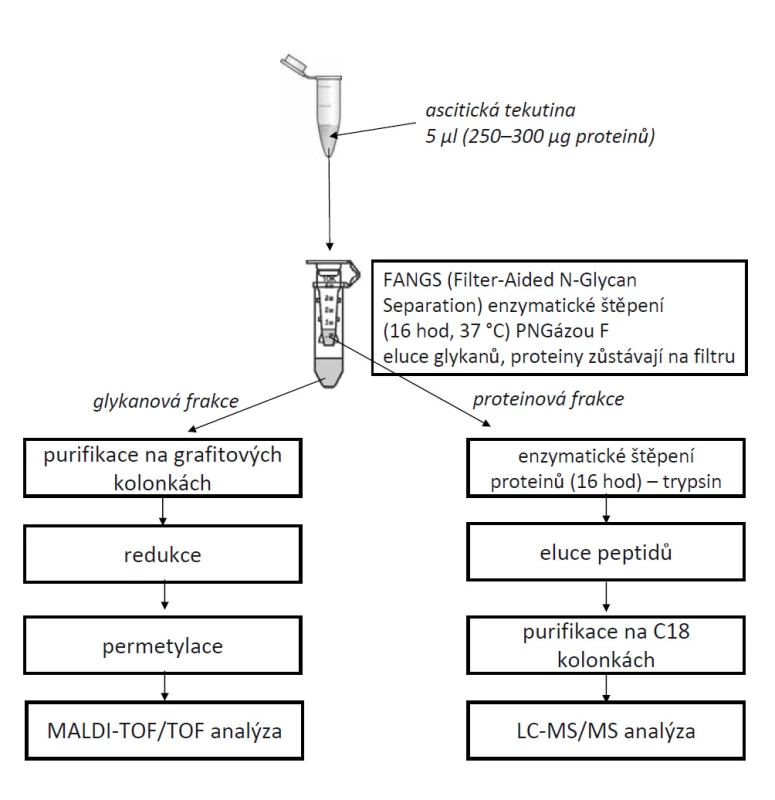
V pilotní studii byly použity vzorky ascitických tekutin od pacientek s benigním a maligním nádorem vaječníků. Pro kompletní glykomickou i proteomickou analýzu bylo použito 5 µl ascitické tekutiny. Proteiny byly denaturovány na filtru (filter-aided N-glycan separation – FANGS), redukovány pomocí 0,1 M dithiotreitolu a alkylovány 0,3 M jodacetamidem. Glykanové struktury byly z proteinů enzymaticky odštěpeny pomocí PNGázy F (odvozena z Flavobacterium meningosepticum) a po 16hodinovém štěpení při 37 °C byly eluovány z filtru. Proteiny zůstaly na filtru a byly štěpeny 16 hod při 37 °C pomocí enzymu trypsinu. Glykanová frakce byla následně purifikována na grafitových kolonkách, vzorky byly redukovány a po permetylaci byly měřeny na hmotnostním spektrometru MALDI-TOF/TOF (Applied Biosystems). Proteinová frakce byla purifikována pomocí C18 kolonek a vzorky byly měřeny na hmotnostním spektrometru Orbitrap-Elite (Thermo Fisher Scientific). Celý postup experimentu je graficky znázorněn na obr. 1.
Výsledky a diskuze
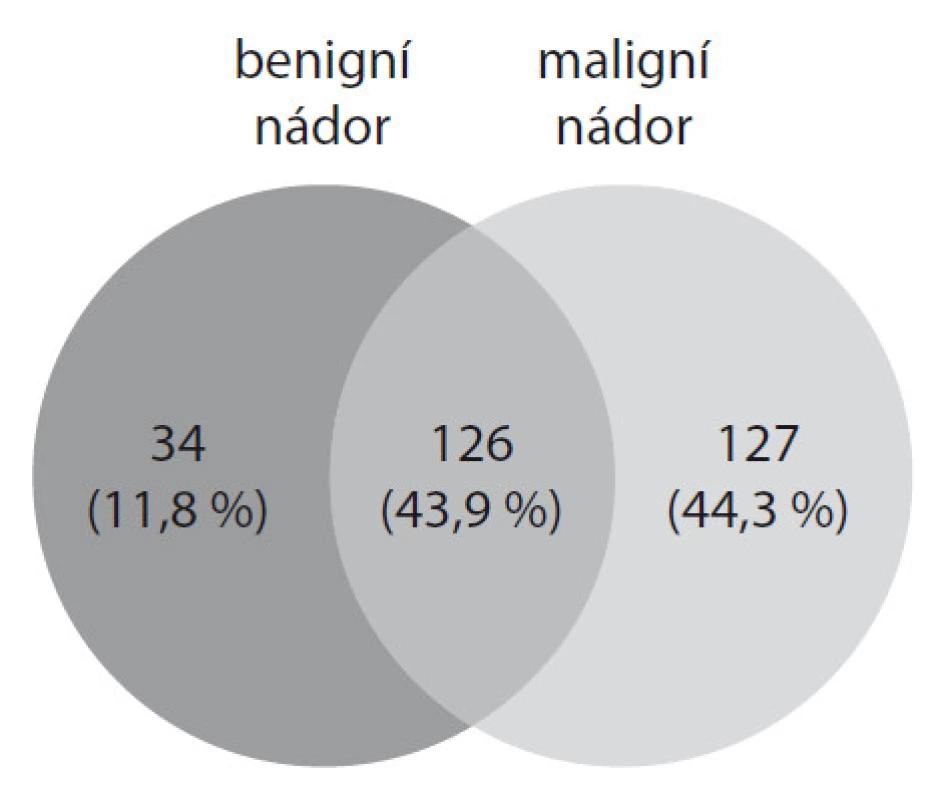
U pacientky s benigním nádorem bylo celkově identifikováno 160 proteinů, u pacientky s maligním nádorem 253 proteinů. V obou vzorcích bylo identifikováno 126 shodných proteinů. Pouze u pacientky s benigním typem nádoru bylo nalezeno 34 unikátních proteinů, které se v maligním vzorku nevyskytovaly. U pacientky s maligním nádorem bylo nalezeno 127 unikátních proteinů (obr. 2), jednalo se především o annexiny (A1, A2, A3, A4 a A10), muciny (1, 2, 5AC, 5B a 13) a peroxiredoxiny (1 a 2). Annexiny patří do rodiny proteinů schopných vázat vápník. U nádorů vaječníků dochází velmi často ke zvýšené expresi těchto proteinů. Annexiny A3 a A4 jsou zapojeny do mechanizmů vzniku rezistence na chemoterapeutickou léčbu u rakoviny vaječníků [5,6]. Rezistence na cisplatinu je provázena také zvýšenou expresí genů pro peroxiredoxin 1 a 2 [7]. Další zajímavé proteiny identifikované u pacientky s maligním nádorem byly především tetraspanin 8, cofilin 1 a anterior gradient protein 2. Souvislost mezi těmito proteiny a rakovinou vaječníků je v současnosti studována.
Glykanové profily pacientek s benigním a maligním nádorem byly výrazně odlišné. U pacientky s benigním typem nádoru byly signifikantně zvýšeny jednoduché glykany s nízkou hodnotou poměru hmotnosti a náboje (m/z) iontů přítomných v hmotnostním spektru. Jednalo se především o glykany s m/z 1 595,81; 1 799,91; 1 840,94 a 1 854,96; dále glykan manózového typu s m/z 2 004,01 a tři komplexní glykany 2 097,08; 2 301,18 a 3 070,56, které jsou fukosylované na základní struktuře (graf 1). Naopak u pacientky s maligním tumorem byly zvýšeny především vyšší, komplexní glykany obsahující sialové kyseliny, případně fukózu. Jedná se o glykany s m/z 3 227,63; 3 257,64 a 3 618,81 (graf 1). Také byl výrazně zvýšen glykan 2 808,41, který je typický pro imonoglobulin G.

Zvýšenou expresi komplexních glykanů u pacientek s maligním nádorem vaječníků lze pozorovat nejen v ascitické tekutině, ale i v séru [2,8]. Profily benigní a maligní ascitické tekutiny významně korelují s již dříve publikovanou studií Biskupa et al [2] zabývající se srovnáním profilů sér pacientek s maligním a benigním nádorem vaječníků a sér zdravých žen. Glykanové profily zdravých sér a sér pacientek s benigním nádorem byly velmi podobné a výrazně se odlišovaly od maligního séra. Podobně jako u maligní ascitické tekutiny byla v séru zjištěna zvýšená exprese vyšších, především tří-a čtyřanténních glykanů a snížená exprese jednoduchých glykanů.
Závěr
Pilotní studie objevila zajímavé rozdíly mezi benigní a maligní ascitickou tekutinou jak na glykanové, tak na proteinové úrovni. V maligním ascitu byly zvýšeny hladiny komplexních fukosylovaných glykanů a byl identifikován téměř dvojnásobný počet unikátních proteinů vč. řady proteinů a především glykoproteinů, které se běžně vyskytují i v sérech pacientek s nádory vaječníků [9]. Získané výsledky budou validovány na větším souboru pacientek a budou porovnány se sadou kontrolních vzorků.
Poděkování
Rádi bychom poděkovali RNDr. Pavlovi Řehulkovi, Ph.D. z Fakulty vojenského zdravotnictví, Univerzity obrany v Hradci Králové za možnost měření glykanových vzorků na hmotnostním spektrometru.
Práce byla podpořena projekty MŠMT – NPU I – LO1413; MZ ČR – RVO (MOÚ, 00209805); GA ČR 16-04496S.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Bc. Eliška Stuchlíková
RECAMO
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: eliskastuchlikova@seznam.cz
Obdrženo: 13. 3. 2017
Přijato: 26. 3. 2017
Sources
1. Smolle E, Taucher V, Haybaeck J. Malignant ascites in ovarian cancer and the role of targeted therapeutics. Anticancer Res 2014; 34 (4): 1553–1561.
2. Biskup K, Braicu EI, Sehouli J et al. The serum glycome to discriminate between early-stage epithelial ovarian cancer and benign ovarian diseases. Dis Markers 2014; 2014 : 238197. doi: 10.1155/2014/238197.
3. Bast RC Jr, Hennessy B, Mills GB. The biology of ovarian cancer: new opportunities for translation. Nat Rev Cancer 2009; 9 (6): 415–428. doi: 10.1038/nrc2644.
4. Ahmed N, Stenvers KL. Getting to know ovarian cancer ascites: opportunities for targeted therapy-based translational research. Front Oncol 2013; 3 : 256. doi: 10.3389/fonc.2013.00256.
5. Kim A, Enomoto T, Serada S et al. Enhanced expression of Annexin A4 in clear cell carcinoma of the ovary and its association with chemoresistance to carboplatin. Int J Cancer 2009; 125 (10): 2316–2322. doi: 10.1002/ijc.24587.
6. Yan X, Yin J, Yao H et al. Increased expression of annexin A3 is a mechanism of platinum resistance in ovarian cancer. Cancer Res 2010; 70 (4): 1616–1624. doi: 10.1158/0008-5472.CAN-09-3215.
7. Kalinina EV, Berezov TT, Shtil’ AA et al. Expression of peroxiredoxin 1, 2, 3, and 6 genes in cancer cells during drug resistance formation. Bull Exp Biol Med 2012; 153 (6): 878–881.
8. Alley WR, Vasseur JA, Goetz JA et al. N-linked glycan structures and their expressions change in the blood sera of ovarian cancer patients. J Proteome Res 2012; 11 (4): 2282–2300. doi: 10.1021/pr201070k.
9. Saldova R, Royle L, Radcliffe CM et al. Ovarian cancer is associated with changes in glycosylation in both acute-phase proteins and IgG. Glycobiology 2007; 17 (12): 1344–1356.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2017 Issue Supplementum1
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- MicroRNA Analysis in Epithelial Ovarian Cancer
- Use of Porous Hydrogel as a 3D Scaffold for the Growth of Leukemic B Lymphocytes
- Ascites May Provide Useful Information for Diagnosis of Ovarian Cancer
- Diagnostic and Therapeutic Potential of Membrane HSP90
- Everolimus in Daily Clinical Practice Focusing to Oral Mucosa Damage Issues – Single Oncology Centre Experience within the Course of the Year 2016
- Analysis of DNA Methylation in BRCA2 Gene Using Electrode Biochips
- Molecular Pathology of Colorectal Cancer, Microsatellite Instability – the Detection, the Relationship to the Pathophysiology and Prognosis
- Lactate Dehydrogenase – Old Tumour Marker in the Light of Current Knowledge and Preanalytic Conditions
- Application of PLA Method for Detection of p53/p63/p73 Complexes in Situ in Tumour Cells and Tumour Tissue
- The Importance of MicroRNA Deregulation in the Molecular Pathogenesis and Histological Transformation of Follicular Lymphoma
- Circulating Myeloid Suppressor Cells and Their Role in Tumour Immunology
- Can we Observe Ethnic Difference in Basic Blood Tests? Single-institution Data from Cancer Prevention Programme in the Czech Republic
- Zinc-modified Nanotransporter for Target Drug Therapy of Breast Cancer
- Fullerene Doxorubicin Nanotransporter for Target Interaction with mutated gene BRCA2
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Ascites May Provide Useful Information for Diagnosis of Ovarian Cancer
- Lactate Dehydrogenase – Old Tumour Marker in the Light of Current Knowledge and Preanalytic Conditions
- Molecular Pathology of Colorectal Cancer, Microsatellite Instability – the Detection, the Relationship to the Pathophysiology and Prognosis
- Circulating Myeloid Suppressor Cells and Their Role in Tumour Immunology