Imunoterapie v léčbě karcinomu plic
Immunotherapy in the Treatment of Lung Cancer
Background:
Lung cancer occupies the leading position of cancer incidence and mortality worldwide, including in the Czech Republic. Despite significant advances in systemic oncology treatments, lung cancer still has the worst prognosis, which is driving the need for innovative therapies and methods to treat this disease. Immunotherapy is a developing area of systemic oncology treatment, which has recently begun to be significantly applied to patients with lung carcinoma. The most useful type of immunotherapy currently employs checkpoint inhibitors, including CTLA-4 inhibitors (ipilimumab and tremelimumab) and PD-1/PD-L1 inhibitors (nivolumab, pembrolizumab, durvalumab, and avelumab). Except for monotherapy, different combinations of these inhibitors or combinations between one more of these inhibitors and chemotherapy or targeted treatment are being actively studied. Despite intensive investigations, anti-tumor vaccines and cytokines have not had an important impact on the treatment of lung cancer. Checkpoint inhibitors have yielded favorable results, especially for the treatment of advanced (i.e., stage IIIB and IV) non-small cell lung cancer (NSCLC) and are being extensively investigated for the treatment of SCLC.
Aim:
The aim of this review was to summarize the most important achievements, possibilities, and perspectives of modern immunotherapy for the treatment of patients with lung cancer.
Conclusion:
Immunotherapy is an important tool in today’s arsenal of oncology treatments, and for patients with lung cancer it offers the hope of prolonging life and img iprovints quality.
Key words:
immunotherapy – lung cancer – NSCLC – SCLC – checkpoint inhibitors
This work was supported by National Sustainability Programme I No. LO1503 provided by Ministry of education, youth and sports and program No. 17-30748A devided by The Ministry of Health of the Czech Republic.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted:
31. 8. 2017
Accepted:
7. 9. 2017
:
O. Fiala 1,2; O. Šorejs 1; M. Pešek 3; J. Fínek 1
:
Onkologická a radioterapeutická klinika LF UK a FN Plzeň
1; Biomedicínské centrum LF UK v Plzni
2; Klinika pneumologie a ftizeologie LF UK a FN Plzeň
3
:
Klin Onkol 2017; 30(Supplementum3): 22-31
:
Review
prolekare.web.journal.doi_sk:
https://doi.org/10.14735/amko20173S22
Východiska:
Karcinom plic zaujímá přední místa v incidenci i mortalitě nádorových onemocnění celosvětově, i v České republice. Přes významné pokroky v systémové onkologické léčbě dosažené v poslední době patří plicní karcinom mezi zhoubné nádory s nejhorší prognózou a potřeba hledání inovativních terapeutických prostředků a metod je zde stále velmi vysoká. Imunoterapie představuje dynamicky se rozvíjející oblast systémové onkologické léčby, která se v poslední době začíná významně uplatňovat i u pacientů s plicním karcinomem. Nejlépe využitelný typ imunoterapie v současné době představují checkpoint inhibitory, kam patří CTLA-4 inhibitory (ipilimumab a tremelimumab) a PD-1/PD-L1 inhibitory (nivolumab, pembrolizumab, durvalumab a avelumab). Mimo monoterapie jsou zkoumány i jejich různé kombinace nebo kombinace s chemoterapií nebo cílenou léčbou. Protinádorové vakcíny ani cytokiny nenalezly v léčbě plicního karcinomu větší význam, přesto, že zde byly zkoumány. Checkpoint inhibitory ukazují příznivé výsledky zejména v léčbě pacientů s pokročilým stadiem (stadium IIIB a IV) nemalobuněčného karcinomu plic (non-small cell lung carcinoma – NSCLC) a jsou intenzivně zkoumány i u pacientů s malobuněčným karcinomem plic (small cell lung carcinoma – SCLC).
Cíl:
Cílem této přehledové práce bylo sumarizovat nejvýznamnější dosažené poznatky o výsledcích, možnostech a perspektivách moderní imunoterapie v léčbě pacientů s karcinomem plic.
Závěr:
Imunoterapie představuje významný směr moderní onkologické léčby a pro pacienty s plicním karcinomem přináší naději na prodloužení života a zlepšení jeho kvality.
Klíčová slova:
imunoterapie – karcinom plic – NSCLC – SCLC – checkpoint inhibitory
Úvod
Karcinom plic zaujímá přední místa v incidenci i mortalitě nádorových onemocnění celosvětově, i v ČR. Incidence zde v roce 2014 činila 59,5 případů na 100 000 obyvatel. Nepříznivým faktem je, že karcinom plic je často diagnostikován v pokročilém stadiu, ve více než polovině případů ve IV. klinickém stadiu. Důsledkem toho je vysoká mortalita, která v roce 2014 činila 53 na 100 000 obyvatel [1]. Primární plicní karcinomy můžeme rozdělit na dvě základní skupiny, malobuněčný (small cell lung cancer – SCLC) a nemalobuněčný karcinom plic (non-small cell lung cancer – NSCLC). NSCLC je nejčastějším histologickým typem, který zaujímá zhruba 85 % všech plicních karcinomů. Přes nesporný pokrok v systémové onkologické léčbě v poslední době, patří plicní karcinom mezi zhoubné nádory s nejhorší prognózou, a tudíž potřeba hledání inovativních terapeutických prostředků a metod je vysoká. Významný rozvoj molekulární biologie a imunologie vedl k porozumění klíčovým procesům, které se uplatňují v regulaci imunitních reakcí na molekulární úrovni a zároveň porozumění některým mechanizmům úniku nádorových buněk imunitnímu sytému. Tento pokrok umožnil vznik nového směru systémové onkologické léčby, který je označovaný jako imunoterapie. Hlavním cílem imunoterapie v onkologii je překonat mechanizmy úniku nádorových buněk imunitního systému a stimulovat vlastní protinádorovou imunitní reakci na různých úrovních. Do imunitního systému je možné terapeuticky zasáhnout mnoha způsoby a v současné době se používá, nebo je zkoumána, řada preparátů založených na různém mechanizmu účinku. Obecně se tyto mechanizmy dají rozdělit na antigenně nespecifické a antigenně specifické. Mechanizmus antigenně nespecifické stimulace imunitního systému spočívá ve stimulaci základních funkcí imunity nezávisle na specificitě nádorového antigenu. Mezi takové metody patří zejména cytokiny a checkpoint inhibitory. Mechanizmus antigenně specifické stimulace imunitního systému spočívá ve stimulaci imunitní reakce cíleně proti specifickému nádorovému antigenu. Mezi takové metody patří zejména monoklonální protilátky, nádorové vakcíny a metody buněčné imunoterapie [2,3].
Oproti chemoterapii nebo radioterapii má imunoterapie, všeobecně, schopnost ničit nádorové buňky selektivně a nezávisle na jejich generačním cyklu. Populace nádorových buněk není ničena frakcionovaně, nýbrž může být eradikována absolutně, pokud není příliš početná [2–7]. Dalším specifikem imunoterapie je opožděný nástup účinku, neboť aktivace imunitního systému může trvat řádově týdny až měsíce. To znamená, že i nově vzniklé léze, které se během počáteční léčby objeví, mohou později regredovat. Tento aspekt byl impulzem k vytvoření nových kritérií pro hodnocení objektivní léčebné odpovědi (objective response rate – ORR) u pacientů léčených imunoterapií (immune-related Response Criteria – ir-RC) [8,9]. Překonání imunotolerance vůči nádoru může být provázeno nežádoucím porušením imunotolerance vůči „normálním tkáním“. Důsledkem toho je pak vznik nežádoucích účinků, které se svým charakterem blíží autoimunitním onemocněním (immune related adverse events – ir-AEs). Tyto jsou pro imunoterapii, do značné míry, specifické. Nejčastěji se zde můžeme setkat s kožní toxicitou, kolitidou, hepatotoxicitou a endokrinopatiemi [10].
Imunoterapie, jakožto léčebný princip v onkologii, je známá již delší dobu, nicméně v posledních letech zažívá zásadní renesanci a postupně nachází uplatnění v léčbě širokého spektra nádorových onemocnění, vč. NSCLC a nadějných výsledků dosahuje i u SCLC. Cílem této práce je sumarizovat nejvýznamnější poznatky na poli imunoterapie v léčbě plicního karcinomu. Fyziologie imunitních reakcí, stejně jako patofyziologické mechanizmy úniku nádorových buněk imunitě, jsou komplikované a protože je tato publikace zaměřena primárně na klinickou problematiku, jsou zde tyto informace podány velmi stručně a zjednodušeně.
Cytokiny
Cytokiny se významným způsobem podílejí na regulaci imunitní reakce na různých úrovních. Můžeme je rozdělit na několik základních skupin – interleukiny, chemokiny, lymfokiny, monokiny, růstové faktory a proapoptotické molekuly. Biologické účinky cytokinů jsou často pleiotropní, mohou vykazovat vzájemně aditivní synergistické účinky, nebo účinky antagonistické, mohou indukovat nebo potlačovat syntézu dalších cytokinů. Významnou limitaci léčebného využití cytokinů v protinádorové léčbě představuje relativně vysoká toxicita a nevýhodná farmakokinetika [2–7]. V léčbě plicního karcinomu byly nejčastěji zkoumány interleukin 2 a interferon α a γ. Přestože některé cytokiny byly hodnoceny v klinických studiích fáze II a III, jejich přínos nebyl potvrzen, a tak nenalezly významnějšího uplatnění v léčbě NSCLC ani v léčbě SCLC [11–15].
Checkpoint inhibitory
Imunitní reakce, vč. imunity protinádorové, podléhají složitému systému regulace. V imunoonkologii mají velký význam zejména inhibiční regulační mechanizmy, jejichž fyziologickým smyslem je bránit abnormální aktivaci imunitní reakce, která by mohla vést k autoimunitnímu poškození zdravých tkání organizmu. Molekulární podstatou těchto mechanizmů je exprese tzv. inhibičních molekul, tedy molekul, které brání aktivaci nebo inaktivují imunitní reakci. Takovéto kontrolní mechanizmy jsou označovány jako tzv. imunitní check-point. Nejlépe prozkoumané, a jako cíl protinádorové imunoterapie využívané, jsou inhibiční molekuly CTLA-4 (cyto-toxic T-lymphocyte antigen-4) a PD-1 (programmed death-1). V počátku imunitní reakce exprimují aktivované T lymfocyty (CD4+ i CD8+) zejména kostimulační molekuly CD28, ale po určité době trvání této aktivace začínají ve větší míře exprimovat inhibiční molekuly CTLA-4. Vazba mezi ligandy CD80/CD86 a CTLA-4 je mnohonásobně silnější než jejich vazba s kostimulační molekulou CD28, výsledným efektem je inhibice imunitní reakce. PD-1 je exprimován na aktivovaných T a B lymfocytech. V nádorovém mikroprostředí je aktivován vazbou ligandů PD-L1 a PD-L2, které mohou být exprimovány T a B lymfocyty, antigen prezentujícími buňkami (antigen presenting cells – APC), NK (natural killer) buňkami, ale i nádorovými buňkami. Důsledkem vazby ligandu na PD-1 na povrchu T lymfocytů je jejich inaktivace a indukce apoptózy. CTLA-4 se jako negativní regulátor imunity uplatňuje zejména v časné fázi aktivace T lymfocytů při jejich aktivaci APC (především na úrovni lymfatických uzlin), zatímco PD-1 se uplatňuje především v efektorové fázi inaktivací cytotoxických T lymfocytů (na periferii či v nádorovém mikroprostředí). Tyto inhibiční mechanizmy jsou z hlediska protinádorové imunity značně nevýhodné a nádorové buňky jich umí velmi dobře využít k úniku imunitnímu systému. Blokáda zmiňovaných kontrolních bodů imunitní reakce pomocí imunomodulačních monoklonálních protilátek, tzv. checkpoint inhibitorů, představuje efektivní způsob stimulace protinádorové imunitní reakce a je za tímto účelem v imunoterapii maligních nádorů hojně využívána. Monoklonální protilátky proti CTLA-4 a PD-1 nebo PD-L1 jsou intenzivně zkoumány a postupně nacházejí uplatnění v léčbě různých malignit, vč. plicního karcinomu [2–5, 16].
Anti-PD-1 a anti-PD-L1 monoklonální protilátky
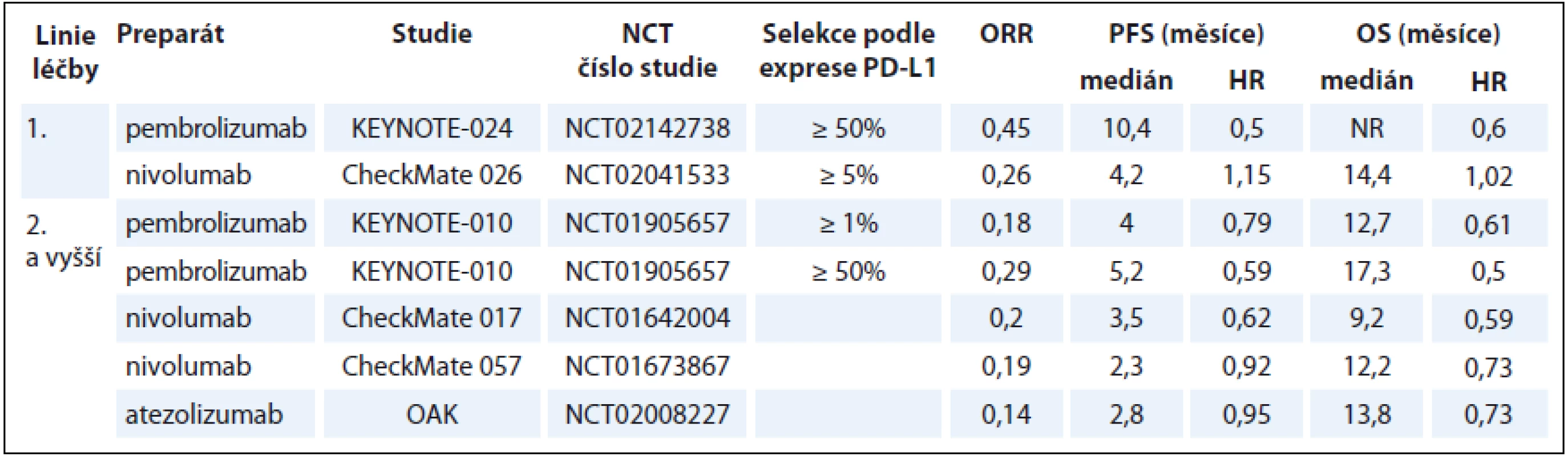
Nivolumab
Nivolumab je plně humanizovaná IgG4 monoklonální protilátka cílená na PD-1 receptor. Jeho protinádorový efekt spočívá v blokádě imunosupresivního efektu nádorových buněk na tumor specifické T lymfocyty. Důsledkem toho je zesílení a obnovení protinádorové imunitní reakce [17]. Efektivita a bezpečnost nivolumabu u pacientů s pokročilým NSCLC v 1. a 2. linii byly zkoumány v několika randomizovaných klinických studiích fáze III a data ze studie fáze I/II ukazují na slibný efekt nivolumabu rovněž u pacientů s SCLC po selhání chemoterapie. Při analýze významu exprese PD-L1 jako potenciálního biomarkeru účinnosti této terapie u NSCLC, byla prokázána větší účinnost u nádorů s vyšší expresí PD-L1. Prediktivní význam exprese PD-L1 je však zřejmě závislý na histologickém typu, byl prokázán u pacientů s nádory neskvamózního typu NSCLC. Stále je otazná optimální metodika stanovení a hodnota cut-off. Prediktivní a prognostický význam exprese PD-L1 u SCLC je zatím nejasný. Ve studii fáze III, CheckMate 017 (NCT01642004), byl nivolumab (3 mg/kg, q2w) srovnáván s docetaxelem (75 mg/m2, q3w) v léčbě 2. linie, po selhání standardní chemoterapie 1. linie založené na platinovém dubletu u 272 pacientů se skvamózním typem NSCLC metastatického stadia. Primárním cílem sledování bylo celkové přežití (overall survival – OS). Výsledky studie prokázaly významné prodloužení OS (9,2 vs. 6,0 měsíce, HR 0,59; p < 0,001) i přežití do progrese (progression-free survival – PFS) (3,5 vs. 2,8 měsíce, HR 0,62; p < 0,001) u pacientů léčených nivolumabem. Ročního přežití bylo dosaženo u 42 % pacientů léčených nivolumabel vs. u 24 % pacientů léčených docetaxelem. Poněkud překvapivým zjištěním bylo, že studie nepotvrdila prognostický ani prediktivní význam exprese PD-L1 v nádorové tkáni. Bezpečnostní profil nivolumabu byl lepší než u docetaxelu. Nežádoucí účinky stupně 3/4 byly popisovány u 7 % pacientů léčených nivolumabem [18]. V další studii fáze III, CheckMate 057 (NCT01673867), byl nivolumab (3 mg/kg, q2w) srovnáván s docetaxelem (75 mg/m2, q3w) v léčbě 582 pacientů s neskvamózním typem NSCLC metastatického stadia po selhání platinového dubletu 1. linie. Primárním cílem sledování bylo opět OS. Výsledky prokázaly významné prodloužení OS (12,2 vs. 9,4 měsíce, HR 0,73; p = 0,002) u pacientů léčených nivolumabem, ale nebyl prokázán statisticky signifikantní rozdíl v PFS (2,3 vs. 4,2 měsíce, HR 0,92; p = 0,39). Ročního přežití bylo dosaženo u 51 % pacientů léčených nivolumabem vs. 39 % u pacientů léčených docetaxelem. Ve studii byl prokázán prediktivní význam exprese PD-L1 v nádorové tkáni, u nádorů s expresí PD-L1 byl efekt léčby vyšší. Bezpečnostní profil nivolumabu byl příznivý, podobně jako ve studii CheckMate 017 [19]. Ve studii fáze III, CheckMate 026 (NCT02041533), byl nivolumab (3 mg/kg, q2w) v léčbě 1. linie srovnáván s chemoterapií založenou na platinovém dubletu (dle volby investigátora) u 541 pacientů s metastatickým NSCLC. Do studie byli vybíráni pacienti s nádory s prokázanou expresí PD-L1 (≥ 1 %). Primárním cílem sledování bylo PFS u pacientů s nádory s expresí PD-L1 ≥ 5%. U této sledované skupiny 423 pacientů studie neprokázala superioritu nivolumabu, co se týče PFS (4,2 vs. 5,9 měsíce, HR 1,15; p = 0,251) ani OS (14,4 vs. 13,2 měsíce, HR 1,02), ale prokázala příznivější profil toxicity nivolumabu (nežádoucí účinky stupně 3/4 – 17,6 vs. 50,6 %) [20]. Je třeba zde upozornit na některé aspekty, které měly zřejmě dopad na přežití pacientů v této studii. Ve skupině léčené nivolumabem byl menší podíl pacientů léčených následnou léčbou (40 vs. 60 %) a rovněž menší podíl pacientů s vysokou expresí PD-L1 (53,2 vs. 74,1 %) [20]. Poměrně vysoké množství pacientů v rameni s nivolumabem, kteří nemohli být léčeni následnou léčbou, reflektuje vysoce agresivní chování nádoru, s nímž se můžeme relativně častěji setkat u pacientů po selhání léčby anti-PD1/anti-PD-L1 inhibitory, v literatuře je tento jev označován jako tzv. hyperprogressive disease (HPD) [21]. Studie fáze I/II, CheckMate 032 (NCT01928394), hodnotila význam nivolumabu a ipilimumabu u podskupiny 216 pacientů s SCLC po selhání chemoterapie založené na kombinaci s platinovým derivátem. Pacienti byli rozděleni do několika skupin dle léčebného schématu, včetně různého dávkování – nivolumab (3 mg/kg, q2w), nivolumab + ipilimumab (1 mg/kg + 1 mg/kg, q3w), nivolumab + ipilimumab (1 mg/kg + 3 mg/kg, q3w), nivolumab + ipilimumab (3 mg/kg + 1 mg/kg, q3w). Nivolumab v monoterapii byl podáván do progrese nemoci, u kombinovaných režimů byly podávány čtyři cykly následované monoterapií nivolumabem (3 mg/kg, q2w) do progrese nemoci. Hlavním cílem sledování byla léčebná odpověď, které bylo dosaženo u 10 % pacientů léčených monoterapií nivolumabem, u 23 % pacientů léčených kombinací nivolumab + ipilimumab v dávce 1 mg/kg + 3 mg/kg a u 19 % pacientů léčených kombinací nivolumab + ipilimumab v dávce 3 mg/kg + 1 mg/kg (kombinací nivolumab + ipilimumab v dávce 1 mg/kg + 1 mg/kg byli léčeni pouze 3 pacienti). Nežádoucí účinky stupně 3/4 byly pozorovány u 13 % pacientů léčených monoterapií nivolumabem, u 30 % pacientů léčených kombinací nivolumab + ipilimumab v dávce 1 mg/kg + 3 mg/kg a u 19 % pacientů léčených kombinací nivolumab + ipilimumab v dávce 3 mg/kg + 1 mg/kg [22].
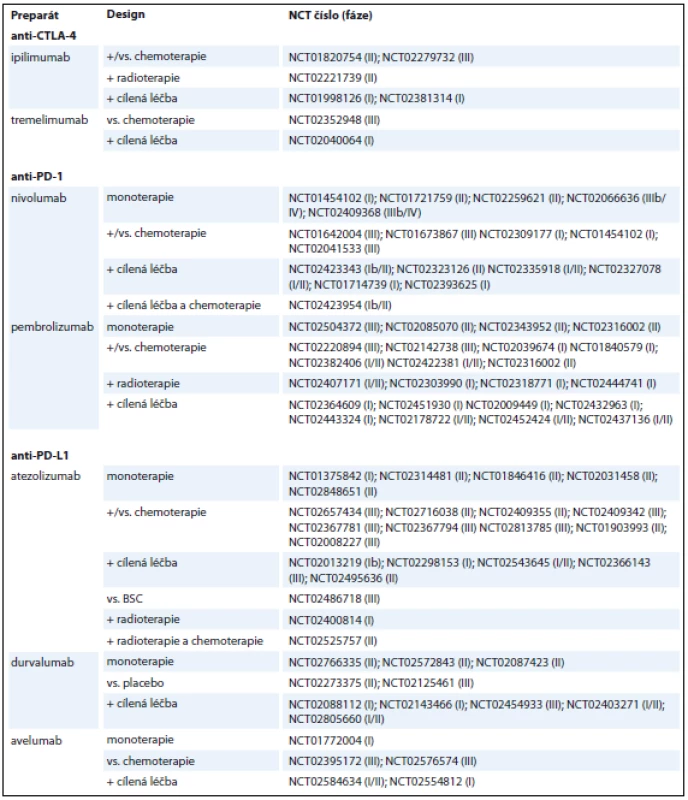
V současné době probíhá několik klinických studií fáze III hodnotících nivolumab v léčbě pokročilého NSCLC v 1. i dalších liniích ve srovnání se standardní chemoterapií (NCT02066636, NCT01642004, NCT01673867, NCT0204 1533) a dále probíhá studie fáze III, NCT02477826, která srovnává nivolu-mab, kombinaci ipilimumab + nivolumab, kombinaci nivolumabu a chemoterapie (platinový dublet) a samotnou chemoterapii v léčbě 1. linie pacientů s metastatickým NSCLC a studie CheckMate 451 (NCT02538666) s obdobným designem, zaměřená na pacienty s extenzivním stadiem (extensive disease – ED) SCLC [23–28]. Zajímavým a nadějným konceptem je kombinace nivolumabu s inhibitory tyrozinkináz u NSCLC se specifickými onkogenními mutacemi, který je zkoumán v některých probíhajících klinických studiích fáze I. Například studie NCT01998126 hodnotí význam kombinace nivolumab/ipilimumab + erlotinib u nádorů s mutací genu EGFR nebo s krizotinibem u nádorů s ALK translokací, studie NCT02393625 hodnotí význam kombinace nivolumab + ceritinib u nádorů s ALK translokací [29, 30].
Pembrolizumab
Pembrolizumab je humanizovaná IgG4 monoklonální protilátka cílená na PD-1 receptor. Princip jeho protinádorového efektu je tudíž obdobný jako u nivolumabu. Efektivita a bezpečnost pembrolizumabu v 1. i 2. linii léčby pacientů s pokročilým NSCLC byly zkoumány v několika randomizovaných klinických studiích fáze III. Výsledky studie fáze Ib, ukazují potenciální efektivitu pembrolizumabu v léčbě SCLC [31].
Ve studii fáze III, KEYNOTE-010 (NCT0 1905657), byl pembrolizumab hodnocen v léčbě 2. linie u 1 034 pacientů s pokročilým stadiem NSCLC s prokázanou expresí (≥ 1 %) PD-L1. Pacienti byli rozděleni do tří ramen, v poměru 1 : 1: 1, k léčbě pembrolizumabem v dávce 2 mg/kg (q3w), v dávce 10 mg/kg (q3w) a docetaxelem (75 mg/m², q3w). Primárním cílem bylo PFS a OS hodnocené v celkové populaci a v podskupině pacientů s nádory s expresí PD-L1 ≥ 50 %. Studie prokázala signifikantní prodloužení OS u pacientů léčených pembrolizumabem, delšího přežití ve srovnání s docetaxelem bylo dosaženo ve skupině léčené dávkou 2 mg/kg (10,4 vs. 8,5 měsíce, HR 0,71; p = 0,0008) i dávkou 10 mg/kg (12,7 vs. 8,5 měsíce, HR 0,61; p < 0,0001). V PFS nebyl prokázán významný rozdíl mezi pembrolizumabem v nižší nebo vyšší dávce a docetaxelem (3,9 vs. 4,0 vs. 4,0 měsíce, HR 0,88 a 0,79; p = 0,07 a p = 0,004). V podskupině pacientů s nádory s expresí PD-L1 ≥ 50 % bylo prokázáno signifikantně delší OS u pacientů léčených pembrolizumabem v nižší i vyšší dávce oproti kontrolní skupině (14,9 vs. 17,3 vs. 8,2 měsíce, HR 0,54 a 0,5; p = 0,0002 a p < 0,0001), rovněž zde bylo prokázáno signifikantně delší PFS u pacientů léčených pembrolizumabem nižší i vyšší dávkou oproti kontrolní skupině (5,0 vs. 5,2 vs. 4,1 měsíce, HR 0,59 a 0,59; p = 0,0001 a p < 0,0001).
Pembrolizumab zde prokázal i příznivější profil toxicity, a to jak v nižší, tak vyšší dávce, ve srovnání s docetaxelem (projevy toxicity stupně 3–5 – 13 vs. 16 vs. 35 %) [32]. V další studii fáze III, KEYNOTE-024 (NCT02142738), byl pembrolizumab (200 mg, q3w) srovnáván se standardním platinovým dubletem v léčbě 1. linie u pacientů s metastatickým NSCLC s prokázanou expresí PD-L1 ≥ 50 % bez aktivační mutace EGFR nebo ALK translokace. Primárním cílem sledování bylo PFS. Výsledky studie prokázaly významné prodloužení PFS (10,3 vs. 6,0 měsíce, HR 0,50; p < 0,001) i OS (HR 0,60; p = 0,005) u pacientů léčených pembrolizumabem. Bezpečnostní profil pembrolizumabu byl i zde příznivější než u chemoterapie (projevy toxicity stupně 3–5 – 26,6 vs. 53,3 %) [33]. Předběžná analýza probíhající studie fáze Ib, KEYNOTE-028 (NCT02054806), hodnotící možnosti využití pembrolizumabu u různých solidních nádorů s prokázanou expresí PD-L1 (≥ 1 %) ukazuje zajímavé výsledky u pacientů s extenzivním stadiem ED SCLC. Z 24 pacientů s ED SCLC předléčených chemoterapií byla zaznamenána léčebná odpověď u 29 %, u 33 % bylo dosaženo kontroly onemocnění, medián PFS činil 1,8 měsíce. Nebyla zjištěna korelace mezi léčebnou odpovědí a mírou exprese PD-L1. Toxicita stupně 3/4 byla pozorována u 8 % pacientů [31].
V současnosti probíhá několik klinických studií fáze III zaměřených na pembrolizumab v léčbě NSCLC a několik studií fáze I a II hodnotících pembrolizumab v léčbě SCLC. Například probíhající studie KEYNOTE-042 (NCT02220894) srovnává pembrolizumab s chemoterapií v 1. linii u pacientů s pokročilým NSCLC, studie KEYNOTE-091 (NCT02504372) hodnotí význam pembrolizumabu v adjuvantní léčbě u pacientů po radikální resekci NSCLC (s nebo bez adjuvantní chemoterapie), studie NCT02359019 je studie fáze II, která hodnotí význam pembrolizumabu v udržovací léčbě pacientů s ED SCLC po ukončení kombinované chemoterapie 1. linie [34–36].
Atezolizumab
Atezolizumab je plně humanizovaná IgG1 monoklonální protilátka cílená na PD-L1. Principem jeho protinádorového efektu je blokáda aktivace PD-1 imunitního checkpointu cestou inaktivace ligandu tohoto receptoru (PD-L1) [32]. Vysoká aktivita atezolizumabu byla pozorována zejména u nádorů s vysokou expresí PD-L1 a/nebo přítomností tumor infiltrujících lymfocytů (tumor-infiltrating lymphocytes – TIL). Atezolizumab prokázal příznivé výsledky v léčbě pacientů s pokročilým NSCLC po selhání 1. linie chemoterapie v klinické studii fáze II, které byly dále potvrzeny výsledky studie fáze III. Slibné výsledky léčby atezolizumabem v 1. linii ukázaly dvě klinické studie fáze II, které hodnotily atezolizumab v léčbě 1., 2. a dalších linií [37,38]. V současné době probíhá několik dalších klinických studií fáze III, které hodnotí význam atezolizumabu v 1. linii léčby pacientů s pokročilým NSCLC.
Studie fáze II, POPLAR (NCT01903993), zkoumala efektivitu a bezpečnost atezolizumabu u 287 pacientů s pokročilým stadiem (IIIB/IV) NSCLC po selhání chemoterapie založené na platinovém dubletu. Hodnocena byla neselektovaná populace pacientů, tedy byli zařazováni i pacienti s nádory neexprimujícími PD-L1. Atezolizumab (1200 mg, q3w) byl komparován s docetaxelem (75 mg/m², q3w). Primárním cílem sledování bylo OS. Ve studii bylo dosaženo signifikantní prodloužení OS (12,6 vs. 9,7 měsíce, HR 0,73; p = 0,04) u pacientů léčených atezolizumabem. Prodloužení přežití významně korelovalo s mírou exprese PD-L1, která tak i zde představuje významný prediktivní biomarker. Z atezolizumabu nejvíce profitovali pacienti s vysokou expresí PD-L1. Oproti tomu, u pacientů s nádory s nízkou nebo nedetekovanou expresí PD-L1 nebyl prokázán profit z této léčby a v obou ramenech bylo dosaženo shodného mediánu OS v délce 9,7 měsíce. Atezolizumab prokázal příznivý bezpečnostní profil [39]. V následné randomizované studii fáze III, OAK (NCT02008227), byl atezolizumab (1 200 mg, q3w) srovnáván s docetaxelem (75 mg/m², q3w) u 1225 pacientů s pokročilým stadiem (IIIB/IV) NSCLC po selhání jedné až dvou linií chemoterapie. I zde byli zařazováni pacienti bez ohledu na expresi PD-L1 v nádoru. Hlavním cílem bylo prodloužení OS. Výsledky studie prokázaly signifikantní prodloužení OS v celkové léčené populaci (13,8 vs. 9,6 měsíce, HR 0,73; p = 0,0003). Byl potvrzen prediktivní význam exprese PD-L1, kdy největšího benefitu z léčby atezolizumabem dosáhli pacienti s nádory s nejvyšší expresí PD-L1 (OS 20,5 vs. 8,9 měsíce, HR 0,41), na druhou stranu z léčby atezolizumabem profitovali i pacienti s nádory s nízkou nebo nedetekovanou expresí PD-L1 (OS 12,6 vs. 8,9 měsíce, HR 0,75). Prodloužení OS v rameni s atezolizumabem bylo srovnatelné u nádorů skvamózního i neskvamózního histologického typu (obojí – HR 0,73). Výsledky studie neprokázaly signifikantní rozdíl v PFS v celkové populaci (2,8 vs. 4,0 měsíce, HR 0,95; p = 0,49). Výsledků, které favorizují atezolizumab, bylo dosaženo pouze v podskupině pacientů s nádory s vysokou expresí PD-L1 (HR 0,63) [40].
V současnosti probíhá řada klinických studií fáze III, které hodnotí význam atezolizumabu v monoterapii i v kombinačních režimech v léčbě NSCLC. Například studie IMpower 110 (NCT02409342) srovnává atezolizumab s kombinací platinového derivátu s pemetrexedem nebo gemcitabinem v 1. linii, studie IMpower 132 (NCT02657434) hodnotí význam kombinace atezolizumabu s platinovým derivátem a pemetrexedem v 1. linii u nádorů neskvamózního histologického typu, studie IMpower 130 (NCT02367781) hodnotí význam kombinace atezolizumabu s karboplatinou a nab-paklitaxelem v 1. linii u nádorů neskvamózního histologického typu, studie IMpower 131 (NCT02367794) s podobným designem je zaměřena na skvamózní histologický typ, studie IMpower 150 (NCT02366143) hodnotí význam kombinace atezolizumabu s karboplatinou, paklitaxelem a bevacizumabem v 1. linii u nádorů neskvamózního histologického typu, studie IMpower 210 (NCT02813785) a IMpower 010 (NCT02486718) hodnotí význam atezolizumabu po selhání chemoterapie [41–46].
Avelumab
Avelumab je humánní IgG1 monoklonální protilátka cílená na PD-L1. Příznivé výsledky léčby avelumabem u podskupiny pacientů s pokročilým stadiem NSCLC po selhání chemoterapie přinesla klinická studie fáze Ib, JAVELIN Solid Tumor (NCT01772004). V této studii bylo 184 pacientů s pokročilým NSCLC léčeno avelumabem (10 mg/kg, q2w). ORR bylo dosaženo u 12 % pacientů, medián PFS činil 2,7 měsíce [47].
V současné době probíhá několik randomizovaných klinických studií fáze III hodnotících význam a bezpečnost avelumabu v 1. i dalších liniích léčby metastatického NSCLC. Studie JAVELIN Lung 100 (NCT02576574), srovnává avelumab s chemoterapií založenou na platinovém dubletu v 1. linii a studie JAVELIN Lung 200 (NCT02395172) srovnává avelumab s docetaxelem ve 2. linii [48,49].
Durvalumab
Durvalumab je další humánní IgG1 monoklonální protilátka cílená na PD-L1. Slibné výsledky léčby durvalumabem (10 mg/kg, q2w), u chemoterapií předléčených pacientů s pokročilým stadiem (IIIB/IV) NSCLC, ukazují recentní analýzy klinické studie fáze II, ATLANTIC (NCT02087423). Do této nerandomizované studie bylo zařazeno 333 pacientů s nádory bez mutací EGFR nebo ALK předléčení min. dvěma liniemi chemoterapie. Léčebné odpovědi bylo dosaženo u 30,9 % pacientů s nádory s expresí PD-L1 ≥ 90 %, u 16,4 % pacientů s nádory s expresí PD-L1 ≥ 25% a pouze u 7,5 % pacientů s nádory s nízkou nebo neprokázanou expresí PD-L1. Medián PFS činil 3,3 měsíce u pacientů s vysokou expresí PD-L1 a 1,9 měsíce u pacientů s nízkou nebo neprokázanou expresí PD-L1 v nádorové tkáni. Přesto, že jde o značně předléčené pacienty, byl durvalumab relativně dobře tolerován a léčba byla provázena přijatelnou mírou toxicity [50]. Definitivní výsledky studie zatím publikovány nebyly.
V současnosti probíhá několik randomizovaných klinických studií fáze III. Studie MYSTIC (NCT02453282) a NEPTUNE (NCT02542293) hodnotí význam durvalumabu v kombinaci s tremelimumabem v 1. linii a studie PACIFIC (NCT02125461) hodnotí význam udržovací léčby monoterapií durvalumabem u pacientů s neresekabilním NSCLC stadia III po konkomitantní chemoradioterapii [51–53].
Anti-CTLA-4 monoklonální protilátky
Ipilimumab
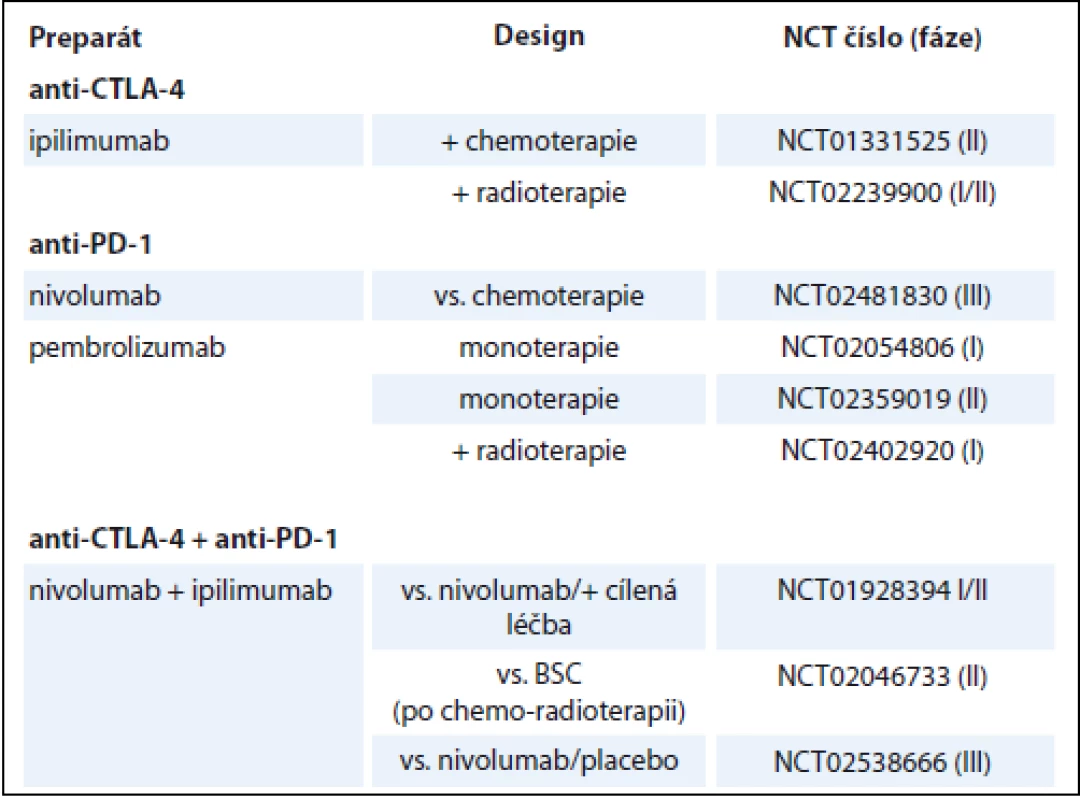
Ipilimumab je humanizovaná IgG1 monoklonální protilátka cílená na CTLA-4. Efektivita a bezpečnost ipilimumabu byly hodnoceny v randomizované studii fáze II, NCT00527735, v níž byl ipilimumab (10 mg/kg, q3w) kombinován s chemoterapií ve složení karboplatina + paklitaxel (AUC 6, 175 mg/m2, q3w) u nepředléčených pacientů s pokročilým NSCLC nebo SCLC. Pacienti byli randomizováni do tří ramen v poměru 1 : 1: 1. Ipilimumab byl komparován s placebem a kombinován s uvedenou chemoterapií v podobě – konkomitantní (4× ipilimumab + paklitaxel + karboplatina, dále 2× placebo + paklitaxel + karboplatina), fázované (2× placebo + paklitaxel + karboplatina, následně 4× ipilimumab + paklitaxel + karboplatina). Hlavním cílem sledování bylo irPFS [54]. U 204 pacientů s NSCLC bylo dosaženo signifikantního prodloužení irPFS v rameni s fázovaným podáním ipilimumabu oproti kontrolní skupině (5,7 vs. 4,6 měsíce, HR 0,72; p = 0,05), bylo zde zjištěno i prodloužení PFS (HR 0,69; p = 0,02). V rameni s konkomitantním režimem nebylo dosaženo signifikantního rozdílu v irPFS oproti kontrolní skupině (5,5 vs. 4,6 měsíce, HR 0,81; p = 0,13). Fázovaný ani konkomitantní režim nebyl spojen s prodloužením OS (HR 0,87; p = 0,23 a HR 0,99; p = 0,48). Incidence nežádoucích účinků stupně 3/4 činila 15 % u pacientů léčených fázovaným režimem a 20 % u pacientů léčených režimem konkomitantním [55]. U 130 pacientů s SCLC bylo dosaženo podobných výsledků, kdy signifikantního prodloužení irPFS bylo dosaženo v rameni s fázovaným režimem (6,4 vs. 5,3 měsíce, HR 0,64; p = 0,03). Fázovaný ani konkomitantní režim s ipilimumabem nebyl spojen s prodloužením PFS (HR 0,93; p = 0,37 a HR 0,93; p = 0,38) ani OS (HR 0,75; p = 0,13 a HR 0,95; p = 0,41). Incidence nežádoucích účinků stupně 3/4 činila 17 % u pacientů léčených fázovaným režimem a 21 % u pacientů léčených režimem konkomitantním [56]. V následné randomizované klinické studii fáze III, NCT01450761, byl význam ipilimumabu u nepředléčených pacientů s ED SCLC hodnocen v kombinaci se standartní chemoterapií 1. linie složení etoposid a platinový derivát (cisplatina nebo karboplatina). Do studie bylo zařazeno celkem 1 132 pacientů, kteří byli randomizováni v poměru 1 : 1. Ipilimumab (10 mg/kg, q3w) byl srovnáván s placebem, hlavním cílem sledování bylo OS. Výsledky neprokázaly prodloužení PFS (4,6 vs. 4,4 měsíce, HR 0,85) ani OS (11,0 vs. 10,9 měsíce, HR 0,94; p = 0,3775) u pacientů léčených kombinací s ipilimumabem [57].
Aktuálně probíhají klinické studie fáze III zaměřené na ipilimumab kombinovaný s chemoterapií, jinými checkpoint inhibitory a preparáty cílené léčby u pacientů s NSCLC i SCLC. Např. studie NCT02279732 hodnotící význam kombinace ipilimumabu a chemoterapie ve složení karbolpaptina + paklitaxel v 1. linii léčby pacientů se skvamózním histologickým typem NSCLC, studie hodnotící kombinaci s nivolumabem byly zmíněny v předchozím textu [58].
Tremelimumab
Tremelimumab je humanizovaná IgG2 monoklonální protilátka cílená na CTLA-4. Randomizovaná klinická studie fáze II, NCT00312975, hodnotila význam udržo-vací léčby tremelimumabem (15 mg/kg, q90d) u 87 pacientů s pokročilým stadiem (IIIB/IV) NSCLC, kteří neprogredovali na léčbě 1. linie chemoterapií platinovým dubletem. Výsledky studie neprokázaly významné prodloužení PFS, léčebné odpovědi bylo dosaženo u 4,8 % pacientů [59].
V současné době probíhající klinické studie fáze III, které hodnotí tremelimumab v kombinaci s durvalumabem u pacientů s pokročilým NSCLC, byly zmíněny v předchozím textu.
Protinádorové vakcíny
Základní princip účinku protinádorových vakcín spočívá v indukci specifické imunitní reakce proti nádoru podáním různě upravených antigenů přítomných na nádorových buňkách, většinou v kombinaci s imunostimulačním adjuvans, které má zvýšit schopnost antigenu stimulovat imunitní systém. V minulosti bylo zkoumáno mnoho typů protinádorových vakcín u různých zhoubných nádorů. Ve většině případů se však tento způsob imunoterapie nesetkal s velkým úspěchem. U pacientů s karcinomem plic byly v minulosti testovány různé protinádorové vakcíny, v rámci adjuvantní léčby, u pacientů s časným stadiem a rovněž v rámci paliativní léčby u pacientů s pokročilým stadiem NSCLC i SCLC. Bohužel, doposud provedené klinické studie nevedly k výraznému úspěchu a imunoterapie pomocí protinádorových vakcín není v současné době užívána v klinické praxi. Z neúspěšných randomizovaných klinických studií fáze III u NSCLC lze uvést např. MAGRIT, START a STOP [60–62]. V léčbě SCLC byly bez většího úspěch testovány např. vakcíny obsahující kyselinu polysialovou (polySA) nebo Bec2 [63–65].
Ve studii MAGRIT byl hodnocen význam vakcíny, která se skládá z rekombinantního proteinu MAGE-A3 (melanomaspecific antigen A3) a imunostimulačního adjuvans u 2 270 pacientů po radikální resekci NSCLC stadia IB, II a IIIA (s nebo bez léčby adjuvantní chemoterapií), kteří měli nádor vykazující expresi MAGE-A3. Pacienti byli randomizováni v poměru 2 : 1 (vakcína: placebo). Studie nesplnila primární cíl, kterým bylo přežití bez recidivy (disease free survival – DFS) (60,5 vs. 57,9 měsíce, HR 1,02; p = 0,74) [60]. Studie START hodnotila význam lipoproteinové vakcíny tecemotide, která indukuje imunitní odpověď na nádorové buňky exprimující MUC1 (mucinous glycoprotein-1) antigen u 1 514 pacientů s neresekabilním NSCLC stadia III, po konkomitantní či sekvenční chemoradioterapii. Studie neprokázala signifikantní zlepšení OS v celkové populaci (25,6 vs. 22,3 měsíce, HR 0,88; p = 0,123), ale v podskupině pacientů léčených konkomitantní chemoradioterapií byl prokázán statisticky signifikantní rozdíl v OS (30,8 vs. 20,6 měsíce, HR 0,78; p = 0,016) [61]. Ve studii STOP byl zkoumán význam podání vakcíny belagenpumatucel-L u 532 pacientů s pokročilým stadiem NSCLC (st. III/IV), kteří neprogredovali během 1. linie chemoterapie založené na platinovém dubletu. Výsledky studie neprokázaly významné prodloužení OS (20,3 vs. 17,8 měsíce, HR 0,94; p = 0,594) ani PFS (4,3 vs. 4,0 měsíce, HR 0,99; p = 0,947) [62]. Studie EORTC 08971 hodnotila význam léčby vakcínou Bec2 u 515 pacientů s limitovaným stadiem (limited desease – LD) SCLC po léčbě chemoterapií a radioterapií. Výsledky studie neprokázaly významné prodloužení PFS (6,3 vs. 5,7 měsíce, HR 1,11; p = 0,2995) ani OS (16,4 vs. 14,3 měsíce, HR 1,12; p = 0,2834) [65].
Závěr
Imunoterapie představuje dynamicky se rozvíjející oblast systémové onkologické léčby a v poslední době se začíná významně uplatňovat v léčbě pacientů s plicním karcinomem. Nejlépe využitelný typ imunoterapie v současné době představují checkpoint inhibitory, které ukazují příznivé výsledky zejména v léčbě pacientů s pokročilým stadiem NSCLC a jsou intenzivně zkoumány i u pacientů s SCLC. Imunoterapie je většinou využívána a zkoumána u pokročilých stadií onemocnění, ale její potenciální využití v budoucnu lze spatřovat i v léčbě časných stadií, v rámci adjuvantní systémové léčby.
V léčbě pacientů s pokročilým stadiem NSCLC se úspěšně etablovaly zatím dva anti-PD-1 checkpoint inhibitory, nivolumab a pembrolizumab. Další checkpoint inhibitory jako jsou atezolizumab, avelumab, durvalumab, ipilimumab a tremelimumab jsou v současné době předmětem řady klinických studií, jejichž výsledky jsou mnohdy netrpělivě očekávány. Přehled výsledků nejvýznamnějších klinických studií fáze III u pacientů s pokročilým stadiem NSCLC je uveden v tab. 1, přehled aktuálně probíhajících klinických studií sumarizuje tab. 2 (NSCLC) a tab. 3 (SCLC). Zajímavým tématem je otázka využitelnosti a spolehlivosti prediktivních biomarkerů, které by bylo možné využít k selekci vhodných pacientů pro tuto léčbu. Hlavní diskutovaný prediktivní biomarker zde představuje exprese PD-L1. V léčbě pacientů s pokročilým SCLC jsou checkpoint inhibitory intenzivně zkoumány a slibné výsledky některých studií nasvědčují tomu, že snad i zde v budoucnu naleznou tyto preparáty své místo. Nadějnou oblast imunoterapie představují různé kombinace checkpoint inhibitorů s jinými checkpoint inhibitory, chemoterapií nebo cílenou léčbou. Různé kombinační režimy jsou zatím zkoumány v řadě klinických studií. Zdá se, že některé takové režimy by mohly vést ke zlepšení efektu terapie, za cenu akceptabilní toxicity. Zajímavé budou jistě i výsledky studií, kde je hodnocen význam kombinace checkpoint inhibitorů s cílenými preparáty u pacientů s pokročilým NSCLC s mutací genu EGFR nebo ALK translokací.

Závěrem můžeme konstatovat, že rozvoj imunoterapie v poslední době významně přispívá ke zlepšení výsledků systémové léčby zejména pacientů s pokročilým stadiem NSCLC a přináší snad i naději na zlepšení situace v léčbě SCLC.
Práce byla financována z Národního programu udržitelnosti I (NPU I) č. LO1503 poskytovaného Ministerstvem školství, mládeže a tělovýchovy a grantového projektu 17-30748A poskytovaného Ministerstvem zdravotnictví ČR.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Ondřej Fiala, Ph.D.
Onkologická a radioterapeutická klinika LF UK a
FN Plzeň
Alej Svobody 80
30100 Plzeň
e-mail: fiala.o@centrum.cz
Obdrženo: 31. 8. 2017
Přijato: 7. 9. 2017
Sources
1. Svod.cz. [online] Český národní webový portál epidemiologie nádorů. Masarykova univerzita, Česká republika. Dostupné na: http: //www.svod.cz.
2. Klener P, Klener P jr. Nová protinádorová léčiva a léčebné strategie v onkologii. 1. vyd. Praha: Grada Publishing 2010; 209.
3. Bartůňková J, Podrazil M, Špíšek R. Imunoterapie v léčbě nádorových onemocnění. Remedia 2015; 25 (1): 34–38.
4. Otáhal P, Trněný M. Současné možnosti imunoterapie nádorových onemocnění. Klin onkol 2015; 28 (Suppl 3): 105–111.
5. Domingues D, Turner A, Silva M et al. Immunotherapy and lung cancer: current developments and novel targeted therapies. Immunotherapy 2014; 6 (11): 1221–1235.
6. Bansal P, Osman D, Gan D et al. Recent Advances in Immunotherapy in Metastatic NSCLC. Front Oncol 2016; 6 : 239. doi: 10.3389/fonc.2016.00239.
7. Mountzios G, Linardou H, Kosmidis P. Immunotherapy in non-small cell lung cancer: the clinical impact of immune response and targeting. Ann Transl Med 2016; 4 (14): 268. doi: 10.21037/atm.2016.06.24.
8. Wolchock J D, Hoos A., O’day S et al. Guidelines for the evaluation of immune therapy activity in solid tumors: immune-related response criteria. Clin Cancer Res 2009; 15 (23): 7412–7420. doi: 10.1158/1078-0432.CCR-09-1624.
9. Klener P, Šťastný M. Posuzování léčebné odpovědi u zhoubných nádorů a potřeba úpravy kritérií pro hodnocení účinnosti imunoterapie. Remedia 2010; 20 (5): 332–336.
10. Lakomý R, Poprach A. Nežádoucí účinky moderní imunoterapie a jejich řešení v klinické praxi. Klin Onkol 2015; 28 (Suppl 4): 103–114.
11. Correale P, Tindara Miano S, Remondo C et al. Secondline treatment of non small cell lung cancer by biweekly gemcitabine and docetaxel +/-granulocyte-macrophage colony stimulating factor and low dose aldesleukine. Cancer Biol Ther 2009; 8 (6): 497–502. doi: 10.4161/cbt.8.6.7593.
12. Ridolfi L, Bertetto O, Santo A et al. Chemotherapy with or without low-dose interleukin-2 in advanced non-small cell lung cancer: results from a phase III randomized multicentric trial. Int J Oncol 2011; 39 (4): 1011–1017. doi: 10.3892/ijo.2011.1099.
13. Lissoni P, Brivio F, Fumagalli L et al. Neuroimmunomodulation in medical oncology: application of psychoneuroimmunology with subcutaneous low-dose IL-2 and the pineal hormone melatonin in patients with untreatable metastatic solid tumors. Anticancer Res 2008; 28 (2B): 1377–1381.
14. Pillai RN, Aisner J, Dahlberg SE et al. Interferon alpha plus 13-cis-retinoic acid modulation of BCL-2 plus paclitaxel for recurrent small-cell lung cancer (SCLC): An Eastern Cooperative Oncology Group study (E6501). Cancer Chemother Pharmacol 2014; 74 (1): 177–183. doi: 10.1007/s00280-014-2427-7.
15. Zarogoulidis K, Ziogas E, Boutsikou E et al. Immunomodifiers in combination with conventional chemotherapy in small cell lung cancer: Aphase II, randomized study. Drug Des Devel Ther 2013; 7 : 611–617. doi: 10.2147/DDDT.S43184.
16. Schvartsman G, Ferrarotto R, Massarelli E. Checkpoint inhibitors in lung cancer: latest developments and clinical potential. Ther Adv Med Oncol 2016; 8 (6): 460–473. doi: 10.1177/1758834016661164.
17. Deel A. Nivolumab in metastatic non-small cell lung cancer. J Adv Pract Oncol 2016; 7 (2): 220–225.
18. Brahmer J, Reckamp K, L, Baas P et al. Nivolumab versus docetaxel in advanced squamous-cell non-small-cell lung cancer. N Engl J Med 2015; 373 (2): 123–135. doi: 10.1056/NEJMoa1504627.
19. Borghaei H, Paz-Ares L, Horn L et al. Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer. N Engl J Med 2015; 373 (17): 1627–1639. doi: 10.1056/NEJMoa1507643.
20. Carbone DP, Reck M, Paz-Ares L et al. First-line Nivolumab in stage IV or recurrent non-small-cell lung cancer. N Engl J Med 2017; 376 (25): 2415–2426. 10.1056/NEJMoa1613493.
21. Champiat S, Dercle L, Ammari S et al. Hyperprogressive disease is a new pattern of progression in cancer patients treated by anti-PD-1/PD-L1. Clin Cancer Res 2017; 23 (8): 1920–1928. doi: 10.1158/1078-0432.CCR-16-1741.
22. Antonia S J, López-Martin J A, Bendell J et al. Nivolumab alone and Nivolumab plus Ipilimumab in recurrent small-cell lung cancer (checkmate 032): a multicentre, open-label, phase 1/2 trial. Lancet Oncol 2016; 17 (7): 883–895. doi: 10.1016/S1470-2045 (16) 30098-5.
23. A Safety Trial of Nivolumab in Patients With Advanced or Metastatic Non-Small Cell Lung Cancer Who Have Progressed During or After Receiving At Least One Prior Chemotherapy Regimen (CheckMate153). Cinicaltrials.cz. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT02066636.
24. Study of BMS-936558 (Nivolumab) Compared to Docetaxel in Previously Treated Advanced or Metastatic Squamous Cell Non-small Cell Lung Cancer (NSCLC) (CheckMate 017). Cinicaltrials.cz. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT01642004.
25. Study of BMS-936558 (Nivolumab) Compared to Docetaxel in Previously Treated Metastatic Non-squamous NSCLC (CheckMate057). Cinicaltrials.cz. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT01673867.
26. An Open-Label, Randomized, Phase 3 Trial of Nivolumab Versus Investigator’s Choice Chemotherapy as First-Line Therapy for Stage IV or Recurrent PD-L1+ Non-Small Cell Lung Cancer (CheckMate 026). Cinicaltrials.cz. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT02041533.
27. An Investigational Immuno-therapy Trial of Nivolumab, or Nivolumab Plus Ipilimumab, or Nivolumab Plus Platinum-doublet Chemotherapy, Compared to Platinum Doublet Chemotherapy in Patients With Stage IV Non-Small Cell Lung Cancer (NSCLC) (CheckMate 227). Cinicaltrials.cz. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT02477826.
28. An Investigational Immuno-therapy Study of Nivolumab, or Nivolumab in Combination With Ipilimumab, or Placebo in Patients With Extensive-Stage Disease Small Cell Lung Cancer (ED-SCLC) After Completion of Platinum-based Chemotherapy (CheckMate 451). Cinicaltrials.cz. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT02538666.
29. Combination Checkpoint Inhibitor Plus Erlotinib or Crizotinib for EGFR or ALK Mutated Stage IV Non-small Cell Lung Cancer. Cinicaltrials.cz. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT01998126.
30. Study of Safety and Efficacy of Ceritinib in Combination With Nivolumab in Patients With ALK-positive Non-small Cell Lung Cancer. Cinicaltrials.cz. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT02393625.
31. Ott PA, Elez E, Hiret S et al. Pembrolizumab for extensive stage SCLC: Efficacy and relationship with PD-L1 expression. Presented at: 16th World Conference on Lung Cancer. Denver, September 6–9 2015: abstract 3285.
32. Vachhani P, Chen H. Spotlight on Pembrolizumab in non-small cell lung cancer: the evidence to date. Onco Targets Ther 2016; 9 : 5855–5866. doi: 10.2147/OTT.S97746.
33. Reck M, Rodríguez-Abreu D, Robinson A G et al. Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer. N Engl J Med 2016; 375 (19): 1823–1833. doi: 10.1056/NEJMoa1606774.
34. Study of MK-3475 (Pembrolizumab) Versus Platinum-based Chemotherapy for Participants With PD-L1-positive Advanced or Metastatic Non-small Cell Lung Cancer (MK-3475-042/KEYNOTE-042). Cinicaltrials.cz. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT02220894.
35. Study of Pembrolizumab (MK-3475) vs Placebo for Participants With Non-small Cell Lung Cancer After Resection With or Without Standard Adjuvant Therapy (MK-3475-091/KEYNOTE-091) (PEARLS). Cinicaltrials.cz. [online]. Available from: https: //clinicaltrials.gov/ct2/ show/NCT02504372.
36. Pembrolizumab in Treating Patients With Extensive Stage Small Cell Lung Cancer After Completion of Combination Chemotherapy. Cinicaltrials.cz. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT02359019.
37. Wakelee H, Patel JD, Heist R et al. ORAL01.04: Phase II Trial of Atezolizumab for Patients with PD-L1-Selected Advanced NSCLC (BIRCH): Updated Efficacy and Exploratory Biomarker Results: Topic: Medical Oncology. J Thorac Oncol 2016; 11 (Suppl 11): 251–252. doi: 10.1016/j.jtho.2016.09.009.
38. Spigel DR, Chaft JE, Gettinger SC et al. Clinical activity and safety from a phase II study (FIR) of MPDL3280A (anti-PDL1) in PD-L1 selected patients with non-small-cell lung cancer (NSCLC). J Clin Oncol 2015; 33 (Suppl 15): 8028. doi: 0.1200/jco.2015.33.
39. Fehrenbacher L, Spira A, Ballinger M et al. Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (poplar): a multicentre, open-label, phase 2 randomised controlled trial. Lancet 2016; 387 (10030): 1837–1846. doi: 10.1016/S0140-6736 (16) 00587-0.
40. Rittmeyer A, Barlesi F, Waterkamp D et al. Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer (OAK): a phase 3, open-label, multicentre randomised controlled trial. Lancet 2017; 389 (10066): 255–265. doi: 10.1016/S0140-6736 (16) 32 517-X.
41. A Study of Atezolizumab (MPDL3280A) Compared With a Platinum Agent (Cisplatin or Carboplatin) + (Pemetrexed or Gemcitabine) in Participants With Stage IV Non-Squamous or Squamous Non-Small Cell Lung Cancer (NSCLC) [IMpower110]. Cinicaltrials.cz. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT02409342.
42. A Study of Atezolizumab in Combination With Carboplatin or Cisplatin + Pemetrexed Compared With Carboplatin or Cisplatin + Pemetrexed in Participants Who Are Chemotherapy-Naive and Have Stage IV Non-Squamous Non-Small Cell Lung Cancer (NSCLC) (IMpower 132). Cinicaltrials.cz. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT02657434.
43. A Study of Atezolizumab (Anti-Programmed Death-Ligand 1 [PD-L1] Antibody) in Combination With Carboplatin Plus (+) Nab-Paclitaxel Compared With Carboplatin + Nab-Paclitaxel in Participants With Non-Squamous Non-Small Cell Lung Cancer (NSCLC) (IMpower130). Cinicaltrials.cz. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT02367781.
44. A Study of Atezolizumab in Combination With Carboplatin + Paclitaxel or Carboplatin + Nab-Paclitaxel Compared With Carboplatin + Nab-Paclitaxel in Participants With Stage IV Squamous Non-Small Cell Lung Cancer (NSCLC) [IMpower131]. Cinicaltrials.cz. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT02367794.
45. A Study of Atezolizumab (Anti-Programmed Death-Ligand 1 [PD-L1] Antibody) in Combination With Carboplatin Plus (+) Paclitaxel With or Without Bevacizumab Compared With Carboplatin+Paclitaxel+Bevacizumab in Participants With Stage IV Non-Squamous Non-Small Cell Lung Cancer (NSCLC) (IMpower150). Cinicaltrials.cz. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT02366143.
46. A Study of Atezolizumab Compared With Docetaxel in Non-Small Cell Lung Cancer (NSCLC) After Failure With Platinum-Containing Chemotherapy (IMpower210). Cinicaltrials.cz. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT02813785.
47. Gulley J L, Rajan A, Spigel D R et al. Avelumab for patients with previously treated metastatic or recurrent non-small-cell lung cancer (javelin solid tumor): dose-expansion cohort of a multicentre, open-label, phase 1b trial. Lancet Oncol 2017; 18 (5): 599–610. doi: 10.1016/S1470-2045 (17) 30240-1.
48. Avelumab in First-line Non-Small Cell Lung Cancer (JAVELIN Lung 100). Cinicaltrials.cz. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT02576574.
49. Avelumab in Non-Small Cell Lung Cancer (JAVELIN Lung 200). Cinicaltrials.cz. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT02395172.
50. Garassino MC, Vansteenkiste J F, Kim J et al. Durvalumab in ≥ 3rd-line locally advanced or metastatic, EGFR/alk wild-type NSCLC: results from the phase 2 atlantic study. J Thorac Oncol 2017; 12 (Suppl 1): 10–11. doi: 10.1016/j.jtho.2016.11.012.
51. Phase III Open Label First Line Therapy Study of MEDI 4736 (Durvalumab) With or Without Tremelimumab Versus SOC in Non Small-Cell Lung Cancer (NSCLC). (MYSTIC). Cinicaltrials.cz. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT02453282.
52. Study of 1st Line Therapy Study of Durvalumab With Tremelimumab Versus SoC in Non Small-Cell Lung Cancer (NSCLC) (NEPTUNE). (NEPTUNE). Cinicaltrials.cz. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT02542293.
53. A Global Study to Assess the Effects of MEDI4736 Following Concurrent Chemoradiation in Patients With Stage III Unresectable Non-Small Cell Lung Cancer (PACIFIC). Cinicaltrials.cz. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT02125461.
54. Phase II Study for Previously Untreated Subjects With Non Small Cell Lung Cancer (NSCLC) or Small Cell Lung Cancer (SCLC). Cinicaltrials.cz. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT00527735.
55. Lynch T J, Bondarenko I, Luft A et al. Ipilimumab in combination with Paclitaxel and Carboplatin as first-line treatment in stage IIIb/IV non-small-cell lung cancer: results from a randomized, double-blind, multicenter phase II study. J Clin Oncol 2012; 30 (17): 2046–2054. doi: 10.1200/JCO.2011.38.4032.
56. Reck M, Bondarenko I, Luft A et al. Ipilimumab in combination with Paclitaxel and Carboplatin as first-line therapy in extensive-disease-small-cell lung cancer: results from a randomized, double-blind, multicenter phase 2 trial. Ann Oncol 2013; 24 (1): 75–83. doi: 10.1093/annonc/mds213.
57. Reck M, Luft A, Szczesna A et al. Phase III randomized trial of Ipilimumab plus Etoposide and Platinum versus placebo plus Etoposide and Platinum in extensive-stage small-cell lung cancer. J Clin Oncol 2016; pii: JCO676601. doi: 10.1200/JCO.2016.67.6601.
58. Cinicaltrials.cz. Phase 3 Trial in Squamous Non Small Cell Lung Cancer Subjects Comparing Ipilimumab Plus Paclitaxel and Carboplatin Versus Placebo Plus Paclitaxel and Carboplatin. [online] [last update posted: September 8, 2017]. Available from: https: //clinicaltrials.gov/ct2/show/NCT02279732.
59. Zatloukal P, Heo D S, Park K et al. Randomized phase II clinical trial comparing tremelimumab (CP-675,206) with best supportive care (BSC) following first-line platinum-based therapy in patients (pts) with advanced non-small cell lung cancer (NSCLC). J Clin Oncol 2009; 27 (Suppl 15): 8071–8071. doi: 10.1200/jco.2009.27.15s.8071.
60. Vansteekiste JF, Cho BC, Vanakesa T et al. Efficacy of the MAGE-A3 cancer immunotherapeutic as adjuvant therapy in patients with resected MAGE-A3-positive non-small-cell lung cancer (MAGRIT): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2016; 17 (6): 822–835. doi: 10.1016/S1470-2045 (16) 000 99-1.
61. Butts C, Socinski MA, Mitchell P et al. Tecemotide (L-BLP25) versus placebo after chemoradiotherapy for stage III non-small-cell lung cancer (START): a randomised, double-blind, phase 3 trial. Lancet Oncol 2014; 15 (1): 59–68. doi: 10.1016/S1470-2045 (13) 70510-2.
62. Giaccone G, Bazhenova LA, Nemunaitis J et al. A phase III study of belagenpumatucel-L, an allogeneic tumour cell vaccine, as maintenance therapy for non-small cell lung cancer. Eur J Cancer 2015; 51 (16): 2321–2329. doi: 10.1016/j.ejca.2015.07.035.
63. Krug LM, Ragupathi G, Ng KK et al. Vaccination of small cell lung cancer patients with polysialic acid or N-propionylated polysialic acid conjugated to keyhole limpet hemocyanin. Clin Cancer Res 2004; 10 (3): 916–923.
64. Krug LM, Ragupathi G, Hood C et al. Immunization with N-propionyl polysialic acid-KLH conjugatein patients with small cell lung cancer is safeand induces IgM antibodies reactive with SCLC cells and bactericidal against group B meningococci. Cancer Immunol Immunother 2012; 61 (1): 9–18. doi: 10.1007/s00262-011-1083-6.
65. Giaccone G, Debruyne C, Felip E et al. Phase III study of adjuvant vaccination with Bec2/bacille Calmette-Guerin in responding patients with limited-disease small-cell lung cancer (European Organisation for Research and Treatment of Cancer 08971-08971B; Silva Study). J Clin Oncol 2005; 23 (28): 6854–6864. doi: 10.1200/ JCO.2005.17.186.
Labels
Paediatric clinical oncology Surgery Clinical oncology Pneumology and ftiseologyArticle was published in
Clinical Oncology

2017 Issue Supplementum3
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Safety and Tolerance of Metamizole in Postoperative Analgesia in Children
-
All articles in this issue
- Immunotherapy for Bladder Cancer
- Evaluation of Inflammatory Cells (Tumor Infiltrating Lymphocytes) in Solid Tumors
- Imunoterapie v léčbě karcinomu plic
- Comparison of RECIST 1.1 and iRECIST for Response Evaluation in Solid Tumours
- Advances in Immunotherapy of Malignant Melanoma
- Combined Regimens in Immunotherapy
- Checkpoint Inhibitors in the Treatment of Upper Gastrointestinal Tract Tumors
- Immunotherapy of Renal Cell Carcinoma
- Immunotherapy of Colorectal and Anal Carcinoma
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Evaluation of Inflammatory Cells (Tumor Infiltrating Lymphocytes) in Solid Tumors
- Comparison of RECIST 1.1 and iRECIST for Response Evaluation in Solid Tumours
- Immunotherapy of Colorectal and Anal Carcinoma
- Imunoterapie v léčbě karcinomu plic
