Souhrnné srovnání kritérií RECIST 1.1 a iRECIST pro hodnocení odpovědi na onkologickou léčbu solidních tumorů
Comparison of RECIST 1.1 and iRECIST for Response Evaluation in Solid Tumours
Background:
Immunotherapy is a relatively new and developing modality in oncological treatment, which may significantly improve treatment results for some patients with malignant tumors. With the increasing number of clinical trials, the demand for a suitable tool to assess and compare treatment responses is growing. Currently, the most common response assessment system for solid tumors is RECIST (response Evaluation Criteria in Solid Tumors) version 1.1. However, in immuno-oncology, a small percentage of patients manifest a new response pattern termed pseudoprogression, in which, after the initial increase in tumor burden or after the discovery of new lesions, a response or at least a prolonged stabilization of the disease can occur. This patient group would be included in the progression category when using RECIST 1.1 and effective treatment would be discontinued. Therefore, iRECIST criteria were established to capture the phenomenon of pseudoprogression, the need for PD confirmation (according to RECIST 1.1) was introduced, and changes were made in the evaluation of new lesions.
Aim:
The present work introduces criteria for the evaluation of oncological responses in solid tumors using RECIST version 1.1 and iRECIST immunotherapy variant (including a brief overview of previous immune criteria). These criteria are compared in an immuno-oncological context and their potential pitfalls are discussed.
Conclusion:
iRECIST criteria were established by expert consensus; however, sufficient data for final validation has not yet been collected. As a result, RECIST 1.1 should be the primary assessment system in immuno-oncology. The use of iRECIST should be reserved for research purposes (testing and validation). Distinguishing pseudoprogression from true PD in patients treated with immunotherapy remains a major challenge in oncological imaging.
Key words:
RECIST – response criteria – immunotherapy – measurement – tumor burden
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted:
24. 9. 2017
Accepted:
3. 10. 2017
:
Š. Houdek 1; T. Büchler 2; E. Kindlová 3
:
Radiodia gnostické oddělení, Nemocnice Na Homolce, Praha
1; Onkologická klinika 1. LF UK a Thomayerova nemocnice, Praha
2; Radioterapeutická a onkologická klinika 3. LF UK a FN Královské Vinohrady, Praha
3
:
Klin Onkol 2017; 30(Supplementum3): 32-39
:
Review
prolekare.web.journal.doi_sk:
https://doi.org/10.14735/amko20173S32
Východiska:
Imunitní terapie je poměrně mladou a dynamicky se rozvíjející modalitou onkologické léčby, která u některých tumorů prokazatelně zlepšuje výsledky léčby. Se zvyšujícím se počtem klinických studií stoupá poptávka po vhodném nástroji umožňujícím hodnotit a porovnávat léčebnou odpověď. V současnosti nejpoužívanější odpověď hodnotící systém pro solidní tumory je RECIST (Response Evaluation Criteria in Solid Tumours) verze 1.1. Jeho aplikace v imunoonkologii však u nevelkého procenta pacientů přináší nový vzor odpovědi nazývaný pseudoprogrese, kdy po prvotním zvětšení tumorózní masy či objevení nových ložisek může nastat odpověď, nebo alespoň prodloužená stabilizace nemoci. Tato skupina pacientů by v případě použití RECIST 1.1 byla zařazena do kategorie progrese (progressive disease – PD) a účinná léčba by byla vysazena. Z toho důvodu došlo ke vzniku kritérií iRECIST, u nichž k zachycení fenoménu pseudoprogrese byla zavedena jednak nutnost potvrzení PD (dle RECIST 1.1) a jednak byly provedeny změny v hodnocené skupině nových lézí.
Cíl:
Přehledová práce seznamuje s kritérii hodnocení onkologické odpovědi u solidních tumorů pomocí RECIST ve verzi 1.1 a imunitní varianty iRECIST (včetně stručného odkazu na předešlá imunitní kritéria). Dále jednotlivé systémy v kontextu imunoonkologie porovnává, představuje jejich specifika a slabá místa.
Závěr:
Kritéria iRECIST vznikla na základě konsenzu odborníků, avšak dosavadní nasbíraná data zatím nejsou dostatečná pro jejich definitivní validaci. Z toho titulu by primárním hodnoticím systémem v případě imunoonkologických studií měl zůstat systém RECIST 1.1. Použití iRECIST by zatím mělo být ponecháno především k výzkumným účelům (pro jeho další testování a validaci). Rozlišit pseudoprogresi od reálné PD pacienta léčeného imunoterapeutickou léčbou je velkou výzvou pro onkologické zobrazování.
Klíčová slova:
RECIST – kritéria odpovědi – imunoterapie – měření – tumorózní masa
Úvod
Snaha stanovit univerzální, objektivní a v běžné praxi použitelná diagnostická kritéria odpovědi jedince na onkologickou léčbu na základě posuzování změn tumorózní masy solidního tumoru není nová a je velkou výzvou pro onkologické zobrazování. Odpověď hodnotící systémy jsou a byly doménou klinických studií, kde použití stejného systému zajišťuje dobrou porovnatelnost jednotlivých studií a jejich výsledků (odpovědí na léčbu) [1], pomalu však začínají pronikat také do klinické praxe. Správně vyhodnocená léčebná odpověď může sloužit jako imperativ ke změně léčby, pokud se ta současná ukáže jako nepříliš efektivní.
Nejstarším hodnoticím systémem jsou kritéria WHO z roku 1981, která jako první přišla s konceptem měření tumorózní masy a určení odpovědi na léčbu na základě její změny proti referenčnímu vyšetření. V roce 2000 na základě retrospektivní analýzy měření 569 pacientů došlo k ustanovení RECIST kritérií. Nejzásadnějšími změnami, které systém přinesl, bylo měření pouze jednoho nejdelšího rozměru (a nikoli měření bidimenzionální), dále definici měřitelných lézí a specifikace jejich maximálního počtu. V současné době nejpoužívanějším systémem hodnocení odpovědi na onkologickou léčbu je revidovaná verze z roku 2009 označovaná RECIST 1.1, která hodnotí také lymfatické uzliny (nejdelší rozměr v krátké ose), redukuje počet měřených lézí, specifikuje a hodnotí nové léze a zahrnuje hybridní modalitu pozitronové emisní tomografie a počítačové tomografie (positron emission tomography and computed tomography – PET/CT) do vyšetřovacích algoritmů [2]. Použití RECIST 1.1 se v současné době neomezuje pouze na klinické studie a s ohledem na hodnocení efektu biologické léčby může být ze strany pojišťoven vyžadováno jako kritérium úhrady. Zařazení do kategorie progrese onemocnění (progressive disease – PD) může pro pacienta znamenat konec úhrady léčby ze strany pojišťovny, a to se všemi možnými důsledky.
Imunoterapie na poli protinádorové léčby je relativně mladou a rychle se rozvíjející modalitou onkologické léčby. Pomáhá stimulovat imunitní systém k označení a napadení tumorózních buněk, které imunitnímu dohledu jinak unikají [3]. Nejvíce studovanými signálními cestami jsou v současnosti CTLA-4 (cytotoxic T-lymphocyte antigen 4), PD-1 (programmed death-1) a PD-L1 (programmed death ligand-1). Imunoterapie přinesla podstatné zlepšení výsledků léčby pro pacienty s melanomem, světlobuněčným karcinomem ledviny, velkobuněčným karcinomem plic, skvamózním karcinomem hlavy a krku, Hodgkinovým lymfomem a karcinomem močového měchýře [4]. I u dalších diagnóz se chystají studie s imunoterapií.
Původní systémy zmíněné výše byly vyvinuty na základě hodnocení odpovědi na klasická cytotoxická chemoterapeutika. Imunomodulační léčba má však na rozdíl od chemoterapeutik odlišný mechanizmus účinku. Použití výše zmíněných diagnostických kritérií (např. nejpoužívanějších dle RECIST 1.1) u pacientů léčených imunoterapeutiky může vést k odlišné grafické odpovědi tumoru, její chybné interpretaci a nakonec i možnému poškození pacienta. Tato unikátní odpověď označovaná jako pseudoprogrese dala vzniknout několika dalším diagnostickým kritériím s přídomkem „imuno“. Jedná se o kritéria pro hodnocení účinnosti imunoterapie (immunology related response criteria – irRC) vycházející z WHO a irRECIST (immunology related RECIST) a iRECIST (immune RECIST) vycházející z RECIST 1.1 (resp. v případě irRECIST také z irRC, ale s využitím unidimenzionálního měření) a dále o neuroonkologická kritéria iRANO (immunotherapy response assessment in neuro-oncology) [5] pro pacienty s maligním gliomem, low-grade gliomem a mozkovými metastázami.
Pseudoprogrese je vzorem odpovědi jedince léčeného imunoterapií, kdy odpověď na léčbu či alespoň prodloužená stabilizace může nastat: 1) po prvotním zvětšení tumorózní masy, 2) za přítomnosti nových lézí. V případě hodnocení klasickými hodnoticími systémy by v těchto případech došlo k chybnému a nevratnému zařazení pacienta do kategorie PD a pacient by tak mohl být poškozen předčasným ukončením efektivní léčby. V závislosti na imunoterapii a typu tumoru se pseudoprogrese může vyskytnout u malé části pacientů (ve studiích pro melanomy typicky ≤ 10 % případů) [1]. Histologický podklad tohoto fenoménu je popisován na základě biop-sií pacientů s melanomem léčených ipilimumabem [6–8]. Zvětšení tumorózní masy, které předcházelo odpovědi na léčbu, reprezentovalo kontinuální růst tumoru do vyvinutí dostatečné imunitní odpovědi nebo infiltraci tumoru imunitními buňkami s přítomným edémem či bez přítomného edému. V tomto kontextu lze usuzovat, že i nové léze se tímto přechodně stanou z nedetekovatelných detekovatelnými. Stran hodnoticích systémů je důležitý požadavek na potvrzení PD min. po 4 týdnech a inkorporaci hodnot měření nových lézí do celkového součtu tumorózní masy (ale zároveň mimo součet referenčního vyšetření). Toto se prvně objevilo v nejstarším z nich, tedy v irRC. Na tomto místě je dobré zmínit, že fenomén pseudoprogrese není spojen pouze s imunoterapií. Je popsán po frakcionované stereotaktické radioterapii vestibulárních schwannomů [9] a po stereotaktické radioterapii mozkových metastáz [10].
V následujícím textu dojde k představení kritérií RECIST 1.1 a specifik imunitní verze iRECIST (s odkazy na verzi RECIST 1.1). Další části se věnují pokračování v léčbě i přes PD dle RECIST 1.1 a úskalím, která použití obou metodik přináší.
Systém hodnocení dle RECIST 1.1
V současné době se jedná o nejpoužívanější kritéria pro hodnocení odpovědi na léčbu solidních tumorů. Text této kapitoly vychází z originálních guidelines pracovní skupiny RECIST [11] publikovaného v European Journal of Cancer v roce 2009. Úvodem je užitečné uvést souhrn jednotlivých pojmů, se kterými kritéria RECIST operují:
- referenční (baseline) – radiologické vyšetření ne starší 4 týdnů od začátku léčby;
- kontrolní vyšetření;
- měřitelné a neměřitelné léze;
- cílové léze (target lesions – TL);
- součet měření lézí cílových (sum of measurements – SOM) a nejmenší SOM od začátku léčby (nadir);
- léze necílové (non-target lesions – nTL);
- nové léze;
- kompletní odpověď (complete response – CR);
- částečná odpověď (partial response – PR);
- stabilní nemoc (stable disease – SD);
- progrese (progressive disease – PD);
- nehodnotitelné (not evaluable – NE);
- nejedná se ani o kompletní odpověď a ani o progresi (non-CR/non-PD).
Sledované léze jsou hodnoceny neměnnou metodikou a ideálně také stejnou modalitou. Jednotlivé kontroly by měly být naplánovány a termíny dodržovány bez ohledu na případná zdržení v léčbě. Připouští se sice hodnocení kožních lézí ≥ 10mm barevnou fotografií a odečet jejich velikosti přiložením metru, ale hlavní roli mají zobrazovací metody. Vedle nich a s nimi je možné v některých případech použít tumorózní markery (tumor markers – TM; jsou-li na referenčním vyšetření elevovány, pro CR je pak nutná jejich normalizace) a cytologická a histologická vyšetření (v některých případech, vyžaduje-li protokol studie, pomohou rozlišit CR a PR).
Za určitých podmínek je možné použít prostý snímek hrudníku. Sledovaná léze musí být jasně ohraničena od okolí a jako měřitelná musí splňovat kritérium ≥ 20 mm. Majoritní roli však hraje použití CT, které je dostupné a jehož výsledky jsou dobře reprodukovatelné. Šířka řezu by měla být ≤ 5 mm. Pokud by šířka vrstvy byla ≥ 5 mm, min. velikost měřitelné léze se zvětší na dvojnásobek dané hodnoty (v mm). Další použitelnou modalitou je magnetická rezonance (magnetic resonance – MRI) a ve specifických případech také PET/CT. Ultrazvuk není vzhledem k interindividuální variabilitě a subjektivitě měření vhodný (pokud jeho výsledek nebude potvrzen na CT či MRI).
Měřitelnost lézí dle RECIST neodpovídá pouze tomu, zda je technicky možné lézi na daném vyšetření změřit, ale je určující pro možnost zařazení do lézí cílových (viz dále). Mezi měřitelné léze se řadí lymfatické uzliny, léze podkoží, plicního parenchymu, solidních orgánů a metastázy. V konkrétních číslech je měřitelná nodální léze v krátké ose ≥ 15 mm a nenodální v nejdelším rozměru ≥ 10 mm (≥ 20 mm na rentgenu plic). Kostní léze jsou měřitelné jen v případě, že obsahují dobře měřitelnou měkkotkáňovou komponentu ≥ 10 mm. Léze po předchozím ozařování jsou považovány za měřitelné až poté, co je jasně dokumentována jejich progrese. Uzliny (nodální léze) pak z terminologického hlediska dělíme na patologické, tj. takové, které v krátké ose měří ≥ 10 mm, a nepatologické < 10 mm. Patologické pak mohou být dle velikosti také měřitelné (tj. v krátké ose ≥ 15 mm).
Neměřitelné léze jsou všechny ostatní léze, tedy léze příliš malé, aby byly měřitelné, dále kostní léze bez měřitelné měkkotkáňové složky, leptomeningeální choroba, ascites, pleurální či perikardiální výpotek, lymfangitida kůže či plic, inflamatorní tumor prsu a léze po předchozím ozařování bez popsané progrese.
Cílové léze
TL jsou první hodnocenou a na kontrolách sledovanou skupinou. Každá cílová léze musí být zároveň lézí měřitelnou. Maximální počet TL u jednoho pacienta je pět, z toho max. dvě na jednu orgánovou soustavu (párové orgány jako plíce, nadledviny a ledviny a celý lymfatický systém se hodnotí jako jedna orgánová soustava). Pokud na referenčním vyšetření existuje více lézí splňujících kritéria pro TL, tj. nenodální léze ≥ 10 mm v nejdelším rozměru, nodální léze ≥ 15 mm v krátké ose, za TL by měly být vybrány takové, které jsou výrazné, dobře demonstrují postižení dané orgánové soustavy a mají předpoklad snadného měření na dalších kontrolách. Pro vlastní měření je třeba použít řez, na němž konkrétní TL měří nejvíce. Preferovány jsou axiální skeny, pokud si charakter tumorózního ložiska nevyžaduje jinak (tuto skutečnost je pak vhodné u naměřené hodnoty ve zprávě zmínit). Jak již bylo uvedeno, nodální léze se měří v krátké ose, pro nenodální se použije nejdelší rozměr.
Na kontrolním vyšetření se pak jednotlivé TL vyhledají a změří. Naměřené hodnoty se sečtou a vznikne SOM. Na základě procentuálního vyjádření změny SOM kontroly a nejnižšího dosavadního či dostupného SOM (nadir či baseline) se určí odpověď TL na léčbu. Pro CR je nutné vymizení veškerých TL, všechny dříve patologické uzliny musí měřit < 10 mm v krátké ose a musí dojít k normalizaci hladin TM (jsou-li k dispozici). PR znamená zmenšení SOM min. o 30 % proti baseline SOM. Při nárůstu SOM o min. 20 % a absolutním zvětšení SOM proti nadir o alespoň 5 mm se jedná o PD. Další možností zařazení do kategorie PD je výskyt jedné či několika lézí nových. Pod zkratkou SD v kategorii TL se rozumí, že nemocný nesplňuje kritéria PR a zároveň ho ještě nelze zařadit do kategorie PD.
Následující řádky přibližují možné eventuality při kontrolách TL. Pokud sledovaná léze regredovala pod 5 mm, existují celkem tři varianty. Velikost léze ještě lze spolehlivě odečíst, použít naměřený rozměr (bez ohledu na změnu v pojmenování uzliny měřící < 10 mm z patologické na nepatologickou použít naměřenou hodnotu). Pokud již měření není spolehlivé (léze je příliš malá), přidělit rozměr 5 mm. V případě, že léze kompletně zregredovala a není již patrna, přidělit 0 mm. Z dalších eventualit může dojít i k rozpadu nenodální TL a v tom případě se sečtou nejdelší rozměry obou fragmentů. Splyne-li nenodální léze v jednu, operuje se s vektorem nejdelšího rozměru.
Necílové léze
Druhou hodnocenou skupinou jsou nTL. Jedná se o všechny neměřitelné léze (viz výčet výše) a o léze sice měřitelné, ale neoznačené jako TL. Způsob hodnocení je především kvalitativní, tedy – léze přítomna, nepřítomna či jasně progreduje. CR nastane při vymizení všech nTL, normalizaci TM a nepřítomnosti uzlin ≥ 10 mm. Jasná progrese nTL a přítomnost nového ložiska znamená PD. Na tomto místě je třeba zdůraznit, že malé zvětšení jednoho či více nTL automaticky neznamená PD. Třetí možností odpovědi je non-CR/non-PD, kdy přetrvává jedna nebo více nTL a hladiny tumorózních markerů jsou bez větší změny. Poslední možností je NE při špatné obrazové kvalitě kontroly či zcela chybějící obrazové dokumentaci. Stran hodnocení celkové odpovědi (overall response – OR) na léčbu je na tomto místě třeba upozornit na možnost úplné absence TL. Tedy situace, kdy žádná z lézí v době referenčního vyšetření nesplňovala kritéria pro TL. OR se pak odvíjí pouze od hodnocení nTL a nových lézí.
Nové léze
Poslední hodnocenou skupinou jsou nové léze. Dle definice se jedná o léze, které na referenčním vyšetření nebyly patrny. Druhou možností jsou léze zjištěné mimo anatomický rozsah baseline vyšetření (např. nález metastáz mozku, když referenčně byl vyšetřen trup). Je nutné si uvědomit, že výskyt jediné nové léze znamená dle RECIST 1.1 nevratný přesun pacienta do PD v rámci OR. Nález by proto měl být jednoznačný, neměl by být zatížený chybou vyšetřovacího procesu či změnou modality. Schopnost vyloučit artefakty dané modality a identifikovat souběžně vznikající benigní nález je klíčová. Existují-li pochybnosti, obezřetnost je s ohledem na možné důsledky na místě. V těchto případech je možné doporučit kontrolu s odstupem (při pokračující léčbě), popř. provést PET/CT. Inkorporace hodnocení glukózového metabolizmu pomocí pozitronové emisní tomografie ve formě fluordeoxyglukózy (fluorodeoxyglucose-positron emission tomography – FDG PET) rozšiřuje čistě morfologické hodnocení využívající měření velikostí o funkční aspekt. Pokud pacient FDG PET v rámci baseline neměl a kontrolní FDG PET je pozitivní a ukazuje na možnou novou lézi / nové léze, je vyžadována CT konfirmace. Je-li pozitivní, pak se za datum PD považuje datum vyšetření FDG PET.
Celková léčebná odpověď
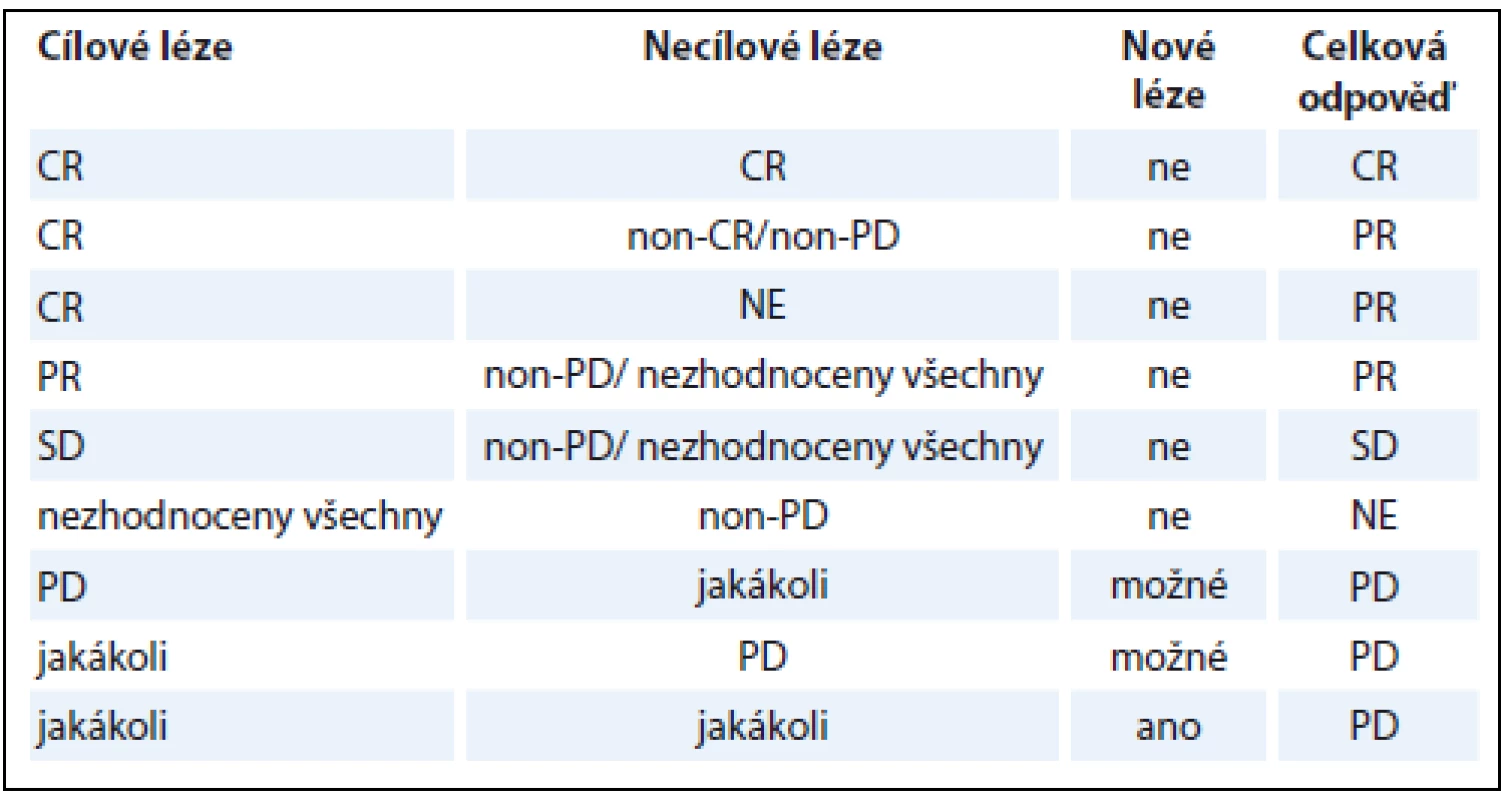
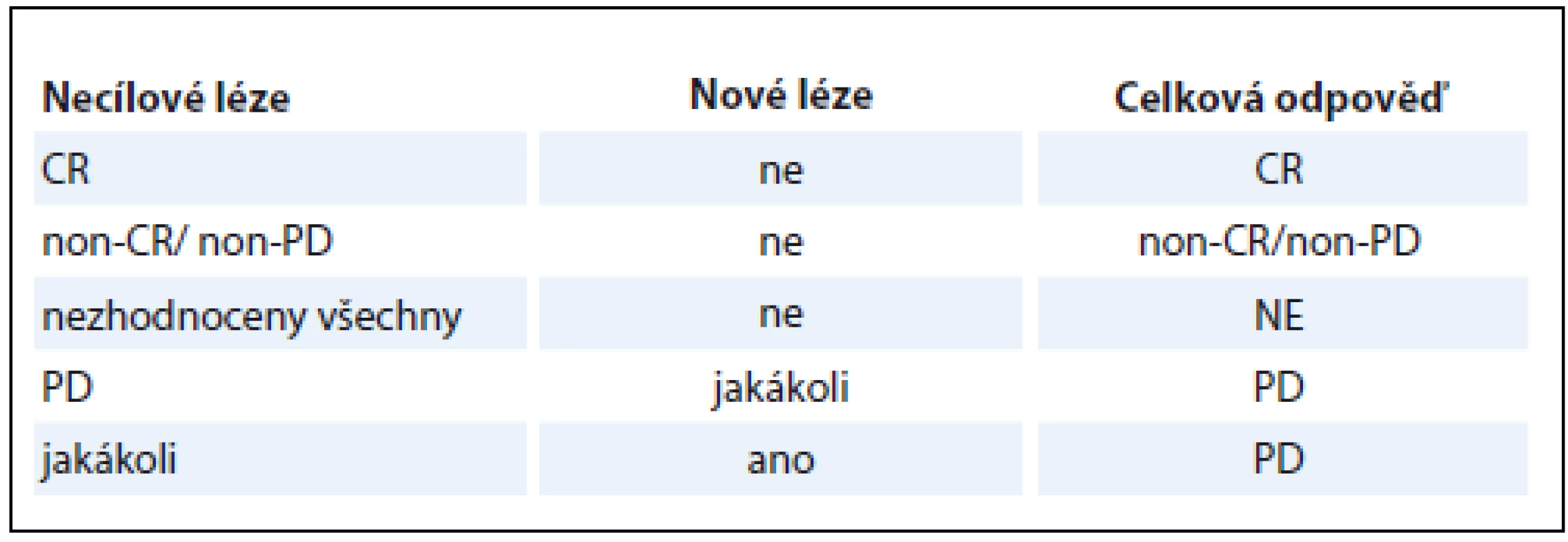
Při znalosti dílčích odpovědí v rámci popisovaných skupin TL, nTL a nových lézí je určení OR na léčbu v rámci dané kontroly snadné (tab. 1). V případě, že léze pacienta nesplňují kritéria pro TL, platí tabulka druhá (tab. 2). Za zmínku stojí fakt, že pro konstatování PD bez ohledu na zbylý nález stačí jediná odpověď PD v TL i nTL, popř. přítomnost byť jediné nové léze. Nejlepší celková odpověď (best overall response – BOR) je nejlepší odpověď, které byla během všech kontrol dosaženo. Pro nerandomizované studie je doporučeno provést kontrolu CR a PR.
Specifika hodnocení dle iRECIST
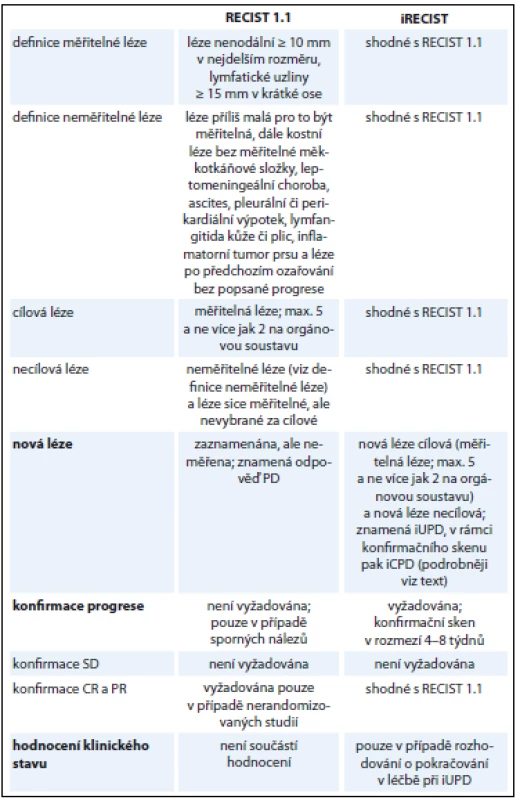
Systém hodnocení odpovědí iRECIST za využití stejných zobrazovacích modalit v zásadě přejímá metodiku a kritéria hodnocení platná pro verzi 1.1 s několika změnami (tab. 3). Dané změny adaptují tradiční kritéria na použití v imunoonkologii a snaží se vzít v úvahu již popisovaný vzor odpovědi zvaný pseudoprogrese. Jednotlivé odpovědi a hodnocené sledované skupiny lézí jsou podle kritérií iRECIST označeny malým písmenem „i“ (např. immune stable disease – iSD). Další text (vč. následující kapitoly) vychází z guideline vydaného skupinou RECIST v časopise Lancet Oncology [1].
Potvrzení progrese
Oproti výchozí verzi operuje iRECIST se dvěma formami PD, nepotvrzené a potvrzené. Zařazení pacienta do první zmíněné se řídí stejnými kritérii jako pro RECIST 1.1, tedy ve skupině TL, nTL či nové léze (proti nadir). Tuto nepotvrzenou progresi (immune unconfirmed progressive disease – iUPD) je však nutné verifikovat na konfirmačním skenu, který je proveden v odstupu nejméně 4 týdnů, ale ne déle než 8 týdnů.
K potvrzení PD může dojít ve stejné skupině (TL, nTL, nové léze), pro kterou byla iUPD konstatována. Ve skupině cílových lézí je třeba nárůst SOM o min. 5 mm absolutně. U necílových je nutná další jednoznačná PD. Pro nové měřitelné léze platí progrese v jejich součtu o min. 5 mm a pro zbylé nové léze pak progrese počtu či jednoznačná progrese velikosti (nové léze dle iRECIST jsou vysvětleny níže). Progrese může nastat i v jiné skupině lézí, než pro které byla iUPD stanovena (např. výskyt nové léze u pacienta s iUPD ve skupině TL). V obou případech se pacient po potvrzení PD přesouvá do kategorie potvrzené progrese (immune confirmed progressive disease – iCPD).
Pokud na konfirmačním skenu iCPD nebude a naopak (proti baseline) dojde ke splnění kritérií pro iCR, iPR nebo iSD (resp. také non-iCR/non-iPD pro nTL), dojde k resetování kontrolních hodnot. Pro stanovení iCPD bude nutné v první řadě opět nabýt kritérií pro iUPD (proti nadir) a až poté případně iCPD. Z toho lze odvodit, že v historii pacienta není četnost iUPD jakkoli omezena. V případě, že konfirmační sken nebude splňovat ani jedno z výše zmíněných kritérií (iCR, iPR, iSD, non-iCR/non-iPD), pak odpověď pacienta zůstane iUPD.
Nové léze
Změna se dotkla také nových lézí, které se dělí na měřitelné a neměřitelné (obr. 1). Z měřitelných se pak určí nové cílové léze (new lesions-target – NLT). Stejně jako pro RECIST 1.1 platí, že měřitelné mají v dlouhém rozměru min. 10 mm a nodální pak min. 15 mm a že NLT může být stanoveno max. 5 a ne více než 2 na jednu orgánovou soustavu. NTL budou na kontrolních vyšetřeních sledovány a měřeny. Jejich součet by však měl být veden separátně od TL a rozhodně by se neměl stát součástí SOM TL, které byly stanoveny při referenčním vyšetření. Všechny zbylé léze nesou označení nové léze necílové (new lesions-non-target – NLNT). Konfirmace progrese (tedy iCPD) v kategorii nových lézí znamená nárůst absolutní hodnoty součtu NLT o nejméně 5 mm nebo zvětšení velikosti NLNT (proti hodnocení skupiny nTL stačí i malé) nebo výskyt dalších nových lézí.
Nejlepší celková odpověď, frekvence kontrol a poznámky ke statistice
Nejlepší celková léčebná odpověď (immune best overall response – iBOR) je až na jednu výjimku v zásadě shodná s BOR u RECIST 1.1. Jedná se tedy o nejlepší odpověď, které bylo v průběhu léčby dosaženo. Pokud po stanovení iUPD došlo na konfirmačním skenu ke splnění kritérií pro iCR, iPR, iSD a non-iCR/non-iPD, pak daná odpověď (i přes předchozí PD) může být brána jako nejlepší.
Stejně jako pro RECIST 1.1 jsou i pro iRECIST kontroly doporučeny po 6–12 týdnech (v závislosti na frekvenci podávání léčby). Mimo daný rámec je možné provést sken k potvrzení PD (v rozestupu min. 4 a max. 8 týdnů). Pokud PD potvrzena není, další kontrola sleduje původní plán a její datum se nijak nezmění (pokud kontroly mají být v rozestupu např. 8 týdnů, tedy 8., 16., a 24. týden, a na první kontrole byla stanovena iUPD, pak kontrola 16. týden proběhne bez ohledu na negativní konfirmační sken ve 12. týdnu). Druhou možností kontrolního vyšetření mimo plán jsou výše zmíněné kontroly (i) CR a (i) PR (v rozestupu nejméně 4 týdnů).
Protokol studie by měl osvětlit, jak naložit s nehodnotitelnými či chybějícími kontrolami. V některých případech může být odůvodnitelné zahrnout výsledek vyšetření do statistik i přesto, že pacient léčbu a kontroly na delší dobu vynechal (jedná se např. o případy léčby CTLA-4 inhibitory, kde je možné předvídat pozdní reakci; platí, jen pokud pacient neobdržel jinou systémovou nebo lokální terapii). Dalším tématem je hodnocení iBOR v případě, že pacient ještě před progresí podstoupil jiný druh léčby. V případě nerandomizovaných studií se doporučuje provést kontrolu CR i PR.
Pokračující léčba po iUPD
Při vědomí možné pseudoprogrese je v imunoonkologii klinicky velmi důležité odlišit případ pseudoprogrese od iCPD. U pacienta s nerozpoznanou pseudoprogresí hrozí předčasné ukončení efektivní terapie. Naopak pacient, u něhož je iCPD mylně považována za pseudoprogresi, může být poškozen pro zdržení změny léčby za potenciálně kurabilní (pokud je tato v daném případě k dispozici). Z těchto důvodů je doporučeno pokračovat v léčbě i přes iUPD až do okamžiku konfirmačního skenu (min. po 4 týdnech od stanovení PD a max. po 8 týdnech), a to pouze za předpokladu, že pacient je klinicky stabilní. Dobrý klinický stav pacienta je totiž předpokladem, že pacient i přes iCPD bude schopen případné další léčby. Klinicky stabilní znamená, že se nezhoršuje performance status a laboratorní nález. Pacient by měl být prostý symptomů svědčících pro PD a jeho stav by neměl vyžadovat intenzifikaci léčby (bolesti, dušnosti atd.).
V některých případech může být racionálním postupem (bez přerušení stávající léčby) prodloužení termínu konfirmačního skenu. Jde především o ty případy, kde je pozdní odpověď známa (např. melanom léčený CTLA-4 inhibitory), a o případy, kdy není možnost jiné léčby (např. BRAF wild-type melanom).
Pokračování v léčbě či její ukončení by vždy mělo být diskutováno s pacientem a do protokolu studie řádně zaznamenáno. Věří-li však pacient či ošetřující tým, že nerespektování doporučení a pokračování v léčbě u pacienta s iCPD je opodstatněné, je vhodné v kontrolách pokračovat.
Úskalí hodnoticích systémů RECIST
Pro správné hodnocení a interpretaci výsledků revidované i imunitní verze RECIST je vhodné přiblížit, jaká úskalí použití těchto systémů přináší [12]. Analogicky k výše popisované pseudoprogresi, kdy podkladem přechodného zvětšení tumoru je infiltrace zánětlivými buňkami, může dojít k paradoxnímu zvětšení léze na podkladě krvácení či nekrózy. V těchto případech by mechanické změření lézí mohlo vést k mylnému závěru PD. Tento fenomén je popisován u cílené léčby při použití agens proti angiogenezi nebo inhibitorů tyrozinkinázy (nejčastěji u hepatocelulárního karcinomu a jaterních metastáz gastrointestinálního stromálního tumoru nebo melanomu). Radiolog odečítající takové vyšetření by na tyto eventuality měl být připraven a k verifikaci nekrózy či krvácení doporučit MRI, eventuálně PET/CT.
Další úskalí přináší hodnocení kavitujících plicních lézí. Progrese velikosti léze, která nově obsahuje kavity, nemusí znamenat nárůst tumorózní masy. Kavitace je poměrně častým jevem u nemalobuněčného karcinomu plic při léčbě agens proti angiogenezi typu VEGF-inhibitorů. Řešením je v nejdelším rozměru odečíst rozměr kavity.
Limitované použití systému RECIST je také v případě tumorózních lézí nepravidelného či výrazně protáhlého tvaru, kde může vykazovat nemalou variabilitu a být nepřesné. To teoreticky dává prostor pro vznik kritérií, která by tumorózní masu hodnotila na základě objemových a nikoli rozměrových změn. Nekonzistentní výsledky měření se dají očekávat také u lézí, které nejsou od okolí dobře diferencovatelné.
Minimálně v případě RECIST 1.1, kde kategorizace do skupiny PD je de facto neměnná, lze považovat pravidlo léze mimo původně skenovanou oblast PD za diskutabilní (např. nález metastázy mozku v průběhu léčby, když jako referenční vyšetření bylo provedeno CT trupu). Nemusí se totiž jednat o skutečnou novou lézi, tato totiž mohla být přítomna již v den referenčního vyšetření.
Diskuze a závěr
Rostoucí význam imunitní terapie v rámci onkologických aplikací si vyžaduje všeobecně akceptovatelná a jednotně používaná kritéria hodnotící léčebnou odpověď. Tato kritéria pak umožní porovnávat výsledky léčby v rámci jednotlivých studií a časem se patrně stanou i součástí každodenní klinické praxe. Vzhledem k existenci vzoru odpovědi označované jako pseudoprogrese se zdá, že klasické hodnoticí systémy pro imunitní léčbu nemusí být ideální a modifikace typu irRC a iRECIST mají svá opodstatnění. Konkrétní čísla pak přineslo srovnání tradičního RECIST 1.1 s irRC v retrospektivní analýze 327 pacientů s pokročilým melanomem léčených inhibitorem PD-1 pembrolizumabem. I když se nejedná o srovnání RECIST 1.1 se systémem iRECIST, ale irRC, je toto první retrospektivní analýza korelující celkové přežití (overall survival – OS) s použitím zmíněných systémů. Studie ukázala, že zhruba 15 % pacientů by při použití verze 1.1 mohlo být poškozeno předčasným přerušením léčby [13].
Na první pohled se mohou irRC a iRECIST zdát celkem ekvivalentní (obě kalkulují s pseudoprogresí), ale opak je pravdou. Prvně zmíněný systém vychází z klasického systému WHO a jako takový používá měření ve dvou směrech (nejdelším a nejdelším na něj kolmým). Naproti tomu iRECIST, stejně jako revidovaná originální verze využívá unidimenzionální měření lézí (nejdelší rozměr pro nenodální a krátká osa pro uzlinu). Variabilita měření v jednom rozměru je mnohem menší než v případě bidimenzionálního, a může tak přesněji vystihnout změnu tumorózní masy [14–16]. To platí především pro malé rozměry, kde i malá chyba v měření znamená velkou procentuální odchylku a riziko nesprávně určené odpovědi tak stoupá. Jinými slovy – prahová hodnota pro stanovení PD v rámci kritérií WHO či irRC (tj. 25% zvětšení naměřené tumorózní masy) může odpovídat pouze variabilitě bidimenzionálního měření a nikoli skutečné PD [16]. A konečně je iRECIST výhodnější pro snadnější porovnatelnost výsledků s nejpoužívanějším odpověď hodnoticím systémem RECIST 1.1, ze kterého vychází.
I přes dosavadní slibné výsledky je nezbytné zmínit, že kritéria iRECIST vznikla na základě konsenzu odborníků, avšak dosavadní nasbíraná data zatím nejsou dostatečná pro jejich validaci. Z toho titulu by primárním hodnoticím systémem i v případě imunoonkologických studií měl zůstávat systém RECIST 1.1. Použití iRECIST by zatím mělo být ponecháno především k výzkumným účelům (pro jeho další testování a validaci).
Výzvou pro onkologické zobrazování je nalézt vhodné a ideálně i v běžné praxi aplikovatelné nástroje (časné markery, prediktory), které by pomohly časně rozlišit pseudoprogresi od reálné progrese [17]. V tom případě by terapie pacienta s pseudoprogresí nebyla předčasně ukončena a pacient s reálnou PD by naopak dostal možnost neefektivní léčbu včas změnit.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Štěpán Houdek
Radiodiagnostické oddělení
Nemocnice Na Homolce
Roentgenova 2/37
150 30 Praha 5
e-mail: stepan.houdek@homolka.cz
Obdrženo: 24. 9. 2017
Přijato: 3. 10. 2017
Sources
1. Seymour L, Bogaerts J, Peronne A et al. iRECIST: guidelines for response criteria for use in trials testing immunotherapeutics. Lancet Oncology 2017; 18 (3): 143–152. doi: 10.1016/S1470-2045 (17) 30074-8.
2. Tirkes T, Hollar M, Tann M et al. Response Criteria in Oncologic Imaging: Review of Traditional and New Criteria. Radio Graphics 2013; 33 (5): 1323–1341. doi: 10.1148/ rg.335125214.
3. Kamta J, Chaar M, Ande A et al. Advancing Cancer Therapy with Present and Emerging Immuno-Oncology Approaches. Front Oncol 2017; 7 : 64. doi: 10.3389/ fonc.207.00064.
4. Ferte CH, Marabelle A. IRECIST: A clarification of tumour response assessment in the immunotherapy era. Eur J Cancer 2017; 77 : 165–167. doi: 10.1016/j.ejca.2017.02.015.
5. Okada H, Weller M, Huang R et al. Immunotherapy Response Assessment in neuro-oncology: a report of the RANO working group. Lancet Oncol 2015; 16 (15): 534–542. doi: 10.1016/S1470-2045 (15) 00088-1.
6. Wolchok JD, Hoos A, O’Day S et al. Guidelines for the Evaluation of Immune Therapy Activity in Solid Tumors: Immune-Related Response Criteria. Clin Cancer Rec 2009; 15 (23): 7417–7420. doi: 10.1158/1078-0432.CCR-09-1624.
7. Hodi FS, Butler M, Oble DA et al. Immunologic and clinical effects of antibody blockade of cytotoxic T lymphocyte-associated antigen 4 in previously vaccinated cancer patients. Proc Natl Acad Sci U S A 2008; 105 (8): 3005–3010. doi: 10.1073/pnas.0712237105.
8. Hodi FS, Oble DA, Drappatz J et al. CTLA-4 blockade with ipilimumab induces significant clinical benefit in a female with melanoma metastases to the CNS. Nat Clin Pract Oncol 2008; 5 (9): 557–561. doi: 10.1038/ncponc1183.
9. Mohammed FF, Schwartz ML, Lightstone A et al. Pseudoprogression of vestibular schwannomas after fractioned stereotactic radiation therapy. J Radiat Oncol 2013; 2 (1): 15–20. doi: 10.1007/s13566-012-0084-1.
10. Wiggenraad R, Bos P, Verbeek-de Kanter A et al. Pseudo-progression after stereotactic radiotherapy of brain metastasis: lesion analysis using MRI cine-loops. J Neurooncol 2014; 199 (2): 437–443. doi: 10.1007/s11060-014-1519-x.
11. Eisenhauer EA, Therasse P, Bogaerts J et al. New response evaluation criteria in solid tumours: Revised RECIST guideline (version 1.1). Eur J Cancer 2009; 45 (2): 228–247. doi: 10.1016/j.ejca.2008.10.026.
12. Nishino M, Jagannathan JP, Ramaiya NH et al. Revised RECIST Guideline Version 1.1: What Oncologists Want to Know and What Radiologists Need to Know. AJR Roentgenol 2010; 195 (2): 281–289. doi: 10.2214/AJR.09.4110.
13. Hodi FS, Hwu WJ, Kefford R et al. Evaluation of Immune-Related Response Criteria and RECIST v1.1 in Patients With Advanced Melanoma Treated With Pembrolizumab. J Clin Oncol 2016; 34 (13), 1510–1517. doi: 10.1200/JCO.2015.64.0391.
14. Nishino M, Guo M, Jackman DM et al. CT tumor volume measurement in advanced non-small-cell lung cancer: Performance characteristics of an emerging clinical tool. Acad Radiol 2011; 18 (1): 54–62. doi: 10.1016/j.acra.2010.08.021.
15. Zhao B, James LP, Moskowitz CS et al. Evaluating variability in tumor measurements from same-day repeat CT scans of patients with non-small cell lung cancer. Radiology 2009; 252 (1): 263–272. doi: 10.1148/radiol.2522081593.
16. Erasmus JJ, Gladish GW, Broemeling L et al. Interobserver and intraobserver variability in measurement of non-small-cell carcinoma lung lesions: implications for assessment of tumor response. J Clin Oncol 2003; 21 (13): 2574–2582. doi: 10.1200/JCO.2003.01. 144.
17. Nishino M. Immune-related response evaluations during immune-checkpoint inhibitor therapy: establishing a “common language” for the new arena of cancer treatment. J Immunother Cancer 2016; 4 : 30. doi: 10.1186/s40425-016-0134-0.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2017 Issue Supplementum3
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Immunotherapy for Bladder Cancer
- Evaluation of Inflammatory Cells (Tumor Infiltrating Lymphocytes) in Solid Tumors
- Imunoterapie v léčbě karcinomu plic
- Comparison of RECIST 1.1 and iRECIST for Response Evaluation in Solid Tumours
- Advances in Immunotherapy of Malignant Melanoma
- Combined Regimens in Immunotherapy
- Checkpoint Inhibitors in the Treatment of Upper Gastrointestinal Tract Tumors
- Immunotherapy of Renal Cell Carcinoma
- Immunotherapy of Colorectal and Anal Carcinoma
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Evaluation of Inflammatory Cells (Tumor Infiltrating Lymphocytes) in Solid Tumors
- Comparison of RECIST 1.1 and iRECIST for Response Evaluation in Solid Tumours
- Immunotherapy of Colorectal and Anal Carcinoma
- Imunoterapie v léčbě karcinomu plic
