Lidský papilomavirus – role v karcinogenezi cervixu a možnosti jeho detekce
Human Papillomavirus – Role in Cervical Carcinogenesis and Methods of Detection
Background:
Persistent infection with high-risk human papillomavirus (HPV) strains, especially HPV 16 and HPV 18, is associated with the onset of various malignant diseases, including cervical carcinoma in women. HPV DNA testing is thus being implemented as a complementary method to standard cytological examination, mainly due to its increased sensitivity.
Aim:
This review outlines the role of HPV in cervical carcinogenesis, with a focus on the formation of cervical intraepithelial neoplasias (CIN1–3) and the molecular mechanism underlying cellular transformation. Current biomarkers used to screen premalignant lesions are described, including mRNA transcripts of the E6 and E7 genes, protein p16 (a cyclin-dependent kinase inhibitor that regulates cell cycle progression from G1 to S phase), altered DNA methylation patterns, and actions of specific microRNAs (short (18–22 bp), non-coding, single-stranded RNA molecules that regulate gene expression at the post-transcriptional level). This review also describes the advantages and drawbacks of commercial HPV tests, and depicts novel methods for more cost-effective and faster HPV diagnostics based on optical or electrochemical detection.
Conclusion:
Although great progress has been made, the incidence and mortality rates of cervical malignancies remain relatively high, especially in developing countries. Incorporation of HPV testing into routine screening programs could help to decrease mortality rates; however, the cost of such testing must be reduced if it is to compete with current cytology-based examinations.
Key words:
HPV – cervical carcinoma – HPV testing – nucleic acid hybridization – mRNA – DNA methylation – microRNA
This work was supported by MEYS-NPS I-LO1413 and GAČR 17-08971S.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted:
25. 9. 2017
Accepted:
26. 1. 2018
:
Bartošík Martin; Hrstka Roman; Jiráková Ludmila
:
RECAMO, Masarykův onkologický ústav, Brno
:
Klin Onkol 2018; 31(2): 89-94
:
Review
prolekare.web.journal.doi_sk:
https://doi.org/10.14735/amko201889
Východiska:
Perzistentní infekce onkogenním typem lidského papilomaviru (human papillomavirus – HPV), nejčastěji HPV 16 a HPV 18, může vést k rozvoji řady maligních onemocnění, zejména pak ke karcinomu děložního hrdla u žen. Testování na přítomnost HPV DNA se tudíž zavádí jako komplementární metoda ke stávajícímu cytologickému vyšetření, mimo jiné i díky vyšší citlivosti.
Cíl:
Tento přehledový článek pojednává o roli HPV v karcinogenezi děložního hrdla, zejména popisuje vznik cervikálních intraepiteliálních lézí (CIN1-3) a molekulární mechanizmus transformace buněk. Představuje existující biomarkery pro diagnostiku prekancerózních lézí, mezi které patří např. mRNA transkripty genů E6 a E7, protein p16 (inhibitor cyklin-dependentní kinázy regulující přechod z G1 do S fáze buněčného cyklu), změněné metylační vzorce DNA nebo působení specifických miRNA, tj. krátkých nekódujících jednořetězcových RNA o délce 18–22 nukleotidů, které posttranskripčně regulují genovou expresi. Dále rozebírá výhody a nevýhody komerčně dostupných HPV testů, a v neposlední řadě představuje nově vyvíjené metody umožňující levnou a rychlou diagnostiku HPV na bázi optické i elektrochemické detekce.
Závěr:
Nádory děložního hrdla i navzdory velkému pokroku v posledních letech stále patří mezi nejrozšířenější ženské malignity s vysokou mortalitou, zejména v rozvojových zemích. Ke snížení mortality by mohla pomoci implementace HPV testování do rutinního screeningového vyšetření. To však bude třeba finančně zefektivnit tak, aby bylo cenově konkurenceschopné se stávajícími cytologickými vyšetřeními.
Klíčová slova:
HPV – karcinom cervixu – HPV testování – hybridizace nukleových kyselin – mRNA – metylace DNA – miRNA
Úvod
Infekce lidským papilomavirem (human papillomavirus – HPV) patří mezi nejběžnější pohlavně přenosné choroby. Předpokládá se, že až 80 % populace se během života setká s infekcí HPV. Celkově je známo > 200 genotypově odlišných kmenů lidských papilomavirů [1], ovšem ne všechny jsou pro člověka nebezpečné, většina z nich způsobuje pouze kožní nebo genitální bradavice (jde o tzv. low-risk HPV, LR-HPV). Některé kmeny však vykazují onkogenní charakter (HPV 16, 18, 36, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68, 73, 82, souhrnně high-risk HPV, HR-HPV), což znamená, že jejich dlouhodobá neléčená přítomnost může vést k maligní transformaci epiteliální tkáně a ke vzniku nádorů cervixu (děložního hrdla), vagíny, anální oblasti, nebo dokonce hlavy a krku. Nejrozšířenějšími onkogenními kmeny jsou HPV 16 a HPV 18, u kterých se uvádí, že způsobují až 70 % všech karcinomů děložního hrdla [2]. Genom HPV je tvořen dvoušroubovicovou kruhovou DNA o délce ~ 8 kb (obr. 1), rozdělenou do tří oblastí:
- 1. časná oblast (early region) obsahující vždy geny E1, E2, E4, E5, E6 a E7, u některých kmenů pak ještě E3 a E8;
- 2. oblast obsahující kódující sekvence genů pozdní fáze (late region) L1 a L2;
- 3. kontrolní oblast (long control region – LCR)
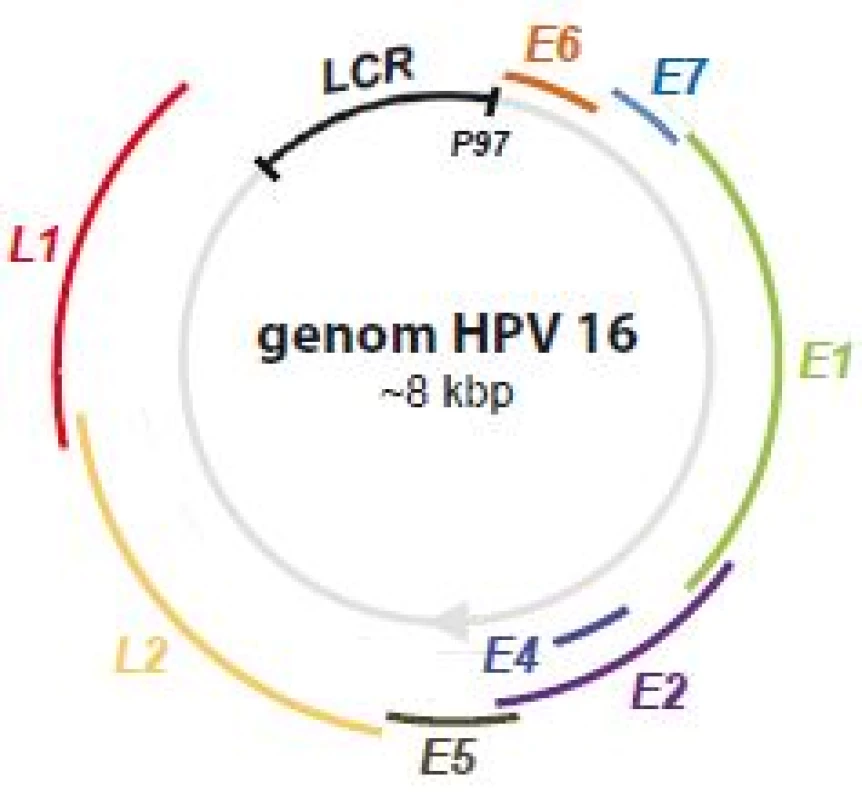
Proteiny kódované geny časné oblasti mají spíše regulační funkci, podílejí se např. na replikaci a transkripci genomu, buněčné signalizaci nebo apoptóze a jsou častěji exprimované v raných fázích infekce (od toho pojmenování early). Proteiny pozdní fáze, L1 a L2, tvoří virový kapsid. Oblast LCR zahrnuje zejména místo počátku replikace, vazebná místa transkripčních faktorů a promotor P97 zodpovědný za transkripci téměř všech genů z časné oblasti. Za normálních okolností je transkripce z promotoru P97 inhibována vazbou proteinu E2, čímž je hladina proteinů E6 a E7 udržována nízká. Genová exprese je polycistronní, více genů má společný promotor a výsledné mRNA transkripty tak závisejí na zvoleném čtecím rámci [3]. Navíc díky alternativnímu sestřihu může jeden mRNA transkript dát vzniknout více proteinům [4].
Role HPV v karcinogenezi cervixu
Zjednodušeně lze vznik cervikálního karcinomu rozdělit do čtyř fází – HPV infekce, virová perzistence, vznik prekanceróz a invazivní karcinom [2] (obr. 2). Naštěstí dokáže imunitní systém člověka HPV infekci ve většině případů odstranit. V opačném případě se infekce stává perzistentní. Vznikají premaligní léze, u kterých je virová DNA v buňce lokalizována nejdřív epizomálně, tj. není začleněná do chromozomální DNA. Postupně však dochází k molekulárním změnám, chromozomální nestabilitě a integraci virové DNA do genomu hostitele, která vede ke ztrátě regionu E2. Sníží se tak hladina proteinu E2, čímž dochází ke zvýšené expresi onkoproteinů E6 a E7, jelikož za normálních okolností protein E2 negativně reguluje transkripci genů E6 a E7 vazbou na tzv. E2-vazebné místo v rámci LCR. Karcinogenní potenciál proteinů E6 a E7 je dán tím, že inhibují expresi důležitého nádorového supresorového proteinu p53, resp. retinoblastomového proteinu pRb, což vede k deregulaci buněčného cyklu buňky, ke snížení exprese proteinů důležitých při opravných mechanizmech DNA a k postupné akumulaci buněčných defektů.
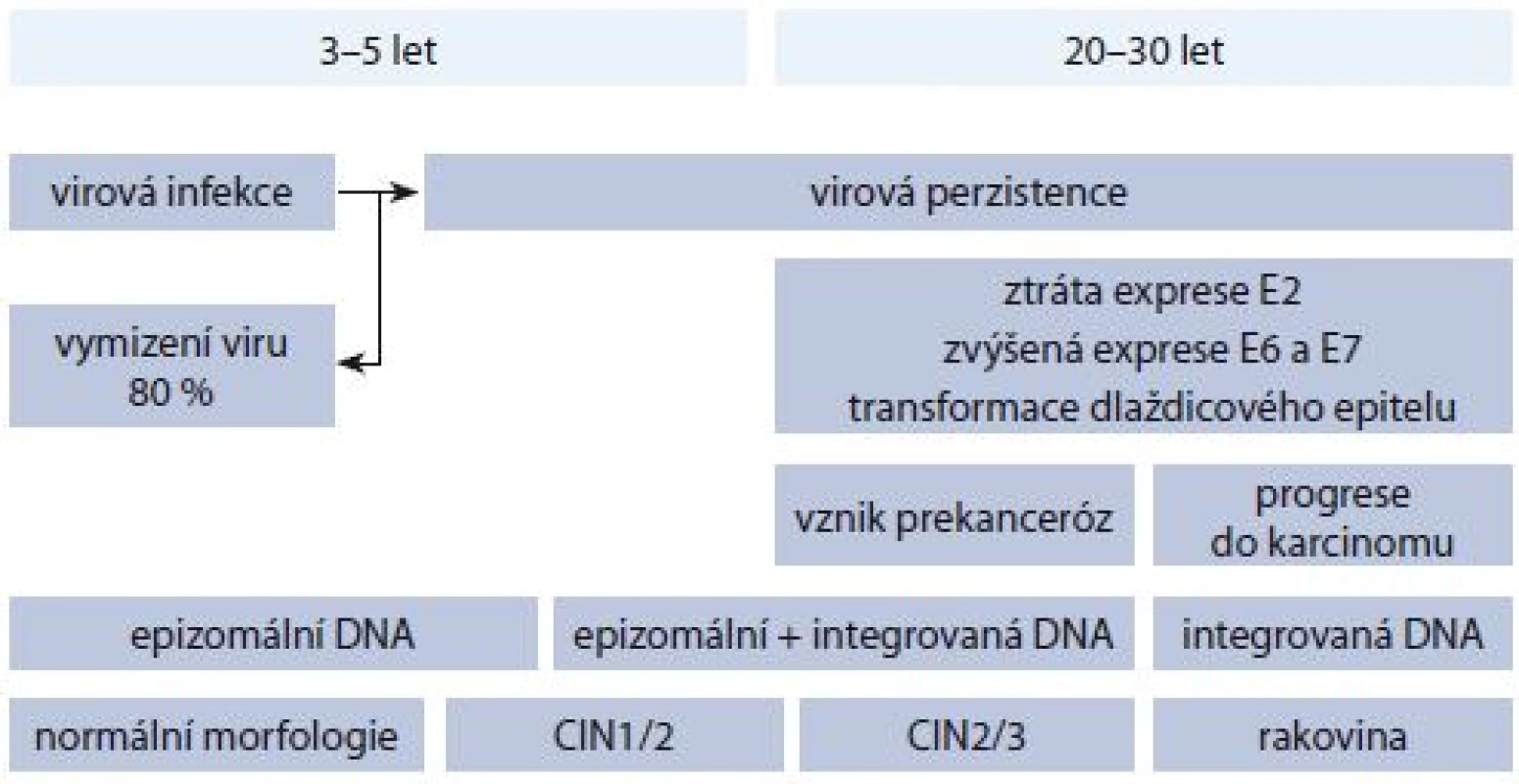
Z histologického hlediska dochází k transformaci epiteliální tkáně cervixu, vznikají tzv. cervikální intraepiteliální neoplazie (CIN) odstupňované dle progrese onemocnění jako CIN1, CIN2 a CIN3, přičemž u CIN1 a části CIN2 lézí může dojít ke spontánní regresi, aniž by byla potřebná konizace (mluvíme o tzv. produktivních lézích, odpovídajících dle nové nomenklatury low-grade skvamózním intraepiteliálním lézím (LSIL)). CIN3 a zbylá část CIN2 patří do tzv. transformujících lézí (odpovídajích high-grade skvamózním intraepiteliálním lézím (HSIL)), které jsou spojeny se zmíněnou deregulací a nadměrnou expresí E6 a E7, přičemž CIN3 je posledním předstupněm invazivního karcinomu. Bohužel z morfologického hlediska není možné rozlišit produktivní a transformující CIN2, a je tedy obtížné určit, zda infekce vymizí, nebo povede až ke vzniku karcinomu. Kromě samotného HPV testování se tak uvažuje o dalších biomarkerech, které by přesněji určily případy vyžadující léčbu. Mezi tyto markery patří kupříkladu mRNA transkripty genů E6 a E7 (produkty aktivní exprese těchto genů), jejichž zvýšená přítomnost poukazuje na přítomnost transformující léze [5]. Nedávná korejská studie např. uvádí až 91% citlivost a 98,6% specificitu pro detekci CIN2+ lézí (pro 337 vzorků) při použití HPV E6/E7 mRNA testu [6]. Autoři ovšem zdůrazňují, že bude zapotřebí provést rozsáhlejší klinické studie s heterogennějším výběrem populace s ohledem na geografické rozdíly.
Mezi další markery patří protein p16INK4a, jehož hladina se zvyšuje inaktivací pRb. Jedná se o inhibitor cyklin-dependentní kinázy regulující přechod z G1 do S fáze buněčného cyklu. I navzdory velké variabilitě v metodách a interpretacích dat existuje spousta studií popisujících korelaci mezi zvýšenou expresí p16INK4a a přítomností CIN2+ lézí [7]. Americká společnost pro kolposkopii a cervikální patologii dokonce doporučila imunohistochemické stanovení p16 u diagnosticky sporných lézí jakožto vhodnou metodu pro rozlišení prekanceróz za předpokladu výrazné „blokové“ pozitivity stanovení p16 [8]. Jako možné biomarkery jsou uvažovány i aberantní epigenetické změny (zejména v DNA metylaci) nebo změněné hladiny miRNA (viz níže).
Epigenetické změny DNA u HPV
Nejvíce studovaným epigenetickým mechanizmem ve spojitosti s cervikálními lézemi jsou metylace DNA, tj. modifikace 5’-uhlíku cytosinu v dinukleotidu CpG metylovou skupinou (za vzniku metylcytosinu). Například metylace promotoru má za následek „vypnutí“ exprese příslušného genu, a pokud je tímto promotorem kontrolována exprese nádorového supresorového genu, hypermetylace tohoto promotoru způsobí nižší expresi daného nádorového supresoru, což může vést až ke karcinogenezi.
I když jsou změněné metylační vzorce virové DNA v souvislosti s progresí karcinomu cervixu dobře známé, data získaná z různých studií jsou často nekonzistentní [9], zejména co se týká asociace mezi metylací v LCR regionu a CIN2+. Některé práce uvádějí pozitivní korelaci mezi frekvencí metylace v LCR a progresí onemocnění [10,11], jiné naopak ukazují sníženou metylaci (demetylaci) určitých promotorů v LCR u pacientů s CIN3 a rakovinou děložního hrdla v porovnání se zdravými jedinci [12]. To je pravděpodobně způsobeno různou přípravou klinických vzorků nebo analýzou odlišných CpG ostrůvků [13]. Zřejmě nejkonzistentnější výsledky vykazuje oblast genů L1 a L2, kde dochází ke zvýšené metylaci u karcinomů [14].
Mezi metody studia metylace DNA, které byly nedávno detailněji popsány v časopise Klinická onkologie [15], patří např. restrikční analýza v kombinaci s kvan-titativní polymerázovou řetězovou reakcí (quantitative polymerase chain reaction – qPCR), metylačně specifická PCR (methylation-specific PCR – MSP), MethyLight PCR (kombinace MSP a fluorescenčního měření pomocí TaqMan sondy) anebo MS-HRM (Methylation-Specific High Resolution Melting) přístup využívající rozdílných teplot tání dvouřetězcových DNA v závislosti na jejich sekvenci. Zmíněné metody využívají buď metylačně senzitivní restrikční endonukleázy rozeznávající a štěpící konkrétní restrikční místa v DNA v závislosti na přítomnosti metylcytosinu, anebo reakci DNA s hydrogensiřičitanem sodným (tzv. bisulfitovou konverzi), který konvertuje cytosin v DNA na uracil, přičemž metylcytosin zůstává nezměněn.
Post-transkripční regulace pomocí miRNA
Funkcí miRNA, tj. krátkých nekódujících jednořetězcových RNA o délce 18–22 nukleotidů, je post-transkripční regulace genové exprese vedoucí k degradaci cílové mRNA a následnému poklesu hladiny příslušného proteinu. miRNA vykazují funkci supresorovou i onkogenní, a proto jsou v současné době intenzivně studovány. Uvažuje se o jejich potenciálním využití jako diagnostických či prognostických biomarkerů, či dokonce v terapii.
Z těchto důvodů byly provedeny celogenomové studie zaměřené na expresi miRNA v cervikálních lézích, ovšem pouze několik miRNA sekvencí se ukázalo být konzistentně změněno napříč těmito studiemi [13]. Nejčastěji uváděné nádorové supresorové miRNA jsou miR-143, miR-145 a miR-214, naopak za onkogenní miRNA jsou považovány např. miR-21 a miR-146a [13,16]. Pro definitivní validaci vybraných miRNA bude ovšem potřeba provést více nezávislých studií a rovněž popsat přesnou roli jednotlivých miRNA v karcinogenezi indukované virem HPV.
Současné testování HPV
Aktuálně se v ČR na přítomnost HPV testují pouze 4 % pacientek s abnormální cytologií s nejasným významem. Cytologie z tekutého media (liquid-based cytology – LBC) je odběrová metoda založená na klasickém Pap testu, avšak odebraný vzorek se místo přímé fixace na sklíčku umísťuje do vhodného média (komerčně pod názvem ThinPrep Pap Test) [17]. Tento postup je vhodný i pro diagnostiku DNA HPV bez nutnosti dvou odběrů. Z roztoku se izolovaná DNA/RNA testuje pomocí komerčně dostupných testovacích sad [18]. Většina testovacích sad je schopná detekovat přítomnost několika HPV typů, a to včetně rozlišení HR/LR HPV a konkrétní genotypizace. Standardně se provádí detekce HPV 16 a HPV 18 (Cervista HPV 16/18 Assay, Hologic), ale existují testy, které zvládnou až 37 genotypů současně (LINEAR ARRAY® HPV Genotyping Test, Roche).
Spousta komerčních HPV testů je založena na PCR amplifikaci a následné hybridizaci. Hlavní rozdíly mezi testy pak tkví v používaných primerech a způsobech detekce. Dalším rozdílem je izolace DNA pro amplifikaci, kterou lze provádět pomocí kolonek (HC2 High-Risk HPV DNA Test, Qiagen) nebo magnetických kuliček (RealTime High Risk HPV, Abbott). Nevýhodou mnoha testovacích sad je jejich zaměření na přítomnost L1 genu (kódujícího hlavní kapsidový protein) [17], který však může být deletován v průběhu integrace virové DNA do lidského genomu. V případě, že L1 region nebude přítomen, DNA HPV test bude falešně negativní [19]. Na trhu se však objevuje stále více testů, které obsahují primery i pro E6/E7 kódující oblast, např. AMPLICOR® Human Papillomavirus Test (Roche) se schválením CE-IVD, které jsou klíčové pro maligní transformaci způsobenou HPV.
Stále více se také rozšiřuje přístup spočívající v hybridizaci amplifikované DNA na sondy vázané na nitrocelulózové proužky, který současně poskytuje informace o genotypu HPV, nicméně tato metodika je náročnější na přístrojové vybavení (INNO-LiPA HPV Genotyping, Innogenetics). Odlišný přístup bez nutnosti PCR amplifikace je použití hybridizační techniky k detekci virové DNA pomocí RNA sondy. Po navázání vzniká DNA/RNA duplex, který je zachytáván protilátkou specifickou pro hybridní molekuly. Následná detekce probíhá vazbou další protilátky s vhodnou detekční značkou. Příkladem tohoto přístupu může být HC2 High-Risk HPV DNA Test (Qiagen). Dalším možným způsobem detekce cílené na E6/E7 oblast je test ZytoFast HPV-Typing ISH Kit (ZytoVision). Test dokáže pomocí značených DNA sond detekovat DNA i RNA a rozpoznávat i různé typy HPV. Tento test je určen pro hybridizaci in situ (chromogenic in situ hybridization), tudíž je vhodnější spíše pro bioptické vzorky.
Další možností detekce E6/E7 oblasti HPV může být zaměření se na mRNA, např. pomocí testu Aptima HPV Assay (Hologic), také se schválením CE-IVD. Cílená detekce E6/E7 mRNA může specifikovat stadium onemocnění, neboť její hladina s progresí onemocnění stoupá.
Plošné testování HPV, zavedené např. ve Spojených státech, prodloužilo interval mezi preventivními cytologickými vyšetřeními v podobě Pap testů na dobu 3 let (naopak v ČR jsou cytologická vyšetření prováděna 1× ročně) a zmíněné HPV testování je prováděno každých 5 let (zavedeno pro pacientky nad 30 let) [20].
Nové přístupy detekce HPV
Kromě komerčně dostupných kitů pro detekci HPV DNA, popsaných v předešlé kapitole, jsou vyvíjeny nové metody, jejichž ambicí je učinit existující HPV testování cenově dostupnější a instrumentálně méně náročné. I tyto přístupy většinou využívají hybridizace DNA mezi hledanou sekvencí HPV DNA a vhodnou DNA sondou, a to přímo v roztoku nebo na vhodném pevném povrchu, např. magnetických kuličkách, obvykle s využitím fluorescenčních nebo elektrochemických metod detekce.
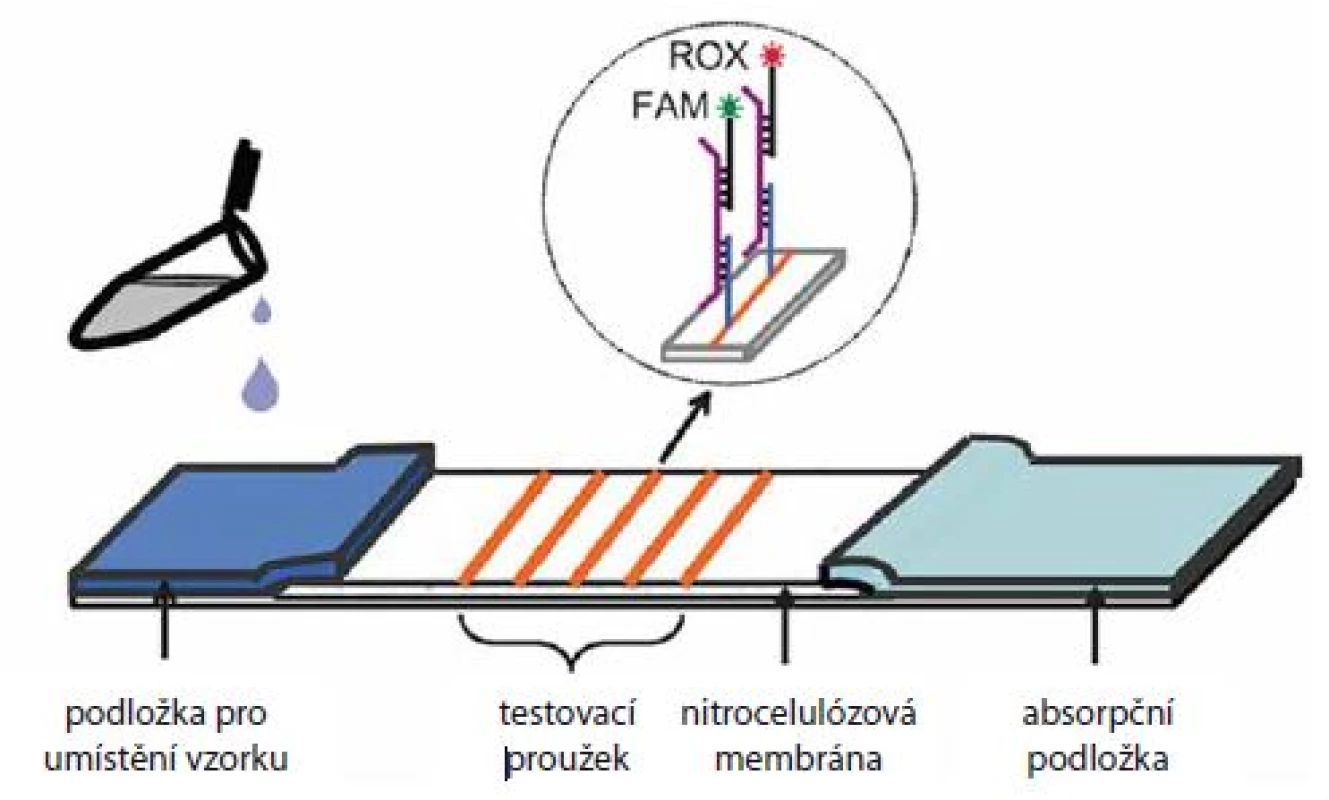
Jedním z příkladů uživatelsky příjemné alternativy ke stávajícím přístupům by mohl být tzv. dipstick test, který je do značné míry podobný jednorázovým těhotenským testům. Nedávno byl vyvinut dipstick test na bázi laterálního proudění (lateral flow dipstick), obsahující nitrocelulózovou membránu pokrytou DNA vazebnými sondami pro detekci 13 onkogenních typů HPV [21] (obr. 3). Vzorek obsahující HPV DNA byl nejdřív amplifikován pomocí asymetrické PCR, jednořetězcové amplikony byly následně hybridizovány s vazebnými sondami na různých místech membrány a detekce byla provedena pomocí DNA sond fluorescenčně značených molekulami ROX a FAM. Zvýšená fluorescence jedné z fluorescenčních barev, vždy na jiném místě membrány, pak znamenala přítomnost daného HPV typu. Dipstick byl úspěšně validován na klinickém materiálu s > 98% konkordancí s komerčně dostupným kitem GenoArray (Hybribio). Další dipstick test s fluorescenční detekcí využil namísto PCR tzv. izotermální amplifikaci [22]. Na rozdíl od PCR reakce, která vyžaduje termocykler (z důvodu cyklování teplot) a delší čas, dokáže speciální polymeráza, při izotermální amplifikaci amplifikovat DNA při konstantní teplotě (obvykle kolem 60 °C) během kratší doby (za < 1 hod). Autoři prezentovali úspěšné rozlišení kmenů HPV 16 a HPV 18 u klinických vzorků a předpokládají, že by test mohl být aplikován v menších nemocnicích a klinikách. Výhodou fluorescenčního měření je vysoká citlivost a možnost paralelního stanovení velkého množství vzorků současně (několik desítek až stovek). Často ovšem vyžaduje náročnější instrumentaci a relativně drahé fluorescenční barvy.
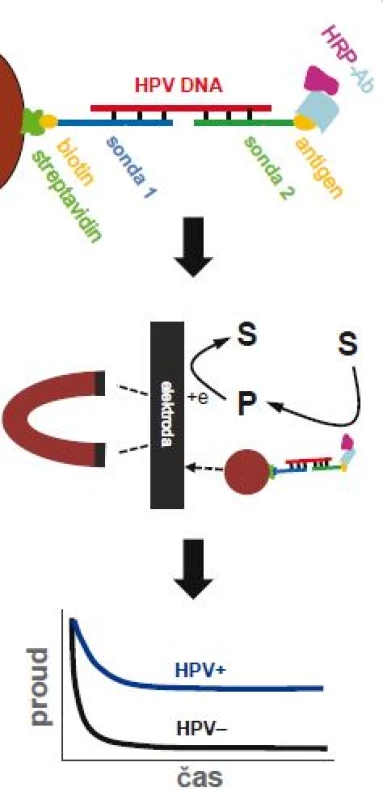
Elektrochemická analýza představuje zajímavou, i když zatím méně používanou alternativu ve srovnání se stávajícími metodami založenými zejména na optické detekci [23]. Nabízí relativně levnou, rychlou a přístrojově nenáročnou možnost detekce na miniaturizovaných čipech. V posledních několika letech pozorujeme výrazný nárůst počtu prací na téma elektrochemické detekce DNA, zejména co se týká aplikace v onkologickém výzkumu [24]. Objevilo se i několik strategií pro stanovení přítomnosti DNA pocházející z HPV 16 [25,26], ovšem ne všechny práce demonstrovaly použitelnost metody na klinických vzorcích. Nedávno byl vyvinut rychlý elektrochemický test pro detekci HPV 16 aplikovatelný i na klinickém materiálu [27]. Pomocí magnetických kuliček byla ze vzorků DNA (izolovaných z kartáčkových stěrů) separována virová DNA z HPV 16 a po PCR amplifikaci byla sledována elektrochemická odezva na elektrodových čipech, které umožňují paralelní detekci více vzorků (obr. 4). Test dokázal úspěšně rozlišit HPV 16 od HPV 18 a výsledky z kartáčkových stěrů dobře korelovaly se standardními metodami. Pro širší použití elektrochemických metod je nicméně zapotřebí jejich rozsáhlejší validace na klinických vzorcích.
Další zajímavou a relativně jednoduchou možností je amplifikace virové DNA spojená s kolorimetrickou [28,29] nebo turbidimetrickou detekcí [30], a to bez nutnosti hybridizace s DNA sondou. Jinými slovy, pokud neznámý vzorek obsahuje virovou DNA, dojde k její amplifikaci a díky exponenciálnímu nárůstu množství DNA ve vzorku dochází i ke změně vlastností roztoku, případně dochází k četnějším interakcím amplikonů s vhodně zvolenou látkou. Pokud se kupříkladu do reakce přidá komplex kalceinu a iontů manganu, je možné detekovat vznik amplikonů kolorimetricky. Během amplifikace se uvolňuje pyrofosfát, který ionty manganu váže na sebe, tím je kalcein uvolněn do roztoku a dochází ke změně barvy z oranžové na žlutozelenou [28]. Turbidimetrické měření využívá skutečnosti, že během amplifikace nastává vysrážení uvolněného pyrofosfátu v přítomnosti hořečnatých iontů, což vede k zakalení roztoku (zvýšení turbidity) [30]. Výhodou obou metod je možnost stanovení přítomnosti virové DNA pouhým okem (díky změně barvy, resp. zákalu), ovšem za cenu poněkud nižší citlivosti.
Závěr a výhled do budoucnosti
I když diagnostika i prevence cervikálních lézí za poslední léta doznala velkého pokroku, a to zejména díky zavedení LBC či HPV testování, resp. díky vývoji vakcín proti onkogenním genotypům HPV a jejich zavedení do praxe, nádory děložního hrdla stále patří mezi nejrozšířenější ženské malignity s vysokou mortalitou zejména v rozvojových zemích, kde spolehlivé screeningové programy chybí.
V ČR je stav lepší, i když i zde je mortalita v porovnání se zeměmi západní Evropy relativně vysoká. Zřejmě i díky adresnému zvaní na preventivní prohlídky (zavedenému v roce 2014) však roste počet žen, které podstupují screeningové vyšetření (čímž roste i incidence), zároveň však dochází k mírnému poklesu mortality. V současnosti je vyšetření přítomnosti nukleové kyseliny vysoce rizikových kmenů HPV v cervikálním stěru hrazeno pouze ženám se sporným cytologickým nálezem nebo jako kontrola konizačního či ablačního výkonu (konkrétně se jedná o výkon č. 95201). Předpokládá se, že implementace HPV testování do rutinního screeningového vyšetření by mohla ještě výrazněji napomoci ke snížení mortality. Avšak aby k tomu skutečně došlo, bude zřejmě zapotřebí zlevnit HPV testování tak, aby bylo cenově konkurenceschopné se stávajícími cytologickými vyšetřeními.
Práce byla podpořena grantem MŠMT-NPU ILO1413 a GAČR 17-08971S.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Obdrženo: 25. 9. 2017
Přijato: 26. 1. 2018
Mgr. Martin Bartošík, Ph.D.
RECAMO Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: martin.bartosik@mou.cz
Sources
1. Burd EM. Human papillomavirus and cervical cancer. Clin Microbiol Rev 2003; 16 (1): 1–17.
2. Schiffman M, Castle PE, Jeronimo J et al. Human papillomavirus and cervical cancer. Lancet 2007; 370 (9590): 890–907. doi: 10.1016/S0140-6736 (07) 61416-0.
3. Zheng ZM, Baker CC. Papillomavirus genome structure, expression, and post-transcriptional regulation. Front Biosci 2006; 11 : 2286–2302.
4. Graham SV. Human papillomavirus: gene expression, regulation and prospects for novel diagnostic methods and antiviral therapies. Future Microbiol 2010; 5 (10): 1493–1506. doi: 10.2217/fmb.10.107.
5. Origoni M, Cristoforoni P, Carminati G et al. E6/E7 mRNA testing for human papilloma virus-induced high-grade cervical intraepithelial disease (CIN2/CIN3): a promising perspective. Ecancermedicalscience 2015; 9 : 533. doi: 10.3332/ecancer.2015.533.
6. Munkhdelger J, Kim G, Wang HY et al. Performance of HPV E6/E7 mRNA RT-qPCR for screening and diagnosis of cervical cancer with ThinPrep® Pap test samples. Exp Mol Pathol 2014; 97 (2): 279–284. doi: 10.1016/j.yexmp.2014.08.004.
7. Cuschieri K, Wentzensen N. Human papillomavirus mRNA and p16 detection as biomarkers for the improved diagnosis of cervical neoplasia. Cancer Epidemiol Biomarkers Prev 2008; 17 (10): 2536–2545. doi: 10.1158/1055-9965.EPI-08-0306.
8. Darragh TM, Colgan TJ, Cox JT et al. The Lower anogenital squamous terminology standardization project for HPV-associated lesions: background and consensus recommendations from the college of american pathologists and the american society for colposcopy and cervical pathology. Arch Pathol Lab Med 2012; 136 (10): 1266–1297. doi: 10.5858/arpa.LGT200570.
9. Clarke MA, Wentzensen N, Mirabello L et al. Human papillomavirus DNA methylation as a potential biomarker for cervical cancer. Cancer Epidemiol Biomarkers Prev 2012; 21 (12): 2125–2137. doi: 10.1158/1055-9965.EPI-12-0905.
10. Bhattacharjee B, Sengupta S. CpG methylation of HPV 16 LCR at E2 binding site proximal to P97 is associated with cervical cancer in presence of intact E2. Virology 2006; 354 (2): 280–285. doi: 10.1016/j.virol.2006.06.018.
11. Vinokurova S, von Knebel Doeberitz M. Differential methylation of the HPV 16 upstream regulatory region during epithelial differentiation and neoplastic transformation. Plos One 2011; 6 (9): e24451. doi: 10.1371/journal.pone.0024451.
12. Hublarová P, Hrstka R, Rotterová P et al. Prediction of human papillomavirus 16 E6 gene expression and cervical intraepithelial neoplasia progression by methylation status. Int J Gynecol Cancer 2009; 19 (3): 321–325. doi: 10.1111/IGC.0b013e31819d8a5c.
13. Steenbergen RD, Snijders PJ, Heideman DA et al. Clinical implications of (epi) genetic changes in HPV-induced cervical precancerous lesions. Nat Rev Cancer 2014; 14 (6): 395–405. doi: 10.1038/nrc3728.
14. Kalantari M, Chase DM, Tewari KS et al. Recombination of human papillomavirus-16 and host DNA in exfoliated cervical cells: A pilot study of L1 gene methylation and chromosomal integration as biomarkers of carcinogenic progression. J Med Virol 2010; 82 (2): 311–320. doi: 10.1002/jmv.21676.
15. Bartošík M, Ondroušková E. Nové metody studia metylace DNA – MS-HRM analýza a elektrochemie. Klin Onkol 2016; 29 (Suppl 4): 64–71. doi: 10.14735/amko20164S64.
16. Sharma G, Dua P, Agarwal SM. A comprehensive review of dysregulated miRNAs involved in cervical cancer. Curr Genomics 2014; 15 (4): 310–323. doi: 10.2174/1389202915666140528003249.
17. Ondryášová H, Koudeláková V, Hajdúch M. Karcinom cervixu – možnosti detekce lidského papilomaviru. Čes Gynek 2013; 78 (3): 289–294.
18. Ronco G, Segnan N, Giorgi-Rossi P et al. Human papillomavirus testing and liquid-based cytology: results at recruitment from the new technologies for cervical cancer randomized controlled trial. J Natl Cancer Inst 2006; 98 (11): 765–774. doi: 10.1093/jnci/djj209.
19. Morris BJ. Cervical human papillomavirus screening by PCR: advantages of targeting the E6/E7 region. Clin Chem Lab Med 2005; 43 (11): 1171–1177. doi: 10.1515/CCLM.2005.203
20. The American cancer society medical and editorial content team. HPV and HPV Testing. [online]. Available from: https: //www.cancer.org/cancer/cancer-causes/infectious-agents/hpv/hpv-and-hpv-testing.html.
21. Xu Y, Liu Y, Wu Y et al. Fluorescent probe-based lateral flow assay for multiplex nucleic acid detection. Anal Chem 2014; 86 (12): 5611–5614. doi: 10.1021/ac5010458.
22. Kumvongpin R, Jearanaikoon P, Wilailuckana C et al. Detection assay for HPV16 and HPV18 by loop-mediated isothermal amplification with lateral flow dipstick tests. Mol Med Rep 2017; 15 (5): 3203–3209. doi: 10.3892/mmr.2017.6370.
23. Bartošík M, Paleček E, Vojtěšek B. Elektrochemická analýza nukleových kyselin, bílkovin a polysacharidů v biomedicíně. Klin Onkol 2014; 27 (Suppl 1): 53–60. doi: 10.14735/amko20141S53.
24. Paleček E, Bartošík M. Electrochemistry of nucleic acids. Chem Rev 2012; 112 (6): 3427–3481. doi: 10.1021/cr200303p.
25. Huang H, Bai W, Dong C et al. An ultrasensitive electrochemical DNA biosensor based on graphene/Au nanorod/polythionine for human papillomavirus DNA detection. Biosens Bioelectron 2015; 68 : 442–446. doi: 10.1016/j.bios.2015.01.039.
26. Karimizefreh A, Mahyari FA, VaezJalali M et al. Impedimetic biosensor for the DNA of the human papilloma virus based on the use of gold nanosheets. Microchim Acta 2017; 184 (14): 1729–1737. doi: 10.1007/s00604-017-2173-8.
27. Bartošík M, Ďuríková H, Vojtěšek B et al. Electrochemical chip-based genomagnetic assay for detection of high-risk human papillomavirus DNA. Biosens Bioelectron 2016; 83 : 300–305. doi: 10.1016/j.bios.2016.04.035.
28. Lin J, Ma B, Fang J et al. Colorimetric detection of 23 human papillomavirus genotypes by loop-mediated isothermal amplification. Clin Lab 2017; 63 (3): 495–505. doi: 10.7754/Clin.Lab.2016.160906.
29. Persano S, Valentini P, Kim JH et al. Colorimetric detection of human papilloma virus by double isothermal amplification. Chem Commun 2013; 49 (90): 10605–10607. doi: 10.1039/c3cc45459b.
30. Saetiew C, Limpaiboon T, Jearanaikoon P et al. Rapid detection of the most common high-risk human papillomaviruses by loop-mediated isothermal amplification. J Virol Methods 2011; 178 (1–2): 22–30. doi: 10.1016/j.jviromet.2011.08.007.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2018 Issue 2
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Human Papillomavirus – Role in Cervical Carcinogenesis and Methods of Detection
- Anogenital HPV Infection as the Potential Risk Factor for Oropharyngeal Carcinoma
- Treatment of Metastatic Renal Cell Carcinoma
- New Approaches for Chemosensitivity Testing in Malignant Diseases
- Quality of Life After High-dose Brachytherapy in Patients with Early Oral Carcinoma
- MAPK/ERK signal pathway alterations in patients with Langerhans Cell Histiocytosis
- Recent Trends in Survival of Testicular Cancer Patients – Nation-wide Population Based Study
- Cutaneous and Subcutaneous Metastases of Adenocarcinoma as a Dominant Clinical Manifestation of Malignancy of Unknown Origin – a Case Report
- Diagnostic, Prognostic and Predictive Immunohistochemistry in Malignant Melanoma of the Skin
- Long Non-coding RNAs as Regulators of the Mitogen-activated Protein Kinase (MAPK) Pathway in Cancer
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Cutaneous and Subcutaneous Metastases of Adenocarcinoma as a Dominant Clinical Manifestation of Malignancy of Unknown Origin – a Case Report
- MAPK/ERK signal pathway alterations in patients with Langerhans Cell Histiocytosis
- Long Non-coding RNAs as Regulators of the Mitogen-activated Protein Kinase (MAPK) Pathway in Cancer
- Human Papillomavirus – Role in Cervical Carcinogenesis and Methods of Detection
