Extrakraniální stereotaktická radioterapie – přehled současných indikací
Stereotactic Body Radiotherapy – Current Indications
Background:
Stereotactic body radiotherapy (SBRT) is used to treat localized tumor lesions and consists of applying high doses of radiation to a small number of fractions using specially equipped linear accelerators, modern immobilization devices, and imaging methods, which are considered special, advanced techniques in modern day radiotherapy. SBRT is a very well tolerated, non-invasive, short-term treatment that does not require hospitalization or any complicated preparation. Compared to standard radiotherapy techniques, SBRT allows, due to its precision, significantly higher doses to be applied to the target with less damage to surrounding healthy tissues. If dose constraints are not exceeded, the risk of damage to tissues and organs around the irradiated volume is reduced to minimum. The principle of SBRT is the application of ablative doses of radiation that cause necrosis of the irradiated tissue.
Purpose:
The aim of this review is to provide a basic overview of SBRT indications, radiation doses used, and potential side effects. It is not intended to be a detailed description of treatment itself (such as discussion of patient fixation systems, management of respiratory movements, or image guided strategies of treatment). This review also discusses rarer indications for SBRT, such as pancreatic carcinoma or hepatocellular carcinoma.
Conclusion:
Advances in image navigation, radiation planning, and dose application have enabled successful introduction of SBRT as a treatment regimen for many primary tumors and oligometastatic disease. If surgery is not possible or the patient refuses surgery, it is always reasonable to consider SBRT. SBRT has curative potential for the treatment of primary lung or prostate tumors. High-dose irradiation of oligometastases of various primary tumors can lead to long-term survival without disease symptoms, delay administration of toxic systemic therapies, and improve the quality of life of oncological patients.
Key words
radiotherapy – stereotactic body radiotherapy – review – ablative radiotherapy – lung cancer – prostate cancer – oligometastatic disease
This work was supported in part by the Ministry of Health, Czech Republic – Conceptual Development of Research Organization (MMCI 00209805). The results of this research have been acquired within CEITEC 2020 (LQ1601) project with the financial contribution made by the Ministry of Education, Youths and Sports of the Czech Republic within special support paid from the National Programme for Sustainability II funds.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted: 30. 10. 2018
Accepted: 4. 11. 2018
Authors:
P. Burkoň 1,2; M. Slavik 1,2; T. Kazda 1,2,3; P. Pospíšil 1,2
; T. Prochazka 1,2; M. Vrzal 1; P. Šlampa 1,2
Authors‘ workplace:
Klinika radiační onkologie, Masarykův onkologický ústav, Brno
1; Klinika radiační onkologie, LF MU, Brno
2; CEITEC – Středoevropský technologický institut, Masarykova univerzita, Brno
3
Published in:
Klin Onkol 2019; 32(1): 10-24
Category:
Review
doi:
https://doi.org/10.14735/amko201910
Overview
Východiska:
Extrakraniální stereotaktická radioterapie (stereotactic body radiotherapy – SBRT) je způsob léčby lokalizovaných nádorových lézí aplikací vysokých dávek ionizujícího záření v malém počtu frakcí pomocí speciálně vybavených lineárních urychlovačů a s využitím moderních imobilizačních pomůcek a zobrazovacích metod. Jde o speciální techniky moderní radioterapie. SBRT je velmi dobře tolerovaná, neinvazivní, krátkodobá léčba, která nevyžaduje hospitalizaci ani žádnou složitou speciální přípravu. Oproti standardním radioterapeutickým technikám umožňuje díky své přesnosti aplikovat výrazně vyšší dávky záření. Dodržením dávkových limitů klesá riziko poškození zdravých tkání a orgánů v okolí ozářeného objemu na minimum. Principem SBRT je aplikace ablativní dávky záření, která způsobí nekrózu ozářeného ložiska. Jako ablativní metoda nabízí neinvazivní alternativu k chirurgické resekci či radiofrekvenční ablaci.
Cíl:
Cílem tohoto přehledového článku je přinést čtenáři základní přehled indikací SBRT, používaných dávek záření a možných nežádoucích účinků, nikoli detailní popis přípravy ozařovacích plánů či samotného provedení léčby (jako je např. diskuze o možnostech fixace pacientů, o managementu dýchacích pohybů nebo o strategii řízení léčby obrazem). Součástí přehledového článku je také diskuze o vzácnějších indikacích SBRT, jako jsou karcinomy slinivky břišní nebo hepatocelulární karcinom.
Závěr:
Pokroky v obrazové navigaci, plánování a aplikaci dávky záření vedly k úspěšnému zavedení SBRT do léčebných schémat řady primárních nádorů i oligometastatického onemocnění. Tam, kde není resekce možná, popř. ji pacient odmítne, je vždy vhodné o SBRT uvažovat. V léčbě primárních nádorů plic či prostaty má SBRT kurativní potenciál. Vysokodávkované ozáření oligometastáz různých primárních nádorů může vést k dlouhodobému přežití bez příznaků nemoci (disease free survival – DFS), popř. může pomoci oddálit nasazení toxické systémové léčby, a tím podstatně zlepšit kvalitu života onkologických pacientů.
Klíčová slova
radioterapie – extrakraniální stereotaktická radioterapie – přehled – ablativní radioterapie – nádory plic – nádory prostaty – oligometastatické onemocnění
Úvod
Extrakraniální stereotaktická radioterapie (stereotactic body radiotherapy – SBRT / stereotaktická ablativní radioterapie – SABR) je způsob léčby lokalizovaných nádorových lézí aplikací vysokých dávek ionizujícího záření v malém počtu frakcí pomocí speciálně vybavených lineárních urychlovačů a s využitím moderních imobilizačních pomůcek a zobrazovacích metod. Jde o speciální techniky moderní radioterapie (RT).
Pro pacienty je důležité, že se jedná o velmi dobře tolerovanou, neinvazivní, krátkodobou léčbu, která nevyžaduje hospitalizaci ani žádnou složitou speciální přípravu. Oproti standardním RT technikám umožňuje SBRT díky své přesnosti aplikovat výrazně vyšší dávky za menšího poškození okolních zdravých tkání. Principem SBRT je aplikace ablativní dávky záření, která způsobí nekrózu ozářeného ložiska. Stereotaktické systémy mohou mít různou podobu, ale tento princip je vždy stejný.
Vynikající lokální kontrola (local control – LC), zlepšení parametru celkového přežití (overall survival – OS) a minimální vedlejší účinky zařadily SBRT mezi standardní metody léčby lokalizovaných nemalobuněčných karcinomů plic (non-small cell lung cancer – NSCLC) a oligometastatického postižení různých lokalizací a různých primárních nádorů [1–4]. SBRT jako ablativní metoda nabízí neinvazivní alternativu k chirurgické resekci či radiofrekvenční ablaci (RFA).
Cílem tohoto přehledového článku je přinést čtenáři základní přehled indikací, používaných dávek záření a možných nežádoucích účinků, nikoli detailní popis praktických aspektů přípravy ozařovacích plánů či popis samotného provedení této léčby (jako je např. diskuze o možnostech fixace pacientů, o managementu dýchacích pohybů nebo o strategii řízení léčby obrazem).
SBRT u nemalobuněčného karcinomu plic
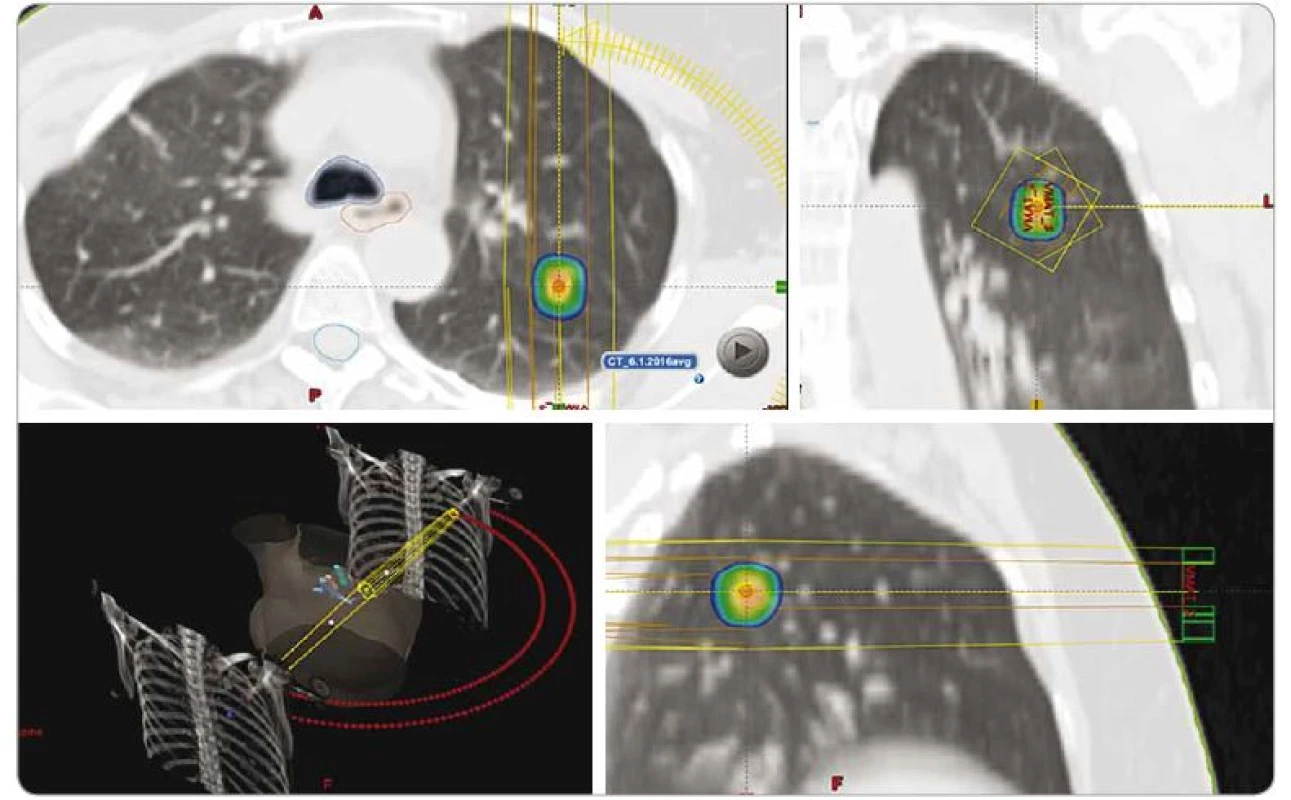
Plicní karcinom je nejčastějším solidním nádorem s největší mírou úmrtnosti na celém světě [5]. V případě I. klinického stadia, není-li léčeno, je medián OS pouhých 9 měsíců a jen 7 % pacientů se dožije 5 let. Za standardní metodu léčby časných stadií NSCLC je považována lobektomie s 5letým OS mezi 60–70 % [6]. Efektivita konvenční RT je v této indikaci poměrně nízká. Tři roky od léčby je LC jen mezi 40–60 % a OS pacientů mezi 20–35 % [7]. Ve studiích využívajících SBRT jsou výsledky výrazně lepší, zejména pokud biologický ekvivalent aplikované dávky přesáhne BED10 ≥ 100 Gy. V těchto případech je popisována 3 roky po léčbě LC mezi 85–95 % a OS mezi 60–80 % [8–12]. Biologicky efektivní dávka je hypotetická dávka, která vede ke stejnému efektu, jako by se posuzované schéma záření podalo kontinuálním ozařováním s nízkým dávkovým příkonem. BED umožňuje srovnávat účinnost různých frakcionačních schémat pro daný typ tkáně.
Podle doporučení National Comprehensive Cancer Network (NCCN) (verze 6/2018) je SBRT doporučena pacientům I. klinického stadia NSCLC, kteří jsou medicínsky inoperabilní nebo kteří operaci odmítají [13–15]. Nerandomizované a populační studie u neoperabilních a starších pacientů prokázaly srovnatelnou lokální kontrolu i celkové přežití SBRT ve srovnání s lobektomií. SBRT je také vhodnou metodou pro pacienty s vysokým operačním rizikem, schopné tolerovat pouze parciální, klínovitou resekci, nikoli však lobektomii (věk ≥ 75 let, špatné funkce plic). Kombinovaná analýza dvou randomizovaných studií srovnávajících SBRT oproti lobektomii u operabilních pacientů poukázala na obdobné výsledky a lepší profil toxicity ve prospěch stereotaktického ozáření [16]. Z důvodu nedostatečného náboru pacientů v obou studiích však tato analýza nemá dostatečnou váhu ke změně standardní péče o pacienty schopné operačního výkonu, nicméně výrazně posiluje indikaci SBRT u pacientů s relativními kontraindikacemi operace nebo u těch, kteří operaci odmítají. Chirurgii jako metodu první volby potvrzují rovněž práce, které prokázaly vyšší výskyt lokoregionálních (uzlinových) recidiv po SBRT než po chirurgické léčbě [17]. V současné době probíhají randomizované studie, které by měly rozdíl mezi chirurgií a SBRT definitivně zhodnotit [18–20].
Základními indikačními kritérii SBRT u plicních karcinomů jsou N0 pacienti s dobře lokalizovanými periferními tumory o velikosti < 5 cm (obr. 1). Rozšířená kritéria zahrnují velikost < 7 cm, centrální lokalizaci, více synchronních lézí, popř. invazi hrudní stěny. V těchto případech se s výhodou uplatňuje frakcionovaná SBRT, popř. je nutná redukce dávky (tab. 1) [21–30].
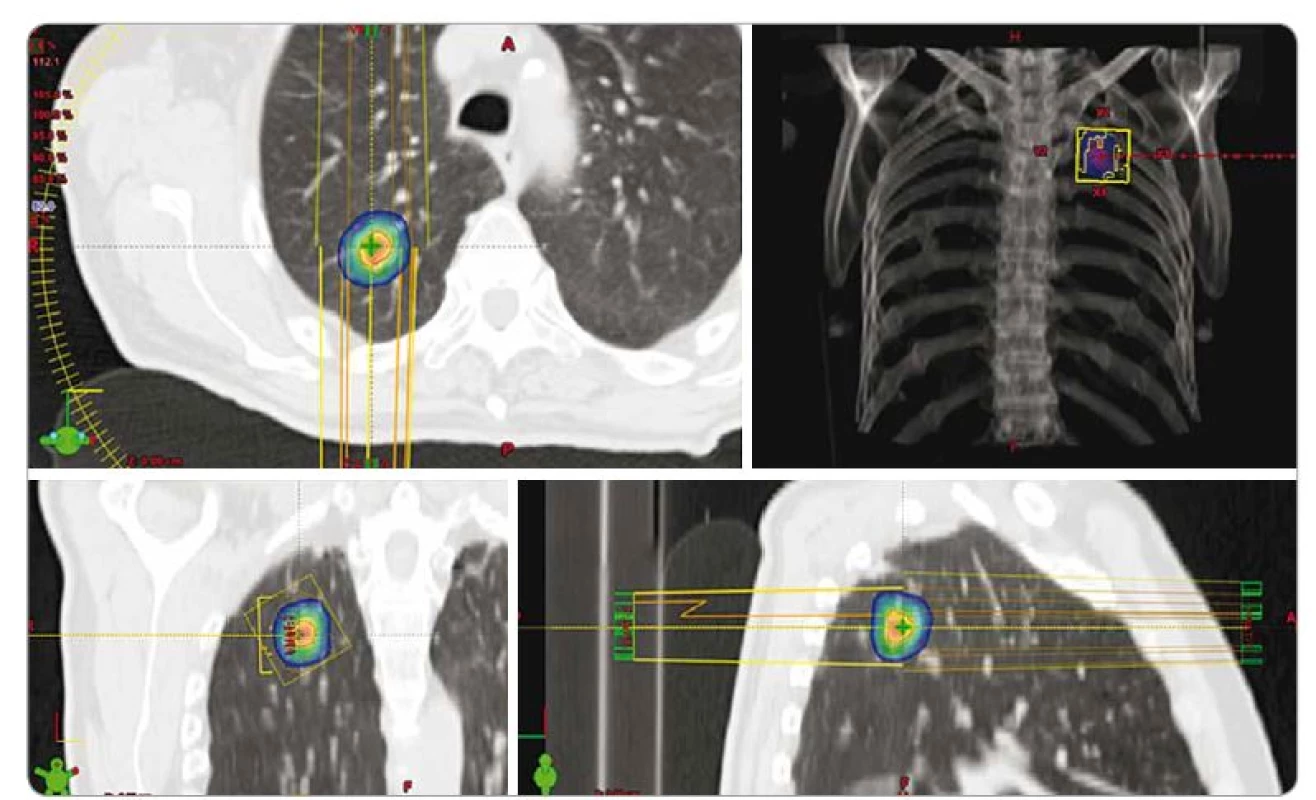
![Vybrané studie stereotaktické radioterapie při léčbě nemalobuněčného karcinomu plic [21–30].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/bdc4368a5e3c451506f3f18937e30b62.jpeg)
SBRT se rovněž začíná uplatňovat v indikaci boost ozáření po ukončení kurativní RT či kombinované chemoradioterapie pokročilých NSCLC, popř. při léčbě recidiv plicních karcinomů. V takových případech je indikace i samotné provedení SBRT přísně individuální.
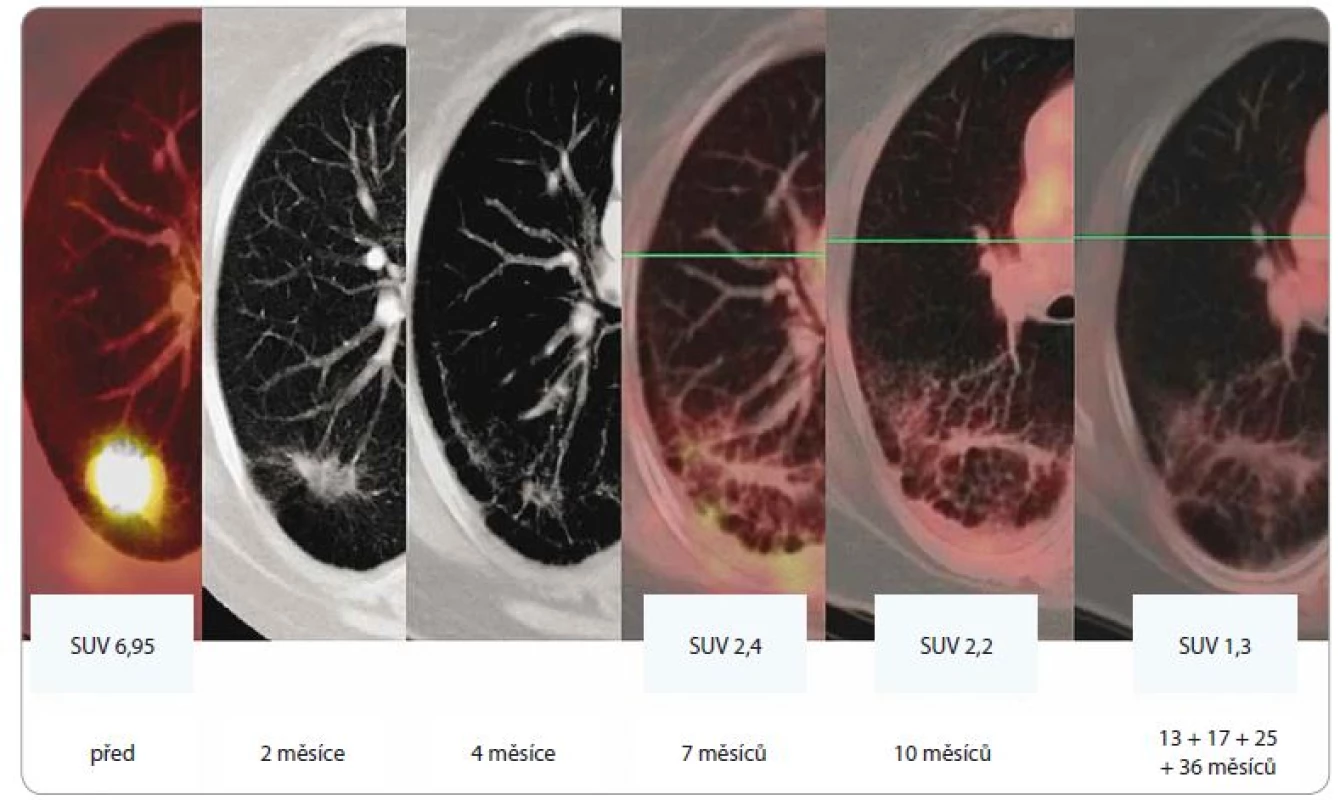
Principem SBRT je aplikace „ablativní“ dávky záření, která způsobí nekrózu ozářeného ložiska. Podle provedených studií je dávka odpovídající BED10 = 100 Gy a vyšší signifikantně účinnější než dávky nižší [9]. Jednoznačně byla výhoda intenzifikovaných režimů (BED10 ≥ 100 Gy) prokázána u periferně lokalizovaných NSCLC. V případě těchto nádorů se běžně používá dávkování 1 × 25–34 Gy, 3 × 18 Gy, 4 × 12 Gy a 5 × 11 Gy (obr. 2). V posledních letech se autoři zaměřují na hodnocení efektivity a toxicity SBRT v léčbě centrálně uložených nádorů (do 2 cm od bronchiálního stromu), popř. nádorů větších rozměrů (> 5 cm, > 100 ccm). V takových případech je doporučeno frakcionovat (rozdělit celkovou dávku do více menších frakcí) – nejčastěji je indikováno 5 × 10 Gy, popř. 8 × 7,5 Gy s event. redukcí s ohledem na rizikové struktury v okolí [31–35].
SBRT – extrakraniální stereotaktická radioterapie, PTV – plánovací cílový objem, D – dávka záření, Gy – Gray
Jednotlivé rizikové struktury musí být při plánování RT konturovány tak, aby bylo možné vyhodnotit dávku pomocí dávkově-objemových histogramů. Dávkové limity jsou uvedeny v příslušných tabulkách vycházejících ze zkušeností řady center či údajů renomovaných časopisů [36].
Spád dávky záření do okolí cílového objemu lze posoudit např. podle poměru objemu izodózy, na kterou je předepisována dávka, a objemu PTV (planning target volume), poměru objemu 50% izodózy a objemu PTV a maximální dávky ve vzdálenosti 2 cm od PTV ve všech směrech [37].
Při dodržení všech dávkových tolerančních limitů je výskyt nežádoucích účinků velmi nízký. Přesto se lze setkat jak s akutní, tak pozdní toxicitou. Mezi časné (< 6 týdnů) vedlejší projevy SBRT plicních nádorů patří únava, suchý kašel rozvíjející se na podkladě postradiačního zánětu, bolesti na hrudi spojené s lokalizovanou pleuritidou, ezofagitida u centrálně uložených lézí a pneumonitida, která souvisí s velikostí ozářeného objemu plíce, kouřením, užíváním kortikoidů a komorbiditami. Postradiační dermatitida je při moderních technikách RT vzácností.
Pozdní toxicita je velmi často ovlivněna komorbiditami, chronickou obstrukční plicní nemocí či intersticiálními záněty. Obecně platí, že pacienti indikovaní k SBRT jsou rizikoví, mají četné vedlejší choroby a většinou snížené plicní funkce. To zvyšuje i riziko pozdních změn. Po > 6 týdnech od ozáření se může objevit radiační pneumonitida, která je kombinována s kašlem, dušností a horečkou. Brachiální plexopatie vzniká při ozařování plicního hrotu, projevuje se neuropatickou bolestí, Lhermitovým příznakem (bolest při předklonu hlavy, která je pociťována jako „šlehnutí“ elektrickým proudem propagující se až do dolních končetin) či motoricko-senzorickými změnami na horních končetinách. U pacientů po léčbě periferních ložisek se lze setkat s bolestmi hrudní stěny na podkladě iritace mezižeberních nervů či zlome-nin žeber. Striktura jícnu a tracheoezofageální píštěl je vzácná komplikace při léčbě centrálních lézí. Při dodržení dávkových limitů nevzniká, riziko vzrůstá při reiradiaci.
SBRT u karcinomu slinivky břišní
Smyslem RT u pokročilého, inoperabilního a nemetastatického karcinomu pankreatu je prevence či zpomalení lokální progrese, která může mít za následek bolest a/nebo obstrukční symp-tomy. Oproti konvenční RT má SBRT lepší LC, trvá krátce a je velmi dobře tolerována. V recentních studiích bylo prokázáno i signifikantní prodloužení přežití v její prospěch. Zhong et al popsali rozdíl v mediánu přežití 13,9 vs. 11,6 měsíce a OS ve 2 letech od léčby 21,7 vs. 16,5 % ve prospěch SBRT [38–41].
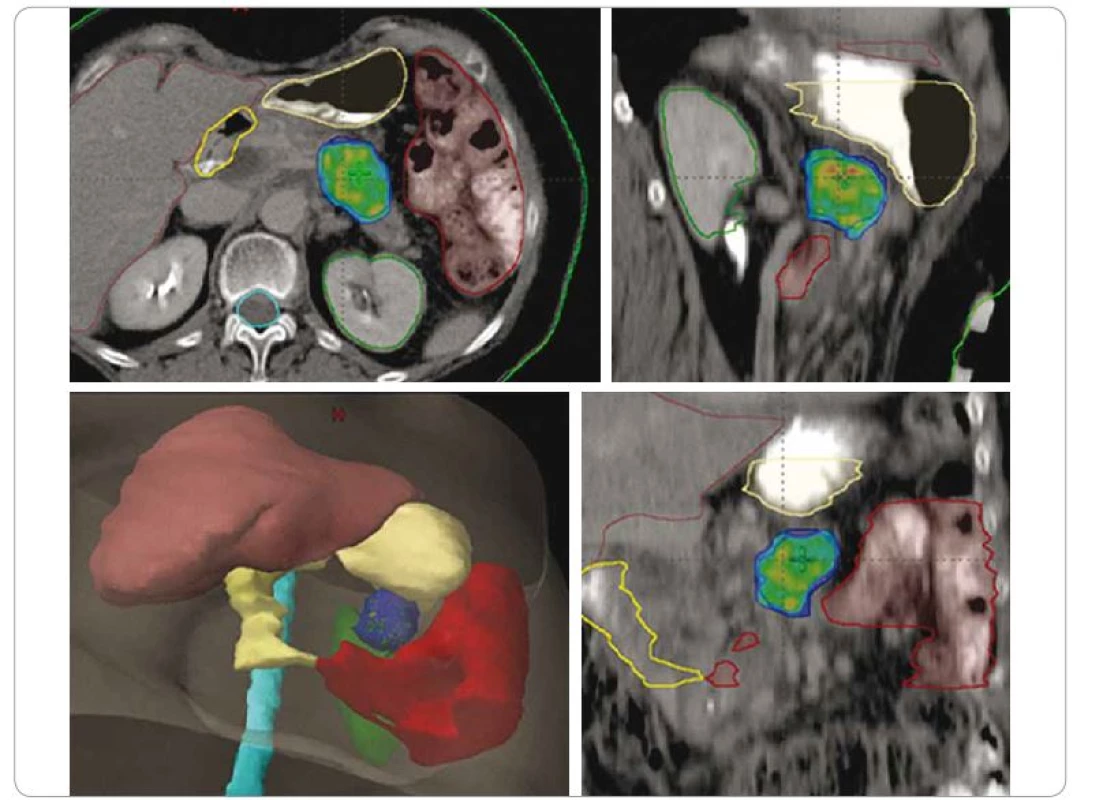
Aktuální doporučení NCCN (verze 2/2018) u pokročilého, inoperabilního a nemetastatického karcinomu pankreatu uvádí SBRT jako jednu z možností léčby po indukční chemoterapii (doporučení kategorie 2A) a jako rovnocennou metodu k chemoradioterapii. Pokud nejsou pacienti schopni absolvovat chemoterapii, lze SBRT použít i jako samostatnou modalitu [42]. Indikace SBRT musí být založena na posouzení lokálního nálezu radiačním onkologem s ohledem na celkovou velikost a vztah k okolním radiosenzitivním strukturám (obr. 3). SBRT by neměla být indikována v případech přímé invaze tumoru do střeva či žaludku prokázané na počítačové tomografii / magnetické rezonanci (CT/MRI) nebo endoskopicky. Nádorové léze pankreatu se ozařují nejčastěji dávkou 30–33 Gy v 5 frakcích. Jsou očekávány výsledky studie fáze III kombinující u lokálně pokročilých karcinomů pankreatu chemoterapii FOLFIRINOX +/ − SBRT [43].
SBRT – extrakraniální stereotaktická radioterapie, SIB – simultánní integrovaný boost, Gy – Gray
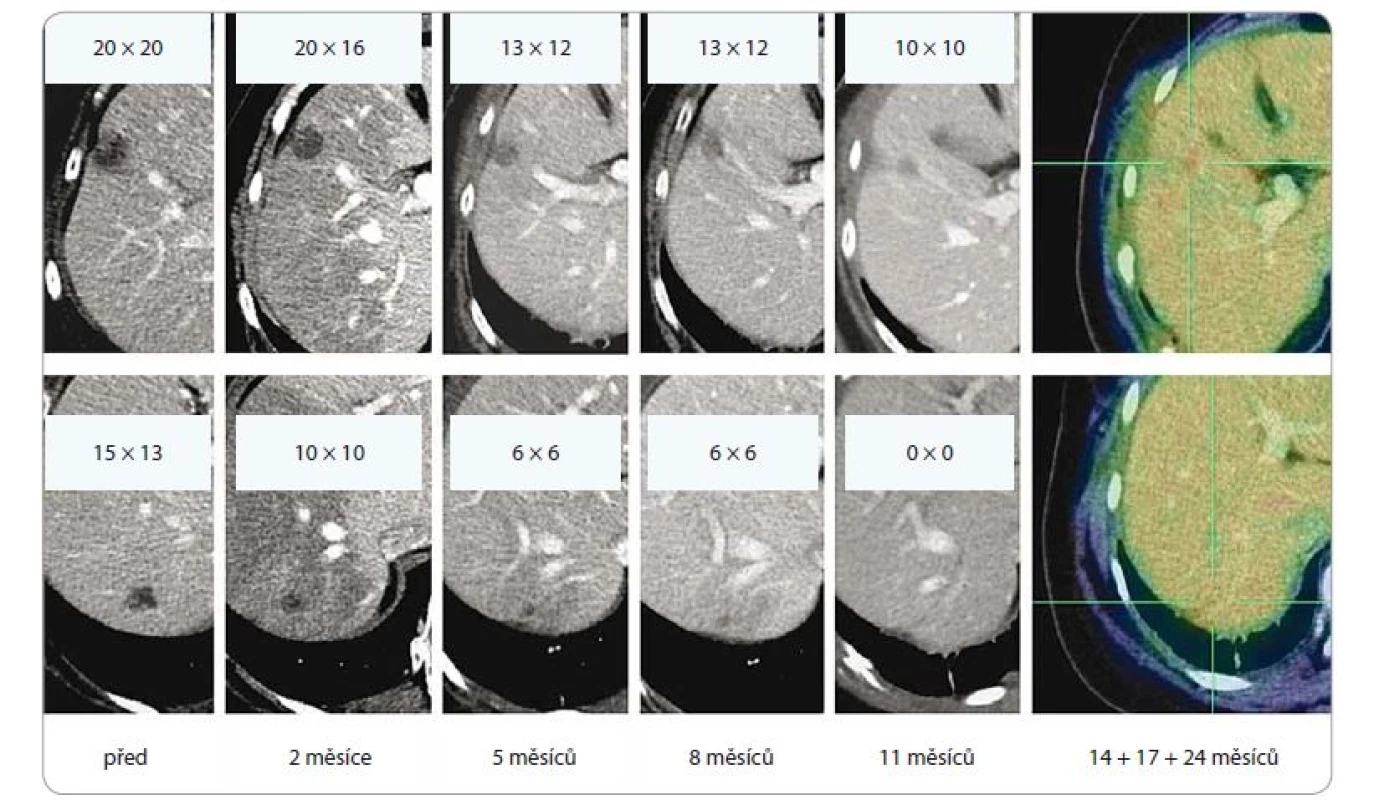
SBRT u hepatocelulárního karcinomu
U hepatocelulárního karcinomu se lokální metody léčby (ablace či embolizace) uplatňují u inoperabilních nálezů nebo v případech, kdy není operace možná (komorbidity, odmítnutí operace ze strany pacienta). Řadíme sem RFA, kryoablaci, perkutánní alkoholizaci, mikrovlnnou terapii, transarteriální embolizaci, chemoembolizaci či radioembolizaci.
Podle doporučení NCCN (verze 3/2018) je jednou z možností lokální léčby také SBRT. Tato je indikována jako alternativa ke všem výše uvedeným ablačním metodám v případě jejich nedostatečného efektu či kontraindikaci [44]. Význam SBRT v léčbě hepatocelulárního karcinomu je potvrzen řadou recentních studií [45,46]. Nejčastěji je SBRT indikována u pacientů s dobrými jaterními funkcemi (Child-Pugh A a B), s dostatečným objemem zdravého jaterního parenchymu a při dodržení všech dávkových limitů v rizikových orgánech [47]. Prozatím nejsou dostatečná data k použití RT u pacientů s horšími jaterními funkcemi (Child-Pugh C) [48,49].
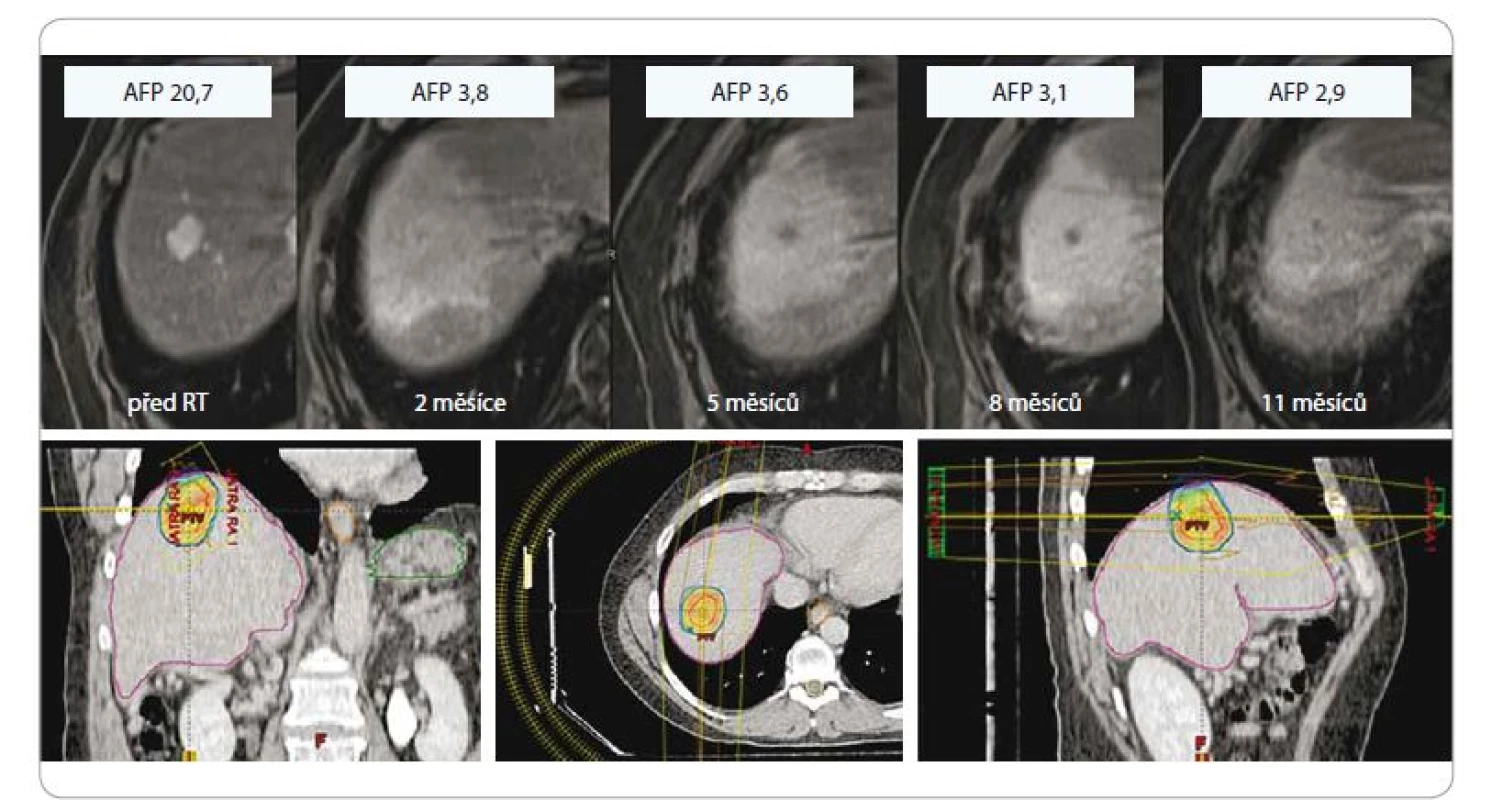
Dávkování SBRT u jaterních ložisek se řídí jejich umístěním, velikostí a funkční kapacitou jater. Periferní léze jsou ozařovány 23–30 Gy jednorázově nebo 27,5–60 Gy v 3–6 frakcích. Centrální léze pak dávkou 40 Gy v 5 frakcích (obr. 4).
SBRT – extrakraniální stereotaktická radioterapie, AFP – alpha-fetoprotein, Gy – Gray
Mezi akutní nežádoucí účinky SBRT v této oblasti patří únava, nevolnost a zvracení, které velmi dobře reagují na podání setronů. Poškození sliznic GIT traktu, jejich atrofie či fibrotizace mohou vést k poruchám výživy a malabsorbci a v delším časovém horizontu ke krvácení, píštělím a perforacím. Při ozáření slinivky může dojít ke snížení tvorby enzymů a poruchám výživy. U periferních jaterních lézí se můžeme setkat s bolestmi na hrudi či zlomeninami žeber. Tyto fraktury jsou často asymptomatické.
Radiačně indukované poškození jater je při dodržení všech limitů vzácné. Vzniká během 3 měsíců od ozáření a může vést k jaternímu selhání. Klasická forma je spojena s anikterickou hepatomegalií, ascitem a zvýšením alkalické fosfatázy v důsledku okluze a zničení centrálních žil se sekundární nekrózou jaterních buněk. Atypická forma nemá klasické příznaky, je spojena s elevací transamináz nad pětinásobek horní hranice nebo se zhoršením skóre Child-Pugh o ≥ 2.
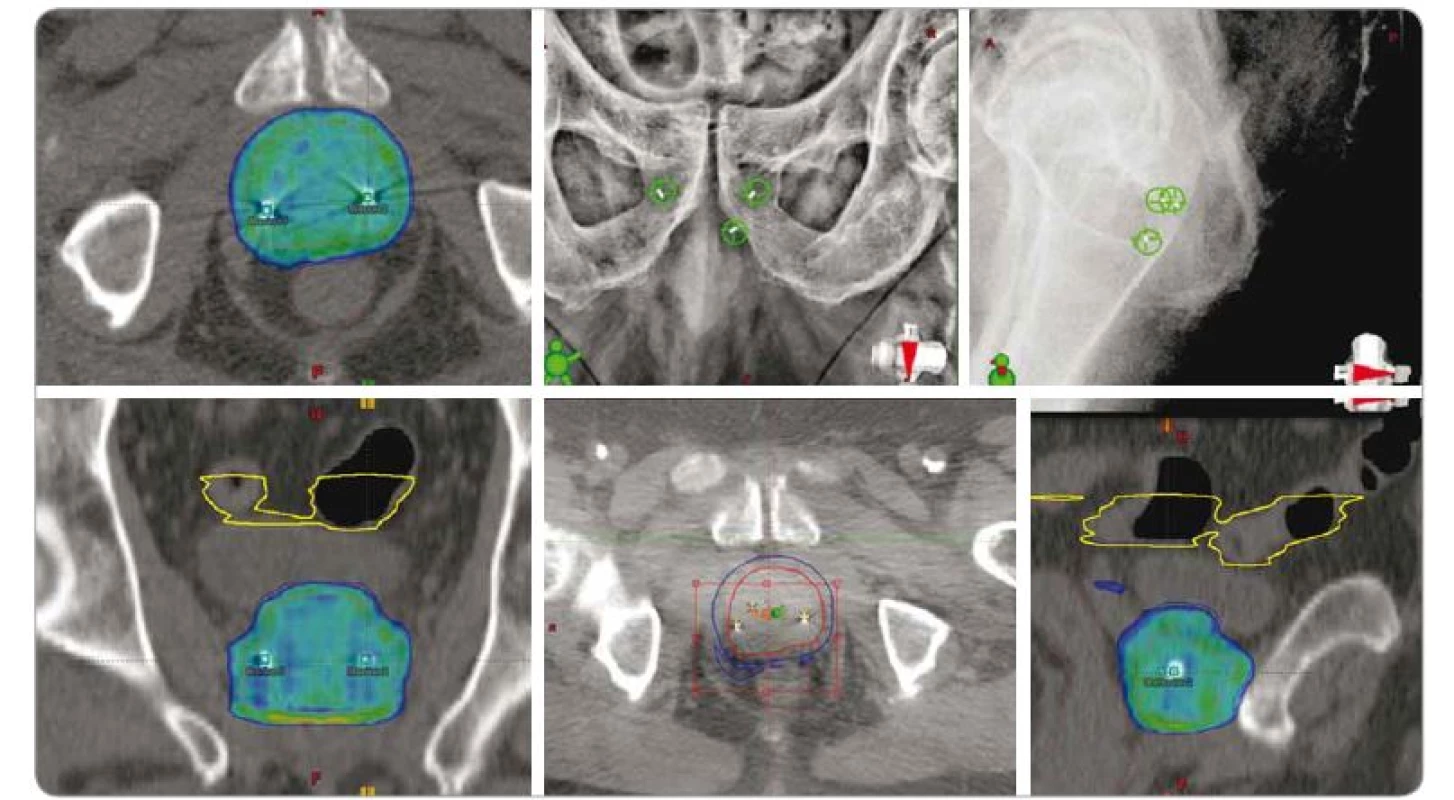
SBRT u karcinomu prostaty
Vysoce akcelerované režimy RT (≥ 6,5 Gy na frakci) jsou moderní kurativní léčebnou metodou časných stadií karcinomu prostaty. Relativně nízká míra proliferace buněk karcinomu prostaty se odráží v nízkém poměru α/β, který je u nádorů prostaty nejčastěji udáván v rozmezí hodnot 1 a 4 [50]. Poměr α/β je jedním z nejdůležitějších radiobiologických parametrů, popisujících vlastní senzitivitu buněk k ionizujícímu záření. Vzhledem k tomu, že poměr α/β buněk karcinomu prostaty je podobný nebo nižší než poměr v okolních rizikových tkáních (rektum, močový měchýř), nemělo by při použití akcelerovaných režimů docházet při srovnatelné účinnosti ke zvýšení rizika pozdní toxicity [51].
V současnosti jsou k dispozici výsledky řady klinických studií srovnávajících stereotaktickou a konvenčně frakcionovanou RT (ozařování s denní dávkou 2 Gy). Provedené studie s mediánem sledování až 6 let poukazují na výbornou biochemickou kontrolu onemocnění a podobnou toxicitu (močový měchýř, rektum a kvalita života) SBRT ve srovnání se standardními technikami záření [52–57]. V analýze dvou studií fáze II bylo 5leté přežití bez biochemického relapsu u pacientů s nízkým, středním a vysokým rizikem návratu choroby 95, 84, resp. 81 % [58].
Při cíleném ozáření pánevních lézí se lze setkat s gastrointestinální a urogenitální toxicitou. Proktitida či průjem se objevuje u cca 30 % pacientů, častější močení či urgence až u 50 % případů. Erektilní dysfunkce je popisována u 20–25 % pacientů. Velmi vzácně jsou popisovány uretrální striktury či rektální vředy. Transuretrální resekce prostaty v anamnéze je kontraindikací SBRT, protože zvyšuje riziko striktury močové trubice.
Riziko pozdní toxicity může být při SBRT vyšší. Jedna retrospektivní studie poukázala na vyšší genitourinární toxicitu po 24 měsících po SBRT než po klasické RT (44 vs. 36 %). Další upozornila na vyšší toxicitu při aplikaci dávek > 47,5 Gy v 5 frakcích [59,60].
Ozáření je prováděno za obrazové kontroly správného nastavení pacienta, resp. správné polohy prostaty v průběhu samotného ozáření. Robotický systém CyberKnife využívá RTG zobrazení zavedených zrn v reálném čase pomocí kV rentgenové skiaskopie, která je schopna zachytit odchylky v lokalizaci zrn v průběhu frakce záření. Lineární urychlovače disponují CT s konickým svazkem, které umožňuje zhodnocení prostaty a okolních struktur trojdimenzionálně. Moderní urychlovače mohou kombinovat obě metody dohromady – 3D obraz s kV snímky zobrazujícími zavedená lokalizační zrna, popř. s detekcí speciálních transpondérů, které vysílají vlastní signál (bez přídatné radiační zátěže) – příkladem je Calypso systém. Pokud se během léčby dostane jejich poloha mimo nastavené limity, je svazek záření automaticky zastaven. Ke snížení rizika rektální toxicity je také možné s výhodou použít transperineálně aplikovaný gel, který dočasně oddálí stěnu konečníku od prostaty [61].
Nejběžnější dávkové schéma při kurativní stereotaktické radioterapii prostaty je tzv. stanfordská frakcionace, tedy 36,25 Gy v 5 frakcích (tj. 5 × 7,25 Gy), další možností je 38 Gy ve 4 frakcích (tj. 4 × 9,5 Gy). Ozáření je vhodné provádět obden [62]. V případě viditelné léze na MRI je možné technikou simultánního integrovaného boostu ložiskově dávku navýšit (v průběhu frakce je navyšována dávka záření do přesně lokalizovaného podobjemu tkáně).
Podle doporučení NCCN (verze 4/2018) může být SBRT považována za alternativu ke konvenčním režimům na pracovištích s vhodným technologickým zázemím a dostatečnými klinickými zkušenostmi [63]. Bez přesné obrazové navigace – stejně jako v jiných lokalitách – není možné léčbu vysokými jednotlivými dávkami bezpečně použít (obr. 5). K jednoznačnému vyhodnocení pozdních nežádoucích účinků léčby bude nicméně nutné vyčkat dlouhodobých výsledků randomizovaných multicentrických studií.
SBRT – extrakraniální stereotaktická radioterapie, PSA – prostatický specifický antigen, Gy – Gray
SBRT u oligometastatického onemocnění
Při terapii diseminovaného nádorového onemocnění, u kterého jsou metastázy omezeny početně i rozsahem postižených orgánů, mohou být úspěšné lokální léčebné metody – resekce, RFA, kryoablace nebo RT. Ablace metastáz může v řadě případů vést k dlouhodobému DFS, popř. k vyléčení. Rovněž možnost oddálení podání potenciálně toxické systémové terapie výrazně ovlivní kvalitu života onkologických pacientů.
Oligometastázy lze definovat jako 5 nebo méně ložisek lokalizovaných v omezeném počtu orgánů [64,65]. Incidence oligometastatického postižení není známa, ale zvýšené využití pozitronové emisní tomografie (PET) /CT a dalších pokročilých diagnostických metod umožňuje častěji diagnostikovat a včas zahájit léčbu asymptomatických ložisek.
V posledních letech byla publikována řada studií, které potvrzují výborný efekt a minimální vedlejší účinky SBRT při léčbě oligometastáz. Tento efekt byl potvrzen také u těch typů nádorů, které jsou obecně považovány za radiorezistentní. V provedených studiích byla 2letá LC přibližně 80 %, 2–3leté DFS nemoci přibližně 20 % a 2–3leté OS mezi 25–40 %. Přestože u řady pacientů dojde po ablaci oligometastáz k progresi základního onemocnění, SBRT může tuto progresi oddálit, popř. odložit nasazení náročné systémové terapie [66–68].
Výsledky SBRT oligometastatického onemocnění mohou být ovlivněny [69]:
- počtem ložisek – pacienti s 1–3 ložisky mají lepší dobu do progrese onemocnění než pacienti s 4–5 metastázami;
- velikostí ložisek – lepší LC u lézí < 3 cm;
- dávkou záření – v případě, že biologický ekvivalent dávky BED je > 100 Gy (při poměru α/β = 10), je léčba spojena s lepší LC;
- dobou bez příznaků nemoci – lepší OS bylo pozorováno v případech, kdy je DFS > 12 měsíců.
Oligometastázy plic a jater
Metastazektomie zůstává zlatým standardem resekabilního onemocnění. Jak ukázaly chirurgické studie, přibližně čtvrtina pacientů po resekci plicních či jaterních oligometastáz přežívá dlouhodobě. Řada pacientů však operaci podstoupit nemůže nebo nechce. Proto se v posledních letech objevuje stále více prací týkajících se účinku SBRT při léčbě metastatického postižení plic a jater (tab. 2) [70–81]. Sice není k dispozici přímé srovnání RT s chirurgií, ale vynikající výsledky, neinvazivní přístup a minimální toxicita řadí už nyní SBRT k základním léčebným metodám takového onemocnění. Principy plánování a dávkování jsou obdobné jako při SBRT léčbě primárních nádorů těchto lokalizací (obr. 6, 7).
![Vybrané studie stereotaktické radioterapie při léčbě oligometastáz plic a jater [70–81].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/e816d6dffc426f414c0e617d4e3592b8.jpeg)
SBRT – extrakraniální stereotaktická radioterapie, PTV – plánovací cílový objem, D – dávka záření, Gy – Gray
PTV – plánovací cílový objem, D – dávka záření, Gy – Gray
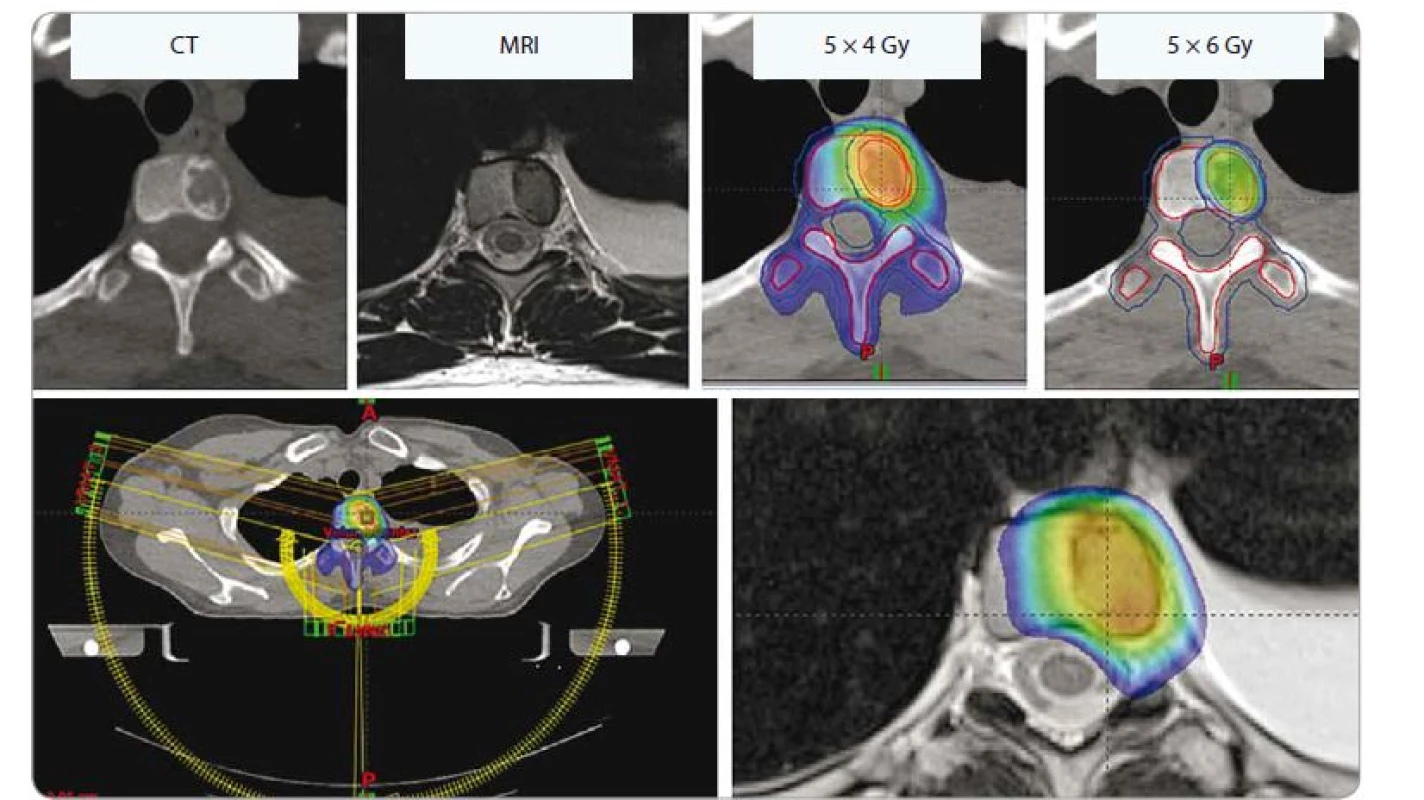
Oligometastázy obratlů
Velmi příkrý spád dávky při SBRT obratlových metastáz umožňuje aplikovat výrazně vyšší dávky záření než při konvenční RT. Ozáření v jedné či několika málo frakcích také zvyšuje kvalitu pacientova života, neboť jej nenutí trávit spoustu času v nemocnici či dojížděním za léčbou. Vyšší dávky jsou spojeny s nižším rizikem recidivy i lepším analgetickým efektem [82,83]. Nejčastěji je indikováno 3 × 9 Gy či 5 × 6–7 Gy podle lokalizace a velikosti ložisek. Řada pracovišť používá jednorázové ozáření 18–24 Gy. Limitující je samozřejmě dávka v oblasti míchy či kaudy equiny. Z dlouhodobého hlediska může též dojít ke zvýšení rizika kompresivních fraktur obratlových těl či k ezofageální toxicitě [84–86]. Při dodržení dávkových limitů je toxicita minimální (obr. 8).
SIB – simultánní integrovaný boost, Gy – Gray, CT - počítačová tomografie, MRI – magnetická rezonance
Oligometastázy nadledvin
S metastatickým postižením nadledvin, nezřídka oligometastatickým, je možné se setkat při diseminaci plicních karcinomů. Není-li indikována operace, je SBRT smysluplnou alternativou [87–89]. Aplikujeme 30 Gy ve 3 frakcích nebo 30–40 Gy v 5 frakcích. Při těchto dávkách a při dodržení limitů na tenké střevo, žaludek, duodenum či ledviny jsou vedlejší účinky minimální.
Oligometastatické postižení lymfatických uzlin
V průběhu různých nádorových onemocnění hrudníku, břicha i pánve lze diagnostikovat solitární postižení lymfatické uzliny. Takové oligometastatické onemocnění má lepší prognózu než systémová diseminace. V těchto případech může být indikována SBRT [90–92]. Dávkování a frakcionace bude významně ovlivněno lokalizací patologické uzliny (obr. 9). Dávky budou v důsledku lokalizace nutně nižší než při SBRT v játrech či plících, nicméně i pouhý odklad podání systémové léčby díky ve prospěch netoxické RT může pozitivně ovlivnit kvalitu života pacientů. Navíc je možné při SBRT technice dosáhnout mnohem větší LC v porovnání s běžně frakcionovanou radioterapií (např. v klasickém režimu 10 × 3 Gy) (tab. 3).
PTV – plánovací cílový objem, Gy – Gray

![Vybrané studie stereotaktické radioterapie při léčbě oligometastáz nadledvin a lymfatických uzlin [87–92].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/474586ba18451dc35a3d9374bccd42de.jpeg)
Hodnocení efektivity SBRT ložisek v jednotlivých orgánech je důležité pro studium speciálních technik RT. Pro hodnocení efektivity SBRT oligometastáz vycházejících z různých primárních nádorů jsou však takové skupiny pacientů příliš heterogenní. Při rozdělení pacientů podle histopatologie jejich onemocnění budou výsledky léčby klinicky mnohem lépe použitelné. Dnes jsou již k dispozici výsledky SBRT oligometastáz NSCLC, kolorektálního karcinomu, rakoviny prsu, ledvin, melanomu a sarkomů (tab. 4) [79,81,93–97].
![Výsledky SBRT oligometastáz podle primárního nádoru [79,81,93–97].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/cd5f49ea0de5d127e56c96eb09ba50ed.jpeg)
Lokální léčba oligometastatického onemocnění je v současnosti jednou z oblastí, ve které je pozorováno prodloužení přežití a zlepšení kvality života onkologických pacientů. V kombinaci se systémovou léčbou může hrát velmi významnou roli také u vícečetně diseminovaných pacientů. Studie by měly být koncipovány tak, aby mohly prokázat nejen význam systémově podávaných preparátů, ale také přínos lokální léčby. Právě vysokodávkovaná cílená RT je velmi účinným a bezpečným lokálním přístupem při léčbě oligometastatického onemocnění.
Méně časté indikace SBRT
Nádory hlavy & krku
Cílenou vysokodávkovanou SBRT je možné indikovat u drobných, dobře lokalizovaných a inoperabilních recidiv spinocelulárních karcinomů hlavy/krku po primární kombinované léčbě [98]. Protože riziko toxicity je zde vysoké, je nutné co nejvíce omezit ozáření okolních struktur. Obecně se nedoporučuje překročit v rizikových strukturách (organ at risk – OAR) jednotlivou dávku 2,5 Gy; jednotlivá dávka nad 4 Gy by v OAR měla být určitě minimalizována. Vzhledem k významnému riziku krvácení se nedoporučuje používat SBRT v případech, kdy recidiva prorůstá do kůže či obrůstá některou z velkých cév [99]. SBRT je možné rovněž použít jako boost ozáření lokálně pokročilých nazofaryngeálních karcinomů po ukončení standardní léčby [100].
Karcinom ledviny
Cílené ozáření nádorů ledvin je možné indikovat u medicínsky inoperabilních pacientů, u recidiv v lůžku po nefrektomii či při kontralaterální lézi v neresekované ledvině. V těchto případech je používáno dávkování podle tolerance ledvin, tj. 30–40 Gy v 3–5 frakcích. Studie fáze I/II prokázaly proveditelnost a bezpečnost SBRT při léčbě primárních nádorů ledviny [101]. V současné době jsou očekávány výsledky studií fáze II.
Gynekologické nádory
SBRT lze použít v případech, kdy není možné u lokálně pokročilých karcinomů děložního čípku k zevní RT přidat brachyterapii, např. z důvodu kontraindikace anestezie či neprůchodnosti cervixu pro brachyterapeutické aplikátory [102]. SBRT se rovněž uplatňuje v léčbě inoperabilních recidiv.
Recidivy nádorů kolorekta
Podobně jako u recidiv gynekologických nádorů je možné SBRT použít u rekurencí tumorů kolorektálních. V takových případech lze bezpečně dosáhnout velmi dobré LC aplikací 25 Gy v 5 frakcích; důležitý je také časový odstup od první RT.
Závěr
Pokroky v obrazové navigaci, plánování a aplikaci dávky záření vedly k úspěšnému zavedení SBRT (nebo radiochirurgie) do léčebných schémat řady primárních nádorů i metastatického onemocnění. Tam, kde není resekce možná, popř. ji pacient odmítne, je vždy vhodné o SBRT uvažovat. Nespornými výhodami této metody jsou její lokální efektivita, neinvazivita a minimální toxicita. Dodržením dávkových limitů klesá riziko poškození zdravých tkání a orgánů v okolí ozářeného objemu na minimum. V léčbě primárních nádorů plic či prostaty má SBRT kurativní potenciál. Vysokodávkované ozáření oligometastáz různých primárních nádorů může vést k dlouhodobému DFS, popř. může pomoci oddálit nasazení toxické systémové léčby, a tím podstatně zlepšit kvalitu života onkologických pacientů.
Tato práce byla částečně podpořena Ministerstvem zdravotnictví ČR – Koncepční rozvoj výzkumné organizace (MMCI 00209805). Výsledky tohoto výzkumu byly získány v rámci projektu CEITEC 2020 (LQ1601) s finančním příspěvkem Ministerstva školství, mládeže a tělovýchovy ČR v rámci zvláštní podpory z prostředků Národního programu pro udržitelnost II.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Petr Burkoň, Ph.D.
Klinika radiační onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: burkon@mou.cz
Obdrženo: 30. 10. 2018
Přijato: 4. 11. 2018
Sources
1. Lo SS, Teh BS, Lu JJ et al (eds). Stereotactic body radiation therapy, medical radiology. Heidelberg: Springer-Verlag Berlin 2012.
2. Burkoň P. Extrakraniální stereotaktická radioterapie. In: Šlampa P et al. Radiační onkologie v praxi. 4. vyd. Brno: MOÚ 2016.
3. Čoupek P, Burkoň P, Dymáčková R et al. Postavení radioterapie v léčbě bronchogenního karcinomu. Klin Onkol 2016; 29 (Suppl 2): S297–S298.
4. Burkoň P, Kazda T, Slávik M. Efekt akcelerované radioterapie u plicního adenokarcinomu. Klin Onkol 2015; 28 (1): 64–65.
5. Torre LA, Siegel RL, Jemal A. Lung cancer statistics. Adv Exp Med Biol 2016; 893 : 1–19. doi: 10.1007/978-3-319-24223-1_1.
6. Howington JA, Blum MG, Chang AC et al. Treatment of stage I and II non-small cell lung cancer: diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2013; 143 (Suppl 5): e278S–313S. doi: 10.1378/chest.12-2359.
7. Timmerman R, Paulus R, Galvin J et al. Stereotactic body radiation therapy for inoperable early stage lung cancer. JAMA 2010; 303 (11): 1070–1076. doi: 10.1001/jama.2010.261.
8. Baumann P, Nyman J, Hoyer M et al. Outcome in a prospective phase II trial of medically inoperable stage I non-small-cell lung cancer patients treated with stereotactic body radiotherapy. J Clin Oncol 2009; 27 (20): 3290–3296. doi: 10.1200/JCO.2008.21.5681.
9. Onishi H, Shirato H, Nagata Y et al. Stereotactic body radiotherapy (SBRT) for operable stage I non-small-cell lung cancer: can SBRT be comparable to surgery? Int J Radiat Oncol Biol Phys 2011; 81 (5): 1352–1358. doi: 10.1016/j.ijrobp.2009.07.1751.
10. Grutters JP, Kessels AG, Pijls-Johannesma M et al. Comparison of the effectiveness of radiotherapy with photons, protons and carbon-ions for non-small cell lung cancer: a meta-analysis. Radiother Oncol 2010; 95 (1): 32–40. doi: 10.1016/j.radonc.2009.08.003.
11. Palma D, Visser O, Lagerwaard FJ et al. Impact of introducing stereotactic lung radiotherapy for elderly patients with stage I non-small-cell lung cancer: a population-based time-trend analysis. J Clin Oncol 2010; 28 (35): 5153–5159. doi: 10.1200/JCO.2010.30.0731.
12. Shirvani SM, Jiang J, Chang JY et al. Comparative effectiveness of 5 treatment strategies for early-stage non-small cell lung cancer in the elderly. Int J Radiat Oncol Biol Phys 2012; 84 (5): 1060–1070. doi: 10.1016/j.ijrobp.2012.07.2354.
13. Ettinger DS, Wood DE, Aisner DL et al. NCCN Guidelines insights: non-small cell lung cancer, version 5.2018. J Natl Compr Canc Netw 2018; 16 (7): 807–821. doi: 10.6004/jnccn.2018.0062.
14. Postmus PE, Kerr KM, Oudkerk M et al. Early and locally advanced non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2017; 28 (Suppl 4): 1–21. doi: 10.1093/annonc/mdx222.
15. Videtic GM, Donington J, Giuliani M et al. Stereotactic body radiation therapy for early-stage non-small cell lung cancer: Executive Summary of an ASTRO Evidence-Based Guideline. Pract Radiat Oncol 2017; 7 (5): 295–301. doi: 10.1016/j.prro.2017.04.014.
16. Chang JY, Senan S, Paul MA et al. Stereotactic ablative radiotherapy versus lobectomy for operable stage I non-small-cell lung cancer: a pooled analysis of two randomized trials. Lancet Oncol 2015; 16 (6): 630–637. doi: 10.1016/S1470-2045 (15) 70168-3.
17. van den Berg LL, Klinkenberg TJ, Groen HJ et al. Patterns of recurrence and survival after surgery or stereotactic radiotherapy for early stage NSCLC. J Thorac Oncol 2015; 10 (5): 826–831. doi: 10.1097/JTO.0000000000000483.
18. ClinicalTrials.gov. Radical resection vs. ablative stereotactic radiotherapy in patients with operable stage I NSCLC (POSTILV). [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT01753414.
19. ClinicalTrials.gov. A study to determine the feasibility and acceptability of conducting a phase III randomised controlled trial comparing stereotactic ablative radiotherapy with surgery in patients with peripheral stage I non-small cell lung cancer considered higher risk of complications from surgical resection (SABRTOOTHv1). [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT02629458.
20. ClinicalTrials.gov. JoLT-Ca sublobar resection (SR) versus stereotactic ablative radiotherapy (SAbR) for lung cancer (STABLE-MATES). [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT02468024.
21. Grills IS, Hope AJ, Guckenberger M et al. A collaborative analysis of stereotactic lung radiotherapy outcomes for earlystage non-small-cell lung cancer using daily online cone-beam computed tomography image-guided radiotherapy. J Thorac Oncol 2012; 7 (9): 1382–1393. doi: 10.1097/JTO.0b013e318260e00d.
22. Palma D, Lagerwaard F, Rodrigues G et al. Curative treatment of stage I non-small-cell lung cancer in patients with severe COPD: stereotactic radiotherapy outcomes and systematic review. Int J Radiat Oncol Biol Phys 2012; 82 (3): 1149–1156. doi: 10.1016/j.ijrobp.2011.03. 005.
23. Chang JY, Liu H, Balter P et al. Clinical outcome and predictors of survival and pneumonitis after stereotactic ablative radiotherapy for stage I non-small cell lung cancer. Radiat Oncol 2012; 7 : 152. doi: 10.1186/1748-717X-7-152.
24. Taremi M, Hope A, Dahele M et al. Stereotactic body radiotherapy for medically inoperable lung cancer: prospective, single-center study of 108 consecutive patients. Int J Radiat Oncol Biol Phys 2012; 82 (2): 967–973. doi: 10.1016/j.ijrobp.2010.12.039.
25. Onishi H, Yoshiyuki S, Yasuo M et al. Japanese multi-institutional study of stereotactic body radiation therapy for more than 2000 patients with stage I non-small cell lung cancer. Int J Radiat Oncol Biol Phys 2013; 87 (Suppl 2): S9–S10. doi: 10.1016/j.ijrobp.2013.06.031.
26. Shibamoto Y, Baba F, Hashizume C et al. Stereotactic body radiotherapy using a radiobiology-based regimen for stage I nonsmall cell lung cancer: 5-year mature results. Int J Radiat Oncol Biol Phys 2013; 87 (Suppl 2): S34–S35. doi: 10.1016/j.ijrobp.2013.06.092.
27. Modh A, Rimmer A, Shah M et al. Survival and toxicity after stereotactic body radiation therapy for central lung tumors. Int J Radiat Oncol Biol Phys 2013; 87 (Suppl 2): S33. doi: 10.1016/j.ijrobp.2013.06.089.
28. Griffieon GH, Lagerwaard FJ, Haasbeek CJ et al. Treatment of multiple primary lung cancers using stereotactic radiotherapy, either with or without surgery. Radiother Oncol 2013; 107 (3): 403–408. doi: 10.1016/j.radonc.2013.04.026.
29. Brooks ED, Sun B, Zhao L et al. Stereotactic ablative radiation therapy is highly safe and effective for elderly patients with early-stage non-small cell lung cancer. Int J Radiat Oncol Biol Phys 2017; 98 (4): 900–907. doi: 10.1016/j.ijrobp.2016.12.022.
30. Singh AK, Suescun JA, Stephans KL et al. A Phase 2 randomized study of 2 stereotactic body radiation therapy regimens for medically inoperable patients with node-negative, peripheral non-small cell lung cancer. Int J Radiat Oncol Biol Phys 2017; 98 (1): 221–222. doi: 10.1016/j.ijrobp.2017.01.040.
31. Chang JY, Balter PA, Dong L et al. Stereotactic body radiation therapy in centrally and superiorly located stage I or isolated recurrent non-small-cell lung cancer. Int J Radiat Oncol Biol Phys 2008; 72 (4): 967–971. doi: 10.1016/j.ijrobp.2008.08.001.
32. Haasbeek CJ, Lagerwaard FJ, Slotman BJ et al. Outcomes of stereotactic ablative radiotherapy for centrally located early-stage lung cancer. J Thorac Oncol 2011; 6 (12): 2036–2043. doi: 10.1097/JTO.0b013e31822e71d8.
33. Chaudhuri AA, Tang C, Binkley MS et al. Stereotactic ablative radiotherapy (SABR) for treatment of central and ultra-central lung tumors. Lung Cancer 2015; 89 (1): 50–56. doi: 10.1016/j.lungcan.2015.04.014.
34. Li Q, Swanick CW, Allen PK et al. Stereotactic ablative radiotherapy (SABR) using 70 Gy in 10 fractions for non-small cell lung cancer: Exploration of clinical indications. Radiother Oncol 2014; 112 (2): 256–261. doi: 10.1016/j.radonc.2014.07.010.
35. Tekatli H, Haasbeek N, Dahele M et al. Outcomes of hypofractionated high-dose radiotherapy in poor-risk patients with “ultracentral” non-small cell lung cancer. J Thorac Oncol 2016; 11 (7): 1081–1089. doi: 10.1016/j.jtho.2016.03.008.
36. Benedict SH, Yenice KM, Followill D et al. Stereotactic body radiation therapy: the report of AAPM Task Group 101. Med Phys 2010; 37 (8): 4078–4101.
37. Xiao Y, Papiez L, Paulus R et al. Dosimetric evaluation of heterogeneity corrections for RTOG 0236: stereotactic body radiotherapy of inoperable stage I-II non-small-cell lung cancer. Int J Radiat Oncol Biol Phys 2009; 73 (4): 1235–1242. doi: 10.1016/j.ijrobp.2008.11.019.
38. Tozzi A, Comito T, Alongi F et al. SBRT in unresectable advanced pancreatic cancer: preliminary results of a mono-institutional experience. Radiat Oncol 2013; 8 (1): 148. doi: 10.1186/1748-717X-8-148.
39. Rwigema JC, Parikh SD, Heron DE et al. Stereotactic body radiotherapy in the treatment of advanced adenocarcinoma of the pancreas. Am J Clin Oncol 2011; 34 : 63–69. doi: 10.1097/COC.0b013e3181d270b4.
40. Gurka MK, Collins SP, Slack R et al. Stereotactic body radiation therapy with concurrent full-dose gemcitabine for locally advanced pancreatic cancer: a pilot trial demonstrating safety. Radiat Oncol 2013; 8 : 44. doi: 10.1186/1748-717X-8-44.
41. Zhong J, Patel K, Switchenko J et al. Outcomes for patients with locally advanced pancreatic adenocarcinoma treated with stereotactic body radiation therapy versus conventionally fractionated radiation. Cancer 2017; 123 (18): 3486–3493. doi: 10.1002/cncr.30706.
42. Tempero MA, Malafa MP, Al-Hawary M et al. Pancreatic adenocarcinoma. Version 2.2018, NCCN Clinical Practice Guidelines In Oncology. J Natl Compr Canc Netw 2018.
43. ClinicalTrials.gov. Pancreatic Cancer Radiotherapy Study Group (Stanford): Phase III trial of FOLFIRINOX +/ − SBRT in locally advanced pancreatic cancer patients. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT01926197.
44. Benson AlB, D’Angelica MI, Abbott DE et al. Hepatobiliary cancers. Version 3.2018, NCCN Clinical Practice Guidelines In Oncology. J Natl Compr Canc Netw 2018.
45. Hoffe SE, Finkelstein SE, Russell MS et al. Nonsurgical options for hepatocellular carcinoma: evolving role of external beam radiotherapy. Cancer Control 2010; 17 (2): 100–110. doi: 10.1177/107327481001700205.
46. Wahl DR, Stenmark MH, Tao Y et al. Outcomes after stereotactic body radiotherapy or radiofrequency ablation for hepatocellular carcinoma. J Clin Oncol 2016; 34 (5): 452–459. doi: 10.1200/JCO.2015.61.4925.
47. Cardenes HR, Price TR, Perkins SM et al. Phase I feasibility trial of stereotactic body radiation therapy for primary hepatocellular carcinoma. Clin Transl Oncol 2010; 12 (3): 218–225. doi: 10.1007/s12094-010-0492-x.
48. Bujold A, Massey CA, Kim JJ et al. Sequential phase I and II trials of stereotactic body radiotherapy for locally advanced hepatocellular carcinoma. J Clin Oncol 2013; 31 (13): 1631–1639. doi: 10.1200/JCO.2012.44.1659.
49. Andolino DL, Johnson CS, Maluccio M et al. Stereotactic body radiotherapy for primary hepatocellular carcinoma. Int J Radiat Oncol Biol Phys 2011; 81 (4): e447–e453. doi: 10.1016/j.ijrobp.2011.04.011.
50. Dasu A. Is the alpha/beta value for prostate tumours low enough to be safely used in clinical trials? Clin Oncol (R Coll Radiol) 2007; 19 (5): 289–301. doi: 10.1016/j.clon.2007.02.007.
51. Krupa P, Ticha H, Kazda T et al. Early toxicity of hypofractionated radiotherapy for prostate cancer. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2016; 160 (3): 435–441. doi: 10.5507/bp.2016.008.
52. Buyyounouski MK, Price RA jr, Harris EE et al. Stereotactic body radiotherapy for primary management of early-stage, low-to intermediate-risk prostate cancer: report of the American Society for Therapeutic Radiology and Oncology Emerging Technology Committee. Int J Radiat Oncol Biol Phys 2010; 76 (5): 1297–1304. doi: 10.1016/j.ijrobp.2009.09.078.
53. Freeman DE, King CR. Stereotactic body radiotherapy for low-risk prostate cancer: five-year outcomes. Radiat Oncol 2011; 6 : 3. doi: 10.1186/1748-717X-6-3.
54. Kang JK, Cho CK, Choi CW et al. Image-guided stereotactic body radiation therapy for localized prostate cancer. Tumori 2011; 97 (1): 43–48.
55. Madsen BL, Hsi RA, Pham HT et al. Stereotactic hypofractionated accurate radiotherapy of the prostate (SHARP), 33.5 Gy in five fractions for localized disease: first clinical trial results. Int J Radiat Oncol Biol Phys 2007; 67 (4): 1099–1105. doi: 10.1016/j.ijrobp.2006.10.050.
56. Chen LN, Suy S, Uhm S et al. Stereotactic body radiation therapy (SBRT) for clinically localized prostate cancer: the Georgetown University experience. Radiat Oncol 2013; 8 : 58. doi: 10.1186/1748-717X-8-58.
57. Katz AJ, Santoro M, Diblasio F et al. Stereotactic body radiotherapy for localized prostate cancer: disease control and quality of life at 6 years. Radiat Oncol 2013; 8 : 118. doi: 10.1186/1748-717X-8-118.
58. King CR, Freeman D, Kaplan I et al. Stereotactic body radiotherapy for localized prostate cancer: pooled analysis from a multi-institutional consortium of prospective phase II trials. Radiother Oncol 2013; 109 (2): 217–221. doi: 10.1016/j.radonc.2013.08.030.
59. Yu JB, Cramer LD, Herrin J et al. Stereotactic body radiation therapy versus intensity-modulated radiation therapy for prostate cancer: comparison of toxicity. J Clin Oncol 2014; 32 (12): 1195–1201. doi: 10.1200/JCO.2013.53.8652.
60. Hannan R, Tumati V, Xie XJ et al. Stereotactic body radiation therapy for low and intermediate risk prostate cancer – results from a multi-institutional clinical trial. Eur J Cancer 2016; 59 : 142–151. doi: 10.1016/j.ejca.2016.02. 014.
61. Padmanabhan R, Pinkawa M, Song DY et al. Hydrogel spacers in prostate radiotherapy: a promising approach to decrease rectal toxicity. Future Oncol 2017; 13 (29): 2697–2708. doi: 10.2217/fon-2017-0073.
62. King CR, Brooks JD, Gill H et al. Long-term outcomes from a prospective trial of stereotactic body radiotherapy for low-risk prostate cancer. Int J Radiat Oncol Biol Phys 2012; 82 (2): 877–882. doi: 10.1016/j.ijrobp.2010.11.054.
63. Mohler JL, Lee RJ, Antonarakis ES et al. Prostate cancer. Version 4.2018, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw 2018.
64. Hellman S, Weichselbaum RR. Oligometastases. J Clin Oncol 1995; 13 (1): 8–10. doi: 10.1200/JCO.1995.13.1.8.
65. Weichselbaum RR, Hellman S. Oligometastases revisited. Nat Rev Clin Oncol 2011; 8 (6): 378–382. doi: 10.1038/nrclinonc.2011.44.
66. Tree AC, Khoo VS, Eeles RA et al. Stereotactic body radiotherapy for oligometastases. Lancet Oncol 2013; 14 (1): e28–e37. doi: 10.1016/S1470-2045 (12) 70510-7.
67. Corbin KS, Hellman S, Weichselbaum RR. Extracranial oligometastases: a subset of metastases curable with stereotactic radiotherapy. J Clin Oncol 2013; 31 (11): 1384–1390. doi: 10.1200/JCO.2012.45.9651.
68. Palma DA, Olson RA, Harrow S et al. Stereotactic ablative radiation therapy for the comprehensive treatment of oligometastatic tumors (SABR-COMET): results of a randomized trial. Int J Radiat Oncol Biol Phys 2018; 102 (3): S3–S4. doi: 10.1016/j.ijrobp.2018.06.105.
69. Chang JS, Sethi RA, Barani IJ. Extracranial oligometastases. In: Sethi RA et al (eds). Handbook of evidence-based stereotactic radiosurgery and stereotactic body radiotherapy. Springer International Publishing Switzerland 2016.
70. Chang DT, Swaminath A, Kozak M et al. Stereotactic body radiotherapy for colorectal liver metastases a pooled analysis. Cancer 2011; 117 (17): 4060–4069. doi: 10.1002/cncr.25997.
71. Rule W, Timmerman R, Tong LY et al. Phase I dose-escalation study of stereotactic body radiotherapy in patients with hepatic metastases. Ann Surg Oncol 2011; 18 (4): 1081–1087. doi: 10.1245/s10434-010-1405-5.
72. Ricardi U, Filippi AR, Guarneri A et al. Stereotactic body radiation therapy for lung metastases. Lung Cancer 2012; 75 (1): 77–81. doi: 10.1016/j.lungcan.2011.04.021.
73. Baschnagel AM, Mangona VS, Robertson JM et al. Lung metastases treated with image-guided stereotactic body radiation therapy. Clin Oncol 2013; 25 (4): 236–241. doi: 10.1016/j.clon.2012.12.005.
74. Sole CV, Lopez Guerra JL, Matute R et al. Stereotactic ablative radiotherapy delivered by image-guided helical tomotherapy for extracranial oligometastases. Clin Transl Oncol 2013; 15 (6): 484–491. doi: 10.1007/s12094-012-0956-2.
75. Scorsetti M, Arcangeli S, Tozzi A et al. Is stereotactic body radiation therapy an attractive option for unresectable liver metastases? A preliminary report from a phase 2 trial. Int J Radiat Oncol Biol Phys 2013; 86 (2): 336–342. doi: 10.1016/j.ijrobp.2012.12.021.
76. Navarria P, Ascolese AM, Tomatis S et al. Stereotactic body radiotherapy (sbrt) in lung oligometastatic patients: role of local treatments. Radiat Oncol 2014; 9 (1): 91. doi: 10.1186/1748-717X-9-91.
77. Singh D, Chen Y, Hare MZ et al. Local control rates with five-fraction stereotactic body radiotherapy for oligometastatic cancer to lung. J Thorac Dis 2014; 6 (4): 369–374. doi: 10.3978/j.issn.2072-1439.2013.12.03.
78. Johnson J, Braunstein S, Descovich M et al. SBRT treatment of central chest lesions: experience at the University of California. San Francisco: University of California 2014.
79. Ricco A, Davis J, Rate W et al. Lung metastases treated with stereotactic body radiotherapy: the RSSearch® patient Registry’s experience. Radiat Oncol 2017; 12 (1): 35. doi: 10.1186/s13014-017-0773-4.
80. Burkon P, Kazda T, Pospisil P et al. Ablative dose stereotactic body radiation therapy for oligometastatic disease: a prospective single institution study. Neoplasma 2018; pii: 180731N558. doi: 10.4149/neo_2018_180731N558.
81. Mahadevan A, Blanck O, Lanciano R et al. Stereotactic body radiotherapy (SBRT) for liver metastasis – clinical outcomes from the international multi-institutional RSSearch® Patient Registry. Radiat Oncol 2018; 13 (1): 26. doi: 10.1186/s13014-018-0969-2.
82. Wang XS, Rhines LD, Shiu AS et al. Stereotactic body radiation therapy for management of spinal metastases in patients without spinal cord compression: a phase 1–2 trial. Lancet Oncol 2012; 13 (4): 395–402. doi: 10.1016/S1470-2045 (11) 70384-9.
83. Gerszten PC, Burton SA, Ozhasoglu C et al. Radiosurgery for spinal metastases: clinical experience in 500 cases from a single institution. Spine 2007; 32 (2): 193–199. doi: 10.1097/01.brs.0000251863.76595.a2.
84. Sahgal A, Atenafu EG, Chao S et al. Vertebral compression fracture after spine stereotactic body radiotherapy: a multi-institutional analysis with a focus on radiation dose and the spinal instability neoplastic score. J Clin Oncol 2013; 31 (27): 3426–3431. doi: 10.1200/JCO.2013.50. 1411.
85. Sahgal A, Weinberg V, Ma L et al. Probabilities of radiation myelopathy specific to stereotactic body radiation therapy to guide safe practice. Int J Radiat Oncol Biol Phys 2013; 85 (2): 341–347. doi: 10.1016/j.ijrobp.2012.05.007.
86. Cox BW, Jackson A, Hunt M et al. Esophageal toxicity from high-dose, single-fraction paraspinal stereotactic radiosurgery. Int J Radiat Oncol Biol Phys 2012; 83 (5): e661–e667. doi: 10.1016/j.ijrobp.2012.01.080.
87. Casamassima F, Livi L, Masciullo S et al. Stereotactic radiotherapy for adrenal gland metastases: university of Florence experience. Int J Radiat Oncol Biol Phys 2012; 82 (2): 919–923. doi: 10.1016/j.ijrobp.2010.11.060.
88. Scorsetti M, Alongi F, Filippi AR et al. Long-term local control achieved after hypofractionated stereotactic body radiotherapy for adrenal gland metastases: a retrospective analysis of 34 patients. Acta Oncol 2012; 51 (5): 618–623. doi: 10.3109/0284186X.2011.652738.
89. Franzese C, Franceschini D, Cozzi L et al. Minimally invasive stereotactical radio-ablation of adrenal metastases as an alternative to surgery. Cancer Res Treat 2017; 49 (4): 20–28. doi: 10.4143/crt.2016.057.
90. Jereczek-Fossa BA, Ronchi S, Orecchia R. Is stereotactic body radiotherapy (SBRT) in lymph node oligometastatic patients feasible and effective? Rep Pract Oncol Radiother 2015; 20 (6): 472–483. doi: 10.1016/j.rpor.2014.10.004.
91. Jereczek-Fossa BA, Piperno G, Ronchi S et al. Linac-based stereotactic body radiotherapy for oligometastatic patients with single abdominal lymph node recurrent cancer. Am J Clin Oncol 2014; 37 (3): 227–233. doi: 10.1097/COC.0b013e3182610878.
92. Yeung R, Hamm J, Liu M et al. Institutional analysis of stereotactic body radiotherapy (SBRT) for oligometastatic lymph node metastases. Radiat Oncol 2017; 12 (1): 105. doi: 10.1186/s13014-017-0820-1.
93. Bae SH, Kim MS, Cho CK et al. High dose stereotactic body radiotherapy using three fractions for colorectal oligometastases. J Surg Oncol 2012; 106 (2): 138–143. doi: 10.1002/jso.23058.
94. Salama JK, Hasselle MD, Chmura SJ et al. Stereotactic body radiotherapy for multisite extracranial oligometastases: final report of a dose escalation trial in patients with 1 to 5 sites of metastatic disease. Cancer 2012; 118 (11): 2962–2970. doi: 10.1002/cncr.26611.
95. Milano MT, Katz AW, Zhang H et al. Oligometastases treated with stereotactic body radiotherapy: long-term follow-up of prospective study. Int J Radiat Oncol Biol Phys 2012; 83 (3): 878–886. doi: 10.1016/j.ijrobp.2011.08.036.
96. Jereczek-Fossa BA, Bossi-Zanetti I, Mauro R et al. CyberKnife robotic image-guided stereotactic radiotherapy for oligometastic cancer: a prospective evaluation of 95 patients/118 lesions. Strahlenther Onkol 2013; 189 (6): 448–455. doi: 10.1007/s00066-013-0345-y.
97. Comito T, Cozzi L, Clerici E et al. Stereotactic ablative radiotherapy (SABR) in inoperable oligometastatic disease from colorectal cancer: a safe and effective approach. BMC Cancer 2014; 14 : 619. doi: 10.1186/1471-2407-14-619.
98. Heron DE, Ferris RL, Karamouzis M et al. Stereotactic body radiotherapy for recurrent squamous cell carcinoma of the head and neck: results of a phase I dose-escalation trial. Int J Radiat Oncol Biol Phys 2009; 75 (5): 1493–1500. doi: 10.1016/j.ijrobp.2008.12.075.
99. Cengiz M, Özyiğit G, Yazici G et al. Salvage reirradiaton with stereotactic body radiotherapy for locally recurrent head-and-neck tumors. Int J Radiat Oncol Biol Phys 2011; 81 (1): 104–109. doi: 10.1016/j.ijrobp.2010.04.027.
100. Hara W, Loo Jr BW, Goffinet DR et al. Excellent local control with stereotactic radiotherapy boost after external beam radiotherapy in patients with nasopharyngeal carcinoma. Int J Radiat Oncol Biol Phys 2008; 71 (2): 393–400. doi: 10.1016/j.ijrobp.2007.10.027.
101. Kaplan ID, Redrosa I, Martin C et al. Results of a phase I dose escalation study of stereotactic radiosurgery for primary renal tumors. Int J Radiat Oncol Biol Phys 2010; 78 (3): S191. doi: 10.1016/j.ijrobp.2010.07.464.
102. Kemmerer E, Hernandez E, Ferriss JS et al. Use of image-guided stereotactic body radiation therapy in lieu of intracavitary brachytherapy for the treatment of inoperable endometrial neoplasia. Int J Radiat Oncol Biol Phys 2013; 85 (1): 129–135. doi: 10.1016/j.ijrobp.2012.02.058.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2019 Issue 1
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Extrakraniální stereotaktická radioterapie – přehled současných indikací
- Mají subtypy HER2 pozitivního karcinomu prsu význam pro klinickou praxi?
- Zhubné nádory penisu – diagnostika a liečba
- Plazmocelulární leukemie – zapomenutá nemoc
- Brachyterapie s vysokým dávkovým příkonem v léčbě časných stadií karcinomu penisu
- Vliv velikosti nádorové masy a stavu p16 na léčebné výsledky – dosažení kompletní remise u prospektivně sledovaných pacientů s nádory orofaryngu
- Rozvoj rezistentní GvHD u pacientky léčené nivolumabem pro relaps Hodgkinova lymfomu po alogenní nepříbuzenské transplantaci
- Účinná imunoterapie glioblastomu u adolescenta se syndromem konstitučního deficitu v mismatch repair opravném systému
- Epidemiologie plazmocelulární leukemie v České republice
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Zhubné nádory penisu – diagnostika a liečba
- Extrakraniální stereotaktická radioterapie – přehled současných indikací
- Vliv velikosti nádorové masy a stavu p16 na léčebné výsledky – dosažení kompletní remise u prospektivně sledovaných pacientů s nádory orofaryngu
- Mají subtypy HER2 pozitivního karcinomu prsu význam pro klinickou praxi?
