68Ga-DOTA-TOC PET/CT vyšetření u pacienta s gastroenteropankreatickým neuroendokrinním nádorem – první vyšetření v České republice
Authors:
Beatrix Bencsiková 1; Zdeněk Řehák 2; Michal Budinský 3; Renata Hejnová 4; Šárka Kozáková 3; Igor Kiss 1; Regina Demlová 3; Marek Svoboda 1,5
Authors‘ workplace:
Klinika komplexní onkologické péče, LF MU a Masarykův onkologický ústav, Brno
1; Oddělení nukleární medicíny, Masarykův onkologický ústav, Brno
2; Ústavní lékárna, Masarykův onkologický ústav, Brno
3; Oddělení klinických hodnocení, Masarykův onkologický ústav, Brno 5 Oddělení genetiky a epidemiologie nádorů, Masarykův onkologický ústav, Brno
4
Published in:
Klin Onkol 2019; 32(5): 390-392
Category:
Oncology Highlights
Úvod
Neuroendokrinní nádory (NEN) představují velmi heterogenní skupinu nádorů vznikajících z buněk difuzního neuroendokrinního systému, jejichž definujícím znakem je endokrinní diferenciace nádorových buněk spojená se schopností produkovat, hromadit a uvolňovat biologicky aktivní látky hormonální povahy [1]. Nejčastějšími lokalizacemi NEN jsou zažívací trakt od žaludku po rektum, pankreas (tzn. gastroenteropankreatické neuroendokrinní nádory – GEP NEN) a dýchací cesty. Méně obvyklými primárními lokalizacemi NEN jsou ovaria, kůže, zcela raritně střední ucho nebo jinde [2]. Společnou vlastností NEN je exprese somatostatinových receptorů pěti podtypů (SSTR1–5). GEP NEN vykazují vždy expresi více než jednoho podtypu receptorů, nejčastěji je však zastoupen podtyp SSTR 2 [3].
Obecně je diagnostika GEP NEN metodami nukleární medicíny založena na zobrazování SSTR v ložisku. Dnešní kamery k zobrazování jsou vesměs hybridní – jednofotonová emisní výpočetní tomografie (single-photon emission computed tomography) a výpočetní tomografie (computed tomography) (SPECT/CT), pozitronová emisní tomografie a výpočetní tomografie (PET/CT) nebo pozitronová emisní tomografie a magnetická rezonance (magnetic resonance imaging) (PET/MRI) kombinující metabolické zobrazení (SPECT/PET) s morfologickým zobrazením (CT/MRI). V konvenční (planární a SPECT) diagnostice byl prvním, od roku 1994 využívaným radiofarmakem pro zobrazování GEP NEN 111In-pentetreotid (OctreoScan, Mallinckrodt Medical BV, Le Petten, Nizozemí) [4]. Méně rozšířené je v ČR další radiofarmakum pro konvenční (planární a SPECT) diagnostiku, a to 99mTc-HYNIC octreotid (Tektrotyd, Narodowe Centrum Badań Jadrowych Polatom, Otwock, Polsko) [5]. PET proti konvenční (planární a SPECT) scintigrafii nabízí zejména výrazně lepší rozlišení, což je dáno hlavně díky zobrazení dvou fotonů místo jednoho i koincidenční detekcí místo kolimované [6]. Nejrozšířenější z pozitronových radiofarmak, tzv. DOTA-konjugovaných peptidů značených galliem-68 (68Ga), je 68Ga DOTA-TOC. Toto radiofarmakum nabízí vyšší afinitu k somatostatinovým receptorům podtypu SSTR2 a doplňkově afinitu i k receptorům podtypu SSTR5. První údaje o klinickém využití radiofarmaka 68Ga-DOTA-TOC pocházejí již z roku 2001 [7]. 68Ga-DOTA-TOC PET/CT vyšetření proti scintigrafii 111In-pentetreotidem (OctreoScan) má vyšší senzitivitu (96 vs. 86 %) a výrazně vyšší i specifitu (93 vs. 50 %) [8]. Je proto logické, že dnes je toto vyšetření u pacientů s GEP NEN považováno za metodu volby k diagnostice, lokalizaci a sledování pacientů. Dále je doporučeno pro výběr pacientů s metastatickým onemocněním před terapií DOTA-peptidy s terapeutickým radionuklidem (luteciem 177Lu nebo ytriem 90Y). U pacientů s jinými nádory lze vyšetření využít k průkazu exprese SSTR v daném typu nádoru před zvážením terapie somatostatinovými analogy [9]. Vyšetření PET/CT s 68Ga-DOTA-TOC proti konvenční (planární a SPECT) scintigrafii s 111In-pentetreotidem (OctreoScan) přináší řadu výhod [10–13]:
- zrychluje celé vyšetření, které tak trvá celkově méně než 2 hod (akumulace 45–90 (optimálně 60) min, poté snímání do 25 min). Naproti tomu scintigrafie s 111In-pentetreotidem (OctreoScan) vyžaduje akumulaci 4–5 hod s následným snímáním a opakovanými snímáními po 24 hod, někdy i 48 hod, často i s nutností použít laxativum;
- lépe vizualizuje malé léze, lépe hodnotí ložiska zejména v játrech a skeletu, nabízí možnost kvantifikací;
- snižuje radiační zátěž pro pacienta (efektivní dávka 4,2 mSv vs. 12 mSv z obvyklých aplikovaných aktivit radiofarmak bez příspěvku CT);
- díky kratšímu poločasu rozpadu radionuklidu (68 min vs. 67 hod) mimo jiné výrazně snižuje radiační zátěž po vyšetření pro osoby v blízkosti pacienta (personál, rodinu).
Nevýhodou zůstává relativní nedostupnost v ČR a absence úhrady (aktuálně v červenci 2019). Proto Masarykův onkologický ústav, který je uznaným centrem pro léčbu NEN v rámci evropské referenční sítě EURACAN, vytvořil a financuje projekt zaměřený na diagnostiku NEN pomocí 68Ga-DOTA-TOC PET/CT ve formě neintervenční poregistrační akademické klinické studie. Přitom předpokládá, že do ukončení projektu bude nalezeno financování z veřejného zdravotního pojištění, aby se toto vyšetření mohlo provádět i v dalších PET centrech v ČR.
Studie potrvá 1,5 roku a může zařadit cca 50 dospělých pacientů s potvrzenými nebo suspektními dobře diferencovanými GEP NEN. U těchto pacientů půjde o:
- zjištění primárního nádoru;
- zjištění rozsahu onemocnění před chirurgickým výkonem nebo lokální léčbou;
- upřesnění diagnostiky recidiv;
- zpřesnění rozsahu metastatického postižení u nových pacientů i pacientů v léčbě.
Kazuistika
Čtyřiapadesátiletý pacient s metastatickým NEN ilea grade 2 zahájil léčbu v prosinci 2015. Anamnesticky byly u pacienta dlouhodobě zažívací potíže, průjmy, bolesti břicha, nadýmání. Pro zhoršení bolestí v epigastriu v listopadu 2015 bylo provedeno ultrazvukové vyšetření břicha s nálezem jaterních ložisek, pacient byl dále došetřován. V prosinci 2015 byla provedena operační revize a resekce nádoru ilea, nález byl multifokální. Peroperačně byl nález dalších ložisek proximálně na tenké kličce, hmatný paket uzlin v radixu mezenteria a při aortě, bez možnosti chirurgického odstranění. Histologické vyšetření prokázalo multifokální NEN grade 2, chromogranin A pozitivní, synaptofyzin pozitivní, Ki67 5%. Pacient byl následně odeslán na naše pracoviště. Vstupní scintigrafie s 111In-pentetreotidem (OctreoScan) v lednu 2016 prokázala pouze patologickou akumulaci radiofarmaka v paketu uzlin v radixu mezenteria. Vyšetření CT zobrazilo několik ložisek v obou lalocích jater a patologickou lymfadenopatii v mezenteriu při radixu. Pacient zahájil léčbu analogem somatostatinu (Sandostatin LAR, Novartis, Basilej, Švýcarsko) od února 2016 a od listopadu 2016 v kombinaci s interferonem-alfa-2b (IntronA, Merck Sharp & Dohme Limited, Hoddesdon, Velká Británie). Od března 2019 se u pacienta objevily nové potíže, bolesti břicha, hubnutí. CT vyšetřením byla prokázána pouze mírná progrese lymfadenopatie v mezenteriu, retroperitoneu a radixu mezenteria. V rámci restagingu jsme tedy doplnili funkční zobrazovací 68Ga-DOTA-TOC PET/CT vyšetření s cílem upřesnění rozsahu nemoci před další zvažovanou onkologickou léčbou. Vyšetření proběhlo dne 26. června 2019 jako první vyšetření tohoto typu v ČR.
Příprava radiofarmaka
Radiofarmakum, edotreotid značený 68Ga, bylo připraveno z registrovaných přípravků – radionuklidový generátor jako zdroj radionuklidu v podobě chloridu galitého (68Ga) – GalliaPharm 1,48 GBq radionuklidový generátor (Eckert & Ziegler RadioPharma GmbH, Berlín, Německo) a SomaKit TOC 40 μg kit pro radiofarmakum (Advanced Accelerator Applications, Saint Genis Pouilly, Francie). Radionuklidový generátor byl eluován 5 ml 0,1 M kyseliny chlorovodíkové přímo do lahvičky kitu SomaKit TOC. Po přidání 0,5 ml reakčního pufru byl přípravek inkubován při teplotě 95 °C po dobu 7 min (C-MAG HS 7, ETS-D5, Ika Werke GmbH, Staufen, Německo). Po 10 min chlazení při pokojové teplotě bylo provedeno hodnocení jakosti přípravku dle požadavků Souhrnu údajů o přípravku (vzhled, pH, efektivita značení radionuklidem – koloidní formy 68Ga a volné 68Ga). Po uvolnění přípravku k aplikaci bylo radiofarmakum rozplněno do injekční stříkačky s využitím µDDS-A (Tema Sinergie, Faenza, Itálie). Takto připravené radiofarmakum bylo předáno k aplikaci na oddělení nukleární medicíny.
PET/CT vyšetření
Aplikace 202 MBq radiofarmaka byla provedena intravenózně (i.v.) kanylou s proplachem 20 ml fyziologického roztoku. Snímání proběhlo na PET/CT skeneru Biograph mCT Flow SIEMENS (Erlangen, Německo), zahájeno bylo v 56. min od aplikace diagnostickým CT s perorálním ( p. o.) podáním kontrastní látky 20 ml Ultravist 350 (Bayer AG, Leverkusen, Německo) i s i.v. podáním kontrastní látky 80 ml Iomeron 400 (Bracco, Milán, Itálie). Parametry snímání: 80 kV 130 mAs eff., pitch 1,4 CARE Dose 4D zapnuto, CARE kV zapnuto, station time 0,5 s, slice 5 mm. Rekonstrukce řezů proběhla iterační metodou, Siemens SAFIRE zapnuto. V 60. min následovalo snímání PET v délce 20 min v rozsahu vertex – kolena se vzpažením horních končetin (obr. 1). Vyhodnocení proběhlo na konzolích Siemens se softwarem Syngovia. PET snímky byly rekonstruovány iterativní metodou s 2 iteracemi a 21 subsety, ImageSize 200 × 200, FWHM 4,0 mm, metoda rekonstrukce TrueX + TOF (ultraHD PET). Obrazy vyšetření byly hodnoceny jak vizuálně, tak i semikvantitativně. Nález byl hodnocen jako pozitivní, pokud akumulace v ložisku převyšovala akumulaci jaterní v parametru SUVmax (max. hodnota standardized uptake value). Další referenční akumulace jsme stanovovali v hýžďovém svalu a aortální blood-pool.
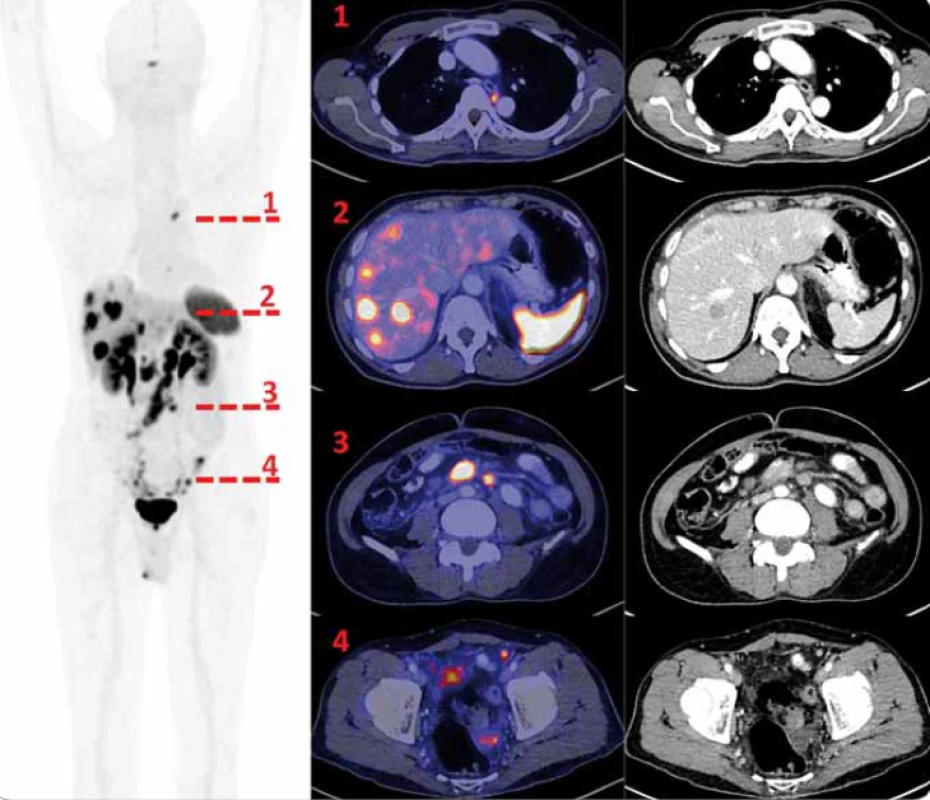
Výsledky
Akumulace radiofarmaka v hypofýze, slezině a při vylučování radiofarmaka i v ledvinách, močovém měchýři a kapku kontaminace močí na spodním prádle pacienta jsme hodnotili jako fyziologické. Jako patologické akumulace jsme hodnotili ložiska v mediastinu, mnohočetně v játrech, v uzlinách retroperitonea oboustranně, v mezenteriu, drobná ložiska na kličkách střevních a v pánvi (obr. 1). Referenční akumulace: játra SUVmax 4,86; aortální blood-pool SUVmax 1,63; hýžďové svalstvo SUVmax 0,93. Patologické akumulace (uvádíme nejvyšší v dané lokalizaci): jaterní ložiska SUVmax 40,08; mediastinální uzliny (SUVmax 11,11); retroperitoneální uzliny (SUVmax 29,06); mezenteriální uzliny (SUVmax 17,66); drobná ložiska na kličkách střevních a v pánvi (SUVmax 14,29).
Závěr
68Ga-DOTA-TOC PET/CT vyšetření jsme prováděli u pacienta se známým nálezem GEP NEN i přibližným rozsahem onemocnění. Potvrzujeme, že toto vyšetření je v současnosti v ČR proveditelné, v našem případě ve formě neintervenční poregistrační akademické klinické studie, kde výrobu radiofarmaka 68Ga-DOTA-TOC hradí ze svých prostředků Masarykův onkologický ústav. Předpokládáme, že nejpozději do ukončení studie bude pro toto vyšetření nalezeno financování z veřejného zdravotního pojištění, aby se mohlo provádět i v dalších PET centrech v ČR.
Tato práce byla podpořena grantem MZ ČR – RVO (MOÚ, 00209805).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato/Accepted: 26. 7. 2019
MUDr. Beatrix Bencsiková, Ph.D.
Klinika komplexní onkologické péče Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: bencsikova@mou.cz
Sources
1. Mandys V. Patologie. In: Sedláčková E, Bajčiová V et al. Neuroendokrinní nádory. Maxdorf: Praha 2016.
2. Vítek P. Neuroendokrinní nádory. In: Onkologie v klinické praxi. Standardní přístupy v diagnostice a léčbě vybraných zhoubných nádorů. Praha: Mladá fronta 2019.
3. Bencsiková B. Antiproliferační účinek analog somatostatinu – analýza dat a klinické aplikace v kontextu výsledků studie CLARINET. Klin Onkol 2016; 29 (4): 253–258. doi: 10.14735/amko2016253.
4. Kubinyi J. Funkční zobrazovací vyšetření. In Sedláčková E, Bajčiová V et al. Neuroendokrinní nádory. Maxdorf: Praha 2016.
5. Táborská K. Somatostatinová receptorová scintigrafie 99mTc-EDDA/HYNIC-TOC první klinické zkušenosti v České republice. Nukl Med 2012; 1: 7–12.
6. Rahmim A, Zaidi H. PET versus SPECT: strengths, limitations and challenges. Nucl Med Commun 2008, 29 (3): 193–207. doi: 10.1097/MNM.0b013e3282f3a515.
7. Hofmann M, Maecke H, Borner R et al. Biokinetics and imaging with the somatostatin receptor PET radioligand 68Ga-DOTATOC: preliminary data. Eur J Nucl Med 2001; 28 (12): 1751–1757. doi: 10.1007/s002590100639.
8. Gabriel M, Decristoforo C, Kendler D et al. 68Ga-DOTA-Tyr3-Octreotide PET in neuroendocrine tumors: comparison with somatostatin receptor scintigraphy and CT. J Nucl Med 2007; 48 (4): 508–518.
9. Virgolini I, Ambrosini V, Bomanji JB et al. Procedure guidelines for PET/CT tumour imaging with 68Ga-DOTA-conjugated peptides: 68Ga-DOTA-TOC, 68Ga-DOTA-NOC, 68Ga-DOTA-TATE. Eur J Nucl Med Mol Imaging 2010; 37 (10): 2004–2010. doi: 10.1007/s00259-010-1512-3.
10. Graham MM, Gu X, Ginader T et al. 68Ga-DOTATOC imaging of neuroendocrine tumors: a systematic review and metaanalysis. J Nucl Med 2017; 58 (9): 1452–1458. doi: 10.2967/jnumed.117.191197.
11. Bombardieri E, Coliva A, Maccauro M et al. Imaging of neuroendocrine tumours with gamma-emitting radiopharmaceuticals. Q J Nucl Med Mol Imaging 2010; 54 (1): 3–15.
12. Švec P, Hrubý M. Radiofarmaka pro diagnostiku a terapii neuroendokrinních nádorů. Chem Listy 2017; 111 (1): 3–10.
13. Teunissen JJ, Kwekkeboom DJ, Valkema R et al. Nuclear medicine techniques for the imaging and treatment of neuroendocrine tumours. Endocr Relat Cancer 2011; 18 (Suppl 1): S27–S51. doi: 10.1530/ERC-10-0282.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2019 Issue 5
- Metamizole vs. Tramadol in Postoperative Analgesia
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Current Insights into the Antispasmodic and Analgesic Effects of Metamizole on the Gastrointestinal Tract
- Obstacle Called Vasospasm: Which Solution Is Most Effective in Microsurgery and How to Pharmacologically Assist It?
- Spasmolytic Effect of Metamizole
Most read in this issue
- Alopecie a poškození vlasů indukované onkologickou terapií
- Pseudomyxom peritonea
- Maligní peritoneální mezoteliom a jeho léčba
- Maligní nádory peritonea – úvod do problematiky
