TSEI u pacientů s mycosis fungoides – klinické výsledky
TSEI in patients with mycosis fungoides – clinical results
Background: Total skin electron irradiation (TSEI) therapy is a complex method for delivering superficial irradiation to entire skin surface for patients with cutaneous T-cell lymphoma, especially with mycosis fungoides (MF). The purpose of this report is to describe the method and evaluate short - and long-term clinical results of TSEI.
Patients and methods: At the Department of Oncology, Regional Hospital České Budějovice, 88 patients were treated with TSEI in the years 1993–2020. In the group of patients, there were 62 males (70%) and 26 females (30%), the average age was 62 (34–85) years, histology: MF: N = 83 (94%), cutaneous T-cell lymphoma N = 2, leukemia N = 3. TNMB (tumor, node, metastasis, blood): stage I: N = 13 (15.3%), stage II: N = 49 (57.7%), stage III: N = 16 (18.8%), stage IV N = 7 (8.2%). We modified the TSEI technique developed at McGill University, Montreal [1], for our conditions. The daily dose is 2 Gy, i.e. 10 Gy/week; the planned total dose is 30–36 Gy. The patient is in a “ballet dancer” position and rotates on the carrousel at 4 turn/min. Two compound fields produce a uniform dose distribution over the total patient height at the source skin distance 355 cm, with the electron energy 6 MeV. The treatment time is 4 + 4 min. The majority of patients (86%) received rotatory TSEI; only elderly and weak patients underwent a static technique (14%).
Results: Following TSEI with doses > 30 Gy, a 100% complete response was achieved. The overall survival for 85 patients in 5 and 10 years was 53.5% and 26.8%, respectively. The overall survival for stage I was 79.2 and 42.5%, for stage II – 61.2 and 33.6%, for stage III – 13.4 and 0% and for stage IV – 68.6 and 0%. The cause specific survival: 25 patients (28.4%) died of MF. “Week timing”, i.e. prolongation of the overall time for TSEI, brings an important reduction of early TSEI side effects (by 70–80%).
Conclusion: TSEI is efficient and well tolerated in patients with MF. All our patients had benefit from TSEI. Some of them achieved long time remission and some of them received good palliation treatment. The quality of life was improved in all cases.
Keywords:
radiotherapy – mycosis fungoides – clinical results
Authors:
M. Dolečková; A. Chourová; D. Králová; P. Berkovský
Authors‘ workplace:
Onkologické oddělení, Nemocnice České Budějovice, a. s.
Published in:
Klin Onkol 2020; 33(Suppl 1): 65-79
Category:
Original Articles
doi:
https://doi.org/10.14735/amko2020S65
Overview
Východiska: Terapie celotělovým ozářením kůže elektronovým svazkem (total skin electron irradiation – TSEI) je komplexní metoda pro dodání dávky na celý povrch pokožky u pacientů s kožním lymfomem T buněk, zejména mycosis fungoides (MF). Účelem této práce je popsat metodu a zhodnotit krátkodobé a dlouhodobé klinické výsledky TSEI.
Soubor pacientů a metody: V letech 1993–2020 bylo na Onkologickém oddělení Nemocnice České Budějovice, a. s., technikou TSEI léčeno 88 pacientů. V souboru bylo 62 mužů (70 %) a 26 žen (30 %), průměrný věk byl 62 (34–85) let. Histologie: MF: n = 83 (94 %), kožní lymfom T buněk: n = 2, leukemie: n = 3. TNMB (nádor, uzlina, metastáza, krev – tumor, node, metastasis, blood): stadium I: n = 13 (15,3 %), stadium II: n = 49 (57,7 %), stadium III: n = 16 (18,8 %), stadium IV: n = 7 (8,2 %). Techniku TSEI vyvinutou na McGill University v Montrealu [1] jsme upravili pro naše podmínky. Denní dávka je 2 Gy, 10 Gy/týden, celková plánovaná dávka je 30–36 Gy. Pacient je v pozici „baletky“ a otáčí se na točně rychlostí 4 ot./min. Složením dvou elektronových polí (energie 6 MeV) se získá rovnoměrné rozložení dávky po celé výšce pacienta při vzdálenosti zdroje záření a kůže 355 cm. Doba ozáření je 4 + 4 min. Většina pacientů obdržela rotační TSEI (86 %), pouze staří a slabí pacienti podstoupili statické ozáření (14 %).
Výsledky: Po TSEI s dávkou > 30 Gy dosáhlo kompletní odpovědi 100 % pacientů. Celkové 5leté a 10leté přežití u 85 pacientů bylo 53,5 a 26,8 %, celkové přežití pro stadium I bylo 79,2 a 42,5 %, pro stadium II bylo 61,2 a 33,6 %, pro stadium III bylo 13,4 a 0 %, pro stadium IV bylo 68,6 a 0 %. Specifické přežití: na MF zemřelo 25 pacientů (28,4 %). „Week timing“, prodloužení celkového času TSEI, přináší významné snížení časných nežádoucích účinků TSEI (o 70–80 %). Závěr: TSEI je účinná a dobře tolerovaná léčba pacientů s MF. Všichni naši pacienti měli z TSEI prospěch. Někteří z nich dosáhli dlouhodobé remise, někteří dobrého paliativního efektu. Kvalita života se zlepšila u všech pacientů.
Klíčová slova:
radioterapie – mycosis fungoides – klinické výsledky
Úvod
Mycosis fungoides (MF) je onemocnění, které patří mezi nízce agresivní, extranodální T-cell non-hodgkinské lymfomy, jde o výsledek nekontrolované klonální proliferace malých až středních CD4+ helper T lymfocytů s cerebriformním jádrem. Sézaryho syndrom (SS), často uváděný jako leukemická varianta MF, je leukemický podtyp kožního T buněčného lymfomu (cutaneous T-cell lymphoma – CTCL) spojovaný s erytrodermií.
Pro pacienty je onemocnění závažné nejen proto, že jde o maligní onemocnění, ale velmi často svým kožním projevem pacienty hyzdí, deklasuje, vyřazuje je z běžné pracovní činnosti a ze společnosti. K tomu přispívají obtěžující symptomy u pokročilých lézí – krvácení a sekrece, a především u erytrodermy nezvladatelný pruritus a trvalé šupinatění kůže.
TNMB klasifikace z roku 2007
- T1 skvrny, papuly a/nebo plaky na < 10 % povrchu těla, T1a pouze skvrny, T1b plaky ± skvrny
- T2 skvrny, papuly nebo plaky na ≥ 10 % povrchu těla, T2a pouze skvrny, T2b plaky ± skvrny
- T3 jeden nebo více tumorů (≥ 1 cm v průměru)
- T4 generalizovaná erytrodermie – skvrny a/nebo infiltrovaná ložiska na ≥ 80 % povrchu těla
- N0 klinicky nejsou přítomny abnormální lymfatické uzliny
- N1 lymfatické uzliny zvětšeny, ale nejsou postiženy MF, histologie dle Dutch systému grade1
- N2 lymfatické uzliny zvětšeny, histologicky pozitivní, dle Dutch systému grade 2
- N3 lymfatické uzliny zvětšeny a histologicky pozitivní, dle Dutch systému grade 3–4, pozitivní nebo negativní klonalita
- Nx klinicky abnormální lymfatické uzliny, histologicky nevyšetřeny
- M0 bez orgánového postižení
- M1 postižení mimokožních orgánů, nutná histologická verifikace (kromě postižení sleziny a jater)
- B0 atypické Sézaryho buňky ≤ 5 % cirkulujících lymfocytů
- B1 atypické Sézaryho buňky >5 % cirkulujících lymfocytů
- B2 atypické Sézaryho buňky ≥ 1 000/µl
Pozn.: skupina N1, N2, B0 a B1 se dělí na podskupiny:
a – neprokázána klonalita TCR (T-cell receptor) T lymfocytů
b – prokázána klonalita TCR T lymfocytů pomocí PCR nebo Southern blot analýzy
Histologický staging pro lymfatické uzliny – Dutch systém:
- N1 – grade 1: dermatopatická lymfadenopatie
- N2 – grade 2: časné postižení při MF (přítomna cerebriformní jádra > 7,5 µm)
- N3 – grade 3: částečné setření struktury
- grade 4: úplné setření struktury uzliny maligními buňkami T
skvrna (patch) je jakákoli kožní léze bez indurace
plak (plaque) je jakákoli kožní léze s indurací, vyvýšením oproti zdravé kůži
tumor je jakákoli solidní nebo nodulární léze ≥ 1 cm v průměru s patrnou infiltrací kůže a/nebo s patrným vertikálním růstem ≥ 5 mm nad niveau
N abnormální uzlina je tuhá, nepravidelná, fixovaná nebo uzlina větší než 1,5 cm. Pro klasifikaci se berou v potaz jen periferní lymfatické uzliny
M musí být biopticky verifikováno, postižení jater a sleziny může být dokumentováno pouze zobrazovacími metodami
B Sézaryho buňky jsou definovány jako cirkulující atypické buňky se zprohýbaným, cerebriformním jádrem s prokázanou klonalitou TCR. V případě, že není možné použít Sézaryho buňky ke stanovení masy nádoru (stadium B0–2), lze je v případě prokázané klonality TCR nahradit jedním z následujících: CD4/CD8 ≥ 10, CD4+CD7 – ≥ 40 % nebo CD4+CD26 – ≥ 30 %
Klinická stadia dle ISCL/EORTC 2007 pro MF/SS
Klinické stadium TNMB klasifikace
IA T1 N0 M0 B0–1
IB T2 N0 M0 B0–1
IIA T1–2 N1–2 M0 B0–1
IIB T3 N0–2 M0 B0–1
IIIA T4 N0–2 M0 B0
IIIB T4 N0–2 M0 B1
IVA T1–4 N0–2 M0 B2
IVB T1–4 N0–3 M1 B0–2
SS je definován jako klinické stadium IV (T4 N0–2 M0–1 B2) [2].
Infiltrace vlasových folikulů (folikulotropizmus) nebo > 25 % velkých buněk v kožních infiltrátech jsou histologické ukazatele, které mohou mít negativní vliv na prognózu [3]. Body surface area (BSA) udává procentuální rozsah postižené kůže. Dlaň s prsty lze považovat za 1 % BSA. Modified severity weighted assesment tool (mSWAT) se používá nejen pro přesnější určení postižení kůže MF, ale především pro hodnocení léčebné odpovědi. Výpočet: procento postižení tělesného povrchu se násobí faktorem závažnosti pro jednotlivý typ postižení (patch = 1, plaky = 2, tumory = 4).
V době diagnózy MF má více než 80 % pacientů onemocnění v podobě patch a plaků, jejich prognóza je dobrá, medián celkového přežití (overall survival – OS) je 15–30 let [4]. Ale asi u 25 % z nich se vyvine progresivní onemocnění [5]. Někteří autoři uvádějí progresi onemocnění u většiny pacientů během měsíců a let [6], udávaný medián OS je 1–5 let [7].
Léze CTCL jsou často kvůli poškozené kožní bariéře s imunitní dysfunkcí kolonizovány bakterií Staphylococcus aureus, produkující enterotoxin. Stafylokokový enterotoxin zvyšuje proliferaci maligních T buněk a vytváří maligní inflamaci. Tuto teorii podporuje série studií, které ukazují, že antibiotická léčba vede nejen k eliminaci infekce Staphylococcus aureus, ale je spojena i se signifikantním klinickým zlepšením u většiny kolonizovaných pacientů. U některých pacientů má antibiotická léčba za výsledek kompletní klinickou odpověď [8].
Léčba mycosis fungoides
Management léčby je multidisciplinární. Výběr léčby závisí především na rozsahu onemocnění, ale také na celkovém stavu pacienta, jeho přání a dostupnosti léčby.
Terapie cílená na kůži (skin-directed therapy – SDT) je aplikována u časných stadií MF (IA–IIA). Prognóza je příznivá u SDT jako první linie léčby. Kompletní remise (complete remission – CR) je dlouhá, ale kurabilita onemocnění je nejistá.
Systémová léčba je především indikována jako samostatná, ev. v kombinaci většinou s celotělovým ozářením kůže elektronovým svazkem, (total skin electron irradiation – TSEI) u pokročilejších MF (stadium IIB–IVB), léčba je často refrakterní a prognóza nepříznivá. Proto se také používá jako léčba konsolidační k udržení dobrého efektu základní léčby (např. po TSEI) anebo v kombinaci zejména u relapsů MF.
Revidovaná guidelines společností International Society for Cutaneous Lymphomas (ISCL), United States Cutaneous Lymphoma Consortium (USCLC) a Cutaneous Lymphoma Task Force of the European Organisation of Research and Treatment of Cancer (EORTC) shrnula v roce 2010 léčebné optimum pro MF/SS do National Comprehensive Cancer Network (NCCN) guidelines [9].
Zhodnocení pacienta, stanovení TNMB a prognózy
- Posouzení prognózy: příznivá je u limitovaného onemocnění MF (riziko pro progresi onemocnění v 5 letech u T1 10 %, u T2 22 %, u T3 48 % a T4 56 %), SS je spojen se špatnou prognózou.
Terapie cílená na kůži
- Topické kortikosteroidy III. a IV. třídy s okluzní fólií – nejběžnější léčba u časných MF (CR u T1 63 %, u T2 25 %), slouží také jako přídavek k jiné topické nebo systémové léčbě u všech stadií.
- Topický nitrogen mustard (mechlorethamin hydrochlorid – NH2) a fototerapie (ultraviolet B 311–312 nm nebo 290–320 nm) mají podobnou úspěšnost u časných stadií MF. NH2 indukuje CR ve 30–60 %, relaps nastane spolehlivě.
- Fototerapie s psoralenem – PUVA (8-methoxypsoralen p. o. a ultraviolet A 320–400 nm), kdy se využívá fotosenzibilizujících účinků psoralenů. CR až 71,4 % u časných stadií, u T3 a T4 je efekt menší.
- TSEI se standardní dávkou 30–36 Gy za 8–10 týdnů je efektivní léčba u refrakterní nebo relabující MF (plaky nebo tumory), je spojeno s kožní toxicitou. CR u T2 75 %, u T3 47 % trvání odpovědi je limitováno – medián 29 a 9 měsíců u T2 a T3. Duvic [10] udává, že TSEI nabízí možnost kurability (CR 84 % a OS v 10 letech 46 %), zejména u pacientů s T2. Nízkodávková TSEI 10 Gy, CR a trvání odpovědi závisí na výšce dávky (5–10 Gy: 16 %, 10–20 Gy: 35 %, 20–30 Gy: 34 %, > 30 Gy: 62 %), minimální vedlejší účinky. Lokální radioterapie je vysoce efektní pro lokalizovanou MF T1a. Pro lokalizované tumory či ulcerované, krvácející nebo bolestivé léze jednorázově nebo ve dvou frakcích podat celkem 7–8 Gy s CR > 90 %. Dávkování se liší v různých pracích, frakcionovaná dávka je doporučena pro solitární lézi 20–24 Gy, pro efektivní paliaci (izolované plaky a tumory) 2 × 4 Gy [11].
Systémová terapie
- Bexaroten je více účinný v počátcích onemocnění, často je používán u refrakterního onemocnění všech stadií nebo u pokročilých kožních lymfomů, poměr rizik celková odezva (over-all response – OR) je 44–67 % s různou délkou trvání (1–25 měsíců).
- Interferony (IFN) jsou často používány v první linii monoterapie u pokročilé MF a také jsou používány v nízkých dávkách v kombinaci s topickou léčbou. IFNá vykazuje úspěšnost ve všech stadiích, OR 29–80 % a CR 4–41 %, úspěšnější je u časných stadií MF.
- Vorinostat nebo romidepsin (inhibitory histondeacetylázy) vykazují efekt v monoterapii u MF s postižením kůže, uzlin nebo SS, OR 24–36 %.
- Alemtuzumab je humanizovaná rekombinační IgG1 monoklonální protilátka efektní u erytrodermy MF/SS s OR 86–100 %.
- Brentuximab vedotin – protilátka proti CD30. U MF s expresí CD30 byla nalezena odpověď v 70 % [11].
- Denileukin diftitox (toxin difterie) může být podán u recidivujících nebo perzistentních CTCL, u kterých je ≥ 20% exprese CD25, odpověď na léčbu podle aplikované dávky OR 24,2–36 %, medián trvání 7 měsíců.
Chemoterapie je obecně rezervována pro refrakterní nebo rychle progredující pokročilé onemocnění MF. Jako nejefektivnější kombinace byly hodnoceny CVP (cyklofosfamid – CFA, vincristin – VCR, prednison) a COP-Bleo (CFA, VCR, prednison, bleomycin) speciálně tam, kde byla ložiska na kůži schopna dosáhnout CR po SDT, zvlášť po TSEI. Nízkodávkový methotrexát u refrakterního onemocnění má OR ve 33–59 %, ve vyšších dávkách až 82 %, toxicita především gastrointestinální a hematologická.
- Allogenní transplantace kmenových buněk je rezervována pro pokročilé a refrakterní onemocnění MF s graft-versus-tumor efektem a může mít i kurativní potenciál u MF [12].
- Extrakorporální fotoferéza (buňky jsou po separaci a přidání psoralenu ozařovány mimo tělo a potom navráceny zpět do oběhu) je primárně efektivní u erytrodermie CTCL a SS.
Kombinace TSEI a jiné léčby
U pokročilého onemocnění je možné použít kombinace TSEI a celotělového ozařování (total body irradiation – TBI) [13] nebo polotělového ozařování (hemi-body irradiation – HBI) nebo regionálního ozáření lymfatických uzlin [14]. S výhodou se používá kombinace TSEI s následnou aplikací IFNá, bexaroten v kombinaci s fototerapií, s IFNá a radioterapií [15], retinoidy konkomitantně s TSEI [16].
Záření má cytotoxický efekt způsobený poškozením DNA, zatímco retinoidy modulují buněčné funkce, modifikují imunitu a alterují expresi genů. Kombinace záření a jiné léčebné metody může mít synergický nebo aditivní léčebný efekt. Samozřejmě kombinace léčby může zvýšit toxicitu.
Refrakterní onemocnění je v případě, že na speciální léčbu nereaguje žádnou, ev. jen minimální odpovědí. Onemocnění není považováno za refrakterní v případě relapsu po úspěšné léčbě a léčbu je ev. možné zopakovat.
Radiobiologie
Maligní T lymfocyty MF a SS patří mezi nejvíce radiosenzitivní buňky [17]. Tato radiosenzitivita je stejná jako u normálních T a B lymfocytů. Lineárně kvadratický model ukazuje na významný počet zabitých buněk, poměr á/â > 10. Toto zjištění umožňuje u MF protrahované ozařovací schéma, což zlepšuje terapeutický poměr, tj. poškození nádorových buněk v poměru k poškozeným zdravým buňkám. Umožňuje kontrolu tumoru při minimálním poškození zdravých tkání. Ukazuje se, že buňky MF mají malou schopnost reparace ze subletálního poškození a pauza v léčbě umožní reparaci zdravé tkáně. Onemocnění je v současné době, navzdory vysoké radiosenzitivitě, nevyléčitelné. Prognóza pacientů závisí především na klinickém stadiu. Pětileté OS: stadium IIB: 40–65 %, III: 45–57 %, IVA: 15–40 % [2].
Metoda a pacienti
Radioterapie zůstává jednou z nejefektivnějších léčebných strategií u časných stadií i pokročilejších kožních forem MF, patří do SDT a kromě lokálního ozáření solitárních ložisek se jedná o TSEI. Onemocnění MF často postihuje velké plochy kůže těla a je potřebné ozářit kůži celého těla. Optimální je použít svazek elektronového záření, kterým dodáme dávku do kůže, a potom následuje rychlý dávkový pokles, takže nepoškodíme zdravé tkáně hlouběji pod kůží. Ozařovací technika TSEI je technicky velice náročná, vyvinutá k ozáření kůže celého těla u MF. Vyžaduje lineární urychlovač s adekvátní energií elektronového záření (4–9 MeV, nejčastěji 6 MeV) s vysokým dávkovým příkonem. Zvýšené nároky jsou také na ozařovnu, aby se mohlo dosáhnout velké vzdálenosti kůže od zdroje (source-skin distance – SSD), tj. 3,5–8 m. TSEI klade vysoké nároky především na fyzikální a dozimetrické zázemí (termoluminiscenční dozimetrie (TLD) s možností vyhodnocování). Vyžaduje pracoviště s týmem zkušených fyziků, dozimetristů, techniků, ale i lékařů, radiologických asistentů a zdravotních sester.
Velkoplošné ozáření kůže celého těla [2] bylo poprvé použito v roce 1950, kdy Trump JG poprvé ozářil dva pacienty s MF elektronovým svazkem na motorizovaném ozařovacím stole [6], a poprvé bylo popsáno v roce 1953 [12]. Nadějné výsledky této ozařovací techniky podnítily řadu radioterapeutických center v Evropě, Americe a Kanadě k zahájení TSEI.
V roce 1992 publikoval Freeman CR [1] klinické zkušenosti u 44 pacientů (z let 1981–1989) s T buněčným kožním lymfomem u rotační TSEI techniky vyvinuté v McGillově Univerzitě v Montrealu v roce 1981. V roce 1988 informuje Kumar et al [18] o rotační technice TSEI při použití duálních polí.
Na onkologickém oddělení Nemocnice České Budějovice, a. s., se s ozařováním MF zabýváme od roku 1985. Celotělové ozáření kůže těla jsme prováděli svazkem elektronů energie 6 MeV na betatronu československé výroby. Od roku 1993 jsme s obnovou ozařovačů začali využívat lineárních urychlovačů. Inspiraci jsme našli v publikaci Freemana et al [1]. Náš tehdejší tým fyziků a techniků zajistil výrobu točny pro pacienty a madla upevněného nad točnou ve stropě ozařovny (pacient se vždy střídavě drží rukou madla). Výsledky dozimetrického vyhodnocení dávky na povrchu a v 1 cm pod povrchem na fantomu a ve střední kraniokaudální rovině na povrchu při složení dvou velkých elektronových polí pod úhlem nám dovolilo zahájit rotační techniku TSEI duálních polí v roce 1993. Během let byl komplex točny několikrát upraven, vždy ke zlepšení pohodlí a bezpečnosti pacienta. Postavení pacienta a dávkové vyhodnocení zůstávalo nezměněné. Využíváme elektronové ozáření energie 6 MeV [19,20].
Cílový objem (target volume – TV) TSEI techniky: primárním TV je epidermis, dermis a struktury adnex. Vzhledem k tvarům a anatomii lidského těla je jisté, že nemůže dojít k homogennímu ozáření TV. Heterogenita dávky v TV může být minimalizována použitím více polí (stanfordská technika dynamická šesti duálních polí) anebo naopak rotační technikou jednoho velkého pole (Freemanova technika McGillovy Univerzity v Montrealu) nebo dvěma velkými duálními poli.
Další způsob, jak zhomogenizovat dávku v TV, je dosycení poddávkovaných oblastí (patch treatment) a naopak po dosažení požadované dávky stínit oblasti, které mají, vzhledem k anatomii lidského těla, vyšší dávku. Ložiska MF na kůži mohou mít různou výšku (tloušťku), a proto je vhodné dosycení reziduálních ložisek (boost treatment) před ukončením nebo po ukončení velkoplošného ozáření kůže.
Distribuce hloubkové dávky závisí na několika faktorech: energii elektronového záření, ozařovací technice a použití bolusu. Při statické technice se uplatňuje „build up effect“ a maximální dávka je pod povrchem, proto některá pracoviště používají jako bolus polykarbonovou desku umístěnou před kůží těla pacienta, aby maximální dávka byla na povrchu kůže [21]. Rotační technikou dosáhneme maximální dávky na povrchu kůže.
Cílem TSEI je zajistit dostatečnou a co nejvíce homogenní dávku v cílovém objemu (v kůži celého těla), která zaručí dlouhodobé klinické výsledky, minimální toxicitu a možnost retreatmentu v případě potřeby. Homogenitu dávky u rotační techniky TSEI jednoho velkého pole vyhodnotili v McGillově Univerzitě na ± 10 % [1]. Homogenita dávky u rotační techniky TSEI duálními poli na našem pracovišti je ± 10 % (graf 1). Nejméně dobrá je homogenita u statické techniky (dvě pole, ale i dvě duální pole), kdy maximální dávky jsou na okrajových oblinách těla, kde vznikají jako pozdní změny teleangiektázie, tzv. lampasy. Při stanfordské technice šesti polí by měla být 80% izodóza ≥ 4 mm pod povrchem kůže a 20% izodóza < 20 mm od kožního povrchu [6]. Při rotační technice je maximální dávka na povrchu. Dávka od povrchu do 5 až 10 mm se pohybuje od 100 do 96 až 81 % (data Onkologického oddělení Nemocnice Č. Budějovice, a. s.) (graf 2).


Vzhledem k rozložení dávky záření při TSEI se neočekává systémová toxicita, při dodržování minimální kontaminace elektronového svazku X zářením. Povolená dávka X záření v elektronovém svazku je 0,7 Gy za celou sérii záření TSEI. Na našem pracovišti je na současném lineárním urachlovači TrueBeam ve 100 cm v elektronovém svazku 6 MeV kontaminace fotony 0,5 %, ve 355 cm 1,0 %.
Ve dvou recentních publikacích bylo popsáno po TSEI snížení počtu maligních T lymfocytů v periferní krvi [22]. Ve skupině, která vykazovala odpověď na kůži, mělo 67 % pacientů i odpověď v periferní krvi. Na našem pracovišti měl pacient se SS ozářený rotační technikou TSEI 36 Gy s týdenním timingem před zahájením léčby 12 % maligních T lymfocytů v periferní krvi a po ukončení ozáření poklesly maligní T lymfocyty v periferní krvi na 1 %. Systémová léčba, která byla před TSEI, při níž stoupaly hodnoty maligních lymfocytů v krvi, byla po dobu TSEI ponechána.
Dozimetrie u TSEI
K posouzení povrchové dávky v různých lokalitách se provádí monitoring, nejčastěji pomocí termoluminiscenční dozimetrie (TLD), někdy filmové dozimetrie. Monitoring dávky na různých částech těla slouží k vyhodnocení poddávkování nebo předávkování a provádí se opakovaně v průběhu TSEI.
Na Onkologickém oddělení Nemocnice České Budějovice, a. s., používáme rutinně TLD u každého pacienta z několika důvodů:
- Hned při prvním ozáření rotační (ev. i statickou) TSEI vyhodnocujeme dávku na kůži ve třech bodech na střední vertikální linii těla (AP i PA). Vzhledem k tomu, že pacienti jsou obézní, ale i asteničtí, nám tyto výsledky slouží k posouzení a ev. upřesnění aplikované dávky. Toto měření provádíme při první a druhé frakci záření, protože pacient v postavení baletky střídá postavení nohou a rukou.
- Při následných frakcích standardně provádíme měření i v samostínicích oblastech (temeno, strany krku, axily, submammární oblast u žen, pod pendulujícím břichem, intergluteálně, vnitřní horní plochy stehen) a v oblastech s pravděpodobnou vyšší dávkou (prsty rukou a nohou, rizikový je i velký nos, dolní ret a ev. i lokty), a to vždy v obou postaveních pacienta. Tyto výsledky slouží k propočtu dávky k dosycení poddávkovaných oblastí po dokončení rotační nebo statické TSEI. Podle výsledků vyšších dávek a nálezů ložisek MF v těchto oblastech dáváme pacientovi od určité dávky ke stínění kůže olověné rukavice (tři velikosti) a olověné boty (tři velikosti).
- U větších tumorů nebo velkých plaků, kde po dokončení TSEI zbývá reziduum, nám výsledky dozimetrického hodnocení pomáhají posoudit celkovou dávku při jejich dosycení.
- Individuálně provádíme měření v průběhu TSEI u atypicky uložených ložisek (na očních víčkách, v oblasti anogenitální, paraanálně atd.).
- Výsledky jsou součástí dokumentace pacienta.
Ozařovací pole
Technika TSEI může být realizována pomocí velkých polí – jedno pole, dvě až šest polí. Abychom mohli dosáhnout velkého pole, musíme použít velkého SSD.
SSD
Optimální SSD u ozařovací techniky TSEI je mezi 3–8 m. Při SSD < 3 m je problematické získat homogenní pokrytí TV dávkou záření a dodržet limit fotonové kontaminace. Při SSD > 8 m se významně zvyšuje čas pro frakci záření [4]. Ozařovny jsou projektovány pro klasickou radioterapii, a proto je často obtížné dodržet SSD 3 m, a to vzhledem k velikosti ozařovny a umístění lineárního ozařovače v ozařovně. SSD na našem pracovišti je 355 cm.
Ozařovací poloha
Ozařovací poloha pacienta je různá a závisí na ozařovací technice. V každém případě je důležité, aby záhyby kůže byly co nejvíce vyrovnané, a lokality, které jsou normálně špatně přístupné, se staly pro elektronové záření přístupnější. Každá ze základních ozařovacích technik TSEI má speciální ozařovací polohu pacienta. Technika stanfordské univerzity (dynamická technika) vyžaduje stojícího pacienta, který mění během 2 dní 6× postavení rukou a nohou – postavení „harlekýna“, při translační technice je pacient v poloze na zádech a na břiše.
Na radioterapeutickém pracovišti Nemocnice České Budějovice, a. s., využíváme statickou techniku jen u pacientů starších a slabých, kteří by nezvládli rotační techniku. Pacient stojí na točně a má rozkročené nohy (stojí stabilně v zakreslené poloze nohou na točně) a rukama se drží madel, která jsou umístěna na ochranné stěně kolem točny. Ozařuje se duálními poli zepředu a zezadu, pole mají stabilní úhel: 288° pro horní pole a 252° pro dolní pole (obr. 1).
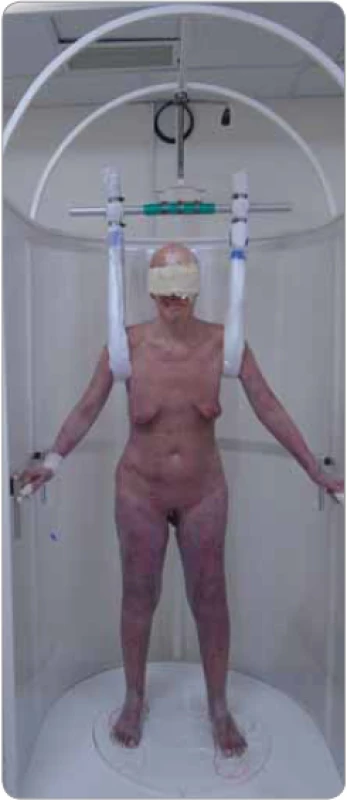
Při rotační duální technice stojí pacient na točně rozkročený, s denním střídáním postavení nohou zakreslených na desce točny a současně se střídáním uchopení jedné ruky madla, které je upevněno ve stropě ozařovny, tedy v postavení „baletky“ (obr. 2). Pacient rotuje na točně, která se automaticky uvede do provozu a ukončuje rotaci se zahájením a ukončením záření. Pacient rotuje konstantní rychlostí 4 ot/min kolem své vertikální osy. Ozářen je postupně dvěma divergentními velkými poli, jejich úhly (288° a 252°) dovolí homogenní ozáření v celé délce pacienta v jedné frakci záření. Rotační technika, navzdory výhodám ve srovnání se stanfordskou technikou TSEI, je méně používaná.
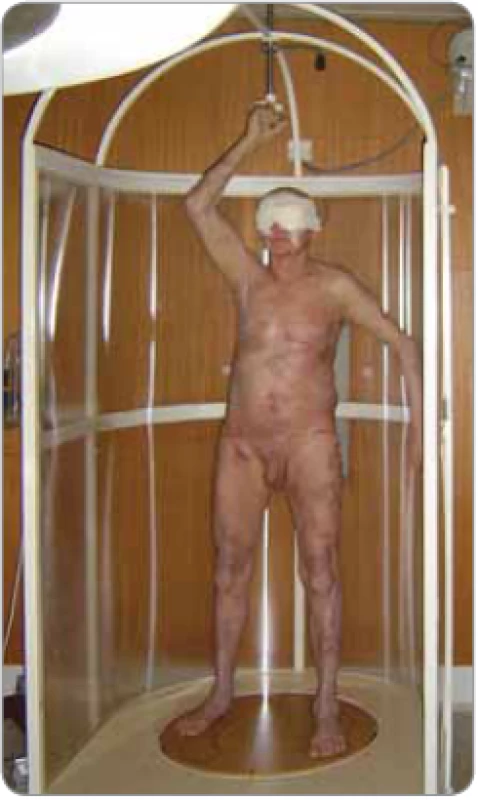
Výhody rotační TSEI
- 100% dávka na povrchu kůže, rychlý pokles dávky po 2 cm;
- toxicita léčby se neprojevuje u vnitřních orgánů;
- trvání jedné frakce (léčebný čas) je relativně krátké (4 + 4 min);
- nastavení pacienta je jednoduché a dobře reprodukovatelné.
Patch treatment („patching“)
Monitoring dávky v průběhu TSEI na různých částech těla slouží k vyhodnocení poddávkování nebo předávkování. Patch treatment by měly zvýšit dávku v samostínicích oblastech asi na 24–26 Gy [23]. Na našem pracovišti je na plosky nohou bez ložisek MF aplikována nízká dávka (10 Gy/týden), v případě ložisek na ploskách 20 Gy/2 týdny, u masivního postižení plosek aplikujeme dávky ≥ 20 Gy, v případě rezidua MF se provádí boost treatment na reziduální onemocnění. Nohy pacienta fixujeme individuálně vytvořeným fixačním zařízením z polystyrenové desky s otvory přesně vytvarovanými a podle nich se vytváří speciální rámeček pro elektronové pole. Ozařování ostatních poddávkovaných oblastí provádíme také u ležícího pacienta na ozařovacím stole speciálně vytvořenými rámečky individuálně u každého pacienta na podkladě dozimetrických údajů. Složitější je dosycování oblasti anogenitální a vnitřní plochy horní části stehen, kdy používáme polohu „à la vache“, při které se na simulátoru vytvoří tvarované pole zaujímající anogenitální oblast s perineem, dále intergluteální a subgluteální oblast s vnitřní plochou horní části stehen. Jde o velké tvarované pole, kdy je nutné použít větší SSD (120 cm). „Frog position“ je především pro pacientky s nálezem v oblasti zevního genitálu. U všech lokalit patch treatment používáme elektronového záření energie 6 MeV.
Publikovaná data desetiletých výsledků z Hamiltonovy, Yalské a Stanfordské univerzity ukazují na 10–20% zlepšení přežití bez progrese (progression free survival – PFS) v případě patch treatment [4].
Boost treatment („boosting“)
Po dosažení plánované dávky TSEI, podle pokročilosti MF, mohou na kůži pacienta zůstat reziduální ložiska MF, většinou zmenšené tumory. Výhodné je reziduum vyhodnotit s odstupem od ukončení TSEI, protože ústup onemocnění je někdy dosti pozvolný. Literatura uvádí 0,9–2,7 měsíce. Stanfordská guidelines [24] a guidelines International Lymphoma Radiation Oncology Group doporučují u velkých tumorů boostování před TSEI [25]. Důvodem je snížení velikosti tumoru a při TSEI i prozáření spodiny tumoru.
Na našem pracovišti jsme zahájili boost ve výjimečných případech před zahájením TSEI. Důvodem byly potíže pacienta:
- bolestivé tumorózní postižení nohy pacienta (vč. plosky) – pacient nemohl stát (obr. 3);
- tumorózní krvácivé postižení MF kůže prstů ruky nebo jinde na kůži pacienta;
- rychle progredující velké tumorózní postižení MF v oblasti obličeje v blízkosti očí.
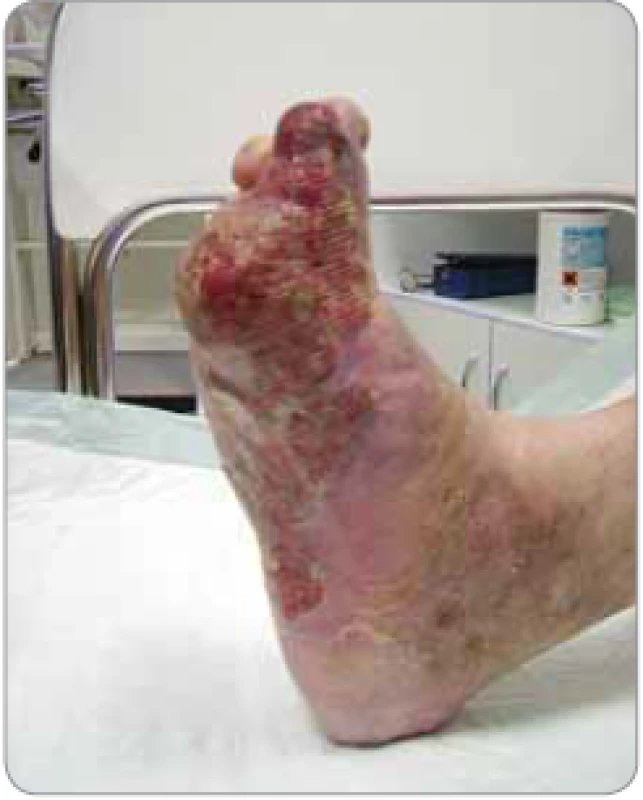
Podle našich zkušeností musí být volba dávky pro boost předcházející TSEI uvážlivá a spíše nižší v závislosti na výšce a lokalizaci tumoru a celkové plánované dávce TSEI. O velikosti dávky pro boost treatment rozhodujeme podle aplikované dávky TSEI na tumor (výsledky TLD) a výšky tumorózního rezidua. Pro boost treatment používáme elektronové záření energie 6 MeV, ale i rentgenové záření, a to v závislosti na lokalitě, velikosti a tvaru tumoru. Nejproblematičtější jsou reziduální tumory v anogenitální oblasti, relativně nepřístupné, v nerovném terénu a v oblasti, kde můžeme očekávat větší poiradiační reakci [26].
Stínění v průběhu TSEI
Většina pracovišť provádí od počátku ozařování stínění předního očního segmentu z důvodů vysoké radiosenzitivity očních čoček. Speciální wolframové stínění – konkávní wolframový vrchlík pokrytý keramikou – zavádíme pod oční víčka v lokální anestezii spojivkového vaku ke stínění předního očního segmentu.
Z důvodů anatomie a charakteristiky spádové křivky elektronového záření jsou vyšší dávky při TSEI naměřeny především na akrálních částech těla. Ke stínění těchto lokalit přistupujeme podle naměřené dávky a v průběhu TSEI používáme Pb rukavice a Pb boty; ke stínění střední části obličeje orfitovou fixační masku s vytvarovaným Pb plátem a ke stínění penisu a skrota Pb suspenzor.
Dávka a čas
Frakcionace se na jednotlivých pracovištích liší, a to jak dávkou pro frakci, tak dávkou za týden a celkovou dávkou. Dávka a čas jsou nejvíce variabilními veličinami u používaných TSEI technik. V současné době je stále dávkovým standardem 30–36 Gy a doba celkové aplikace TSEI je doporučována 6–10 týdnů. V poslední době probíhají studie s nízkými dávkami, tedy celkovou dávkou 10–12 Gy nebo ≥ 30 Gy. Náhledy na dávku celkovou, ale i jednotlivou jsou různé a v průběhu času se mění.
Na Onkologickém oddělení Nemocnice České Budějovice, a. s., používáme jak u techniky TSEI rotační, tak statické dávku pro frakci 2 Gy při pěti frakcích za týden při plánované dávce 30–36 Gy. Poiradiační erytém si vynutil většinou kolem druhého týdne ozařování přerušení na jeden či více týdnů. Od roku 2014 plánujeme TSEI v týdenních blocích, tzv. week timing, tj. první týden se ozařuje, druhý týden je pauza. Tímto timingem se vyhneme vynucenému nepravidelnému přerušování TSEI, protože poiradiační nežádoucí časné účinky jsou mírné a klasicky popisované reakce na kůži jsou zcela minimální, ve 20–30 %. Pacienti ze vzdálených míst pobývají jeden týden v nemocnici a druhý týden doma, což prospívá i jejich psychice. Zlepšuje se kvalita života pacienta a lékař může lépe odečíst odpověď MF na záření. Plánovaná dávka je 30–36 Gy, aktuální (reálná) dávka je v závislosti na rozsahu a odpovědi MF.
Protrahovanou léčbou TSEI ať nízkou dávkou pro frakci, nebo sníženým počtem frakcí/týden, anebo kombinací obojího či týdenním timingem nesnižujeme efekt léčby, ale signifikantně redukujeme časnou a pozdní toxicitu zdravých tkání. Důvodem je radiobiologie maligních lymfocytů.
Toxicita TSEI
Výsledkem výšky aplikované dávky TSEI je léčebný efekt a toxicita záření, tj. čím vyšší je dávka, tím lepší je výsledek léčby, a s výškou dávky obecně rostou i vedlejší účinky záření. A naopak. Snaha radioterapeuta je získat dobrý efekt léčby a minimalizovat nežádoucí účinky záření. Jaké jsou možnosti?
- Zajistit co největší homogenitu adekvátní dávky – v průběhu TSEI stínit oblasti s vyšší dávkou, po ukončení TSEI dosytit poddávkované oblasti a dosytit ev. reziduální ložiska MF. Samozřejmé je od počátku stínit oční čočky.
- Využít radiobiologie maligních T lymfocytů, protrahovat ozařovací schéma.
Nežádoucí účinky TSEI jsou časné a pozdní a vždy se týkají kůže a kožních adnex. Nevýhodou TSEI jsou při dávkách kolem 20 Gy a více reverzibilní časné reakce. Na kůži vzniká dermatitis erythematosa až dermatitis bulosa. Alopecie je při dávce > 25 Gy většinou ireverzibilní, onycholýza je reverzibilní a objevuje se asi za 4–6 týdnů od ukončení TSEI, konjunktivitida je často spojena s aplikací stínicího plátku pod oční víčka.
Jako pozdní reakce se objevuje ireverzibilní suchá dermatitida, někdy s teleangiektaziemi. V místech patch a plaků pozorujeme občas významnější pigmentace či jiné barevné změny, v místech tumorů či velkých plaků jsou často depigmentace nebo stříbrné jizvy. U malého počtu pacientů se mohou očekávat radiačně indukovaná milia a epidermální inkluzní cysty. Může se objevit hypo - či anhidrosis, občas u mužů gynekomastie [6]. Při vyšších dávkách TSEI, v místech, kde má kvůli anatomii lidského těla pacient vyšší dávku (především akra), se kromě výše uvedených poiradiačních reakcí může objevit i fibróza, ev. i ložisko poiradiační nekrózy. Jako velmi pozdní efekt se hodnotí sekundární malignity kůže (bazaliom, dlaždicobuněčný karcinom).
Toxicitu TSEI na Onkologickém oddělení Nemocnice České Budějovice, a. s., musíme rozdělit do dvou skupin. U první skupiny (56/85 (66 %), pacientů při rotační či statické TSEI (s 30–40 Gy) bylo vynucené přerušení léčby závislé na délce trvání reakce. I pozdní reakce v této skupině byly významnější (poiradiační fibrózy, ojediněle i dlouhé hojení poiradiačních ulcerací). U druhé skupiny 29/85 (34 %) pacientů byla split technika plánovaná. Díky týdennímu timingu od roku 2014 nedošlo k intenzivnímu erytému a mokvání, časné reakce byly mírné a jen lokální, toxicita na kůži (časná i pozdní) se snížila asi na 20–30 %. Reverzibilní onycholýza je stále ve 100 % [20].
Péče o kůži
U všech pacientů s MF je důležitá péče o kůži v průběhu léčby TSEI a po ní, ale i při jiné aplikované léčbě. Především jde o zabránění anebo likvidaci infekce zejména v ložiscích MF, opakované stěry z ložisek a podle citlivosti a kultivace nasazení antibiotik (ATB). Nejčastějším patogenem je Staphylococcus aureus, který kolonizuje kůži u pacientů s MF. Kolonizace je nejvýznamnější u erytrodermy MF/SS. Není vhodné podcenit péči o kůži, neboť následná sepse je potom častá a mnohdy i smrtelná. Infekce v kožních ložiscích způsobuje bolest, sekreci, ložiska se nehojí, svědí, pacienti se škrábou a infekci si přenáší na další místa, vytváří se další infikovaná ložiska. U našich pacientů používáme částečnou „whirlpool“ terapii. Sprcha, zejména u erytrodermie, redukuje bakteriální kolonizaci, snižuje inflamaci, čistí rané plochy, odstraňuje odumřelou kůži. Pacient je následně zabalen do prostěradla a na lůžku je kůže ošetřena 2% ung. argenti sulfathiazoli. Spolu s ATB p. o. či i.v. (dle K+C) byla tímto způsobem infekce či sepse v posledních letech vždy zvládnuta.
Výsledky
Charakteristika souboru
Na Onkologickém oddělení Nemocnice České Budějovice, a. s., bylo v letech 1993–2020 léčeno celkem 88 pacientů, kteří obdrželi TSEI. Statická technika TSEI byla použita u 12 pacientů (13,7 %), rotační u 76 pacientů (86,3 %). V souboru bylo 62 mužů (70 %) a 26 žen (30 %), průměrný věk byl 62 let, medián 63 (34–85) let. Histologicky se jednalo v 94 % o MF (n = 83), CTCL (n = 2) a leukemii (n = 3). TNMB: stadium I: 13 (15,3 %), II: 49 (57,7 %), III: 16 (18,8 %), IV: 7 (8,2 %). Všech 85 pacientů (MF: n = 83, CTCL: n = 2) mělo plánovanou dávku 30–36 Gy, aplikovaná dávka byla podle rozsahu a odpovědi onemocnění, ev. podle stavu pacienta a poiradiační reakce: 8–19 Gy 2×, 20–29 Gy 8×, 30–36 Gy 42×, 37–40 Gy 32× a 44 Gy 1×. Patch treatment byl proveden u 100 % pacientů s dokončeným TSEI, boost treatment pouze u pacientů s reziduálními ložisky MF.
Výsledky
Pacienti s dávkou TSEI ≥ 30 Gy měli 100% CR. OS v souboru 85 pacientů bylo 53,5 % v 5 letech a 26,8 % v 10 letech (graf 3).

Přežití v 5 a 10 letech podle rozsahu onemocnění souhlasilo s pokročilostí onemocnění až na stadium IV: stadium I 76,2 % a 42,5 %, stadium II 61,2 % a 33,6 %, stadium III 13,4 % a 0 %, stadium IV 68,6 % a 0 % (graf 4).

Přežití podle příčiny smrti a vztahu k základnímu onemocnění: ze souboru 85 pacientů žije 33 pacientů (38,8 %), 51,5 % (n = 17) je bez známek MF a 48,5 % (n = 16) se známkami MF. Zemřelo 52 pacientů (61,2 %), 51,9 % (n = 27) na jinou příčinu smrti (IM, duplicitní tumor, embolizace, iktus apod.), z toho 55,6 % (n = 15) bez známek MF a 44,4 % (n = 12) se známkami MF (graf 5). MF byla příčinou smrti u 25 pacientů (48,1 %) (graf 6). CSS v 5 a 10 letech je 73,3% a 40,1% [27]. Statistické hodnocení bylo provedeno metodou Kaplan-Meier.


Relaps MF po TSEI v období sledování byl častý, častější u pokročilých stadií, nejčastěji se objevoval ve formě patch nebo plaků s minimální infiltrací. Volbou léčby byly lokální kortikoidy, PUVA či UVB, v případě jen několika ložisek jsme volili lokální ozáření. Naše snaha byla zajistit i systémovou léčbu, a to v případě, když odpověď na léčbu byla malá, anebo dokonce onemocnění progredovalo. Jednou z možností ovlivnit relaps MF při mnohočetném postižení kůže je retreatment TSEI (reTSEI). Opětovné zopakování TSEI má však jiné podmínky než TSEI v primární léčbě.
Diskuze
Výhodou TSEI je, že stále zůstává excelentní léčbou MF, vysoký poměr kompletních remisí vede k významnému klinickému efektu, ale OS nemusí být ovlivněno. Pravděpodobnost kompletní remise a jejího trvání závisí na rozsahu onemocnění a aplikované dávce záření, vyšší dávka ≥ 30 Gy ve srovnání s nízkodávkovým režimem dosahuje 100% OR oproti 71 % [28] a snižuje se se zvyšujícím se stadiem MF. Relaps MF po TSEI je většinou ve formě patch, ev. plaků a dobře reaguje na SDT (např. kortikoidy, PUVA). Další výhodou TSEI je poměrně rychlá odpověď ložisek MF na záření ve smyslu ústupu obtěžujících symptomů, jako je pruritus, bolest, krvácení, sekrece. S tím souvisí i ústup hyzdících ložisek MF především na viditelných částech těla, které způsobují pacientům psychické trauma, tedy TSEI přináší zlepšení kvality života jak po stránce somatické, tak psychické (obr. 4, 5).
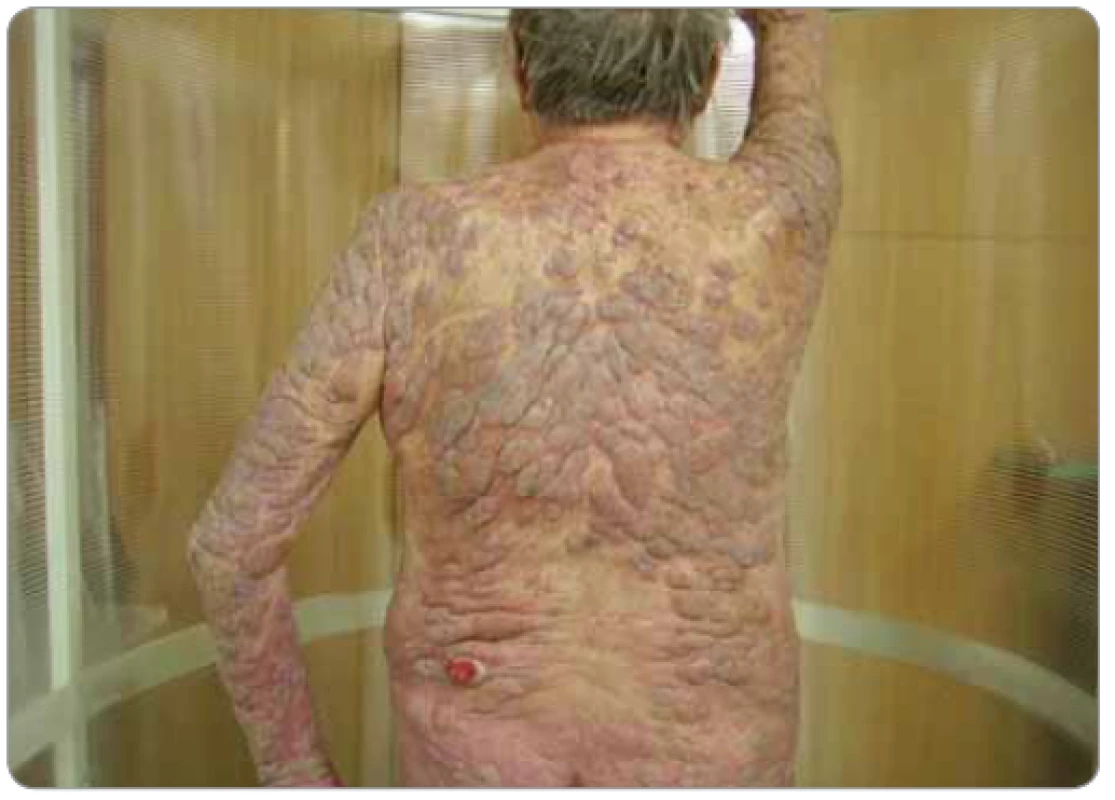

Nevýhodou TSEI jsou poiradiační komplikace časné, pozdní a velmi pozdní. Dalšími nevýhodami pro některé pacienty je dlouhé trvání léčby, nepříjemné ozařovací polohy – poloha „à la vache“ a „frog position“. Pro někoho je nepříjemné zasouvání stínicích plátků pod víčka [29].
V multivariantní analýze byly hodnoceny prognostické faktory. Signifikantním činitelem pro ovlivnění OS je pouze věk (p = 0,002) a stadium MF (p = 0,028) Na PFS má signifikantní vliv uzlinové postižení (p = 0,026), kožní dávka záření (p = 0,007) a klinická odpověď na záření (p = 0,004) [29].
Pro pacienta s MF je důležité léčbou dosáhnout co nejdelší remise onemocnění. V případě, že je jeho onemocnění pokročilé a pacient je v celkově špatném stavu, je snaha docílit dobré paliace, tj. ústupu symptomů onemocnění a i kratší kompletní nebo parciální remise.
Podle rozsahu onemocnění a stavu pacienta je možné použít různé druhy léčby cílené na kůži a/nebo systémovou léčbu. Vzhledem k nízké incidenci MF nemáme k dispozici randomizované studie s větším počtem pacientů, které by vyhodnotily bezpečnost a úspěšnost léčebných strategií. K dispozici máme většinou retrospektivní vyhodnocení léčby jednotlivých center. Jones et al [23] v roce 2003 uvádí, že literatura obsahuje klinické výsledky od více než 2 000 pacientů s MF. Bohužel, ne všechna centra popisují či hodnotí výsledky stejným způsobem, ale všechna klinická data potvrzují, že vyšší dávky TSEI jsou spojeny s vyšší CR, zlepšením PFS a specifického přežití (cause-specific survival – CSS) a OS.
Výsledky jednotlivých prací jsou často velmi rozdílné, design prací není stejný a velmi často jde o studie s malým počtem pacientů a s různým rozsahem onemocnění, proto je velmi obtížné porovnávat výsledky léčby. Příklady některých prací srovnatelné svým designem a výsledky s naším souborem:
- Hoppe et al 1979, Stanford, California, USA [30] (stanfordská technika šesti polí), 140 pacientů, dávka 20–40 Gy, OS v 5 a 10 letech 65 % a 46 %, OS v 5 a 10 letech podle stadií: stadium IB 75 % a 57 %, stadium II 43 % a 43 %, stadium III a IV 40 % a 0 %;
- Freeman et al 1992, Montreal, Kanada [1] (rotační technika TSEI – jedno pole), 44 pacientů; CR u T2, T3, T4 91 %,71 %, 68 %, medián OS u T2, T3, T4 63,16 a 23 měsíců;
- Wilson et al 1994, New Haven, Ontario, USA [31] (modifikovaná stanfordská metoda) u 164 pacientů po TSEI 36 Gy vyhodnotili OS u T1 90 %, T2 87 %, T3 pouze 53 % a T4 63 %;
- Jones et al 1994, Hamilton, Kanada [12] (modifikovaná stanfordská metoda TSEI), 146 pacientů, dávka 30 a 35 Gy, OS v 5 a 10 letech pro T1 93 % a 86 %, pro T2 81 % a 69 %, pro T3 53 % a 32 %. Pro 54 pacientů s T1N0 a s dávkou 35 Gy bylo CSS v 10 letech 100 %;
- Chinn et al 1999, Stanford, Kalifornie, USA [32] (stanfordská technika TSEI), výsledky u 148 pacientů T2, T3 hodnotil jako vysoce efektivní iniciální léčbu, většinou dávkou 36 Gy: medián přežití pro T2 11,7 let a pro T3 5,1 let;
- Rampino et al 2002, Turín, Itálie [33] (stanfordská technika TSEI) publikovali výsledky u 60 pacientů s MF stadia I, II, III, IV, medián dávky byl 30 Gy, OS v 5 a 10 letech: 50 % a 45 %;
- Ysebaert et al 2004, Dijon, Francie [34] (TSEI – mobilní ozařovací stůl), vyhodnotili výsledky léčby MF u 141 pacientů se stadiem T1 a T2; medián dávky TSEI 30 Gy, OS 5 let 90 %, 10 let 84,8 %, 15 let 42 %;
- Navi et al 2011, Stanford, Kalifornie, USA [35] udává u 180 pacientů po TSEI (modifikovaná stanfordská metoda) s 30–40 Gy, OS u T2 a T3 5 let 59 %, 10 let 40 %;
- Morris et al 2013, Londýn, Anglie [24] (modifikovaná stanfordská metoda TSEI), 41 pacientů, medián OS u T2, T3, T4 : 56, 25 a 46 měsíců;
- Heumann et al 2015, Atlanta, Giorgia, USA [36] publikuje výsledky u rotační duální TSEI techniky u 68 pacientů s CTCL při dávce > 30 Gy, 5leté OS celé kohorty je 61,2 %;
- Elsayad et al 2015, Muenster, Německo [29] (modifikovaná stanfordská metoda TSEI), 45 pacientů. U MF pro konvenční dávky TSEI – OS 77 měsíců vs 14 měsíců u nízkodávkového režimu (p = 0,553). U SS byl medián přežití 48 vs 16 měsíců (p = 0,219);
- Jones et al 2002, EORTC Cutaneous Lymphoma Project Group [4] ve spojení s experty z radioterapeutických center Severní Ameriky dosáhli konsenzu: akceptovat metody a klinické indikace pro TSEI v léčbě MF.
Klinické indikace TSEI pro primární léčbu
- Stadium IA a T1N1 (podskupina stadia IIA) – je možná léčba TSEI, 95 % pacientů dosáhne kompletní klinické i patologické remise, PFS v 10 letech je 50 % a CSS v 10 letech je vždy 100 %. Relaps kompletně odpovídá na PUVA.
- Stadium IB a T2N1 (podskupina stadia IIA) s TSEI je dosaženo kožní remise v 90 %, třetina pacientů má PFS v 5 a 10 letech méně než 20 %. Bez adjuvantní terapie CSS v 10 letech je 96 %.
- Stadium IIB s limitovanými tumory i plaky má v 5 letech PFS ve 45 % a v 10 letech v 15 %. Avšak u pacientů s rozsáhlým postižením kůže tumory nebo i s rozsáhlým postižením plaky lze nabídnout TSEI jen s paliativním záměrem, onemocnění často progreduje během 5 let.
- Stadium III – nastává úleva od symptomů, remise je asi v 75 %, ale PFS v 5 letech je 26 %.
- Stadia IVA a IVB – TSEI má paliativní záměr, šance na kompletní kožní remisi je výjimečně v 70 % u stadia IVA. U stadia IVB může TSEI nabídnout zlepšení kvality života, i když lze očekávat smrt pacientů během 5 let od TSEI.
Naše výsledky léčby TSEI u 85 pacientů (MF + CTCL) jsou podobné. OS v 5–10 letech je 53,5 % a 26,8 %, soubor je poměrně věkově starý, průměr je 62 let. Podle rozsahu onemocnění nejlepších výsledků v 5 a 10 letech dosahují pacienti časných stadií: stadium I 76,2 % a 42,5 %, stadium II 61,2 % a 33,6 % stadium III 13,4 % a 0 %, stadium IV 68,6 % a 0 %.
Zajímavé je 5leté OS v našem souboru u stadia IV: 68,6%. Výsledek je těžko vysvětlitelný, mohli bychom zvažovat výšku dávky (30–36 Gy) nebo malý soubor léčených (7 pacientů). Z výše uvedených hodnoticích souborů, podobné charakteristiky jako náš, také někteří autoři vyhodnocují T4 s lepším výsledkem než T3 [1,25,32].
U erytrodermy je vyhodnocení TSEI nejisté. Někteří mají námitky vzhledem ke špatné toleranci a krátkému DFS [37], jiní použití TSEI schvalují [41]. Navzdory příznivé odpovědi MF na záření u techniky TSEI, Hoppe nedoporučuje tuto techniku v první linii léčby u limitovaného onemocnění a nedoporučuje ji u erytrodermy vzhledem k poiradiační mokvavé dermatitidě [37,38], na rozdíl od Jonese et al, kteří naopak TSEI u erytrodermy doporučují [41]. Naše zkušenosti s TSEI u erytrodermy jsou dobré, rychlý ústup pruritu, po léčbě výborný komfort života (bez symptomů, kůže bez erytrodermy, pacient je opět normálního vzhledu), výjimečně i dobré přežití. Podmínkou je dobrý celkový stav pacienta, konsolidační systémová léčba a péče o kůži nejen v době sepse.
Navzdory radiosenzitivitě MF a dobrým výsledkům u časných stadií MF po TSEI onemocnění recidivuje. Častější a časnější relapsy jsou po nižších dávkách a u pokročilých stadií. I u konvenčního dávkování je problematické udržet léčebný efekt na kůži pacienta. Většinou i u těchto pacientů během 2 let dochází k relapsu.
Tadros et al [39] v roce 1983 z Hamiltonova regionálního centra vedou v publikaci diskuzi o možných příčinách selhání TSEI. Nejběžnější jsou lokální ložiska na kůži, která mohou být způsobena lokálním poddávkováním, tumorózní depozita uložená níže než proniká elektronový paprsek nebo relativní radiorezistence. Další příčinou může být neléčené okultní onemocnění (stínění vlasaté části hlavy, kde nejsou ložiska MF na kůži). Cirkulující epidermotropické maligní T buňky, jejichž zdroj může být okultní ložisko MF, mohou být také příčinou relapsu MF. Ve své práci poukazuje na možnost snížení relapsů po TSEI u vysoce rizikové skupiny pacientů s MF, touto možností je systémová nebo topická adjuvantní léčba.
U relapsů MF ve formě patch je možno použít SDT. U pokročilejší formy je vhodná buď systémová léčba, a/nebo SDT nebo retreatment TSEI, anebo jejich kombinace. Udává se, že adjuvantní terapie může zajistit klinický benefit u pacienta, ale v současné době není znám režim, který tento úkol nejvíce splňuje [23]. V ČR se k adjuvantní léčbě, zejména u pokročilejšího onemocnění MF, často používá IFNá, bexaroten, ev. nízkodávkový methotrexát.
Na našem pracovišti si pacient (u pozdních stadií MF) po ukončení TSEI adjuvantně dlouhodobě aplikuje Roferon A jako konsolidační léčbu. U některých pacientů prodlužuje období bez relapsu, v případě přerušení jeho aplikace (špatná tolerance subjektivní a/nebo objektivní) se často objeví relaps ve formě patch. Po normalizaci nálezů často navodí opětná aplikace přípravku Roferon A stav CR.
Londýnské pracoviště má ve svých standardech možnost adjuvantního 3měsíčního kurzu PUVA, který je zahájen 3 měsíce po TSEI. OS bylo 44 měsíců s PUVA a 25 měsíců bez PUVA [35].
Závěr
Onemocnění MF je v současné době nevyléčitelné. Vzhledem k vysoké radiosenzitivitě T lymfocytů je radioterapie léčbou vysoce efektivní. U časného onemocnění dosahuje dlouhodobého přežití, ale bohužel zejména u pokročilejšího onemocnění není léčebný efekt trvalý a OS se s pokročilostí onemocnění zkracuje.
Z pohledu pacienta je TSEI, ve srovnání s jinými léčebnými modalitami, léčba obtížnější, ale je spojena s lepším léčebným efektem (studie Yalské univerzity) [40]. Většina našich ozářených pacientů je ve shodě s výsledky uvedené studie a často se dožadují dalšího ozáření, i když někdy již není možné.
Přežití pacientů našeho souboru (n = 85) v 5 a 10 letech 53,5 % a 26,8 % je obdobné jiným literárním údajům.
Je řada otázek, na které ještě nedokážeme odpovědět, a situaci řešíme podle svých zkušeností a teoretických znalostí.
Poděkování všem lékařům v ČR, kteří spolupracovali a/nebo spolupracují s naším pracovištěm, léčí a dispenzarizují naše společné pacienty s mycosis fungoides. Poděkování pracovníkům Onkologického oddělení Nemocnice České Budějovice, a. s., kteří se podíleli na zavedení techniky TSEI, nadále ji vylepšují a podílejí se na léčbě a ošetřování pacientů.
Acknowledgments to all doctors in the Czech Republic who have cooperated and/or cooperate with our department, treat and dispensarise our common patients with mycosis fungoides. Acknowledgments to the staff of the Oncology Department of the Hospital České Budějovice, a.s., who have been involved in the introduction
of the TSEI technique, continue to improve it and participate in the treatment of patients.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
MUDr. Miluše Dolečková, Ph.D.
Onkologické oddělení
Nemocnice České Budějovice, a. s.
B. Němcové 54
370 87 České Budějovice
e-mail: doleckova@nemcb.cz
Obdrženo/Submitted: 5. 3. 2020
Přijato/Accepted: 22. 3. 2020
Sources
1. Freeman CR, Suissa S, Shenouda G et al. Clinical experience with a single field station skin electron irradiation technique for cutaneous T-cell lymphoma. Radiotherapy and oncology 1992); 24 (3): 155–162. doi: 10.1016/0167-8140 (92) 90374-4.
2. Belada D, Trněný M et al. Diagnostické a léčebné postupy u nemocných s maligními lymfomy. 7. (5. tištěné) doplněné a přepracované vydání. Praha: CLSG KLS 2013.
3. Trautinger F, Eder J, Assad Ch et al. European Organisation for Reseach and Treatment of Cancer consensus recommendations for the treatment of mycosis fungoides/Sézary syndrome – Update 2017. Eur J Cancer 2017; 77 : 57–74. doi: 10.1016/j.ejca.2017.02.027.
4. Jones G, Kacinski BM, Wilson LD et al. Total skin electron radiation in the management of mycosis fungoides: Consensus of European Organization for Research and Treatment of Cancer (EORTC) Cutaneous Lymphoma Project Group, J Am Acad Dermatol 2002; 47 (3): 364–370. doi: 10.1067/mjd.2002.123482.
5. Whittaker S, Hoppe R, Prince M. How I treat mycosis fungoides and Sézary syndrom. Blood 2016; 127 (25): 3142 – 3153. doi: 10.1182/blood-2015-12-611830.
6. Chowdhary M, Chhabra AM, Kharod S et al. Total skin electron beam therapy in the treatment of mycosis fungoides: a review of conventional and low-dose regimens. Clin Lymphoma Myeloma Leuk 2016; 16 (12): 662–671. doi: 10.1016/j.clml.2016.08.019.
7. Polívka J. Primární kožní lymfomy: současný pohled na vzácná hematoonkologická onemocnění. [online]. Dostupné z: https: //www.solen.cz/pdfs/int/2016/05/05.pdf.
8. Krejsgaard T, Lindahl LM, Mongan NP et al. Malignant inflammation in cutaneous T-cell lymphoma – a hostile takeover. Semin Imunopathol 2016; 39 (3): 269–282. doi: 10.1007/s00281-016-0594-9
9. Jawed SI, Myskowski PL, Horwitz S et al. Primary cutaneous T-cell lymphoma (mycosis fungoides and Sézary syndrome). Part II. Prognosis, management and future directions. J Am Acad Dermatol 2014; 70 (2): 223. doi: 10.1016/j.jaad.2013.08.033.
10. Hom DB, Adams G, Koreis M et al. Choosing the optimal wound dressing for irradiated soft tissue wounds. Otolaryngol Head Neck Surg 1998; 121 (5): 591–598. doi: 10.1016/S0194-5998 (99) 70062-8.
11. Vašků V, Adam Z, Král Z. Kožní T-lymfomy a současné léčebné postupy. Klin Onkol 2000; 13 (2): 35–41.
12. Duvic M, Donato M, Dabaja B et al. Total skin electron beam and non-myeloablative allogeneic hematopoietic stem-cell transplantation in advanced mycosis fungoides and Sezary syndrome. J Clin Oncol 2010; 28 (14): 2365–2372. doi: 10.1200/JCO.2009.25.8301.
13. Halberg FE, Fu, KK, Weaver KA et al. Combined total body X.ray irradiation and total skin electron beam radiotherapy with an improved technique. Int J Radiat Oncol Biol Phys 1989; 17 (2): 427–432. doi: 10.1016/0360-3016 (89) 90461-6.
14. Maigon P, Truc G, Dalac S et al. Radiotherapy of advanced mycosis fungoides: indications and results of total skin electron and photon beam irradiation. Radiother Oncol 2000; 54 (1): 73–78. doi: 10.1016/s0167-8140 (99) 00162-0.
15. Fialová P, Vašků V, Adam Z. Naše zkušenosti s léčbou bexarotenem u kožních T-lymfomů. [online]. Dostupné z: https: //www.solen.cz/pdfs/der/2011/04/02.pdf.
16. Jones G, McLean J, Rosenthal D et al. Combined treatment with oral etretinate and electron beam therapy in patiens with cutaneous T-cell lymphoma (mycosis fungoides and Sézary syndrome). J Am Acad Dermatol 1992; 26 (6): 960–967. doi: 10.1016/0190-9622 (92) 70142-3.
17. Hoppe RT. Mycosis fungoides: radiation therapy. Dermatol Ther 2003; 16 (4): 347 – 354. doi: 10.1111/j.1396-0296.2003.01647.x.
18. Kumar PP, Good RR, Jones EO et al. Rotational total skin electron beam therapy. Strahlenther Onkol 1988; 164 (2): 73–78.
19. Dolečková M, Kutová J, Králová D et al. Problems of total skin electron irradiation of skin T - cell lymphomas. Radiotherapy and Oncology 1997; 43 (Suppl_2): 784.
20. Dolečková M, Králová D. Mycosis fungoides. In: Šlampa P, Petera J (eds). Radiační onkologie. 1. vyd. Praha: Galén 2007 : 357–362.
21. Funk A, Hensley F, Krempien R et al. Palliative total skin; electron beam therapy (TSEBT) for advanced cutaneous T-cell lymphoma. Eur J Dermatol 2008; 18 (3): 308–312. doi: 10.1684/ejd.2008.0394.
22. Kamstrup MR, Gniadecki R, Iversen L et al. Low-dose (10-Gy) total skin electron beam therapy for cutaneous T-cell lymphoma: an open clinical study and pooled data analysis. Int J Rad Oncol Biol Phys 2015; 92 (1): 138–143. doi: 10.1016/j.ijrobp.2015.01.047.
23. Jones G, Wilson LD, Fox-Goguen L. Total skin electron beam radiotherapy for patients who have mycosis fungoides. Hematol Oncol Clin N Am 2003; 17 (6): 1421–1434. doi: 10.1016/s0889-8588 (03) 00108-4.
24. Morris SL, McGovern M, Bayne S et al. Results of a 5-week schedule of modern total skin electron beam radiation therapy. Int J Radiation Oncol Biol Phys 2013; 86 (5): 936–941. doi: 10.1016/j.ijrobp.2013.04.042.
25. Specht L, Dabaja B, Illidge T et al. Modern radiation therapy for primary cutaneous lymphomas: Field and dose guidelines from the International Lymphoma Radation Oncology Group. Int J Radiat Oncol Biol Phys 2015; 92 (1): 32–39. doi: 10.1016/j.ijrobp.2015.01.008.
26. Dolečková M, Králová D, Vojan F. Total skin irradiation (TSEI) for mycosis fungoides: the problem of boost therapy. Radiotherapy and Oncology 2002; 64 (suppl_1): 167.
27. Dolecková M, Berkovský B, Studynková A. Total skin electron irradiation (TSEI) for mycosis fungoides. Clinical Results. Retreatment possible? Radiotherapy and Oncology 2008; 88 : 297.
28. Elsayat K, Kriz J, Moustakis Ch et al. Total skin electron beam for primary cutaneous T-cell lymphoma Int J Radiation Oncol Biol Phys 2015; 93 (5): 1077–1086. doi: 10.1016/j.ijrobp.2015.08.041.
29. Dolečková M, Králová D, Kutová J et al. The adventage and disadvantage of total skin electron irradiation (TSEI) in patients with cutaneous T-cell lymphoma. Radiotherapy and Oncology 2001; 58 (Suppl_1): 106.
30. Hoppe RT, Cox RS, Fuks Z et al. Electron-beam therapy for mycosis fungoides: The Stanford University experience. Cancer Treat Rep 1979; 63 (4): 691–700.
31. Wilson LD, Cooper DL, Goodrich AL et al. Impact of non - CTCL dermatologic diagnoses and adjuvant therapies on cutaneous T-cell lymphoma patients treated with total skin electron beam radiation therapy. Int J Radiat Oncol Biol Phys 1994; 28 (4): 829–837. doi: 10.1016/0360-3016 (94) 90102-3.
32. Gamsiz H, Beyzadeoglu M, Sagerm O et al. Evaluation of mycosis fungoides management by total skin electron beam therapy with „translation technique“. JBUON 2015; 20 (4): 1124–1131.
33. Rampino M, Ragona R, Monetti U et al. Total skin electron beam therapy in mycosis fungoides. Our experience from 1985 to 1999. Radiol Med 2002; 103 (1-2): 108–114.
34. Ysebaert L, Truc G, Dalac S et al. Ultimate results of radiation therapy for T1-T2 mycosis fungoides (including reirradiation). Int J Radiat Oncol Biol Phys 2004; 58 (4): 1128–1134. doi: 10.1016/j.ijrobp.2003.08.007.
35. Navi D, Riaz N, Levin YS et al.The Stanford University experience with conventional-dose, total skin electron-beam therapy in treatment of generalized patch or plaque (T2) and tumor (T3) mycosis fungoides. Arch Dermatol 2011; 147 (5): 561–567. doi: 10.1001/archdermatol.2011.98.
36. Heumann TR, Esiashvili N, Parker S et al. Total skin electron therapy for cutaneous T-cell lymphoma using a modern dual-field rotational technique. Int J Radiat Oncol Biol Phys 2015; 92 (1): 183–191, doi: 10.1016/j.ijrobp.2014.11.033.
37. Hoppe R. Total skin electron beam therapy in management of mycosis fungoides. In: Vaeth J, Meyer J. Front Radiat Ther Oncol 1991; 25 : 80–89.
38. Zackheim HS. Cutaneous T cell lymphoma: update of treatment. Dermatology 1999; 199 (2): 102–105. doi: 10.1159/000018214.
39. Tadros AA, Tepperman BS, Hryniuk WM et al. Total skin electron irradiation for mycosis fungoides: failure analysis and prognostic factors. Int J Radiat Oncol Biol Phys 1983; 9 (9): 1279–1287. doi: 10.1016/0360-3016 (83) 90258-4.
40. Yu JB, Khan AM, Jones GW et al. Patient perspectives regarding the value of total skin electron beam therapy for cutaneous T-cell lymphoma/mycosis fungoides. Am J Clin Oncol 2009; 32 (2): 142–144. 10.1097/COC.0b013e3181841f5c.
41. Jones GW, Rosenthal D, Wilson LD. Total skin electron radiation for patients with erythrodermic cutaneous T-cell lymphopma (mycosis fungoides and the Sézary syndrome). Cancer 1999; 85 (9): 1985–1995. doi: 10.1002/ (sici) 1097-0142 (19990501) 85 : 9<1985:: aid-cncr16>3.0.co; 2-o.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2020 Issue Suppl 1
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Onkologie využívá paprsky X už 125 let…
- Radiotherapy of patients with implantable electronical devices
- Gene therapy in radiation oncology
- Spatial patterns of glioblastoma failure related to contouring strategy of adjuvant radiotherapy (RTOG vs. EORTC target volumes approach): clinical trial introduction
- Nutrition during radiotherapy of cancer patients
- Radiobio logical aspects of re-irradiation and their modelling in the determination of the tolerance dose in organs at risk
- The role of radiation therapy in rectal cancer
- Secondary tumors and radiotherapy
- Diet and its effect on prostate cancer, with a focus on plant-based diet
- Cyberknife boost 5–10 Gy for advanced nasopharyngeal cancer
- TSEI in patients with mycosis fungoides – clinical results
- Hypofractionated radiotherapy for prostate cancer
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Secondary tumors and radiotherapy
- Nutrition during radiotherapy of cancer patients
- Diet and its effect on prostate cancer, with a focus on plant-based diet
- TSEI in patients with mycosis fungoides – clinical results
