Hepatocelulární karcinom z pohledu gastroenterologa/hepatologa
Hepatocellular carcinoma from the view of gastroenterologist/hepatologist
Hepatocellular carcinoma (HCC) is one of the major complications of chronic liver disease, mostly of liver cirrhosis. Liver diseases from different causes differ in the risks of HCC development. Different mechanisms of carcinogenesis are involved in HCC development in different liver diseases as well. Generally, two main pathways are distinguished: the cause of liver disease itself (e. g. viral infections, accumulation of heavy metals etc.) and chronic liver inflammation and fibrogenesis, including mechanisms of oxidative stress. Rare cases of HCC in liver without underlying cirrhosis are likely the consequences of the mechanisms directly linked with particular etiological factor (e. g. protein X in chronic hepatitis B virus (HBV) infection). The key approach which can lead to significantly better results of any treatment used in HCC cases is HCC screening and surveillance. The appropriate method of HCC surveillance is abdominal ultrasonography in 6-month intervals. There is still one question to be solved: the correct definition of target population which should undergo this method of surveillance. Currently, the target population in the developed world is defined as all patients with liver cirrhosis. Unfortunately, the only method of primary prevention of HCC is available: universal HBV vaccination. Antiviral treatment of hepatitis B or C is considered as a method of secondary prevention. Adjuvant therapy of HCC after its primary therapy (antiviral therapy after HCC resection etc.) and other measures able to reduce HCC recurrence risk are usually mentioned as tertiary prevention approach. The BCLC staging system is the most common system used in Europe for the classification of HCC at the diagnosis. This classification combines the stage of HCC itself with other parameters, such as liver disease severity (Child – Pugh classification), portal hypertension etc. BCLC is a system which guides the physicians to optimal treatment options in every HCC stage. The only potentially curable approaches are surgical resection or liver transplantation. These options may be used in 1/3 of all HCC patients. Unfortunately, the vast majority of HCC patients can be treated only by palliative treatment options with transarterial chemoembolisation being the most common one.
Keywords:
hepatocellular carcinoma – chronic hepatitis B – chronic hepatitis C – non-alcoholic steatohepatitis
Authors:
prof. MUDr. Urbánek Petr, CSc.; MUDr. Hříbek Petr
Authors‘ workplace:
Interní klinika 1. LF UK a ÚVN Praha
Published in:
Klin Onkol 2020; 33(Supplementum 3): 34-44
Category:
Review
doi:
https://doi.org/10.14735/amko20203S34
Overview
Hepatocelulární karcinom (HCC) je maligní onemocnění jater, které ve většině případů vzniká v terénu chronického jaterního onemocnění. Různá jaterní onemocnění mají různé riziko rozvoje karcinomu, na jeho vzniku se podílejí u jednotlivých onemocnění také rozdílné kancerogenní mechanizmy. Obecně se tyto mechanizmy mohou týkat přímého působení vlastní příčiny jaterního onemocnění (virové infekce, kumulace těžkých kovů) nebo návazných mechanizmů chronického zánětu a fibrogeneze, ke kterým můžeme řadit i procesy oxidativního stresu. Existují i případy HCC bez jaterní cirhózy a zde se pak uplatňují především zmíněné mechanizmy s přímým podílem etiologického faktoru (např. X protein u infekce virem hepatitidy B (HBV)). Klíčovou metodou, která prokazatelně umožňuje dosáhnout lepších léčebných výsledků HCC, je screening – surveillance HCC. Metodou screeningu je abdominální sonografie opakovaná každých 6 měsíců. Otázkou, která dosud nebyla jednoznačně vyřešena a která ve svém důsledku velmi významně ovlivňuje efektivitu, je definice cílové populace, která musí být screeningové metodě vystavena. V současné době jsou cílovou populací osoby s jaterní cirhózou a máme dostupnou pouze jedinou metodu primární prevence HCC. Jedná se o univerzální vakcinaci HBV. Za metody sekundární prevence můžeme považovat všechny metody léčby chronických jaterních onemocnění, zejména pak protivirovou léčbu infekce HBV a HCV (virus hepatitidy C). Terciární prevencí je pak vlastně adjuvantní terapie HCC po jeho terapii či některé další postupy snižující riziko rekurence HCC. Pro určení stupně pokročilosti HCC se nejčastěji v Evropě používá tzv. Barcelonská klasifikace kombinující vlastní rozsah nádoru s dalšími parametry, jako je stupeň pokročilosti jaterní dysfunkce a celkový stav. Její výhoda je v tom, že implikuje přímo volbu vhodné terapeutické metody. Za potenciálně kurativní metody jsou nyní považovány pouze metody chirurgické, transplantace jater a jaterní resekce. Radikální přístup lze použít u jedné třetiny pacientů. Základní paliativní metodou léčby HCC je transarteriální chemoembolizace.
Klíčová slova:
hepatocelulární karcinom – chronická hepatitida B – chronická hepatitida C – nealkoholová steatohepatitida
Epidemiologie
Hepatocelulární karcinom (HCC) je nejčastějším primárním maligním nádorovým onemocněním jater. Podle údajů systému GLOBOCAN bylo na celém světě v roce 2018 registrováno 841 080 případů HCC, ve stejném roce a podle stejného zdroje bylo zaznamenáno 781 631 případů úmrtí na HCC [1]. Incidence onemocnění má výraznou geografickou variabilitu. HCC je velice rozšířenou malignitou v oblasti jihovýchodní Asie a subsaharské Afriky, kde je diagnostikováno až 85 % všech případů HCC. V podmínkách ČR se jedná o onemocnění méně časté, i když ne vzácné. Základní epidemiologické charakteristiky HCC v ČR ukazuje graf 1. Incidence primárních zhoubných nádorů jater v ČR v roce 2014 činila 8,6 nových případů na 100 000 obyvatel za rok. Byla tak přibližně 7krát nižší než incidence kolorektálního karcinomu v témže období. Onemocnění je v našich podmínkách jednoznačně častější u mužů: 12,1/100 000 obyvatel/rok, u žen je incidence 5,3/100 000 obyvatel/rok [2]. Tato data nelze vztahovat čistě na HCC, protože kód v Mezinárodní klasifikaci nemocí (MKN), pod kterým se novotvary hlásí, je společný s intrahepatálním cholangiogenním karcinomem. I tak však zřejmě četnost HCC v ČR setrvale stoupá.

Etiologie
Přibližně 90 % případů HCC se ve vyspělých zemích světa vyvíjí v terénu jaterní cirhózy či pokročilé jaterní fibrózy. Vznik HCC ve zdravých játrech je zcela ojedinělý. U jedné třetiny pacientů s jaterní cirhózou se základní onemocnění během života komplikuje vznikem HCC. Jaterní cirhózu lze proto z pohledu HCC považovat za prekancerózu. Riziko vzniku HCC u jednotlivých jaterních onemocnění se nicméně významně liší (schéma 1) [3]. V precirhotickém stadiu onemocnění se HCC může vyvinout u osob s chronickou infekcí virem hepatitidy B (HBV) a u pacientů s nealkoholovou steatohepatitidou (NASH).
![Schéma 1. Patogeneze HCC. Upraveno podle [25].](https://pl-master.mdcdn.cz/media/image_pdf/2d8ee0203eadd3dd7818fd147dc23ed0.png?version=1604911063)
Chronická infekce HBV je hlavní příčinou HCC v Asii, především v Číně a v jihovýchodní Asii. Přibližně 70–90 % HBV asociovaného s HCC se nicméně rozvíjí v terénu jaterní cirhózy [4]. Další rizikové faktory jsou: mužské pohlaví, vyšší věk, asijský či africký původ, pozitivní rodinná anamnéza HCC. Z virologických parametrů jsou rizikem vysoká sérová koncentrace HBV DNA, HBV genotyp, dále trvání infekce HBV a koinfekce s HCV, HIV a virem hepatitidy D (HDV). Významným rizikem je i kouření.
Protivirová léčba nukleotidovými analogy vede k významnému snížení rizika rozvoje HCC [5,6]. Predikovat riziko rozvoje HCC u osob protivirově léčených je mnohem obtížnější než u osob před zahájením léčby HBV. V této indikaci bylo publikováno několik skórovacích systémů s vysokou negativní prediktivní hodnotou pro období 3–10 let [7].
Nealkoholové ztukovatění jater (non-alcoholic fatty liver disease – NAFLD) a NASH (NAFLD/NASH) je spolu s chronickou infekcí HCV a nadužíváním alkoholu hlavní příčinou rozvoje HCC ve vyspělých zemích západního světa. Přibližně 20–30 % osob s NAFLD vyvine v čase významnou jaterní fibrózu a kolem 10–20 % vyvine jaterní cirhózu [8]. HCC asociovaný s NAFLD/NASH je nejrychleji narůstající příčinou HCC v mnoha kohortách pacientů po transplantaci jater [9]. Publikovaná rizika rozvoje HCC u NAFLD/NASH se v mnoha ohledech velmi liší, pohybují se od 0 až do 38 % během 5–10 let [10].
Incidence HCC u pacientů s HCV asociovanou jaterní cirhózou je 0,5–10 %. Faktorem, který toto riziko významně modifikuje, je dosažení setrvalé virologické odpovědi, tj. vyléčení infekce HCV podáním úspěšné protivirové léčby. Kanwal et al prokázali až 76% snížení rizika HCC u pacientů po úspěšné léčbě infekce HCV [11]. Riziko rozvoje HCC u těchto pacientů naopak významně navyšuje současná přítomnost diabetes mellitus 2. typu, vyšší věk, mužské pohlaví, nadužívání alkoholu a koinfekce HCV s HBV a HIV [12,13].
Patogeneze
Z pohledu kancerogeneze patří HCC pravděpodobně mezi nejhůře prozkoumaná nádorová onemocnění. Podobně jako u mnoha jiných nádorových onemocnění platí i u HCC pravděpodobně teorie více kroků směřujících k nádorové transformaci jaterní buňky [14]. Situaci v případě HCC ukazuje schéma 1. HCC je komplikací mnoha jaterních onemocnění, které samy o sobě mají zcela rozdílnou patogenezi, takže je prakticky jisté, že i vlastní molekulární mechanizmy maligní transformace hepatocytu budou rozdílné u různých onemocnění. Z tohoto pohledu můžeme rozlišit dvě situace:
- HCC vzniká v přibližně 90 % případů v terénu jaterní cirhózy jako důsledek průběhu chronického jaterního onemocnění. Zde se při vzniku HCC uplatňují především mechanizmy spojené s aktivací fibrogeneze v důsledku chronického zánětu a s postupnou progresí do jaterní cirhózy [15]. V důsledku těchto alterací dochází v průběhu času s vysokou pravděpodobností k řadě epigenetických změn, které můžeme do určité míry chápat jako vlastní molekulární podklad vzniku nádorového procesu. Prakticky u žádného jaterního onemocnění však nebyly přesné mechanizmy kancerogeneze identifikovány a poznány tak, aby umožnily přenést tyto poznatky do léčebných postupů.
- HCC vzniká bez preexistujícího chronického jaterního onemocnění, bez zánětu, bez jaterní fibrózy či cirhózy. V těchto případech se předpokládá přímá interakce rizikového faktoru s některými kancerogenními mechanizmy [16]. Jako typický příklad tohoto typu nádorového procesu se uvádí většinou vznik HCC při chronické infekci HBV. Procesy kancerogeneze ve spojení s infekcí HBV patří dnes mezi nejlépe prozkoumané nádorové procesy vůbec. Základním procesem je integrace virové HBV DNA do lidského genomu, které přímo vede k aktivaci nejrůznějších onkogenních signálů, a to dokonce bez rozvoje jaterní fibrózy. Infekce HBV tak vede ke vzniku HCC i bez jaterní cirhózy. Za klíčový protein, který interaguje s řadou buněčných procesů v hostitelské buňce, a je tak přímo svázán z kancerogenezí, je považován protein X. Dnes je známo, že riziko rozvoje HCC není u všech genotypů/řetězců viru HBV identické. Významně vyšší riziko HCC je u infekce HBV genotypu C, který je nejprevalentnější právě v Asii. Některé specifické mutace tzv. pre-core oblasti virového genomu a v promotoru tzv. basal core genu HBV rovněž významně zvyšují riziko vzniku nádorového procesu [17].
Oba popsané mechanizmy se přirozeně mohou kombinovat. Je tomu tak typicky např. u infekce HCV. Virové strukturální i nestrukturální proteiny viru interagují s nitrobuněčnými procesy s potenciálem maligní transformace. Podobně jako u HBV byla popsána i vazba určitých genetických variant HCV (kvazidruhů) s rozvojem HCC [19]. Skutečnost, že HCC v případech chronické HCV infekce vzniká prakticky výhradně u osob s jaterní cirhózou ukazuje, že k vlastní nádorové transformaci tyto popsané změny zřejmě nestačí a je třeba uvažovat i o spoluúčasti procesu zánětu a fibroprodukce.
Diagnostika
Problematiku diagnostiky HCC lze rozdělit na diagnostiku u pacientů s jaterní cirhózou a u pacientů bez rozvinuté cirhotické přestavby jaterního parenchymu.
Hepatocelulární karcinom v jaterní cirhóze
Nejčastější situací je záchyt ložiskové léze při sonografii jater v rámci surveillance HCC nebo při náhodném vyšetření z jiné indikace. Takový nález má poměrně vysokou specificitu, a to zejména v případě, že jde o lézi nově vzniklou, která nebyla patrná na předchozích vyšetřeních. Zásadním nedostatkem sonografie je její vysoká závislost na zkušenostech vyšetřujícího lékaře a pro časná stadia jen nízká senzitivita (okolo 60 %) [19]. Nejčastějšími následujícími zobrazovacími metodami jsou výpočetní tomografie (CT) a magnetická rezonance (MR) (schéma 2) [20]. V případě známé jaterní cirhózy lze diagnózu HCC s velmi vysokou specificitou stanovit pouze na základě těchto zobrazovacích vyšetření u ložisek > 1 cm [21]. V případě typického sycení ložiska kontrastní látkou a jeho vymývání v pozdních fázích se považuje takový nález za patognomický pro HCC a bioptická verifikace již není nutná [22]. Specificita metod se pohybuje dle literatury mezi 85 a 100 % [23]. Pokud není obraz na CT a/nebo MR typický, přistupuje se k cílené biopsii ložiska. Role ultrasonografie jater s podáním kontrastní látky (CEUS) nabyla v posledních evropských doporučeních nového významu. Zatímco dříve se metoda nepovažovala za přínosnou pro její nízkou senzitivitu i specificitu, dle recentní retrospektivní studie na 1 006 pacientech je při použití nových kritérií pro hodnocení léze specifita téměř absolutní [24]. Ani ve světle posledních doporučení však nelze metodu považovat za výhodnější oproti CT a/nebo MR. Může je pouze vhodně doplňovat a své využití nalézá v případě kontraindikací CT či MR jako komplementární metoda. CT a/nebo MR slouží zároveň jako metody stagingové.
![Schéma 2. Diagnostický algoritmus vyšetření ložiskové jaterní léze u pacienta s jaterní cirhózou. Upraveno podle [20].](https://pl-master.mdcdn.cz/media/image_pdf/19c45309b10975a20d906eb2b4e58865.png?version=1604911088)
Hepatocelulární karcinom bez jaterní cirhózy
U pacientů s náhodným nálezem vysoce suspektního maligního ložiska jater by v případě absence chronické jaterní choroby měl proběhnout adekvátní onkoscreening v závislosti na věku a pohlaví pacienta. V případě negativních nálezů je nutná histologická verifikace léze. Nelze použít neinvazivní diagnostická kritéria jako u pacientů s jaterní cirhózou. Jiná situace nastává u vybraných skupin nemocných bez cirhózy, zato ale s chronickou infekcí HBV nebo NASH. Tito nemocní jsou rizikovější z pohledu rozvoje HCC, i v těchto případech lze doporučit alespoň základní onkoscreening před provedením biopsie.
Klasifikační systémy a jejich vztah k léčbě hepatocelulárního karcinomu
Jedním z problémů spojených s HCC je skutečnost, že nelze pro jeho klasifikaci a staging použít standardní TNM systém jako u ostatních solidních nádorů. Hlavní příčinou této komplikace je skutečnost, že HCC se rozvíjí většinou jako poměrně pozdní komplikace jaterní cirhózy, kdy už může být přítomen určitý stupeň jaterní dysfunkce. Taková dysfunkce životně důležitého orgánu (která není dána vlastním nádorovým procesem) přitom může významně limitovat terapeutické možnosti a přežití pacienta. Dalším limitujícím faktorem je pak celkový stav pacienta. Některé starší systémy klasifikující HCC se pokoušely o kombinaci alespoň některých ze jmenovaných faktorů, některé kombinují i další prognosticky různě významné faktory, jako je např. přítomnost trombózy portální žíly (tab. 1) [25]. Je potřeba zdůraznit, že žádný z těchto systémů nebyl validován ve vztahu k doporučení léčebné modality HCC.
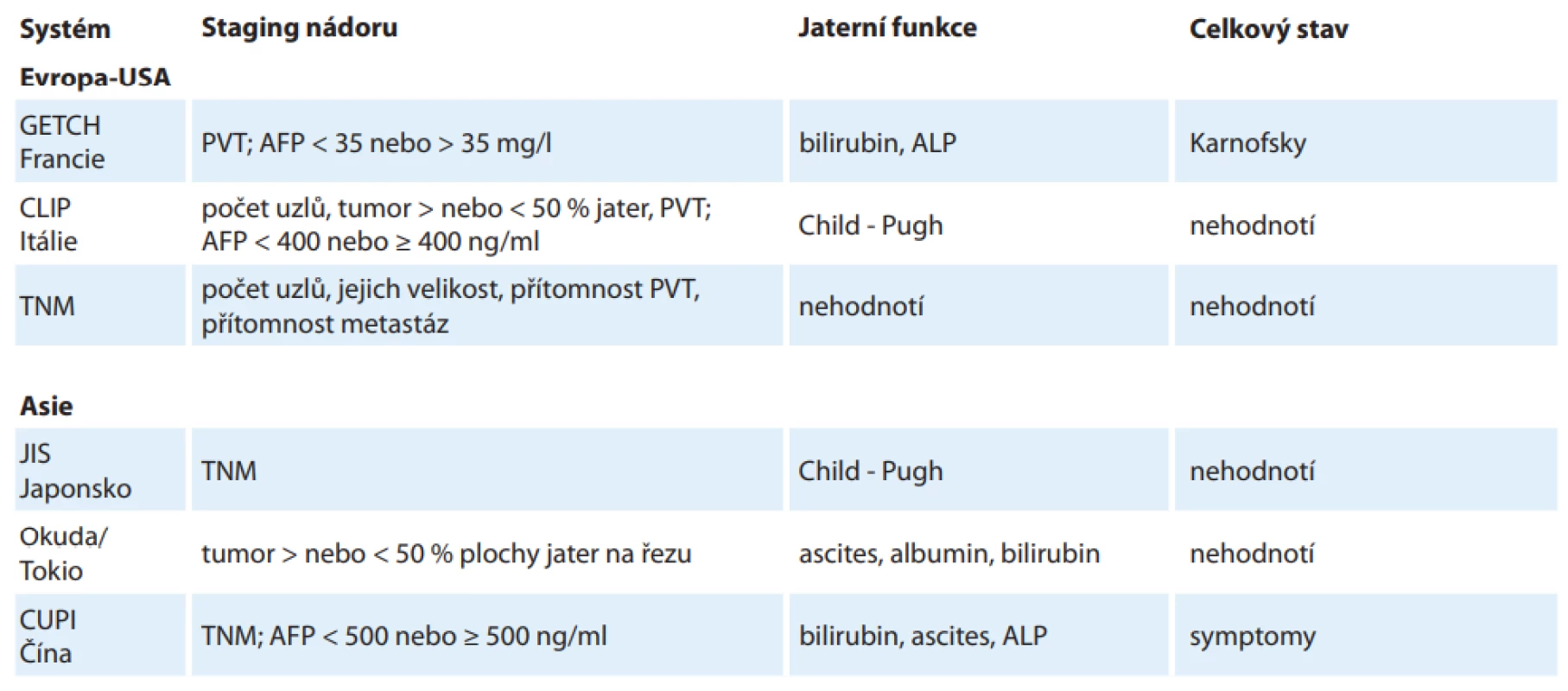
Většinu zmíněných nedostatků odstranila až tzv. Barcelonská klasifikace (BCLC, schéma 3) [26]. Systém v sobě kombinuje hodnocení rozsahu nádoru, celkový stav pacienta a funkční klasifikaci jaterní cirhózy Child-Pugh vč. hodnocení přítomnosti portální hypertenze. HCC tak dělí na stadia 0–D a především implikuje použití konkrétní léčebné modality pro dané stadium s udáním očekávaného přežití pacientů. Klíčové u všech případů je odlišení kritérií, kdy lze u pacienta použít některou z potenciálně kurabilních metod léčby, tj. chirurgické řešení. Bohužel radikální léčbu stále podstupuje méně než jedna třetina všech nemocných s HCC [27].

Stadium 0 + A
U pacientů ve velmi časném a časném stadiu onemocnění je suverénním přístupem chirurgická léčba, která nabízí možnost úplného vyléčení. Pacienti s klinicky významnou portální hypertenzí (CSPH), tj. s portohepatálním gradientem (HVPG) ≥ 10 mm Hg, by měli být indikováni ke zvážení transplantační léčby. Problematika transplantace jater pro HCC je záležitostí vysoce specializovanou a složitou. Neustále se vyvíjejí indikační kritéria pro použití transplantační léčby tak, aby bylo dosaženo optimálního vztahu mezi pokročilostí onemocnění a přežitím po transplantaci (tzv. metroticket koncept). U nemocných bez CSPH lze zvažovat chirurgickou resekci. U pacientů komorbidních s vysokým operačním rizikem může být s kurativním záměrem použita radiofrekvenční ablace (RFA) HCC. Celkové přežívání pacientů ve stadiu HCC 0 + A přesahuje 5 let [28,29].
Stadium B
Nemocní se středně pokročilým HCC jsou díky široké definici dle BCLC velice heterogenní skupinou. Léčba nemocných v tomto stadiu je považována primárně za paliativní, nicméně s velice významným prodloužením celkového přežívání. Metodou volby je transarteriální chemoembolizace ložisek, kdy se využívá dominantně arteriální neovaskularizace nádoru oproti nepostiženému jaternímu parenchymu živenému převážně portálním systémem. Celkové přežívání léčených pacientů > 2,5 roku.
V dostupné literatuře se lze setkat s nápadně se rozcházejícími údaji o vlivu TACE na celkové přežívání. Medián přežití se pohybuje od 16,5 do 47,7 měsíce [30]. Důvody pro takto velké rozpětí jsou následující:
- Stadium B dle BCLC klasifikace je definováno velice široce, a skupina pacientů je tak značně heterogenní. Kritéria stadia B může na jedné straně splnit nemocný těsně za hranicí kritérií pro transplantační léčbu s dobře zachovalou syntetickou funkcí jater, na druhé straně ale také pacient na hranici funkční klasifikace Child-Pugh B s vícečetným bilobárním postižením na hranici technické proveditelnosti TACE.
- Metoda klade vysoké nároky na zkušenosti intervenčního radiologa.
- Nejdelší celkové přežívání bylo v řadě studií podmíněno až extrémní selekcí pacientů indikovaných k výkonu, což není v podmínkách reálné praxe akceptovatelné.
Problematice širokého rozpětí pacientů s HCC stadia B jsme se věnovali i na našem pracovišti. Vyšli jsme z práce rakouských autorů Siegharta et al z roku 2013 [31]. V práci byly pomocí multifaktoriální analýzy definovány faktory mající vztah k přežití pacientů po opakované TACE. Změnám těchto faktorů bylo přiřazeno bodové hodnocení a jejich prostý součet byl označen jako ART (Assessment for Retreatment with TACE) skóre (tab. 2). Tento přístup a použití ART skóre umožnil autorům v rámci stadia HCC B dle BCLC klasifikace definovat skupiny s významně lepším/horším celkovým přežitím (overall survival – OS) při opakované léčbě tzv. drug-eluting bead TACE (DEB-TACE).
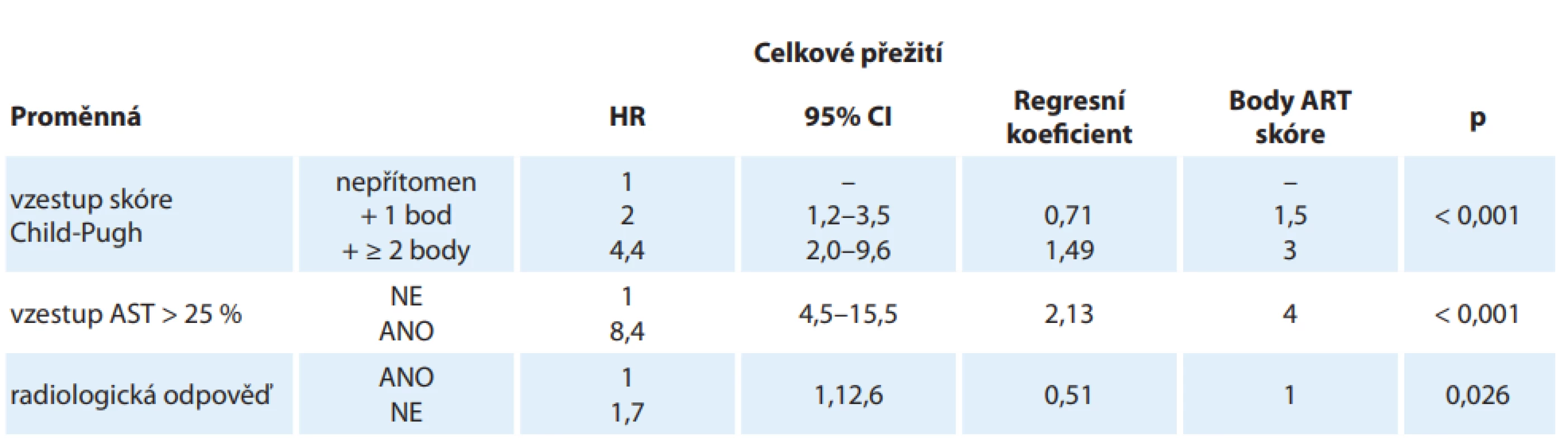
Do naší retrospektivní studie byli zařazeni jen ti nemocní, kteří podstoupili v letech 2007–2015 minimálně dvě etapy DEB-TACE, všichni ve stadiu B dle BCLC, a bylo u nich zároveň možno spočítat ART skóre. Další podmínkou pro zařazení do studie byl odstup mezi cykly chemoembolizace 90 ± 15 dní. Mezi příčiny nezařazení pacienta do souboru patřily zejména nedodržení limitu odstupu mezi jednotlivými etapami DEB-TACE, dále některé chybějící laboratorní odběry bezprostředně před druhou etapou DEB-TACE nutné k výpočtu ART skóre a absence informací o okamžiku úmrtí pacienta.
V souboru pacientů bylo spočítáno ART skóre vždy den před druhou etapou DEB-TACE a proběhlo rozdělení do dvou skupin dle ART skóre. Další etapa DEB-TACE byla provedena bez ohledu na výsledek skóre, a to dle současně platných standardů. Rozhodnutí o další etapě bylo tedy uskutečněno na základě hodnocení efektu předchozí terapie dle kontrolního CT nebo MR vyšetření za použití kritérií mRECIST (modified Response Evaluation Criteria in Solid Tumors), poklesu sérové hladiny alfa-fetoproteinu (AFP) a klinického stavu pacienta [32]. V analýze jsme následně porovnávali medián celkového přežití (OS v měsících) skupin dle ART skóre a celého souboru bez diferenciace (tedy léčených dle nynějších doporučení).
Vstupní kritéria splnilo 18 nemocných, průměrný věk v okamžiku stanovení diagnózy HCC byl 64,5 let. Medián OS celého zkoumaného souboru byl 18 měsíců (95% CI 12–33), medián OS skupiny s příznivým ART skóre byl 33 měsíců (95% CI 17–36; 1 žena, 10 mužů) a medián OS skupiny s prognosticky nepříznivým ART činil v souboru 12 měsíců (95% CI 6–18; 1 žena, 6 mužů). Rozdíl OS mezi skupinami diferencovanými dle ART skóre byl podle Coxova modelu statisticky významný (p < 0,01).
Stadium C
V terapii pokročilého HCC se uplatňuje systémová onkologická léčba. Zatímco ještě donedávna se opírala o multikinázový inhibitor sorafenib, který byl jediným schváleným lékem v této indikaci, v současné době zažívá onkologie rapidní rozšiřování léčebných možností. Celkové přežívání léčených pacientů je ≥ 10 měsíců.
Stadium D
Základním kritériem pro indikaci pouze symptomatické léčby u nemocných s HCC je přítomnost chronického jaterního selhávání vyjádřeného třídou C dle Child-Pugh a/nebo PS ≥ 3. V takových případech není jakákoli snaha léčebně ovlivnit HCC racionální, dominují buď jiné život ohrožující komorbidity či terminální jaterní selhávání.
Screening
Definování screeningové metody a cílové populace, jež bude takové metodě vystavena, představuje v případě HCC poměrně složitý problém. Aby byly splněny podmínky nákladové efektivity, musí být zvolená metoda levná, jednoduchá, dobře dostupná v běžné praxi, její uplatnění musí být spojeno s významným efektem, tj. s významně lepším přežitím nemocných, u kterých bude mít metoda pozitivní výsledek (tzn., odhalí daný nádor v časném stadiu, které je dobře či alespoň lépe léčitelné, než jsou stadia pokročilá). Zároveň ale musí být splněny i určité podmínky v cílové populaci. Především jde o to, aby riziko vzniku nádoru v uvažované populaci bylo alespoň 1,5 % ročně a aby tato cílová – riziková populace byla přesně definována.
Metoda screeningu
Evropská asociace pro studium jater (EASL) jako metodu screeningu HCC u pacientů s jaterní cirhózou doporučuje provádět abdominální ultrasonografii (USG) v intervalu 6 měsíců. Toto doporučení bylo převzato i do doporučení České hepatologické společnosti.
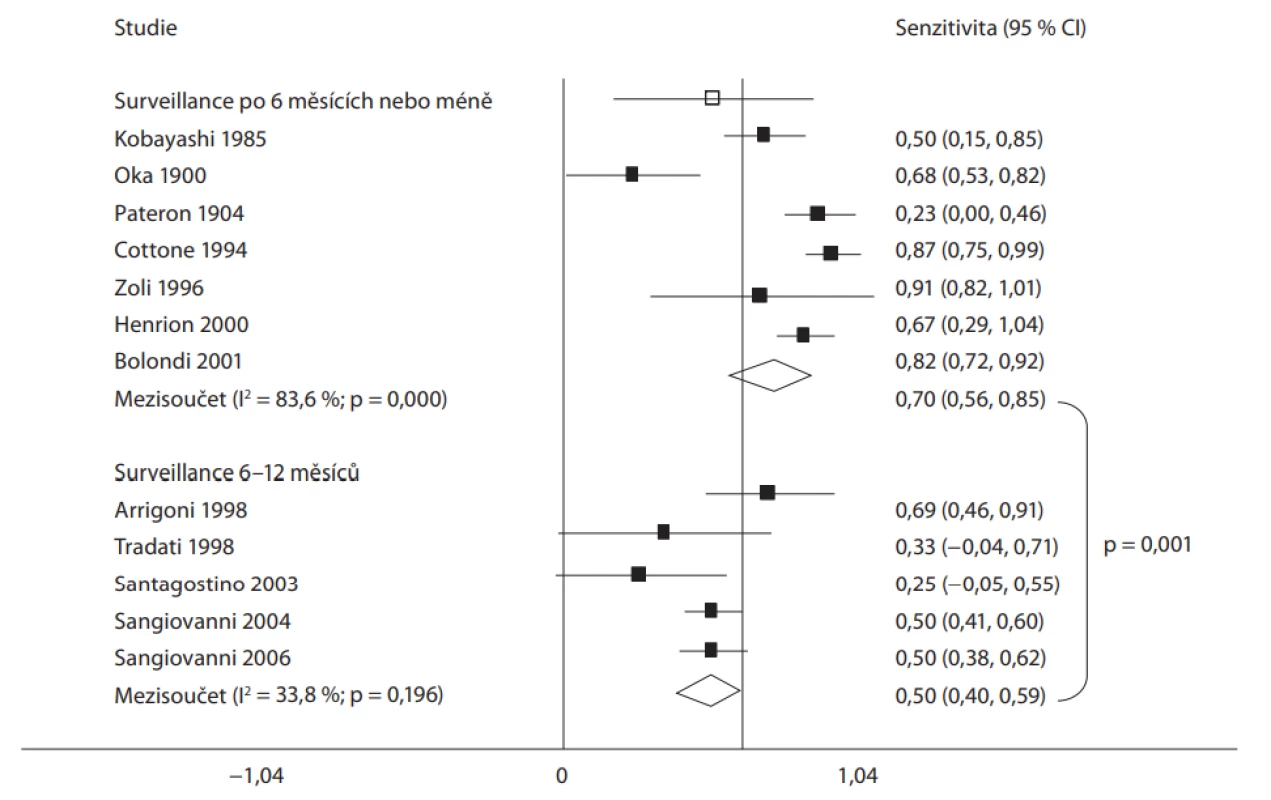
Datovou oporou pro tato doporučení je především čínská studie publikovaná v roce 2004 [33]. Cílovou skupinu ve studii představovalo 18 816 osob s chronickou infekcí HBV (bez rozdílu stadia onemocnění). Sledované osoby byly randomizovány do dvou skupin. V první skupině osob byla prováděna USG jater a vyšetření sérové koncentrace AFP v intervalu 6 měsíců, ve druhé skupině tento postup prováděn nebyl. Při hodnocení celkové mortality byl ve skupině sledované sonograficky prokázán pokles mortality o 37 %. Významně lepší bylo i jednoleté (66 vs. 31 %), tříleté (53 vs. 7,2 %) a pětileté (46 vs. 0 %) přežití. Interval 6 měsíců ve studii autoři zvolili na základě znalostí o významné progresi a růstu HCC [34]. Následné studie dokonce prokázaly, že zkrácení intervalu provádění USG jater na dobu < 6 měsíců nevede k navýšení senzitivity metody, a tím ani k navýšení pozitivního efektu metody ve smyslu dalšího zlepšení přežívání nemocných. Naopak, prodloužení intervalu na dobu > 6 měsíců (a to i o několik málo týdnů!) vede k významnému zhoršení senzitivity celého postupu a zhoršení přežívání (obr. 1) [19]. Čínská studie nehodnotila samostatně přínos vyšetřování koncentrací AFP. Role tohoto nádorového markeru ve screeningu HCC je považována v současnosti za kontroverzní. V roce 2012 byla publikována metaanalýza, která se u pacientů s chronickou infekcí HBV snažila tuto otázku vyřešit [35]. Autoři identifikovali tři (!) studie, které následně hodnotili. Jednou z hodnocených prací byla již citovaná čínská práce. Její výsledky byly uveřejněny v sedmi samostatných publikacích, nicméně přínos AFP pro časnou diagnózu HCC nebylo možné jednoznačně vyhodnotit. Druhá studie pocházela z Toronta a byla provedena na skupině 1 069 HBsAg (hepatitis B surface antigen) pozitivních osob [36]. Jako screeningová metoda v první skupině bylo použito vyšetření koncentrací AFP bez USG, ve druhé skupině byla použita kombinace obou metod. Bohužel ani v této studii nebylo možno zhodnotit a srovnat přínos AFP, protože incidence HCC byla ve sledovacím období 5 let velmi nízká. Třetí hodnocená studie (publikovaná pouze jako sjezdový abstrakt) pocházela z Tchaj-wanu a jejím primárním cílem bylo určení optimálního intervalu při kombinaci AFP a USG jako screeningových metod [37].
Cílová populace
Evropská asociace pro studium jater (EASL) i Americká asociace pro studium jater (AASLD) definují jako populaci indikovanou pro screening/surveillance HCC především pacienty s jaterní cirhózou, a to bez rozdílu etiologie. Obě nadnárodní organizace se dále snaží o určitou stratifikaci rizika. Skupiny s vysokým rizikem rozvoje HCC podle EASL-EORTC ukazuje tab. 3 [38]. I z běžné klinické praxe je však známo, že riziko rozvoje HCC není u všech chronických jaterních onemocnění stejné [39]. Wilsonova nemoc svou kalkulovanou roční incidencí HCC pod 1 % nesplňuje kritéria pro zahájení screeningu, podobně je tomu např. také u jaterní cirhózy při autoimunitní hepatitidě (roční incidence HCC se pohybuje kolem 1,1–1,2 %) [40]. Významným onemocněním s rizikem rozvoje HCC je NAFLD (viz výše). HCC se zde může rozvinout v jakémkoli stadiu jaterního postižení, i bez jaterní cirhózy. NAFLD je ve vyspělých zemích světa významnou příčinou právě necirhotického HCC. Datová opora pro provádění screeningu ve skupině osob s NAFLD bez jaterní cirhózy prakticky neexistuje. U pacientů s jaterní cirhózou při NAFLD, resp. NASH je naopak vzhledem k roční incidenci HCC kolem 2–4 % screening doporučován [41].

Efektivita screeningu
Kohortové studie potvrzují matematické modely v tom smyslu, že screening lze z pohledu populačního považovat za efektivní a především nákladově efektivní v případě, že ho podstoupí alespoň 34 % cílové populace [42]. Z mnoha různých důvodů se však toto číslo ve vyspělých zemích světa v případě screeningu HCC pohybuje maximálně kolem 20 % [43]. Příčiny jsou komplexní, řada z nich je dána důvody na „pacientské“ straně, řada z nich naopak na straně zdravotního systému v daném regionu.
Etiologicky specifická prevence hepatocelulárního karcinomu
Hepatitida B
Univerzální vakcinace HBV je jedinou dostupnou primární prevencí HCC. První zemí na světě, která zahájila program univerzální vakcinace HBV, byl Tchaj-wan v roce 1982. Pokles prevalence HBsAg mezi lety 1984 a 1999 z téměř 10 na 0,7 % byl doprovázen významným poklesem incidence HCC z 0,7/100 000 obyvatel ročně počátkem 80. let na přibližně polovinu v roce 1994 (graf 2) [44]. Po 20 letech trvání programu vakcinace bylo relativní riziko rozvoje HCC pro vakcinované děti mezi 6. a 19. rokem věku pouze 0,31 ve srovnání s osobami, které vakcinaci z různých důvodů nepodstoupily [45].

Za metodu sekundární prevence HCC u pacientů s chronickou infekcí HBV je považována protivirová léčba. Mechanizmy vedoucí k poklesu incidence HCC u léčených osob s infekcí HBV jsou dva:
- pokles či úplná zástava replikace viru (úroveň replikace viru měřená jako sérová koncentrace HBV DNA je dobře definovaným rizikem progrese jaterní fibrózy i rozvoje HCC);
- potlačení aktivity zánětu a regrese jaterní fibrózy.
V roce 2009 byla publikována metaanalýza dvanácti studií, kde bylo hodnoceno celkem 2 082 osob léčených interferonem alfa (IFNa) [46]. Léčba vedla k poklesu rizika rozvoje jaterní cirhózy (relativní riziko (RR) vs. neléčené osoby 0,65) i HCC (RR 0,59). V éře nukleotidových analogů entekaviru a tenofoviru máme mnoho studií na téma redukce incidence HCC z Asie, z Evropy či Ameriky je studií výrazně méně. Většina z nich se ale shoduje v tom, že při léčbě dochází k redukci rizika vzniku HCC až o 80 % u pacientů bez jaterní cirhózy a o 30 % u cirhotiků [47,48]. Za zmínku nicméně stojí zjištění, že osoby, u nichž je při protivirové léčbě dosaženo odpovědi, ale jejich sérová koncentrace HBV DNA není neměřitelná (HBV DNA < 2 000 IU/ml), mají významně vyšší riziko vzniku HCC než osoby s nedetekovatelnou sérovou HBV DNA (poměr rizik (HR) 1,98), zejména v případě, že jde o cirhotiky (HR 2,20) [49].
Problematikou terciární prevence (tj. adjuvantní terapie po kurativní resekci HCC nebo ablaci HCC) se zabývala metaanalýza třinácti studií z roku 2014 [50]. V analýze celkem 6 350 osob došli autoři k závěru, že terapie nukleotidovými analogy vedla jak k prodloužení doby do rekurence onemocnění, tak i k prodloužení celkového přežití. Tento závěr byl také následně potvrzen randomizovanou kontrolovanou studií [51,52].
Hepatitida C
Vyléčení infekce HCV (dosažení setrvalé virologické odpovědi – SVR) je asociováno s významným snížením rizika vzniku HCC, a to bez ohledu na použitou variantu léčby (IFNa vs. přímo působící virostatika (directly acting antivirals – DAA)) a pokročilost jaterní cirhózy (SVR vs. non-SVR; HR cca 0,28) [53]. Protivirová léčba je tak modalitou sekundární prevence. U pacientů se SVR je riziko rozvoje HCC významně nižší, ale není nula. Podobných výsledků je dosahováno i při léčbě pacientů s kompenzovanou cirhózou, redukce incidence je významnější, ale ani v této skupině není nula. Proto je každý pacient s pokročilou jaterní fibrózou (F3) a jaterní cirhózou i po dosažení SVR podle současných doporoučení indikován k doživotnímu sledování a screeningu HCC. Vzhledem k relativně krátké dostupnosti DAA se jejich pozitivní efekt na snížení incidence HCC nemohl v populačním měřítku ještě projevit.
Použití DAA jako terciární prevence, tj. adjuvantní terapie pro kurativních modalitách HCC, je u HCV poněkud odlišné od HBV. O terciární prevenci ve většině případů nelze mluvit, protože DAA jsou pacientům podána buď před terapií HCC, nebo nejpozději současně s ní.
Alkohol
Abstinence snižuje riziko HCC ročně o přibližně 6–7 %, k vyrovnání rizika s běžnou populací dochází při abstinenci u etylické jaterní cirhózy po 20 a více letech [54,55]. Prevence alkohol asociovaného HCC tedy spočívá v komplexních snahách, nejen lékařské veřejnosti, o snížení příjmu alkoholu v dané populaci. Z této jednoduché věty však vyplývá zřejmě nesplnitelný socioekonomický úkol.
Nealkoholové ztukovatění jater, obezita a metabolický syndrom
Primární prevence HCC asociovaného s NAFLD / obezitou / metabolickým syndromem neexistuje, modifikace životního stylu je pojímána jako prevence sekundární. Metaanalýza devatenácti studií, celkem 1 290 045 osob, prokázala snížení RR HCC na 0,72 při zvýšení příjmu zeleniny, nikoli však ovoce, obdobný efekt mělo i navýšení fyzické aktivity [56,57].
Závěr
Hepatocelulární karcinom je jednou z častých komplikací pokročilé jaterní cirhózy. Jednotlivá chronická jaterní onemocnění se liší rizikem vzniku HCC. Za nejrizikovější je považována kombinace chronických infekcí HBV + HCV, naopak minimální riziko rozvoje HCC je např. u Wilsonovy nemoci. V terénu jaterní cirhózy vzniká přibližně 90 % všech případů HCC, 10 % připadá na „necirhotický“ HCC. Etiologicky se v této podskupině uplatňuje především chronická infekce HBV a NAFLD. Přes veškeré pokroky na poli komplexní péče o HCC jsou naše možnosti ve srovnání s jinými nádorovými onemocněními velmi limitované. Klíčovým krokem pro zlepšení přežívání nemocných s HCC je jeho odhalení v počátečních stadiích vývoje. Pro hodnocení stagingu nádoru je používána tzv. BCLC klasifikace, která jako jediná klasifikace HCC přímo implikuje použití léčebné metody a definuje i přežití nemocných. Potenciálně kurativním metodám je i ve 21. století vystavováno stále minimum pacientů. Tato neradostná skutečnost je důkazem existujících rezerv na poli screeningu a surveillance HCC.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential confl icts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
prof. MUDr. Petr Urbánek, CSc.
Interní klinika 1. LF UK a ÚVN Praha
U Vojenské nemocnice 1200
160 00 Praha 6
e-mail: petr.urbanek@uvn.cz
Obdrženo/Submitted: 1. 7. 2020
Sources
1. Global Cancer Observatory. [online]. Available from: https: //gco.iarc.fr/.
2. ÚZIS ČR. Novotvary 2014. [online]. Dostupné z: https: //www.uzis.cz/index-en.php?pg=record&id=7686.
3. Spangenberg HC, Thimme R, Blum HE. Advances in prevention and diagnosis of hepatocellular carcinoma. Expert Rev Gastroenterol Hepatol 2008; 2 (3): 425–433.
4. Chayanupatkul M, Omino R, Mittal S et al. Hepatocellular carcinoma in the absence of cirrhosis in patients with chronic hepatitis B virus infection. J Hepatol 2017; 66 (2): 355–362. doi: 10.1016/j.jhep.2016.09.013.
5. Wu C-Y, Lin J-T, Ho HJ et al. Association of nucleos (t) ide analogue therapy with reduced risk of hepatocellular carcinoma in patients with chronic hepatitis B – a nationwide cohort study. Gastroenterology 2014; 147 (1): 143–151. doi: 10.1053/j.gastro.2014.03.048.
6. Wong GL, Chan HL, Mak CW et al. Entecavir treatment reduces hepatic events and deaths in chronic hepatitis B patients with liver cirrhosis. Hepatology 2013; 58 (5): 1537–1547. doi: 10.1002/hep.26301.
7. Ahn J, Lim JK, Lee HM et al. Lower observed hepatocellular carcinoma incidence in chronic hepatitis B patients treated with entecavir: results of the ENUMERATE study. Am J Gastroenterol 2016; 111 (9): 1297–1304. doi: 10.1038/ajg.2016.257.
8. Ahmed A, Wong RJ, Harrison SA. Nonalcoholic fatty liver disease review: diagnosis, treatment, and outcomes. Clin Gastroenterol Hepatol 2015; 13 (12): 2062–2070. doi: 10.1016/j.cgh.2015.07.029.
9. Wong RJ, Cheung R, Ahmed A. Nonalcoholic steatohepatitis is the most rapidly growing indication for liver transplantation in patients with hepatocellular carcinoma in the US. Hepatology 2014; 59 (6): 2188–2195. doi: 10.1002/hep.26986.
10. White DL, Kanwal F, El-Serag HB. Association between nonalcoholic fatty liver disease and risk for hepatocellular cancer, based on systematic review. Clin Gastroenterol Hepatol 2012; 10 (12): 1342–1359. doi: 10.1016/j.cgh.2012.10.001.
11. Kanwal F, Kramer J, Asch SM et al. Risk of hepatocellular cancer in HCV patients treated with direct-acting antiviral agents. Gastroenterology 2017; 153 (4): 996–1005. doi: 10.1053/j.gastro.2017.06.012.
12. El-Serag HB. Epidemiology of viral hepatitis and hepatocellular carcinoma. Gastroenterology 2012; 142 (6): 1264–1273. doi: 10.1053/j.gastro.2011.12.061.
13. Thrift AP, El-Serag HB, Kanwal F. Global epidemiology and burden of HCV infection and HCV - related disease. Nat Rev Gastroenterol Hepatol 2017; 14 (2): 122. doi: 10.1038/nrgastro.2016.176.
14. Tornillo L, Carafa V, Sauter G et al. Chromosomal alterations in hepatocellular nodules by comparative genomic hybridization: high-grade dysplastic nodules represent early stages of hepatocellular carcinoma. Lab Invest 2002; 82 (5): 547–553. doi: 10.1038/labinvest.3780449.
15. Zhang DY, Friedman SL. Fibrosis-dependent mechanisms of hepatocarcinogenesis. Hepatology 2012; 56 (2): 769–775. doi: 10.1002/hep.25670.
16. Jhunjhunwala S, Jiang Z, Stawiski EW et al. Diverse modes of genomic alteration in hepatocellular carcinoma. Genome Biol 2014; 15 (8): 436. doi: 10.1186/s13059-014-0436-9.
17. Levrero M, Zuckman-Rossi J: Mechanisms of HBV-induced hepatocellular carcinoma. J Hepatol 2016, 64 (1_Suppl): S84–S101. doi: 10.1016/j.jhep.2016.02.021.
18. El-Shamy A, Pendleton M, Eng FJ et al. Impact of HCV core gene quasispecies on hepatocellular carcinoma risk among HALT-C trial patients. Sci Rep 2016; 6 : 27025. doi: 10.1038/srep27025.
19. Singal A, Volk ML, Waljee A et al. Meta-analysis: surveillance with ultrasound for early-stage hepatocellular carcinoma in patients with cirrhosis. Aliment Pharmacol Ther 2009; 30 (1): 37–47. doi: 10.1111/j.1365-2036.2009.04014.x.
20. Bruix J, Sherman M. Management of hepatocellular carcinoma: an update. Hepatology 2011; 53 (3): 1020–1002. doi: 10.1002/hep.24199.
21. Forner A, Vilana R, Ayuso C et al. Diagnosis of hepatic nodules 20 mm or smaller in cirrhosis: Prospective validation of the noninvasive diagnostic criteria for hepatocellular carcinoma. Hepatology 2008; 47 (1): 97–104. doi: 10.1002/hep.21966.
22. Mueller C, Waldburger N, Stampfl U et al. Non-invasive diagnosis of hepatocellular carcinoma revisited. Gut 2017; 68 (5): 991–993. doi: 10.1136/gutjnl-2017-314981.
23. Chou R, Cuevas C, Fu R et al. Imaging techniques for the diagnosis of hepatocellular carcinoma. Ann Intern Med 2015; 162 (10): 697–711. doi: 10.7326/M14-2509.
24. Terzi E, Iavarone M, Pompili M et al. Contrast ultrasound LI-RADS LR-5 identifies hepatocellular carcinoma in cirrhosis in a multicenter retrospective study of 1,006 nodules. J Hepatol 2018; 68 (3): 485–492. doi: 10.1016/j.jhep.2017.11.007.
25. Marrero JA, Fontana RJ, Barrat A et al. Prognosis of hepatocellular carcinoma: comparison of 7 staging systems in an American cohort. Hepatology 2005; 41 (4): 707–716. doi: 10.1002/hep.20636.
26. Llovet JM, Di Bisceglie AM, Bruix J et al. Design and endpoints of clinical trials in hepatocellular carcinoma. J Natl Cancer Inst 2008; 100 (10): 698–711. doi: 10.1093/jnci/djn134.
27. Takayama T, Makuuchi M, Hirohashi S et al. Early hepatocellular carcinoma as an entity with a high rate of surgical cure. Hepatology 1998; 28 (5): 1241–1246. doi: 10.1002/hep.510280511.
28. Roayaie S, Blume IN, Thung SN et al. A system of classifying microvascular invasion to predict outcome after resection in patients with hepatocellular carcinoma. Gastroenterology 2009; 137 (3): 850–855.
29. Kudo, M. Review of 4th Single Topic Conference on HCC. Hepatocellular carcinoma: international consensus and controversies. Hepatol Res 2007; 37 (Suppl 2): S83–S87. doi: 10.1111/j.1872-034X.2007.00167.x.
30. Raoul JL, Sangro B, Forner A et al. Evolving strategies for the management of intermediate-stage hepatocellular carcinoma: available evidence and expert opinion on the use of transarterial chemoembolization. Cancer Treat Rev 2011; 37 (3): 212–220. doi: 10.1016/j.ctrv.2010.07.006.
31. Sieghart W, Hucke F, Pinter M et al. The ART of decision making: retreatment with transarterial chemoembolization in patients with hepatocellular carcinoma. Hepatology 2013; 57 (6): 2261–2273. doi: 10.1002/hep.26256.
32. Lencioni R, Llovet JM. Modified RECIST (mRECIST) assessment for hepatocellular carcinoma. Semin Liver Dis 2010; 30 (1): 52–60. doi: 10.1055/s-0030-1247132.
33. Zhang BH, Yang BH, Tang ZY. Randomized controlled trial of screening for hepatocellular carcinoma. J Cancer Res Clin Oncol 2004; 130 (7): 417–422. doi: 10.1007/s00432-004-0552-0.
34. Sheu JC, Sung JL, Chen DS et al. Growth rate of asymptomatic hepatocellular carcinoma and its clinical implications. Gastroenterology 1985; 89 (2): 259–266. doi: 10.1016/0016-5085 (85) 90324-5.
35. Aghoram R, Cai P, Dickinson JA. Alpha-foetoprotein and/or liver ultrasonography for screening of hepatocellular carcinoma in patients with chronic hepatitis B. Cochrane Database Syst Rev 2012; (9): CD002799. doi: 10.1002/14651858.CD002799.pub2.
36. Sherman M, Peltekian M, Lee C. Screening for hepatocellular carcinoma in chronic carriers of hepatitis B: incidence and prevalence of hepatocellular carcinoma in a North American urban population. Hepatology 1995; 22 (2): 432–438.
37. Wang J-H, Chang K-C, Kee K-M et al. Hepatocellular carcinoma surveillance at 4 - vs. 12-month interval for patients with chronic viral hepatitis – a randomized study in community. Am J Gastroenterol Hepatology 2013; 108 (3): 416–424. doi: 10.1038/ajg.2012.445.
38. European Association for the Study of the Liver. EASL-EORTC Clinical Practice Guidelines: management of hepatocellular carcinoma. J Hepatol 2012 : 56 (4): 908–943. doi: 10.1016/j.jhep.2011.12.001.
39. Spangenberg HC, Thimme R, Blum HE. Targeted therapy for hepatocellular carcinoma. Nat Rev Gastroenterol Hepatol 2009; 6 (7): 423–432. doi: 10.1038/nrgastro.2009.86.
40. Yeoman AD, Al-Chalabi T, Karani JB et al. Evaluation of risk factors in the development of hepatocellular carcinoma in autoimmune hepatitis: Implications for follow-up and screening. Hepatology 2008; 48 (3): 863–870. doi: 10.1002/hep.22432.
41. European Association for the Study of the Liver. EASL Clinical Practice Guidelines: management of hepatocellular carcinoma. J Hepatol 2018; 69 (1): 182–236. doi: 10.1016/j.jhep.2018.03.019.
42. Cadier B, Bulsei J, Nahon P et al. Early detection and curative treatment of hepatocellular carcinoma: A cost-effectiveness analysis in France and in the United States. Hepatology 2017; 65 (4): 1237–1248. doi: 10.1002/hep.28961.
43. Singal AG, El-Serag HB. Hepatocellular carcinoma from epidemiology to prevention: translating knowledge into practice. Clin Gastroenterol Hepatol 2015; 13 (12): 2140–2151. doi: 10.1016/j.cgh.2015.08.014.
44. Chang MH, Chen CJ, Lai MS et al. Universal hepatitis B vaccination in Taiwan and the incidence of hepatocellular carcinoma in children. Taiwan Childhood Hepatoma Study Group. N Engl J Me 1997; 336 (26): 1855–1859. doi: 10.1056/NEJM199706263362602.
45. Chang MH, You SL, Chen CJ et al. Taiwan Hepatoma Study Group. Decreased incidence of hepatocellular carcinoma in hepatitis B vaccinees: a 20-year follow-up study. J Natl Cancer Inst 2009; 101 (19): 1348–1355. doi: 10.1093/jnci/djp288.
46. Yang YF, Zhao W, Zhong YD et al. Interferon therapy in chronic hepatitis B reduces progression to cirrhosis and hepatocellular carcinoma: a meta-analysis. J Viral Hepat 2009; 16 (4): 265–271. doi: 10.1111/j.1365-2893.2009.01070.x.
47. Papatheodoridis GV, Chan HL, Hansen BE et al. Risk of hepatocellular carcinoma in chronic hepatitis B: assessment and modification with current antiviral therapy. J Hepatol 2015; 62 (4): 956–967. doi: 10.1016/j.jhep.2015.01.002.
48. Papatheodoridis GV, Idilman R, Dalekos GN et al. The risk of hepatocellular carcinoma decreases after the first 5 years of entecavir or tenofovir in Caucasians with chronic hepatitis B. Hepatology 2017; 66 (5): 1444–1453. doi: 10.1016/j.jhep.2015.01.002.
49. Kim JH, Sinn DH, Kang W et al. Low-level viremia and the increased risk of hepatocellular carcinoma in patients receiving entecavir treatment. Hepatology 2017; 66 (2): 335–343. doi: 10.1002/hep.28916.
50. Sun P, Dong X, Cheng X et al. Nucleot (s) ide analogues for hepatitis B virus-related hepatocellular carcinoma after curative treatment: a systematic review and meta-analysis. PLoS One 2014; 9 (7): e102761. doi: 10.1371/journal.pone.0102761.
51. Huang G, Lau WY, Wang ZG et al. Antiviral therapy improves postoperative survival in patients with hepatocellular carcinoma: a randomized controlled trial. Ann Surg 2015; 261 (1): 56–66. doi: 10.1097/SLA.0000000000000858.
52. Wang ZY, Tao QF, Wang ZH et al. Antiviral therapy improves post-operative survival outcomes in patients with HBV-related hepatocellular carcinoma of less than 3 cm – a retrospective cohort study. Am J Surg 2019; 219 (4): 717-725. doi: 10.1016/j.amjsurg.2019.05.016.
53. Nahon P, Bourcier V, Layese R et al. ANRS CO12 CirVir Group. Eradication of hepatitis C virus infection in patients with cirrhosis reduces risk of liver and non-liver complications. Gastroenterology 2017; 152 (1): 142–156. doi: 10.1053/j.gastro.2016.09.009.
54. Heckley GA, Jarl J, Asamoah BO et al. How the risk of liver cancer changes after alcohol cessation: a review and meta-analysis of the current literature. BMC Cancer 2011; 11 : 446. doi: 10.1186/1471-2407-11-446.
55. La Vecchia C. Alcohol and liver cancer. Eur J Cancer Prev 2007; 16 (6): 495–497. doi: 10.1097/CEJ.0b013e328 0145b5d.
56. Yang Y, Zhang D, Feng N et al. Increased intake of vegetables, but not fruit, reduces risk for hepatocellular carcinoma: a meta-analysis. Gastroenterology 2014; 147 (5): 1031–1042. doi: 10.1053/j.gastro.2014.08.005.
57. Wen CP, Lin J, Yang YC et al. Hepatocellular carcinoma risk prediction model for the general population: the predictive power of transaminases. J Natl Cancer Inst 2012; 104 (20): 1599–1611. doi: 10.1093/jnci/djs372.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2020 Issue Supplementum 3
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Editorial
- Hepatocelulární karcinom – zobrazovací metody a intervence pod kontrolou zobrazovacích metod
- Hepatocelulární karcinom z pohledu transplantologa
- Současné možnosti léčby hepatocelulárního karcinomu
- Budoucí možnosti léčby hepatocelulárního karcinomu
- Chirurgická léčba hepatocelulárního karcinomu
- Hepatocelulární karcinom z pohledu gastroenterologa/hepatologa
- Shrnutí
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Budoucí možnosti léčby hepatocelulárního karcinomu
- Současné možnosti léčby hepatocelulárního karcinomu
- Hepatocelulární karcinom – zobrazovací metody a intervence pod kontrolou zobrazovacích metod
- Hepatocelulární karcinom z pohledu gastroenterologa/hepatologa
