Epiteloidní hemangioendoteliom v PET/ CT obraze
Epithelioid hemangioendothelioma on PET/CT scan
Background: At present, lung cancer ranks among the most frequent malignant diseases. However, according to literature data, mesenchymal lung tumors are very rare, representing less than 0.5% of all malignant lung tumours. Epithelioid hemangioendothelioma of the lungs belongs to this group of uncommon entities. Case report: We present a case of a 45-year-old male with a history of increasing dyspnoea and abdominal and back pains, developing over the past several months. Vertebral lesions were found on imaging studies. PET/ CT following 18F-fluorodeoxyglucose administration (FDG) showed a large FDG-positive malignant infiltration affecting the thorax, abdominal cavity, and bones. The extension and other characteristics of the mass on PET/ CT did not correspond to any of the common oncologic diseases. With its spread in a plaque-like form predominantly in the right hemithorax and on the surface of the liver, the disease closely resembled malignant mesothelioma. The primary tumour origin could not be clearly identified on PET/ CT scans but they allowed us to choose a suitable site to obtain tissue for pathologic examination. Based on a CT-guided bone biopsy of the 7th right rib, the diagnosis was concluded as epithelioid hemangioendothelioma. Despite an early initiation of systemic treatment, the patient succumbed to the disease only 15 days after the diagnosis, due to superior vena cava syndrome and progressive pleural effusion leading to respiratory insufficiency. Conclusions: Given the extremely low prevalence of epithelioid hemangioendothelioma and its heterogeneous manifestation, it is impossible to base the diagnosis solely on disease symptoms, laboratory findings, and imaging modalities. In this respect, pathologic examination has a crucial role. For the same reason, there is a lack of recommendations for the standard-of-care systemic therapy of metastatic disease.
Keywords:
epithelioid hemangioendothelioma – PET/ CT– treatment
Authors:
Renata Koukalová 1,2; Jiří Šedo 3; Dagmar Krákorová Adámková 3; Zuzana Šimková 1; Pavel Fabian 4; Petr Szturz 5
Authors‘ workplace:
Oddělení nukleární medicíny, MOU Brno
1; LF MU Brno
2; Klinika komplexní onkologické péče MOÚ a LF MU Brno
3; Oddělení onkologické patologie, MOÚ Brno
4; Department of Oncology, Lausanne University Hospital (CHUV), Lausanne, Switzerland
5
Published in:
Klin Onkol 2021; 34(3): 235-240
Category:
Original Articles
doi:
https://doi.org/10.48095/ccko2021235
Overview
Východiska: Maligní plicní nádory patří v současnosti dle četnosti k nejčastějším zhoubným onemocněním. Mezenchymální nádory plic jsou však velmi vzácné. Dle literárních dat představují necelých 0,5 % všech maligních plicních nádorů. Jednou ze vzácných variant je plicní epiteloidní hemangioendoteliom. Případ: Prezentujeme případ 45letého muže s několikaměsíční anamnézou narůstající dušnosti, s bolestí břicha a zad. Zobrazovacími metodami bylo zjištěno postižení skeletu páteře. PET/ CT s 18F-fluorodeoxyglukózou (FDG) prokázalo rozsáhlý FDG-avidní maligní proces postihující hrudník, dutinu břišní i skelet. Rozsah a charakter infiltrace v PET/ CT obraze nebyly typické pro žádnou z častějších onkologických diagnóz. Svým plošným šířením zejména v pravém hemithoraxu a na povrchu jater onemocnění nejvíce připomínalo maligní mezoteliom. PET/ CT vyšetření nedetekovalo jasné primární tumorózní ložisko, umožnilo však lokalizovat místo vhodné k bioptické verifikaci procesu. Biopsií infiltrovaného 7. žebra vpravo pod CT kontrolou byl zjištěn epiteloidní hemangioendoteliom. I přes časné zahájení systémové léčby pacient umírá na respirační insuficienci se syndromem horní duté žíly a progredujícím fluidothoraxem 15 dní po stanovení diagnózy. Závěr: Vzhledem k extrémně raritnímu výskytu epiteloidního hemangioendoteliomu a jeho heterogenním projevům není možné určit správnou diagnózu pouze na základě klinických projevů, laboratorních vyšetření či nálezů v zobrazovacích metodách. Rozhodující význam pro určení diagnózy má histopatologické vyšetření. Ze stejného důvodu nebyla dosud vypracována doporučení pro systémovou léčbu mnohočetného postižení.
Klíčová slova:
epiteloidní hemangioendoteliom – PET/ CT – léčba
Úvod
Epiteloidní hemangioendoteliom (EHE) je vzácná malignita cévního původu. Vyskytovat se může v různých lokalizacích, jakou jsou játra, plíce, mediastinum, srdce, gastrointestinální trakt, peritoneum, kosti vč. kostní dřeně, měkké tkáně hlavy, krku, končetin, břicha, anogenitální oblast, lymfatické uzliny, prsní žlázy, mozek, mozkové pleny a kůže [1–3]. Nejčastěji jsou však postižena játra, plíce, kůže nebo kosti [4].
50–76 % pacientů je asymptomatických [1,3]. Odhadovaná prevalence EHE je méně než 1 pacient na milion obyvatel [5]. Plicní epiteloidní hemangioendoteliom (PEHE) je považován za nízce až středně maligní sarkom plic. Jeho biologická povaha ho řadí mezi hemangiom a angiosarkom. Poprvé byl popsán v roce 1975 Dailem a Liebowem pod názvem intravaskulární bronchoalveolární tumor, protože byl považován za agresivní formu bronchoalveolárního karcinomu prorůstajícího do přilehlých krevních cév. Následně však byl dalšími metodami potvrzen endoteliální původ nádorových buněk. Současný název byl poprvé použit Weisem et al v roce 1986 [1]. Dosud bylo v dostupné literatuře popsáno přibližně 248 případů PEHE [3]. Největší soubor obsahoval data 93 pacientů [6]. PEHE se vyskytuje až 4× častěji u žen než u mužů – podle různých autorů jsou ženy postiženy v 62–80 % případů [3]. Pleurální forma PEHE se zdá být naopak častější u mužů [7].
Věkový průměr pacientů s PEHE je 37 let a přes 40 % nemocných je mladších 40 let. Výskyt nemoci má dva vrcholy – ve 3. a 5. dekádě života. Přibližně polovina případů je asymptomatických a onemocnění se zjistí náhodně na skiagramu hrudníku. Druhá polovina nemocných má nespecifické příznaky jako dušnost, suchý kašel, pleurální bolest, hmotnostní úbytek a celkovou slabost. Vzácně se může nemoc projevovat alveolárním krvácením a rychle progredující plicní hypertenzí. Pleurální postižení může mít podobu suché pleuritidy nebo pleurálního výpotku. Vzdálené metastázy se objevují asi u 25 % případů [1].
Popis případu
Z anamnézy muže narozeného v roce 1973 je významná informace o prodělaném pneumotoraxu v roce 2010. Ve stejném roce byla také provedena resekce pravé plíce s dekortikací pleury pro pachypleuritis calcarea. Histologický nález odpovídal fibrózní pleuritidě s ložiskově vystupňovanou reaktivní, místy až atypickou, proliferací mezotelu. Malignita však potvrzena nebyla. Po 20 letech aktivního kouření pacient v této době cigarety odložil. V dalším období se postupně objevily chronické komplikace charakteru fibrotizace hrudníku vpravo s kalcifikacemi paravertebrálně a také skolióza páteře. Zdravotní stav se dále komplikoval v roce 2015 úrazovou frakturou žeber.
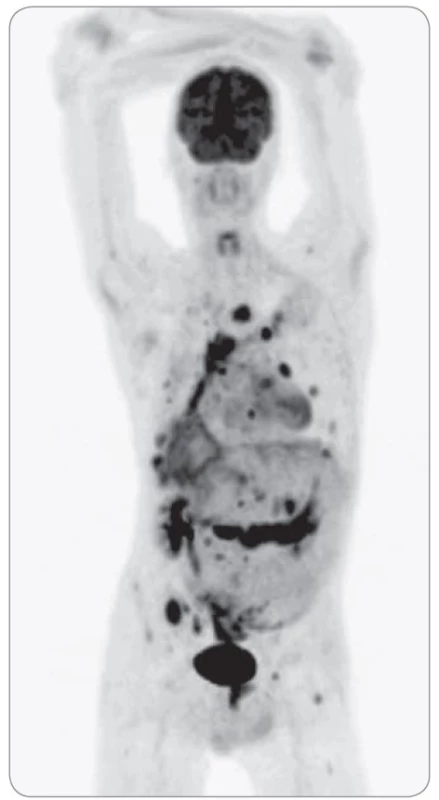




Chronické bolesti zad, které sám přičítal skolióze při retrakci pravého hemitoraxu, se výrazněji zhoršily v červnu 2018. Došlo také k progresi bolestí břicha a k výraznému úbytku na váze (25 kg za 4–5 měsíců). Výsledky gastroskopie, kolonoskopie a UZ vyšetření břicha neobjasnily příčinu uvedených příznaků. Pro zhoršující se bolesti zad byla koncem ledna 2019 provedena MR páteře, kde byla zjištěna ložiska charakteru metastáz v hrudní oblasti. Vzhledem k zjištěné maligní infiltraci skeletu přišel pacient začátkem února 2019 k došetření a léčbě do Masarykova onkologického ústavu. Úvodem byla v ambulanci léčby bolesti nastavena adekvátní léčba chronické smíšené bolesti hrudní páteře, hrudníku a břicha. O několik dní později bylo provedeno PET/ CT vyšetření, které upřesnilo rozsah postižení netypickým procesem, který vykazoval jednoznačné známky malignity. V PET/ CT obraze (obr. 1) dominovala rozsáhlá FDG-avidní solidní tumorózní masa v mediastinu, která v podobě pruhovitého infiltrátu od úrovně trachey postupovala podél vzestupné aorty parakardiálně vpravo (obr. 2) a dále se kaudálněji šířila po povrchu jater (obr. 3). Další části maligní infiltrace byly v okrajích pravého plicního křídla a v hrudní stěně vpravo, místy byly patrné i zřetelné pruhovité kalcifikace. Metastatické postižení plic mělo charakter spíše pruhovitých denzních infiltrátů a drobných subcentimetrových ložisek subpleurálně. Méně nápadné metastatické postižení bylo i na pleuře a v parenchymu plic subpleurálně vlevo (obr. 4). Vyjma výše popsané objemné infiltrace byla v mediastinu i jednotlivá separovaná metastatická ložiska – např. patologická uzlina ventrálně od levé pulmonální artérie. V oblasti dutiny břišní (kromě infiltrace na povrchu jater) byl nejnápadnější objemný pruhovitý mezenteriální infiltrát, který vykazoval vysoký uptake FDG (obr. 5). Dále byly patrné metastázy v játrech a nevýrazně zvětšené patologické uzliny v retroperitoneu. Zejména v PET obraze byla vysoce suspektní infiltrace na povrchu kliček střevních. Většinou vysoce FDG avidní metastázy ve skeletu měly v CT obraze smíšený charakter – některé metastázy byly jednoznačně osteolytického charakteru, jiné léze byly převážně osteoplastické. Část skeletálních metastáz neměla v CT obraze jednoznačný korelát a byla zřetelná pouze metabolicky (obr. 6).
Metabolická aktivita patologických ložisek a infiltrátů ve všech lokalizacích se značně lišila. Maximální standardizovaná hodnota vychytávání (standardized uptake value – SUVmax) se pohybovala od relativně nízkých hodnot (např. SUVmax 3,2 jaterní metastázy) až po nápadně vysoké hodnoty (např. SUVmax 12,3 osteolytického ložiska v pravé lopatě kyčelní) při metabolické aktivitě jaterního parenchymu SUVmax 2,5.


Rozsah a charakter maligní infiltrace byl velmi netypický, nejvíce se blížil vzhledu mezoteliomu. Z PET/ CT nálezu se nedalo jednoznačně určit primární tumorózní ložisko. PET/ CT však umožnilo výběr lokality vhodné k bioptické verifikaci.
Přibližně od poloviny února 2019 pacient udával progresi dušnosti a zvýšenou únavnost. Došlo k rychlému rozvoji respirační insuficience, kdy levá plíce zjevně nedostatečně nahrazovala dysfunkci pravé plíce. Pro zhoršení zdravotního stavu byl pacient hospitalizován.
Laboratorní vyšetření neodhalila zásadnější odchylky od normy. Nekonkluzivní byly také výsledky nádorových markerů – negativní výsledky prostatického specifického antigenu, β-podjednotky lidského choriového gonadotropinu, β2-mikroglobulin, α-fetoproteinu, CA 19-9, karcinoembryonálního antigenu a CA 72-4. Pro postižení skeletu byly nálezy konzultovány na spondyloonkologické komisi. Byla upravena léčba bolesti a zavedena oxygenoterapie. Pod CT kontrolou byla začátkem března 2019 provedena biopsie 7. žebra vpravo, den poté byl pacient ve stabilizovaném stavu propuštěn do domácí péče. Patologem byl popsán epiteloidní hemangioendoteliom, který byl potvrzen i v rámci druhého expertního čtení, vč. molekulárně genetického průkazu patognomické fúze genů WWTR1-CAMTA1. Vzhledem k anamnéze a charakteru aktuálního postižení lze předpokládat, že se patrně jednalo o pleurální formu PEHE.
V den uzavření histologického nálezu (12. den po biopsii) byl pacient v březnu 2019 opět akutně přijat na lůžkové oddělení pro progredující dušnost. Na CT vyšetření plic a mediastina provedeném během hospitalizace (23 dnů od PET/ CT) byla diagnostikována další progrese maligní infiltrace pleury, bránice a mediastina. Maximum postižení bylo v mediastinu vpravo v místě vstupu horní duté žíly (HDŽ) do pravé síně. Lumen bylo výrazně zúženo s hrozícím rozvojem syndromu HDŽ. Zvýraznil se také výpotek v levé pohrudniční dutině. Byl zaveden hrudní drén, nasazeny betablokátory pro sinusovou tachykardii, kortikosteroidy a po kolektivní rozvaze bylo při výkonnostním stavu 2 (podle Eastern Cooperative Oncology Group) zahájeno z vitální indikace podání paliativní systémové chemoterapie (26 dnů od PET/ CT) v režimu paklitaxel/ karboplatina. Třetí den po podání chemoterapie došlo k výraznému zlepšení klidové dušnosti s trvající lehkou hyposaturací (saturace O2 > 90 % v klidu). Dobře spolupracující pacient bez známek infekce byl propuštěn do domácího ošetřování na oxygenoterapii, se zavedeným hrudním drénem a vyhovující analgetickou léčbou. Lze předpokládat, že zásadní podíl na přechodném zlepšení stavu měla především upravená podpůrná léčba, spíše než samotná chemoterapie. V následujících 10 dnech od propuštění však došlo k rychlému zhoršování celkového stavu, progredovala slabost a respirační insuficience. S ohledem na omezené možnosti léčby a celkový stav byla u pacienta dále zvolena pouze symptomatická terapie nádorového onemocnění, která byla v domácím prostředí upravována. U pacienta se postupně objevila také zmatenost a neklid. Pacient zemřel koncem března 2019 v péči domácího hospice –15. den po prvním podání paliativní systémové chemoterapie (41 dnů od PET/ CT).
Diskuze
Nelze zpětně určit, kdy došlo u pacienta k rozvoji onemocnění. Není jasné, zda komplikace v roce 2010 byly již způsobeny tímto raritním nádorem (při falešné negativitě histologického vyšetření) či došlo k rozvoji maligního onemocnění až v průběhu následujících let. Malignita (i přes výrazné symptomy) zůstala dlouho nerozpoznána. V době potvrzení diagnózy bylo již stadium nemoci značně pokročilé.
Etiologie vzniku EHE je dosud neznámá [3]. Na molekulární úrovni mohou mít vliv různé angiogenní stimulátory, které působí jako promotory proliferace endotelových buněk [8]. Jedna z nových hypotéz patogeneze se týká příčinné souvislosti mezi chronickou infekcí způsobenou Bartonellou a rozvojem tohoto vzácného vaskulárního tumoru [9]. Některé práce hovoří o možném vlivu hormonální antikoncepce a vinylchloridu na vznik PEHE [1].
V současnosti neexistuje žádný sérový marker pro diagnostiku PEHE.
Prognóza EHE a jeho průběh je velmi variabilní. Přežití pacientů kolísá od 6 měsíců po 28 let, průměrně 4,6 roku [5,10,11]. Pokud je EHE lokalizováno v měkkých tkáních, je mortalita pouze 13 %. Pokud jsou primárně postižena játra, dosahuje mortalita 35 %. Nejhorší prognózu mají pacienti s postižením plic – mortalita v tomto případě dosahuje 65 % [12]. Někteří autoři rozlišují v rámci postižení plic formu pleurální a dominantní postižení plicního parenchymu. Horší prognózu má postižení pleury [13].
K nepříznivým prognostickým faktorům EHE patří např. plicní léze, multiorgánové postižení, progrese onemocnění, postižení ≥ 3 kostí, ascites, mužské pohlaví a věk ≥ 55 let [3,5].
U asymptomatických pacientů s PEHE je udáván medián přežití 180 měsíců, u těchto pacientů jsou v literatuře popsané i případy spontánních regresí.
Medián přežití pacientů s PEHE zhoršuje např. přítomnost alveolární hemoragie, hemoptýza, pleurální výpotek, ztráta hmotnosti a anemie [14]. Horší prognózu mají také pacienti s hilovými metastázami a postižením jater [15]. K nepříznivým prognostickým faktorům patří také přítomnost klinických obtíží, endobronchiální a intravaskulární šíření tumoru, mediastinální nebo periferní lymfadenopatie, současné postižení jater a/ nebo jiných orgánů. Známkou agresivního chování nemoci jsou také opacity typu mléčného skla v parenchymu plic a/ nebo intersticiální ztluštění patrná na CT plic s vysokým rozlišením [1].
V zobrazovacích metodách může v závislosti na lokalizaci a rozsahu postižení EHE připomínat řadu jiných onemocnění. V případě výskytu mnohočetných nodulárních lézí v plicích může dojít k záměně např. s hematogenními metastázami, arteriovenózními malformacemi, granulomatozními plicními procesy (mimo jiné sarkoidózou, Wegenerovou granulomatózou, pneumokoniózou), s non-Hodgkinským lymfomem, amyloidózou a několika dalšími vzácnými onemocněními plic – např. s mnohočetnými kalcifikujícími fibrózními tumory [11]. Pokud v obraze dominuje postižení pleury, připomíná EHE maligní mezoteliom. V diferenciální diagnóze je nutné vyloučit také bronchogenní karcinom a difuzní pleurální karcinomatózu [13]. Vzhledem k raritnímu výskytu EHE není mnoho prací zaměřených na diagnostiku a sledování EHE pomocí PET/ CT. Autoři zabývající se diagnostikou EHE v různých lokalizacích se shodují v tom, že PET/ CT je významnou metodou pro staging i sledování vývoje onemocnění [16]. V případě výskytu EHE v hrudníku může být FDG-avidita lézí variabilní a může souviset s biologickou povahou onemocnění [17]. Se stoupající hodnotou SUVmax lze očekávat větší maligní potenciál onemocnění. Mohou však existovat i výjimky. Nizami et al popisuje případ 13leté dívky s agresivní formou PEHE v podobě plicních nodulů, které vykazovaly jen mírně zvýšený uptake FDG [18].
Vzhledem k raritnímu výskytu EHE dosud neexistují doporučené standardní léčebné postupy.
V případě malého rozsahu PEHE (solitární uzel, několik izolovaných lézí) je možno zvažovat chirurgické řešení [1]. Při lokalizovaném jaterním EHE se řešením jeví transplantace jater. Pokud se EHE projevuje jako solitární kostní léze, je možným řešením resekce kosti „en bloc“. U multifokálního postižení kostí končetiny je nutná i amputace. V terapii kostního postižení se uplatňuje též radiofrekvenční ablace [3]. Nejsou data o zásadní účinnosti radioterapie v léčbě EHE [1,3]. Svoji roli však má v léčbě paliativní, vč. analgetické.
Současné postupy v léčbě metastatického EHE zahrnují různé režimy s konvenčními cytostatiky a antiangiogenními léky, a to jak v monoterapii, tak i v kombinaci. Celkové přežití u těchto pacientů dosahuje podle jedné metaanalýzy 83 % v prvním, 56 % v druhém a 41 % ve třetím roce od stanovení diagnózy [19]. S ohledem na vzácný výskyt onemocnění se léčebná doporučení nezakládají na prospektivních studiích, ale spíše na popisech jednotlivých případů a malých souborů pacientů. Mezi nejčastěji používaná chemoterapeutika se řadí karboplatina, paklitaxel, adriamycin, etoposid, ifosfamid, dakarbazin, cyklofosfamid a vinkristin. Vzhledem k původu onemocnění v endoteliálních buňkách se z cílené léčby upírá pozornost zejména k již zmíněným antiangiogenním lékům, jako jsou např. talidomid, bevacizumab nebo apatinib, ale i méně specificky působící multikinázové inhibitory pazopanib a sorafenib [20].
Závěr
Epiteloidni hemangioendoteliom je velmi vzácné onemocnění s obtížně predikovatelným biologickým chováním i velmi variabilním průběhem. Může být náhodně zjištěn u asymptomatických pacientů s následnou dlouhodobou stabilizací. Jindy se jedná o velmi agresivní, rychle progredující postižení se špatnou prognózou. Vzhledem k jeho raritnímu výskytu a pestrým projevům bývá téměř nemožné určit správnou diagnózu na základě klinického nálezu, laboratorních vyšetření či nálezu v zobrazovacích metodách. Ty umožní zjistit přesný rozsah onemocnění a sledování léčebné odpovědi. Umožní také určit místo vhodné k bioptické verifikaci. PET/ CT má oproti jiným zobrazovacím metodám výhodu, že přesněji dokáže určit v terénu často rozsáhlého procesu oblast s vysokým maligním potenciálem. Konečné stanovení diagnózy má však vždy v rukou zkušený patolog. Vzhledem k extrémně raritnímu výskytu onemocnění neexistuje dosud „evidence-based“ doporučení pro systémovou léčbu mnohočetného postižení.
Obdrženo/Submitted: 14. 3. 2021
Přijato/Accepted: 14. 5. 2021
MUDr. Renata Koukalová
Oddělení nukleární medicíny
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: rkoukalova@mou.cz
Sources
- Skřičková J, Kolek V et al. Základy moderní pneumoonkologie. Praha: Maxdorf 2012.
- Mehta SR, Das A, Barnard N et al. Metastatic pulmonary epithelioid hemangioendothelioma: a case report and review of the literature. Respir Med Case Rep 2012; 7 : 17–20. doi: 10.1016/ j.rmcr.2012.09.003.
- Sardaro A, Bardoscia L, Petruzzelli MF et al. Epithelioid hemangioendothelioma: an overview and update on a rare vascular tumor. Oncol Rev 2014; 8(2): 259. doi: 10.4081/ oncol.2014.259.
- Lau K, Massad M, Pollak C et al. Clinical patterns and outcome in epithelioid hemangioendothelioma with or without pulmonary involvement: insights from an internet registry in the study of a rare cancer. Chest 2011; 140(5): 1312–1318. doi: 10.1378/ chest.11-0039.
- Lau K, Massad M, Weinberg G et al. Clinical patterns and outcome in epithelioid hemangioendothelioma with or without pulmonary involvement. Chest 2011; 140(5): 1312–1318. doi: 10.1378/ chest.11-0039.
- Amin RM, Hiroshima K, Kokubo T et al. Risk factors and independent predictors of survival in patients with pulmonary epithelioid haemangioendothelioma. Review of the literature and a case report. Respirology 2006; 11(6): 818–825. doi: 10.1111/ j.1400-1843.2006.00923.x.
- Lee YJ, Chung MJ, Jeong KC. Pleural epithelioid hemangioendothelioma. Yonsei Med J 2008; 49(6): 1036–1040. doi: 10.3349/ ymj.2008.49.6.1036.
- Radzikowska E, Szczepulska-Wójcik E, Roszkowski K et al. Pulmonary epithelioid hemangioendothelioma – interferon 2-alpha treatment – case report. Pneumol Allergol Pol 2008; 76(4): 281–285.
- Mascarelli PE, Iredell JR, Breitschwerdt EB et al. Bartonella species bacteremia in two patients with epithelioid hemangioendothelioma. J Clin Microbiol 2011; 49(11): 4006–40012. doi: 10.1128/ JCM.05527-11.
- Teo SK, Chiang SC, Tan KK. Intravascular bronchioloalveolar tumor: a 20 year survival. Med J Aust 1985; 142(3): 220–222.
- Miettinen M, Collan Y, Vilkko P et al. Intravascular bronchioloalveolar tumor. Cancer 1987; 60(10): 2471–2475. doi: 10.1002/ 1097-0142(19871115)60 : 10<2471::aid-cncr2820601021>3.0.co;2-8.
- Gomez-Arellano LI, Ferrari-Caballo T, Dominguez-Malagon HR. Multicentric epithelioid hemangioendothelioma of bone. Report of a case with radiologic-pathologic correlation. Annals Diagn Pathol 2012; 16(1): 43–47. doi: 10.1016/ j.anndiagpath.2011.08.001.
- Crotty EJ, McAdams HP, Erasmus JJ et al. Epithelioid hemangioendothelioma of the pleura: clinical and radiologic features. Am J Roentgenol 2000; 175(6): 1545–1549. doi: 10.2214/ ajr.175.6.1751545.
- Bagan P, Hassan M, Barthes FL et al. Prognostic factors and surgical indications of pulmonary epithelioid hemangioendothelioma: a review of the literature. Ann Thorac Surg 2006; 82(6): 2010–2013. doi: 10.1016/ j.athoracsur.2006.06.068.
- Schattenberg T, Kam R, Pfannschmidt J et al. Pulmonary epithelioid hemangioendothelioma: report of three cases. Surg Today 2008; 38(9): 844–849. doi: 10.1007/ s00595-007-3712-4.
- Albano D, Bosio G, Tironi A et al. 18F-FDG PET/ CT in pleural epithelioid hemangioendothelioma. Asia Ocean J Nucl Med Biol 2017; 5(1): 70–74. doi: 10.22038/ aojnmb.2016.7971.
- Woo JH, Kim TJ, Lee KS et al. Epithelioid hemangioendothelioma in the thorax: clinicopathologic, CT, PET, and prognostic features. Medicine (Baltimore) 2016; 95(30): e4348. doi: 10.1097/ MD.0000000000004 348.
- Nizami I, Mohammed S, Abouzied ME. Pulmonary epitheloid hemangioendothelioma PET CT findings and review of literature. Ann Saudi Med 2014; 34(5): 447–449. doi: 10.5144/ 0256-4947.2014.447.
- Mehrabi A, Kashfi A, Fonouni H et al. Primary malignant hepatic epithelioid hemangioendothelioma: a comprehensive review of the literature with emphasis on the surgical therapy. Cancer 2006; 107(9): 2108–2121. doi: 10.1002/ cncr.22225.
- Lamar JM, Motilal Nehru V, Weinberg G. Epithelioid hemangioendothelioma as a model of YAP/ TAZ-driven cancer: insights from a rare fusion sarcoma. Cancers 2018; 10(7): 229. doi: 10.3390/ cancers10070229.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2021 Issue 3
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Léčba nemetastatického kastračně rezistentního karcinomu prostaty
- Sociální faktory mají vliv na průběh a prognózu maligní nemoci
- Léčba nemetastatického kastračně refrakterního karcinomu prostaty
- Indikace žilních vstupů v onkologii – doporučení národních odborných společností a současný stav v ČR
- Mechanobiologie kancerogeneze
- Epiteloidní hemangioendoteliom v PET/ CT obraze
- Využití PET/ CT s markerem hypoxie (18F-FMISO) v plánování radioterapie
- Lipozomální irinotekan – nová možnost systémové léčby karcinomu pankreatu
- COVID-19 a onkologické ochorenie
- Aktuality z odborného tisku
- Životné jubileum doc. MU Dr. Juraja Kaušitza, CSc.
- Jubileum prvej dámy radiačnej onkológie na Slovensku – MUDr. Eva Siracká, DrSc.
- Genetické a epigenetické základy radiorezistence nádorových buněk prostaty
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Indikace žilních vstupů v onkologii – doporučení národních odborných společností a současný stav v ČR
- Epiteloidní hemangioendoteliom v PET/ CT obraze
- COVID-19 a onkologické ochorenie
- Mechanobiologie kancerogeneze
