Kalcifylaxe jako multioborový problém: důležité informace (nejen) pro klinického osteologa a kazuistiky
Calciphylaxis as a multidisciplinary problem: important information (not only) for clinical osteologists and case reports
Calciphylaxis (CUA – calcifying uremic arteriolopathy) is a serious clinical complications characterized by large and painful skin and subcutaneous tissue ulcerations and necrosis, associated with the risk of sepsis and mortality. Its pathogenesis is quite complicated. Despite it is a rare entity, physicians of all specialities may meet this disease. Therefore, this paper focuses on principal characteristics of CUA, risk factors in pathogenesis (namely calcium and phosphate metabolism disturbances, hyperparathyroidism, and association with warfarin therapy), as well as on therapeutics principles and possibilities. The most promising current therapy approach is administration of sodium thiosulfate. Three case reports are presented for illustration.
Keywords:
warfarin – calcifying uremic arteriolopathy – calciphylaxis – hyperparathyroidism – matrix GLA mortality protein – sepsis – skin necrosis – sodium thiosulfate – surgical parathyroidectomy
Authors:
Sulková Dusilová Sylvie 1,2; Šafránek Roman 1,2; Pokorná Anita 1; Soukup Tomáš 3; Bělobrádková Martina 3; Horáček Jiří 6; Bláha Vladimír 4; Palička Vladimír 5
Authors‘ workplace:
Hemodialyzační středisko FN Hradec Králové
1; Katedra interních oborů LF UK, Hradec Králové
2; II. interní gastroenterologická klinika LF UK a FN Hradec Králové
3; III. gerontometabolická klinika LF UK a FN Hradec Králové
4; Osteocentrum, Ústav klinické biochemie a diagnostiky LF UK a FN Hradec Králové
5; IV. interní hematologická klinika LF UK a FN Hradec Králové
6
Published in:
Clinical Osteology 2019; 24(4): 205-215
Category:
Overview
Kalcifylaxe (CUA – calcifying uremic arteriolopathy/kalcifikující uremická arteriolopatie) je velmi závažná klinická komplikace charakterizovaná rozsáhlými a bolestivými ulceracemi a nekrózami kůže a podkoží, s rizikem sepse a úmrtí. Patogeneza je značně komplikovaná. I když jde o onemocnění vzácné, může se s ním setkat každý lékař. Článek se věnuje popisu základní charakteristiky onemocnění, patogenetickým a rizikovým faktorům (zejména poruše fosfokaciového metabolizmu, hyperparatyreóze a spojitosti s léčbou warfarinem) a léčebným možnostem (z nichž v současné době je nejvýznamnější tiosulfát sodný). Problematika je dokreslena třemi konkrétními kazuistikami.
Klíčová slova:
hyperparathyreóza – chirurgická paratyreoidektomie – kalcifikující uremická arteriolopatie – kalcifylaxe – kožní nekróza – matrix GLA proteinmortality – sepse – tiosulfát sodný – warfarin
Úvod
Kalcifylaxe nebo také kalcifikující uremická arteriolopatie (CUA – Calcifying Uremic Arteriolopathy) je poměrně vzácná avšak mimořádně závažná komplikace projevující se hlubokými nekrózami a gangrénami kůže a podkoží, s rizikem infekce, sepse a úmrtí. Patogeneza CUA je komplexní, složitá a zřejmě heterogenní a dosud není plně objasněna. V popředí jsou změny minerálového a kostního metabolizmu spolu s dalšími komplexními patogenetickými vlivy [1].
Nejčastěji se s CUA setkávají nefrologové, neboť naprostou většinu postižených představují pacienti se selháním ledvin [1,2]. Kalcifylaxe se však může manifestovat i u pacientů bez selhání ledvin, dokonce i u osob se zcela zdravými ledvinami [3]. Je např. popisována u primární hyperparatyreózy, u autoimunitních systémových nemocí, při prokoagulačních stavech a u dalších stavů [3–6].
Pro klinického osteologa je významná její komplikovaná asociace s vitaminem D, s hyperkalcemií a s odchylkami kostní remodelace (BFR – Bone Formation Rate/kostní „obrat“) a v této souvislosti pochopitelně s abnormalitami aktivity příštítných tělísek, resp. odchylkami kostí (mimo jiné také při velmi sníženém, či naopak velmi vystupňovaném kostním obratu). Za rizikovou z hlediska CUA se považuje i kortikoterapie a přinejmenším hypoteticky i bisfosfonáty, resp. jimi navozená tzv. adynamická kost (viz níže, abnormality kostního obratu) [7–14].
Jak bylo vysvětleno v přehledných a dalších publikacích, v patogenezi je prakticky vždy důležitá porucha metabolizmu kalcia, fosforu, vitaminu D a důležitá je také abnormální aktivita příštítných tělísek [1,2,7,8,11,14–17]. Literární i naše zkušenosti ukazují, že kalcifylaxe může být spojena s těžkou hyperparatyreózou, ať již primární, či sekundární. Literatura zvažuje v těchto případech jako postup volby chirurgickou paratyreoidektomii [15]. Naše letité zkušenosti ukazují, že paratyreoidektomie je v těchto případech nejen nezbytná, ale i neodkladná [17]. Problematika je detailněji rozebrána v dalším textu.
V diagnostice a terapii se neobejdeme bez multioborové spolupráce (klinická biochemie, mikrobiologie, histopatologie, radiologie, sonografie, nukleární medicína; z klinických disciplín kromě nefrologie i endokrinologie, vnitřní lékařství, kožní lékařství, otorinolaryngologie, chirurgie, hematologie, revmatologie, dále i ambulance bolesti a intenzivní medicína, samozřejmě i následná ošetřovatelská péče) [1,2,17–19].
Hospitalizace je podmínkou pro šanci na uzdravení, akutní fáze manifestního postižení není možné léčit ambulantně. V našich podmínkách jde obvykle o lůžka nefrologická, ale i jiná – všeobecná interna, metabolická lůžka včetně JIP, lůžka dalších interních oborů, případně i lůžka kožních pracovišť; pooperační lůžka včetně JIP při chirurgickém řešení a v neposlední řadě i lůžka následné péče pro úplné doléčení. Různorodost lůžkových oddělení vidíme v praxi u konziliárně řešených případů. Náš názor je, že samotná vlastní „odbornost“ lůžkové stanice není důležitá, mnohem důležitější je znalost problematiky a nejen odborná, ale i velmi pečlivá péče personálu.
Problematika kalcifylaxe by měla být v nefrologické obci celkem dobře známá, neboť naprostá většina klinických případů i publikací se týká dialyzovaných pacientů. Přesto, ale i možná právě proto, je její léčba v naší republice soustředěna do několika „referenčních“ pracovišť.
Během 7 desítek let historie pravidelné dialyzační léčby lze vysledovat určitá období s poměrně vysokým výskytem (až 5 % dialyzovaných pacientů). Jde o období spojená buď s liberální preskripcí kalcia (např. po náhradě aluminium-hydroxidu za kalcium-karbonát jako vazače fosfátů v zažívacím traktu, což proběhlo na přelomu 80. a 90. let) či s rutinní aplikací tzv. „vysokokalciových“ roztoků (1,75 mmol/l difuzibilního kalcia, tj. silně pozitivní bilance), či s prudkým nárůstem léčby některým z aktivních vitaminů D (dříve parenterální kalcitrol, poté po zavedení parenterálního parikalcitolu ve vyšších dávkách).
Přitom vždy šlo nikoliv o „špatný lék“ či „špatný postup“, ale o nesprávné indikace či dávkovací schémata u nových nevyzkoušených postupů (například kalcium-karbonát nikdy nebyl klinicky zkoušen).
U nás byl nejvyšší výskyt CUA zřejmě v 90. letech. Poté sice výskyt poklesl, ale přesto tato komplikace zůstává nadále hrozbou. Kalcifylaxe je asociována s vysokou morbiditou (zejména kruté bolesti, imobilizace, hluboké nehojící se kožní a podkožní defekty, celkové chátrání až sepse) i mortalitou (50%, ale až 80%, příčinou je sepse) [1,2,15,19–21].
Základní podmínkou úspěšného zvládnutí kalcifylaxe je její rychlé rozpoznání, znalost patogenetických souvislostí a rizikových faktorů a neodkladné zahájení cílené léčby. Již zde zmiňujeme, že naprosto nezbytná je znalost asociace mezi CUA a poruchou funkce příštítných tělísek, resp. o spojení CUA nejen s hyperfunkcí, ale i s hypofunkcí – zejména při pozitivní bilanci vápníku anebo fosforu) [2,15,19].
Zásadní patogenetickou roli má i rovnováha mezi prokalcifikačními faktory a ochrannými protikalcifikačními faktory (hladina a aktivita proteinů C a S, lokální i systémové ochranné faktory – viz dále]. Do této rovnováhy významně, a v případě kalcifylaxe zcela negativně, zasahuje warfarin [1,2,9,15,22–28].
Cílem textu je podat základní přehled o kalcifylaxi jako multioborové sice vzácné, ale velmi závažné nemoci, s ilustrativním doplněním o tři vybrané komentované kazuistiky řešené ve spolupráci více lékařských oborů ve Fakultní nemocnici Hradec Králové.
Kalcifylaxe – základní přehled problematiky
I když je kalcifylaxe vzácná, vždy je život ohrožující [1,2,16,19,29]. Morfologickou podstatou je nekróza a gangréna kůže a podkožní (tukové) tkáně. Kožní a podkožní nekrózy vznikají na podkladě kompletního uzávěru mikrocirkulace v dané oblasti [1,2,15,29]. To znamená, že kalcifylaxe vzniká pouze v terénu těžkých cévních změn.
Od ischemické choroby dolních končetin (ICHDK) se kalcifylaxe liší zejména lokalizací a také charakterem nekróz. Obvykle jde o hluboké a rozsáhlé kožní a podkožní nekrotické oblasti břišní stěny, hýždí, stehen, lýtek, resp. oblastí, v nichž je přítomna podkožní tuková vrstva) [1,2,29]. Kazuisticky jsou popsány i lokalizace ve vnitřních orgánech a vzácně také na periferii končetin [30,31].
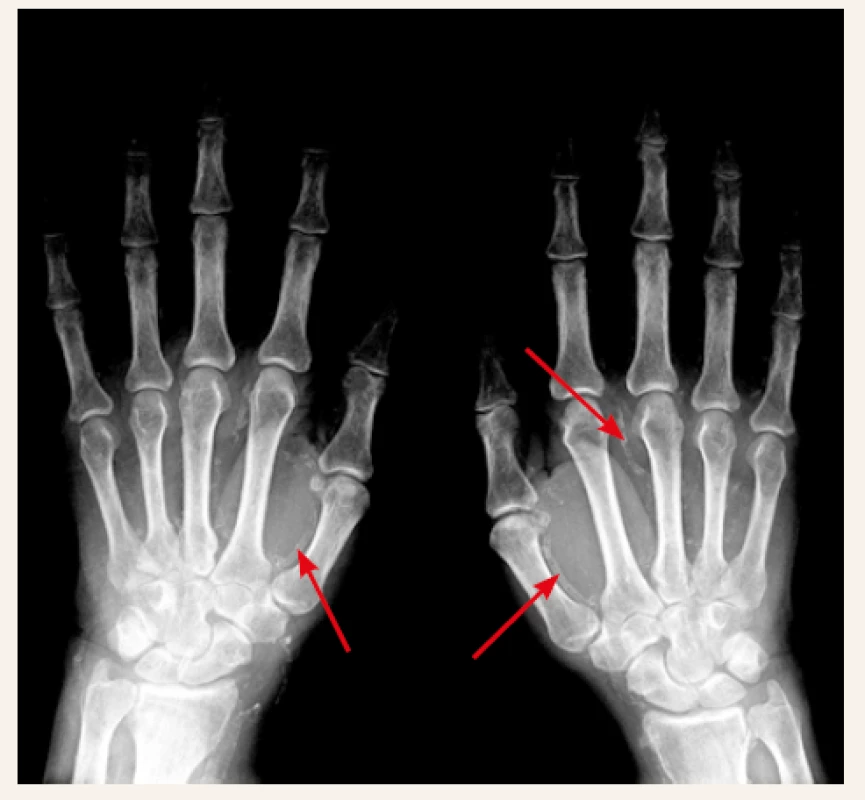
V přívodných tepnách do postižené oblasti pravidelně zjišťujeme mediokalcinózu. Je patrná na prostém nativním RTG-snímku, a to nejen ve velkých cévách, ale až do periferie postižené oblasti (obr. 1). V postižené oblasti kůže a podkoží dochází k proliferaci endotelu, která spolu s lokální trombózou v mikrocirkulaci zužuje (až uzavírá) lumen mikrocirkulace. Ischemii zhoršuje i lokální trombózou v mikrocirkulaci (mikrotromby v oblasti arteriol i venul) a v cévní periferii nacházíme kompletní uzávěr mikrocirkulace. Kalcifikace větších i úplně drobných cév obsahují prakticky „čistý“ apatit (kalcium-fosfát), s cirkulární lokalizací v intimně, ale zejména intersticiálně (na rozdíl od arteriosklerózy, při níž intersticiální kalcio-fosfátová depozita chybějí) [32].
Kalcifylaxi rozpozná ten, kdo ji viděl (obr. 2). Diagnóza je klinická. Iniciálně se objevují bolestivé mapovité barevné nafialovělé změny kůže připomínající vzhledem livedo reticularis [1,24]. Během krátké doby (během hodin či několik málo dnů, vzácně však i za mnohem déle) vznikne nekrotický, resp. gangrenózní černý mapovitý defekt kůže a podkoží, s červeným až fialově lividním okrajem. Léze je i spontánně extrémně bolestivá a kalcifylaxe obvykle pacienta imobilizuje. Různě velké a často vícečetné plošné léze se mapovitě rozšiřují. Rány se záhy mohou i infikovat, s rozvojem sepse s velmi těžkým průběhem. Antibiotika je zde nutno aplikovat cíleně (podle kultivací) a vždy parenterálně, přesto jistota průniku antibiotik do postižené tkáně chybí.
Kazuistika 2. Obr. z archivu autorky
Obecně, každá klinicky stanovená diagnóza může být zpochybněna, neboť nezpochybnitelná je jen diagnóza získaná zobrazovacími metodami, v tomto případě tedy biopsií. Sami (a nejen sami) jsme v tomto případě konzervativními zastánci postupu, že méně je více. Ani biopsie tkáně nemusí být výtěžná, tj. nemusí klinicky jasnou diagnózu potvrdit [33,34]. Navíc, bioptovaná oblast se nemusí zhojit. Naopak, samotná biopsie může být provokativním momentem (tzv. trigger) pro další šíření nekrózy [15]. Proto se biopsie doporučuje pouze u vybraných a klinicky nejasných případů. Zcela kontraindikovaná je biopsie v infikovaném terénu a v orgánových lokalizacích.
Opakovaně se uvádí, že příčina kalcifylaxe není zcela jasná. Vždy však platí, že (i) jde o komplexní působení více faktorů a (ii) je přítomna porucha metabolizmu vápníku a fosforu (může být důsledkem poruchy funkce příštítných tělísek anebo poruchy metabolizmu vitaminu D; v některých případech jde o spojitost s pozitivní vápníkovou či fosfátovou bilancí, či dokonce s léčbou kortikoidy) [1,2,19].
Koncentrace vápníku i fosforu v krvi nejsou rozhodující: až 80 % pacientů má normo - či hypokalcemii (tj. nikoliv hyperkalcemii), až 40 % má normo - či hypofosfatemii (tj. nikoliv hyperfosfatemii). Nefrologům je tato laboratorní situace známa z nálezů při sekundární hyperparatyreóze (SHPT), u níž ani při těžké formě nemusí být koncentrace vápníku a fosforu v krvi změněny (a přesto je metabolizmus vápníku i fosforu narušen) [17].
Samotné sérové koncentrace vápníku ani fosforu sice nejsou rozhodující, ale zcela zásadní je skutečný kostní obrat. Ten je výrazně ovlivněn aktivitou příštítných tělísek. Predispozicí ke kalcifylaxi je velmi vysoký i velmi nízký kostním obrat (tj. hyperparatyreóza, ale i hypoparatyreóza). Pokud je kostní obrat vysoce vystupňovaný (fibrózní osteodystrofie při těžké hyperparatyreóze), je fosfor i vápník z kosti rychle a trvale uvolňován (osteoresorpce) a společně se ukládají mimo kost (do cév). Stejný výsledek je i při tzv. adynamické kosti, asociované mimo jiné s hypoparatyreózou. Kostní obrat i schopnost kosti deponovat vápník a fosfor jsou abnormálně nízké a jakékoliv pozitivní bilance vápníku a fosforu vedou k cévním kalcifikacím. Ve velké většině případů vzniká mediokalcinóza. Avšak v terénu mediokalcinózy stačí i jen nevelké „trigger“ faktory a výsledkem je kalcifylaxe. Rozlišení (resp. „kvalifikovaný odhad“) rychlosti kostního obratu vyžaduje kromě znalosti interpretace hladin osteomarkerů i velkou klinickou zkušenost (kostní biopsii neindikujeme). Orientačně využíváme zejména koncentrace PTH.
Koncentraci PTH, a tedy i kostní obrat, ovlivňuje vitamin D. Vztah mezi deficitem vitaminu D a (sekundární) hyperparatyreózou je dobře znám Samotná hypovitaminóza D je (možná překvapivě) stejně tak riziková pro kalcifikace, jako jsou vysoké hladiny vitaminu D („duální“ vztah vitaminu D ke kalcifikacím) [7,8,10,11]. Vyšší riziko kalcifikací při hypovitaminóze D je dáno dvojím mechanizmem: zvýšením aktivity příštítných tělísek (tj. nepřímo), ale také chyběním regulace transkripční aktivity genů spojených s ochrannými mechanizmy cévní stěny proti kalcifikacím. Mechanizmus, kterým jsou s kalcifikacemi a potažmo s kalcifylaxí spojené vysoké hladiny vitaminu D, je zcela jiný a celkem jednoduchý: nastává nefyziologicky pozitivní bilance vápníku i fosforu v organizmu, a to vlivem účinku vitaminu D v organizmu.
Jak jsme již zmínili, při každé CUA je potřeba vyloučit nerovnováhu mezi tzv. prokalcifikačními faktory a mezi inhibitory (mimokostních) kalcifikací. Fyziologicky jsou obě linie v rovnováze. Rizikem pro CUA jsou obecně prokoagulační stavy (antifosfolipidový syndrom) a všechny situace, v nichž chybí ochranné protikalcifikační faktory (deficit proteinu C, deficit proteinu S; a také hypovitaminóza K, tj. většinou iatrogenní důsledek léčby warfarinem, viz dále).
Nejvýznamnějším cirkulujícím inhibitorem kalcifikací je fetuin A. Jeho koncentrace se snižují při zánětu a malnutrici, u dialyzovaných pacientů jsou nízké, a velmi nízké koncentrace jsou při kalcifylaxi [21,35]. Nejvýznamnějším lokálním (tj. cévní stěně přítomným) inhibičním faktorem mimokostních kalcifikací je matrix GLA-protein. Přítomnost, resp. funkční vlastnosti tohoto proteinu jsou závislé na vitaminu K. Při léčbě warfarinem je tohoto proteinu nedostatek, resp. je v ochraně cévní stěny neúčinný [27].
Ke kalcifylaxi jsou více disponováni diabetici a obézní osoby, zejména s nízkou sérovou koncentrací albuminu (většinou s chronicky zánětlivým stavem), osoby léčené warfarinem, navíc v kombinaci s aktivním vitaminem D v nevhodných dávkách [1,3,6,19,21,22]. V těchto případech může být funkce ledvin i fyziologická. Spouštěcím momentem mohou být i sebemenší poranění disponované oblasti, včetně např. i pouhých subkutánních aplikací.
Evidence-based (založená na důkazech) léčba u kalcifylaxe stále neexistuje. Jak uvádí literatura, „některé léčebné přístupy mohou být efektivní“ [15]. Samozřejmostí je nejprve a co nejdřív odhalit a odstranit všechny možné rizikové okolnosti a nedopustit jejich pokračování (částečně viz již výše). Obecnou podstatou je (i) diagnostika a korekce metabolizmu vápníku a fosforu (pozor, není totožné s termínem „fyziologická koncentrace“), (ii) rychlé (a podle našich zkušeností radikální) řešení akcentované hyperparatyreózy, pokud je přítomna, (iii) okamžité „stop“ pro všechny léky spojené s rizikem CUA (warfarin, vitamin D, kalciové přípravky; pokud možno i kortikoidy), (iv) kontrola a optimalizace dialyzační léčby.
Antibiotická léčba při infekci se řídí dle výsledků kultivace. Na analgeticích (včetně opioidů i opiátů) nelze šetřit, bolesti jsou kruté.
V současné době je již dostatek publikací na téma úspěšné léčby kalcifylaxe tiosulfátem sodným (sodium thiosulfate – STS) [20,36–38]. Sami s touto léčbou máme již velké a příznivé zkušenosti [17]. Přípravek se obvykle podává intravenózně, i když existují izolované zprávy o aplikaci lokální [39]. U hemodialyzovaných pacientů je schéma podání 3krát týdně (resp. podle frekvence dialýz), obvykle 15–25 gramů v jedné dávce podané v poslední hodině dialýzy. Tolerance infuze STS je dobrá, vzácně může krátkodobě klesnout tlak nebo se objeví přechodná nevolnost. Při dlouhodobé léčbě STS je zcela nutno kontrolovat acidobazickou rovnováhu. Může dojít k těžké, až fatální metabolické acidóze [40].
Tiosulfát je účinný i v léčbě kalcifylaxe u non-renálních pacientů, dávkovací schéma je zde jiné, obvykle dle volby pracoviště, podání je nitrožilní [3,20]. Tiosulfát sodný se podává dlouhodobě, až několik měsíců, i déle (do zhojení lézí). Opakovaně se uvádí, že má i analgetický účinek, a to již po 2 týdnech podání. V žádném případě však nemůže nahradit nutnou souběžnou analgetickou léčbu.
Přípravek u nás není dostupný. Zprvu jsme postupovali cestou mimořádného dovozu ze zahraničí. Nyní ho lékárna FNHK je schopna se zárukou kvality vyrobit magistraliter, což nám i dalším pracovištím v ČR významně ulehčilo postup a logistiku léčby [17].
Součástí léčby je pečlivá kontrola všech případných patogenetických i precipitujících okolností. Nezbytná je pečlivá lokální léčba a ošetřovatelská péče. Je třeba hned od začátku počítat s tím, že celková i lokální léčba může trvat řadu měsíců, půl roku, i déle [1,2,3,15,18,20].
Z výše uvedeného je zřejmé, že mezi riziky pro vznik kalcifylaxe najdeme mnoho heterogenních faktorů [1,3,15,41]. To ukazuje, že skutečný hlavní patogenetický „viník“ stále nebyl usvědčen. Pátrání po dalších souvislostech však nekončí. Na poli kalcifylaxe je snad jen jedna „vlaštovka“ z oblasti molekulární genetiky [42]. Existují také domněnky o možném spojení s určitými predispozičními vlastnostmi tukové podkožní tkáně [43].
Evidence-based doporučené postupy pro léčbu CUA neexistují. Existují však akceptovaná pravidla na úrovni „expert-opinion“ doporučení. K těm patří interdisciplinární přístup, rozpoznání a odstranění (všech) dosud známých rizikových stavů (je-li možno) a také upřednostnění léčby na pracovištích ovládajících danou problematiku [1,15].
Diferenciální diagnostika kalcifylaxe je sice široká, ale v praxi při znalosti klinického obrazu je jednodušší, než by se mohlo zdát. Do výčtu situací, které je třeba odlišit, patří zejména ischemie na podkladě aterosklerózy (zde pomůže lokalizace, neboť kalcifylaxe jako taková se jen vzácně vyskytuje na periferii), „vředová“ kožní léze při venostáze při žilní hypertenzi, infikovaná či jinak poškozená prostá celulitida, podkožní cholesterolová depozita i cholesterolové emboly, pyoderma gangrenosum, nekrotická vaskulitida na autoimunitním podkladě a tzv. Martorellovy ulcerace [1,3]. Je patrné, že jde vesměs o situace buď mimořádně vzácné, nebo celkem rozlišitelné, pokud vezmeme v úvahu celkový obraz.
Kalcifylaxe ve FN Hradec Králové: vybraná kazuistická sdělení
Uvádíme 3 vybrané případy pacientů s kalcifylaxí, která byla diagnostikována a léčena ve FN Hradec Králové. Jde jen o malou část z celkového počtu u nás hospitalizovaných pacientů s touto diagnózou. Uvedené 3 případy ukazují, jak dramatický průběh může kalcifylaxe mít, včetně toho nejzávažnějšího vyústění, úmrtí. Dále dokumentují, jak důležité je postupovat cíleně a rychle, neboli jak důležité jsou nejen znalosti a zkušenosti, ale časový horizont pro celý multioborový tým. Prezentujeme i případ kalcifylaxe u pacientky zcela bez onemocnění ledvin. V neposlední řadě poukazujeme ve vzájemném srovnání 3 prezentovaných kazuistik i na důležité shody, ale i odlišnosti mezi jednotlivými pacienty, ať již v příčinách vzniku, v terapeutickém postupu, a také ve výsledku léčby.
Kazuistika 1
Pacientka (narozena v roce 1963) byla léčena pro chronické selhání ledvin na podkladě „multicystické přestavby ledvin“ peritoneální dialýzou od roku 2002. V roce 2004 byla úspěšně transplantována, štěp byl však funkční jen dva roky. Od roku 2006 byla opět léčena v pravidelném hemodialyzačním programu. V roce 2009 byla transplantována podruhé. Druhý štěp byl výborně funkční téměř 6 let. Po tuto dobu byla pacientka sledována v transplantační ambulanci, užívala standardní imunosupresivní léčbu (prednison + mykofenolát + takrolimus), neprodělala žádnou epizodu rejekce.
Na podzim roku 2013 byla přijata k hospitalizaci ve spádové nemocnici pro sepsi. Prvotní příčinou byla komunitní pneumonie u imunosuprimované pacientky. Antibiotická cílená léčba vedla ke zlepšení stavu. Nutné přerušení imunosupresivní léčby při manifestní infekci plic však vyústilo až v selhání funkce štěpu, s opětnou nutností hemodialyzační léčby. V té době byla přeložena do FN Hradec Králové. Nefunkční štěp zůstával in situ, tj. v levé kyčelní jámě.
Při přijetí do FN HK dominují kruté bolesti obou dolních končetin, pacientka je pro bolest prakticky imobilní, ležící na lůžku, hybnost pouze s dopomocí. Vizuálně patrné rozsáhlé „skvrny“ charakteru „livedo reticularis“ na hýždích, stehnech i bércích obou dolních končetin. V laboratoři při přijetí mimo jiné byla zjištěna extrémní elevace myoglobinu v séru (> 3 000 μg/l, horní referenční rozmezí 58 μg/l), proto byla před vznikem nekróz zvažována především svalová léze, rabdomyolýza [44].
Během 1–2 dnů po přijetí se v původních oblastech lividních změn (zejména obě hýždě a obě stehna) vytvořily rozsáhlé a hluboké černé nekrózy kůže a podkoží a rychle se mapovitě šířily. Ihned byl vysazen warfarin [23,24,41]. Dialyzační léčba probíhala prakticky denně, s užitím vysokopropustných dialyzačních membrán k odstranění myoglobinu.
Současně byl podrobně zkontrolován metabolizmus vápníku a fosforu, včetně koncentrace PTH (stanoveno tzv. metodou 3. generace). Vyšetření prokázalo hyperparatyreózu (maximální koncentrace 1–84PTH 20 pmol/l, vstupně 15 pmol/l), byť bez hyperkalcemie (pro deficit vitaminu D, koncentrace 25D byla 18,7 nmol/l, kalcemie 2,41 mmol/l). Asociace mezi kalcifylaxí a hyperparatyreózou byla v literatuře opakovaně doložena a byla nám známa [45,46]. Stejně tak je ovšem nutné počítat s rizikem kalcifylaxe v opačném případě, tj. po totální paratyreoidektomii – vysvětlení je uvedeno výše (asociace mezi kostním obratem a cévními kalcifikacemi, zejména při poruše funkce ledvin) [47].
Neodkladné ultrasonografické (USG) vyšetření verifikovalo jedno velké příštítné tělísko (PT) o průměru více než 20 mm a objemu 2 ml. Neprodleně jsme indikovali paratyreoidektomii (PTX).
USG nález jednoho zobrazeného tělíska odpovídal stavu po subtotální paratyreoidektomii před mnoha lety, kdy bylo jako „nesuspektní“ ponecháno in situ. Nicméně, nyní již bylo tělísko jasně indikováno k chirurgickému odstranění.
Operace však nebyla úspěšná, příštítné tělísko nebylo perioperačněnalezeno. Paratyreoidektomie však byla nutná. USG-vyšetření bylo opakováno, a to i s aspirační biopsií tenkou jehlou. V punktátu byla detekována vysoká koncentrace 1–84PTH (> 300 pmol/l). Scintigrafie zaměřená na detekci tělíska byla negativní, resp. nepřínosná. Doplňující magnetická rezonance krční oblasti ukázala vlevo nahoře za štítnou žlázou okrouhlý útvar, v diferenciální diagnóze zahuštěná cysta, ev. cysticky degenerované příštítné tělísko.
Po průkazu PTH v punktátu následovala již rychle další chirurgická revize, při které bylo tělísko již nalezeno a kompletně odstraněno. Pooperační koncentrace 1–84PTH v krvi byla 1 pmol/l. Histologicky byl kromě cysticky změněného hyperplastického příštítného tělíska diagnostikován i papilární mikrokarcinom štítné žlázy.
V průběhu hospitalizace byla pacientka nadále pravidelně hemodialyzována, léčena mimo jiné tiosulfátem sodným (3krát týdně 15 gramů v infuzi do návratové části dialyzačního krevního okruhu, během posledních 30 minut dialýzy), antibiotiky a morfiem. Defekty byly denně pečlivě lokálně ošetřovány. Vlastní podávání tiosulfátu bylo zcela bez komplikací.
Byť při reoperaci bylo příštítné tělísko (konečně) odstraněno, kožní a podkožní nekrózy se v mezidobí již natolik rozšířily, že vlastní radikální operace (paratyreoidektomie) ani komplexní pooperační konzervativní léčba již nestačily. Bohužel, operace přišla příliš pozdě.
Jaké byly příčiny neúspěchu léčby kalcifylaxe u této pacientky? Prodlení mezi diagnózou CUA a vlastní kauzální léčbou, resp. diagnózou hyperparatyreózy a konečným odstraněním tělíska trvalo více týdnů. Představa o terapeutickém postupu nebyla zprvu jednotná. I proto byla provedena biopsie z postiženého kožního ložiska, která diagnózu CUA potvrdila (kalcifikace v mikrocirkulaci, tromby, intimální hyperplazie a nekrózy tkáně) [32].
Zprvu byl kladen důraz na rabdomyolýzu jako na příčinu nekróz. Koncentrace 1–84PTH 15 pmol/l nebyla iniciálně považována za významnou, s odůvodněním, že operační nález před lety deklaroval, že ponechané příštítné tělísko (PT) je v pořádku; další sledování v tomto směru bylo sporadické. Nemůžeme vyloučit, avšak ani prokázat, že určitou precipitující roli mohl sehrát i detekovaný papilocelulární mikrokarcinom štítné žlázy; v literatuře jsme asociaci nezjistili, avšak jedná se již o třetí podobný případ v naší praxi.
Zpětné hodnocení průběhu diagnózy i léčby nám velmi pomohlo pro řešení dalších případů. Víme nyní jednoznačně, že o prognóze pacienta s kalcifylaxí rozhoduje nejen odborná znalost a klinické zkušenosti, ale také posloupnost terapeutických kroků, včetně jejich neprodlené realizace!
I když po PTX pokračovala léčba v plném rozsahu, včetně podávání parenterálních antibiotik, tiosulfátu, intenzivní dialýzy, lokální péče, a též péče symptomatické (analgezie), zlepšení nenastalo. Defekty se nejen nehojily, ale dále se rozšiřovaly a infikovaly se. S vědomím nezvratnosti stavu jsme o závažném stavu informovali rodinu pacientky. V dialyzačním léčení jsme nepokračovali a pacientka zemřela ve věku 51 let na nezvládnutelnou sepsi při vícečetných rozsáhlých hlubokých a infikovaných defektech v rámci kalcifylaxe a se selhání́m funkčního štěpu v důsledku rejekce při vysazení imunosuprese pro sepsi.
Kazuistika 2
Muž ve věku 62 let podstoupil biopsii nativní ledviny v roce 2013; v histologickém nálezu byl již obraz „end-stage kidney“ (atrofie a jizvení tkáně), při němž rozpoznání původního onemocnění ledvin již není možné.
V té době (8/2013) byly jeho (vybrané) laboratorní nálezy tyto: 8/2013: S-Ca 2,06 mmol/l, S-ALP 2,31 μkat/l, eGFR (rovnice MDRD) 0,25 ml/s. Koncentrace PTH v séru testem druhé generace (iPTH) byla 52 pmol/l. Hyperparatyreóza byla vyhodnocena jako sekundární (SHPT) v souvislosti s chronickým onemocněním ledvin, dosud neléčeným. Ambulantně byl do léčby vřazen parikalcitol 1 μg/den per os A Calcium effervescens 1 000 mg/den (tuto terapii zpětně hodnotíme jako dubiózní). Na další plánovanou nefrologickou kontrolu se pacient nedostavil.
V červnu 2014 byl akutně přivezen na oddělení urgentní medicíny (OUM) pro dušnost a příznaky uremie. Dříve založená fistule pro dialýzu byla nefunkční. Proto byl pod USG-kontrolou zaveden centrální žilní dialyzační katétr do levé jugulární žíly a ještě v den přijetí byla provedena první hemodialýza, se zahájením pravidelného hemodialyzačního léčení.
Ve fyzikálním nálezu při přijetí byl popsán nevelký kožní defekt v oblasti stehna. Postupně a celkem rychle se objevila nekrotická ložiska s lividními lemy na obou stehnech i na obou bércích, zde až s cirkulárním rozsahem. Klinická diagnóza kalcifylaxe byla všemi akceptována. Neprodleně se zkontrolovaly všechny známé rizikové okolnosti. Bylo zjištěno, že pacient až donedávna užíval warfarin (míval dříve trombózy žil DK). Naměřená hodnota PTH byla 32 pmol/l, tj. zdánlivé zlepšení, avšak klinikům bylo známo, že v prosinci 2013 laboratoř změnila metodiku stanovení a přešla od testu 2. generace na test 3. generace (výsledky změřené testy 3. generace jsou vždy nižší).
Na laboratorní průkaz hyperparatyreózy navázaly ihned zobrazovací metody pro detekci příštítných tělísek před naplánováním chirurgické PTX. USG-vyšetření PT bylo provedeno celkem 4krát (!), vždy se stejným závěrem: PT nezjištěna. Ani scintigrafie a ani nukleární magnetická rezonance příslušné oblasti krku nedokázaly PT lokalizovat.
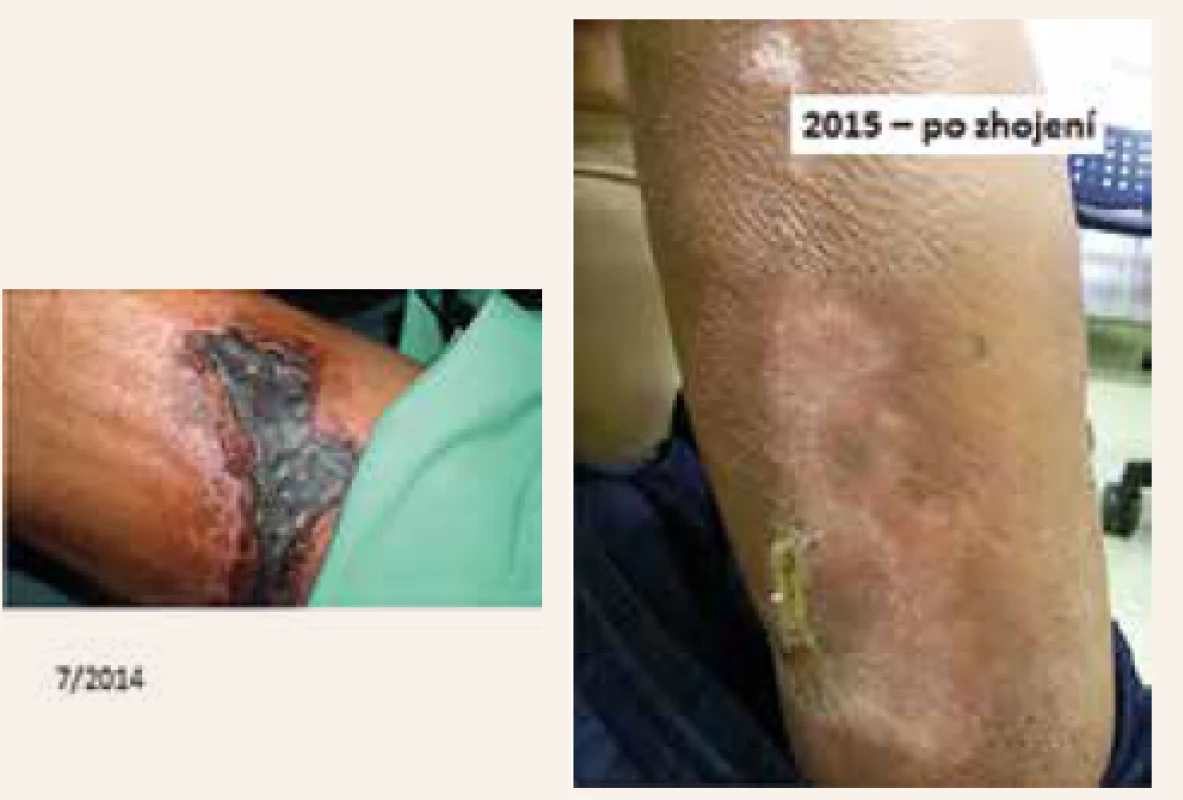
Pacient byl od samého počátku léčen tiosulfátem sodným v dávce 25 g 3krát týdně během poslední hodiny dialýzy. Intenzivní hemodialýzy spolu s nekalciovými vazači fosforu (sevelamer) upravily koncentraci fosforu v krvi. Hned od počátku byla velká pozornost věnována pečlivé lokální péči. Pro kruté bolesti s nemožností samostatného pohybu byl pacient upoután na lůžko, aplikovali jsme plné dávky opiátů. Přesto se stav progresivně zhoršoval, nekrotická ložiska se zvětšovala, přibývaly nové postižené okrsky a pacient chátral.
Vzhledem k tíži situace, ale i pod tlakem nedávné zkušenosti (viz kazuistika 1) a s vědomím, že tzv. explorativní krční operace (explorative neck surgery) zde byla kontraindikovaná pro mezitím vzniklé další interní závažné komplikace (mimo jiné přítomné závažné chlopenní vady s kalcifikacemi; trombóza centrálních žil, bronchopneumonie) jsme se poměrně rychle rozhodli pro radikální, přitom zcela netypický postup. Po souhlasu nefrologa, endokrinologa, anesteziologa i operatéra (lékař ORL) byla neprodleně provedena totální tyreoidektomie s totální PTX.
Odstranění prvního příštítného tělíska bylo histologicky potvrzeno již perioperačně. Další 3 tělíska (všechna nodulárně hyperplastická) byla histologicky prokázána v materiálu odstraněné tkáně. Pooperačně kontrolovaná koncentrace PTH v krvi ukázala téměř nulové hodnoty. Očekávanou hypotyreózu jsme celkem jednoduše vyřešili suplementační léčbou (Euthyrox v dávkách podle vývoje TSH). Pooperační hypokalcemii (koncentrace Ca v krvi mezi 1,5–1,8 mmol/l), rovněž očekávanou (a naštěstí asymptomatickou) jsme však pouze monitorovali. Pacient nedostal žádnou parenterální ani perorální suplementaci kalcia, a to nejméně po dobu tří měsíců, spíše déle. Domníváme se, že jsme tím mohli přispět k mobilizaci kalcia z kalcifylaxí změněné tkáně a následně, spolu s komplexem dalších opatření, k úplnému zhojení.
Pacient byl dimitován po 8měsíční hospitalizaci v klinicky výborném stavu, s plně zhojenými defekty (byť s rozsáhlými kožními jizvami), volně mobilní, bez bolesti, bez analgetické léčby. Nyní, již téměř 6 let poté, je nadále dialyzován, ve výborné kondici, plně soběstačný. Uvedená kazuistika i s podrobným rozborem byla publikována [17].
Od počátku jsme si byli vědomi, že jsme iatrogenně způsobili hypoparatyreózu a že musíme počítat s „adynamickou“ kostní nemocí. Proto jsme důsledně dbali, aby nenastala pozitivní bilance kalcia a fosforu. Po letech můžeme uvést, že tato iatrogenně podmíněná a očekávaná hypoparatyreóza byla a nadále je dlouhodobě asymptomatická. Žádné projevy kalcifylaxe či jakékoliv kožní defekty se již neobjevily. Během 5 let pacient neprodělal žádnou zlomeninu kostí. V medikaci má malou dávku Vigantolu k udržení hladiny 25D mezi 50–75 μmol/l a malou dávku kombinovaného přípravku s obsahem kalcia a magnézia (jde o „vazač“ fosfátů v zažívacím traktu), s predialyzační koncentrací kalcia 2,0–2,1 mmol/l.
Tento z našeho pohledu nakonec úspěšně vyřešený případ potvrdil naše přesvědčení, že léčba musí být opravdu zahájena bezodkladně. S odstupem času navíc vidíme, že postchirurgická hypoparatyreóza u dialyzovaného pacienta může probíhat asymptomaticky a bezproblémově.
Vysvětlení, proč všechna 4 tělíska byla operačně nalezena a odstraněna, aniž by byla předtím detekovatelná v zobrazovacích metodách, může spočívat v jejich dodatečně zjištěných morfologických charakteristikách: všechna tělíska byla lokalizována intraparenchymově, tj. „uvnitř“ laloků štítné žlázy, a všechna byla poměrně malá – maximální rozměr do 10 mm.
Odvozeným “poučením” je, že (minimálně) u kalcifylaxe se při rozhodování o paratyreoidektomii nemůžeme řídit samotnou velikostí tělísek (pokud je najdeme). Jak ukazuje tato naše zkušenost, i relativně nevelká tělíska mohou být vysoce hyperfunkční a bez odpovědi na konzervativní léčbu.
Kazuistika 3
Na lůžkové oddělení revmatologie FN HK byla přijata v květnu 2018 žena ve věku 74 let, od ledna 2018 léčená kortikoidy pro revmatickou polymyalgii. Dále byla léčena inzulinem pro diabetes mellitus 2. typu. Pro chronickou fibrilaci síní užívá dlouhodobě warfarin. Její renální funkce jsou dlouhodobě, resp. trvale normální. Od května 2018 má na obou dolních končetinách bolestivá hmatná lividní podkožní „indurace“, posléze defekty s nekrózou kůže i podkoží, lokalizované dominantně v podkolenní oblasti, až s cirkulárním rozsahem. Zprvu jsme pomýšleli na pyoderma gangrenosum, i proto byla léčena pulzy solumedrolu. Ischemická choroba tepen ani žilní trombóza v dané oblasti nebyly potvrzeny jako vyvolávající příčiny, resp. byly vyloučeny. Nativní RTG snímek postižené oblasti končetin ukázal mediokalcinózu tepen až do periferie. Vlastní diagnóza kalcifylaxe byla potvrzena biopticky.
Laboratorní hodnoty byly následující: S-Ca i S-P v normě, S-krea 69 μmol/l, 1–84PTH 3,4 pmol/l (v normě), S-25D 29 pmol/l (velmi nízká hodnota).
Kortikoterapie byla postupně ukončena. Warfarin byl vysazen a antikoagulační léčba pokračovala nízkomolekulárním heparinem. Pacientce jsme aplikovali tiosulfát sodný ve schématu 5krát týdně 5 gramů pomalu intravenózně v maloobjemové infuzi (roztok byl připravován v nemocniční lékárně magistraliter). V lokální léčbě se zde osvědčil přípravek Solerex. Protože se podařilo zabránit infekci, hojení ložisek bylo jednodušší a kratší. Pacientka byla dimitována se zhojenými defekty po 18 týdnech pobytu v nemocnici.
Uvedená kazuistika dokumentuje opět komplexní multioborový přístup. Vyšetřovací postup byl rychlý a terapie byla vedena podle již osvědčeného schématu. V patogenezi nehrály roli ani hyperparatyreóza, ani selhání ledvin. Mohla se však uplatnit kombinace léčby inzulinem a warfarinem, zejména při kortikoterapii.
Kazuistika je ilustrací výskytu kalcifykaxe a její úspěšné léčby u pacientky bez postižení ledvin a bez poruchy fosfokalciového metabolizmu. Ukazuje také, že kalcifylaxi může rozpoznat i lékař jiné odbornosti (v tomto případě revmatolog) a může ji při vzájemných konzultacích terapeuticky zajistit. I tato pacientka měla velmi nízké hladiny vitaminu D, což opět dokumentuje, že nízké hodnoty vitaminu D v krvi nejsou z hlediska mediokalcinózy ani kalcifylaxe ochranné, spíše naopak. Warfarin byl pro další léčbu kontraindikován a byl nahrazen nízkomolekulárním heparinem. V literatuře se mezitím objevily zprávy o možné a bezpečné indikaci vybraných přípravků ze skupiny NOAC (resp. DOAC), konkrétně apixabanu [48].
Vzájemné srovnání popsaných kazuistik
Popsané kazuistiky mají řadu shod, ale i řadu odlišností. Považujeme za vhodné je zde uvést a okomentovat. Vzájemné srovnání 3 vybraných kazuistik ukazuje tab.
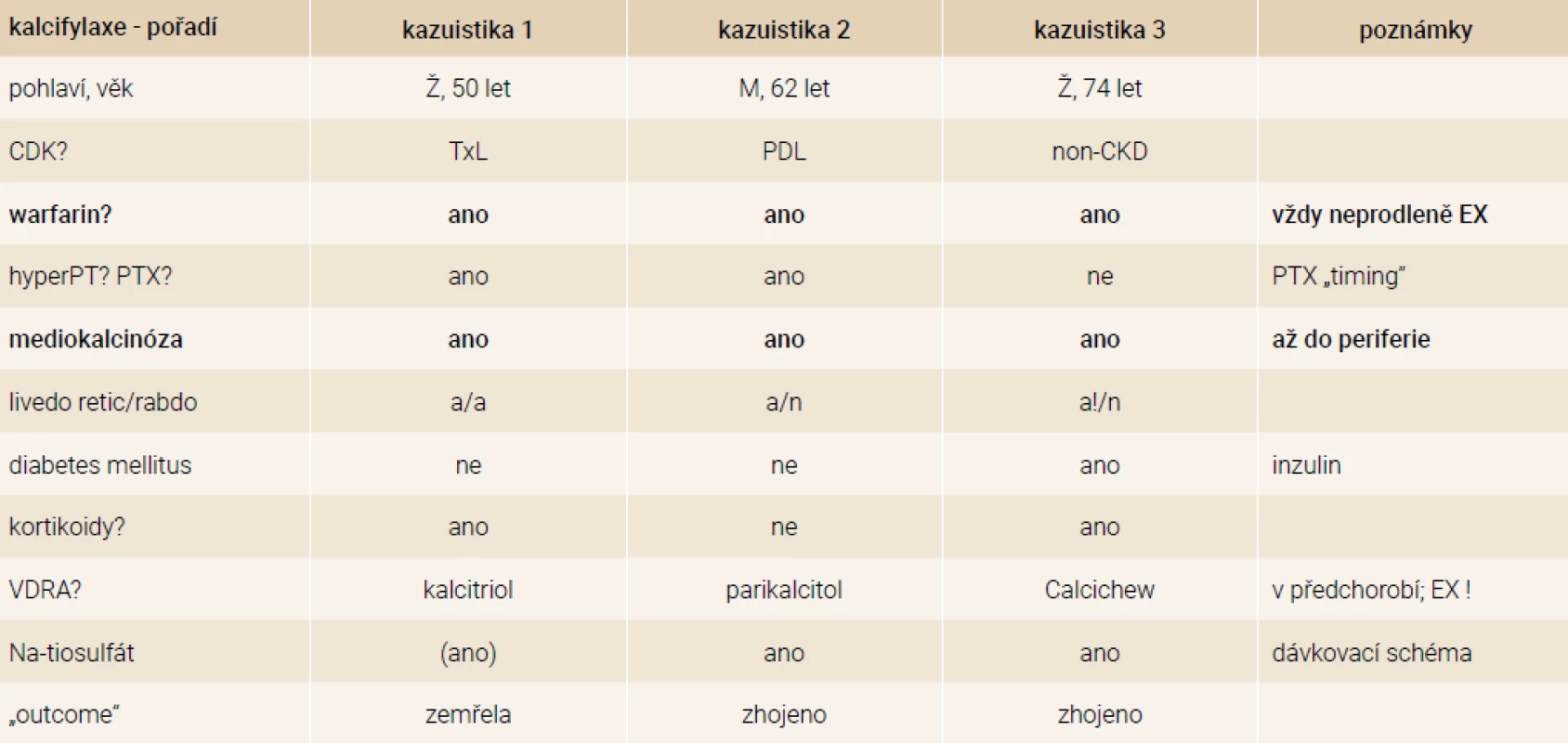
Naše 3 kazuistiky jsou vybrány z dalších několika desítek případů. V posledních 5 letech jsou však prakticky všechny naše zkušenosti pozitivní. První neúspěšnou kazuistiku jsme měli neustále v průběhu léčby našeho druhého pacienta na paměti a provází nás stále. Druzí dva léčení pacienti přežili, žijí nadále, jsou v dobrém klinickém stavu, soběstační, dobře mobilní, bez bolestí a bez léků na bolest.
Věk, ve kterém byla kalcifylaxe diagnostikována, odpovídá literárním údajům (maximum 40–70 let, s predilekcí u žen) [1]. Ve 2 případech (ze 3) se kalcifylaxe rozvinula při těžké SHPT. Ani v jednom případě však nešlo o manifestaci typickou. V prvním případě se jednalo o progredující hyperfunkci ponechaného tělíska u transplantované pacientky s předchozí subtotální paratyreoidektomií, což zprvu nebylo zcela správně vyhodnoceno. Situaci navíc ztížila nejasná operační lokalizace tělíska. K vlastní manifestaci kalcifylaxe (u jednoznačně rizikové pacientky) mohl přispět iniciální systémový zánět (prohloubení kalcifikačního procesu při každém zánětu), ale také pokles až zánik vlastní funkce ledvin (vlastní selhání ledvin je spojeno s vyšší pravděpodobností manifestace při souběhu rizikových faktorů), teoretická, resp. hypotetická spojitost s papilárním karcinomem štítné žlázy je zmíněna výše.
Všichni tři pacienti byli léčeni warfarinem. Z toho pouze jedna pacientka aktuálně, zbylí dva v předchorobí. To ukazuje na možnou perzistenci změn funkce či přítomnosti matrix GLA proteinu v cévní stěně i po vysazení léčby. Avšak u obou těchto pacientů byla průkazná asociace s hyperparatyreózou a role anamnesticky užívaného warfarinu v rozvoji CUA není jediná.
Domníváme se však, že literární i námi pozorovanou asociaci mezi warfarinem a CUA je nutné nyní více sdílet a diskutovat zejména s lékaři, kteří se zabývají problematikou koagulace a terapeutické antikoagulace. Nepřímo tím získává podporu i vyšší rozšíření (upřednostnění) NOAC před warfarinem [48]. Avšak zdaleka ne všichni nemocní léčení warfarinem se s kalcifylaxí utkají; stále zbývá mnoho otazníků.
Mediokalcinóza jako rizikový, resp. asociovaný faktor pro CUA je naprosto nepochybná. Proč, kdy a jakým způsobem (u nefrologických pacientů) vzniká, je předmětem rozsáhlé nefrologické literatury [47,49,50]. Sami pro praxi považujeme za důležité (byť dosud nikoliv rutinní) vyšetřování možné mediokalcinózy systémově, tj. v celé kohortě (dialyzovaných) pacientů. Pokud je mediokalcinóza zjištěna, je nutno pacienta považovat za vysoce kardiovaskulárně rizikového (samozřejmě i rizikového pro CUA). Tito pacienti by měli mít zavedena všechna dostupná preventivní a profylaktická opatření pro minimalizaci rizika kalcifylaxe (mj. podle našeho závěru i vynechání léčby warfarinem).
Literatura uvádí, že iniciální vizuální manifestací může být změna kožního zabarvení a podkožní indurace charakteru livedo reticularis [23,24]. Naše zkušenosti to potvrzují. Žádná takováto barevná změna, navíc spojená s bolestí, nesmí být podceněna! Literatura též uvádí, že iniciální formy se mohou svou manifestací velmi podobat rabdomyolýze (i toto můžeme potvrdit). Navíc, naše zkušenost ukázala, že s CUA se sdružuje i velmi vysoká hodnota myoglobinu, tedy laboratorního průkazu rabdomyolýzy. Rabdomyolýzu je vždy třeba neprodleně řešit, myoglobin odstranit high-flux dialyzační membránou. Současně doporučujeme aktivně pátrat po možné asociované kalcifylaxi.
Častější výskyt CUA u diabetiků je v literatuře sice uváděn, ale jistě zdaleka ne každý diabetik je ohrožen touto komplikací. Stejně tak je to i se vztahem k léčbě kortikoidy. Platí však, že kortikoidy nejsou pro léčbu kalcifylaxe vhodné a případnému terapeutickému testu (např. pro vyloučení pyoderma gangrenosum) musí předcházet pečlivá rozvaha.
Tiosulfát sodný (STS – sodium-tiosulfát) je v léčbě akceptován CUA naprostou většinou autorů. Dávkovací schémata se mohou lišit, byť většinou je u dialyzovaných pacientů doporučováno podat 3krát týdně 15 gramů. Sami jsme s STS mnohokrát pracovali. Pokud kontrolujeme acidobazickou rovnováhu (přípravek je spojen s rizikem metabolické acidózy), nezaznamenali jsme žádnou negativní zkušenost, a to ani při podávání dlouhodobém, dokonce v délce až několika měsíců. S léčbou STS se má pokračovat prakticky až do úplného zhojení, byť z hlediska evidence-based medicíny pro to jasná data neexistují. Sami jednoznačně doporučujeme podávat STS až do úplného odloučení nekróz a jednoznačně viditelné granulační spodiny, resp. lépe až do úplného zhojení.
U našich 3 pacientů byly podávány léky ze skupiny VDR-aktivátorů. Nemůžeme vyloučit, že vzhledem k s nimi spojené pozitivní kalciové i fosfátové bilanci to mohlo ke kalcifylaxi přispět. Sami pacientům s mediokalcinózou přímé VDR (vitamin D receptor) aktivátory podáváme jen velmi opatrně, za kontrol fosforu v krvi a bez suplementace vápníku per os. Je důležité mít na paměti, že aktivním metabolitem vitaminu D neřešíme status zásob vitaminu D v organizmu. Naopak, nejméně dva z našich zde prezentovaných pacientů měli při manifestaci CUA hladiny vitaminu D až neměřitelně nízké. Suplementace však byla zahájena až za několik týdnů, resp. jistě až při průkazném hojení defektů, a to nikoliv s cílem plné úpravy deficitu.
Na podkladě literárních znalostí i získaných zkušeností doporučujeme v současné době ohledně vitaminu D u pacientů s CUA tento postup: v akutním stadiu ihned přerušit podávání všech VDR-aktivátorů, včetně cholekalciferolu i všech aktivních či selektivních metabolitů a analog, bez ohledu na jejich hladiny v krvi (pokud je lze měřit). Až po stabilizaci stavu (lze i před plným zhojením) lze podle skutečně naměřené hladiny 25D stav zásob vitaminu D mírně korigovat, ale pouze při evidentním deficitu (cílová hladina 25D je pak kolem 50 nmol/l (nejsme si totiž jisti, zda plná úprava je správně). K aktivním metabolitům vitaminu D, cíleným přímo na receptor vitaminu D v příštítných tělískách k potlačení tvorby parathormonu, se již nevracíme! Pokud se totiž jednalo o hyperparatyreózu, byla řešena paratyreoidektomií. Jiné než chirurgické řešení není při CUA zárukou úspěchu léčby! Poté, co je hyperparatyreóza vyřešena, již žádný aktivní metabolit vitaminu D není nadále indikován.
Závěr
Téma kalcifylaxe není nové. Kromě nefrologie je však málo známé. Většina lékařů o této komplikaci, jejíž název je sice velmi podobný termínu kalcifikace, ale rozhodně s ním není totožný, vůbec neví.
Pro svůj ojedinělý výskyt, navíc prakticky jen v úzce definované skupině rizikových nemocných (se selháním ledvin), zůstávala kalcifylace dlouho nepovšimnuta, resp. byla jen ojediněle diskutována, a to prakticky pouze v nefrologické komunitě, a to nesystematicky, resp. vysloveně kazuisticky. Přitom ani v této medicínské odbornosti nevešla v dostatečnou povědomost.
Porucha minerálového metabolizmu a metabolizmu vitaminu D, spolu s problematikou metabolické kostní nemoci při onemocnění a selhání ledvin, je stále vysoce aktuální. Její výskyt ani závažnost se nesnižují, možná spíše naopak. A nesnižuje se ani výskyt tak závažné komplikace, kterou představuje kalcifylaxe.
Literární, ale i klinické poznatky na pracovištích, které se této komplikaci věnují, se podstatně rozšířily. Víme, že kalcifylaxe nemusí mít tak vysokou mortalitu, jak je uváděno. Známe řadu rizikových okolností a souvislostí. Patří k nim nejen poruchy metabolizmu vápníku a fosforu, či vitaminu D, či typicky hyperparatyreóza (ale i hypoparatyreóza). Víme bezpečně, že svou roli má i warfarin a známe důvod, proč ke kalcifylaxi u (prediskonovaných osob?) při léčbě warfarinem může dojít. Víme, že ochranu před kalcifylaxí má zásadní důležitost normální (fyziologický) kostní metabolizmus, konkrétně kostní obrat. Odchylky oběma směry jsou spojeny s depozicí vápníku i fosforu mimo kost, tedy predilekčně do cévní stěny. Víme i mnohé další, a umíme kalcifylaxi nejen rozpoznat, ale i léčit.
Víme, že kalcifylaxe není jednooborové téma, ale že toto téma je mezioborové a multioborové. Kalcifylaxe může postihnout i pacienty bez onemocnění ledvin. Rizikové faktory jdou napříč obory a s kalcifylaxí se může setkat i klinický osteolog, stejně jako lékař kteréhokoliv oboru. Kalcifylaxe musí být rozpoznána včas. Pacient s kalcifylaxí má být neprodleně prezentován pracovišti, které má s diagnostikou a zejména s komplexní léčbou dostatečné zkušenosti, opřené o detailní znalost tématu. Toto pracoviště pak pracuje nejen odborně správně ale také neprodleně. K principům léčby patří podrobná analýza všech zvažovaných rizikových okolností, neprodleně „stop“ jejich dalšímu vlivu, včetně i radikálních řešení (viz zde popisované chirurgické paratyreoidektomie) a kontinuální systémové i pečlivé lokální léčby.
Autoři děkují za spolupráci při diagnostice a léčbě nemocných s kalcifylaxí kolegyním a kolegům z různých pracovišť Fakultní nemocnice Hradec Králové (řazeno abecedně): V. Adámková, doc. Dostál, dr. Fortunato, prof. Chrobok, D. Judlová, dr. Maňák, Z. Kmentová, Mgr. Kotlář, dr. Krčálová, prof. Laco, prim. Pavlíková; I. Pitoňáková, doc. Pospíšil, prim. Růžička, prim. Podhola, prim. Suchý, M. Šlemrová, M. Vágnerová, ing. Vávrová, dr. Víšek, dr.Vižďa, prim. Vyroubal a mnoha dalším.
Podpořeno MZ ČR – RVO (FNHK, 00179906) a programem PROGRES Q40/11.
Received | Doručeno do redakce | Doručené do redakcie 31. 1. 2020
Accepted | Přijato po recenzi | Prijaté po recenzii 10. 2. 2019
prof. MUDr. Sylvie Dusilová Sulková, DrSc.
Sources
- Nigwekar SU, Thadhani R, Brandenburg VM. Calciphylaxis. N Engl J Med 2018; 378(18): 1704–1714. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMra1505292>.
- Nigwekar SU, Kroshinsky D, Nazarioan RM et al. Calciphylaxis: Risk factors, diagnosis and treatment. Am J Kidney Dis 2015; 66(1): 133–146. Dostupné z DOI: <http://dx.doi.org/10.1053/j.ajkd.2015.01.034>.
- Nigwekar SU, Wolf M, Sterns RH et al: Calciphylaxis for nonuremic causes. A systematic review. Clin J Am Soc Nephrol 2008; 3(4): 1139–1143. Dostupné z DOI: <http://dx.doi.org/10.2215/CJN.00530108>.
- Jouhhadar R, Bright T. Calciphylaxis in primary hyperparathyroidism: a case report a brief review. South Med J 2009; 102(3): 318–21. Dostupné z DOI: <http://dx.doi.org/10.1097/SMJ.0b013e318197237f>.
- Kusari A, Cotter D, Hinds B et al. Non-uremic calciphylaxis in a patient with multiple rheumatologic diseases. Dermatol Online J 2019; 25(2). Dostupné z PII: <https://pii: 13030/qt2fg525bs>.
- Dobry AS, Ko LN, St John J et al. Association Between Hypercoagulable Conditions and Calciphylaxis in Patients With Renal Disease: A Case-Control Study. JAMA Dermatol 2018; 154 (2): 182–187. Dostupné z DOI: <http://dx.doi.org/10.1001/jamadermatol.2017.4920>.
- Monegal A, Peris P, Alsina M et al. Development of multiorganic calciphylaxis during teriparatide, vitamin D, and calcium treatment. Osteoporos Int 2016; 27(8): 2631–2634. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–016–3571–1>.
- Storan ER, O’Gorman SM, Murphy A et al. Case Report of Calciphylaxis Secondary to Calcium and Vitamin D3 Supplementation. J Cutan Med Surg 2017; 21(2): 162–163. Dostupné z DOI: <http://dx.doi.org/10.1177/1203475416668162>.
- Spanakis EK, Sellmeyer DE. Nonuremic calciphylaxis precipitated by teriparatide [rhPTH(1–34)] therapy in the setting of chronic warfarin and glucocorticoid treatment. Osteoporos Int 2014; 25(4): 1411–1414. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–013–2580–6>.
- Shah DS, Williamson DJ. A rare cause of ulceration with a promising new treatment. Calciphylaxis due to secondary hyperparathyroidism caused by vitamin D deficiency. Clin Exp Dermatol 2010; 35(3): e90–93. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2230.2009.03558.x>.
- Mawad HW, Sawaya BP, Sarin R et al. Calcific uremic arteriolopathy in association with low turnover uremic bone disease. Clin Nephrol. 1999; 52(3): 160–166
- Nasr R, Ghazanfar H. Parathyroidectomy as a Cure for Calciphylaxis in a Non-Dialysis Chronic Kidney Disease Patient? Am J Case Rep 2019; 20 : 1170–1174. Dostupné z DOI: <http://dx.doi.org/10.12659/AJCR.917105>.
- Karmegam S, Shetty A. Calciphylaxis after parathyreoidectomy. Hemodial Int 2017; 21(Suppl 2): 2S62–2S66. Dostupné z DOI: <http://dx.doi.org/10.1111/hdi.12599>.
- Erdel BL, Juneja R, Evans-Molina C. A case of calciphylaxis in a patient with hypoparathyroidism and normal renal function. Endocr Pract 2014; 20(6): e102–e105. Dostupné z DOI: <http://dx.doi.org/10.4158/EP13509.CR>.
- Brandenburg VM, Evenepoel P, Floege J et al. [ERA-EDTA working group on CKD-MBD and EUCALNET]. Lack of evidence does not justify neglect: how can we address unmet medical needs in calciphylaxis? Nephrol Dial Transplant 2016; 31(8): 1211–1219. Dostupné z DOI: <http://dx.doi.org/10.1093/ndt/gfw025>.
- Nigwekar SH, Zhao S, Wenger J et al. A nationally representative study of calcific uremic arteriolopathy risk factors. J Am Soc Nephrol 2016; 27(11): 3421–3429. Dostupné z DOI: <http://dx.doi.org/10.1681/ASN.2015091065>.
- Dusilová Sulková S, Horáček J, Vykoukalová E et al. Parathyreoidectomy in hyperparathyroidism-associated calciphylaxis in end-stage renal disease should be prompt and radical – a case report with two original therapeutic modifications and successful outcome. Acta Medica (Hradec Králové) 2017; 60(2): 85–88. Dostupné z DOI: <http://dx.doi.org/10.14712/18059694.2017.99>.
- Nigwekar SU. Multidisciplinary approach to calcific uremic arteriolopathy. Curr Opin Nephrol Hypertens 2015; 24(6): 531–7. Dostupné z DOI: <http://dx.doi.org/10.1097/MNH.0000000000000175>.
- McCarthy JT, El-Azhary RA, Patzelt MT et al. Survival, risk factors, and effect of treatment in 101 patients with calciphylaxis. Mayo Clin Proc 2016 91(10): 1384–1394. Dostupné z DOI: <http://dx.doi.org/10.1016/j.mayocp.2016.06.025>.
- Peng T, Zhuo L, Wang Y et al. Systematic review of sodium thiosulfate in treating calciphylaxis in chronic kidney disease patients. Nephrology (Carlton) 2018; 23(7): 669–675. Dostupné z DOI: <http://dx.doi.org/10.1111/nep.13081>.
- Brandenburg VM, Kramann R, Rothe H et al. Calcific uremic arteriolopathy (calciphylaxis): data from a large nationwide registry. Nephrol Dial Transplant 2017; 32(1): 126–132. Dostupné z DOI: <http://dx.doi.org/10.1093/ndt/gfv438>.
- Asobie N, Wong E, Cook M. Calciphylaxis in a Diabetic Patient Provoked by Warfarin Therapy. Clin Exp Dermatol 2008; 33(3): 342–344. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2230.2007.02626.x>.
- Al-Ani M, Parperis K. Warfarin-induced calciphylaxis. BMJ Case Rep 2016. Dostupné z DOI: <http://dx.doi.org/10.1136/bcr-2015–214142>.
- Yu WY, Bhutani T, Kornik R et al. Warfarin-Associated Nonuremic Calciphylaxis. JAMA Dermatol 2017; 153(3): 309–314. Dostupné z DOI: <http://dx.doi.org/10.1001/jamadermatol.2016.4821>.
- Ketteler M, Brandenburg VM. K-alcification protection in dialysis patients: the underestimated phenomenon of vitamin K deficiency. J Am Soc Nephrol 2017; 28(6): 1667–1668. Dostupné z DOI: <http://dx.doi.org/10.1681/ASN.2017020180>.
- Yu WY, Bhutani T, Kornik L et al. Warfarin-Associated Nonuremic Calciphylaxis. JAMA Dermatol 2017; 153(3): 309–314. Dostupné z DOI: <http://dx.doi.org/10.1001/jamadermatol.2016.4821>.
- Nigwekar SU, Bloch BD, Nazarian RM et al. Vitamin K–Dependent Carboxylation of Matrix Gla Protein Influences the Risk of Calciphylaxis. J Am Soc Nephrol 2017; 28(6): 1717–1722. Dostupné z DOI: <http://dx.doi.org/10.1681/ASN.2016060651>.
- Hasegava H. Clinical Assessment of Warfarin Therapy in Patients with Maintenance Dialysis-Clinical Efficacy, Risks and Development of Calciphylaxis. Ann Vasc Dis. 2017; 10(3): 170–177. Dostupné z DOI: <http://dx.doi.org/10.3400/avd.ra.17–00062>.
- Chen TY, Lehman LJ, Gibson JE et al. Histopathology of Calciphylaxis: Cohort Study With Clinical Correlations. Am J Dermatopathol 2017; 39(11): 795–802. Dostupné z DOI: <http://dx.doi.org/10.1097/DAD.0000000000000824>.
- Kazanji N, Falatko J, Neupane S et al. Calciphylaxis presenting as digital ischemia. Intern Emerg Med 2015; 10(4): 529–30. Dostupné z DOI: <http://dx.doi.org/10.1007/s11739–014–1172–6>.
- Gupta N, Haq KF, Mahajan S et al. Gastrointestinal Bleeding Secondary to Calciphylaxis. Am J Case Rep 2015; 16 : 818–822. Dostupné z DOI: <http://dx.doi.org/10.12659/ajcr.895164>.
- Colboc H, Moguelet P, Bazin D et al. Localization, Morphologic Features, and Chemical Composition of Calciphylaxis-Related Skin Deposits in Patients With Calcific Uremic Arteriolopathy. JAMA Dermatology 2019; 155(7): 789–796. Dostupné z DOI: <http://dx.doi.org/10.1001/jamadermatol.2019.0381>.
- Williams EA, Moy AP, Cipriani NA et al. Factors associated with false-negative pathologic diagnosis of calciphylaxis. J Cutan Pathol 2019; 46(1): 16–25. Dostupné z DOI: <http://dx.doi.org/10.1111/cup.13364>.
- Ellis CL, O’Neill WC. Questionable specificity of histologic findings in calcific uremic arteriolopathy. Kidney Int 2018; 94(2):390–395. Dostupné z DOI: <http://dx.doi.org/10.1016/j.kint.2018.03.016>.
- Schäfer C, Heiss A, Schwarz A et al. The serum protein α2–Heremans-Schmid glycoprotein/fetuin-A is a systemically acting inhibitor of ectopic calcification. J Clin Invest 2003; 112(3): 357–366. Dostupné z DOI: <http://dx.doi.org/10.1172/JCI200317202>.
- Schlieper G, Brandenburg V, Ketteler M et al. Sodium thiosulfate in the treatment of calcific uremic arteriolopathy. Nat Rev Nephrol 2009; 5(9): 539–543. Dostupné z DOI: <http://dx.doi.org/10.1038/nrneph.2009.99>.
- Carrell EJ, Bell A. Sodium thiosulfate for the treatment of warfarin-induced calciphylaxis in a nondialysis patients. J Pharmacol Pharmacother 2015; 6(4): 222–224. Dostupné z DOI: <http://dx.doi.org/10.4103/0976–500X.171882>.
- Schlieper G1, Brandenburg V, Ketteler M et al. Sodium thiosulfate in the treatment of calcific uremic arteriolopathy. Nat Rev Nephrol; 5(9): 539–543. Dostupné z DOI: <http://dx.doi.org/10.1038/nrneph.2009.99>.
- Strazzula L, Nigwekar SU, Steele D et al. Intralesional sodium thiosulfate for the treatment of calciphylaxis. JAMA Dermatol 2013; 149(8): 946–949. Dostupné z DOI: <http://dx.doi.org/10.1001/jamadermatol.2013.4565>.
- Mao M, Lee S, Kashani K et al: Severe anion gap acidosis associated with intravenous sodium thiosulfate administration. J Med Toxicol 2013; 9(3): 274–247. Dostupné z DOI: <http://dx.doi.org/10.1007/s13181–013–0305-z>.
- Russ P, Russwurm M, Kortus-Goetze B et al. Phenprocoumon based anticoagulation is an underestimated factor in the pathogenesis of calciphylaxis. BMC Nephrol 2019; 20(1): 114. Dostupné z DOI: <http://dx.doi.org/10.1186/s12882–019–1301–6>.
- Hansjoerg Rothe H, Brandenburg V, Haun et al. Ecto-5’ -Nucleotidase CD73 (NT5E), vitamin D receptor and FGF23 gene polymorphisms may play a role in the development of calcific uremic arteriolopathy in dialysis patients. Data from the German Calciphylaxis Registry. PLoS ONE 2017; 12(2): e0172407. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0172407>.
- El-Azhary RA, Patzelt MT, McBane RD et al: Calciphylaxis: A disease of pannicular trombosis. Mayo Clinic Proc 2016; 91(10): 1395–1402. Dostupné z DOI: <http://dx.doi.org/10.1016/j.mayocp.2016.06.026>.
- Randall DP, Fisher MA, Thomas C. Rhabdomyolysis as the presenting manifestation of calciphylaxis. Muscle Nerve 2000; 23(2):289–293. Dostupné z DOI: <http://dx.doi.org/10.1002/(sici)1097–4598(200002)23 : 2<289::aid-mus24>3.0.co; 2-h>.
- Bishop J, Brown E, Podesta A et al. Surgical Management of Calciphylaxis Associated with Primary Hyperparathyroidism: A Case Report and Review of the Literature Int J Endocrinol. Int J Endocrinol 2010; 2010. Dostupné z DOI: <http://dx.doi.org/10.1155/2010/823210>.
- Roy R, Lee JA. Calciphylaxis due to hyperparathyroidism. Endocr Pract 2011; 17(Suppl 1): 54–56. Dostupné z DOI: <http://dx.doi.org/10.4158/EP10349.RA>.
- Thompson B, Towler DA. Arterial calcification and bone physiology: role of the bone vascular axis. Nat Rev Endocrinol 2012; 8(9): 529–543. Dostupné z DOI: <http://dx.doi.org/10.1038/nrendo.2012.36>.
- Garza-Mayers AC, Shah R, Sykes DB et al. The Successful Use of Apixaban in Dialysis Patients with Calciphylaxis Who Require Anticoagulation: A Retrospective Analysis. Am J Nephrol. 2018; 48(3):168–171. Dostupné z DOI: <http://dx.doi.org/10.1159/000491881>.
- Disthabanchong S, Srisuwarn P. Mechanism of vascular calcification in kidney disease. Adv Chron Kidney Dis 2019, 26(6): 417–426. Dostupné z DOI: <http://dx.doi.org/10.1053/j.ackd.2019.08.014>.
- Voelkl J, Lang F, Eckardt KU et al. Signaling pathways involved in vascular smooth muscle cell calcification during hyperphosphatemia. Cell Mol Life Sci 2019; 76(11): 2077–2091. Dostupné z DOI: <http://dx.doi.org/10.1007/s00018–019–03054-z>.
Labels
Clinical biochemistry Paediatric gynaecology Paediatric radiology Paediatric rheumatology Endocrinology Gynaecology and obstetrics Internal medicine Orthopaedics General practitioner for adults Radiodiagnostics Rehabilitation Rheumatology Traumatology OsteologyArticle was published in
Clinical Osteology

2019 Issue 4
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Hope Awakens with Early Diagnosis of Parkinson's Disease Based on Skin Odor
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Memantine Eases Daily Life for Patients and Caregivers
-
All articles in this issue
- Pracovní návrh doporučených postupů pro diagnostiku a léčbu kostních poruch při CKD MBD se specifickým zaměřením na nálezy nízkého obsahu kostního minerálu při vyšetření DXA
- Denzitometrické vyšetření u pacientů s chronickým onemocněním ledvin
- Kostní nemoc u pacientů po orgánové transplantaci
- Kalcifylaxe jako multioborový problém: důležité informace (nejen) pro klinického osteologa a kazuistiky
-
ODPORÚČANIE SOMOK
DLHODOBÁ LIEČBA OSTEOPORÓZY DENOSUMABOM - První biosimilár k léčbě osteoporózy v EU schválen!
- Souvislost mezi kostní a cévní kalcifikací: důkazy z klinických studií
- Clinical Osteology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Kalcifylaxe jako multioborový problém: důležité informace (nejen) pro klinického osteologa a kazuistiky
- Denzitometrické vyšetření u pacientů s chronickým onemocněním ledvin
- Pracovní návrh doporučených postupů pro diagnostiku a léčbu kostních poruch při CKD MBD se specifickým zaměřením na nálezy nízkého obsahu kostního minerálu při vyšetření DXA
- Kostní nemoc u pacientů po orgánové transplantaci