Experimentální a klinické aplikace mezenchymálních kmenových buněk u míšního poranění
The Use of Mesenchymal Stem Cells in the Experimental and Clinical Therapy of Spinal Cord Injury
The use of mesenchymal stem cells (MSC) represents an experimental therapeutic modality in the treatment of spinal cord injury. MSC can be harvested from the bone marrow, fat tissue and other peripheral tissues from adult individuals. Compared to other types of stem cells, MSC are easy to access and expand and they can be used in autologous settings. Over the last 15 years, MSC have been widely studied in experimental spinal cord injury, especially in rodents, with promising results. MSC support remyelination of demyelinated axons, axonal sprouting, angiogenesis, have immunosuppressive effect and secrete neurotrophic factors that may led to functional improvement. These promising results led to launching of clinical studies in patients with spinal cord injury. Phase I/II clinical studies showed that the use of MSC represent a safe method. However, functional effect needs to be proved in further clinical studies. Data suggest that MSC will need to be combined with other methods, such as lesion bridging, scar tissue breakdown and blocking of inhibitory molecules. This paper provides an overview of the use of MSC in experimental and clinical SCI.
Key words:
spinal cord injury – mesenchymal stem cells – stem cell therapy – clinical studies
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Authors:
A. Hejčl 1,2; P. Jendelová 2,3; M. Sameš 1; E. Syková 2,3
Authors‘ workplace:
Neurochirurgická klinika UJEP a Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem, o. z.
1; Ústav experimentální medicíny AV ČR, v. v. i., Praha
2; Ústav neurověd, 2. LF UK v Praze
3
Published in:
Cesk Slov Neurol N 2014; 77/110(5): 560-567
Category:
Review Article
Podpořeno Grantovou agenturou České republiky 13- 00939S, 14- 14961S, grantem Lidské zdroje pro neurovědní výzkum v Královéhradeckém a Ústeckém kraji CZ.1.07/ 2.3.00/ 20.0274 a dále finančně podpořeno projektem LO1309 MŠMT ČR v rámci programu NPU I.
Overview
Užití mezenchymálních kmenových buněk (MSC) je jedním z experimentálních terapeutických přístupů k léčbě poranění míchy. MSC lze získat z kostní dřeně, tukové tkáně i z jiných periferních tkání dospělých jedinců. Výhodou je, v porovnání s jinými kmenovými buňkami, jejich dobrá dostupnost, snadná expanze a možnost autologního použití. MSC byly v posledních 15 letech studovány v experimentálním míšním poranění zejména u hlodavců se slibnými výsledky. Existuje několik mechanizmů, jakými působí MSC na míšní lézi. Především to je remyelinizace demyelinizovaných vláken, podpora pučení axonů (sprouting), angiogeneze, imunosupresivní efekt či sekrece neurotrofních faktorů, které mohou vést k funkčnímu zlepšení. Tyto slibné výsledky urychlily zahájení klinických studií u pacientů s poraněním míchy. Klinické studie fáze I/ II ukázaly, že se jedná o bezpečnou metodu, avšak funkční průkaz vyžaduje další klinické studie. Ukazuje se, že MSC bude třeba kombinovat s jinými metodami, jako je přemostění léze, enzymatické štěpení jizvy a blokátory inhibičních faktorů. Tato práce přináší přehledný souhrn o aplikaci MSC u míšního poranění v experimentu i klinice.
Klíčová slova:
poranění míchy – mezenchymální kmenové buňky – buněčná terapie – klinické studie
Úvod
Poznatek zaznamenaný již v papyru Edwina Smithe, že poranění míchy nedokážeme léčit, platí i po více než 3 500 letech [1]. I přes to, že v posledních 20 letech bylo dosaženo významného posunu ve výzkumu, je zřejmé, že existuje ještě dlouhá cesta k definitivní léčbě. Rozvíjí se několik směrů výzkumu: především užití kmenových buněk, tkáňového inženýrství a biomateriálů, výzkum imunologické odpovědi či modifikace inhibičních faktorů [2].
Počet klinických zkoušek využívajících kmenové buňky kostní dřeně, obdobně jako jiné buňky (olfaktorická glie či Schwannovy buňky), u pacientů s poraněním míchy ve světě roste. Velmi intenzivní je oblast výzkumu kmenových buněk i v České republice, kde dosud proběhla jedna klinická studie [3]. V následujícím článku shrnujeme současný stav terapie pomocí mezenchymálních kmenových buněk u experimentálního míšního poranění, poznatky z klinických studií a v závěru je doplňujeme rozvahou o dalším vývoji léčby míšního poranění.
Mezenchymální kmenové buňky
Hematopoetické buňky kostní dřeně se užívají v léčbě pacientů s hematologickými onemocněními mnoho let [4]. V kostní dřeni ale existují dva typy kmenových buněk: hematopoetické kmenové buňky a mezenchymální kmenové buňky (Mesenchymal Stem Cells, MSC). MSC jsou snadno dostupné a je možné jejich autologní i alogenní využití. V kostní dřeni dospělého člověka zaujímají MSC přibližně 0,001 – 0,01 % všech jaderných buněk [5]. Podle prohlášení Mezinárodní společnosti pro buněčnou léčbu (International Society for Cellular Therapy) jsou MSC definovány následujícími vlastnostmi:
- schopností adherence k plastu při kultivaci za standardních podmínek,
- expresí povrchových molekul CD105, CD73 a CD90 a naopak chyběním povrchových molekul CD45, CD34, CD14 či CD11b, CD79alpha nebo CD19, HLA‑DR a
- schopností diferenciace do adipocytů, chondroblastů a osteoblastů in vitro [6].
Mezenchymální buňky jsou tkáňově specifické multipotentní buňky, které mohou být izolovány i z jiných částí těla, jako jsou Whartonův rosol, pupečník, pupečníková krev, placenta, zubní dřeň či tuková tkáň. Výzkum či dokonce klinické aplikace MSC probíhají u různých onemocněních CNS. Příkladem jsou roztroušená skleróza [7], mozková mrtvice [8], amyotrofická laterální skleróza [9], Parkinsonova choroba [10] či míšní poranění [3,11 – 13]. Mezenchymové buňky kostní dřeně mohou migrovat do místa postižení v závislosti na místních indukčních signálech. Bylo prokázáno, že transplantované buňky kostní dřeně zvyšují expresi růstových a trofických faktorů při ischemii mozku potkana [14]. In vitro diferencují do osteoblastů, chondrocytů, adipocytů a myoblastů [5,15]. Jejich schopnost diferencovat do buněk CNS (astrocyty, neurony, oligodendroglie) je však velmi malá. Po transplantaci do mozku či míchy reagují MSC na vnitřní signály, jako jsou FGFs (Fibroblast Growth Factors), NGF (Nerve Growth Factor) či NCAM (Neural Cell Adhesion Molecule), a mohou ochránit neurony před apoptózou a zrychlit regeneraci pomocí produkce růstových faktorů, jako například BDNF (Brain‑Derived Neurotrophic Factor), VEGF (Vascular Endothelial Growth Factor), NGF (Nerve Growth Factor) či GDNF (Glial ‑ Derived Neurotrophic Factor) [16]. Po transplantaci MSC snižují senzitivitu k ligandům glutamátových receptorů a podporují tak plasticitu poškozené tkáně CNS [17].
Kmenové buňky kostní dřeně lze také mobilizovat z kostní dřeně do periferní krve pomocí granulocytárního kolonie stimulujícího faktoru (G‑CSF). Tyto buňky pak migrují do míšní léze [18]. V experimentální studii provedené na našem pracovišti jsme porovnali aplikaci kultivovaných MSC s frakcí čerstvě připravených mononukleárních buněk kostní dřeně a s mobilizací buněk z kostní dřeně. Všechny tři pokusy statisticky významně zlepšily motoriku a čití zadních končetin potkanů v porovnání s aplikací fyziologického roztoku. Morfometrická analýza také prokázala statisticky významné zvýšení objemu zachovalé bílé i šedé hmoty [13]. Zlepšení v histologických i funkčních parametrech bylo nejvíce patrné právě u potkanů po aplikaci MSC.
Mechanizmy působení mezenchymálních kmenových buněk u míšního poranění
V posledních 15 letech bylo provedeno velké množství studií s aplikací MSC převážně na laboratorních potkanech s experimentálním míšním poraněním [11]. MSC byly podány buď samostatně, nebo v kombinaci s jinými terapeutickými přístupy (biomateriály, trofické faktory) [19 – 21]. Funkční efekt MSC lze na základě provedených studií obecně shrnout do následujících čtyř kategorií:
- Implantované MSC diferencují do myelinizujících buněk a remyelinizují demyelinizované axony [22,23].
- Podporují pučení axonů v oblasti léze a přes gliální jizvu [24,25].
- MSC mají imunosupresivní efekt, neboť modulují imunitní reakci podporou M2 podtypu makrofágů oproti klasickým aktivovaným M1 makrofágům. M2 podtyp makrofágů působí protizánětlivě a má zvýšenou schopnost fagocytózy, což vede k redukci sekundárního traumatu a atrofie míchy (redukují velikost posttraumatických kavit, redukují aktivitu astrocytů a mikroglie/ makrofágů [13,26 – 28]).
- Secernují růstové cytokiny (IL‑6, IL‑7, IL‑10, VEGF, IFN - g) a snižují prozánětlivé cytokiny [29].
Zdroje mezenchymálních kmenových buněk
Základním zdrojem mezenchymálních kmenových buněk u dospělých jedinců je kostní dřeň, která umožňuje po traumatu odběr kmenových buněk v dostatečném množství. Druhým zdrojem jsou MSC z tukové tkáně (AMSC). Výhodou obou podtypů MSC je možnost autologní transplantace. U AMSC je odběr jednoduchý, navíc zdrojem těchto kmenových buněk může být „odpadní“ tuková tkáň při liposukcích. Aplikace MSC v míšním poranění působí podobně jako u MSC z kostní dřeně; podporují angiogenezi, růst axonů, inhibují gliální jizvu a zánětlivou reakci. Druhá skupina MSC jsou perinatální zdroje: MSC z pupeční šňůry, Whartonův rosol, kmenové buňky pupečníkové krve, mezenchymální buňky z pupečníku nebo z placenty.
Časování aplikace mezenchymálních kmenových buněk
Vhodné terapeutické okno pro aplikaci MSC má zásadní význam pro její úspěch. Zdálo by se, že čím dříve bude léčba aplikována, tím lépe. Nicméně experimentální studie ukazují, že akutní léčba (cca do sedmi dnů) může mít horší výsledky než aplikace odložená, tedy ve fázi subakutní (zhruba po sedmi dnech) [30,31]. Důvodem může být rozvoj zánětlivé reakce s velkou invazí imunokompetentních buněk v akutní fázi a s tím související otok nervové tkáně. Po prvním týdnu dochází k významnému poklesu imunokompetentních buněk v tkáni, regresi edému a prostředí poraněné CNS tak může příznivěji reagovat na intervence. Studie účinků MSC v akutní či subakutní fázi byly nejčastěji prováděny po sedmi dnech od míšního poranění. Menší počet studií shrnuje podání MSC v chronické fázi míšního poranění [32 – 34]. Zde bude nutná kombinace MSC s jinými modalitami, např. biomateriály, které umožní přemostění syringomyelie, či enzymy, které štěpí gliální jizvu [19,31,35,36]. Balónková kompresní léze je jedna z metod vytvoření experimentálního míšního poranění, jež velmi dobře napodobuje reálnou klinickou situaci, a lze ji využít k hodnocení léčby jak v akutní, tak i právě v chronické fázi, kdy dochází k rozvoji posttraumatické syringomyelie [37]. V naší práci právě přemostění syringomyelie pomocí porézního hydrogelu v kombinaci s MSC vedlo k zachování většího množství míšní tkáně a ke zlepšení funkce zadních končetin testovaných zvířat [19].
Další faktor, který může být významný, je opakované podání. Čížková et al zkoumali vliv opakovaného podání (třikrát denně po dobu tří dnů) MSC intratékálně [38]. Zatímco jednorázové podání ani opakované podání v časné fázi míšního poranění (do pěti dnů po míšním poranění) nevedlo ke statisticky významnému zlepšení stavu laboratorních potkanů, opakovaná i.t. aplikace mezi 7. a 9. dnem vedla u potkanů ke statisticky významnému zlepšení motoriky. Opakované aplikace by tedy mohly zvýšit účinek MSC. Opakované aplikace MSC byly použity i u některých klinických studií u pacientů s míšním poraněním (viz níže).
Metody aplikace mezenchymálních kmenových buněk u míšního poranění
V experimentu či klinické praxi se u míšního poranění využívají tyto metody aplikace MSC:
- intraspinální – přímá aplikace do míchy v okolí léze [34,39],
- intratékální – převážně cestou lumbální punkce, event. injekcí do cisterna magna či intraventrikulárně [40,41],
- intraarteriální – využívající metodu katetrizace a. vertebralis z a. femoralis [3],
- intravenózní [3,13,42].
Zatímco podání do okolí místa léze je nejpřímější, existuje zde riziko poškození po aplikaci následkem přímého poranění či krvácení do ještě funkčních oblastí míšní tkáně. Jelikož MSC mají schopnost migrovat do místa poranění, lze využít aplikace do okolí místa anebo systémovou aplikaci [43]. Velké množství studií na potkanech využívalo intravenózní podání [13,44,45]. V poslední době se rozvíjí intratékální metoda aplikace MSC [33,34,46,47]. Její výhodou je minimální invazivita, ale zároveň je aplikace cílena blíže k lézi. Migraci a přežívání MSC označených nanočásticemi železa je možné průběžně sledovat pomocí magnetické rezonance [48].
Bylo provedeno několik studií, které porovnávaly efektivitu jednotlivých metod. Kim et al porovnávali intravenózní a intraspinální aplikaci u chronického míšního poranění (šest týdnů po SCI) [34]. Procento přeživších buněk bylo 36,5 % u intraspinální aplikace a 15,5 % u intravenózní aplikace. Exprese růstových faktorů BDNF a NGF byla vyšší v obou transplantovaných skupinách v porovnání s kontrolní skupinou (bez aplikace MSC), stejně jako zlepšení motoriky potkanů. Vaquero et al porovnali intravenózní a intraspinální aplikaci u chronického poranění míchy [33]. Funkční výsledek (dle testů motoriky i senzitivity) byl statisticky významně lepší po intraspinální aplikaci v porovnání s intravenózní aplikací. Ke zlepšení došlo i v trofice zadních končetin potkanů (měřeno velikostí lýtkových svalů). Jiná studie, která porovnávala intratékální a intravenózní aplikaci [49], ukázala, že po intratékální aplikaci je v místě léze přítomno větší množství aplikovaných MSC (4,1 % vs 2,3 % po čtyřech dnech a 3,4 % vs 1,6 % po 21 dnech), větší množství zachovalé míšní tkáně, menší gliální jizva a slabší reakce proti cizímu tělesu v porovnání s intravenózní aplikací. I když výsledky studií naznačují, že cílenější aplikace dosahuje lepších výsledků (což lze očekávat), není zcela jednoznačně prokázáno, která z výše uvedených aplikačních metod je v určitém časovém intervalu od traumatu nejefektivnější.
Experimentální léčba kmenovými buňkami u míšního poranění větších zvířat a lidoopů
Experimentální studie u větších zvířat jsou z mnoha důvodů náročnější: horší dostupnost zvířat, náročnější etické požadavky a péče, větší riziko komplikací, náročnější operativa atp. S tím souvisí i malé množství studií provedených na větších zvířatech i menší množství jedinců ve skupinách. Přesto existuje několik prací využívajících MSC u psů a prasat. Nishida et al použili MSC u chronického poranění míchy u 10 psů [50]. Šest z nich znovu chodilo a u jednoho se obnovila nocicepce, zatímco v kontrolní skupině 13 psů chodili znovu dva a obnova nocicepce nebyla pozorována ani u jednoho jedince. Všichni psi zůstali inkontinentní, avšak žádné komplikace autoři po aplikaci nepozorovali. V jiné studii autoři aplikovali kmenové buňky u sedmi psů po jednom týdnu od míšního poranění, tedy v akutní fázi [51]. Dva léčení psi uhynuli po jednom měsíci na kombinaci infekce močových cest, proleženin a sepsi. Čtyři psi se po léčbě signifikantně zlepšili. Tři psi, kteří sloužili jako kontroly (bez léčby), byli utraceni po 3 – 12 měsících poté, co u nich nedošlo k žádnému zlepšení. Histologické vyšetření pěti psů z léčené skupiny prokázalo přítomnost periferního typu myelinizace v místě léze. Je patrné, že malý počet zvířat v těchto studiích neumožňuje větší statistické hodnocení. Ještě náročnější podmínky experimentálních studií jsou u primátů; proto se nám také podařilo identifikovat jen jednu studii aplikace MSC u primátů s poraněním míchy [52,53]. V této práci provedené na 10 jedincích makaka rhesus (pět léčených, pět kontrol) implantace MSC z kostní dřeně diferencovaných do neurální linie podpořila neurogenezi a vedla k funkčnímu zlepšení u všech léčených opic, zatímco v kontrolní skupině nedošlo k žádnému zlepšení [53].
Klinické studie kmenových buněk u míšního poranění
Dosavadní klinické studie jsou prováděny ve fázi I/ II, tedy základem je zjistit bezpečnost podání při sledování funkčního skóre. Současný stav klinických studií nedovoluje vzhledem k malému počtu pacientů s míšním poraněním v jednotlivých studiích, heterogenitě souborů a často chybějícím kontrolám jednoznačně vyvodit závěry ve smyslu funkčního významu aplikace MSC.
První publikovaná studie využívající kmenové buňky kostní dřeně referovala o kombinované aplikaci mononukleárních buněk injikovaných do míšní léze spolu s aplikací GM‑CSF u šesti pacientů s akutním poraněním míchy [54]. Stejná skupina pak publikovala výsledky u 35 pacientů léčených stejnou kombinací. V této studii se 10 měsíců po léčbě zlepšilo 29,5 % pacientů v akutní fázi, 33,3 % pacientů v subakutní fázi, avšak žádný pacient léčený v chronické fázi. Studie také zahrnovala dalších 13 pacientů kontrolních, kteří prodělali pouze standardní dekompresi spolu s fúzí. V této skupině došlo ke zlepšení u 7,7 % pacientů. Výsledky klinické studie provedené v Praze byly popsány na prvních 20 pacientech [3]. Mononukleární buňky kostní dřeně byly aplikovány buď katetrizačně cestou a. vertebralis, či intravenózní infuzí u pacientů v akutní nebo chronické fázi míšního poranění. Zlepšení v motorice a senzitivitě bylo pozorováno u pěti z šesti pacientů po intraarteriální aplikaci, z toho jeden pacient byl 17 měsíců po míšním poranění. U pacientů nebyly pozorovány žádné závažné komplikace po aplikaci MSC. Seznam publikovaných klinických studií je uveden v tab. 1. Další registrované klinické studie užití MSC u míšního poranění jsou uvedeny na stránkách www.clinicaltrials.gov. Doposud nelze učinit žádný závěr o efektivitě podané léčby, neboť je nejprve nutno prokázat, zda je zlepšení u některých pacientů po léčbě na podkladě přirozeného vývoje poranění či vlivem buněčné terapie.
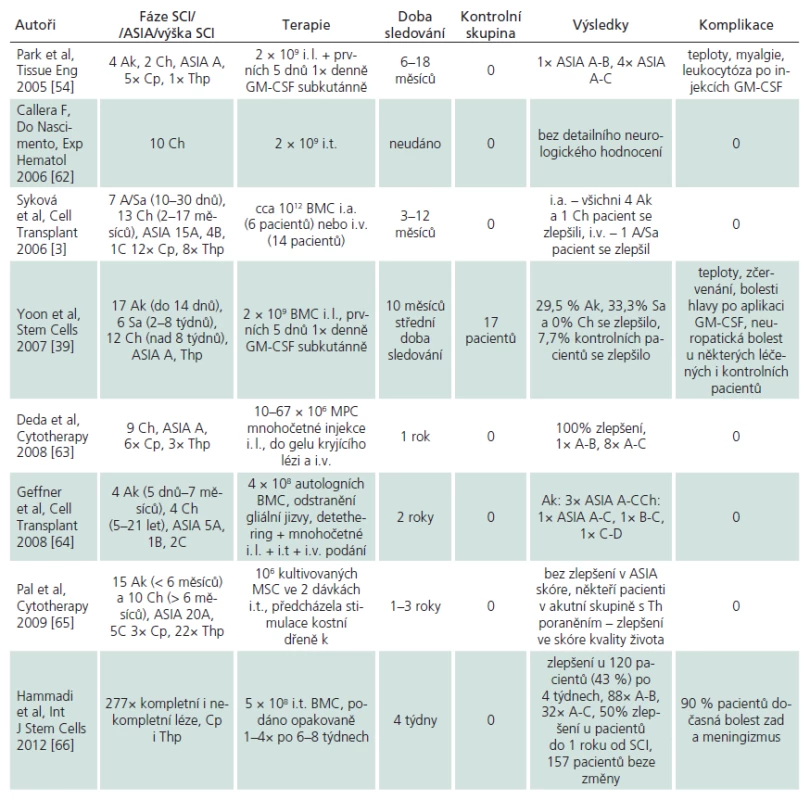
Již hodnotnější závěry lze ale vyvodit ve smyslu bezpečnosti podání MSC. Většina studií uvádí, že podání MSC u pacientů s míšním poraněním se obešlo bez závažných komplikací. Mezi méně závažné krátkodobé komplikace pak řadí občasný výskyt zvýšené teploty, bolesti svalů či leukocytózu. Důležité je, že zatím v žádné studii nebyl popsán rozvoj nádorů u pacientů po míšním poranění, i když k definitivnímu hodnocení bude ještě nutno vyčkat dlouhodobých hodnocení pacientů. Jedna taková studie je však již k dispozici [55]. Zde autoři užili přímé intramedulární podání autologních MSC u 10 pacientů s chronickým míšním poraněním. U žádného z těchto pacientů nebyly pozorovány komplikace. Šest z 10 pacientů se zlepšilo v motorickém skóre horních končetin po šesti měsících. Navíc tři z nich pozorovali v průběhu tří let pokračující zlepšování v běžných denních aktivitách; dále byly patrné změny na magnetické rezonanci (např. zmenšení velikosti kavit) a zlepšení v elektrofyziologii. Dle dostupné literatury pouze jediná publikace uvádí závažnější komplikace, a to práce z Káhiry [46]. Autoři po intratékální aplikaci pozorovali rozvoj neuropatické bolesti u téměř 56 % pacientů, zatímco u kontrolní skupiny nebyla pozorována žádná. Zároveň autoři zjistili zhoršení závažné spasticity (stupeň 3) u téměř 10 % pacientů. Tato spasticita omezila rehabilitaci a byla nutná aplikace botulintoxinu A. U kontrol autoři nepozorovali žádné zhoršení spasticity. Zásadní komplikace byl vznik encefalomyelitidy po třetí intratékální dávce; původní příčina myelopatie u této pacientky byla postinfekční myelitida.
Limitace experimentálních a klinických studií
Množství provedených experimentálních studií kmenových buněk u míšního poranění je značné; převážná většina z nich je na laboratorních potkanech, menší množství pak na větších savcích či na opicích. Výsledky experimentů na potkanech jsou často přesvědčivě dokumentovány histologicky i funkčními testy (převážně motoriky anebo senzitivity). Na druhou stranu je nutno verifikovat, zdali aplikace MSC a s tím související morfologické změny jsou skutečnou příčinou funkčního zlepšení. V jedné z mála takto provedených studií byly nejdříve experimentálně aplikovány NSC v míšním poranění myší s výsledným funkčním zlepšením. Následně byly NSC zničeny toxinem, což vedlo ke statisticky významnému funkčnímu zhoršení stavu těchto myší [56].
Také chybí studie, které by opakovaly a verifikovaly výsledky jiných laboratoří provedením identického experimentu. Logickým zdůvodněním je nedostatečná prestiž opakované studie, a tím i horší možnosti její publikovatelnosti. Na tento nedostatek zareagovala NINDS (National Institute of Neurological Disorders and Stroke), která financuje program nazvaný „Facilities of Research Excellent in Spinal Cord Injury, FORE ‑ SCI“. Ten umožňuje opakování studie provedené v jiné laboratoři, často právě za plné asistence laboratoře, kde byl průvodní výzkum prováděn. Nevýhodou je také provádění experimentální míšní léze na úrovni hrudní (Th) páteře a relativně malé množství studií prováděných v úrovni krční (C) páteře.
V souvislosti s klinickými studiemi je patrné malé množství doposud léčených pacientů v jednotlivých studiích. To je dáno jednak primárně malým počtem pacientů, ale také vysokou heterogenitou souborů ve smyslu časování léčby, metod aplikace, různých typů kmenových buněk (většina studií byla provedena s aplikací mononukleárních preparátů, v menšině pak byly použity in vitro pomnožené MSC), či kombinací kmenových buněk s jinými metodami. Další udávanou limitací klinických studií je málo informací týkající se rehabilitace těchto pacientů [57].
Převážná většina pacientů v klinických studiích míšního poranění jsou pacienti s kompletní lézí míšní (ASIA A), což jistě souvisí i se snahou minimalizace potencionálních rizik v souvislosti s buněčnou léčbou. Na druhou stranu většina experimentálních studií je na laboratorních zvířatech s nekompletní lézí míšní. Vzhledem ke způsobu, jakým MSC působí na míšní lézi, lze očekávat efekt léčby pomocí MSC spíše u nekompletních lézí. Nabízí se tedy potřeba nových klinických studií zahrnujících pacienty s nekompletními lézemi, dále aplikace většího množství buněk a především jejich opakované podání; pro tento směr svědčí i výsledky dosavadních klinických studií, které prokázaly, že aplikace MSC u pacientů s míšní lézí je metoda bezpečná.
Poranění míchy je z hlediska patofyziologie komplexní proces daný sérií patologických procesů a obecně se předpokládá, že také budoucí léčba bude zahrnovat kombinovanou aplikaci: terapie kmenovými buňkami, implantace biomateriálů k přemostění léze, aplikace enzymů štěpících gliální a mezenchymální jizvu či podání protilátek proti inhibitorům myelinu CNS. Rozvíjí se tak obor tkáňového inženýrství. Např. biomateriály mohou fungovat jednak jako nosiče kmenových buněk a zároveň jako strukturální základ („lešení“), po kterém mohou růst nové cévy či vlákna [19,31]. Taková kombinace se jeví zvláště výhodná u chronického poranění míchy, kdy vzhledem k časté syringomyelii jsou samotné MSC naprosto nedostatečné, jak plyne z mnoha experimentálních studií. Výhodou využití právě syntetických biomateriálů je možnost jejich modifikace. Cílem experimentálních studií je syntetizovat biomateriál, který bude mít tu nejlepší kombinaci vlastností coby strukturálního „lešení“ i nosiče buněk či dalších faktorů [12,36,58 – 60]. V lednu 2014 byla publikována první studie ortopedů z káhirské univerzity, kteří u 14 pacientů s chronickým poraněním míchy provedli přemostění míšní léze pomocí štěpů z periferních nervů a v kombinaci s graftem na bázi chitosanu s lamininem [61]. U 12 pacientů pozorovali zlepšení ze stupně ASIA A na stupeň ASIA C a u dvou pacientů z ASIA A na ASIA B. Komplikací bylo sekundární hojení na podkladě hematomu a tvorby séromu.
Závěr
Množství experimentálních studií převážně na laboratorních potkanech vedlo k postupnému rozvoji klinických studií u pacientů s míšním poraněním. Z dosavadních výsledků lze odvodit, že se jedná o relativně bezpečnou metodu, nicméně zatím při jednorázovém podání bez přesvědčivých funkčních výsledků v klinické aplikaci. Je nutno podotknout, že většina klinických studií byla ve fázi I/ II. K tomu, abychom mohli hodnotit výsledky klinických aplikací, je nutné zlepšit homogenitu souborů pacientů nebo vždy porovnat léčenou skupinu s kontrolní. Je nezbytné ve studii zvýšit množství podaných buněk, aplikovat je co nejdříve po traumatu a podávat opakovaně. Vzhledem k mechanizmu působení MSC by bylo vhodné i testování pacientů s nekompletními lézemi míšními. Na druhou stranu u pacientů s chronickým poraněním se jeví aplikace samotných MSC jako nepřesvědčivé. Zde lze do budoucnosti předpokládat využití komplexnějšího přístupu, např. rozštěpit gliální jizvu a přemostit posttraumatickou kavitu v centru léze, případně vytvořit prostředí se správným gradientem neurotrofních faktorů, které by podpořily znovunapojení ascendentních a descendentních drah v místě léze. Takové řešení může v budoucnosti zahrnovat implantaci (injekční, mikrochirurgickou či jinou formou) biomateriálů (syntetických anebo vlastních), kombinaci s neurotrofními faktory či jinými formami buněčné terapie. Zásadní moment úspěšného rozvoje klinického výzkumu v této oblasti je také korektní komunikace s laickou veřejností a médii. Pacienti a jejich příbuzní očekávají nové léčebné metody s velkými nadějemi. Musí být proto pravdivě a otevřeně informováni o reálných možnostech takové experimentální léčby bez vzbuzování zbytečných nadějí. V závěru lze shrnout, že je žádoucí dále zkoumat aplikace MSC u míšního poranění jak v experimentu, tak i v klinických studiích, v České republice pak nejlépe cestou grantových studií.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MU Dr. Aleš Hejčl
Neurochirurgická klinika
UJEP a Krajská zdravotní a.s.
Masarykova nemocnice v Ústí nad Labem, o.z.
Sociální péče 12A
401 00 Ústí nad Labem
e‑mail: ales.hejcl@gmail.com
Přijato k recenzi: 21. 5. 2014
Přijato do tisku: 4. 7. 2014
Sources
1. Beneš V. Poranění míchy. Praha: Avicenum 1987.
2. Li J, Lepski G. Cell transplantation for spinal cord injury: a systematic review. Biomed Res Int 2013 : 786475. doi: 10.1155/ 2013/ 786475.
3. Sykova E, Homola A, Mazanec R, Lachmann H, Konradova SL, Kobylka P et al. Autologous bone marrow transplantation in patients with subacute and chronic spinal cord injury. Cell Transplant 2006; 15(8 – 9): 675 – 687.
4. Samson D, Chanarin I, Reid CD. Recent advances in haematology. Postgrad Med J 1981; 57(665): 139 – 149.
5. Pittenger MF, Mackay AM, Beck SC, Jaiswal RK, Douglas R, Mosca JD et al. Multilineage potential of adult human mesenchymal stem cells. Science 1999; 284(5411): 143 – 147.
6. Dominici M, Le Blanc K, Mueller I, Slaper ‑ Cortenbach I, Marini F, Krause D et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy 2006; 8(4): 315 – 317.
7. Krasulová E TM, Kozák T, Havrdová E. Autologous Hematopoietic Stem Cells Transplantation and its Current Role in Multiple Sclerosis Treatment. Cesk Slov Neurol N 2009; 72/ 105(3): 227 – 234.
8. Kocsis JD, Honmou O. Bone marrow stem cells in experimental stroke. Prog Brain Res 2012; 201 : 79 – 98. doi: 10.1016/ B978 ‑ 0 ‑ 444 ‑ 59544 ‑ 7.00005 ‑ 6.
9. Soler B, Fadic R, von Bernhardi R. Stem cells therapy in amyotrophic lateral sclerosis treatment. A critical view. Rev Neurol 2011; 52(7): 426 – 434.
10. Glavaski ‑ Joksimovic A, Bohn MC. Mesenchymal stem cells and neuroregeneration in Parkinson‘s disease. Exp Neurol 2013; 247 : 25 – 38. doi: 10.1016/ j.expneurol.2013.03.016.
11. Forostyak S, Jendelova P, Sykova E. The role of mesenchymal stromal cells in spinal cord injury, regenerative medicine and possible clinical applications. Biochimie 2013; 95(12): 2257 – 2270. doi: 10.1016/ j.biochi.2013.08.004.
12. Sykova E, Jendelova P, Urdzikova L, Lesny P, Hejcl A.Bone marrow stem cells and polymer hydrogels – two strategies for spinal cord injury repair. Cell Mol Neurobiol 2006; 26(7 – 8): 1113 – 1129.
13. Urdzikova L, Jendelova P, Glogarova K, Burian M, Hajek M, Sykova E. Transplantation of bone marrow stem cells as well as mobilization by granulocyte ‑ colony stimulating factor promotes recovery after spinal cord injury in rats. J Neurotrauma 2006; 23(9): 1379 – 1391.
14. Li Y, Chen J, Chen XG, Wang L, Gautam SC, Xu YX et al. Human marrow stromal cell therapy for stroke in rat: neurotrophins and functional recovery. Neurology 2002; 59(4): 514 – 523.
15. Prockop DJ. Marrow stromal cells as stem cells for nonhematopoietic tissues. Science 1997; 276(5309): 71 – 74.
16. Li N, Sarojini H, An J, Wang E. Prosaposin in the secretome of marrow stroma ‑ derived neural progenitor cells protects neural cells from apoptotic death. J Neurochem 2010; 112(6): 1527 – 1538. doi: 10.1111/ j.1471 ‑ 4159.2009.06565.x.
17. Hao P, Liang Z, Piao H, Ji X, Wang Y, Liu Y et al. Conditioned medium of human adipose‑derived mesenchymal stem cells mediates protection in neurons following glutamate excitotoxicity by regulating energy metabolism and GAP ‑ 43 expression. Metab Brain Dis 2014; 29(1): 193 – 205. doi: 10.1007/ s11011 ‑ 014 ‑ 9490 ‑ y.
18. Koda M, Nishio Y, Kamada T, Someya Y, Okawa A,Mori C et al. Granulocyte colony ‑ stimulating factor (G‑CSF) mobilizes bone marrow ‑ derived cells into injured spinal cord and promotes functional recovery after compression‑induced spinal cord injury in mice. Brain Res 2007; 1149 : 223 – 231.
19. Hejcl A, Sedy J, Kapcalova M, Toro DA, Amemori T,Lesny P et al. HPMA ‑ RGD hydrogels seeded with mesenchymal stem cells improve functional outcome in chronic spinal cord injury. Stem Cells Dev 2010; 19(10): 1535 – 1546. doi: 10.1089/ scd.2009.0378.
20. Amemori T, Jendelova P, Ruzickova K, Arboleda D, Sykova E. Co ‑ transplantation of olfactory ensheathing glia and mesenchymal stromal cells does not have synergistic effects after spinal cord injury in the rat. Cytotherapy 2010; 12(2) :212 – 225. doi: 10.3109/ 14653240903440103.
21. Shin DA, Pennant WA, Yoon do H, Ha Y, Kim KN.Co ‑ transplantation of bone marrow ‑ derived mesenchymal stem cells and nanospheres containing FGF ‑ 2 improve cell survival and neurological function in the injured rat spinal cord. Acta Neurochir (Wien) 2014; 156(2): 297 – 303. doi: 10.1007/ s00701 ‑ 013 ‑ 1963 ‑ y.
22. Sasaki M, Honmou O, Akiyama Y, Uede T, Hashi K,Kocsis JD. Transplantation of an acutely isolated bone marrow fraction repairs demyelinated adult rat spinal cord axons. Glia 2001; 35(1): 26 – 34.
23. Akiyama Y, Radtke C, Kocsis JD. Remyelination of the rat spinal cord by transplantation of identified bone marrow stromal cells. J Neurosci 2002; 22(15): 6623 – 6630.
24. Ankeny DP, McTigue DM, Jakeman LB. Bone marrow transplants provide tissue protection and directional guidance for axons after contusive spinal cord injury in rats. Exp Neurol 2004; 190(1): 17 – 31.
25. Hofstetter CP, Schwarz EJ, Hess D, Widenfalk J, El Manira A, Prockop DJ et al. Marrow stromal cells form guiding strands in the injured spinal cord and promote recovery. Proc Natl Acad Sci U S A 2002; 99(4): 2199 – 2204.
26. Himes BT, Neuhuber B, Coleman C, Kushner R, Swanger SA, Kopen GC et al. Recovery of function following grafting of human bone marrow ‑ derived stromal cells into the injured spinal cord. Neurorehabil Neural Repair 2006; 20(2): 278 – 296.
27. Busch SA, Hamilton JA, Horn KP, Cuascut FX, Cutrone R, Lehman N et al. Multipotent adult progenitor cells prevent macrophage ‑ mediated axonal dieback and promote regrowth after spinal cord injury. J Neurosci 2011; 31(3): 944 – 953. doi: 10.1523/ JNEUROSCI.3566 ‑ 10.2011.
28. Schwartz M. „Tissue ‑ repairing“ blood ‑ derived macrophages are essential for healing of the injured spinal cord: from skin‑activated macrophages to infiltrating blood ‑ derived cells? Brain Behav Immun 2010; 24(7): 1054 – 1057. doi: 10.1016/ j.bbi.2010.01.010.
29. Zhukareva V, Obrocka M, Houle JD, Fischer I, Neuhuber B. Secretion profile of human bone marrow stromal cells: donor variability and response to inflammatory stimuli. Cytokine 2010; 50(3): 317 – 321. doi: 10.1016/ j.cyto.2010.01.004.
30. Coumans JV, Lin TT, Dai HN, MacArthur L, McAtee M, Nash C et al. Axonal regeneration and functional recovery after complete spinal cord transection in rats by delayed treatment with transplants and neurotrophins. J Neurosci 2001; 21(23): 9334 – 9344.
31. Hejcl A, Urdzikova L, Sedy J, Lesny P, Pradny M,Michalek J et al. Acute and delayed implantation of positively charged 2 - hydroxyethyl methacrylate scaffolds in spinal cord injury in the rat. J Neurosurg Spine 2008; 8(1): 67 – 73. doi: 10.3171/ SPI ‑ 08/ 01/ 067.
32. Zurita M, Vaquero J. Functional recovery in chronic paraplegia after bone marrow stromal cells transplantation. Neuroreport 2004; 15(7): 1105 – 1108.
33. Vaquero J, Zurita M, Oya S, Santos M. Cell therapy using bone marrow stromal cells in chronic paraplegic rats: systemic or local administration? Neurosci Lett 2006; 398(1 – 2): 129 – 134.
34. Kim JW, Ha KY, Molon JN, Kim YH. Bone marrow ‑ derived mesenchymal stem cell transplantation for chronic spinal cord injury in rats: comparative study between intralesional and intravenous transplantation. Spine (Phila Pa 1976) 2013; 38(17): E1065–E 1074. doi: 10.1097/ BRS.0b013e31829839fa.
35. Tom VJ, Sandrow ‑ Feinberg HR, Miller K, Santi L,Connors T, Lemay MA et al. Combining peripheral nerve grafts and chondroitinase promotes functional axonal regeneration in the chronically injured spinal cord. J Neurosci 2009; 29(47): 14881 – 14890. doi: 10.1523/ JNEUROSCI.3641 ‑ 09.2009.
36. Hejcl A, Ruzicka J, Kapcalova M, Turnovcova K, Krumbholcova E, Pradny M et al. Adjusting the chemical and physical properties of hydrogels leads to improved stem cell survival and tissue ingrowth in spinal cord injury reconstruction: a comparative study of four methacrylate hydrogels. Stem Cells Dev 2013; 22(20): 2794 – 2805. doi: 10.1089/ scd.2012.0616.
37. Vanicky I, Urdzikova L, Saganova K, Cizkova D, Galik J. A simple and reproducible model of spinal cord injury induced by epidural balloon inflation in the rat. J Neurotrauma 2001; 18(12): 1399 – 1407.
38. Cizkova D, Novotna I, Slovinska L, Vanicky I, Jergova S, Rosocha J et al. Repetitive intrathecal catheter delivery of bone marrow mesenchymal stromal cells improves functional recovery in a rat model of contusive spinal cord injury. J Neurotrauma 2011; 28(9): 1951 – 1961. doi: 10.1089/ neu.2010.1413.
39. Yoon SH, Shim YS, Park YH, Chung JK, Nam JH, Kim MO et al. Complete spinal cord injury treatment using autologous bone marrow cell transplantation and bone marrow stimulation with granulocyte macrophage ‑ colony stimulating factor: Phase I/ II clinical trial. Stem Cells 2007; 25(8): 2066 – 2073.
40. Ohta M, Suzuki Y, Noda T, Ejiri Y, Dezawa M, Kataoka K et al. Bone marrow stromal cells infused into the cerebrospinal fluid promote functional recovery of the injured rat spinal cord with reduced cavity formation. Exp Neurol 2004; 187(2): 266 – 278.
41. Saito F, Nakatani T, Iwase M, Maeda Y, Murao Y,Suzuki Y et al. Administration of cultured autologous bone marrow stromal cells into cerebrospinal fluid in spinal injury patients: a pilot study. Restor Neurol Neurosci 2012; 30(2): 127 – 136. doi: 10.3233/ RNN ‑ 2011 ‑ 0629.
42. Quertainmont R, Cantinieaux D, Botman O, Sid S, Schoenen J, Franzen R. Mesenchymal stem cell graft improves recovery after spinal cord injury in adult rats through neurotrophic and pro‑angiogenic actions. PloS One 2012; 7(6): e39500. doi: 10.1371/ journal.pone.0039500.
43. Spaeth E, Klopp A, Dembinski J, Andreeff M, Marini F. Inflammation and tumor microenvironments: defining the migratory itinerary of mesenchymal stem cells. Gene Ther 2008; 15(10): 730 – 738. doi: 10.1038/ gt.2008.39.
44. Osaka M, Honmou O, Murakami T, Nonaka T, Houkin K, Hamada H et al. Intravenous administration of mesenchymal stem cells derived from bone marrow after contusive spinal cord injury improves functional outcome. Brain Res 2010; 1343 : 226 – 235. doi: 10.1016/ j.brainres.2010.05.011.
45. Zhang D, He X. A meta‑analysis of the motion function through the therapy of spinal cord injury with intravenous transplantation of bone marrow mesenchymal stem cells in rats. PloS One 2014; 9(4): e93487. doi: 10.1371/ journal.pone.0093487.
46. Kishk NA, Gabr H, Hamdy S, Afifi L, Abokresha N, Mahmoud H et al. Case control series of intrathecal autologous bone marrow mesenchymal stem cell therapy for chronic spinal cord injury. Neurorehabil Neural Repair 2010; 24(8): 702 – 708. doi: 10.1177/ 1545968310369801.
47. Liu J, Han D, Wang Z, Xue M, Zhu L, Yan H et al. Clinical analysis of the treatment of spinal cord injury with umbilical cord mesenchymal stem cells. Cytotherapy 2013; 15(2): 185 – 191. doi: 10.1016/ j.jcyt.2012.09.005.
48. Jendelova P, Herynek V, DeCroos J, Glogarova K, Andersson B, Hajek M et al. Imaging the fate of implanted bone marrow stromal cells labeled with superparamagnetic nanoparticles. Magn Reson Med 2003; 50(4): 767 – 776.
49. Paul C, Samdani AF, Betz RR, Fischer I, Neuhuber B. Grafting of human bone marrow stromal cells into spinal cord injury: a comparison of delivery methods. Spine (Phila Pa 1976) 2009; 34(4): 328 – 334. doi: 10.1097/ BRS.0b013e31819403ce.
50. Nishida H, Nakayama M, Tanaka H, Kitamura M, Hatoya S, Sugiura K et al. Evaluation of transplantation of autologous bone marrow stromal cells into the cerebrospinal fluid for treatment of chronic spinal cord injury in dogs. Am J Vet Res 2011; 72(8): 1118 – 1123. doi: 10.2460/ ajvr.72.8.1118.
51. Lee JH, Chung WH, Kang EH, Chung DJ, Choi CB, Chang HS et al. Schwann cell‑like remyelination following transplantation of human umbilical cord blood (hUCB) – derived mesenchymal stem cells in dogs with acute spinal cord injury. J Neurol Sci 2011; 300(1 – 2): 86 – 96. doi: 10.1016/ j.jns.2010.09.025.
52. Deng YB, Liu XG, Liu ZG, Liu XL, Liu Y, Zhou GQ. Implantation of BM mesenchymal stem cells into injured spinal cord elicits de novo neurogenesis and functional recovery: evidence from a study in rhesus monkeys. Cytotherapy 2006; 8(3): 210 – 214.
53. Deng YB, Yuan QT, Liu XG, Liu XL, Liu Y, Liu ZG et al. Functional recovery after rhesus monkey spinal cord injury by transplantation of bone marrow mesenchymal ‑ stem cell ‑ derived neurons. Chin Med J 2005; 118(18): 1533 – 1541.
54. Park HC, Shim YS, Ha Y, Yoon SH, Park SR, Choi BHet al. Treatment of complete spinal cord injury patients by autologous bone marrow cell transplantation and administration of granulocyte ‑ macrophage colony stimulating factor. Tissue Eng 2005; 11(5 – 6): 913 – 922.
55. Park JH, Kim DY, Sung IY, Choi GH, Jeon MH, Kim KK et al. Long‑term results of spinal cord injury therapy using mesenchymal stem cells derived from bone marrow in humans. Neurosurgery 2012; 70(5): 1238 – 1247. doi: 10.1227/ NEU.0b013e31824387f9.
56. Cummings BJ, Uchida N, Tamaki SJ, Salazar DL, Hooshmand M, Summers R et al. Human neural stem cells differentiate and promote locomotor recovery in spinal cord ‑ injured mice. Proc Natl Acad Sci U S A 2005; 102(39): 14069 – 14074.
57. Wright KT, El Masri W, Osman A, Chowdhury J, Johnson WE. Concise review: Bone marrow for the treatment of spinal cord injury: mechanisms and clinical applications. Stem Cells 2011; 29(2): 169 – 178. doi: 10.1002/ stem.570.
58. Hejcl A, Lesny P, Pradny M, Michalek J, Jendelova P, Stulik J et al. Biocompatible hydrogels in spinal cord injury repair. Physiol Res 2008; 57 (Suppl 3): S121 – S132.
59. Kubinova S, Horak D, Hejcl A, Plichta Z, Kotek J,Proks V et al. SIKVAV ‑ modified highly superporous PHEMA scaffolds with oriented pores for spinal cord injury repair. J Tissue Eng Regen Med 2013. doi: 10.1002/ term.1694.
60. Hejcl A, Lesny P, Pradny M, Sedy J, Zamecnik J, Jendelova P et al. Macroporous hydrogels based on 2 - hydroxyethyl methacrylate. Part 6 : 3D hydrogels with positive and negative surface charges and polyelectrolyte complexes in spinal cord injury repair. J Mater Sci Mater Med 2009; 20(7): 1571 – 1577. doi: 10.1007/ s10856 ‑ 009 ‑ 3714 ‑ 4.
61. Amr SM, Gouda A, Koptan WT, Galal AA, Abdel ‑ Fattah DS, Rashed LA et al. Bridging defects in chronic spinal cord injury using peripheral nerve grafts combined with a chitosan ‑ laminin scaffold and enhancing regeneration through them by co ‑ transplantation with bone ‑ marrow ‑ derived mesenchymal stem cells: case series of 14 patients. J Spinal Cord Med 2014; 37(1): 54 – 71. doi: 10.1179/ 2045772312Y.0000000069.
62. Callera F, do Nascimento RX. Delivery of autologous bone marrow precursor cells into the spinal cord via lumbar puncture technique in patients with spinal cord injury: a preliminary safety study. Exp Hematol 2006; 34(2): 130–131.
63. Deda H, Inci MC, Kürekçi AE, Kayihan K, Ozgün E,Ustünsoy GE et al. Treatment of chronic spinal cord injured patients with autologous bone marrow-derived hematopoietic stem cell transplantation: 1-year follow-up. Cytotherapy 2008; 10(6): 565–574. doi: 10.1080/14653240802241797.
64. Geffner LF, Santacruz P, Izurieta M, Flor L, Maldonado B, Auad AH et al. Administration of autologous bone marrow stem cells into spinal cord injury patients via multiple routes is safe and improves their quality of life: comprehensive case studies. Cell Transplant 2008; 17(12): 1277–1293.
65. Pal R, Venkataramana NK, Bansal A, Balaraju S,Jan M, Chandra R et al. Ex vivo-expanded autologous bone marrow-derived mesenchymal stromal cells in human spinal cord injury/paraplegia: a pilot clinical study. Cytotherapy 2009; 11(7): 897–911. doi: 10.3109/14653240903253857.
66. Hammadi AA, Marino A, Farhan S. Clinical response of 277 patients with spinal cord injury to stem cell therapy in Iraq. Int J Stem Cells 2012; 5(1): 76–78.
67. Karamouzian S, Nematollahi-Mahani SN, Nakhaee N, Eskandary H. Clinical safety and primary efficacy of bone marrow mesenchymal cell transplantation in subacute spinal cord injured patients. Clin Neurol Neurosurg 2012; 114(7): 935–939.
68. Jiang PC, Xiong WP, Wang G, Ma C, Yao WQ, Kendell SF et al. A clinical trial report of autologous bone marrow-derived mesenchymal stem cell transplantation in patients with spinal cord injury. Exp Ther Med 2013; 6(1): 140–146.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2014 Issue 5
- Memantine Eases Daily Life for Patients and Caregivers
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Advances in the Treatment of Myasthenia Gravis on the Horizon
-
All articles in this issue
- Chirurgická léčba supratentoriálních kortiko‑ subkortikálních kavernomů
- Neutralizační protilátky a Myxovirus resistance protein A při sledování biologické účinnosti interferonu β
- Vazospazmy jako komplikace subarachnoidálního krvácení – kazuistika
- Polyurie v neurointenzivní péči – kazuistika
- Leukodystrofie – klinické a rádiologické aspekty
- Bariéry nervového systému za fyziologických a patologických stavů
- Experimentální a klinické aplikace mezenchymálních kmenových buněk u míšního poranění
- Volumetrické hodnocení resekability gliomů inzuly
- Validita Testu 16 slov pro diferenciální diagnostiku demence Alzheimerova typu a behaviorální formy frontotemporální demence
- Česká tréninková verze Montrealského kognitivního testu (MoCA‑ CZ1) k časné detekci Alzheimerovy nemoci
- Repetitivní transkraniální magnetická stimulace v léčbě depresivní poruchy – randomizovaná, jednoduše slepá, antidepresivy kontrolovaná studie
- Výsledky operační léčby adenomů hypofýzy na Neurochirurgické klinice FN Olomouc
- Endoskopická endonazální technika v léčbě kraniofaryngeomů
- Neuroborrelióza imitující mozkový nádor u dětí a vice versa
- Anti‑N‑ metyl‑ D‑ aspartát receptorová encefalitida
- Asymetrie trojklaného nervu u klasické neuralgie trigeminu – zhodnocení pomocí magnetické rezonance
- Standardizace české verze testu Londýnské věže – administrace, skórování, validita
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Česká tréninková verze Montrealského kognitivního testu (MoCA‑ CZ1) k časné detekci Alzheimerovy nemoci
- Leukodystrofie – klinické a rádiologické aspekty
- Bariéry nervového systému za fyziologických a patologických stavů
- Chirurgická léčba supratentoriálních kortiko‑ subkortikálních kavernomů

