Výskyt a rizikové faktory neprovokovaných epileptických záchvatů u pacientů po ischemické cévní mozkové příhodě
Occurrence and risk factors of unprovoked epileptic seizures in ischaemic stroke patients
Aim: The aim of our study was to determine the occurrence of unprovoked epileptic seizures in ischaemic stroke (IS) patients and compare their association with SeLECT score risk factors (IS severity, large-artery atherosclerosis, acute symptomatic epileptic seizures in association with the initial IS, cortical localization of the lesion, the involvement of the middle cerebral artery territory).
Patients and methods: Retrospective analysis of consecutive supratentorial IS survivors with a negative history of epilepsy, admitted to two major comprehensive stroke centers in the Czech Republic and Austria in one year period (2015). The follow-up information was collected from available medical documentation, using a structured telephone questionnaire and patients visits.
Results: 315 patients were included (59% men, median age 69 years, median National Institutes of Health Stroke Scale 4, intravenous thrombolysis 29.2%, mechanical thrombectomy 6.3%). Unprovoked epileptic seizures occurred in 24 patients (7.6%), the median follow-up period was 3.3 years. The seizure and seizure-free groups differed significantly in cortical involvement of the ischaemic lesion (70.8 vs. 38.5%; P = 0.002), a significant difference in the rest of SeLECT score risk factors was not found.
Conclusions: Unprovoked epileptic seizures occurred in 7.6% of IS survivors during the median follow-up period of 3.3 years. Cortical involvement of the ischaemic lesion was the only SeLECT score parameter with a significant difference between seizure and seizure-free groups.
Keywords:
risk factor – incidence – ischaemic stroke – unprovoked seizure – post-stroke epilepsy
Authors:
P. Janský 1; T. Růžičková 1; ; A. Olšerová 1; J. Reichl 2; M. S. Vosko 3; L. Šťovíčková 1; J. Paulasová-Schwabová 1; V. Šulc 1; H. Magerová 1; A. Kalina 1; D. Kala 4; J. Otáhal 4; P. Marusič 1; M. R. Vosko 4; A. Tomek
Authors‘ workplace:
Department of Neurology, Second, Faculty of Medicine, Charles University and Motol University Hospital, Prague, Czech Republic
1; Department of Neurology 2, Kepler, Universitätsklinikum, Med Campus III, Linz, Austria
2; Technical University of Munich, School of Medicine, Germany
3; Institute of Physiology, Czech, Academy of Sciences, Prague, Czech, Republic
4
Published in:
Cesk Slov Neurol N 2020; 83/116(3): 278-284
Category:
Original Paper
doi:
https://doi.org/10.14735/amcsnn2020278
Overview
Cíl: Popsat výskyt neprovokovaných epileptických záchvatů u pacientů po ischemické CMP (iCMP) a porovnat jejich asociaci s rizikovými faktory skóre SeLECT (tíže iCMP, onemocnění velkých tepen, výskyt akutních symptomatických epileptických záchvatů v souvislosti s iniciální iCMP, kortikální lokalizace léze, postižení povodí střední mozkové tepny).
Soubor a metodika: Retrospektivní analýza konsekutivních pacientů se supratentoriální iCMP s negativní anamnézou epilepsie přijatých během roku 2015 do dvou komplexních cerebrovaskulárních center v ČR a Rakousku. Informace o výskytu záchvatů během sledovaného období byly získány z dostupné lékařské dokumentace, prostřednictvím strukturovaného telefonního dotazníku a osobních návštěv pacientů.
Výsledky: Zařazeno bylo 315 pacientů (59 % muži, medián věku 69 let, medián vstupního National Institutes of Health Stroke Scale 4, intravenózní trombolýza 29,2 %, mechanická trombektomie 6,3 %). Neprovokované epileptické záchvaty byly při mediánu sledování 3,3 roku zaznamenány u 24 (7,6 %) pacientů. Pacienti s neprovokovanými záchvaty měli oproti ostatním signifikantně častěji kortikální lokalizaci ischemické léze (70,8 vs. 38,5 %; p = 0,002), ve výskytu ostatních rizikových parametrů skóre SeLECT se tyto dvě skupiny nelišily.
Závěr: Kumulativní incidence neprovokovaných epileptických záchvatů byla 7,6 % při mediánu sledování 3,3 roku od iCMP. Jediným parametrem skóre SeLECT, kterým se pacienti s neprovokovanými záchvaty od zbytku kohorty odlišovali, byla kortikální lokalizace ischemické léze.
Klíčová slova:
ischemická cévní mozková příhoda – neprovokovaný záchvat – vaskulární epilepsie – rizikový faktor – incidence
Úvod
Vzhledem k pokroku terapeutických možností v léčbě akutní ischemické CMP (iCMP) klesá časná mortalita a zároveň roste počet pacientů přežívajících s možným rozvojem pozdních komplikací iCMP. Jedním z takových významných následků se zvýšenou následnou morbiditou i mortalitou je výskyt neprovokovaných epileptických záchvatů [1]. Ischemická CMP je příčinou téměř 50 % nově zaznamenaných epileptických záchvatů u pacientů nad 60 let [2] a celkově je zodpovědná až za 11 % případů epilepsie v dospělosti [3]. Diagnózu strukturální epilepsie po CMP (post-stroke epilepsy, v tomto významu dále v textu užíváno spojení vaskulární epilepsie) lze stanovit již při výskytu jednoho neprovokovaného epileptického záchvatu po CMP, neboť v této situaci je splněna podmínka pro diagnózu epilepsie, tedy že pravděpodobnost opakování záchvatu v následujících 10 letech je více než 60 % [4]. To ve studii ukázali autoři Hesdorffer et al [5], když popsali, že pravděpodobnost recidivy po prvním neprovokovaném záchvatu po CMP je 71,5 % (59,7–81,9 %). Neprovokovaný záchvat je takový, který nastane více než 7 dní od CMP záchvaty vyskytující se do 7 dní od CMP jsou považovány za akutní symptomatické. Toto rozlišení má význam pro terapeutický přístup – kdy pacienti s akutními symptomatickými záchvaty nevyžadují dlouhodobé užívání antiepileptik, naopak u pacientů po prvním neprovokovaném záchvatu po CMP by terapie měla být nasazena [6].
Údaje o prevalenci záchvatů po CMP se v literatuře pohybují v rozmezí 2–20 %, s vyššími hodnotami u hemoragií a subarachnoidálního krvácení [7]. Takto velké rozmezí hodnot mezi jednotlivými studiemi je dáno výraznou variabilitou ve zvolené definici epilepsie, charakteristik záchvatů, doby sledování či zahrnutím různých typů CMP. V nejrozsáhlejší metaanalýze, zahrnující všechny typy CMP, na více než 102 000 pacientech ukázali Zou et al prevalenci záchvatů blížící se 7,0 % [8]. Vedle toho Wang et al do metaanalýzy zahrnuli 34 502 pacientů pouze po iCMP a popsali výskyt záchvatů (akutních symptomatických i neprovokovaných) u 5,7 % pacientů, odpovídající incidenci 18 / 1 000 osoboroků [9]. V jedné z největších multicentrických studií na pacientech po iCMP Bladin et al zaznamenali v rámci 9měsíčního sledování kumulativní incidenci neprovokovaných záchvatů 3,8 % [10].
Etiopatogeneticky se na rozvoji vaskulární epilepsie podílí řada faktorů a mechanismů strukturální a funkční přestavby poškozené mozkové tkáně vedoucí k trvalým změnám v excitabilitě neuronů i ke změnám v konektivitě neuronové sítě [11]. K takovým mechanismům patří tvorba gliových jizev, chronický zánět, angiogeneze, neurodegenerace, změna synaptické plasticity či změny exprese iontových kanálů. V rozvoji akutních symptomatických záchvatů se uplatňují zejména důsledky hypoxie a metabolické dysbalance, poruchy hematoencefalické bariéry, glutamátové excitotoxicity či dysfunkce iontových kanálů [12].
K odhadu rizika rozvoje vaskulární epilepsie byla identifikována řada rizikových faktorů. K nejvýznamnějším patří hemoragická CMP, u iCMP potom, hemoragická transformace ischemického ložiska [13], kortikální lokalizace léze [14], léze v karotickém povodí [15] či v povodí střední mozkové tepny [16], dále tíže iCMP (vyjádřená skórem National Institutes of Health Stroke Scale [NIHSS]) [17], mladší věk [18], výskyt akutních symptomatických záchvatů [19], demence [20] i některé genetické faktory [21]. Snaha integrovat jednotlivé rizikové faktory a podpořit tak jejich prediktivní hodnotu vedla k tvorbě prognostických modelů. V roce 2010 bylo představeno prognostické skóre PoSERS [22], které bylo založeno jen na malém souboru a nebylo validováno. Dosud nejrobustnějším prediktivním nástrojem je skóre SeLECT [23] představené Galovicem et al v roce 2018. Název SeLECT je akronymem pěti rizikových faktorů využitých k jeho výpočtu: tíže iCMP, přítomnosti onemocnění velkých tepen, výskytu akutních symptomatických záchvatů v souvislosti s iniciální iCMP, kortikální lokalizace léze, postižení povodí střední mozkové tepny. Jednotlivým rizikovým faktorům jsou přiřazeny body, jejichž součtem získáme konečnou hodnotu skóre (tab. 1). S vyšší hodnotou skóre stoupá riziko neprovokovaných záchvatů. Hodnota nula bodů představuje 1,3% riziko (95% CI 0,7–1,8) rozvoje vaskulární epilepsie během 5 let, zatímco hodnota devět bodů 63% riziko (95% CI 62–93).
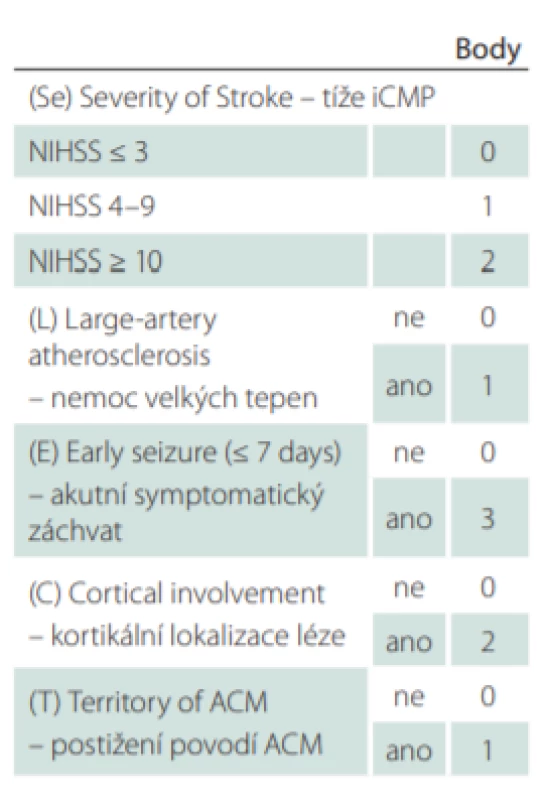
Cílem naší práce je popsat na retrospektivní kohortě výskyt neprovokovaných epileptických záchvatů u pacientů po iCMP a porovnat jejich asociaci s rizikovými faktory skóre SeLECT.
Soubor a metodika
Do studie byli zařazeni dospělí pacienti po prodělané iCMP, kteří byli konsekutivně hospitalizovaní během roku 2015 ve dvou komplexních cerebrovaskulárních centrech v ČR a v Rakousku. V obou zařízeních byl dotazem na nemocniční informační systém získán seznam hospitalizací s vykázaným kódem Mezinárodní klasifikace nemocí pro iCMP (I63.x). V tomto seznamu byli manuálně identifikováni jednotliví pacienti, kteří prodělali akutní či subakutní iCMP. Pro potřeby studie byli vstupně vyloučeni pacienti s anamnézou epilepsie (pacienti s anamnézou akutních symptomatických záchvatů ponecháni) či léčbou antiepileptiky (pacienti užívající gabapentin, pregabalin a benzodiazepiny z jiné než epileptické indikace ponecháni), dále byli vyloučeni pacienti s izolovanou infratentoriální iCMP a pacienti zemřelí do 2 týdnů od iCMP.
Dotazník a sledování pacientů
Hlavním zdrojem pro informace během sledování pacientů byl strukturovaný telefonický rozhovor s pacientem či členem jeho domácnosti. Rozhovor vycházel z upravené verze dotazníku pro pacienty s epilepsií (tab. 2), již využívaného v klinické praxi českého pracoviště. Dále byl v dotazníku zjišťován výskyt recidivy iCMP či tranzitorní ischemické ataky (TIA). Česká i německá verze dotazníku byla administrována pro tyto účely vyškolenými studenty lékařských fakult. Hovory probíhaly v období od dubna 2018 do října 2019. V případě podezření na výskyt epileptického záchvatu nebo nejasností v průběhu rozhovoru bylo dotazování opakováno lékařem. Pacienti s pozitivním výsledkem dotazníku byli pozváni na neurologické vyšetření. U pacientů s výraznějším neurologickým deficitem po iCMP, který mohl komplikovat určení případného záchvatu, byla identifikace záchvatu posuzována v rámci širšího lékařského týmu. K vyloučení akutního symptomatického záchvatu při recidivě iCMP bylo v případě důvodného podezření provedeno zobrazovací a laboratorní vyšetření. Pacientům bez telefonního kontaktu byl dotazník zaslán dopisem. V případě nedostupnosti pacienta (informace o úmrtí, odmítnutí rozhovoru, nezastižení na telefonu třikrát v různé dny a časy, bez odpovědi na dopis) byl kontaktován praktický lékař či bylo využito lékařské dokumentace v nemocničním informačním systému. Lékařská dokumentace bez zmínky o proběhlých záchvatech byla považována za dostatečný zdroj, pokud byla z neurologické kliniky či z hospitalizace na interní klinice a alespoň v odstupu 1 roku od iCMP. Pacienti, u kterých nebylo možné žádným z těchto prostředků prověřit výskyt záchvatů, byli ze studie vyloučeni. V rakouské kohortě byly možné zdroje informací pro sledování cílových událostí omezenější, vedle telefonických rozhovorů to byla nemocniční dokumentace, jiné možnosti k dispozici nebyly.

Sběr a statistické vyhodnocení dat
Z nemocničních informačních systémů byla retrospektivně zjištěna data týkající se iniciální hospitalizace. Sbírána byla data z několika okruhů: data týkající se iCMP, rizikové faktory epilepsie, cévní rizikové faktory, medikace, laboratorní hodnoty, výskyt akutních symptomatických záchvatů. Pro potřeby této práce byly vyhodnocovány zejména parametry skóre SeLECT (tíže iCMP, onemocnění velkých tepen, výskyt akutních symptomatických záchvatů v souvislosti s iniciální iCMP, kortikální lokalizace léze, postižení povodí střední mozkové tepny). Data pacientů byla uložena v databázovém systému REDCap (Research Electronic Data Capture [Vanderbilt University, Nashville, TN, USA]). Statistické zpracování získaných dat bylo provedeno s využitím statistického softwaru SPSS Statistics 25 (IBM, Armonk, NY, USA). Deskriptivní statistika byla použita pro charakteristiku všech pacientů, podskupin pacientů dle rozvoje vaskulární epilepsie a dle zařazujícího pracoviště. Zhodnocení statistické významnosti rozdílu bylo provedeno mezi podskupinami s vaskulární epilepsií a bez rozvoje neprovokovaných záchvatů, sledované parametry byly hodnoceny pomocí chí-kvadrát testu, exaktního Fisherova testu nebo Mann-Whitneyova testu podle charakteru proměnných.
Použité definice, škály, klasifikace
Vaskulární epilepsie byla identifikována při výskytu alespoň jednoho neprovokovaného záchvatu v odstupu alespoň 7 dní od iCMP. Záchvaty byly určeny dle klasifikace Mezinárodní ligy proti epilepsii (International League Against Epilepsy; ILAE) 2017 [24]. Etiologie iCMP byla klasifikována dle studie Trial of Org 10172 in Acute Stroke Treatment (TOAST) [25]. Tíže postižení po iCMP byla vyjádřena pomocí škály NIHSS [26].
Výsledky
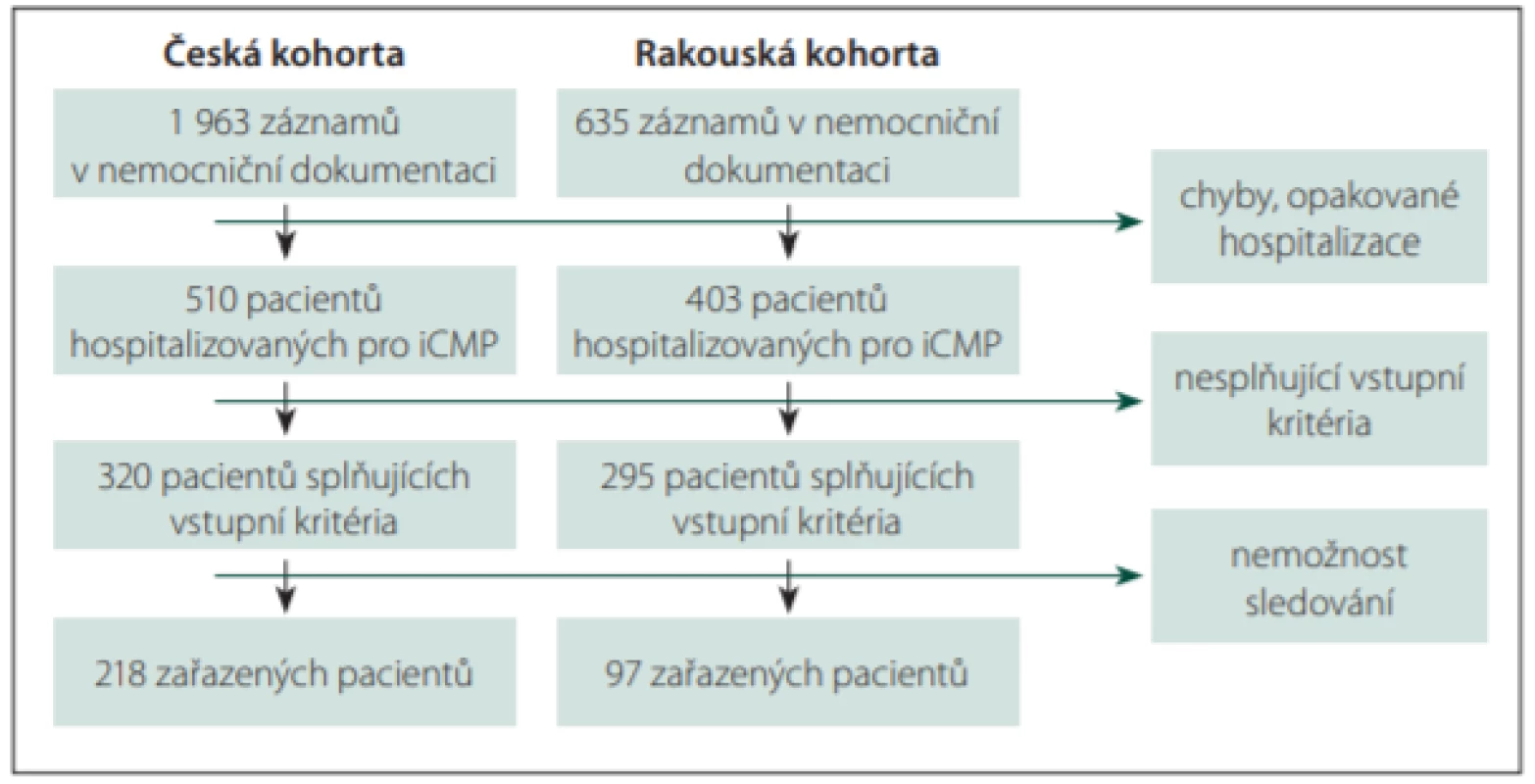
Po vyloučení chybně kódovaných, duplicitních a jiných nevalidních hospitalizací bylo identifikováno 510 pacientů hospitalizovaných pro iCMP v roce 2015 v české větvi a 403 v rakouské větvi (obr. 1). Z české kohorty 190 pacientů nesplnilo vstupní kritéria, z toho 128 pacientů pro přítomnost izolované infratentoriální léze, 14 pacientů pro anamnézu či aktuální terapii epilepsie, dalších 48 pacientů pak zemřelo do dvou týdnů od iCMP. 108 pacientů z rakouské kohorty nesplnilo vstupní kritéria, z toho 80 pacientů kvůli přítomnosti izolované infratentoriální léze, 6 pacientů kvůli anamnéze či aktuální terapii epilepsie, 22 pacientů kvůli úmrtí do 2 týdnů od iCMP. Z 320 pacientů v české kohortě, kteří splnili vstupní kritéria, bylo kvůli nemožnosti sledování vyloučeno 102 pacientů, u kterých chyběly kontakt na praktického lékaře či kvalitní dokumentace ze sledovaného období a zároveň se odmítli účastnit dotazníku (24 pacientů) či zemřeli nebo na ně neexistoval žádný kontakt (78 pacientů, z toho 25 obesláno dopisem). Z rakouské kohorty bylo takto vyloučeno celkem 198 pacientů z 295 splňujících vstupní kritéria.
Fig. 1. Patient population identification.
Charakteristika souboru
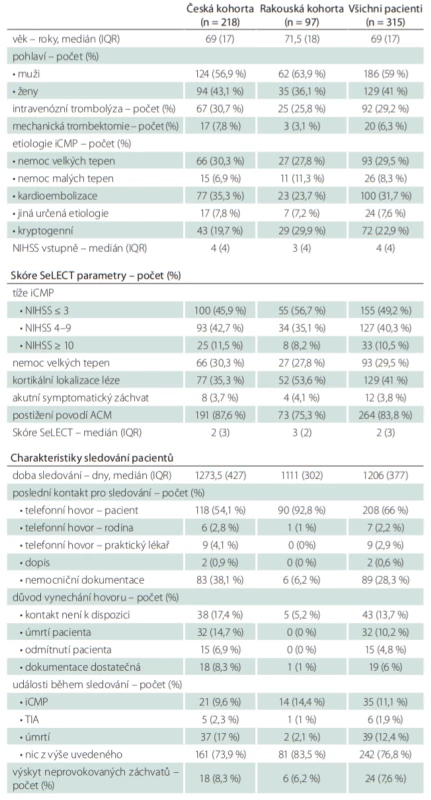
Zařazeno bylo tedy celkem 315 pacientů (218 českých a 97 rakouských), z toho 59 % mužů, věkový medián byl 69 let (interquartile range; IQR 17), medián NIHSS 4 (IQR 4), intravenózní trombolýza byla provedena u 29,2 % pacientů, mechanickou trombektomii podstoupilo 6,3 % pacientů (tab. 3). Etiologie iCMP byla nejčastěji stanovena jako kardioembolizační (31,7 %), dále nemoc velkých tepen (29,5 %), kryptogenní (22,9 %), nemoc malých tepen (8,3 %) a jiná určená etiologie (7,6 %). NIHSS ≤ 3 bylo zaznamenáno u 49,2 % pacientů, NIHSS 4–9 u 40,3 % pacientů, NIHSS ≥ 10 u 10,5 %, kortikální lokalizace ischemické léze byla identifikována u 41 % pacientů, akutní symptomatické záchvaty v souvislosti s iCMP byly zaznamenány u 3,8 % pacientů, povodí arteria cerebri media (ACM) bylo postiženo v 83,8 % případů. Klinickými charakteristikami souboru i parametry skóre SeLECT se česká a rakouská větev mírně lišily, v rakouské kohortě byla zaznamenána významnější převaha mužů (63,9 vs. 56,9 %), bylo provedeno méně intravenózních trombolýz (25,8 vs. 30,7 %), provedeno méně mechanických trombektomií (3,1 vs. 7,8 %), etiologie iCMP byla určena méně často jako kardioembolizační (23,7 vs. 35,3 %), naopak častěji jako kryptogenní (29,9 vs. 19,7 %), pacienti se prezentovali lehčím postižením (NIHSS ≤ 3 56,7 vs. 45,9 %), měli častěji kortikální lézi (53,6 vs. 35,3 %) a méně často postižení povodí ACM (75,3 vs. 87,6 %). Medián vypočítané hodnoty skóre SeLECT dosahoval u české kohorty dvou (IQR 3), u rakouské kohorty tří (IQR 2), pro celý soubor dvou (IQR 3). Během sledování s mediánem délky 1 206 dní (IQR 377) byly neprovokované záchvaty zachyceny celkem u 7,6 % pacientů. Větší podíl výskytu neprovokovaných záchvatů byl zaznamenán v české kohortě (8,3 vs. 6,2 %). Recidivu iCMP prodělalo 11,1 % pacientů, TIA 1,9 % pacientů. 12,4 % pacientů během sledovaného období zemřelo. Česká větev zaznamenala oproti rakouské více úmrtí (17,1 vs. 2,1 %) a méně recidiv iCMP (9,6 vs. 14,4 %).
Charakteristika zachycených záchvatů
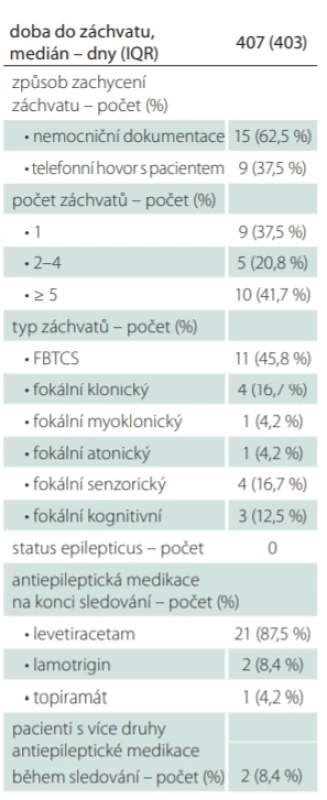
Z 24 pacientů se zachycenými neprovokovanými záchvaty (v české kohortě 18 pacientů, v rakouské 6 pacientů) byl záchvat identifikován u 15 pacientů (62,5 %) z nemocniční dokumentace, u 9 (37,5 %) pomocí telefonního dotazníku. U rakouské kohorty převažoval jako zdroj informace o záchytu záchvatu telefonní dotazník nad nemocniční dokumentací (83,3 vs. 16,7 %), u české naopak dominovala jako zdroj nemocniční dokumentace (77,8 vs. 22,2 %). U 10 pacientů s pozitivním výsledkem dotazníku se záchvaty po kontrole v ambulanci nepotvrdily. Příčinou příznaků napodobujících možné epileptické záchvaty byly nejčastěji projevy spasticity, dále např. důsledky lehkého mozkového poranění, syndrom karpálního tunelu či projevy neuropatie.
Medián doby do neprovokovaného záchvatu byl 407 dní (IQR 403). Tab. 4 shrnuje charakteristiku zachycených záchvatů. Nejčastěji byl zachycen záchvat fokální přecházející do bilaterálního tonicko-klonického (11 pacientů; 45,8 %). Z fokálních záchvatů bez motorických projevů (7 pacientů; 29,2 %) byly popsány záchvaty senzorické a kognitivní, z fokálních motorických (6 pacientů; 25 %) záchvaty klonické, atonické a myoklonické. Status epilepticus, vč. nonkonvulzivního, zaznamenán nebyl. Všem pacientům se zachycenými záchvaty byla nasazena antiepileptická medikace, nejčastěji levetiracetam (21 pacientů; 87,5 %), dále lamotrigin (2 pacienti; 8,4 %) a topiramát (1 pacient; 4,2 %). U dvou pacientů bylo nutné druh nasazené antiepileptické medikace během doby sledování měnit.
Rizikové faktory vaskulární epilepsie
Medián vypočítaných hodnot skóre SeLECT (tab. 5) u pacientů s vaskulární epilepsií byl čtyři (IQR 3), u pacientů bez záchytu neprovokovaných záchvatů byl medián skóre SeLECTdva (IQR 3), tento rozdíl byl statisticky významný (p = 0,002). Pacienti s neprovokovanými záchvaty měli oproti ostatním signifikantně častěji kortikální lokalizaci léze (70,8 vs. 38,5 %; p = 0,002). Ve skupině s neprovokovanými záchvaty byly zaznamenány častěji vyšší hodnoty vstupního skóre NIHSS, tento rozdíl ale nebyl statisticky významný (medián 6 vs. 4; p = 0,062). Ve výskytu ostatních rizikových faktorů skóre SeLECT a základních klinických charakteristik se tyto dvě skupiny nelišily. Počty iCMP, TIA ani úmrtí během doby sledování nebyly signifikantně odlišné u pacientů s vaskulární epilepsií a pacientů bez záchytu neprovokovaných záchvatů.
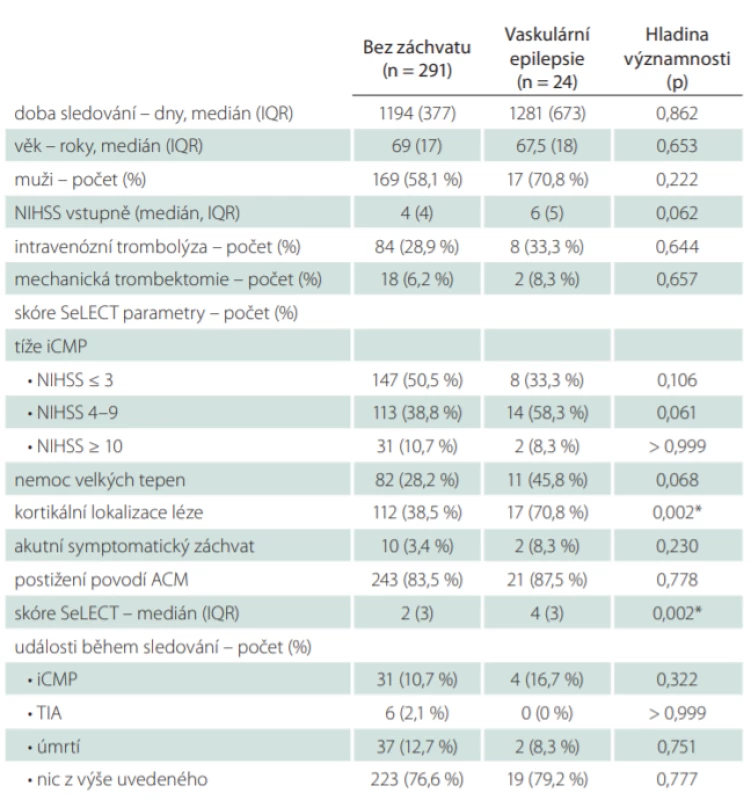
ACM – arteria cerebri media; iCMP – ischemická CMP; IQR – kvartilové rozpětí; NIHSS – National Institutes of Health Stroke Scale; TIA – tranzitorní ischemická ataka
Diskuze
Hlavním cílem této retrospektivní analýzy bylo popsat výskyt neprovokovaných záchvatů po iCMP. Zjištěná kumulativní incidence 7,6 %, odpovídající incidenci 23/1 000 osoboroků, se v kontextu ostatních studií na pacientech po iCMP pohybuje kolem horní hranice dříve popsaných hodnot. Porovnání studií je však komplikované pro jejich metodickou různorodost, některé studie využívají starší definici epilepsie, kdy pro její diagnózu bylo nutné zaznamenat výskyt alespoň dvou neprovokovaných záchvatů, studie se liší v délce sledování, ve vstupních a vylučovacích kritériích. V největší dostupné metaanalýze byl popsán výskyt záchvatů po iCMP u 5,7 % pacientů, odpovídající incidenci 18/1 000 osoboroků [9], zahrnovala ovšem akutní symptomatické i neprovokované záchvaty a u některých zařazených studií chyběl údaj o délce sledování. V jedné z největších multicentrických prospektivních studiích na pacientech po iCMP zaznamenali po 9 měsících sledování Bladin et al prevalenci neprovokovaných záchvatů 3,8 %, po započítání i akutních symptomatických záchvatů byl pak popsán celkový výskyt záchvatů u 8,6 % pacientů [10]. Retrospektivním charakterem, délkou sledování i vstupními kritérii se naší studii nejvíce blíží recentní švédská studie vycházející z dat 240 pacientů švédského registru (Swedish Stroke Registry), kde při mediánu sledování 2,9 roku byla kumulativní incidence 5,4 %, odpovídající incidenci 23/1 000 osoboroků [27], hodnotě shodné s výsledkem naší studie. Německá prospektivní studie na 1 815 pacientech popsala během 2letého sledování 8,2% kumulativní incidenci neprovokovaných záchvatů [28]. S délkou sledování samozřejmě roste kumulativní incidence, bylo ale ukázáno, že největší množství neprovokovaných záchvatů je zaznamenáno v prvním roce od iCMP [29]. V práci Galovice et al, představující skóre SeLECT [23], byly použity celkem čtyři kohorty – švýcarská derivační (1 200 pacientů, medián sledování 2,3 roku, kumulativní incidence záchvatů 6 %, sledování pomocí telefonních dotazníků a osobních návštěv) a tři validační – rakouská (459 pacientů, medián sledování 0,8 roku, kumulativní incidence záchvatů 7 %, sledování pomocí osobních návštěv), německá (311 pacientů, medián sledování 1,9 let, kumulativní incidence záchvatů 7 %, sledování pomocí telefonních dotazníků) a italská (399 pacientů, medián sledování 2 roky, kumulativní incidence záchvatů 3 %, sledování pomocí osobních návštěv). Nižším hodnotám kumulativní incidence ve všech těchto kohortách oproti naší studii odpovídají kratší doba sledování a také přísnější vylučovací kritéria, kdy byli vyloučení pacienti s anamnézou předchozí iCMP, výskytem iCMP během sledování, intrakraniálním nádorem, anamnézou operace mozku, anamnézou traumatu mozku a přítomností jiných abnormalit (hydrocefalus, vaskulitida, aneurysma a jiné). V naší studii jsme pacienty s těmito komorbiditami ponechali, jejich výskyt byl však zaznamenán pro potřeby dalších analýz. Snahou bylo takto zahrnout méně selektovanou skupinu pacientů, jejíž složení lépe odpovídá klinické praxi.
Dalším cílem této studie bylo ověřit asociaci skóre SeLECT a jeho jednotlivých rizikových faktorů s výskytem neprovokovaných záchvatů po iCMP. Stejně jako ve třech validačních studiích Galovice et al [23] i na našem souboru se potvrdily statisticky signifikantní rozdíly v mediánu hodnoty skóre mezi skupinou s rozvojem vaskulární epilepsie a skupinou bez záchvatů. Z jednotlivých rizikových faktorů, z nichž se skóre skládá, pak byl zaznamenán pouze signifikantní rozdíl ve výskytu kortikálních lézí (u skupiny s vaskulární epilepsií 4 vs. 2; p = 0,002), což odpovídá již popsaným výsledkům [27] a logicky vychází z představy o epileptogenezi po iCMP.
Silnou stránkou naší studie je propracovaná metodika retrospektivního záchytu záchvatů, využívající veškeré teoreticky možné způsoby získání informace o pacientovi (telefonní dotazník, dopis, lékařská dokumentace, oslovení praktického lékaře). Výhodou studie je využití dvou nezávislých kohort z různých pracovišť umožňující porovnat výsledky mírně odlišné metodiky při sledování pacientů, kdy absence možnosti kontaktovat praktického lékaře, odeslat dopis pacientovi a omezené možnosti přístupu k lékařské dokumentaci byly patrně hlavním důvodem k nižší zaznamenané hodnotě kumulativní incidence neprovokovaných záchvatů v rakouské kohortě oproti české (6,2 vs. 8,3 %).
Základní limitací studie je její retrospektivní charakter, který nutně vede k nekompletnosti sbíraných dat a ztrátě pacientů během sledovaného období. Pro nedostatek údajů během sledování bylo vyloučeno 102 pacientů z české kohorty a 198 pacientů z rakouské, kde byly možnosti zjistit informace o zemřelých pacientech omezené. Proto byl také zaznamenán nízký počet úmrtí během sledování v rakouské kohortě. Limitací je též absence validační studie dotazníku na identifikaci záchvatů. Jeho pozitivní prediktivní hodnota byla 47,3 %. Vliv falešné pozitivity dotazníku byl eliminován při pohovorech pacientů s lékařem. Určitou roli, podceňující výskyt záchvatů, hraje také selekční bias, kdy pacienti s těžším postižením v důsledku iCMP časněji umírají a hůře spolupracují během sledování. U některých pacientů nebylo k dispozici vyšetření mozku magnetickou rezonancí, hodnocení CT tak mohlo v těchto případech vést např. k nepřesnostem v určení kortikální lokalizace ischemického ložiska.
Závěr
Výsledky naší studie potvrzují poměrně častý výskyt neprovokovaných záchvatů, a tedy dle nové definice rozvoj vaskulární epilepsie po iCMP. Kumulativní incidence dosahovala 7,6 % při mediánu sledování 3,3 roku, odpovídající incidenci 23/1 000 osoboroků. Nejvýznamnějším rizikovým faktorem rozvoje vaskulární epilepsie je kortikální lokalizace ischemického ložiska. Prediktivní nástroje, jako je skóre SeLECT, mohou být využity k určení rizika rozvoje neprovokovaných záchvatů po iCMP na základě jednoduchých a v klinické praxi dostupných údajů. Pacienti se zjištěným zvýšeným rizikem tak mohou být pod větší kontrolou, realizovanou i s možným využitím strukturovaného telefonního dotazníku na výskyt záchvatů. Dalším uplatněním prediktorů může být v budoucnu např. jejich využití při náboru do klinického hodnocení léčivých látek s potenciálním antiepileptogenním účinkem.
Etické principy
Studie byla provedena ve shodě s Helsinskou deklarací z roku 1975 (a jejími revizemi z let 2004 a 2008). Studie byla schválena lokální Etickou komisí FN Motol (31.1.2018, EK 111/18). Souhlas pacientů se získáním a zpracováním informací o jejich zdravotním stavu pro potřeby studie byl získán telefonicky, v případě nedostupnosti telefonického kontaktu potom vzhledem k retrospektivnímu charakteru studie souhlas získán nebyl. Databáze byla vedena pod anonymizovanými identifikátory pacientů.
Grantová podpora
Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. AZV 15-33115A.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
MUDr. Petr Janský
Department of Neurology Second Faculty of Medicine Charles University Motol University Hospital
V Úvalu 84,
150 06 Prague
Czech Republic
e-mail: petr.jansky2@fnmotol.cz
Přijato k recenzi: 26. 1. 2020
Přijato do tisku: 28. 4. 2020
Sources
1. Huang CW, Saposnik G, Fang J et al. Influence of seizures on stroke outcomes: a large multicenter study. Neurology 2014; 82 (9): 768–776. doi: 10.1212/WNL.000000 0000000166.
2. Yang H, Rajah G, Guo A et al. Pathogenesis of epileptic seizures and epilepsy after stroke. Neurol Res 2018; 40 (6): 426–432. doi: 10.1080/01616412.2018.1455014.
3. Hauser WA, Annegers JF, Kurland LT. Incidence of epilepsy and unprovoked seizures in Rochester, Minnesota: 1935–1984. Epilepsia 1993; 34 (3): 453–458. doi: 10.1111/j.1528-1157.1993.tb02586.x.
4. Fisher RS, Acevedo C, Arzimanoglou A et al. ILAE Official Report: a practical clinical definition of epilepsy. Epilepsia 2014; 55 (4): 475–482. doi: 10.1111/epi.12550.
5. Hesdorffer DC, Benn EK, Cascino GD et al. Is a first acute symptomatic seizure epilepsy? Mortality and risk for recurrent seizure. Epilepsia 2009; 50: 1102–1108. doi: 10.1111/j.1528-1167.2008.01945.x.
6. Beghi E, Carpio A, Forsgren L et al. Recommendation for a definition of acute symptomatic seizure. Epilepsia 2010; 51 (4): 671–675. doi: 10.1111/j.1528-1167.2009.02285.x.
7. Doria JW, Forgacs PB. Incidence, implications, and management of seizures following ischemic and hemorrhagic stroke. Curr Neurol Neurosci Rep 2019; 19 (7): 37. doi: 10.1007/s11910-019-0957-4.
8. Zou S, Wu X, Zhu B et al. The pooled incidence of post-stroke seizure in 102 008 patients. Top Stroke Rehabil 2015; 22 (6): 460–467. doi: 10.1179/1074935715Z.00000000062.
9. Wang JZ, Vyas MV, Saposnik G et al. Incidence and management of seizures after ischemic stroke: systematic review and meta-analysis. Neurology 2017; 89 (12): 1220–1228. doi: 10.1212/WNL.0000000000004407.
10. Bladin CF, Alexandrov AV, Bellavance A et al. Seizures after stroke: a prospective multicenter study. Arch Neurol 2000; 57 (11): 1617–1622. doi: 10.1001/archneur.57.11.1617.
11. Altman K, Shavit-Stein E, Maggio N. Post Strokeseizures and epilepsy: from proteases to maladaptive plasticity. Front Cell Neurosci 2019; 13: 397. doi: 10.3389/fncel.2019.00397.
12. Tanaka T, Ihara M. Post-stroke epilepsy. Neurochem Int 2017; 107: 219–228. doi: 10.1016/j.neuint.2017.02.002.
13. Leone MA, Tonini MC, Bogliun G et al. Risk factors for a first epileptic seizure after stroke: a case control study. J Neurol Sci 2009; 277 (1–2): 138–142. doi: 10.1016/j.jns.2008.11.004.
14. Silverman IE, Restrepo L, Mathews GC. Poststroke seizures. Arch Neurol 2002; 59 (2): 195–201. doi: 10.1001/archneur.59.2.195.
15. De Reuck J, Goethals M, Vonck K et al. Clinical predictors of lateonset seizures and epilepsy in patients with cerebrovascular disease. Eur Neurol 2015; 54 (2): 68–72. doi: 10.1159/000087715.
16. Awada A, Omojola MF, Obeid T. Late epileptic seizures after cerebral infarction. Acta Neurol Scand 1999; 99 (5): 265–268. doi: 10.1111/j.1600-0404.1999.tb00674.x.
17. Conrad J, Pawlowski M, Dogan M et al. Seizures after cerebrovascular events: risk factors and clinical features. Seizure 2013; 22 (4): 275–282. doi: 10.1016/j.seizure.2013.01.014.
18. Graham NS, Crichton S, Koutroumanidis M et al. Incidence and associations of poststroke epilepsy: the prospective south london stroke register. Stroke 2013; 44 (3): 605–611. doi: 10.1161/STROKEAHA.111.000220.
19. Lamy C, Domigo V, Semah F et al. Early and late seizures after cryptogenic ischemic stroke in young adults. Neurology 2003; 60 (3): 400–404. doi: 10.1212/wnl.60.3.400.
20. Cordonnier C, Henon H, Derambure P et al. Influence of pre-existing dementia on the risk of post-stroke epileptic seizures. J Neurol Neurosurg Psychiatry 2005; 76 (12): 1649–1653. doi: 10.1136/jnnp.2005.064535.
21. Yang H, Song Z, Yang GP et al. The ALDH2 rs671 polymorphism affects post-stroke epilepsy susceptibility and plasma 4- HNE levels. PLoS One 2014; 9 (10): 109634. doi: 10.1371/journal.pone.0109634.
22. Strzelczyk A, Haag A, Raupach H et al. Prospective evaluation of a post-stroke epilepsy risk scale. J Neurol 2010; 257 (8): 1322–1326. doi: 10.1007/s00415-010-5520-9.
23. Galovic M, Döhler N, Erdélyi-Canavese B et al. Prediction of late seizures after ischaemic stroke with a novel prognostic model (the SeLECT score): a multivariable prediction model development and validation study. Lancet Neurol 2018; 17 (2): 143–152. doi: 10.1016/S1474-4422 (17) 30404-0.
24. Scheffer IE, Berkovic S, Capovilla G et al. ILAE classification of the epilepsies: position paper of the ILAE Commission for Classification and Terminology. Epilepsia 2017; 58 (4): 512–521. doi: 10.1111/epi.13709.
25. Adams HP, Bendixen BH, Kappelle LJ et al. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in acute stroke treatment. Stroke 1993; 24 (1): 35–41. doi: 10.1161/01.str.24.1.35.
26. Brott T, Adams HP Jr, Olinger CP et al. Measurements of acute cerebral infarction: a clinical examination scale. Stroke 1989; 20 (7): 864–870. doi: 10.1161/01.str.20.7.864.
27. Hassani M, Cooray G, Sveinsson O et al. Post-stroke epilepsy in an ischemic stroke cohort – incidence and diagnosis. Acta Neurol Scand 2020; 141 (2): 141–147. doi: 10.1111/ane.13174.
28. Jungehulsing GJ, Heuschmann PU, Holtkamp M et al. Incidence and predictors of post-stroke epilepsy. Acta Neurol Scand 2013; 127 (6): 427–430. doi: 10.1111/ane.12070.
29. Pitkanen A, Roivainen R, Lukasiuk K. Development of epilepsy after ischaemic stroke. Lancet Neurol 2016; 15 (2): 185–197. doi: 10.1016/S1474-4422 (15) 00248-3.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2020 Issue 3
- Metamizole vs. Tramadol in Postoperative Analgesia
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Memantine Eases Daily Life for Patients and Caregivers
- Hope Awakens with Early Diagnosis of Parkinson's Disease Based on Skin Odor
Most read in this issue
- Glioblastom grade IV – dlouhodobé přežití
- Bolesti hlavy v graviditě
- Primární progresivní afázie
- Kognitivní poruchy u dětí s epilepsií
