Využití DNA diagnostiky u pacientů s povrchovou keratitidou virového původu
Applying the DNA Diagnostics in Patients with Superficial Keratitis of Viral Origin
Aim:
The authors evaluate the significance of the DNA diagnostics in patients with superficial keratitis of viral origin and their capability to be used for monitoring of the treatment effectiveness in the follow-up. The presence of herpes simplex virus 1 and 2, varicella zoster virus (HSV 1, HSV 2, VZV), and adenoviruses was assessed by means of the DNA analysis.
Material and methods:
The group consisted of 54 patients (33 men and 21 women), mean age 45.6 ± 9.5 years, who were treated at the Eye Department for superficial keratitis or keratouveitis of viral origin. A sample from the involved place was taken with a cotton swab and a sample of approx. 50 μL of tears was taken from the conjunctival sac with a single-use micropipette. The cotton swab and the tears were shaken with the EliDNA Store Kit (ELISABETH PHARMACON, Czech Republic) buffer, which prevents the DNA degradation and allows the storage and transport of samples at the room temperature. After the transportation in to the laboratory, the DNA was isolated by means of the UltraClean DNA Tissue Kit (MoBio, U.S.A.). The isolated DNA was used for HSV 1, HSV 2, VZV, and adenoviruses detection by means of PCR (polymerase chain reaction). All samples were screened for the HSV1 presence using the in-house RealTime method with TaqMan probe and the Applied Biosystems RealTime System 7300 device. In case of positive result of the DNA analysis, control samples were taken in 7 – 10 days periods until negative result was obtained; another sample was taken in case of suspected relapse. The control examination was also performed by means of cultivation from the same sample by another laboratory.
Results:
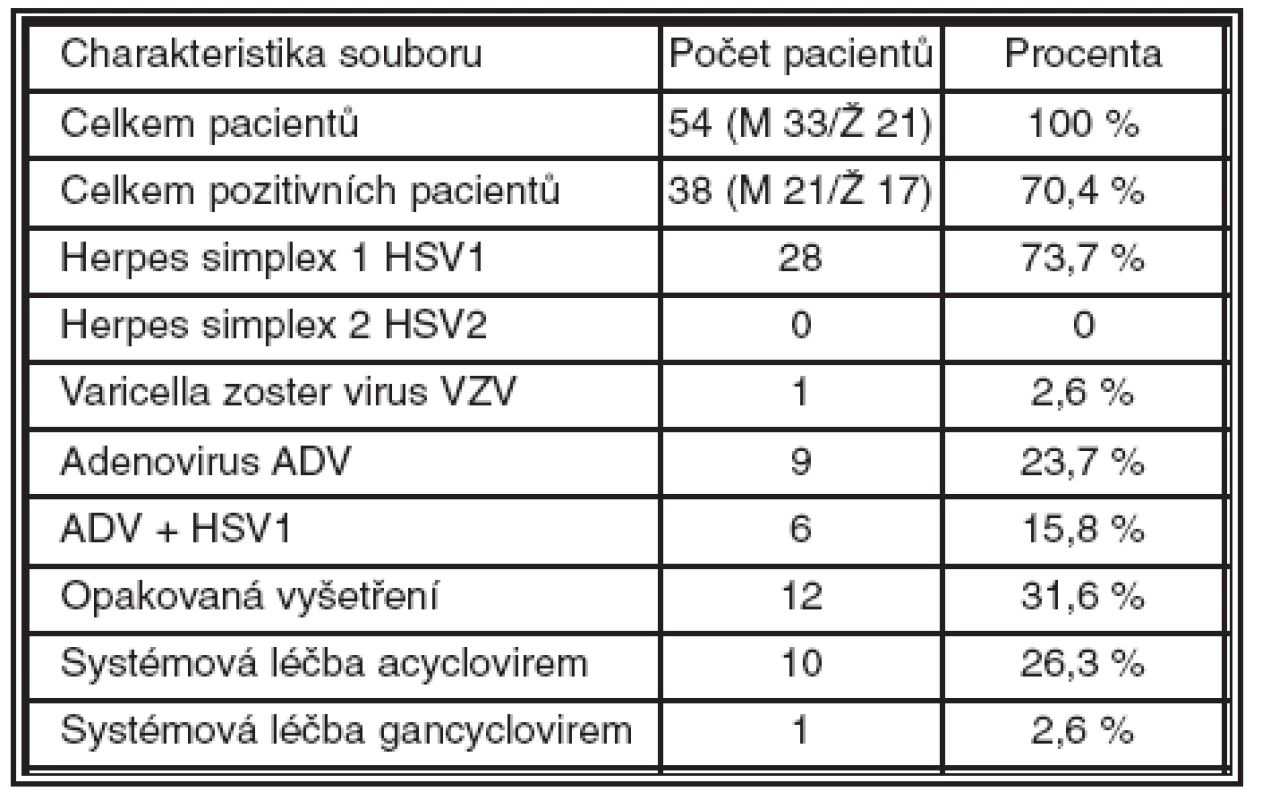
Altogether 82 samples were taken and 230 DNA analyses were performed. The DNA diagnostics proved the presence of HSV 1 DNA in 28 patients, in one case, VZV DNA was detected, and 16 patients were positive on adenoviruses. The HSV 1 positive samples were confirmed by means of in-house RealTime PCR method as well as commercially available in vitro diagnostic healthcare device End-Point PCR HSV1/2 (Nanogen Advanced Diagnostics, Italy). All cultivation control examinations performed in another laboratory were negative. The samples were taken repeatedly in 9 patients to monitor the efficacy of the treatment.
Summary:
The DNA diagnostics seem to be a fast and reliable method to determine the etiological agent in patients with superficial keratitis and allow very accurate monitoring of the treatment efficacy.
Key words:
PCR, keratitis, DNA diagnostics, herpes simplex virus, varicella zoster virus, adenovirus, RealTime
:
Z. Hlinomazová 1; O. Šerý 2; M. Horáčková 1; R. Pitelová 2; V. Loukotová 1; E. Vlková 1
:
Oční klinika LF MU a FN, Brno-Bohunice, přednostka prof. MUDr. Eva Vlková, CSc.
1; Laboratoř DNA diagnostiky, Katedra biochemie, Přírodovědecká fakulta MU, Brno, vedoucí katedry prof. RNDr. Vladimír Mikeš, CSc.
2
:
Čes. a slov. Oftal., 64, 2008, No. 2, p. 47-51
Cíl:
Autoři hodnotí význam DNA diagnostiky u pacientů s povrchovou keratitidou virového původu a její možnosti využití pro sledování účinnosti léčby. DNA analýzou byla stanovena přítomnost virů HSV1, HSV2, VZV a adenovirů.
Materiál a metodika:
Sledovaný soubor tvořilo 54 pacientů (33 mužů a 21 žen) průměrného věku 45,6 ± 9,5 let, kteří byli na naší klinice léčeni pro povrchovou keratitidu či keratouveitidu virového původu. Jednorázovou mikropipetou a vatovým tamponem byl proveden stěr z místa postižení a bylo odebráno cca 50 μl slz ze spojivkového vaku. Tampón i slzy byly protřepány s pufrem EliDNA Store Kit (ELISABETH PHARMACON, ČR), který zabraňuje degradaci DNA a umožňuje skladování a přepravu vzorků při pokojové teplotě. Po transportu do laboratoře byla ze vzorků izolována DNA pomocí kolonek kitem UltraClean DNA Tissue (MoBio, USA). Izolovaná DNA posloužila pro detekci virů HSV1, HSV2, VZV a adenovirů pomocí nested PCR. Všechny vzorky byly dále prověřeny na přítomnost HSV1 in house metodikou RealTime s využitím próby TaqMan a přístroje Applied Biosystems RealTime System 7300. Při zjištění pozitivního výsledku pomocí DNA analýzy byl proveden kontrolní odběr po 7–10denních intervalech do negativního výsledku a dále také při suspektní recidivě onemocnění. Kontrolní vyšetření bylo prováděno také kultivačně ze stejného materiálu jinou laboratoří.
Výsledky:
Celkem bylo provedeno 82 odběrů a 230 DNA analýz. DNA diagnostika prokázala přítomnost HSV1 DNA u 28 pacientů, v jednom případě byla detekována DNA VZV a 16 pacientů bylo pozitivních na ADV. Pozitivita vzorků pro HSV1 byla ověřena in house metodou RealTime PCR i komerčně dostupným in vitro diagnostickým zdravotnickým prostředkem End-Point PCR HSV1/2 (Nanogen Advanced Diagnostics, Itálie). Všechna kontrolní vyšetření prováděná v jiné laboratoři vyšla kultivačně negativní. Opakovaně byla detekce pro monitorování léčby provedena u 9 pacientů.
Závěr:
DNA diagnostika se jeví jako rychlá a účelná metoda zjištění etiologického agens u pacientů s povrchovou keratitidou, která umožňuje velmi přesné monitorování účinnosti léčby.
Klíčová slova:
PCR, keratitida, DNA diagnostika, herpes simplex virus, varicella zoster virus, adenovirus, RealTime
Úvod
Povrchová recidivující keratitida je onemocnění, které může být způsobeno celou řadou faktorů. Častou příčinou jsou infekční záněty především virové etiologie, dále může být způsobena na podkladě imunologickém (Thygessonova keratitida), chemickým, termickým či mechanickým poškozením povrchu rohovky (recidivující eroze) a v neposlední řadě může být projevem povrchových dystrofií rohovky. Diferenciální diagnostika je v některých případech obtížná.
Herpetická povrchová keratitida způsobená herpes simplex virem typ 1, vzácně typem 2, je chronické recidivující onemocnění řadící se k nejčastější příčině „jednooké“ praktické slepoty v civilizovaných zemích. Postižení rohovky může být různé. Nejčastěji probíhá v podobě povrchové keratitidy dendritického či geografického typu.
Varicella zoster virová keratitida či keratouveitida se vyskytuje u dvou třetin nemocných s herpes zoster ophthalmicus, ale může se vyskytovat i samostatně. Klinicky se projevuje povrchovou keratitidou v akutním stadiu, a po 3–4 měsících se může objevit imunitní forma disciformní keratitidy provázena nekrotizující intersticiální keratitidou.
Adenovirová keratokonjunktivitida se řadí mezi nejčastější recidivující oboustranné infekce spojivky a rohovky. Probíhá pod obrazem folikulárního zánětu spojivek, spojeného s povrchovou keratitis punctata v jeho akutní fázi. Druhé stadium probíhá pod obrazem hluboké epiteliální keratitidy a třetí stadium pak pod obrazem subepiteliální imunologické keratitidy. V některých případech může toto recidivují stadium ovlivnit zrakovou ostrost.
Klinické formy výše uvedených keratitid ve své klasické formě se dají dobře diagnostikovat.
Existují faktory měnící klinický obraz nemoci a ovlivňující klinický průběh onemocnění: systémové choroby (diabetes mellitus, autoimunitní onemocnění a další), předešlá medikace (systémová i lokální).
Problematika přesné diagnostiky se zavedením účinné léčby je rozhodující pro maximální možnost zachování dobré zrakové ostrosti. DNA diagnostika prováděná metodou PCR (polymerázové řetězové reakce) je rychlá laboratorní metoda zpřesňující diagnózu. Zároveň umožňuje monitorování účinnosti léčby zvláště u torpidních herpetických recidivujících keratitid, resp. keratouveitid.
Cílem práce bylo zhodnotit význam DNA diagnostiky u pacientů s povrchovou keratitidou virového původu a její možnosti využití pro sledování účinnosti léčby. DNA analýzou byla stanována přítomnost virů HSV1, HSV2, VZV a adenovirů.
Materiál a metodika
Klinická část
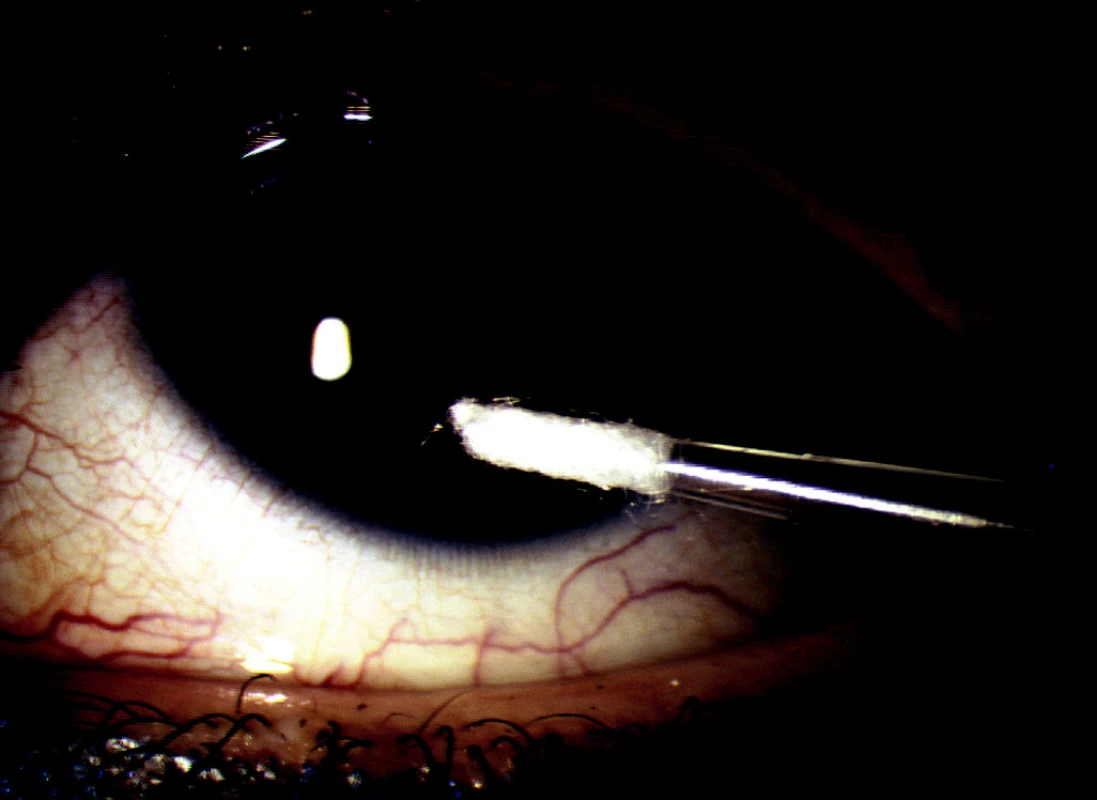
V probíhající prospektivní nerandomizované studii jsme hodnotili soubor 54 pacientů (33 mužů a 21 žen) průměrného věku 45,6 ± 9,5, u kterých byla stanovena pracovní diagnóza virové keratitidy či keratouveitidy. Vzorky byly odebírány v období devíti měsíců od 3/2005 do 12/2005. Po podepsání informovaného souhlasu byl u pacientů proveden odběr vzorků dle námi připravené a ověřené metodiky: sterilní jednorázovou mikropipetou s vatovým tamponem byl proveden stěr (otisk) z místa postižení (obr. 1) a bylo odebráno cca 50 mikrolitrů slz ze slzného jezírka spojivkového vaku. Tento odběr byl proveden bez předešlého barvení a bez předešlého kapání jakýchkoliv očních kapek včetně lokálních anestetik pro vyloučení možnosti ovlivnění odebraného vzorku. Tampón i slzy byly protřepány s pufrem EliDNA Store Kit (ELISABETH PHARMACON, ČR), který zabraňuje degradaci DNA a umožňuje skladování a přepravu vzorků při pokojové teplotě. Vzorky byly přepraveny do laboratoře při pokojové teplotě.
Opakovaný odběr byl prováděn stejnou metodou v časovém odstupu 7–10 dnů po zavedené léčbě lokálním okulentem 3% acyclovirem. Odběr byl proveden nejméně 2 hodiny po lokální aplikaci acycloviru. V případě recidivující keratitidy byla lokální léčba doplněna systémovou léčbou acyclovirem v dávce 400–800 mg 5krát denně po 4 hodinách s nočním vynecháním. Při recidivující keratouveitidě a vážném nálezu na rohovce byl pacient hospitalizován a byla nasazena léčba systémovým acyclovirem parenterálně v i.v. infuzích.
Při prvním odběru každého pacienta byl po získání vzorku pro DNA analýzu proveden následný stěr štětičkou pro kultivaci virů a při suspektní bakteriální superinfekci byl proveden odběr pro bakteriální kultivaci se zjištěním citlivosti.
DNA analýzy
Přijaté vzorky byly před izolací DNA uchovávány v lednici při 4 °C maximálně 10 dní. Izolace DNA z odebraného vzorku byla prováděna pomocí komerčně dostupného izolačního kitu UltraClean Tissue DNA Kit (MoBio, USA). Vzorek byl silně vortexován a nanesen na kolonku, která je součástí shora uvedeného kitu. Izolovaná DNA byla eluována do 50 μl elučního pufru.
K nested PCR detekci byly využity kity pro dvoukrokovou nested PCR – End-Point PCR HSV1/2, End-Point PCR VZV a End-Point PCR ADENOVIRUS (Nanogen Advanced Diagnostics, Itálie). Tyto komerčně dostupné kity patří mezi in vitro diagnostické zdravotnické prostředky in vitro. Detekce amplifikované DNA byla prováděna na agarózovém gelu pro velmi krátké fragmenty EliPhore (ELISABETH PHARMACON) barveném ethidiumbromidem. Výsledný gel byl fotografován digitálním fotoaparátem Camedia 3030. Amplifikované DNA fragmenty byly srovnávány s pozitivní kontrolou. Pro zamezení získání falešně negativních výsledků (zamezení vlivu inhibicí) byla při PCR použita univerzální vnitřní kontrola DECK (Nanogen Advanced Diagnostics, Itálie).
K RealTime PCR analýze HSV1 byla využita in house metoda. K detekci byl využit přístroj ABI 7300 (Applied Biosystems). Primery pro RealTime PCR detekci byly navrženy v naší laboratoři pomocí softwaru Primer Express 2.0.0. ze sekvence NC_001806 uložené v databázi GenBank (National Center for Biotechnology Information).
Pro RealTime PCR reakci byly použity primery HS11 a HS12 a sonda HS1S. Sonda obsahovala fluorescenční barvu FAM a zhášeč ECLIPSE. Reakční směs o celkovém objemu 25 μl obsahovala, 12,5 μL TaqManUniversal PCR Master Mix (Applied Biosystems), 1 μM každého z primerů, 0,125 μM sondy a 5 μl izolované DNA.
Po počáteční denaturaci trvající 2 minuty při 50 °C a 10 minutách při 95 °C byla DNA amplifikována v tříkrokových cyklech 40krát, denaturace 20 s při 95 °C, annealing 20 s při 55 °C a extenze 32 s při 72 °C. Po ukončení amplifikace byla provedena automatická analýza. Jako pozitivní výsledky byly určeny ty křivky, u kterých byla automaticky stanovena hodnota Ct (počet cyklů, ve kterém došlo k prokazatelnému zvýšení fluorescence). Pozitivita vzorku byla ještě okometricky posouzena s ohledem na charakteristický tvar amplifikační křivky.
Pro vyloučení případné kontaminace vzorků (falešné pozitivity) v průběhu odběru i DNA analýz bylo prováděno slepé testování, kdy do laboratoře byly bez upozornění mezi vzorky náhodně přimíchávány čisté odběrové tampóny s kódy smyšlených pacientů, které byly v ordinaci vloženy do pufru EliDNA Store Kit. V průběhu činnosti laboratoře nebyl zaznamenán falešně pozitivní výsledek.
Výsledky
U 54 pacientů jsme zaznamenali 38 pozitivních výsledků pomocí DNA diagnostiky metodou PCR. Charakteristika výsledkového souboru je uvedena v tabulce 1.
Herpes simplex virus 1 byl pozitivní u 28 pacientů (obr. 2A, B), varicella zoster virus byl pozitivní u 1 pacienta s anamnézou herpes zoster ophthalmicus před 12 měsíci. Adenovirus byl pozitivní u 9 pacientů a u 6 pacientů jsme zaznamenali pozitivitu herpes simplex l a adenoviru současně. Pozitivní adenoviry jsme zaznamenali v letním období červenec-srpen při výskytu epidemické keratokonjunktivitidy.
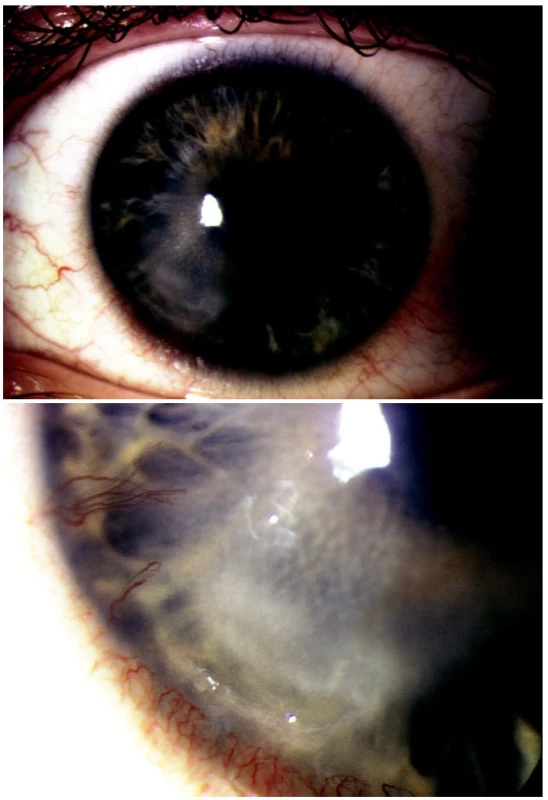
Opakovaná vyšetření jsme provedli u 12 pacientů po 7–10denních intervalech při nehojících se keratitidách po 7denním nasazení lokální léčby acyclovirem. A dále při systémové léčbě acyclovirem u pacientů s recidivující keratitidou.
Výsledky sledování pacientů se systémovou léčbou acyclovirem byly následující: celkem bylo léčeno systémovým acyclovirem 10 pacientů, u 4 pacientů jsme zaznamenali pozitivní výsledky po měsíční léčbě při doporučené udržovací dávce acyclovir 200 mg 2krát denně, u 2 pacientů jsme zaznamenali po 14 dnech pozitivní výsledky při doporučené udržovací dávce 400 mg 2krát denně. U 1 VZV pozitivního pacienta jsme zaznamenali pozitivní výsledky po přeléčení infuzní léčbou po dobu 10 dnů acyclovirem v dávce 500 mg a dále 250 mg ve 2 infuzích po 12 hodinách. Po přechodu na perorální léčbu 800 mg 5krát denně zůstával odběr stále pozitivní po dalších 7 dnech. Onemocnění bylo označeno jako acyclovir rezistentní keratouveitida a pacient byl přeléčen gancyclovirem p. o. Po 6 měsících sledování zůstává odběr PCR negativní.
Falešně negativní výsledky lze vyloučit, protože při nested PCR analýzách byly využity vnitřní kontroly. Deklarovaná senzitivita kitů je 1–10 genomických DNA na PCR reakci. V našem souboru jsme nezaznamenali negativní výsledek při pozitivním klinickém nálezu aktivní keratitidy.
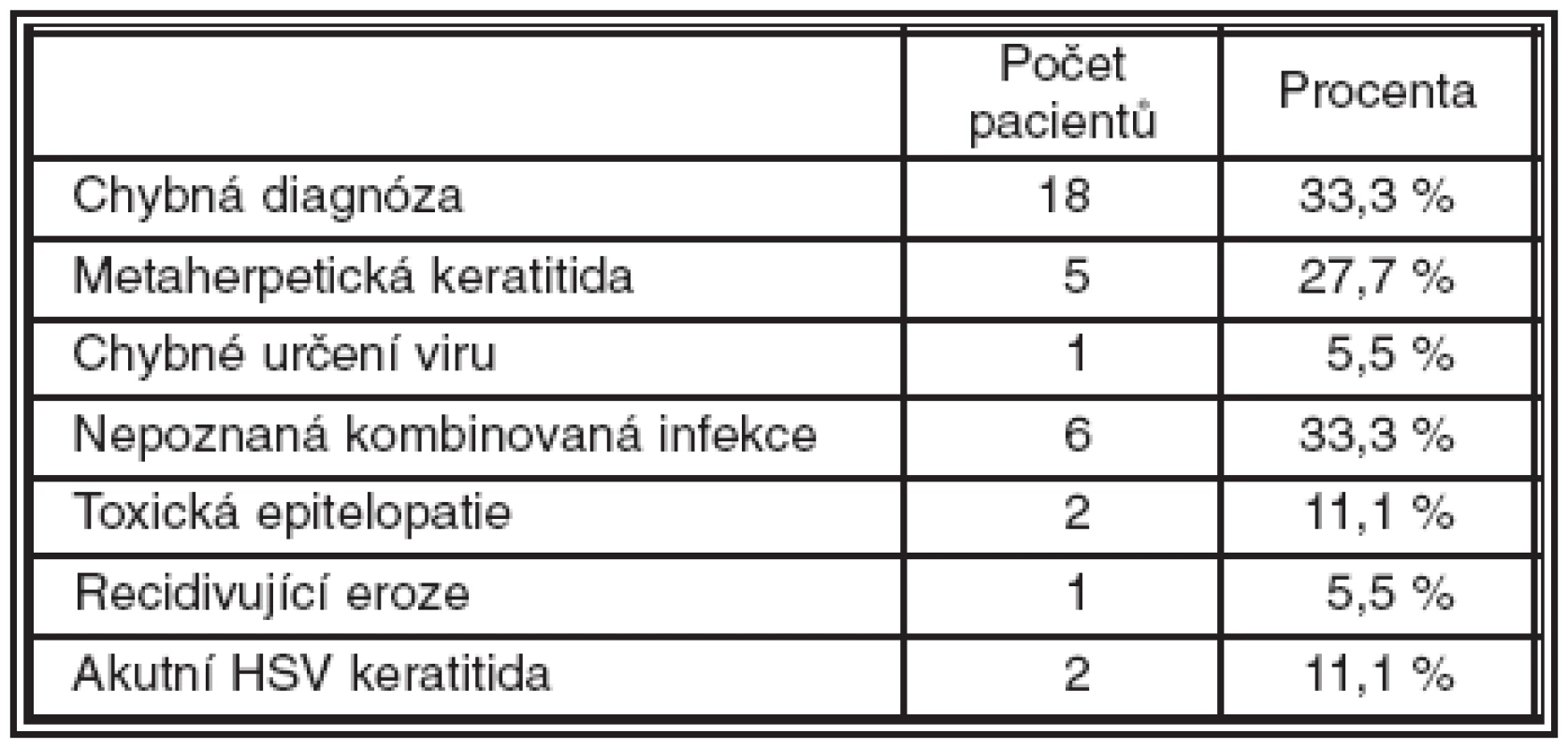
Falešně pozitivní výsledky nebyly zaznamenány s ohledem na náhodné slepé testování negativních vzorků. Srovnáním výsledků získaných metodou nested PCR kitem End-Point PCR HSV1/2 s in house metodou RealTime PCR bylo dosaženo naprosté shody. Chybnou klinickou diagnózu jsme zaznamenali u 16 pacientů ze sledovaného souboru. U 5 pacientů byla diagnostikována metaherpetická keratitida, u které by průkaz virové DNA měl být negativní a jednalo se o akutní herpetickou infekci. U 1 pacienta jsme se zmýlili v diagnostice HSV, pacient byl pozitivní na VZV, a u 6 pacientů, tedy u všech kombinovaných infekcí adenoviróz a herpes simplex viru jsme diagnostikovali u 3 případů jen ADV infekci a u 3 případů jen HSV infekci. Toxická epitelopatie byla 2krát zaměněna za HSV keratitidu a 1 byla zaměněna recidivující eroze. Oba typy keratitid byly výrazně zhoršeny po aplikaci acyclovir ung 5krát denně po dobu 3 dnů. Léčba byla vysazena a pacient zahojen pod lubrikačními preparáty. Akutní HSV keratitida zaměněná za metaherpetickou byla diagnostikována 2krát. Přehled chybných diagnóz uvádí tabulka 2.
Sekundární infekci jsme u naších pacientů zaznamenali 2krát. Jednalo se o infekci bakterií Staphylococcus koaguláza negativní. Virostatická léčba byla u těchto dvou pacientů doplněná lokální antibiotickou léčbou dle citlivosti ofloxacinem s úvodní dávkou 5krát po 15 minutách a dále 2krát denně po dobu 10 dnů.
Diskuse
V posledních letech vlivem celé řady faktorů (medikace lokální, systémová, nárůst systémových onemocnění) dochází ke změně klinického obrazu povrchové keratitidy do podoby atypické epiteliální keratitidy a ta se stává obtížně diagnostikovatelnou stran etiologie (1). Zároveň v posledních letech dochází k nárůstu incidence herpes virových keratitid (4).
Přesná diagnóza však umožňuje možnost včasné kauzální léčby. Chybná diagnóza u virových keratitid často vede k nasazení kombinovaných preparátů s kortikosteroidy, a tím i k závažnému zhoršení klinického obrazu. Každá progrese onemocnění vede k další destrukci lamel rohovky a po zhojení k sytější jizvě. To vše má za následek zhoršení zrakové ostrosti, a to ať již v podobě vzniku jizvy či obtížně korigovatelného nepravidelného astigmatismu. Již v roce 1985 popisuje Saiki užitečnost polymerázové řetězové reakce jako vhodné diagnostické metody k diagnóze virových onemocnění oka.
Procento klinicky nepřesných diagnóz v naší studii podporuje nutnost zavedení DNA analýz do standardních odběrů u povrchových keratitid nereagujících na zavedenou léčbu.Koizumi neshledal korelaci mezi klinickou manifestací atypické keratitidy a výsledky PCR diagnostiky u těchto keratitid (3). Při detailním rozboru příčin chybných diagnóz v našem souboru, byl klinický obraz chybně diagnostikován především u suspektní metaherpetické keratitidy. Dle našich výsledků u tohoto typu keratitidy dochází k vylučování virové DNA do slz. Někteří autoři uvádí nižší senzitivitu vyšetření při odběru virové DNA ze slz (7).
Dalším přínosem této metody (což považujeme za jednu z nejdůležitějších) je možnost sledování účinnosti léčby. Dle doporučení je vhodné při opakujících se keratitidách zavedení udržovací léčby systémovým acyclovirem po dobu 2–6 měsíců(1, 4). Otázkou zůstává neúčinnost této léčby u námi prokázaných 6 pacientů (6 z 10 pacientů systémově užívajících acyclovir).
Zajímavostí zůstává koincidence dvou virů adenoviru a herpes simplex viru v letním období při vzniku epidemie keratokonjunktivitidy. Uchio (8) prokázal,že 4,3 % pacientů s diagnózou epidemické keratokonjunktivitidy mělo prokázáno pozitivitu HSV1 (na buněčné kultuře). V našem souboru jsme prokázali koincidenci obou virů metodou PCR u 15,8 %. Zůstává otázkou, která z infekcí byla iniciální.
V posledních 10 letech laboratorní metody detekce virové DNA zaznamenaly velký pokrok. Od běžných PCR s citlivostí cca 100 genomických DNA se přešlo k nested PCR metodám s citlivostí 1–10 genomických DNA. Dnes se i v klinických laboratořích všeobecně přechází k RealTime PCR metodám, které v případě správného designu mají stejnou ne-li lepší citlivost, než metody nested PCR. Narozdíl od nested PCR metod, které jsou většinou dvoukrokové a při jejichž provádění hrozí nebezpečí zkřížené kontaminace, se metody RealTime PCR provádějí v jednom kroku bez otevírání mikrozkumavek, čímž se velmi podstatně omezuje možnost vzniku falešně pozitivních výsledků. V současné době lze v klinických laboratořích sledovat silný ústup metod kultivací virů. Tato časově, finančně i metodicky náročná metodika ustupuje DNA diagnostickým metodám, které kromě rychlosti provedení a větší citlivosti mají i další neocenitelné výhody. Z našich výsledků je patrné, že kultivační vyšetření přítomnosti virů bylo v našich podmínkách nevhodné.
Závěr
Z výsledků naší prospektivní studie vyplývá, že DNA diagnostika virových keratitid metodou PCR je rychlou a spolehlivou laboratorní metodou, která umožňuje přesné stanovení diagnózy u diagnosticky složitých pacientů. Nově zavedená metodika detekce DNA pomocí Real Time PCR umožňuje stejně citlivou detekci virů jako mají komerčně dostupné in vitro diagnostické zdravotnické prostředky. DNA diagnostika umožňuje monitorování účinnosti léčby, případně určení rezistence virů na dosavadní léčbu. Zavedená metodika odběru se jeví jako šetrná metoda bez nutnosti skarifikace rohovky a její mechanické destrukce opakovanými odběry.
Poděkování: podpořeno grantem IGA MZ ČR NR/8507-3
MUDr. Zuzana Hlinomazová Ph.D.
Oční klinika LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: zhlinom@fnbrno.cz
Sources
1. Herpetic Eye Disease Study Group: Acyclovir for prevalence of recurrent herpes simplex virus eye disease. N. Engl. J. Med., 339, 1998 : 300–306.
2. Kay, S.B., Lynas, C, Patterson, A. et al.: Evidence for herpes simplex viral latency in the human Bornea. Br. J. Ophthalmol., 75, 1991 : 195–200.
3. Koizumi, N., Nishida, K., Adachi, W. et al.: Detection of herpes simplex virus DNA in atypical epithelial keratitis using polymerase chain reaction. Br. J. Ophthalmol., 83, 1999 : 957–960.
4. Labetoulle, M., Auquier, P., Conrad, H. et al.: Incidence of herpes simplex virus keratitis in France. Ophthalmology, 112, 2005 : 888–895.
5. Ojasni, Y., Yamamoto, S., Nishida, K et al.: Demonstration of herpes simplex virus DNA in idiopathic corneal endoteliopathy. Am. J. Ophthalmol., 112, 1991 : 419–423.
6. Openshaw, H., Mcneil, J.I.,, Lin X.H. et al.: Herpes simplex virus DNA in normal corneas: persistence without viral sheddin from ganglia. J. Med. Virol., 46, 1995 : 75–80.
7. Soma, H., Nishida, K., Adachi, W. et al.: Detection sensitivity of herpes simplex virus DNA in tear fluid by PCR Metod. Jpn. J. Clin. Ophthalmol., 49,1995 : 603–606.
8. Uchio, E., Takeuchi, S., Itoh, N. et al.: Clinical and epidemiological features of acute follicular conjunctivitis with special reference to that caused by herpes simplex virus1. Br. J. Ophahtalmol., 84, 2000 : 968–972.
9. Yamamto, S., Shimoura, Y., Kinoshita, S. et al.: Detection of herpes simplex virus DNA in human tear film by polymerase chain reaction. Am. J. Ophthalmol., 117, 1994 : 160–163.
10. Yamamto, S., Shimoura, Y., Kinoshita, S. et al.: Differentiation zosteriform herpes simplex from ophthalmic zoster. Arch. Ophthalmol., 112, 1994 : 1515–1516.
Labels
OphthalmologyArticle was published in
Czech and Slovak Ophthalmology

2008 Issue 2
-
All articles in this issue
- Applying the DNA Diagnostics in Patients with Superficial Keratitis of Viral Origin
- The Application of the Autologous Serum Eye Drops Results in Significant Improvement of the Conjunctival Status in Patients with the Dry Eye Syndrome
- Arteriovenous Decompression for Branch Retinal Vein Occlusion with Internal Membrane Peeling for Macular Edema
- Spontaneous Premacular Hemorrhage
- Treatment for Recurrent Pterygium
- GDx before and after LASIK in Middle and High Myopia
- The Presence of Dry Eye Syndrome and Corneal Complications in Patients with Rheumatoid Arthritis and its Association with -174 Gene Polymorphism for Interleukin 6
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- The Application of the Autologous Serum Eye Drops Results in Significant Improvement of the Conjunctival Status in Patients with the Dry Eye Syndrome
- Treatment for Recurrent Pterygium
- Spontaneous Premacular Hemorrhage
- Applying the DNA Diagnostics in Patients with Superficial Keratitis of Viral Origin