Keratoconjunktivitis sicca (KCS) při folikulární konjunktivitidě u dospělých pacientů s etiologií Chlamydia pneumoniae (souhrnná dvanáctiletá studie)
Keratoconjunctivitis Sicca during Folicular Conjunctivitis in Adult Patients with Chlamydia pneumoniae Etiology (Summarizing twelve Years Study)
Aim:
Following the previous study observing keratoconjunctivitis sicca (KCS) after treated follicular conjunctivitis of chlamydial etiology from the years 1999-2002, at this time the authors would like to point out the possible connection between KCS appearance and Chlamydia pneumoniae infection.
Material:
In the Department of Ophthalmology, during the period of 12 months (in the years 2009 – 2010), there were treated 11 adult patients (6 women and 5 men) in the age of 28 – 81 years (median, 50 years) with follicular conjunctivitis lasting on average 2.5 years and caused by Chlamydia pneumoniae, and simultaneously were diagnosed the symptoms of KCS, out of the total number of 37 examined patients with similar clinical findings.
Methods:
The diagnosis of chlamydial infection in clinical symptoms of follicular conjunctivitis and simultaneous signs of KCS was established partly according to the serologic positivity of chlamydial genus (anti-LPS) and/or species (anti-Ch. pneumoniae and anti-Ch.trachomatis) IgG, IgM, and IgA antibodies together with simultaneous anti-cHSP60 IgG positivity, further using conjunctival prints examined by means of indirect immunofluorescence method using specific monoclonal antibodies; in conjunctival smears and peripheral leucocytes was tested also the presence of Chlamydia pneumoniae DNA. The main subjective complaints of the patients were burning sensation, sticking, or foreign-body sensation; the itching and lacrimation were less common. Among clinical signs dominated the hyperemia and the edema of the lower fornix; the tortuosity of the vessels and the follicles were not always present. The KCS diagnosis was confirmed by Bengal rose staining. Results: In 10 patients, the positive IgA and/or IgM anti-Ch. pneumoniae antibodies were detected. Simultaneously, the positive anti-cHSP60 IgG were confirmed, out of them medium - and high-positive findings were in 7 patients, and anti-LSP antibodies IgA and/or IgM in 8 of them. Positive smears were found in 6 patients. In 2 persons of this group of treated patients, the general serologic findings were not significant, but the Chlamydia pneumoniae infection was confirmed by Chlamydia pneumoniae DNA positivity in peripheral leucocytes; in these 2 patients, the symptoms lasted for one half of the year. As the side findings were the confirmations of active Chlamydia trachomatis infection in other 4 patients of the whole group. The patients with Chlamydia pneumoniae infection were treated systemically by macrolide antibiotic azithromycine for 12 days. After the treatment, above all else the clinical signs of conjunctival inflammation disappeared, but remained KCS symptoms, which were disappearing only slowly. The optimal supporting therapies were lubricant drops with different concentration of sodium hyaluronide without preservatives. Control microbiological examinations during 6 months after the treatment termination confirmed negative smears findings, but the antibody levels were not decreased significantly.
Conclusion:
This study confirmed the possible connection between the KCS and Chlamydia pneumoniae infection in simultaneous clinical signs of follicular conjunctivitis. Along with that the study pointed out the necessity of simultaneous evaluating of the microbial findings and clinical symptoms to consider the systemic antibiotic treatment.
Key words:
follicular conjunctivitis, Chlamydia pneumoniae, Chlamydia trachomatis, keratoconjunctivitis sicca
:
J. Krásný; D. Hrubá 1; M. Netuková; V. Kodat; J. Pokorná
:
Oční klinika FN Královské Vinohrady, Praha, přednosta prof. MUDr. P. Kuchynka, CSc.
; Vidia-Diagnostika s. r. o., Praha
1
:
Čes. a slov. Oftal., 67, 2011, No. 2, p. 42-50
:
Original Article
Cíl:
Ve studii v návaznosti na předchozí pozorování KCS po léčené folikulární konjunktivitidě chlamydiové etiologie z let 1999 až 2002 nyní autoři chtěli poukázat na možnou souvislost mezi vznikem keratoconjunctivitis sicca (KCS) a infekcí Chlamydia pneumoniae.
Materiál:
Na oftalmologické klinice bylo léčeno v období 12 měsíců (v letech 2009–2010) 11 dospělých pacientů (6 žen a 5 mužů) ve věku 28–81 let (medián 50 let), kdy při folikulární konjunktivitidě trvající v průměru 2,5 roku vyvolané Chlamydia pneumoniae byly současně diagnostikovány příznaky KCS a to z celkového počtu 37 vyšetřených pacientů s obdobnými klinickými projevy.
Metodika:
Diagnóza chlamydiové infekce při klinických projevech folikulární konjunktivitidy se současnými známkami KCS byla stanovena jednak na základě sérologické pozitivity chlamydiových rodových (anti-LPS) a/nebo druhových (anti-Ch. pneumoniae a anti-Ch. trachomatis) IgG, IgM, IgA protilátek spolu se současnou pozitivitou anti-cHSP60 IgG, dále ze spojivkových otiskových preparátů vyšetřených metodou nepřímé imunoflurescence pomocí specifických monoklonálních protilátek, ve spojivkových stěrech a v periferních leukocytech byla současně vyšetřována i DNA Chlamydia pneumoniae. Hlavními subjektivními obtížemi bylo pálení, řezání či pocit cizího tělíska, svědění a slzení bylo méně časté. Do klinického obrazu patřila především hyperémie a zduření dolního fornixu za ne vždy přítomné spoluúčasti vinutosti cév a folikulů. KCS byla potvrzena barvením bengálskou červení.
Výsledky:
U 10 pacientů byla zaznamenána pozitivita anti-Ch. pneumoniae protilátek ve třídách IgA a/nebo IgM. Současně byla prokázaná pozitivita anti-cHSP60 IgG, z toho střední a silně pozitivní nález byl u 7 nemocných a anti-LSP protilátky IgA a/nebo IgM u 8 z nich. Pozitivní stěry byly zaznamenány u 6 pacientů. U 2 nemocných z tohoto souboru léčených pacientů byl celkový sérologický nález nevýrazný, ale infekci Chlamydia pneumoniae potvrzovala pozitivita DNA Chlamydiae pneumoniae v periferních leukocytech, obtíže těchto 2 pacientů byly půlroční. Vedlejším pozorováním bylo potvrzení aktivní infekce Chlamydia trachomatis u dalších 4 nemocných z celého souboru.
Pacienti při infekci Chlamydia pneumoniae byli léčeni celkově podávaným makrolidovým antibiotikem azithromycinem po dobu 12 dní. Po ukončení léčby sice ustoupily klinické příznaky konjunktiválního zánětu, ale přetrvávaly jen pomalu se zmírňující obtíže KCS. Optimální podpůrnou léčbu lubrikancií představovala různě koncentrovaná kolyria hialuronátu sodného bez konzervačních látek. Kontrolní mikrobiologická vyšetření v průběhu 6 měsíců po ukončení léčby prokázala negativní nález ve stěrech, ale hladiny protilátek nebyly významně sníženy.
Závěr:
Tato studie potvrdila možnou souvislost mezi KCS a infekcí etiologie Chlamydia pneumoniae při současných klinických projevech folikulární konjunktivitidy. Zároveň ukázala na nutnost současného hodnocení mikrobiologického nálezu a klinického obrazu pro zvážení celkové léčby antibiotiky.
Klíčová slova:
folikulární konjunktivitida, Chlamydia pneumoniae, Chlamydia trachomatis, keratoconjunctivitis sicca
Úvod
Celá studie o problematice oční symptomatologie zánětlivých projevů vyvolaných jedním ze zástupců z rodu Chlamydia, jmenovitě Chlamydia pneumoniae, byla zahájena v roce 1999 (s určitým přerušením na výzkumné úrovni, nikoliv ve sledování nemocných) a pokračuje od roku 2008 doposud. V rámci výzkumného projektu IGA NI-6811/3: „Význam Chlamydia pneumoniae v patogenezi chronických lidských onemocnění“ bylo detekováno toto agens jednak jako další možná příčina oftalmia neonatorum [20, 22], ale výsledky studie ukázaly i na možnou souvislost mezi chronickou folikulární konjunktivitidou chlamydiové etiologie a vznikem KCS [21]. Danému problému jsme se věnovali i v následujících letech, ale výzkumný projekt v rámci IGA jsme získali po předchozí snaze v oftalmologicko-otorhinolaryngologické sekci až v mikrobiologické sekci IGA v roce 2008 – NS 10016/4: „Chlamydia pneumoniae v etiologii keratokonjunktivitis sicca“. V úvodu celkové studie jsme znovu klinicky zhodnotili výsledky léčby skupiny deseti pacientů s KCS starších 45 let z předchozího grantového projektu. Tito pacienti byli léčeni pro folikulární konjunktivitidu na podkladě pozitivity IgA a/nebo IgM rodově i druhově specifických protilátek proti Chlamydia pneumoniae, kterou ve čtvrtině případů doprovázela současná pozitivita ve spojivkových stěrech [24]. Odstup 5,5 až 7 let pro posouzení klinického nálezu a pro vývoj hodnocení sérologických nálezů se ukázal jako významný. Až po této době byl prokázán pokles hladin protilátek i ústup objektivního nálezu a subjektivních obtíží při KCS různého rozsahu bez známek folikulárního zánětu spojivek. Celkem 7 pacientů bylo bez klinických příznaků KCS a bez pravidelné lokální léčby lubrikancií, současně byl zaznamenán u 4 z nich významný pokles hladin protilátek, u 3 pacientů byl sérologický nález bez zásadních změn. U zbývajících 3 nemocných se příznaky suchého oka jen zmírnily a trvale neustoupily, proto si tito pacienti museli několikrát denně aplikovat umělé slzy. Přesto byl pokles hladin protilátek zaznamenán u dvou z nich [24].
V rámci nového projektu byla pro posouzení významnosti sérologického nálezu (protilátek proti chlamydiím souhrnně a proti Chlamydia pneumoniae) u pacientů s konjunktivitidou a pro zjištění protilátkového pozadí dospělé populace sérologicky vyšetřena i kontrolní skupina osob [17]. Dále byla oftalmologům pracujícím především v terénu nabídnuta možnost odesílat pacienty splňující podmínky chronické (folikulární) konjunktivitidy doprovázené příznaky KCS k podrobnému vyšetření, které převyšovalo svým rozsahem sérologických testů a testů na přítomnost DNA Chlamydia pneumoniae možnosti poskytující zatím ZP. Informace byly podány na sjezdech ČOS [23], [25] či v hlavním periodiku ČOS [24]. Musíme s politováním konstatovat, že se naše snaha nesetkala s pochopením a pacientů odeslaných na podrobné vyšetření bylo značně méně, než jsme čekali. Příčinou je nejspíše komercionalizace našeho oboru ve smyslu doporučované aplikace rozličných lubrikancií bez přesné specifikace problému KCS.
Vlastní studie
V období od května 2009 do června 2010 jsme provedli podrobné mikrobiální vyšetření u 37 pacientů se symptomy a známkami KCS, které byly provázené projevy chronického folikulárního konjunktiválního dráždění. Pacienti se dostavili na všeobecnou ambulanci Oční kliniky FN Královské Vinohrady spíše sami na základě internetových a publikačních informací než na doporučení oftalmologů.
Mikrobiální vyšetření zahrnovalo sérologická vyšetření protilátek a detekci Chlamydia pneumoniae. Vlastní sérologické vyšetření se týkalo stanovení hladin anti-LPS (lipopolysacharidových) protilátek (rodově specifických) IgG, IgA, IgM (medac, Germany), dále druhově specifických anti-Ch.pneumoniae IgG, IgA, IgM (Savyon Diagnostics, Israel), anti-Ch.trachomatis IgG, IgA (medac, Germany) a protilátek proti chlamydiovému heat-shock proteinu – cHSP60 IgG (medac, Germany). Detekce antigenu Chlamydia pneumoniae byla provedena vyšetřením spojivkových stěrů (otiskové preparáty na sklíčku) metodou nepřímé imunofluorescence pomocí specifických monoklonálních protilátek (medac, Germany), přítomnost DNA (Chlamydia pneumoniae) byla vyšetřena metodou PCR (TIB MolBiol, Germany) a DNA CT (Chlamydia trachomatis) také pomocí PCR (in house metoda). Současně byla sledována přítomnost DNA (Chlamydia pneumoniae) v periferních leukocytech.
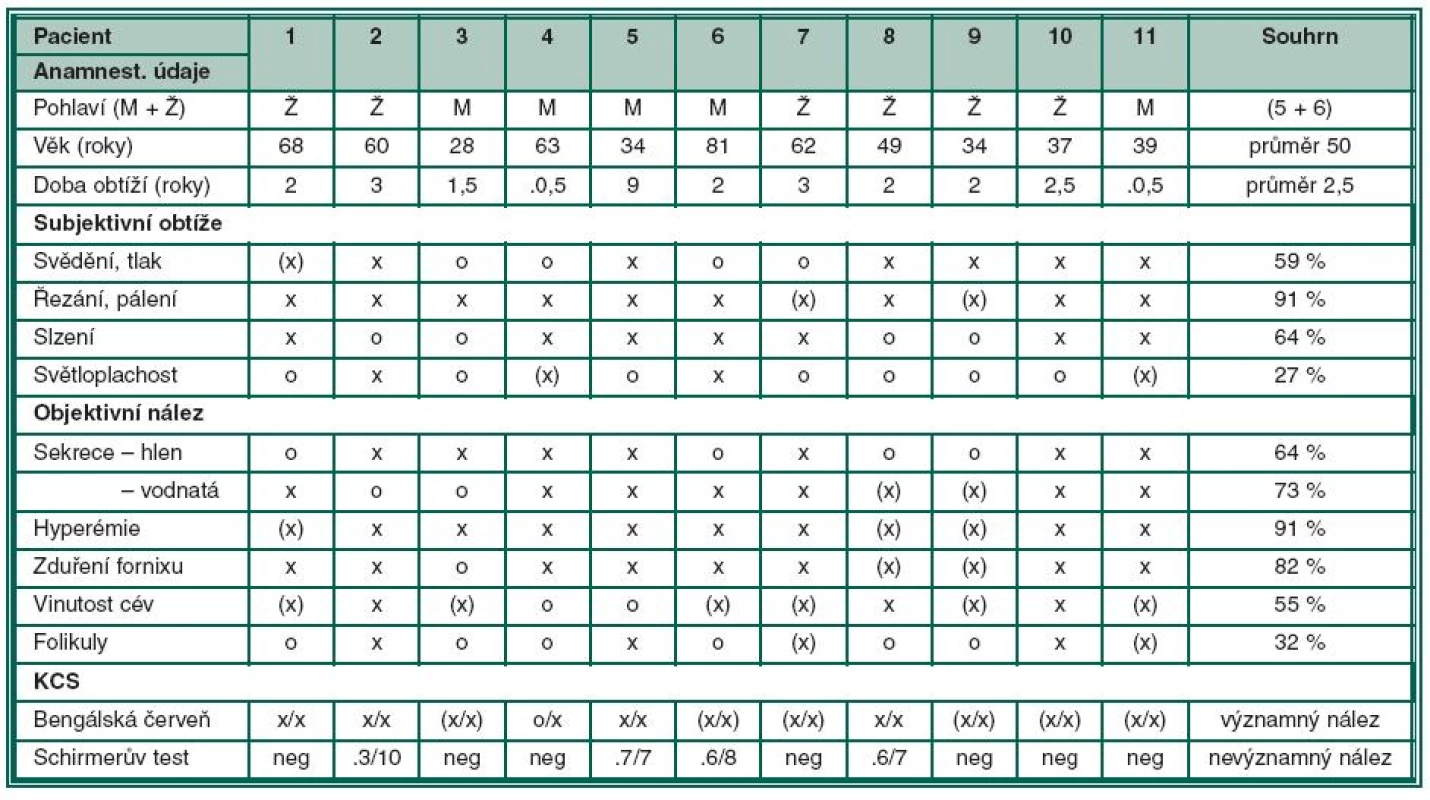
Výsledky skupiny 11 pacientů (6 žen a 5 mužů ve věku od 28 do 81 let, medián 50 let) s potvrzenou oční Chlamydia pneumoniae infekcí a doprovodnými příznaky KCS uvádí tabulka č. 1. U 10 pacientů byla zaznamenána pozitivita anti-Ch. pneumoniae ve třídách IgA a/nebo IgM se současnou pozitivitou anti-cHSP60 IgG, z toho střední nález (tab. 1 – „x“) u 3 pacientů, silně pozitivní nález (tab. 1 –„xx“) u 5 nemocných a jednou byl nález jen hraniční. Anti-chlamydia IgA a/ nebo IgM byly pozitivní u 8 z nich. Pozitivní stěry byly zaznamenány u 6 pacientů.
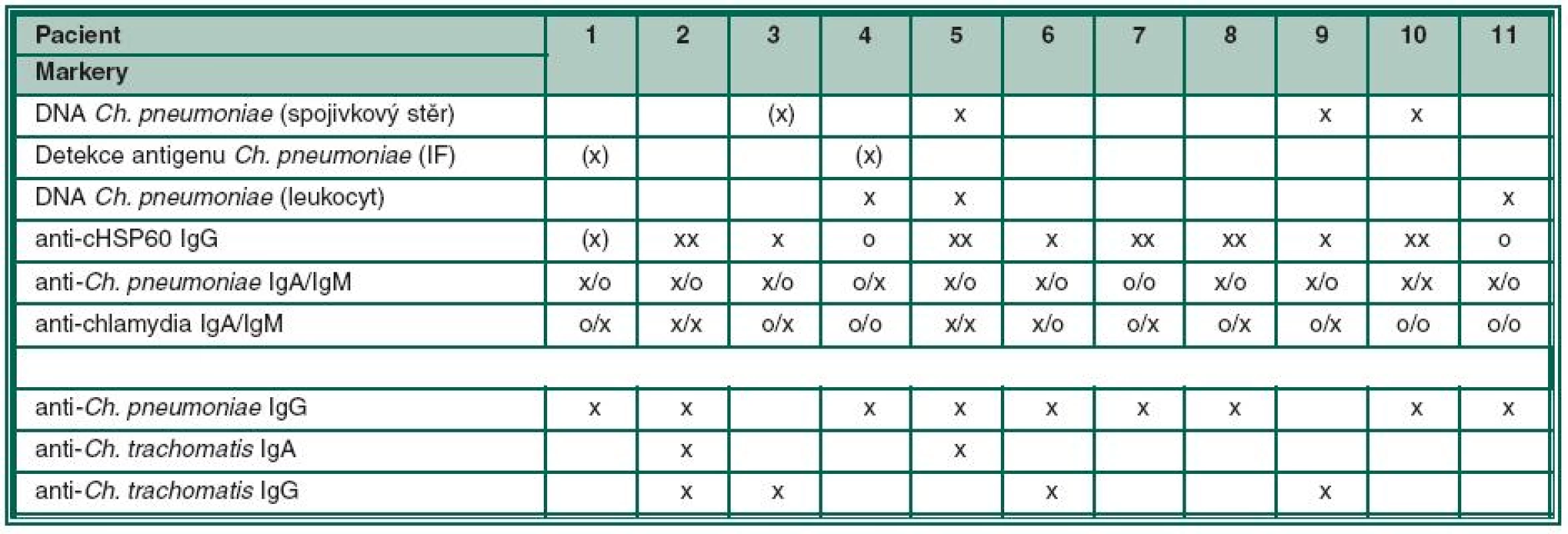
Anamnestické hladiny anti-Ch. pneumoniae IgG byly zaznamenány u 9 nemocných, a to většinou s delší anamnézou obtíží, což svědčilo pro déle trvající onemocnění. Doprovodným nálezem byla pozitivita anti-Ch. trachomatis protilátek, a to dvakrát ve třídě IgA a u 4 nemocných s anamnestickými protilátkami (IgG).
Ve skupině 37 vyšetřených jsme navíc diagnostikovali a léčili 4 nemocné s pozitivní Chlamydia trachomatis oční infekcí obdobných klinických příznaků, kteří současně měli pozitivní anamnestické anti-Ch. pneumoniae IgG a zároveň i anti-Ch. trachomatis IgG. Aktivní infekci potvrdila u dvou pacientů pozitivita DNA Chlamydia trachomatis ve stěrech.
Klinické příznaky skupiny 11 léčených pacientů jsou shrnuty do tabulky 2, ve které jsou zaznamenány i anamnestické údaje a výsledky testů k potvrzení KCS. Klinický rozvoj obtíží byl pacienty udáván v rozmezí 6 měsíců až 9 let, v průměru 2,5 roku.
Prakticky všichni nemocní jako hlavní obtíže udávali pálení, řezání či pocit cizího tělíska v očích. Současné svědění či tlak v očích byl dalším doprovodným jevem u poloviny z nich. Výrazná světloplachost byla přítomná minimálně. U většiny postižených (u 3/4) byla tato subjektivní symptomatologie provázena obtěžujícím slzením či hlenovitou sekrecí z očí a proto nebyl významně postižen meniskus slzného filmu. Různě rozsáhlé zduření dolní přechodné řasy vždy společně s hyperémií rozličného stupně byly hlavními příznaky konjunktiválního dráždění. Zvýšená vinutost cév bulbární spojivky a folikulární přestavba dolní tarzální spojivky, která byla bledší barvy než hyperemicky zbarvená okolní tkáň, byla pozorována u většiny vyšetřených s trváním nemoci déle než dva či tři roky. Obrazová dokumentace jednotlivých pacientů ukazuje rozliční rozvoj klinického obrazu (obr. 1 – 4). U všech vyšetřených byly detekovány pomocí barvení bengálskou červení různě četné defekty spojivkového epitelu, na rozdíl od Break-up-time testu, který nebyl nikdy zkrácen, a ani vyšetření pomocí Schirmerova testu nebylo celkově signifikantně přínosné (tab. 2).
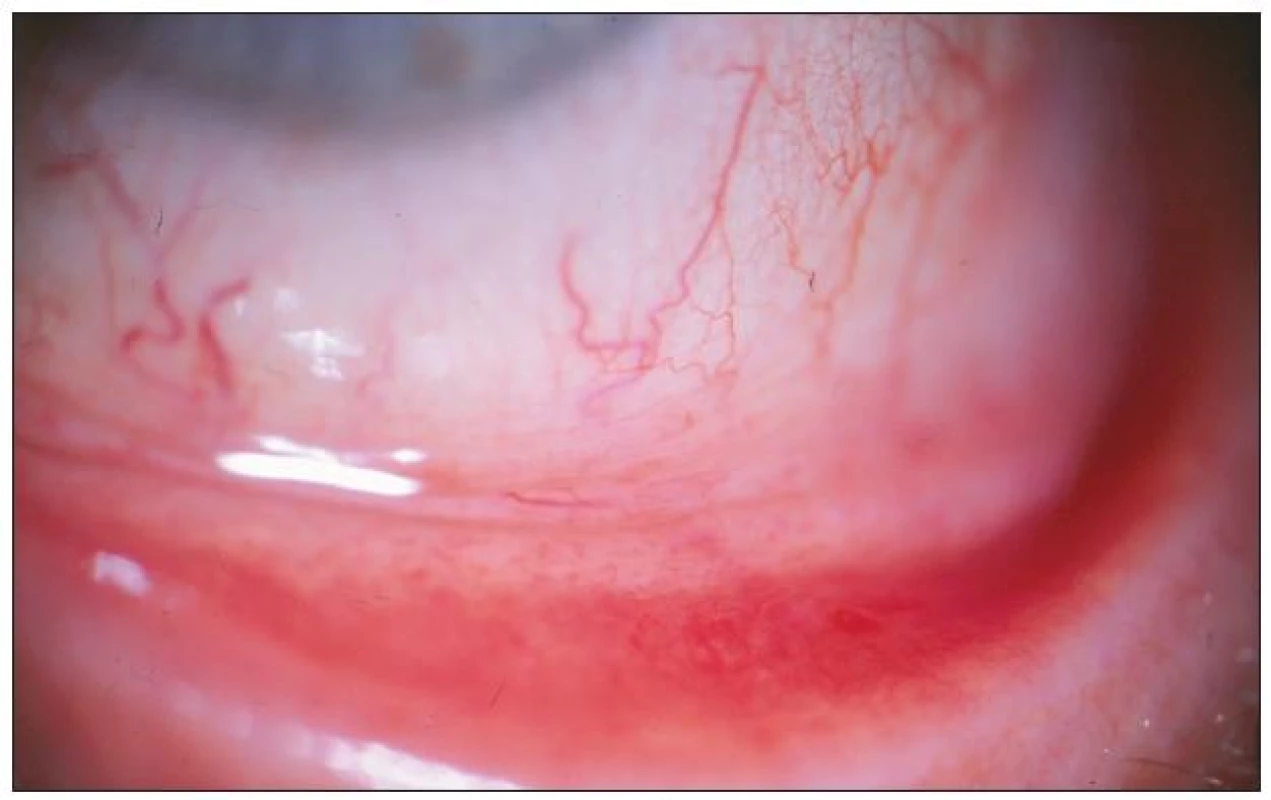
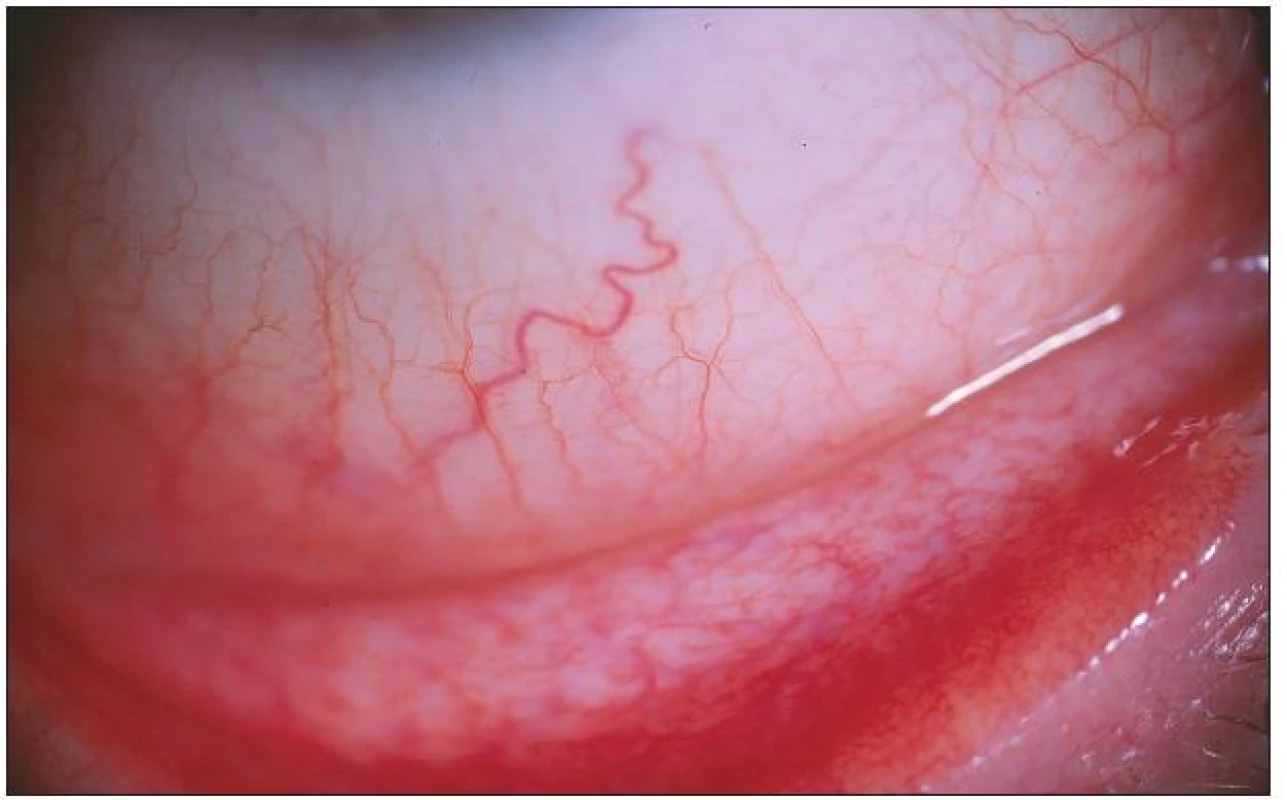
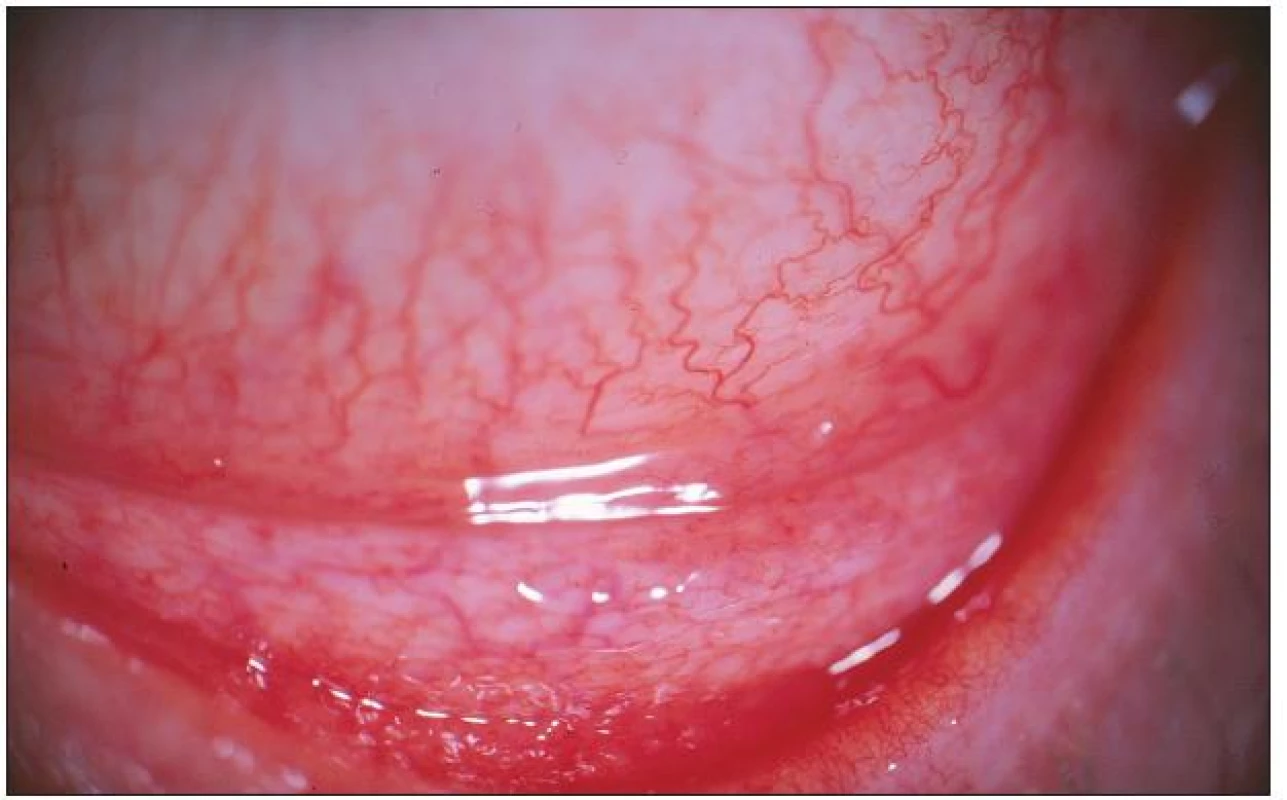
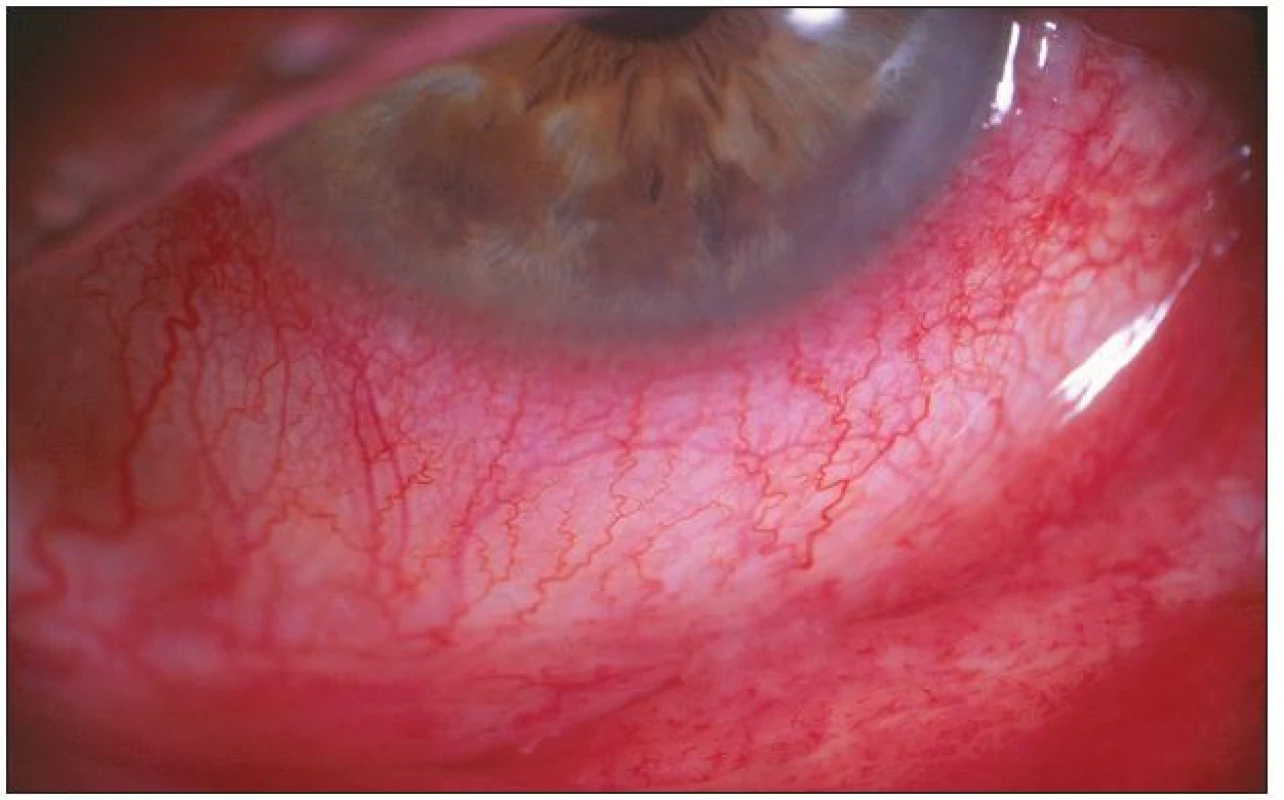
Folikulární zánět etiologie Ch. pneumoniae jsme léčili celkově podávaným makrolidovým (azalidovým) antibiotikem azithromycinem v dávce 500 mg denně po dobu 12 dní. (Oční infekci etiologie Ch. trachomatis jsme léčili stejným antibiotikem po dobu 7–9 dní, současně byl azithromycin 500 mg po dobu tří dnů podáván i sexuálním partnerům těchto pacientů.) U všech léčených osob byl kontrolní stěr ze spojivky tři měsíce po léčbě negativní, ale sérologický nález se po šesti měsících od ukončení léčby téměř nezměnil. Po léčbě byl redukován nález prosáknutí dolního fornixu s částečným ústupem hyperémie spojený současně s ústupem patologické sekrece. Subjektivní obtíže (řezaní, pálení či pocit cizího tělíska) provázené přechodnou hyperémií bulbární i tarzální spojivky přetrvávaly, ale byly menšího rozsahu, neboť k celkové léčbě antibiotiky byly lokálně podávány střídavě vzorky lubrikancií různého generického složení (carbomer, celulóza, glykokalyx, hialuronat, polyvinyl alcohol). Pacienti subjektivně hodnotili jejich efekt. V jejich hodnocení byly nejlépe tolerovány kolyria hialuronátu sodného v různých koncentracích bez konzervačních přísad. Pro zklidnění spojivky v případech výrazné hyperémie jsme léčbu doplnili o aplikaci fluorometholonu pouze na noc.
Pacienti jsou i nadále kontrolováni, pro další a definitivní zhodnocení průběhu jejich choroby a efektu antibiotické terapie bude potřeba delší období než je tato prakticky 3,5-letá grantová studie. Přesto z těchto výsledků a z výsledků pilotní studie, která hodnotila změny hladin protilátek po léčbě folikulární konjunktivitidy Chlamydia pneumoniae etiologie po dlouhém odstupu (po 5,5 až 7 letech), lze vyslovit určité závěry:
- Chlamydia pneumoniae se může podílet na vzniku KCS, přičemž o jejím rozvoji rozhoduje především rozsah jednotlivých klinických příznaků, ale i doba trvání neléčeného folikulárního zánětu spojivky.
- U rodových (anti-chlamydia) protilátek dochází během let k minimálnímu pohybu, výraznější pohyb byl až po delší době zaznamenán u druhových anti-Ch. pneumoniae protilátek (IgA a IgM), proto nelze pouze na základě hladin protilátek indikovat celkovou léčbu makrolidovými antibiotiky. Anti-Ch. pneumoniae IgG jsou pouze anamnestické protilátky, jejich dynamika hladin nemá význam pro posuzování klinického nálezu.
- Jednoznačnou indikací k léčbě je pozitivní nález antigenu či DNA ve stěru ze spojivky. Tento mikrobiologický nález svědčí pro aktivní infekci.
- Pro posouzení chronicity trvajícího zánětlivého procesu může být přínosné zhodnocení pozitivity protilátek proti chlamydiovému heat-shock proteinu (anti-cHSP60 IgG). Společně s pozitivitou anti-Ch. pneumoniae IgA a/nebo IgM a s klinickým obrazem folikulární konjunktivitidy mohou být i tyto pozitivní nálezy indikací pro léčbu antibiotiky.
- Lékem první volby je azithromycin v dávce 500 mg denně po dobu nejméně 12 dní, kratší doba podávání se nám neosvědčila z důvodu přetrvání pozitivity agens ve stěrech.
- Výběr lumbrikancií, které jsou nedílnou součástí terapie, je dán subjektivním pocitem nemocného, přesto lze doporučit preparáty s obsahem hialuronátu sodného bez stabilizujících látek. Pozitivní efekt má podání fluorometholonu v minimálních dávkách.
Diskuse
Chlamydie patří k nejrozšířenějším mikroorganismům v lidské, ale i zvířecí říši. Pro člověka z hlediska vzniku možných onemocnění jsou důležité zejména dva primárně lidské patogeny, a to Chlamydia trachomatis a Chlamydia pneumoniae [23].
První izolát tohoto Chlamydia pneumoniae pocházel ze spojivky dítěte v rámci vakcinační studie trachomu na Tchaj-wanu v roce 1965, tehdy ovšem popisovaný jako atypický kmen Chlamydia psittaci [10]. K primoinfekci Chlamydia pneumoniae dochází nejčastěji v době školní docházky a je vázána především na horní a dolní dýchací cesty. Většina infekcí proběhne inaparentně nebo jen s mírnými klinickými příznaky [1, 40]. Toto agens je dáváno do možné souvislosti i s dalšími chorobami respiračního traktu jako je astma bronchiale [6], chronická obstrukční plicní choroba (CHOPD) [15], bronchopulmonální karcinom [29], sarkoidóza [35]. Výzkumy se zabývají také otázkami možného vlivu infekce Chlamydia pneumoniae na aterosklerózu [14], infarkt myokardu [37] nebo myokarditidu [43]. Koincidence s Chlamydia pneumoniae se udává u onemocnění CNS [19]: např. u Alzheimerovy choroby [2] nebo u roztroušené sklerózy [40], kdy u progresivní formy byly intratekálně potvrzeny specifické oligoklonální anti-Ch.pneumoniae IgG, jenž mohou hrát patogenní roli [11]. Další oblastí patologického působení Chlamydia pneumoniae mohou být artritidy [39] či jiné autoimunitní choroby jako jsou dermatomyositidy, vaskulitidy, SLE a giant cell arteritidy [13]. Vzestup hladin anti-Ch. pneumoniae protilátek je dáván do souvislosti s posunem body mass indexu u obezity v rámci kardiovaskulárních chorob [28], ale i jinak zdravých mladých vojenských rekrutů [36]. Zda vůbec a případně jakým dílem se Chlamydia pneumoniae podílí na výše uvedených stavech v rámci respiračního traktu i mimo něj, je ale stále nejasné (především z důvodu neexistence validovaných diagnostických metod a dokud nebude provedena rozsáhlá prospektivní, kontrolovaná, slepá multicentrická studie s použitím diagnostických metod v souladu s doporučeními CDC (Centra pro kontrolu nemocí), zůstane úloha Chlamydia pneumoniae u akutních a chronických infekcí neobjasněna [27]. Stále není k dispozici uspokojivá definice persistentní nebo chronické infekce Chlamydia pneumoniae pomocí sérologických markerů, v tomto směru panuje poměrně mnoho nejasností [9].
O možnosti konjunktivitid etiologie Chlamydia pneumoniae se zmiňuje práce publikovaná před dvaceti pěti lety, ve které autoři referují o folikulární konjunktivitidě bez známek keratitidy [12], ke které patří obraz minimální mukopurulentní sekrece [7]. Chlamydia pneumoniae může dlouhodobě přetrvávat v organismu v makrofázích, které mohou být vektorem jejich šíření v organismu [45]. S variabilními výsledky byla DNA Chlamydia pneumoniae prokázána v periferních leukocytech u pacientů s ICHS [4] a v aterosklerotických plátech [5], kdy se předpokládá společné působení infekčního agens a žírných buněk v produkci cytokinů a matrix degradující metaloproteináz [8]. Pozitivní nález DNA Chlamydia pneumoniae v periferních leukocytech jsme zaznamenali rovněž u dvou našich pacientů s akutní formou folikulární konjunktivitidy a u jednoho nemocného s významně pozitivním sérologickým nálezem svědčím pro dlouho trvající infekci v možném spojení s Chlamydia trachomatis.
Interpretace sérologických nálezů u chronicky nemocných pacientů není vždy jednoznačná, neboť 60–80 % dospělé populace má anamnestické hladiny protilátek proti Chlamydia pneumoniae [40]. V současné době probíhají rozsáhlé studie vztahu promořenosti lidské populace jednotlivými infekcemi u závažných celkových chorob. Prevalence diabetu 2. typu je 12,7 % u multietnické studie o ateroskleróze. Nejvyšší séropozivitu 85 % zde vykazoval HSV, u CMV byla 77 %, třetí v pořadí byla Chlamydia pneumoniae v 76 %, hepatitida A v 58 % a Helicobacter pylori v 45 % [31].
Z tohoto důvodu je při hodnocení sérologických nálezů pro indikaci léčby vhodné sledovat spíše hladiny IgA a IgM svědčící pro aktivitu chlamydiové infekce, jestliže vlastní detekce Chlamydia pneumoniae ve stěrech spojivky není pozitivní. Využívat dynamiku jejich hladin jako ukazatele úspěšnosti léčby je problematické, neboť jsme pozorovali, že hladiny protilátek klesají velmi pomalu [25]. Při posouzení efektu ATB terapie je nutno vycházet z porovnání klinického obrazu před a po léčbě i ze subjektivních pocitů nemocných.
Do vyšetřovaných sérologických markerů zánětu jsme zařadili i vyšetření protilátek proti chlamydiovému heat-shock proteinu (anti-cHSP60 IgG). Heat-shock proteiny obecně jsou silné imunogeny a v průběhu jakékoliv bakteriální infekce jejich syntéza silně narůstá, infekční agens se tak snaží bránit se před imunitními mechanismy hostitele [16, 18]. Test cHSP60 IgG Elisa (medac) používá jako antigen rekombinantní protein tepelného šoku 60 (cHSP60) z Chlamydia trachomatis. I když tento test zachytává převážně protilátky proti HSP60 Ch. trachomatis, tak vzhledem k velmi vysoké homologii heat-shock proteinů (95 %) je možný záchyt protilátek i proti Chlamydia pneumoniae [17]. Tato možnost se nám potvrdila u tří pacientů s vysokou pozitivitou anti-cHSP60 IgG bez přítomnosti anti-Ch. trachomatis protilátek.
Součástí tohoto výzkumného úkolu také bylo sérologicky vyšetřit kontrolní soubor „zdravých“ osob, aby bylo možno posoudit významnost nálezů protilátek u pacientů s KCS. Rozbor sérologických nálezů u stovky vyšetřených jedinců bez známek akutního očního nebo celkového onemocnění v době odběru, kdy v anamnéze neudávali léčbu antibiotiky v posledních šesti měsících, léčbu chronického zánětu dýchacího traktu a astmatu či terapii kloubního nebo kardiovaskulárního onemocnění prokázal a potvrdil významné protilátkové pozadí i u osob bez akutního či chronického zánětu. Naše výsledky se dají rozdělit na dvě skupiny podle pozitivity anti-cHSP60 IgG. U 55 vyšetření byly IgG proti cHSP60 negativní a nebyly přítomné žádné anti-Ch. pneumoniae protilátky všech tříd (20 sér) nebo byly pouze anamnestické anti-Ch. pneumoniae protilátky, tj. IgG (25 sér). Při negativitě anti-cHSP60 IgG 10 sér vykazovalo pozitivitu anti-Ch.pneumoniae protilátek třídy IgG a IgM a/nebo IgA. U druhé části kontrolní skupiny 45 jedinců vykazovalo pozitivitu anti-cHSP60 IgG. Žádné anti-Chl. pneumoniae protilátky nebo jen anamnestické protilátky mělo v této skupině 24 sér. Pozitivitu protilátek proti chlamydiovému heat-shock proteinu provázelo potvrzení anti-Ch. pneumoniae protilátek třídy IgG a IgM a/nebo IgA u 21 sér. V této druhé skupině s pozitivitou anti-cHSP60 IgG byla významněji zastoupena přítomnost anti-Ch. trachomatis protilátek (19x) oproti skupině s negativními anti-cHSP60 IgG (5x). Celkově nebyly zachyceny žádné anti-Ch. pneumoniae protilátky v 31 % , pouze anamnestické hladiny (třída IgG) v 38 % a pozitivita anti-Ch.pneumoniae IgA a/nebo IgM byla v 31 % dospělé populace bez projevů akutní infekce či zánětlivých laboratorních parametrů [17]. Vyplývá z toho nutnost opatrného hodnocení sérologických nálezů z pohledu celkového nasazení antibiotické léčby.
Porovnání dvou předchozích studií [21, 25] se současně presentovaným hodnocením subjektivních obtíží a objektivního nálezu u nemocných zásadně nelišilo. Řezání, pálení či pocit cizího těliska bylo prakticky vždy přítomné, svědění a slzení provázelo obtíže u více jak poloviny nemocných a světloplachost nebyla tak významná. Součástí klinického obrazu byla vždy hyperémie, nález zduření dolního fornixu byl prakticky u většiny pacientů. Zvýšená vinutost cév této oblasti i nález folikulů dokresloval klinický obraz podle doby trvání příznaků. Přítomná sekrece byla vodnatého charakteru s hlenovou příměsi. Tento popis není patognomický pro oční chlamydiovou infekci, ale přesto může napomoci v diferenciálně diagnostické rozvaze při příznacích KCS. Věkové rozmezí KCS u folikulární konjunktivitidy Chlamydia pneumoniae etiologie se posouvá pod hranici 45. Tuto skutečnost potvrdila i dodatečná diagnóza KCS u 2 z 9 nemocných mladších 45 let z původní studie [21].
V diagnostice KCS u pacientů po zánětlivém onemocnění spojivky etiologie CP se nám opět lépe osvědčila, stejně jako v pilotní studii [25], její detekce barvením Bengálskou červení s interpretací podle van Bijstervelda 3 až 9 bodů na spojivce [42] než klasický Schirmerův test, kde se za pozitivní nález považuje sekrece slz pod 10 mm [38]. Break-up-time se v tomto případě v diagnostice neuplatnil, neboť lipidová vrstva slzného filmu vytvářená hlavně meibomskými žlázkami [3], není významně postižena tímto typem zánětu spojivky. Příčinou KCS u folikulární konjunktivitidy etiologie CP bude spíše porucha ve složení slz (hladina mucinu) než jejich produkce. Důvodem bude přechodné či trvalé poškození povrchového epitelu a pohárkových buněk spojivky zánětem. Takto vzniklá epidermalizace spojivkového epitelu je popisována především u trachomu, pemphigoidu či poleptání a je důvodem vzniku KCS [3].
Podle WHO je příznaky suchého oka postiženo cca 6 % dospělé populace [33], prevalence u populace nad 60 let v moderní společnosti stoupla z 14 na 33 % [3]. KCS představuje multifaktoriální onemocnění slzného filmu a povrchu oka ústící v dyskomfort, narušení zrakových funkcí a v nestabilitu slzného filmu, bývá spojen se zvýšenou osmolaritou slz a zánětem povrchu oka (International Dry Eye Workshop, 2007) [33]. Variabilita v příčinách s následnými a často rozdílnými klinickými příznaky KCS se odrazila ve všeobecnému označení TDS (Tear Dysfunction Syndrome) [3]. Faktory zevního prostředí (klimatizace vyvolávající proudění vzduchu, snížení vlhkosti vlivem ústředního či lokálního topení, atd.) v místnostech či autech narušují přirozenou cirkulaci vzduchu a zvyšují odpařování slz. V moderní společnosti se na nárůstu KCS také podílejí refrakční operace a nošení KČ [3, 33]. Dalšími příčinami je rostoucí spotřeba lokálních očních léků a vliv jejich stabilizujících látek na snížení citlivosti rohovek omezující nutnost mrkání. Nejčastěji používaný benzalkonium chlorid snižuje stabilitu slzného filmu a dlouhodobé podávání způsobuje abnormality epitelových buněk, ale i ztrátu pohárkových buněk spojivky. Také některé celkově podávané léky, jako např. amiodaron, antihypertenziva, antihistaminika, betablokátory, diuretika, hormonální substituce (estrogen a progesteron) a tricyklická antidepresiva, zase snižují produkci slz [3, 33].
KCS byla pozorována u chronické hepatitidy typu C [34] , u HIV pozitivních pacientů [44] či u dětí s infekcí EBV [32]. KCS je rovněž spojen se zhruba 15 systémovými onemocněními pojivové tkáně [34]. Hlavním představitelem je Sjögrenův syndrom, kdy postižení slzné žlázy negativně ovlivňuje produkci slz. Příčinou mohou být některé záněty hlavně virové etiologie, které mohou slznou žlázu destruovat, uvažuje se především o EBV, dalšími viry jsou CMV, virus vyvolávající parotitidu a některé enteroviry [33, 34].
Podpořeno grantem IGA NS 10016/4
MUDr. Jan Krásný
Oční
klinika FNKV
Šrobárova
50
100
34 Praha 10
e-mail:
krasny@fnkv.cz
Sources
1. Aldous, M. B., Grayston. J. T., Wang, S. P., Foy, H. M.: Seroepidemiology of Chlamydia Pneumoniae TWAR Infection in Seattle Families, 1966–1979. J Infect Dis, 166, 1992 : 646–649.
2. Balin, B.J., Gerard, H.C., Arking, E.J. et al.: Identification and Localization of Chlamydia Pneumoniae in the Alzheimer’s Brain. Med Microbiol Immunol, 187, 1998 : 23–42.
3. BenEzra, D. (ed): Blepharitis and Conjunctivitis – Guideline for Diagnosis and Treatment, Chapter 16: Dry Eye, Editorial Glosa, Barcelona, 2006, pp. 123–206, ISNB 84-7429-268-9.
4. Blasi, F., Boman, J., Esposito, G. et al.: Chlamydia Pneumoniae DNA Detection in Peripheral Blood Mononuclear Cells Is Predictive of Vascular Infection. J. Infect. Dis. 180, 1999 : 2074–2076.
5. Blasti, F., Fagetti, L., Allegra, L.: Chlamydia Pneumoniae Detection in Atherosclerotic Plaque in Italy. J Infect Dis, 181, 2000; suppl. 3 : 444–446.
6. Cunningham, A.F., Johnston, S.L., Julious, S.A., et al.: Chronic Chlamydia Pneumoniae Infection and Asthma Exacerbations in Children. Eur Respir. J. 11, 1998 : 345 – 349
7. Dawson, Ch.R., Schachter, J., Stephens, R.D.: Chlamydial Keratoconjunctivitis. In: Pepose, J.S., Holland, N.G., Wihelmus, K.R.: Ocular Infection & Immunity. Mosby, St. Louis, 1995, pp. 818–829, ISBN 0-8024-3422-7.
8. Di Pietro, M., Schiavoni, G., Del Pieno, M. et al.: Chlamydia Pneumoniae and Atherosclerosis: the Role of Mast Cell. J Biol Regul Homeost Agents, 23, 2009 : 65–69.
9. Dowel, V. et al.: Standardizing Chlamydia Pneumoniae Assays: Recommendations from the Centers for Disease Control and Prevention (USA) and the Laboratory Centre for Disease Control (Canada). Clin Infect Dis, 33, 2001 : 492–503.
10. Dwyer, R., Treharne, J.D., Jones, B.R., Herring, J.: Chlamydial Infection: Results of Microimmunofluorescence tests for the Detection of Type-specific Antibody in Certain Chlamydia Infection. Br J Vener Dis. 48, 1972 : 452 – 459.
11. Fainardi, E., Castellazi, M., Tamborino, C. et al.: Chlamydia Pneumoniae – specific Intratheal Oligoclonal Antibody Response in Predominantly Detected in a Subret of Multiple Sclerosis Patients with Progressive Forms J Neurovirol, 15, 2009 : 425–433.
12. Forsey, T., Darougar, S.: Acute Conjunctivitis Caused by an Atypical Chlamydia Strain 10L 207. Br J Ophthalmol, 68, 1984 : 408.
13. Fujita, M., Hatachi, S., Yagita, M.: Acute Chlamydia Pneumoniae Infection in the Pathogenesis of Autoimmune Diseases. Lupus, 18, 2009; 164–168.
14. Grayton, J.T.: Design of Future Intervention Studies for Chlamydia Pneumoniae in Atherosclerosis. Am Heart J, 138, 1999, 5 Pt 2: S556–S557.
15. Hahn, D.L.: Chlamydia Pneumoniae, Asthma and CHOPD: What Is the Evidence? Annals of Allergy, Asthma & Immunol, 83, 1999 : 271–288.
16. Hightower, L. E.: Heat Shock, Stress Proteins, Chaperones and Proteotoxicity. Cell, 56, 1991 : 191–197.
17. Hrubá, D., Kodat, V., Krásný, J.: Sérologické nálezy chlamydiových protilátek v České republice (kontrolní soubor studie: Chlamydia Pneumoniae v etiologii keratokonjunktivitis sicca). Čas Lék česk, 16, 2011: v tisku
18. Huittinen, T., Leinonen, M., Tenkanen, L. et al.: Autoimmunity to Human Heat Shock Protein 60, Chlamydia Pneumoniae Infection, and Inflammation in Predicting Coronary Risk. Arteriosclerosis Thrombosis and Vascular Biology, 22, 2002 : 431–437.
19. Koskiniemi, M., Gencay, M., Salonen, O., et al.: Chlamydia Pneumoniae Associated with Central Nervous System Infections. Eur Neurol, 36, 1996 : 160–163.
20. Krásný, J., Borovanská, J., Hrubá, D.: Chlamydia Pneumoniae – etiologie Ophthalmia neonatorum. Čes Slov Oftal, 59, 2003 : 240–248.
21. Krásný, J., Borovanská, J., Hrubá, D.: Chlamydia Pneumoniae – etiologie folikulární konjunktivitidy a následné keratokonjunktivitis sicca u dospělých pacientů. Čes Slov Oftal, 59, 2003 : 325–333.
22. Krásný, J., Borovanská-Tomášová, J., Hrubá D.: Relationship between Chlamydia trachomatis and Chlamydia Pneumoniae as the Cause of Neonatal conjunctivitis (Ophthalmia Neonatorum). Ophthalmologica, 219, 2005 : 232–236.
23. Krásný, J., Hrubá, D., Tomášová-Borovanská, J.: Chlamydiové infekce oka. In : Rozsíval, P. (Ed).: Moderní trendy v oftalmologii, Praha, Galen, 2005, s. 177–203, ISBN 80-7262-326-5.
24. Krásný, J., Hrubá, D., Netuková, M., et al.: Keratokonjunktivitis sicca v pohledu možné chlamydiové infekce. Sborník XVI. Sjezdu ČOS, Nukleus HK, 2008, s. 45–46.
25. Krásný, J., Hrubá, D., Netuková, M., et al.: Chlamydia pneumoniae v etiologii keratokonjunktivitis sicca u dospělých pacientů. Čes Slov Oftal, 65, 2009 : 102–106.
26. Krásný, J., Hrubá, D., Kodat, L., et al.: Sérologické nálezy u pacientů s keratokonjunktivis sicca a kontrolního souboru u chlamydiové infekce. Sborník XVIII. sjezdu ČOS, Nukleus HK, 2010, s. 113.
27. Kumar, S., Hammerschlag, M.R.: Acute Respiratory Infection Due to Chlamydia Pneumoniae: Current Status of Diagnostic Methods, CID 44, 2007 : 568–576.
28. Lajunen, T., Vikatmaa, P., Bloigu, A. et al.: Chlamydial LPS and High-sensitivity CRP Levels in Serum Are Associated with an Elevated Body Mass Index in Patients with Cardiovascular Disease. Innate Immun. 14, 2008 : 375–382.
29. Laurila, A.L., Anttila, T., Laara, E., et al.: Serological Evidence of an Association between Chlamydia Pneumoniae Infection and Lung Cancer. Int J Cancer, 74, 1997 : 31–34.
30. Lietman, T., Brooks, D.,Moncada, J., et al.: Chronic Follicular Conjunctivitis Associated with Chlamydia Psittaci and Chlamydia Pneumoniae. Clin Infect Dis, 26, 1998 : 1335–40.
31. Lutsey, P.L., Pankow, J.S., Bertoni, A.G. et al: Serogical Evidence of Infections and Type 2 Diabetes: the MultiEthnic Study of Atherosclerosis. Diabet. Med. 26, 2009 : 149–152.
32. Merayo-Lloves, J., Baltatzis, S., Foster, C.S.: Epstein-Barr Virus Dacryoadenitis Resulting in KCS in a Child. Am J Ophthalmol, 132, 2001 : 922–923.
33. Pflugfelder, S.C., Beuerman, R.W.: Dry Eye and Ocular Surface Disorders. New York, M. Dekker, 2004, p. 428, ISBN 0-8024-3422-7.
34. Pflugfelder, S.C., Whitcher, J.P., Troy, E.D.: Sjogren Syndrome. In: Pepose, J.S., Holland, N.G., Wihelmus, K.R.(Ed) : Ocular Infection & Immunity. St. Louis, Mosby, 1995, pp. 313–333, ISBN 0-8016-6757-7.
35. Puolakkainen, M., Campbell, L.A., Kuo, C.C. et al.: Serological Response to Chlamydia Pneumoniae in Patients with Sarcoidosis. J Infection, 33, 1996 : 199–205.
36. Rantala, A., Lajunen, T., Juvonen, R. et al.: Chlamydia Pneumoniae Infection Is Associated with Elevated Body Mass Index in Young Men. Epid Infect, 17, 2009 : 1–7.
37. Ridker, P.R., Kundsin, R.B., Stampfer, M.J., et al.: Prospective Study of Chlamydia Pneumoniae IgG Seropositivity and Risk of Future Myocardial Infraction. Circulation, 99, 1999 : 1161–1164.
38. Schirmer, O.: Studies zur Physiologie und Pathologie der Tranenabsonderung und Tranenabfuhr. Graefes Arch. Clin. Exp. Ophthalmol. 56, 1903 : 47–60.
39. Schumacher, H.R. Jr., Gerad, H.C., Arayssi, T.K., et al.: Lower Prevalence of Ch. Pneumoniae DNA compared with Ch. trachomatis DNA in Synovial Tissue of Arthritis Patients. Arthritis Rheum. 42, 1992 : 1889–93.
40. Sodja, J.: Sérologický přehled chlamydiových protilátek. Zprávy CEM 1998, č.7, s. 34–36.
41. Sriram, S., Mitchel, W., Stratton, C.: Multiple Sclerosis Associated with Ch. Pneumoniae Infection of the CNS. Neurology, 50, 1998 : 571–572.
42. van Bijsterveld, O.: Diagnostic Test in the Sicca Syndrome. Arch. Ophthalmol. 82, 1969 : 10–14.
43. Weslen, L., Pahlson, C., Lindquist, O., et al.: An Increase in Sudden Unexpected Cardiac Deaths Among Young Swedish Orienteers During 1979–1992. E Heart J, 17, 1996 : 902–910.
44. Willoughby, C.E., Barker, K., Kaye, S.B., et al.: Epstein-Barr Virus in the Tear Film in Sjogrenęs Syndrome and HIV Infection. J. Med. Virol, 68, 2002 : 378–383.
45. Wu, L., Skinner, S.J., Lambie, N et al.: Immunohistochemical Staining for C. pneumoniae Is Increased in Lung Tissue from Subject with Chronic Obstructive Pulmonary Disease. Am J Respir Crit Care Med, 162, 2000 : 1148–51.
Labels
OphthalmologyArticle was published in
Czech and Slovak Ophthalmology

2011 Issue 2
-
All articles in this issue
- Keratoconjunktivitis sicca (KCS) při folikulární konjunktivitidě u dospělých pacientů s etiologií Chlamydia pneumoniae (souhrnná dvanáctiletá studie)
- Visual Functions and Quality of Life in Patients with Keratoconus
- EPI-LASEK – Our Experience
- Comparison of Topic Mydriasis and Mydriasis Achieved by Soaked Cellulose in the Conjunctival Sac
- Benzalkonium Chloride Daily Dose – an Important Criterion in Glaucoma Treatment
- Ocular Signs and Symptoms after Scoliosis Surgery (a Case Report)
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Benzalkonium Chloride Daily Dose – an Important Criterion in Glaucoma Treatment
- Ocular Signs and Symptoms after Scoliosis Surgery (a Case Report)
- Visual Functions and Quality of Life in Patients with Keratoconus
- Keratoconjunktivitis sicca (KCS) při folikulární konjunktivitidě u dospělých pacientů s etiologií Chlamydia pneumoniae (souhrnná dvanáctiletá studie)
