Retinopatia prematúrnych detí – terapia II. časť
Retinopathy of Prematurity – Therapy. Part 2
Retinopathy of prematurity (ROP) is a disease that affects immature vasculature in the eyes of premature babies that potentially leads to blindness. Authors describe revised indications for the treatment of ROP, standard treatment – peripheral retinal ablation by laser photocoagulation and the cryotherapy using off label treatment-intravitreal anti-VEGF injection.
Key words:
retinopathy of prematurity, indications, laser photocoagulation, cryotherapy, intravitreal anti-VEGF therapy
Authors:
Z. Prepiaková; D. Tomčíková; B. Kostolná; A. Gerinec
Authors‘ workplace:
Klinika detskej oftalmológie DFNsP LFUK, Bratislava, prednosta kliniky prof. MUDr. Anton Gerinec, CSc.
Published in:
Čes. a slov. Oftal., 70, 2014, No. 2, p. 50-54
Category:
Comprehensive Report
Overview
Retinopatia prematúrnych detí (ROP) je potencionálne oslepujúce ochorenie, ktoré postihuje nezrelú sietnicu prematúrnych detí. Autori podávajú súhrnný pohľad indikácií na liečbu ROP a terapeutických možností – štandardnej liečby periférnou abláciou sietnice laserovou koaguláciou a kryopexiou, ako aj použitie off label liečby intravitreálnou aplikáciou anti-VEGF preparátov.
Kľúčové slová:
retinopatia prematúrnych detí, indikácie, laserová koagulácia, kryoterapia, intravitreálna anti-VEGF terapia
Liečba retinopatie prematúrnych detí bola a stále je predmetom intenzívneho výskumu. Zatiaľ neexistuje medikamentózna liečba, ktorá by bola schopná ovplyvniť priebeh akútnej ROP (30). Základom liečby ostáva chirurgická – laserová koagulácia a kryopexia avaskulárnej sietnice.
Indikácie
Na základe výsledkov multicentrickej štúdie CRYO-ROP (Cryo therapy for Retinopathy of Prematurity) v roku 1988 indikáciou na liečbu bolo stanovené prahové threshold štádium – 3. štádium ROP (obr. 1, 2), ktoré zasahuje kontinuálne rozsah 5 hodín, alebo kumulatívne rozsah 8 hodín v zóne I alebo II, pri prítomnosti plus formy ochorenia (7, 8). Vzhľadom na lepšie anatomické výsledky, dosiahnuté pri veľmi včasnej liečbe, keď poklesol výskyt nepriaznivých štrukturálnych zmien na očnom pozadí pri 9-mesačnom sledovaní, (z 15,6 % na 9,1 %), od roku 2003 podľa randomizovanej kontrolovanej ETROP štúdie (10) prišlo k zmenám indikácií na liečbu. Bola určená definícia predprahového pre-threshold štádia (obr. 3) a to bolo rozdelené na 2 typy: typ 1 a typ 2, pričom pri rizikovom type 1 bola odporučená včasná liečba. Predprahové pre-threshold štádium predstavuje v zóne I akékoľvek štádium s plus formou alebo ROP 3. štádia bez plus formy a v zóne II ROP 2. alebo 3. štádia pri prítomnosti plus formy (tab. 1). Typ 1 ROP vysoko riziková je indikovaná na včasnú kryo alebo laserovú ablatívnu liečbu, ktorá má byť vykonaná do 72 hodín od stanovenia pre-threshold štádia, a typ 2 ROP málo riziková, ktorá nevyžaduje okamžitú liečbu. Pri type 2 ROP nie je potrebná okamžitá liečba, ale sledovanie progresie v pravidelných intervaloch, prístup wait-and-watch, a liečbu je potrebné zvažovať len pri prechode ROP typu 2 do typu 1. Za typ 2 ROP sú považované všetky ostatné predprahové štádia ROP bez plus formy (tab. 1). Stav vaskulatúry na sietnici – prítomnosť plus formy ochorenia je teda veľmi dôležitým faktorom pri určovaní indikácie k liečbe.
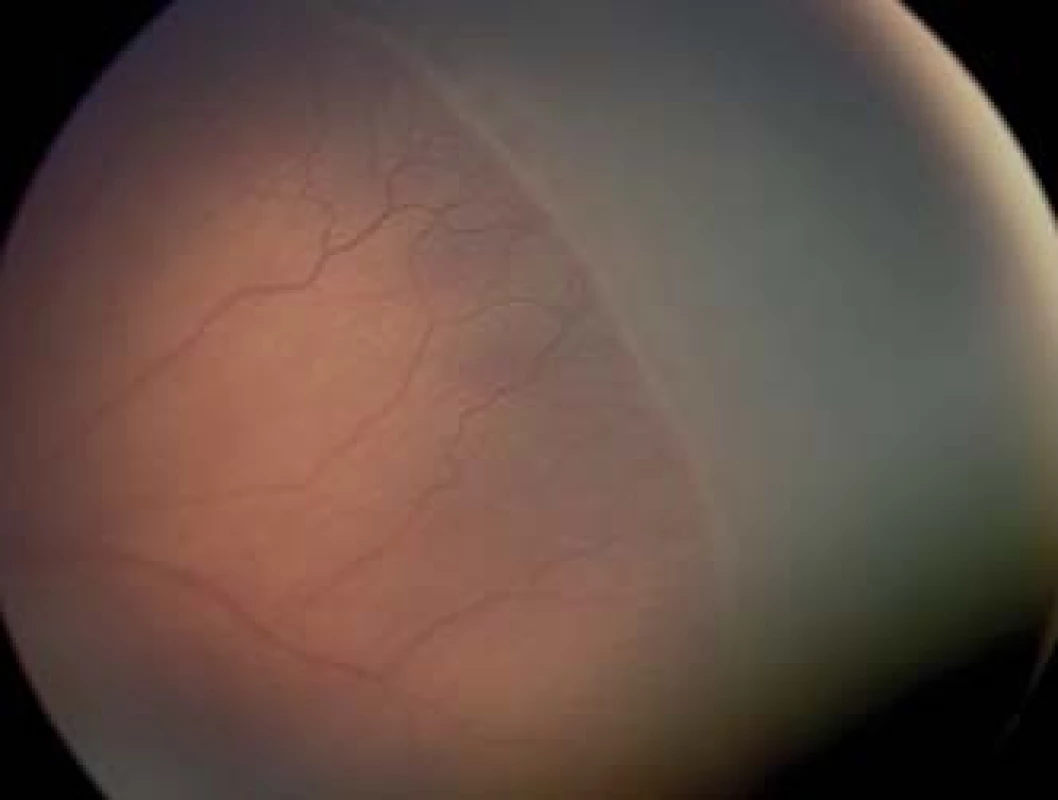
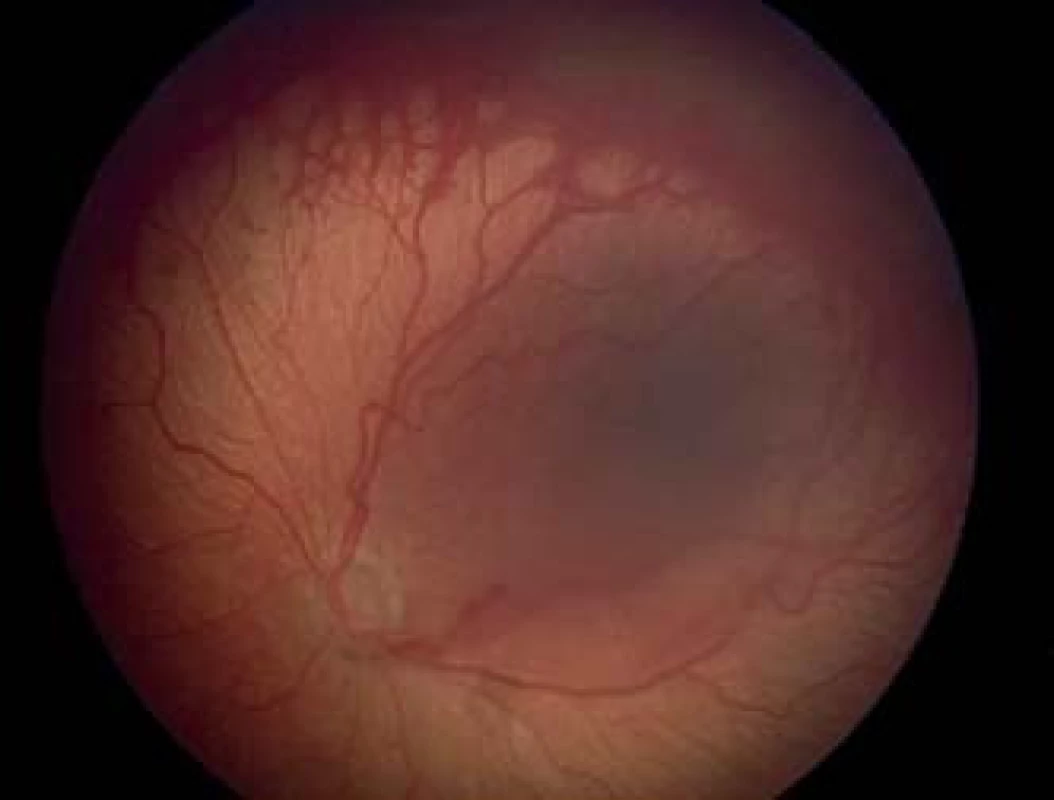
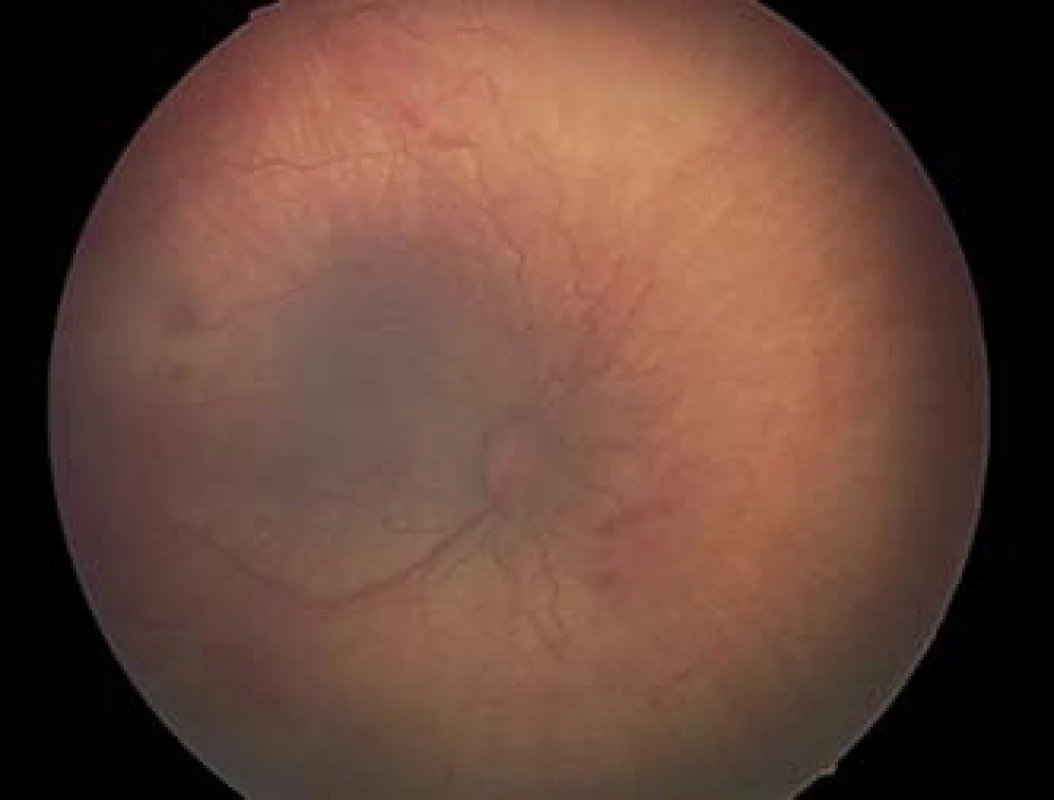

Plus forma bola v ETROP štúdii definovaná ako prítomnosť dilatácie a tortuozity ciev na zadnom póle minimálne v 2 kvadrantoch (6 a viac hodín) v rovnakej alebo výraznejšej miere ako na štandardnej fotografii CRYO-ROP z roku 1980.
Podstatou klasickej chirurgickej liečby ROP je deštrukcia avaskulárnej sietnice kryo alebo laserovou abláciou, ktorou sa dosiahne zmenšenie retinálnej hypoxie, zníženie produkcie VEGF a ostatných angiogénnych mediátorov a dosiahne sa regresia ochorenia.
Kryopexia sietnice
Kryopexia bola od 80. rokov minulého storočia na základe výsledkov štúdie Cryo - ROP hlavným spôsobom liečby retinopatie nedonosených detí. Vďaka kryoterapii došlo k redukcii nepriaznivých anatomických výsledkov pri liečbe prahového štádia ROP zo 47,9 % v neliečenej skupine na 27,2 % pri liečbe (9). Pri kryopexii sa aplikujú zásahy na oblasť avaskulárnej sietnice pomocou kryosondy pri teplote -60° až -80° C pod kontrolou nepriamej oftalmoskopie. Počet zásahov závisí od veľkosti avaskulárnej zóny, pričom každý kryo zásah je vidno pri aplikácii ako výrazné zbelenie sietnice. Ošetrenie zadného pólu je veľmi náročné a nezaobíde sa bez otvorenia spojovky a často nie je dostatočné. Na koaguláciu zadného pólu sietnice je možné použitie špeciálne zahnutých detských sond, ktoré do istej miery umožňujú aj čiastočné ošetrenie tejto časti sietnice. Niektoré pracoviská preto používajú techniku ošetrenia periférie sietnice kryopexiou v kombinácii s laserovou fotokoaguláciou centrálnych častí sietnice, čím sa skráti doba výkonu. Výhodou kryopexie je, že môže byť použitá aj pri zníženej transparencii optických médií. Pri kryopexii sa môžu vyskytovať systémové (bradykardia, tranzientná hypotenzia, zástava dýchania...), ako aj lokálne komplikácie. Pooperačne je spojená s výrazným opuchom až chemózou spojovky, bolestivosťou, eleváciou vnútroočného tlaku. Z neskorších komplikácií sa opisuje zakrvácanie do sklovcového priestoru, intraretinálne krvácania, deformácie makulárnej krajiny, atrofia zrakového nervu a výrazné zúženie zorného poľa až k trubicovitému videniu. V porovnaní s laserovým ošetrením spôsobuje väčšiu deštrukciu tkaniva a u detí ošetrených kryopexiou je neskôr popisovaný vyšší výskyt klinicky významnej myopie v porovnaní s očami po laserovom ošetrení (6). V poslednom období je kryopexia používaná skôr ako aditívna liečba pri progresii ROP a pri zníženej transparencii optických médií.
Laserová fotokoagulácia sietnice
Laserová fotokoagulácia je dnes vzhľadom na menší výskyt komplikácií a porovnateľnú efektivitu považovaná za štandardnú liečbu ROP, väčšinou sa aplikuje transpupilárne, je možný aj transsklerálny prístup. Pomocou diódového laseru s vlnovou dĺžkou 810 nm s využitím nepriamej oftalmoskopie a 28 alebo 20 D spojnej šošovky sa transpupilárne koaguluje avaskulárna časť sietnice, anteriórne od miesta fibroproliferácií až po ora serrata laserovým lúčom s energiou od 200–400 mW s trvaním zásahu od 200–400 ms. Výsledná stopa by mala byť sivobelavá a počet zásahov varíruje v závislosti od veľkosti avaskulárnej zóny od 200–3000. Pri laserovej liečbe môže byť použitá metóda jednotlivých zásahov (so vzdialenosťou 1,0 až 1,5 stopy medzi jednotlivými zásahmi), metóda takmer konfluentných zásahov (vzdialenosť 0,5 až 1,0 veľkosti stopy medzi zásahmi) alebo metóda splývajúcich zásahov, pri ktorej nie sú ponechané medzi jednotlivými laserovými stopami voľné priestory (obr. 4, 5). V súčasnosti je trend k použitiu denznejších foriem fotokoagulácie pri liečbe ROP (3, 4, 15). Pri ich použití je menšia progresia do vyšších štádií ROP a menšia potreba doplňujúcej liečby. Pri porovnávaní metódy jednotlivých zásahov verzus takmer konfluujúcich zásahov sa metóda denznejších zásahov javí ako bezpečnejšia (28, 38). Laserová fotokoagulácia umožňuje ošetrenie sietnice aj u agresívnych posteriórnych foriem retinopatie na zadnom póle, čo nebolo možné dosiahnuť kryosondou, pričom perifériu sietnice je možné laserovať s použitím sklerálneho indentátora. Problémom je laserová koagulácia pri úzkej pupile, zníženej transparencii médií ako pri výskyte tunica vasculosa lentis, zákaloch a hemoragiách sklovca. Laserové ošetrenie je v porovnaní s kryopexiou časovo náročnejšie, avšak využitie nových typov laserov s možným konfluujúcim – paint režimom laseru výrazne skracuje dobu a umožňuje rýchlejšiu a kvalitnejšiu laserkoaguláciu avaskulárnej sietnice s menšou záťažou pre prematúrne dieťa. V prípade použitia metódy jednotlivých laserových zásahov je na skrátenie doby výkonu možné kombinované ošetrenie posteriornej sietnice laserovou fotokoaguláciou a periférnej sietnice kryokoaguláciou. Dlhodobé výsledky dokazujú podobnú efektivitu pre navodenie regresie ROP, pričom po fotokoagulácii je štatisticky významné vyššie percento očí s anatomicky dobrým nálezom a uvádza sa aj lepšia zraková ostrosť v porovnaní s kryoterapiou (2). V porovnaní s kryopexiou laserkoagulácia spôsobuje menšiu zápalovú reakciu a menšie mechanické poškodenie tkaniva. Čo sa týka pooperačných komplikácií po diódlaserkoagulácii, bývajú väčšinou tranzitórne a vyskytujú sa na prednom i zadnom segmente oka. Môže byť prítomný prechodný edém rohovky, drobné krvácanie do prednej komory, ruptúry dúhovky, vitreálne a intraretinálne hemoragie, ktoré majú tendenciu sa spontánne vstrebať. Výskyt katarakty ako komplikácie sa udáva do 1 % (17), častejšie pri prítomnosti tunica vasculosa lentis, vplyvom absorpcie laserového žiarenia a môže byť vo forme drobných fokálnych šošovkových opacitov bez signifikantného vplyvu na vízus ako aj súčasne s ischémiou predného segmentu a následnou ftízou bulbu. Výskyt komplikácií sa predpokladal hlavne pri konfluentnom type laserovania, avšak nebol potvrdený signifikatne vyšší výskyt (15) a pri porovnávaní jednotlivých metód je metóda denznejších zásahov účinnejšia (28, 38). Dlhodobé komplikácie ešte nie sú dostatočne známe, ale zahŕňajú straty na periférii zorného poľa, riziko vyššieho výskytu neskorého odlúčenia sietnice vzhľadom na prítomnosť trhlín a jaziev na rozhraní laserovanej sietnice a prítomnosť abnormálnych vitreoretinálnych trakcií (4). Výskyt vysokej myopie a anizometropie u prematúrnych detí po laserovom ošetrení je nižší ako po kryopexii a je čiastočne spôsobený inhibíciou rastu predného segmentu bulbu s anteriorne umiestnenou šošovkou s vyššou optickou mohutnosťou.
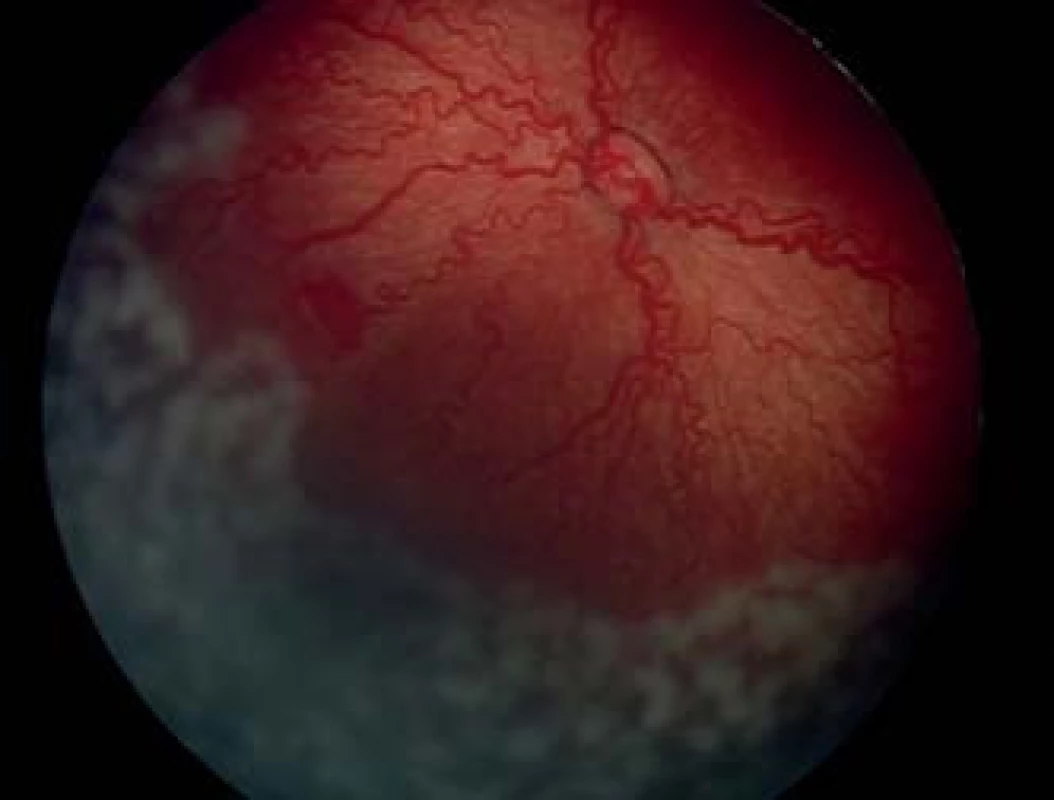
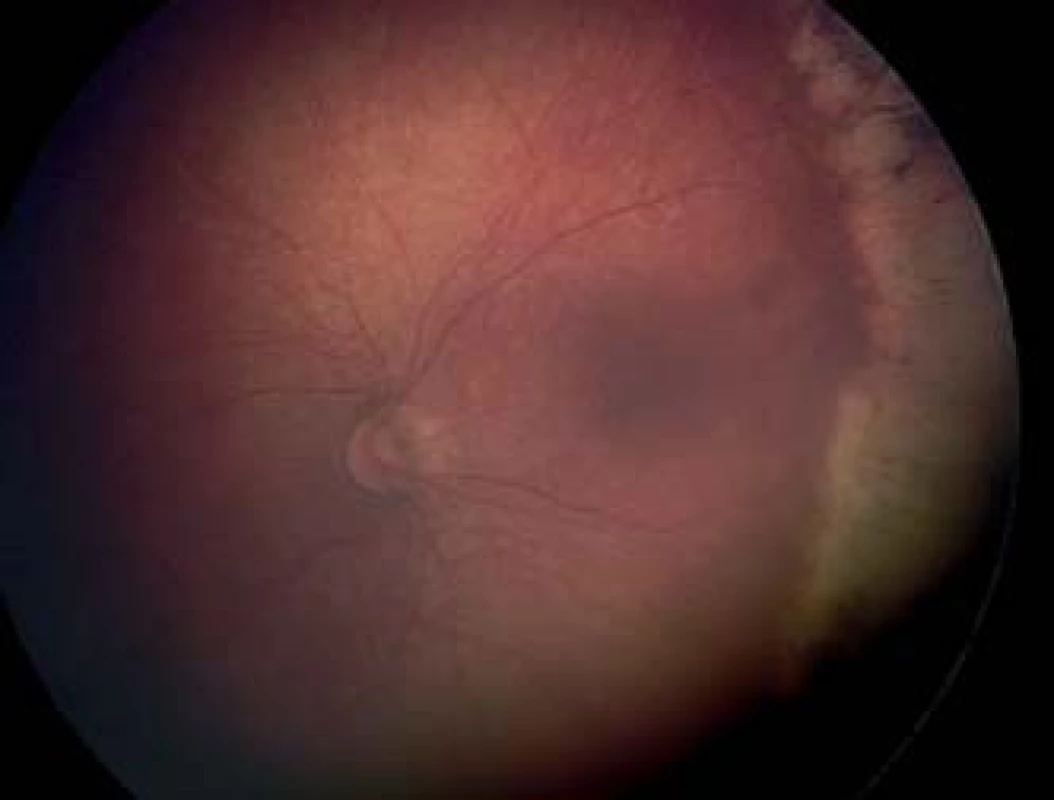
Opakovaná liečba (retreatment)
Pri nedostatočnej regresii a pretrvávaní aktivity ochorenia, keď v priebehu 1–2 týždňov nedochádza k ústupu plus formy, pretrváva dilatácia a tortuozita ciev a sú prítomné tzv. skip oblasti (skip area) s nedostatočne olaserovanou časťou sietnice, hypoxická sietnica ostáva rezervoárom na kontinuálnu produkciu rastových faktorov. Je nutné doplnenie laserovej liečby v mieste skip oblastí, prípadne pri výraznej aktivite a progresii retinopatie v závislosti od nálezu je možná doplnková kryopexia.
Liečba akútneho odlúpenia sietnice.
Sklerálna bukláž a vitrektómia
V prípade ďalšej progresie a rozvoja nepriaznivých štrukturálnych zmien s vývojom amócie sietnice je indikovaná chirurgická intervencia, pričom typ operačného výkonu závisí od štádia ROP, retrolentárnych pomerov, vaskulárnej aktivity ochorenia (prítomnosť plus formy a neovaskularizácií) a prítomnosti exsudatívnych komponentov (32). Pri periférne lokalizovanej a počínajúcej amócii sietnice (4. a št. ROP) je vhodné našitie penovej episklerálnej plomby, ktorá sa ponecháva na mieste 3–6 mesiacov. V prípade väčšieho rozsahu amócie je možná sklerálna bukláž, pričom serklážna páska sa vyberá do 1 roku vzhľadom na riziko retardácie rastu bulbu. Dlhodobé funkčné výsledky cirkulárnej sklerálnej bukláže však často aj pri anatomickom priložení sietnice nebývajú na rozdiel od našitia episklerálnej plomby presvedčivé. Pravdepodobne indukovaná myopizácia bulbu v dôsledku axiálnej elongácie a posun šošovky smerom dopredu pôsobia potencionálne amblyogénne. Kým v minulosti bola vitrektómia poslednou alternatívou, v prípade neúspešnosti sklerálnej bukláže, v súčasnosti je niektorými pracoviskami preferovaná primárna vitrektómia (35), ktorá môže byť kombinovaná súčasne so sklerálnou buklážou. Výhodou vitrektómie v 4. štádiu ROP je súčasné uvoľnenie anteroposteriórnych trakcií spolu s odstránením endogénnych vazodilatátorov a angiogénnych faktorov (VEGF) z kavity sklovca (34). Priaznivejšie výsledky sa dosahujú pokiaľ je operácia indikovaná až po odoznení aktivity ochorenia s ústupom plus formy v 4. a štádiu ROP. Pri retinopatii nedonosených sú zaužívané techniky lens sparing (šošovku šetriaca) vitrektómia a vitrektómia s dvoma vstupmi, ako bezpečná a efektívna u ROP 4. a 5. štadia bola referovaná aj 25-guage pars plicata vitrektómia (14). Vitrektómia u novorodenca a dospelého sa odlišuje z niekoľkých hľadísk (39): miestom vstupu je vhodnejšia pars plicata ako pars plana, šošovka je relatívne väčšia, ťažšie je možné dosiahnuť odlúčenie kortikálneho sklovca, trhliny sú horšie tolerovateľné a zriedkavejšie úspešne zreparované, častejšie sa vyskytuje pupilárna membrána, bývajú prítomné irido-retinálne a retinálno-retinálne adhézie, subretinálne hemoragie a exsudácie spolu s degeneráciou retinálneho pigmentového epitelu znemožňujú dobré funkčné výsledky a v neposlednom rade maximum funkčného rozvoja je možné očakávať až v priebehu niekoľkých rokov. Všeobecne však funkčné výsledky bývajú často veľmi slabé, keď výsledný vízus je limitovaný na percepciu svetla, aj keď sa anatomicky sietnica priložila. V prematúrnej sietnici začínajú fotoreceptory (čapíky a tyčinky) degenerovať krátko po odlúpení sietnice na rozdiel od dospelých, u ktorých sa dobré výsledky môžu dosiahnuť dokonca niekoľko týždňov po vzniku amócie (11). Neskoro indikovaná vitrektómia nemôže zabezpečiť funkčnú aktivitu ani keď je sietnica priložená, organická amblyopia je zapríčinená zničením retinálnych receptorov, ktoré nastáva 2–3 týždne po odlúpení nezrelej sietnice (20). Zlepšenie výsledkov chirurgickej liečby priniesla kombinácia vitrektómie s farmakoterapiou s predoperačným intravitreálnym podaním anti-VEGF, alebo triamciolonu intravitreálne na konci operácie (18) na zníženie vaskulárnej aktivity ochorenia. Kompletné priloženie sietnice v 5. štádiu ROP udávajú autori pri enzýmovo-asistovanej vitrektómii s použitím autológneho plazmínu na uľahčenie separácie kortikálneho sklovca a proliferatívnych membrán od sietnice (40). Je ťažké porovnávať výsledky štúdií vzhľadom na veľkú heterogenitu pacientov, nálezov na sietnici a aktivity ochorenia pri použití rôznych chirurgických techník riešenia progredujúcich závažných foriem ROP. Ich účinná liečba ostáva stále problematická, a aj keď od zavedenia doporučení ETROP štúdie do praxe sa znížil počet očí, v 4. a 5. štádiu ROP, stále je potrebné klásť zvýšený dôraz na prevenciu ich vzniku.
Nové metódy liečby – intravitreálne podanie anti-VEGF
V patogenéze ROP dochádza k vazoobliterácii s následnou neovaskularizáciou, pričom v progresii ochorenia je dôležitým faktorom hypoxia s ďalšími kľúčovými rastovými mediátormi – VEGF a erytropoetínom (37). Úloha VEGF pri vývoji retinopatie bola dokázaná a objavujú sa práce, poukazujúce na sľubný efekt intravitreálne podaných antirastových faktorov v liečbe neovaskularizácií pri ROP. Anti-VEGF látky ako pegaptanib sodium, ranibizumab a bevacizumab boli skúmané off-label, avšak žiaden z nich nebol doposiaľ schválený na použitie v pediatrickej praxi. V literatúre boli publikované úspešné výsledky po jednorazovom intravitreálnom podávaní bevacizumabu (pre veľkú molekulu 150 kD bevacizumab nemôže penetrovať z intaktnej sietnice a až na malé množstvá uniknúť do obehu), keď u 11 detí (22 očí) s ROP v zóne I a posterior zóne II bolo podané intravitreálne obojstranne 0,625 mg/ 0,025 ml bevacizumabu (Avastin) bez predchádzajúceho laserového ošetrenia, pričom neboli pozorované systémové ani lokálne nežiadúce účinky (25). V USA prebieha multicentrická prospektívna štúdia BEAT-ROP u 150 detí – Bevacizumab Eliminates the Angiogenic Threat of Retinopathy of Prematurity (24). V poslednom období boli publikované práce s intravitreálnou aplikáciou ranibizumabu (Lucentis 0,25 mg/0,025 ml) v monoterapii (5). Autori vzhľadom na kratší polčas rozpadu a vyššiu väzbovú afinitu ranibizumabu v porovnaní s bevacizumabom predpokladajú menší výskyt nežiadúcich účinkov, u 6 očí po 1 injekcii došlo k regresii ochorenia a neboli pozorované systémové ani lokálne nežiadúce účinky. Efektívne sa ukázalo aj použitie kombinovanej liečby laserového ošetrenia s následným podaním intravitreálnej injekcie anti-VEGF a intravitreálne podanie pri nedostatočnej regresii alebo zlyhaní laserovej liečby, pričom spolu s laserovou liečbou boli použité jednak bevacizumab (Avastin) (22, 31) ranibizumab (Lucentis) (26) a pegaptanib (Macugen) (1). Intravitreálne podanie anti-VEGF však môže viesť k nežiadúcim kontrakciám proliferatívnych membrán a zhoršeniu trakčnej amócie (16), niektoré práce popisujú po intravitreálnom podaní bevacizumabu systémové nežiadúce účinky ako tromboembolické komplikácie či hypertenziu, tak ako pri intravenóznej onkologickej liečbe (12, 36). Bolo dokázané, že bevacizumab predsa len môže uniknúť do systémovej cirkulácie, s následným znížením sérových hladín VEGF, pričom vyvíjajúce sa životne dôležité orgány (mozog, pľúca) sú stále závislé na regulačných cievnych procesoch a potrebujú VEGF pre ďalší vývoj (29, 33). V porovnaní s konvenčnou laserovou liečbou pri liečbe intravitreálne podanými anti-rastovými faktormi nedochádza k trvalej deštrukcii sietnice so zúžením zorného poľa a retinálne cievy postupne dorastú až do periférie. Počas normálneho vývoja retinálnej vaskulatúry sa mení hladina VEGF, preto je veľmi dôležité správne načasovanie podania VEGF inhibítora. Vzhľadom na možné recidívy ROP pri liečbe anti-VEGF je potrebné dlhšie dôsledné sledovanie a zhodnotenie nálezu na sietnici, s možnou opakovanou liečbou, po dobu minimálne 16 týždňov po aplikácii injekcie. Intravitreálne podanie sa ukazuje ako perspektívna a účinná liečba overená na malých sériách pacientov. Jej bežné používanie vyžaduje prospektívnu randomizovanú multicentrickú klinickú štúdiu, najmä z hľadiska možných nežiadúcich účinkov liečby (23, 25).V súčasnosti u nás ostáva rezervované na použitie v prípadoch slabej dilatácie zrenice, opáknych médií so zhoršenou vizualizáciou a nemožnosťou laserového ošetrenia alebo u detí pri nedostatočnej regresii po primárnej diódlaserkoagulácii sietnice a u niektorých agresívnych posteriórnych foriem AP-ROP s veľmi krátkymi cievami, nedosahujúcimi makulárnu oblasť (19, 21).
Záver
Je potrebné zdôrazniť dôležitosť spolupráce oftalmológa s neonatológom, a to nielen v skríningovom, ale aj v diagnosticko-liečebnom procese ROP. Vďaka výrazným pokrokom v neonatologickej starostlivosti, uváženej a kontrolovanej aplikácii kyslíku, novým postupom pri ventilácii, aplikácii surfaktantu, antenatálnom podávaní kortikoidov ostáva u nás celková incidencia, aj incidencia ťažkých foriem ROP v posledných rokoch stabilizovaná. Zavedenie adekvátneho skríningového programu prahových, resp. predprahových štádií retinopatie prematúrnych detí a včasné ošetrenie s kompletnou abláciou periférnej avaskulárnej sietnice priniesli výrazné zlepšenie anatomických aj funkčných výsledkov u prematúrnych detí. Aj keď telemedicína s možnosťou dokumentácie a prenosu snímkov pomocou RetCam môže napomôcť ďalšiemu zlepšeniu diagnostiky a liečby retinopatie nedonosených detí, vyšetrenie sietnice nepriamym oftalmoskopom s použitím indentácie je stále kľúčovým vyšetrením v jej diagnostike. Technologický progres a nové techniky konfluentnej diódlaserkoagulácie umožňujú v dnešnej dobe rýchle a bezpečné ošetrenie sietnice. V budúcnosti je možné očakávať rozvoj medikamentóznej terapie a prevencie ROP. Veľmi nádejné sú posledné výsledky multicentrických prospektívnych štúdií s použitím intravitreálne aplikovaných antirastových faktorov, predovšetkým u agresívnych posteriórnych foriem AP-ROP, na štandardné zavedenie tejto liečby je však potrebné počkať na dlhodobejšie výsledky u väčších súborov pacientov. Dochádza k renesancii aplikácie vitamínov E a C ako antioxidantov, udržujúcich integritu bunkových membrán. Použitie nenasýtených omega mastných kyselín, erytropoetínu, IGF-1 (insulin-like rastový faktor-1), GCSF (granulocyte colony-stimulujúci faktor) a aj nových antioxidantov, protizápalových faktorov, kmeňových buniek, či génová liečba môžu perspektívne priniesť úspechy v prevencii či liečbe ROP (27). Celosvetovo je tomuto stále potenciálne oslepujúcemu ochoreniu venovaná veľká pozornosť a štúdie, organizované s podporou WHO Vision 2020 Programme (13) predpokladajú, že ROP môže byť v budúcnosti preventívne liečiteľné ochorenie. V súčasnosti je potrebné pripomenúť, že ukončením skríningu a adekvátnou liečbou akútnej ROP sa sledovanie prematúrnych detí nekončí, ale je nevyhnutná ich dlhodobá dispenzarizácia do adolescencie vzhľadom na riziko ostatných očných komplikácií prematurity.
Do redakce doručeno dne 6. 1. 2014
Do tisku přijato dne 22. 4. 2014
MUDr. Zuzana Prepiaková
Klinika detskej oftalmológie LF UK a DFNsP
Limbova 1
833 40 Bratislava
e-mail: prepiakova.zuzana@gmail.com
Sources
1. Autrata, R., Krejčírová, I., Šenková, K.,et al.: Intravitreal pegaptanib combined with diode laser therapy for stage 3+ retinopathy of prematurity in zone I and posterior zone II. Eur J Ophthalmol, 22(5); 2012 : 687–94.
2. Autrata, R., Šenková, K., Holousová, M, et al.: Retinopatie nedonošených a možnosti chirurgické léčby. Folia Strabol Neuroophthalmol, X; 2009 : 40–45.
3. Banach, M.J., Ferrone, P.J., Trese, M.T.: A comparison of dense versus less dense diod laser photocoagulation patterns for threshold retinopathy of prematurity. Ophthalmology, 107; 2000 : 324–328.
4. Banach, M.J.,Berinstein, D.M.: Laser therapy for retinopathy of prematurity. Current Opinion in Ophthalmology, 12; 2001 : 164–170.
5. Castellanos, M. A. M., Schwartz, S., García-Aguirre, G., et al.: Short-term Outcome After Intravitreal Ranibizumab Injections for the Treatment of Retinopathy of Prematurity. Br J Ophthalmol. 97(7); 2013 : 816–819.
6. Cook, Anne, White, S., Batterbury, M., Clark, D.: Ocular growth and refractive error development in premature infants without retinopathy of prematurity. Invest Ophthalmol Vis Sci, 44(3), 2003 : 953-960.
7. Cryotherapy for Retinopathy of Prematurity Cooperative Group. Multicenter trial of cryotherapy for retinopathy of prematurity. 3 1/2 year outcome - structure and function. Arch Ophthalmol. 111;1993 : 339–44.
8. Cryotherapy for Retinopathy of Prematurity Cooperative Group: Multicenter trial of cryotherapy for retinopathy of prematurity. Preliminary results. Arch Ophthalmol. 106; 1988 : 471–9.
9. Cryotherapy for Retinopathy of Prematurity Cooperative Group: Multicenter trial of cryotherapy for retinopathy of prematurity: Ophthalmological outcomes at 10 years. Arch Ophthalmol, 119; 2001 : 1110–1118.
10. Early Treatment for Retinopathy of Prematurity Cooperative Group: Revised indications for the treatment of retinopathy of prematurity: results of the early treatment for retinopathy of prematurity randomized trial. Arch Ophthalmol, 121(12), 2003 : 1684–1694.
11. Fisher, S.K.: Cellular effects of detachment on the neural retina and retinal pigment epithelium. In: Ryan,S.J.: Retina(ed 2), St Louis, Mosby, 1994, s. 2035–2061.
12. Fung, A.E., Rosenfeld, P.J., Reichel, E.: The international intravitreal bevacizumab safety survey: using the internet to assess drug safety worldwide. Br J Ophthalmol, 90(11), 2006 : 1344–1349.
13. Gilbert, C., Foster, A.: Childhood blindness in the context of VISION 2020: the right to sight. Bulletin of the World Health Organization, 79(3); 2001 : 227–232.
14. Gonzales, C. R., Boshra, J., Schwartz, S. D.: 25-Gauge pars plicata vitrectomy for stage 4 and 5 retinopathy of prematurity. Retina, 26(7); 2006: S42–S46.
15. Gonzales, V.H., Giuliari, G.P., Banda, R.M et al.: Confluent Laser Photocoagulation for the Treatment of Retinopathy of Prematurity, J Pediatr Ophthalmol Strabismus, 47(2), 2010 : 81–85.
16. Honda, S., Hirabayashi, H., Tsukahara, Y., Negi, A.: Acute contraction of the proliferative membrane after an intravitreal injection of bevacizumab for advanced retinopathy of prematurity. Graefes Arch Clin Exp Ophthalmol, 246(7); 2008 : 1061–3.
17. Christiansen, S.P., Bradford, J.D.: Cataract in infants treated with argon laser photocoagulation for threshold retinopathy of prematurity, Am J Ophthalmol, 119(2); 1995 : 175–80.
18. Lakhanpal, R. R., Fortun, J. A., Chan-Kai, B., et al.: Lensectomy and vitrectomy with and without intravitreal triamcinolone acetonide for vascularly active stage 5 retinal detachments in retinopathy of prematurity. Retina, 26(7); 2006 : 736–740.
19. Lalwani, G.A., Berrocal, A.M., Murray, T.G. et al.: Off-label use of intravitreal bevacizumab (Avastin) for salvage treatment in progressive threshold retinopathy of prematurity, Retina, 28; 2008 : 13–18.
20. Lashkari, K., Hirose, T., Yazdany, J., et al.: Vascular endothelial growth factor and hepatocyte growth factor levels are differentially elevated in patients with advanced retinopathy of prematurity. Am J Pathol, 156(4); 2000 : 1337–1344.
21. Law, J.C., Recchia, F.M., Morrison, D.G. et al.: Intravitreal bevacizumab as adjunctive treatment for retinopathy of prematurity. J AAPOS, 14(1); 2010 : 6–10.
22. Lee, J.Y., Chae, J.B., Yang, S.J. et al.: Effects of intravitreal bevacizumab and laser in retinopathy of prematurity therapy on the development of peripheral retinal vessels. Graefes Arch Clin Exp Ophthalmol, 248(9); 2010 : 1257–1262.
23. Kong, L., Mintz-Hintzer, A.H.: Intravitreal Bevacizumab as Anti - Vascular Endothelial Growth FactorTherapy for Retinopathy of Prematurity: A Morfologic Study. Arch. Ophthalmol, 126(8); 2008 : 1161–1163.
24. Mintz-Hittner, H.A., Kennedy, K.A., Chuang, A.Z.: BEAT-ROP cooperative group: efficacy of intravitreal bevacizumab for stage 3+ retinopathy of prematurity. N Engl J Med, 364(7); 2011 : 603–615.
25. Mintz-Hittner, H.A., Kuffel, R.R.: Intravitreal injection of bevacizumab (Avastin) for treatment of stage 3 retinopathy of prematurity in zone I or posterior zone II. Retina, 28(6); 2008 : 831–838.
26. Mota, Á., Carneiro, Á., Breda, J., et al.: Combination of Intravitreal Ranibizumab and Laser Photocoagulation for Aggressive Posterior Retinopathy of Prematurity. Case Rep Ophthalmol, 3(1); 2012 : 136–141.
27. Mutlu, F.M., Sarici, S.U.: Treatment of retinopathy of prematurity: a review of conventional and promising new therapeutic options. Int J Ophthalmol, 6(2); 2013 : 228–236.
28. Paysse, E.A., Hussein, M.A., Miller, A.M. et al.: Pulsed mode versus near continous mode delivery of diode laser photocoagulation for high – risk retinopathy of prematurity. JAAPOS, 11; 2007 : 388–392.
29. Pieh, C., Agostini, H., Buschbeck, C. et al.: VEGF-A,VEGF-1, VEGFR-2 und Tie2 levels in plasma of premature infants: relationship to retinopathy of prematurity. Br J Ophthalmol, 92(5); 2008 : 689–693.
30. Repka, M.X.: Ophthalmological problems of the premature infant. Ment Retard Dev Disabil Res Rev, 8; 2002 : 249-57.
31. Roohipoor, R., Ghasemi, H., Ghassemi, F. et al.: Intravitreal bevacizumab in retinopathy of prematurity: an interventional case series. Graefes Arch Clin Exp Ophthalmol, 249(9); 2011 : 1295–1301.
32. Roohipoor, R., Karkhaneh, R., Riazi-Esfahani, M. et al.: Surgical management in advanced stages of retinopathy of prematurity; our experience. Journal of ophthalmic & vision research, 4(3); 2009 : 185–190.
33. Sato, T., Wada, K., Arahori, H. et al.: Serum concentrations of bevacizumab (avastin) and vascular endothelial growth factor in infants with retinopathy of prematurity. Am J Ophthalmol, 153(2); 2012 : 327–333.
34. Sears, J. E., Sonnie, C.: Anatomic success of lens-sparing vitrectomy with and without scleral buckle for stage 4 retinopathy of prematurity. Am J Ophthalmol, 143(5); 2007 : 810–813.
35. Shah, P. K., Narendran, V., Kalpana, N. et al.: Anatomical and visual outcome of stages 4 and 5 retinopathy of prematurity. Eye, 23(1); 2009 : 176–180.
36. Shima, C., Sakaguchi, H., Gomi, F. et al.: Complications in patient after intravitreal injection of bevacizumab. Acta Ophthalmol, 86(4); 2008 : 372–376.
37. Smith, L. E.: Through the eyes of a child: understanding retinopathy through ROP the Friedenwald lecture. Invest Ophthalmol Vis Sci, 49(12); 2008 : 5177–5182.
38. Tomčíková, D., Prepiaková, Z., Kostolná, B. et al.: Prínos konfluujúcej (paint) – diódlaserkoagulácie v liečbe retinopatie nezrelých detí. Čes a Slov Oftal, 67; 2011 : 115–118.
39. Tawansy, K. A., Samuel, M. A.: Retinopathy of prematurity: practical surgical management in the new millennium. Tech Ophthalmol, 2; 2004 : 60–67.
40. Tsukahara, Y., Honda, S., Imai, H. et al.: Autologous plasmin-assisted vitrectomy for stage 5 retinopathy of prematurity: a preliminary trial. Am J Ophthalmol, 144(1); 2007 : 139–141.
Labels
OphthalmologyArticle was published in
Czech and Slovak Ophthalmology

2014 Issue 2
-
All articles in this issue
- Retinopatia prematúrnych detí I. časť
- Retinopatia prematúrnych detí – terapia II. časť
- Dlouhodobé výsledky implantace Phakic 6 Refractive při korekci krátkozrakosti
- Skríning retinopatie prematúrnych detí (ROP)
- Oční manifestace extrarenálního maligního rhabdoidního tumoru
- Postižení okohybných svalů u pacientů s endokrinní orbitopatií
- Akutní zadní multifokální plakoidní pigmentová epiteliopatie
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Postižení okohybných svalů u pacientů s endokrinní orbitopatií
- Retinopatia prematúrnych detí I. časť
- Akutní zadní multifokální plakoidní pigmentová epiteliopatie
- Retinopatia prematúrnych detí – terapia II. časť
