Aflibercept v léčbě diabetického makulárního edému
Aflibercept in the Diabetic Macular Edema Treatment
Diabetic retinopathy is together with the diabetic macular edema the most common cause of vision loss in the working population. It is also the most common diabetic microvascular abnormality. Aflibercept is approved for the diabetic macular edema treatment, it is a recombinant fusion protein, binding VEGF A, B, and P1GF. The efficacy and safety of the treatment comparing with the laser treatment were set by VIVID-DME and VISTA–DME studies. The T DRCR.net study protocol confirmed the efficacy of aflibercept, ranibizumab, and bevacizumab in the treatment of diabetic macular edema. The best results in the whole group were obtained if using aflibercept, especially in the group of patients with worse initial visual acuity. In all three studies, the safety of intraviteraly applied aflibercept was proven.
Key words:
diabetic macular edema, aflibercept, ranibizumab, bevacizumab
Authors:
J. Studnička
Authors‘ workplace:
Oční klinika FN a LF UK, Hradec Králové
přednostka prof. MUDr. Naďa Jirásková, Ph. D., FEBO
Published in:
Čes. a slov. Oftal., 71, 2015, No. 5, p. 243-246
Category:
Original Article
Overview
Diabetická retinopatie je spolu s diabetickým makulárním edémem nejčastější příčinou ztráty zraku u pracující populace. Je také nejčastější mikrovaskulární abnormalitou cukrovky. K léčbě DME je schválen aflibercept, rekombinantní fúzní protein, který vychytává VEGF A, B a PlGF. Efektivitu i bezpečnost léčby ve srovnání s laserovým ošetřením prokázaly klinické studie VIVID-DME a VISTA-DME. Protokol T DRCR.net studie prokázal efektivitu afliberceptu, ranibizumabu i bevacizumabu v léčbě DME. Nejlepších výsledků v celém souboru bylo dosaženo při použití afliberceptu, především u skupiny pacientů s horší vstupní zrakovou ostrostí. Ve všech třech studiích byla prokázána bezpečnost intravitreálně podávaného afliberceptu.
Klíčová slova:
diabetický makulární edém, aflibercept, ranibizumab, bevacizumab
Úvod
Diabetická retinopatie (DR) je nejčastější mikrovaskulární komplikací diabetu a je hlavní příčinou ztráty zraku u pracující populace v západním světě (4). Slepota u diabetu je nejčastěji způsobena diabetickým makulárním edémem (DME), zejména u diabetiků 2. typu (1). Prevalence DME je uváděna u diabetiků 1. typu 15 % a u diabetiků 2. typu 23 % a stoupá s délkou trvání diabetu a výskytem nefropatie a neuropatie (10). Podle výsledků rozsáhlé „The Wisconsin Epidemiologic Study“ se u diabetiků 1. typu do 5 let od diagnózy cukrovky prakticky DME nevyskytuje, po 20 letech má DME téměř 30 % nemocných. U diabetiků 2. typu se DME vyskytuje častěji u pacientů léčených inzulínem než u pacientů na perorální léčbě antidiabetiky. Prevalence edému narůstá také s vyšší hladinou glykovaného hemoglobinu a s proteinurií (3).
Makulární edém vzniká v důsledku zhroucení hematookulární bariéry, což má za následek akumulaci extracelulární tekutiny v sítnici, vznik sítnicového edému a ukládání proteinů a lipidů ve formě tvrdých exsudátů. Základním článkem vzniku DR a DME je hyperglykemie. Dlouhodobá hyperglykémie má za následek poruchu mikrocirkulace. Následná extravazace tekutiny vede ke vzniku edému sítnice a k jejímu funkčnímu poškození. V patofyziologii DME hrají roli i chronické systémové zánětlivé procesy kapilár. V jejich průběhu se uvolňují zánětlivé mediátory aktivující změny nervových a gliálních buněk sítnice. Důsledkem popsaných procesů je prohlubující se hypoxie makulární oblasti. Hypoxie vede mimo jiné k produkci vaskulárního endotelového růstového faktoru (VEGF), který zvyšuje propustnost kapilár, která je následována akumulací extracelulární tekutiny (9).
Aflibercept v léčbě DME
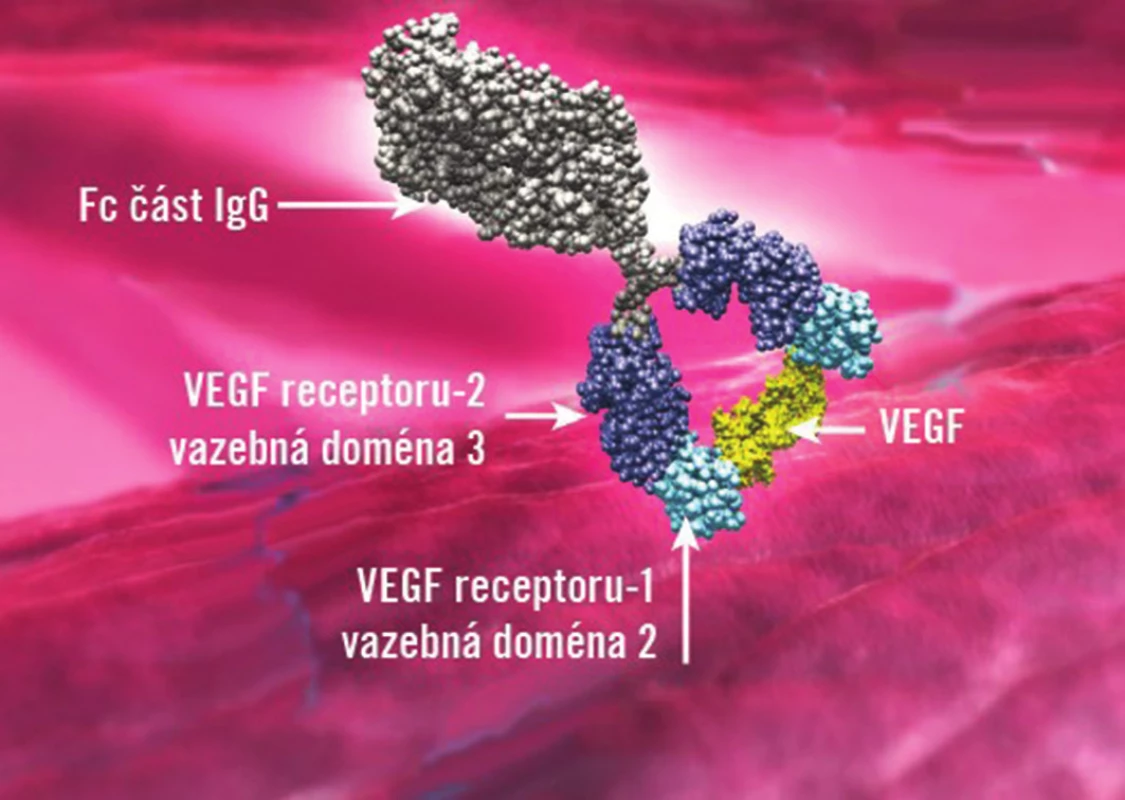
V léčbě DME je nově schválen aflibercept (Eylea™, Regeneron and Bayer Healthcare) což je rekombinantní fúzní protein, který se skládá z částí receptorů VEGF 1 a 2 a Fc porce IgG1 (obr. 1). Po intravitreálním podání působí svými receptory jako návnada pro VEGF A, B a placentární růstový faktor (PlGF), a tím zamezuje jejich působení na receptory endotelových buněk sítnicových a choroidálních cév. Účinnost a bezpečnost intravitreálně aplikovaného afliberceptu v léčbě DME prokázaly dvě klinické studie VISTA-DME a VIVID-DME. V klinické studii VISTA-DME, která probíhala v USA, bylo hodnoceno 466 respondentů. Ve studii VIVID-DME, která probíhala v Evropě, Japonsku a v Austrálii, bylo celkem 406 pacientů s DM 1. typu nebo 2. typu s klinicky signifikantním DME, jejichž vstupní nejlépe korigovaná zraková ostrost (NKZO) byla 20/40 až 20/320. V obou studiích byli pacienti randomizováni do tří různých skupin v poměru 1 : 1:1. V první skupině pacientů byl aplikován aflibercept v dávce 2 mg každé čtyři týdny, v druhé skupině byl aplikován aflibercept v dávce 2 mg každý osmý týden po pěti úvodních měsíčních aplikacích a v třetí skupině bylo provedeno laserové ošetření DME na začátku hodnocení a dále od třetího měsíce sledování podle klinického nálezu.
Po uplynutí sledovací doby 52 týdnů bylo v klinické studii VISTA-DME zjištěno zlepšení průměrné NKZO v první skupině o 12,5 písmen, ve druhé skupině o 10,7 písmen. Tento výsledek byl statisticky významně lepší oproti léčbě laserem, kde byl dosažen průměrný zisk 0,2 písmena (p < 0,0001). Zlepšení NKZO, které bylo definované jako zisk tří a více řádků ETDRS optotypů, bylo prokázáno u 41,6 % pacientů léčených měsíční aplikací afliberceptu 2 mg, u 31,1 % pacientů druhé skupiny s dvouměsíční aplikací po úvodní pětiměsíční nasycovací léčbě a u 7,8 % pacientů, kteří podstoupili ošetření laserem (p < 0,0001).
V klinické studii VIVID-DME byl prokázán v první skupině pacientů zisk průměrné NKZO 10,5 písmen, v druhé skupině 10,7 písmen a v třetí skupině 1,2 písmena (p < 0,0001). Zlepšení NKZO o tři a více řádků ETDRS optotypů bylo prokázáno u 32,4 % pacientů první skupiny, 33,3 % pacientů druhé skupiny a u 9,1 % pacientů třetí skupiny (p < 0,0001). V obou klinických studiích by prokázán statisticky významný efekt na snížení centrální retinální tloušťky (CRT) při podávání afliberceptu ve srovnání s ošetřením laserem. V klinické studii VISTA-DME byl zjištěn pokles CRT v prvních dvou skupinách léčených afliberceptem o 185,9 µm, resp. o 183,1 µm oproti skupině pacientů léčených laserem, kde byl dokumentován pokles CRT o 73,3 µm (p < 0,0001). Dosažené výsledky ve studii VIVID-DME byly podobné se snížením CRT o 195 µm, resp. o 192,4 µm v prvních dvou skupinách ve srovnání se skupinou pacientů ošetřených laserem, kde byl zjištěn pokles o 66,2 µm (p < 0,0001). Intravitreálně aplikovaný aflibercept byl velmi dobře tolerovaný. Výskyt očních a závažných celkových vedlejších účinků, včetně arteriálních tromboembolických příhod, byl ve všech skupinách obou klinických studií porovnatelný (5).
Porovnání účinnosti a bezpečnosti u očí s DME léčených afliberceptem 2 mg nebo bevacizumabem 1,25 mg (Avastin®, F. Hoffmann-La Roche Ltd.) nebo ranibizumabem 0,3 mg (Lucentis®, Novartis Pharma AG) bylo zjišťováno v rámci protokolu T studie DRCR.net (Diabetic Retinopathy Clinical Research Network). Multicentrické studie se zúčastnilo celkem 660 pacientů s DM 1. nebo 2. typu, kteří byli léčeni v 89 centrech USA. Do studie byli zařazeni pacienti se vstupní NKZO v rozmezí 20/32 – 20/320, CRT ≥ 250 µm měřenou na OCT Stratus (Carl Zeiss AG), v případě měření na přístroji Spectralis (Heidelberg Engineering) musela být CRT ≥ 320 µm u mužů a ≥ 305 µm u žen a v případě měření na OCT Cirrus (Carl Zeiss AG) musela být CRT ≥ 305 µm u mužů a ≥ 290 µm u žen. Pacienti nesměli být léčení blokátory VEGF v posledních 12 měsících před zařazením do studie a nesměli mít žádnou jinou léčbu DME čtyři měsíce před zahájením studie. Všichni pacienti byli randomizováni do tří skupin, ve všech skupinách byla léčba intravitreálními injekcemi účinné látky opakována po čtyřech týdnech, pokud bylo zjištěno zlepšení nebo zhoršení nálezu. Injekce nebyla aplikována, pokud byla NKZO 20/20 anebo lepší a nález na OCT byl v normě nebo od 24. týdne byla NKZO a nález na OCT stabilní po dvou po sobě následujících aplikacích. Pokud se NKZO nebo nález na OCT zhoršil, byla injekce znovu podána. Změna nálezu byla definována jako zlepšení nebo zhoršení NKZO o ≥ 5 písmen nebo ≥ 10 % CRT na OCT od poslední injekce.
Jako záchranná léčba byla zvolena laserová terapie centra sítnice, kterou bylo možno použít od 24. týdne sledování, pokud nebylo zaznamenáno zlepšení DME minimálně po dvou po sobě jdoucích injekcích účinné látky. Tabulka 1 ukazuje některé vybrané vstupní charakteristiky pacientů.
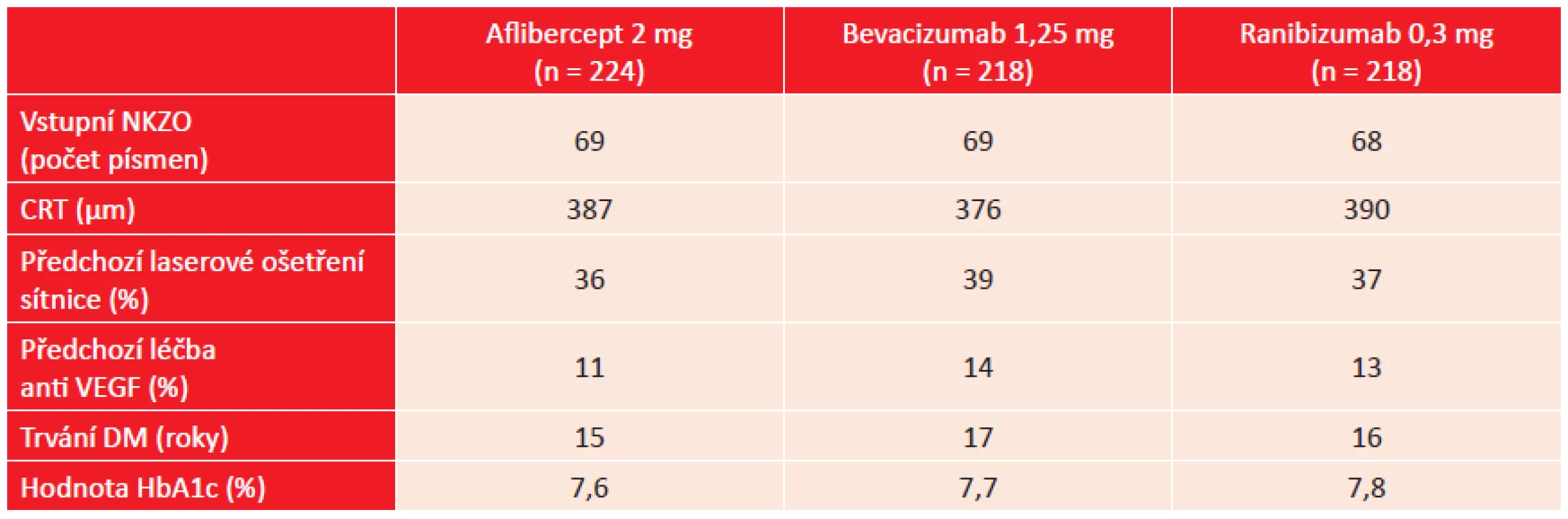
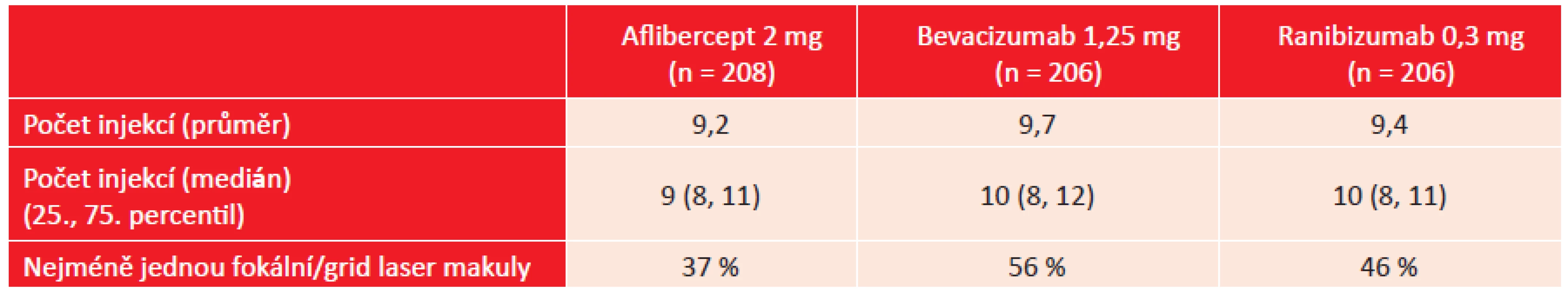
Nejlepší výsledky při použitém dávkovacím schématu byly zjištěny po ročním sledování při léčbě afliberceptem s průměrným ziskem + 13,3 písmen optotypů. Ve skupině pacientů léčených ranibizumabem byl zjištěn zisk + 11,2 písmen, u pacientů léčených bevacizumabem zisk + 9,7 písmen. Výsledky léčby afliberceptem ve srovnání s léčbou bevacizumabem byly statisticky výrazně významné (p < 0,001), méně významné bylo srovnání mezi afliberceptem a ranibizumabem (p = 0,03). Výsledky byly odlišné u pacientů s lepší vstupní NKZO a horší NKZO. V podskupině se vstupní NKZO 20/32 – 20/40 byly zjištěny pouze statisticky nevýznamné rozdíly v dosažené NKZO mezi jednotlivými preparáty. V podskupině pacientů se vstupní NKZO 20/50 a horší byly prokázány statisticky významné rozdíly. Po roční léčbě afliberceptem byl zjištěn zisk + 18,9 písmen, po léčbě ranibizumabem zisk + 14,2 písmen a po léčbě bevacizumabem zisk + 11,8 písmen. Výsledky léčby afliberceptem byly statisticky významné ve srovnání s léčbou ranibizumabem i bevacizumabem. Tyto funkční výsledky byly doprovázeny i výsledky anatomickými. Při léčbě afliberceptem byl zaznamenán pokles CRT o 210 µm, při léčbě ranibizumabem o 176 µm a při léčbě bevacizumabem o 135 µm. Pokles CRT po léčbě afliberceptem byl statisticky významný ve srovnání s léčbou bevacizumabem, stejně tak byl významný pokles CRT po léčbě ranibizumabem ve srovnání s léčbou bevacizumabem. Počet aplikací porovnávaných léčivých přípravků a indikace laserového ošetření makuly ukazuje tabulka 2.
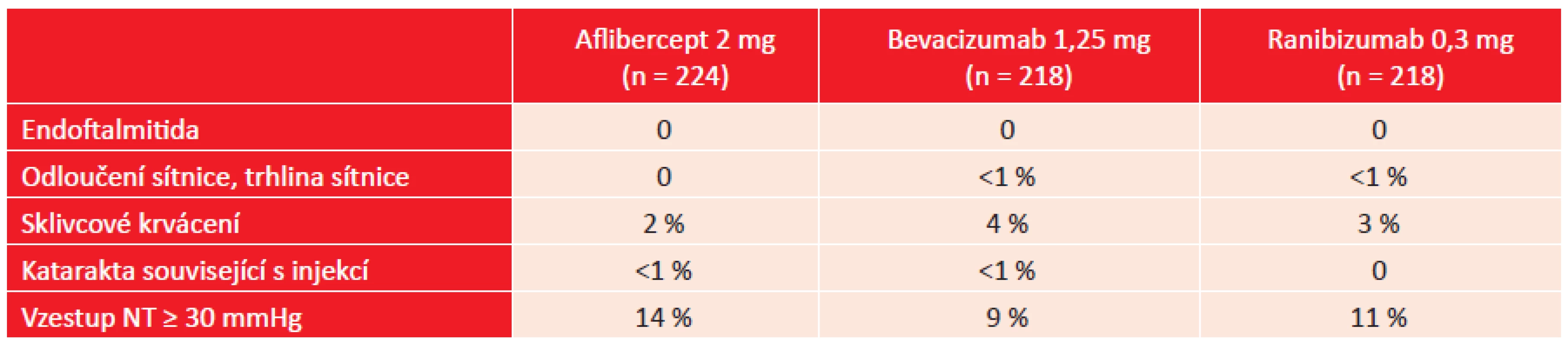
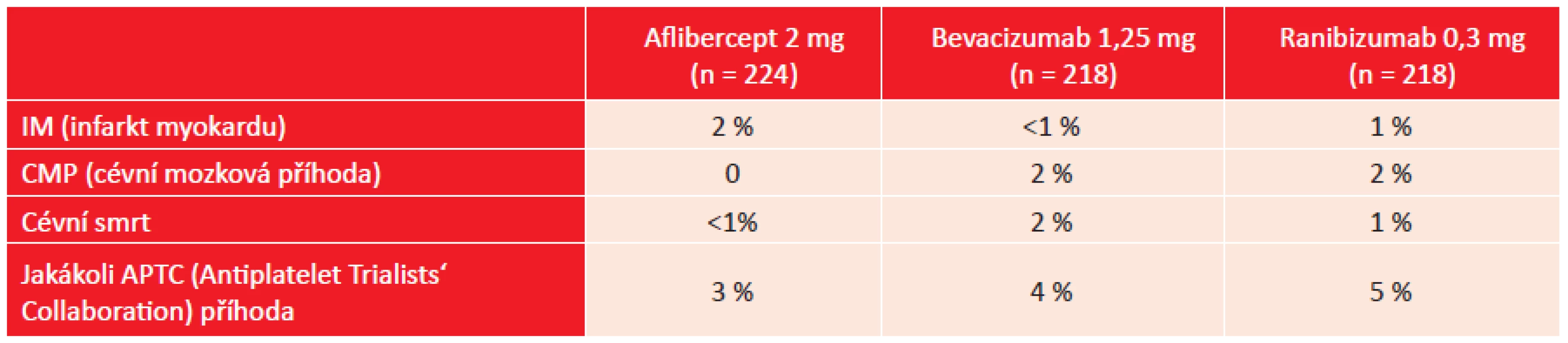
Výskyt vybraných nežádoucích očních účinků ukazuje tabulka 3. Elevace nitrooční tenze byla u všech pacientů přechodná nebo zvládnutelná medikamentózní léčbou, žádný z pacientů nemusel podstoupit antiglaukomovou operaci. V tabulce 4 je přehled vybraných systémových nežádoucích účinků. Při následně provedené analýze byl zjištěn výskyt jakékoliv kardiovaskulární příhody u 19 % pacientů léčených afliberceptem, u 16 % v případě léčby bevacizumabem a u 26 % při léčbě ranibizumabem. Tento rozdíl byl statisticky významný pouze při porovnání ranibizumabu a bevacizumabu (2).
Diskuse
Klinické studie VISTA-DME i VIVID-DME prokázaly statisticky významný efekt léčby afliberceptem u DME při měsíčním dávkování i při prodloužení intervalu podávání afliberceptu na 8 týdnů. V obou studiích byla efektivita významně vyšší oproti léčbě laserem. Obě studie také prokázaly bezpečnost afliberceptu s porovnatelným výskytem vedlejších očních i celkových nežádoucích účinků ve srovnání s pacienty ošetřenými laserem (5). V rámci T protokolu DRCR.net studie byla prokázána účinnost tří anti VEGF látek v léčbě DME při odlišném dávkovacím schématu. Podstatného zlepšení NKZO bylo dosaženo již za jeden měsíc od začátku léčby a přetrvalo po celý rok sledování. V průměru bylo dosaženo většího zlepšení při léčbě afliberceptem, ale účinek se lišil podle vstupní zrakové ostrosti. Pacienti s počáteční mírnou ztrátou zraku (20/32 – 20/40), která byla zjištěna u 50 % studijních očí, se nevyznačovali výrazným rozdílem v dosažené NKZO při použití jednotlivých anti VEGF látek. Pacienti s horší vstupní NKZO výrazně lépe reagovali na léčbu afliberceptem 2 mg než na léčbu bevacizumabem 1,25 mg či ranibizumabem 0,3 mg (2). Zatímco uvedená dávka bevacizumabu je běžně užívaná v léčbě DME v Evropě i v USA, ranibizumab 0,3 mg je schválený k léčbě DME v USA, zatímco v Evropě je schválená dávka 0,5 mg ranibizumabu. Užití nižší dávky ranibizumabu v USA vyplývá z výsledků studií RISE a RIDE, které prokázaly srovnatelnou efektivitu 0,3 mg a 0,5 mg ranibizumabu u DME při měsíčním podávání (8). V Evropě schválená dávka 0,5 mg ranibizumabu má podporu v klinických studiích RESOLVE a RESTORE, které prokázaly efekt této dávky (6, 7). Porovnání účinnosti dávky 0,5 mg ranibizumabu s 2 mg afliberceptu a 1,25 mg bevacizumabu při stejném dávkovacím režimu zatím nemáme k dispozici. Bevacizumab měl menší účinek na snížení makulárního edému než druhé dva přípravky, a to bez ohledu na vstupní zrakovou ostrost. Největší efekt na pokles CRT byl prokázán u afliberceptu, což byl také důvod pro nejnižší procento použití záchranné léčby laserem u této podskupiny pacientů. Závažné nežádoucí účinky se ukázaly podobné u jednotlivých skupin. Nebyly zjištěny významné rozdíly v četnosti závažných cévních příhod (IM, CMP). Při zpětné analýze kardiovaskulárních onemocnění včetně arteriální hypertenze byla zjištěna vyšší četnost při léčbě ranibizumabem, která byla ve srovnání s léčbou bevacizumabem statisticky významně vyšší (2). Toto neodpovídá předchozím studiím a mohlo jít o náhodný výsledek (6, 7).
Závěr
Všechny tři anti-VEGF přípravky představují účinnou léčbu zhoršení zraku způsobeného DME. Efektivita afliberceptu v léčbě DME byla prokázána při fixním dávkovacím režimu i při individuálním PRN režimu. Efekt afliberceptu je prokazatelně lepší u pacientů s horší vstupní zrakovou ostrostí. Byla prokázána dobrá snášenlivost intravitreálně podávaného afliberceptu se srovnatelně nízkým výskytem nežádoucích účinků v porovnáním s laserovým ošetřením a ostatními užívanými blokátory VEGF. Výsledky klinických studií podporují použití afliberceptu v běžné klinické praxi.
Autoři práce prohlašují, že vznik i téma odborného sdělení a jeho zveřejnění není ve střetu zájmu a není podpořeno žádnou farmaceutickou firmou.
Do redakce doručeno dne 9. 6. 2015
Do tisku přijato dne 25. 9. 2015
Doc. MUDr. Jan Studnička, Ph.D.
Oční klinika FN a LF UK Hradec Králové
Sokolská 581
500 05 Hradec Králové
jan.studnicka@fnhk.cz
Sources
1. Clarke, M.: Diabetic retinopathy – reasons for screening. In: Dodson, PM., Diabetic retinopathy. Oxford: Oxford University Press; 2008 : 11–5.
2. Diabetic Retinopathy Clinical Research Network, Wells, JA., Glassman, AR. et al.: Aflibercept, bevacizumab, or ranibizumab for diabetic macular edema. N Engl J Med, 372; 2015, 13 : 1193–203.
3. Hirai, FE., Knudtson, MD., Klein, BE. et al.: Clinically significant macular edema and survival in type 1 and type 2 diabetes. Am J Ophthalmol, 145; 2008 : 700–6.
4. Cheung, N., Wong, TJ.: Diabetic retinopathy and systemic complications. In: Duh, EJ. (Ed): Diabetic retinopathy. New Jersey: Humana Press; 2009 : 465–85. o
5. Korobelnik JF., Do, DV., Schmidt-Erfurth, U. et al.: Intravitreal aflibercept for diabetic macular edema. Ophthalmology, 121; 2014, 11 : 2247–54.
6. Massin, P., Bandello, F., Garweg, JG. et al.: Safety and efficacy of ranibizumab in diabetic macular edema (RESOLVE Study): a 12-month, randomized, controlled, double-masked, multicenter phase II study. Diabetes Care, 33; 2010, 11 : 2399–405.
7. Mitchell, P., Bandello, F., Schmidt-Erfurth, U. et al.: The RESTORE study: ranibizumab monotherapy or combined with laser versus laser monotherapy for diabetic macular edema. Ophthalmology, 118; 2011, 4 : 615–25.
8. Nguyen, QD., Brown, DM., Marcus, DM. et al.: Ranibizumab for diabetic macular edema: results from 2 phase III randomized trials: RISE and RIDE. Ophthalmology, 119; 2012, 4 : 789–801.
9. Sosna T., Švancarová, R., Netuková, M. et al.: Nové postupy v léčbě diabetické makulopatie. Kazuistiky v diabetologii, 10; 2012 : 15–22.
10. Zander, E., Herfurth, S., Bohl, B. et al.: Maculopathy in patients with diabetes mellitus type 1 and type 2: associations with risk factors. Brit J Ophthalmol, 84; 2000 : 871–6.
Labels
OphthalmologyArticle was published in
Czech and Slovak Ophthalmology

2015 Issue 5
-
All articles in this issue
- Léčba diabetického makulárního edému mikropulsním laserem – první zkušenosti
- Výsledky léčby diabetického makulárního edému laserovým systémem PASCAL
- Prevalencia DIAbetickej RETinopatie a význam genetických faktorov v rozvoji diabetickej retinopatie u pacientov s diabetes mellitus typu 1. a 2. na Slovensku (DIARET SK). Prehľad aktuálnych poznatkov a postavenie epidemiologickej štúdie DIARET SK
- Aflibercept v léčbě diabetického makulárního edému
- Možnosti chirurgické léčby diplopie u pacientů s endokrinní orbitopatií
- Solární makulopatie po sledování částečného zatmění slunce
- Oční myiáza
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Oční myiáza
- Možnosti chirurgické léčby diplopie u pacientů s endokrinní orbitopatií
- Solární makulopatie po sledování částečného zatmění slunce
- Léčba diabetického makulárního edému mikropulsním laserem – první zkušenosti
