RHEOFERÉZA V LÉČBĚ VĚKEM PODMÍNĚNÉ MAKULÁRNÍ DEGENERACE
RHEOPHERESIS IN THE TREATMENT OF AGE-RELATED MACULAR DEGENERATION
Purpose: Evaluation of the long-term effect of rheopheresis treatment of dry form of age-related macular degeneration (AMD).
Materials and Methods: The treatment group consisted of 65 patients and 55 patients in the control group, with a minimum follow-up period of 60 months. The basic treatment consisted of 8 rheopheresis procedures, and the additional treatment (booster therapy) of 2 rheopheresis procedures 1.5–2 years after the basic treatment. We evaluated changes in best corrected visual acuity, anatomical effect, electrical activity of the retina, haematological, biochemical and immunological parameters.
Results: Rheopheresis treatment contributed significantly: 1) to stabilisation of best corrected visual acuity of the treated patients, which initially showed an insignificant increased during the 2-years follow-up period, and then slightly decreased. By contrast, visual acuity decreased in the control group, to an insignificant degree up to 4 years, then statistically significantly. 2) to an improvement of the morphological findings in 62.4% of treated patients compared to 7.5% in the control group, while disease progression to stage 3 (neovascular form of the disease or geographic atrophy) with a significant decrease of visual acuity occurred in only 7.1% of treated patients, versus 37.0% in the control group. 3) to regression, even to the attachment of drusenoid pigment epithelial detachment (DPED). To a reduction of the area of DPED in 80.4% of treated patients, in contrast with an steaincrease in the area of DPED in 47.1% of patients in the control group, and the development of new DPED in only 2 eyes of treated patients compared with 16 eyes of patients in the control group. 4) to a preservation of the integrity of the ellipsoid layer in the fovea in 68.2% of the treated patients, while by contrast we found a damaged ellipsoid layer in the fovea in 66.6% of the control patients. 5) to a stabilisation of the activity of ganglion cells, the pineal system and the activity of the central area of the retina, with eccentricity between 1.8° and 30° in the treated patients, compared to alteration in the control group manifested mainly after 3.5 years of the follow-up period. 6) to a statistically significant improvement in rheological parameters, thereby increasing flow in microcirculation and positively influencing the metabolism in the retina. Also to a positive effect on the classical, alternative and lectin pathway of complement activation, a reduction in the level of proprotein convertase subtilisin kexin 9 (PCSK9), and thus also the level of LDLcholesterol, and 7) Additional treatment with 2 RHF procedures (so-called "booster therapy") seems to be a safe and suitable method of prolonging the stabilisation phase, or even improving visual acuity, anatomical and functional findings.
Conclusion: We demonstrated positive changes in anatomical, functional and humoral parameters upon rheopheresis treatment of AMD. Their correlation provides a real possibility to identify patients at risk and to manage an individualised regime of rheopheresis therapy. This method of treatment is effective and safe, with a low percentage of non-serious adverse effects.
Keywords:
rheopheresis – dry form of AMD – DPED – ellipsoid layer of photoreceptors – ERG
Authors:
H. Langrová 1; E. Rencová 1; M. Bláha 2; J. Studnička 1; panov. A. Stě 1; J. Breznayová 1; M. Burova 1; Š. Jedličková 1; H. Dvořáková 1; V. Bláha 3; M. Lánská 2
Authors‘ workplace:
Univerzita Karlova, Lékařská fakulta Hradec Králové, Oční klinika
1; Univerzita Karlova, Lékařská fakulta Hradec Králové, IV. Interní, hematologická klinika
2; Univerzita Karlova, Lékařská fakulta Hradec Králové, III. Interní, gerontometabolická klinika
3
Published in:
Čes. a slov. Oftal., 79, 2023, No. 1, p. 8-24
Category:
Original Article
doi:
https://doi.org/10.31348/2023/2
Overview
Cíle: Hodnocení dlouhodobého vlivu léčby rheoferézou na suchou formu věkem podmíněné makuární degenerace.
Materiál a metody: Do hodnocení jsme zařadili 65 pacientů a do kontrolní skupiny 55 pacientů s minimální dobou sledování 60 měsíců. Základní léčba se skládala z 8 procedur rheoferézy, přídatná léčba (booster therapy) ze 2 rheoferéz za 1,5-2 roky po základní léčbě. Hodnotili jsme změny nejlépe korigované zrakové ostrosti, anatomických poměrů a elektrické aktivity sítnice, hematologické, biochemické a imunologické parametry.
Výsledky: Léčba rheoferézou významně přispěla: 1) Ke stabilizaci nejlépe korigované zrakové ostrosti léčených pacientů, která se nejprve nevýznamně zvyšovala do 2 let sledování a následně jen mírně klesala. Naproti tomu v kontrolní skupině se zraková ostrost snižovala, do 4 let nevýznamně, poté již statisticky významně. 2) Ke zlepšení morfologického nálezu u 62,4 % léčených pacientů v porovnání se 7,5 % kontrol, naproti tomu k progresi onemocnění do 3. stadia (vlhká forma onemocnění nebo geografická atrofie) s významným poklesem zrakových funkcí došlo jen u 7,1 % léčených pacientů oproti 37,0 % kontrol. 3) K regresi, dokonce i k přiložení drúzového odchlípení retinálního pigmentového epitelu (DPED). Ke zmenšení plochy DPED u 80,4 % léčených pacientů, naproti tomu ke zvětšení plochy DPED u 47,1 % kontrol a rozvoji nového DPED jen u 2 očí léčených pacientů oproti 16 očím kontrol. 4) K udržení integrity vrstvy elipsoidů ve fovee u 68,2 % léčených pacientů, naproti tomu defektní elipsoidní vrstvu ve fovee jsme zaznamenali u 66,6 % kontrol. 5) Ke stabilizaci aktivity gangliových buněk, čípkového systému a aktivity centrální oblasti sítnice s excentricitou mezi 1,8° a 30° u léčených pacientů v porovnání s její alterací v kontrolní skupině projevující se zejména od 3,5 let sledování. 6) K statisticky významnému zlepšení rheologických ukazatelů, a tím ke zvýšení průtoku v mikrocirkulaci a pozitivnímu ovlivnění metabolizmu v sítnici. K pozitivnímu vlivu na klasickou, alternativní i lektinovou cestu aktivace komplementu, snížení hladiny PCSK9 (proprotein konvertáza subticilin kexin 9), a tím i hladiny LDL-cholesterolu a 7) Přídatná léčba 2 procedurami RHF (tzv. „booster therapy“) se zdá být bezpečnou a vhodnou metodou prodloužení fáze stabilizace, či dokonce zlepšení zrakové ostrosti, anatomického a funkčního nálezu.
Závěr: Prokázali jsme pozitivní změny anatomických, funkčních i humorálních ukazatelů při léčbě VPMD rheoferézou. Jejich korelace skýtá reálnou možnost ohrožené nemocné vytipovat a řídit individualizovanou intenzitu rheoterapie. Metodika je účinná a bezpečná s nízkým procentem nezávažných vedlejších účinků.
Klíčová slova:
rheoferéza – suchá forma věkem podmíněné makulární degenerace – drúzová ablace pigmentového epitelu sítnice – elipsoidní vrstva – elektroretinografie
ÚVOD
Věkem podmíněná makulární degenerace (VPMD) je degenerativní onemocnění centrální části sítnice a cévnatky. Je nejčastější příčinou praktické slepoty obyvatel rozvinutých zemí starších 65 let [1]. Onemocnění se vyskytuje ve dvou variantách. V 80–90 % je přítomna pomalu se rozvíjející „suchá“ atrofická forma VPMD a asi v 10–20 % se vyvine rychle progredující „vlhká“ exsudativní forma s neovaskulární choroidální membránou [2]. Náhlý zvrat VPMD do vlhké formy během 5 let je popisován až ve 26 % případů [3].
Primární změny u VPMD byly popsány v Bruchově membráně, v retinálním pigmentovém epitelu (RPE) a v choriokapilaris. Dochází k poruše perfúze v cévnatce a sítnici, rozvíjí se dysfunkce RPE a ztráta schopnosti aktivního transportu metabolitů ze sítnice. Metabolity se pak hromadí ve formě drúz, jak jsme sami popsali [4]. Měkké drúzy jsou světle žluté s neostrou hranicí, jednotlivé nepřesahují 165 μm v průměru. Při progresi choroby se sdružují ve splývající drúzy, které mají větší průměr a tendenci přejít do závažnějšího stadia: drúzového odchlípení pigmentového epitelu sítnice (DPED) [5,6]. Pokud DPED zasahuje i centrální foveolu (CF), dochází už v tomto stadiu ke zhoršení nejlépe korigované zrakové ostrosti (NKZO), protože se ke změnám RPE přidružuje i defekt vrstvy elipsoidů vnitřních segmentů fotoreceptorů. Následkem je poškození a úbytek fotoreceptorů [7]. Terén přítomného DPED je s narůstajícím věkem vhodným podkladem pro zvrat ze suché do vlhké formy vznikem submakulární neovaskularizace (CNV). Je umístěna v cévnatce a je reakcí na místní hypoxii. Patří už k 3. stádiu VPMD, které neléčeno vede k praktické slepotě snížení zrakové ostrosti na 3/50 a méně. Déletrvající DPED ovšem může způsobit i další projev nevratného postižení makuly, rozvoj geografické atrofie RPE. Při obvyklém postižení touto formou se opět dříve nebo později setkáváme se vznikem praktické slepoty.
Byly objeveny důkazy pro genetickou zátěž nemocných s VPMD a nalezena souvislost několika genetických odchylek a VPMD [8,9]. Revoluční změnou v názorech na patogenezi onemocnění je „zánětlivá“ teorie. Souvislost rozvoje VPMD se zánětlivými a imunitními procesy podporuje přítomnost imunokomplexů (IgM, IgG) a komponent komplementového systému (C3, C5, CD46) v drúzách. Je známo, že proteiny komplementu, makrofágy a cytokiny akcelerují angiogenezi, formaci a prorůstání CNV [10]. Vznik a progresi VPMD ovlivňuje zřejmě také mutace genu H [8] a/nebo oxidativní poškození vedoucí k apoptóze fotoreceptorů [11]. Samozřejmě začaly snahy o potlačení aktivace komplementu. Jsou vyvíjeny inhibitory složek komplementu [12], monoklonální protilátky proti faktoru B, D nebo inhibitory C5 s možností použití u VPMD s větší účinností a méně častou aplikací [8]. Studie jsou zatím ve fázi 1 nebo 2 a zřejmě potrvá ještě několik let, než budou k dispozici v klinické praxi. Tyto poznatky nás vedly k výzkumu změn cest aktivace komplementu a složky H při léčbě rheoferézou jako potenciálně významných bioindikátorů progrese VPMD. Je známo, že komplement, zejména alternativní a lektinová cesta hrají důležitou roli při poruchách mikrocirkulace u VPMD [8,9]. Léčba cílená na systém komplementu pravděpodobně bude reprezentovat další nový přístup k léčbě nebo i prevenci poruch v mikrocirkulaci, jako je VPMD a další. Změny složek komplementu by, dle naší hypotézy, mohly být také markerem úspěšnosti léčby, a tedy by mohla existovat korelace mezi mírou poklesu aktivity složek komplementu a aktivitou choroby a klinickým obrazem. Velmi cenné by bylo, že jde o časný marker. Úspěšnost léčby se totiž dosud posuzuje klinickými ukazateli (vývoj morfologických změn na sítnici, pokles NKZO atd.), které jsou dlouhodobé. Neumožňují proto individualizované řízení frekvence a intenzity terapie již během základní série rheoferéz. Důležitá je také korelace změn komplementu nejen s aktivitou choroby a klinickým nálezem, ale i s dalšími bioindikátory (markery aktivity endotelu, koagulace, fibrinolýzy, metabolismus lipoproteinů) a se speciálními ukazateli (faktory aktivace apoptózy, vybranými interleukiny, adhezními molekulami).
Hypotézy o patogenezi VPMD hovoří také o pravděpodobném podílu metabolismu lipoproteinů na rozvoji a progresi onemocnění. Sítnice, se svými schopnostmi zpracovávat světlo, je unikátním fotooxidativním prostředím mezi ostatními druhy nervových tkání. Sítnice tak má zřejmě schopnost příjmu lipidů a jejich metabolismu včetně oxidativních procesů. Přísun lipidů do všech buněčných vrstev retiny z krve byl prokázán [13,14]. Sítnice je také schopna syntetizovat lipidy a udržovat „steady-state“ co do složení lipidů [15]. K plnění těchto úkolů jsou (byly v sítnici potvrzeny) stejné molekuly jako v patofyziologickém procesu příjmu a metabolismu lipidů jinde ve vnitřním prostředí [15]. Důležitým enzymem ovlivňujícím hladinu cholesterolu je proprotein convertáza subtilisin/kexin 9 (PCSK9). Jedná se o sekreční regulátor LDL receptoru na povrchu buněk, jeho funkcí je zvyšovat hladinu LDL cholesterolu [16]. Více než 30 % plazmatického PCSK9 je vázáno na LDL-cholesterol, proto předpokládáme, že by při rheoferéze u VPMD mohlo dojít také ke snížení hladiny PCSK9.
Léčba suché formy VPMD se v současné době opírá o preventivní farmakoterapii antioxidanty vitaminu E, C, betakarotenu, mědi, zinku a neesterifikovaného luteinu (Age-related Eye Disease Study 1, Age-related Eye Disease Study Research Group 2001, Lutein Antioxidant Supplementation Trial [17].
Rheoferéza (RHF) je považována za účinnou metodu léčení suché formy VPMD. Několik studií, včetně naší, demonstrovalo účinnost rheoferézy [6,18-22]. Podle Schwartze et al., 2013 (Writing Committee of the American Society for Apheresis) bylo publikováno několik kazuistik, dvě kontrolované studie a pět randomizovaných studií, které prokazují účinnost rheoferézy u suché formy VPMD [20]. Na základě těchto studií zařadila ASFA (American Society for Hemapheresis) rheoferézu již v předposledním vydání pravidelně novelizovaných pravidel (guidelines) v roce 2013 jako terapii první linie u suché formy VPMD [23]. Léčbu pacientů s VPMD rheoferézou jsme jako první v České republice zahájili již v roce 2005. Léčba byla hrazena z grantových prostředků. Náklady na 1 RHF proceduru činí cca 17 000 Kč, základní léčba 8 procedurami tak stojí 136 000 Kč.
Předpokládaným pozitivním účinkem rheoferézy u VPMD je snížení difúzní bariéry v Bruchově membráně, zlepšení výživy RPE a neuroretiny, pokles ischémie a tvorby cévního endotelového růstového faktoru (VEGF) a pokles aktivity zánětlivého procesu, což jsou prokázané patofyziologické mechanismy vzniku a progrese choroby [24]. Dochází k úpravě poměrů na molekulární úrovni a k aktivaci funkčních rezerv sítnice. Všechny tyto faktory mohou přispět ke stabilizaci morfologie i funkce makuly, této pro zrak nejdůležitější oblasti, a k zastavení nebo alespoň zpomalení progrese VPMD [6]. Naším cílem je zábrana zvratu do 3. stadia VPMD, zejména odvrácení vzniku submakulární neovaskularizace a geografické atrofie sítnice v makule, a tedy ochránění centrální foveoly od zasažení patologickými změnami.
Rheoferéza a vlastní modifikace procedur
Rheoferéza je v klasické podobě podle Klingela et al. [24] modifikace membránové diferenční filtrace plazmy, kdy se používá speciální sekundární plazmatický filtr s relativně malými otvory, nazývaný rheofiltr, který z protékající plazmy eliminuje exaktně definované spektrum proteinů s vysokou molekulární hmotností (nad 150 000 Daltonů). Jedná se zejména o fibrinogen, α2-makroglobulin, imunoglobulin M, LDL cholesterol, von Willebrandův faktor, trombomodulin a fibronektin [25]. Eliminace těchto proteinů vede ke snížení krevní i plazmatické viskozity a dále ke zlepšení agregability a flexibility erytrocytů [26,27]. Výsledkem snížené krevní i plazmatické viskozity je zlepšení krevního průtoku mikrocirkulací a léčebně příznivé ovlivnění některých poruch v mikrocirkulaci [10]. Dochází k příznivým posunům hladin cytokinů a adhezních molekul, dále ke zvýšené produkci oxidu dusnatého endotelem, a ke zlepšení deformability erytrocytů [26].
V naší modifikaci rheoferézy (zvané také rheohemaferéza) byl pro primární oddělení plazmy použit kontinuální separátor Cobe Spectra, anebo Spectra Optia (Terumo BCT, Lakewood, Colorado, USA). Ve druhém kroku plazma procházela filtrem Evaflux 4A (Kawasumi, Tokyo, Japonsko). Filtrační membrány mají celkový povrch 2 m2, jsou vyrobeny z kopolyméru etylénu a vinylalkoholu a uspořádány do formy kapilár s vnitřním průměrem 175 μm a průměrem pórů 0,03 μm. Kapiláry jsou uzavřené v obalu z polykarbonátové pryskyřice. Filtr je umístěn a řízen přístrojem CF 100 (Infomed, Ženeva, Švýcarsko). Při vzestupu tlaku v kapilárách filtru nad 250 mm Hg přístroj CF-100 automaticky zpětně propláchne kapiláry fyziologickým roztokem, který se spolu s odfiltrovanými částicemi odvede do odpadního vaku. Všechny sety spojovacích hadic, filtr i odpadní vak jsou určeny k jednorázovému použití.
Po průchodu filtrem se ošetřená plazma spolu s krevními buňkami vrací zpět do oběhu pacienta druhým žilním vstupem. Výkon je kontinuální, ve stejný okamžik se krev pacientovi odebírá i vrací. Množství krve a plazmy, které je aktuálně v extrakorporálním oběhu, je dáno použitým separátorem (u separátoru Spectra Optia je to 185 ml, u Cobe Spectra 240 ml). Pro výkon je nutná kontinuální antikoagulace, u reoferéz jsme použili kombinaci ACD-A (Baxter, Mnichov, SRN) a úvodního jednorázového intravenózního podání nefrakcionovaného heparinu v dávce 4000 j. Roztok ACD-A byl použit v poměru 1 : 22 ke krvi. Absolutní většina výkonů byla provedena ambulantně, z dvou periferních venózních vstupů (používají se s výhodou žíly v kubitální jamce).
Pracovní postupy užívané při rheoferéze se mezi jednotlivými pracovišti liší a každé centrum má zavedenu vlastní modifikaci extrakorporální eliminace. Klíčové části naší modifikace byly patentovány (patenty č. 301836/2013, č. 301836/2010 a č. 3050387/2015). V průběhu léčby byly provedeny potřebné úpravy metodiky a zlepšení podle minulých zkušeností (např. zlepšen způsob kanylace periferních žil i centrální katetrizace bezpečnější a průměrově vhodnou kanylou, upraven způsob antikoagulace, upřesněna sada základních zajišťovacích hematologických a biochemických markerů). Byla zlepšena péče o nemocné (zkušenost týmu, trvalé monitorování saturace 02, alarmové zařízení přímo u lůžka, vyhřívaná lůžka, monitorování EKG, pulsu a dechové frekvence).
Přístroj u lůžka ukazuje Obrázek 1, schéma procedury je popsáno na Obrázku 2: plazma je oddělena od krevních tělísek pomocí separátoru Cobe-Spectra nebo Optia (Likewood, Oklahoma, USA) a dále čerpána do linek přístroje CF 100 (Infomed, Ženeva, Švýcarsko), který řídí průtok plazmy přes filtr Evaflux (Kawasumi, Tokyo, Japonsko). Po průchodu filtrem je plazma vedena spolu s krevními elementy zpět k nemocnému. Bližší detaily a zkušenosti s naší modifikací metodiky jsme popsali jinde [10,29,30-32].


Procedury trvají 3–4 hodiny v závislosti na množství promyté krve a rychlosti průtoku krve, což je dáno především stavem odběrové periferní žíly. Při tom mají pacienti paže upoutány pro zasunutí odběrových jehel do obou kubitálních jamek. Je tedy nutné zabezpečovat drobné potřeby nemocného jako je úprava polohy při obtížích ze strnulé polohy, odstranění případného svědění, podání nápojů, krmení u diabetiků, zajistit močení atd. Pacienti s VPMD trpí obyčejně ve svém věku dalšími obtížemi nebo chorobami, což je nutno zohlednit a respektovat. Monitorování klinického stavu pacientů při výkonech včetně základních vitálních funkcí (puls, krevní tlak, dechová frekvence, případně monitorování EKG) bylo obligátní a bylo prováděno dle Standardního operačního postupu Separátorového centra Fakultní nemocnice v Hradci Králové, který je pravidelně validován a kontrolován vnitřními i zevními audity. Dále byl detailně připraven protokol ke sledování a registraci nežádoucích reakcí, a to okamžitých nebo dlouhodobých – 26 položek, vycházejících z literárních zkušeností, našich předchozích výsledků a sledování [30] a pravidel WAA (World Apheresis Assotiation) registru, v jehož síti a podle jeho pravidel bylo postupováno [33]. Všechny nežádoucí účinky spojené s aferézou byly následně hodnoceny podle jednotného schématu WAA registru, zadávány a odesílány elektronicky přes registrační kód do WAA registru [34].
Pacientovi bylo umožněno před proceduru shlédnout in natura výkon při léčbě jiných pacientů – cílem bylo, pokud možno odstranit neodůvodněné obavy před prvním výkonem, kdy bývá větší procento výskytu nežádoucích reakcí. Před zahájením rheoferézy byl znovu zhodnocen stav pacienta i doplněna anamnéza. Pozornost byla věnována farmakologické anamnéze, pokud nemocný užívá ACE-inhibitory, hrozí tzv. bradykininové nežádoucí reakce. Bylo provedeno objektivní interní vyšetření, včetně posouzení stavu periferních žil, změřen puls a tlak auskultační metodou. Nemocní podepsali informovaný souhlas. Během aferézy byli pacienti trvale monitorováni personálem separátorového centra. V případě závažných nežádoucích příhod těžkého stupně byla zajištěna pomoc týmu jednotky intenzívní péče (přivolání alarmem kliniky a vzhledem k územní blízkosti byla možná specializovaná pomoc řádově v desítkách vteřin).
MATERÁL A METODY
Soubor pacientů
Dosud jsme léčili rheoferézou celkem 84 pacientů a do kontrolní skupiny randomizovali 72 pacientů. Do hodnocení jsme zařadili 65 pacientů průměrného věku 69,3 let (rozmezí 52–85 let; 35 žen; 27 mužů) a do kontrolní skupiny 55 pacientů průměrného věku 73,5 roku (rozmezí 56–82 let; 42 žen a 10 mužů) s minimální dobou sledování 60 měsíců (průměrná doba sledování 106 měsíců, maximální doba sledování 141 měsíců). Pacienti v kontrolní skupině byli sledováni ve stejných časových intervalech jako pacienti léčení rheoferézou.
Na základě dlouhodobých zkušeností jsme stanovili indikační kritéria a kontraindikace léčby rheoferézou. Indikací k léčbě byla přítomnost VPMD s měkkými drúzami ve stádiu 1–3 dle EURYEYE studie (Augood et al. 2004) nebo drúzová ablace RPE (DPED) s nejlépe korigovanou zrakovou ostrostí v rozmezí 20/20 až 20/125 (monokulus 20/160) ETDRS optotypů, věk mezi 50–80 lety s tělesnou hmotností nad 50 kg a dobrá kvalita periferních žil pro opakované léčebné procedury. Očními kontraindikacemi jsou přítomnost vlhké formy VPMD, geografické atrofie v makule nebo jiné irreverzibilní změny, jiná onemocnění sítnice a cévnatky než VPMD (dystrofie, zánětlivá onemocnění), akutní krvácení na očním pozadí, onemocnění zrakového nervu včetně glaukomu a opacita optických médií limitující vyšetření očního pozadí. Z celkových kontraindikací pak závažná celková onemocnění, např. malignity, stp. infarktu myokardu a centrální mozkové příhodě v posledních 3 měsících a nekorigovaná arteriální hypertenze ≥ 160/100.
U všech nemocných byla provedena základní léčba 8 procedurami rheoferézy, a to dvě za týden, 2 týdny přestávka a puls byl opakován 4x. Současně jsme provedli 2 přídatné rheoferézy, tzv. „booster therapy“ („posilující“, anebo „přídatnou“ léčbu) u 20 pacientů, kteří podstoupili základní sérii rheoferéz před 1,5 až 2 roky.
Oftalmoskopický nález pacientů: Ve skupině léčených pacientů byly měkké drúzy a splývající měkké drúzy přítomny u 60 očí, drúzová ablace RPE pak u 56 očí. Vlhká forma VPMD byla diagnostikována u 14 očí, a tyto nebyly do hodnocení zařazeny. V kontrolní skupině byly měkké drúzy a splývající měkké drúzy přítomny u 54 očí a drúzová ablace RPE u 38 očí. Vlhkou formu jsme zjistili u 18 očí, které nebyly hodnoceny. Do hodnocení morfologického nálezu jsme však zařadili pouze ty pacienty, u kterých byla od začátku sledování prováděna optická koherenční tomografie se spektrální doménou (SD-OCT).
Vyšetření
Oftalmologická vyšetření
- Nejlépe korigovaná zraková ostrost (NKZO) na ETDRS optotypových tabulích.
- Sledování vývoje měkkých drúz a drúzového odchlípení pigmentového epitelu sítnice (DPED) v průběhu léčby v [mm2] programem VISUPAC na digitální fundus kameře (FF 450 + IR, Zeiss).
- Stav sítnicové cirkulace fluorescenční angiografií (FAG) na digitální fundus kameře (FF 450 + IR, Zeiss), od r. 2019 angio-OCT (Spectralis, Heidelberg).
- Optická koherenční tomografie (OCT; Cirrus, Zeiss od r. 2009; 2005-2009: Stratus, Zeiss) k ověření uložení drúz, stanovení tloušťky sítnice a anatomických změn zejména v oblasti elipsoidů fotoreceptorů.
- Elektroretinografické vyšetření (ERG) k objektivnímu zjištění funkčního stavu sítnice:
a) Záblesková ERG k testování aktivity tyčinkového a čípkového systému.
b) Multifokální elektroretinografie (mfERG) specificky detekující lokalizované, drobné změny aktivity fotoreceptorů a jejich bipolárních buněk centrální oblasti sítnice.
c) ERG na reverzační podnět (pERG) snímající aktivitu gangliových buněk a centrální oblasti sítnice.
Sledování nemocných
Časový harmonogram oftalmologických vyšetření: před zahájením léčby, za 3, 6 a 12 měsíců byla provedena následující vyšetření: NKZO, fundusfotografie, elektrofyziologická vyšetření a OCT. FAG/angio-OCT před zahájením léčby a v případě podezření na progresi do vlhké formy VPMD. Pokud byla indikována přídatná rheoferéza po 1,5 až 2 letech, byl cyklus všech vyšetření zopakován, jinak byla prováděna vyšetření v ½ ročních intervalech.
Biochemické, hematologické a imunologické parametry
Vyšetřovali jsme kompletní základní biochemický a hematologický profil [29,31], dále pak parametry s vazoaktivní či koagulační nebo jinou patogenetickou aktivitou nebo určující pro efektivitu a bezpečnost procedur:
- lipoproteiny: celkový cholesterol, LDL-cholesterol, HDL
- cholesterol, Lp(a), apolipoprotein A a B;
- vzhledem k aktivnímu podílu selektinů (adhezních molekul) nebo jiných adhezních molekul a makrofágů na aktivitě atheromatózy: vyšetření sP-selektinu, MCP-1 (monocyte chemotactic peptide) a endoglinu;
- dynamiku speciálních markerů, které by mohly svědčit pro zánětlivou aktivitu (IL-10), markery stavu buněčné imunity (solubilní antigen CD40), aktivity endotelu, nebo markery apoptózy (sAPOfas);
- sledování parametrů patofyziologie a funkce krevních destiček: počet, MPV (střední objem trombocytu), PDW (šíře distribuce histogramu destiček podle jejich objemu) a PCT (destičkový hematokrit);
- základní ukazatele aktivity endotelu (trombomodulin, vW-factor) a fibrinolýzy (fibrinogen, tPA = tkáňový aktivátor plazminogenu a jeho inhibitor PAI-1);
- rheologické parametry (viskozita krve a plazmy, fibrinogen, α2-makroglobulin, imunoglobuliny);
- komplement: všechny tři základní cesty aktivace komplementu (klasická, alternativní a lektinová) a složka H komplementu;
- PCSK9: proprotein konvertáza subtilisin/kexin 9), sekreční regulátor LDL receptoru na povrchu buněk.
VÝSLEDKY
Nejlépe korigovaná zraková ostrost
Léčení pacienti
Ve sledované skupině pacientů, kteří podstoupili léčbu rheoferézou, jsme zjistili v průběhu pětiletého sledování jen nevýznamné kolísání NKZO. Do 2 let sledování se NKZO nevýznamně zvyšovala, poté je nicméně patrný trend jejího poklesu (Graf 1).

Kontrolní skupina
V kontrolní skupině pacientů jsme během čtyřleté sledovací doby zjistili statisticky nevýznamný pokles NKZO. Po pěti letech sledování byl pokles NKZO již statisticky významný (p = 0,031), viz Obrázek 3. Rozdíly NKZO mezi skupinami pacientů byly na začátku a až do 4 let sledování jen nevýznamné. Od 4 let sledování byla NKZO kontrolní skupiny významně nižší v porovnání s léčenými pacienty (p < 0,05 a p < 0,01).

Morfologické změny
Jako zlepšení nálezu jsme hodnotili zmenšení plochy měkkých drúz o více než 25 % původní plochy, bez zvratu do DPED, dále zmenšení (o více než 25 % původní plochy) či úplné vymizení DPED bez vzniku následné atrofie RPE, bez přechodu do 3. stádia VPMD. Hodnocení beze změny znamená stabilizaci nálezu v rozmezí ±25 % původní plochy patologických změn (plocha drúz, DPED). Za mírné zhoršení považujeme progresi plochy měkkých drúz a zvětšení plochy DPED o > 25% původní plochy, vznik izolované atrofie RPE s postižením centrální foveoly (CF) a také vznik pigmentací v této lokalizaci. Ostatní mírné zvýšení pigmentace může být naopak přínosem a ochranou před vznikem submakulární neovaskularizace. Za výrazné zhoršení VPMD považujeme vznik geografické atrofie a zvrat do vlhké formy VPMD na základě rozvoje nové CNV. Vývoj morfologických změn ve skupinách pacientů je uveden v Tabulce 1.

Závěrem lze shrnout, že ve výsledcích výrazně převyšuje zlepšení v prvních letech po rheoferéze, ale s časovým odstupem může nastoupit proces zhoršování morfologického nálezu. Nastupuje otázka vhodnosti opakování rheoferézy po 1, 2 až 3 letech za účelem zábrany zvratu úpravy fyziologického nálezu ve zhoršení. Při srovnání obou skupin dominuje významná schopnost zlepšení morfologického nálezu v makule po rheoferéze proti přirozenému, metabolickými změnami ve stáří ovlivněnému nálezu u kontrolní skupiny.
Drúzová ablace pigmentového epitelu
Léčení pacienti
Před léčbou jsme zjistili DPED u 56 očí (28x OP a 28x OL). Po zahájení léčby do 5 let sledování jsme zaznamenali zmenšení plochy DPED u 45 očí (23x OP a 22x OL). Z toho úplné vymizení DPED jsme pozorovali u 6 očí (3x OP a 3x OL), u 4 očí z nich bez projevů atrofie RPE. U 2 očí jednoho pacienta se po vymizení DPED rozvinula výrazná atrofie RPE, zřejmě pro původně plošně veliké, několik let přetrvávající DPED doprovázené poklesem vízu. U 1 oka tohoto pacienta progredovalo onemocnění s rozvojem CNV po 7 letech od léčby. Jen u 3 očí se zmenšením plochy DPED se rozvinula geografická atrofie. DPED zůstalo bez významných změn u 4 očí (1x OP a 3x OL). Zvětšení plochy DPED jsme zjistili u 6 očí, u 2 očí jedné pacientky s rozvojem CNV do 1 roku po léčbě. Nově vzniklou DPED jsme zjistili u 2 očí (1x OP a 2x OL), z nich na jednom oku vznikla CNV za 3 roky po léčbě, viz Tabulka 2.

Kontrolní skupina
Před léčbou jsme zjistili DPED u 17 očí (10x OP a 7x OL). Po zahájení léčby do 5 let sledování jsme zaznamenali zmenšení plochy DPED u 10 očí (7x OP a 3x OL). Úplné vymizení DPED jsme pozorovali u 2 očí (2x OP). Vymizení DPED u 2 očí a zmenšení plochy DPED u 2 očí doprovázel rozvoj CNV. Zmenšení plochy DPED bylo nahrazeno rozvojem geografické atrofie u 2 očí (1x OP a 1x OL), zlepšením skončilo jediné oko se zmenšením DPED. DPED zůstalo bez významných změn u 2 očí (2x OL). Zvětšení plochy DPED jsme zjistili u 8 očí (2x OP, 6x OL), u jedné pacientky s rozvojem CNV do 1 roku po léčbě. Rozdíly mezi pacienty a kontrolní skupinou uvedené v Tabulce 2 o zmenšení nebo zvětšení DPED jsou významné ve prospěch léčených pacientů na úrovni p < 0,001.
Plocha DPED
Průměrná hodnota DPED byla na začátku sledování u pacientů léčených rheoferézou velikosti 6,78 ±3,79 mm2, na konci sledování se zmenšila na 4,13 ±3,84 mm2 (p < 0,001). U pacientů v kontrolní skupině byla průměrná velikost DPED na začátku sledování 4,09 ±3,48 mm2, na závěr sledování se zvětšila na 6,69 ±4,2 mm2 (p = 0,001). V průběhu sledování jsme zjistili vznik CNV u dvou očí ve skupině léčených rheoferézou a u šesti očí ve skupině kontrolní. Porovnání mezi skupinami vyjadřuje Tabulka 3.

Stav elipsoidní vrstvy fotoreceptorů
Stav elipsoidní vrstvy jsme hodnotili u podskupiny 24 pacientů s DPED; 12 pacientů (22 očí) bylo léčeno 8 procedurami RHF a 12 pacientů (18 očí) bylo z kontrolní skupiny.
Léčení pacienti
Na začátku sledování byla ve skupině léčených pacientů elipsoidní vrstva fotoreceptorů intaktní u 6/22 (27,3 %) očí a u všech těchto očí zůstala bez defektu i za 2,5 roku. U zbylých 16/22 očí (72,7 %) bylo DPED provázeno odchlípením elipsoidní vrstvy, bez jejího defektu u 15/22 očí. Defekt elipsoidní vrstvy jsme zjistili jen u 1 oka (Obrázek 3 A, B a C) a tento defekt perzistoval a rozšířil se do oblasti foveoly za 2,5 roku (Obrázek 4 A, B a C).

Na konci sledování jsme zjistili přiložení elipsoidní vrstvy u 8 očí (50 % z původně 16 očí s jejím odchlípením). Zbytky odchlípení elipsoidů jsme diagnostikovali u 7 očí, zvětšené u 1 oka a minimální u 6 očí. U 15 očí (68,2 %) jsme nenalezli defekt elipsoidní vrstvy (6 očí s původně souvislou vrstvou elipsoidů a 9 očí s původním odchlípením vrstvy elipsoidů). Defekt elipsoidů jsme pozorovali u 7/22 očí (31,8 %). Naštěstí tento defekt dosahoval pouze u 4 očí (8,8 %) do oblasti centrální foveoly, a tím negativně ovlivnil funkci fotoreceptorů a zrakové ostrosti (ZO) (Obrázek 5).

Kontrolní skupina
Na začátku sledování byla v kontrolní skupině elipsoidní vrstva fotoreceptorů přiložená k DPED u 6/18 očí (33,3 %). U zbylých 12/18 očí (66,6 %) bylo DPED provázeno odchlípením elipsoidní vrstvy, bez jejího defektu u 9 očí, s defektem u 3 očí. Původní odchlípení elipsoidní vrstvy se zvětšilo u všech 12 očí.
Na konci sledování zůstala integrita elipsoidní vrstvy zachována pouze u 3/6 očí (16,7 %) s původně přiloženou elipsoidní vrstvou a u 3/6 očí se rozvinul její defekt, který nedosahoval foveoly. U 9/12 očí jsme zjistili rozvoj defektů elipsoidů a u 3/12 očí se původní defekty zvětšily. Celkem byl defekt elipsoidů diagnostikován u 15/18 očí (83,3 %), z nichž 12 dosahovalo do oblasti foveoly a negativně ovlivnilo vízus (Obrázek 6 A, B a C). Navíc u 6 očí s původním odchlípením elipsoidů se rozvinula choroidální neovaskularizace (CNV). Rozvoj CNV často předchází ruptura odchlípené elipsoidní vrstvy fotoreceptorů později následovaná rozvojem otoku vnitřních vrstev sítnice (Obrázek 7).

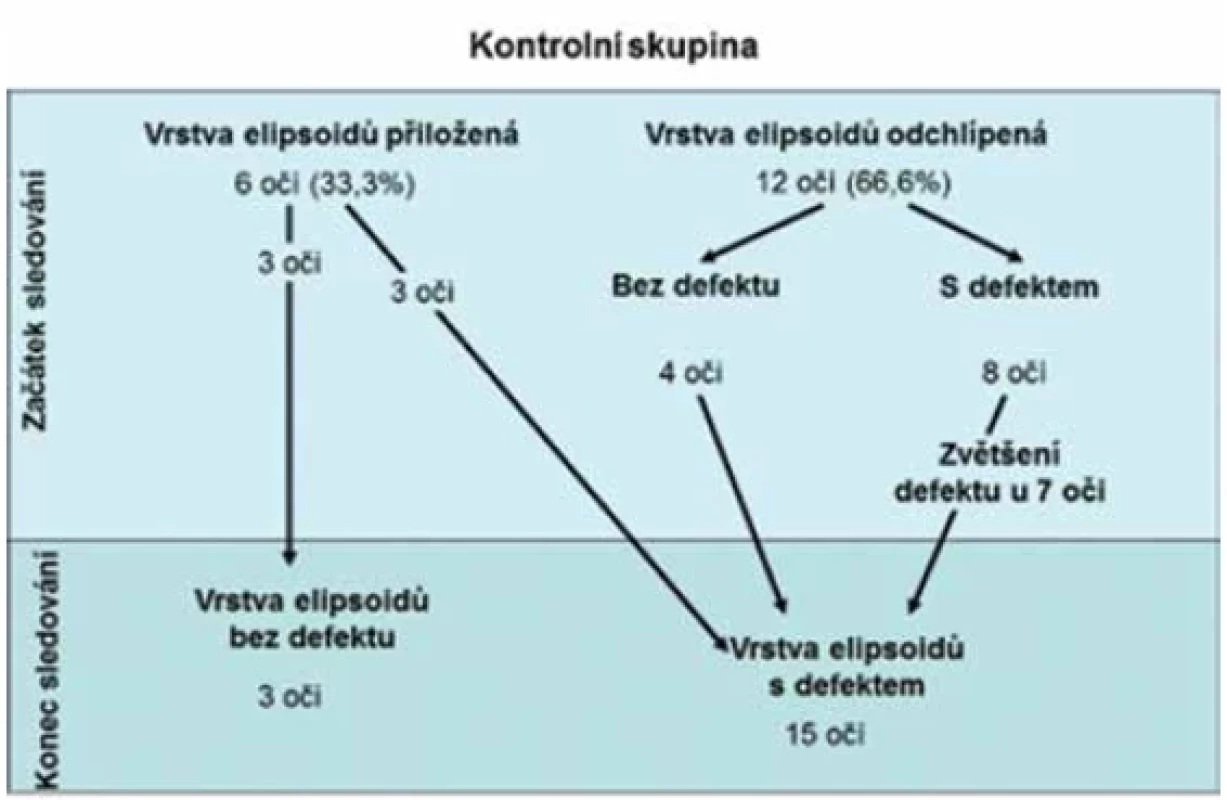
Závěrem konstatujeme, že na konci sledování zůstalo 15 očí (68,2 %) léčených pacientů bez porušení elipsoidní vrstvy, její defekty jsme zjistili u 7 očí, pouze u 4 z nich dosahoval defekt do foveoly a negativně ovlivnil vízus. V kontrolní skupině jsme zjistili defekty elipsoidní vrstvy u 15 očí (83 %), z toho ve 12 případech dosahoval defekt do foveoly a způsobil pokles ZO. Multifokální elektroretinografie prokázala významně vyšší amplitudy parafoveolárních odpovědí v oblasti mezi 1,8° a 7° excentricity u léčených pacientů (p = 0,04) na konci sledování. Zlepšení rheologických poměrů přispělo k udržení integrity elipsoidní vrstvy ve fovee, což je zásadním faktorem pro zachování zrakové ostrosti.
Elektroretinografie
Elektroretinografie na reverzační podnět (pERG): aktivita centrální oblasti sítnice (vlna p50) a gangliových buněk (vlna N95)
Zjistili jsme nevýznamné kolísání amplitud vlny P50 během celého sledování v obou skupinách pacientů. Amplitudy vlny N95 se mění u léčených pacientů nevýznamně až do 3 let, poté se však snižují statisticky významně (p < 0,05 a p < 0,01). V kontrolní skupině se snižují statisticky významně již za 1 rok sledování (p < 0,01) a zůstávají významně nižší v porovnání s původními hodnotami (p < 0,05 až p < 0,01).
Latence obou vln (P50 i N95) zůstávají u léčených pacientů prakticky na původní úrovni až do 3 let sledování, poté se statisticky významně prodlužují (p < 0,05 a p < 0,01). Naproti tomu v kontrolní skupině jeví tendenci postupného nárůstu v průběhu sledovacího období, který je převážně statisticky významný (p < 0,05 až p < 0,01).
Záblesková elektroretinografie (ERG) skotopická: aktivita tyčinkového systému
Skotopická: aktivita tyčinkového systému Zjistili jsme převážně jen nevýznamné kolísání amplitud tyčinkové odpovědi a oscilačních potenciálů v průběhu sledování v obou skupinách pacientů. Amplitudy a - a b-vln maximální odpovědi se v obou skupinách pacientů postupně snižují, u léčených pacientů převážně nevýznamně a u kontrol významně (p < 0,05 až p < 0,01). Latence skotopických odpovědí zůstávají u léčených pacientů prakticky na původní úrovni až do 3 let sledování, poté se statisticky významně prodlužují (p < 0,05 a p < 0,01). Naproti tomu v kontrolní skupině jeví tendenci postupného nárůstu v průběhu sledovacího období, který je převážně statisticky významný (p < 0,05 až p < 0,01).
Fotopická: aktivita čípkového systému
Zjistili jsme poměrně stabilní amplitudy fotopických odpovědí pacientů obou skupin do 3,5 roku sledování, poté dochází k poklesu aktivity, ve skupině léčených pacientů statisticky nevýznamnému a u kontrol statisticky významnému (p < 0,05 a p < 0,01). Rozdíly amplitud mezi skupinami pacientů byly převážně jen nevýznamné. Latence většiny odpovědí se v průběhu sledování prodloužily v obou skupinách pacientů nevýznamně a byly v převážné většině delší v kontrolní skupině oproti léčeným pacientům (p < 0,05).
Multifokální elektroretinografie (mfERG): aktivita centrální oblasti sítnice
Regresní analýza potvrdila jen nevýznamné kolísání amplitud foveolární aktivity v obou skupinách pacientů, navíc byl zjištěn velký rozptyl hodnot amplitud. V parafoveolární, paramakulární i v periferních oblastech s excentricitou mezi 1,8° a 30° jsme u léčených pacientů zjistili poměrně stabilní odpovědi až do 4 let pozorování, poté nastává pokles aktivity, který je převážně jen nevýznamný s výjimkou významného poklesu A2 až A4 za 4,5 roku. Naproti tomu u kontrolní skupiny se amplitudy odpovědí snižují významně od 4 let sledování a v tomto období jsou také významně nižší v porovnání s léčenými pacienty, zatímco předtím se liší jen nevýznamně. Latence většiny odpovědí se prodloužily v obou skupinách pacientů v průběhu sledování, převážně statisticky nevýznamně, rozdíly mezi skupinami pacientů byly převážně jen nevýznamné, Obrázek 8 A, B a Graf 2 A, B.

![Multifokální ERG: amplitudy průměrné odpovědi pozitivních
vrcholů mfERG. (A) Parafoveolární oblast v 2. kruhu
mfERG. A2 – amplituda pozitivní vlny průměrné odpovědi v 2.
kruhu kolem foveoly v obou skupinách pacientů během sledování
před výkonem, za 6 měsíců, 1 rok, 1,5 roku až do 5 let. Na
ose y je amplituda v [nVdeg-2]. (B) Paramakulární oblast ve 3.
kruhu mfERG. A3 – amplituda pozitivní vlny průměrné odpovědi
v 3. kruhu kolem foveoly v obou skupinách pacientů během
sledování před výkonem, za 6 měsíců, 1 rok, 1,5 roku až do 5 let.
Na ose y je amplituda v [nVdeg-2]](https://pl-master.mdcdn.cz/media/image_pdf/f62c6e29676043c726abd5cdb430592e.png?version=1677337760)
Centrální aktivita sítnice (zejména v parafoveolární oblasti mezi 1,8° and 7° excentricity nebo dokonce paramakulární aktivita mezi 5° a 13°) vzrostla u léčených pacientů s včasným poklesem nebo znovupřiložením DPED. Naproti tomu u pacientů s dlouhotrvajícím nebo perzistentním DPED se aktivita sítnice a NKZO v některých případech dokonce zhoršila.
Přídatná léčba („booster therapy“)
Na souboru 65 pacientů s pokročilou suchou formou VPMD jsme tedy prokázali pozitivní účinek základní léčby rheoferézou na morfologický i funkční stav oka, který přetrvává řadu měsíců, ale může se zmenšit. Popsali jsme statisticky významný rozdíl ve ZO ve prospěch léčených pacientů v porovnání s kontrolami do 2 let, později byl rozdíl již jen nevýznamný. Také úvodní pozitivní funkční efekt léčby elektroretinograficky byl za 36 až 42 měsíců již jen nevýznamný. Proto jsme se rozhodli provést přídatnou léčbu za 2 roky po standardní RHF léčbě. Tuto přídatnou léčbu jsme provedli u 20 pacientů (11 mužů a 9 žen), kteří podstoupili základní sérii rheoferéz před 1,5 až 2 roky. Hodnotili jsme vývoj 35 očí (5 očí mělo již na začátku vlhkou formu onemocnění) do 4 let sledování, tedy 2 roky po přídatné léčbě.
Nejlépe korigovaná ZO se v průběhu vyšetření měnila jen statisticky nevýznamně (Graf 3).

Zjistili jsme zlepšení morfologického nálezu (zmenšení plochy měkkých drúz a DPED) u 85,7 % (30/35 očí). Oční nález byl stabilizován u 8,6 % (3/35 očí). Mírné zhoršení s rozvojem malé oblasti RPE-atrofie v centru jsme zjistili u 2/35 očí (5,7 %). Progrese do 3. stádia onemocnění (vlhká forma, geografická atrofie) nebyla zjištěna u žádného pacienta. Vývoj velikosti defektů vrstvy elipsoidů je uveden na Graf 4.

Elektroretinografie
pERG: Funkce centrální oblasti sítnice (P50) a gangliových buněk (N95) se nevýznamně zvýšila po standardní RHF léčbě, poté se významně snížila před přídatnou RHF léčbou a následně se za 2 roky opět zvýšila (Graf 5 A, B).
![ERG na reverzační podnět: amplitudy průměrných odpovědí. (A) Pozitivní vlna P50: funkce
makuly. Na ose y je amplituda pozitivní vlny P50 v [μV]. Na ose x jsou termíny vyšetření. (B) Negativní
vlna N95: funkce gangliových buněk. Na ose y je amplituda negativní vlny N95 v [μV]. Na
ose x jsou termíny vyšetření](https://pl-master.mdcdn.cz/media/image_pdf/d2c711aaf961ceae0d3abe641c6aee91.png?version=1677338030)
Funkce tyčinkového, čípkového systému a centrální oblasti sítnice na mfERG kolísala jen nevýznamně v průběhu celého sledování s tendencí mírného zvýšení aktivity po základní léčbě RHF, snížení před přídatnou léčbou a opětovného zvýšení po přídatné léčbě.
Závěr: zlepšení zrakové ostrosti, anatomického a funkčního nálezu po standardní léčbě rheoferézou přetrvává dlouhodobě, přídatná léčba 2 procedurami RHF se zdá být bezpečnou a vhodnou metodou prodloužení této fáze. Rheoferéza pozitivně ovlivňuje přirozený, nepříznivý průběh suché formy VPMD změnou aktivity negativně působících faktorů.
Laboratorní ukazatele při léčbě rheoferézou
Zhodnocení základních biochemických parametrů (glykémie, minerály, ledvinné a jaterní funkce) prokázalo jen výkyvy bez klinické významnosti, i pokud byly statisticky významné. Pokud jde o poklesy hodnot, kdy se mohou podílet diluční změny (po procedurách dojde k nevelké krevní diluci, která činí asi 5 až 10 %).
Základní hematologické ukazatele, a to krevní obraz (hemoglobin, hematokrit, leukocyty) včetně parametrů destiček, nejsou procedurami klinicky významně ovlivněny, i když statistická významnost může být zjištěna. Určitý vzestup počtu leukocytů, přesto zcela v normálních hodnotách, je obecně pozorován po rheoferetických procedurách prováděných i v jiných klinických indikacích. Procedury jsou tedy po stránce ovlivnění krevního obrazu bezpečné.
Ukazatele účinnosti rheoferéz
Hodnotili jsme reologickou úspěšnost jednotlivých rheoferetických procedur (jako základní předpoklad úspěšné léčby VPMD) podle poklesu rheologicky významných faktorů (α2-makroglobulin, IgM, fibrinogenu, lipoproteinů), viz. Tabulka 4. Jejich pokles vedl k výslednému efektu na viskozitu krve a plazmy.

Efektem terapie je snížení definovaného spektra vysokomolekulárních látek. Výsledky jsou níže demonstrovány v Tabulce 4 – je vidět, že procedury jsou velmi účinné a vedou ke snížení α2-makroglobulinu o 51 %, fibrinogenu o 54 %, IgM o 60 %, LDL-cholesterolu o 62 %, apolipoproteinu B o 59 %; sníží se i další rizikový faktor – lipoprotein (a) o 54 %.
Pokles uvedených faktorů nakonec ovlivní rheologické poměry: viskozita plné krve klesá o 9,3 % a viskozita plazmy o 11,1%. Výsledkem je zlepšení průtoku v mikrocirkulaci.
Ukazatele ke sledování výsledku výzkumných procedur
- Komplement: klesá nejen aktivita alternativní cesty (o 1/3), ale i klasické cesty na 88 %, lektinové cesty na 62 % a faktoru H na 80 % [10].
- Hladina PCSK9 je u pacientů s VPMD významně vyšší než v kontrolní skupině. Po procedurách významně klesá. Koreluje s hladinou celkového cholesterolu, nekoreluje s LDL, HDL cholesterolem, fibrinogenem, viskozitou plazmy a krve, apolipoproteinem B, IgM a α2 - makroglobulinem. Zlepšení nebo stabilizace NKZO a morfologického nálezu bylo u pacientů doprovázeno snížením LDL-CH a PCSK9 a zlepšením markerů endoteliální dysfunkce.
- Sledovali jsme také dynamiku speciálních markerů, které by mohly svědčit pro zánětlivou aktivitu (IL-10), markery stavu buněčné imunity (MCP-1, solubilní antigen CD40), aktivity endotelu, adhezní molekuly (např. selektiny) nebo markery apoptózy (sAPOfas).
- Hladina sP-selektinu po procedurách klesala, stejně jako endoglin. Hladinu sE-selektinu jsme vyšetřovali na začátku výzkumu, ale nedošli jsme k pozitivním výsledkům; protože se hladina neměnila, dále nebyla sledována.
- IL 10 při vyšetřování prvních pacientů vykazoval po léčbě výrazný pokles.
- Hladina sCD40L klesala zprvu nevýznamně, nyní po vyšetření dalších pacientů je již pokles statisticky významný.
- Hladina hsCRP klesala významně.
- Annexin V, ukazatel apoptózy po RHF procedurách číselně klesal, ale jen nevýznamně.
- Solubilní APO-Fas po procedurách významně klesal.
Nežádoucí účinky rheoferézy
Podle našich několikaletých zkušeností je rheohemaferéza bezpečnou léčebnou metodikou. Prováděna ve výše uvedených indikacích, s respektováním kontraindikací, se vyskytuje jen 5 % nezávažných nežádoucích účinků [34]. Nejčastějšími reakcemi jsou podle našich i literárních zkušeností vazovagální příhody s relativně pestrou škálou tomu odpovídajících symptomů, a to zpravidla nevolnost, slabost, lehké a krátkodobé poklesy krevního tlaku [36,39]. Obyčejně stačilo krátkodobé přerušení procedury, eventuálně horizontální nebo i Trendelenburgova poloha a odezněly.
Pokud jde o citrátové obtíže: jsou uvedeny jen velmi zřetelné reakce. Mírné se vyskytují téměř pravidelně, takže v naší modifikaci metodiky byl zpravidla do systému zařazen vstup, kde jsou obsaženy 4 ampule kalcium gluconicum v 100–250 ml fyziologického roztoku. Tato infúze může podle potřeby pomalu přikapávat. Průměrná spotřeba za celou čtyřhodinovou proceduru bývá 100–150 ml roztoku. Jako pracoviště registrované ve světovém registru hemaferéz WAA – Word Apheresis Registry jsme tuto metodu hlásili do centra a byla přijata a doporučena k provádění. Kladné výsledky s touto prevencí byly publikovány společně v letech 2009 a 2010 [37,38].
Specifickou komplikací, na kterou je nutno v rámci objektivity upozornit a se kterou je možno se setkat u výkonů se sekundárním zpracováváním (filtrací) plasmy, je bradykininová reakce. Lze jí ovšem předcházet, což je nutné, neboť bývá nepříjemná. U našich pacientů se pečlivá prevence zdařila a reakci jsme nepozorovali. Vyskytuje se u pacientů, kteří užívají ACE-inhibitory. Projevuje se zarudnutím, hypotenzí, bradykardií a dušností (bradykinin působí také bronchokonstrikci). Na negativně nabitých površích filtrů nebo kolon dochází k aktivaci kininového systému a následné tvorbě bradykininu. Za normálních okolností je bradykinin rychle inaktivován kinázami I (ACE = angiotensin-konvertující-enzym) a II (dva typy peptidáz), ale u pacientů užívajících ACE-inhibitory jsou tyto enzymy blokovány. Při blokádě ACE dochází k hromadění bradykininu a vzniku příznaků popsaných výše. Proto by u pacientů podstupujících sekundární filtraci plazmy měl být ACE inhibitor vysazen alespoň 24 hodin před výkonem [39-41].
Pokud jde o technickou stránku provedení rheoferézy (k technickým obtížím): výkony patří mezi nejsložitější mezi hemaferetickými terapeutickými zákroky. Závisí na teoretické připravenosti a technické zručnosti personálu, který je dobře zaškolen teprve po cca 100 procedurách. Do té doby se vyskytovaly drobnější technické závady. Při závažnější technické poruše může být potřeba proceduru ukončit. Za celé čtyři poslední roky však již k tomu nedošlo.
Při hodnocení bezpečnosti a tolerability vlastní modifikace léčebné rheoferézy se jevila v rukou zkušeného personálu bezpečná. Vedlejší příhody byly klinicky lehce zvládnutelné. I tolerance procedur je přijatelná. Jako únosnou hranici tolerability, kdy je možno docílit žádaného klinického výsledku a je ještě velmi přijatelná tolerance ze strany nemocných, se jeví doba trvání procedury do 4 hodin. Obyčejně však trvá procedura 3 hodiny, jen při špatném stavu periferních žil a pomalém průtoku krve dosahuje až o hodinu déle.
DISKUZE
K léčbě rheoferézou jsme indikovali nemocné se suchou formou VPMD s měkkými drúzami za účelem udržení co nejlepší NKZO a snížení rizika přechodu do terminálního stadia této choroby ve formě geografické atrofie nebo dokonce vlhké formy VPMD, které jsou spojeny se značným poklesem ZO. V dlouhodobém sledování jsme prokázali u pacientů s pokročilou suchou formou VPMD zlepšení NKZO, podobně jako němečtí autoři studie MAC-I z Univerzity v Cologni, studie MAC-II z Univerzity ve Frankfurtu a MAC-III z Univerzity v Hamburgu [25]. Ve srovnání s výsledky multicentrické, randomizované, dvojitě slepé studie MIRA-1 jsme prokázali zlepšení NKZO léčených pacientů a statisticky významné zhoršení pacientů kontrolní skupiny v dlouhodobém sledování. Studie MIRA-1 však byla v komplexním hodnocení zatížena chybou při dodržení vstupních kritérií léčených pacientů a následná analýza po vyloučení pacientů, kteří nesplnili vstupní kritéria, potvrdila efekt rheoferézy v ročním sledování [42,43]. Na rozdíl od studie MIRA-1 nebylo naše sledování dvojitě slepé, protože naše etická komise nepovolila extrakorporální cirkulaci v rámci dvojitě slepé studie, protože rheoferéza obecně může mít vážné nežádoucí účinky (přestože jsme je v naší studii nepozorovali). Naše dlouhodobé výsledky prokázaly tendenci ke zlepšování ZO léčených pacientů v dlouhodobějším horizontu, přestože nebylo statisticky významné. Pokles NKZO v léčené skupině si vysvětlujeme opožděným projevem zlepšení mikrocirkulace v sítnici, které po rheoferéze prokazatelně nastává. Postupné zhoršování NKZO v kontrolní skupině je projevem přirozené progrese onemocnění, které bylo vyjádřené i vyšším zastoupením nově vytvořené neovaskulární formy VPMD u kontrolní skupiny.
Námi zjištěné zvýšení amplitud pERG odpovědí, významné u vlny P50 a nevýznamné pro vlnu N95, svědčí pro pozitivní vliv léčby rheoferézou na funkci centrální oblasti sítnice a gangliových buněk u pacientů po rheoferéze. Hodnocení pERG u pacientů s AMD léčených rheohemaferézou jsme v literatuře nenašli. V této studii jsme zjistili stabilní fotopickou aktivitu léčených pacientů, naproti tomu její významný pokles v kontrolní skupině. Hodnocením elektrické aktivity sítnice u pacientů s VPMD léčených rheoferézou se zabývá poměrně málo autorů. Popisují buď nevýznamné změny fotopické aktivity sítnice [6] nebo zvýšení amplitud čípkové odpovědi za 2,5 roku [44]. Rencová et al. zjistili významné zvýšení aktivity centrální oblasti sítnice v paramakulární oblasti s excentricitou mezi 5° a 13° po rheoferéze [6]. Bláha et al. popisují zvýšení odpovědí v oblasti mezi 11° a 22o excentricity u léčených pacientů [44]. V této studi se aktivita centrální oblasti sítnice a NZKO zvýšila u léčených pacientů s časným poklesem nebo vymizením DPED. Naproti tomu u pacientů s dlohodobě trvajícím DPED se paradoxně může NZKO i aktivita sítnice snížit z důvodu degenerativních změn vnější nukleární vrstvy a vrstvy elipsoidů na OCT [45].
Jedním z cílů rheoferézy je dosáhnout vstřebání měkkých drúz. První výsledky jsou uvedeny v předchozí studii [6], při níž jsme zjistili vliv rheoferézy také na zmenšení až vymizení plochy DPED. Pokud dojde ke splynutí měkkých drúz do DPED, při běžném rozvoji VPMD, tato patologická změna se postupně zvětšuje a nejeví tendenci k resorpci. Pokud se po letech přece jen resorbuje, bývá nahrazována atrofií retinálního pigmentového epitelu (RPE) nejčastěji ve formě geografické atrofie. Toto terminální stadium suché formy VPMD je samozřejmě spojeno s výrazným poklesem ZO [5]. Naše výsledky ukazují, že po rheoferéze se plocha DPED zmenšuje a v dlouhodobém sledování tak nedochází k rozvoji rozsáhlé geografické atrofie RPE. Khanifar et al. se zmiňuje o nebezpečí zvratu drúz splývajících do DPED i jednotlivých vysokých drúz do vlhké formy VPMD [46]. Sikorski et al. využívá spektrálního OCT s vysokou rozlišovací schopností a upozorňuje na možnost hromadění tekutiny pod elipsoidní vrstvou fotoreceptorů v prohlubních mezi sousedními, částečně už splývajícími drúzami [45]. Tato tekutina zvětšuje vzdálenost mezi povrchem RPE a vrstvou elipsoidů fotoreceptorů. Zdejší přítomnost tekutiny pod neuroepitelem sítnice překvapivě neznamená ještě přítomnost submakulární neovaskularizace, a tedy vlhké formy VPMD [45]. Tím si vysvětlujeme statisticky nevýznamné snížení ZO a nevýznamné snížení hodnot multifokálního ERG v případě, kdy po léčbě dochází k přiložení DPED bez vzniku atrofie RPE. Atrofie RPE po přiložení DPED po rheoferéze může nastat, ale vzhledem k její malé velikosti nebyla u léčených pacientů spojena s výrazným poklesem NKZD. Dle Sikorského et al. na vrcholu obzvlášť prominující drúzy nebo DPED může dojít k defektu v tenké, k RPE přiléhající elipsoidní vrstvě, kam se dostane tekutina, což je již známkou zvratu do vlhké formy VPMD [45]. K tomu přece jenom došlo u dvou očí našich léčených nemocných několik let po provedení rheoferézy. Ve srovnání s kontrolní skupinou, je četnost zvratu v neovaskulární VPMD nižší, přestože není statisticky významná pro malou velikost souboru. Na rozdíl od kontrolního souboru, kdy jsme pozorovali zvrat v neovaskulární VPMD u jednoho oka již 6 měsíců po začátku sledování, dochází vlivem rheoferézy k oddálení progrese onemocnění. Toto zjištění nás vede k předpokladu, že k dosažení maximálního účinku bude třeba rheoferézu opakovat pravděpodobně za 1,5 až 2 roky od posledních cyklů. Tato úvaha je posílena i výsledky mfERG, které se mezi 30 až 42 měsícem již nemění, přestože předtím se mírně zlepšovaly.
Zhodnocení biochemických a hematologických ukazatelů před rheoferézou a bezprostředně po ní ukázalo hodnoty, které jsou sice statisticky významné, ale klinicky nikoliv. Pokud jde o poklesy hodnot – mohou se podílet diluční změny (po procedurách dojde k nevelké krevní diluci, která činí až 5–10 %). Určitý vzestup počtu leukocytů, i když zcela v normálních hodnotách, je obecně pozorován po těchto procedurách prováděných i v jiných klinických indikacích. Jako po jiných hemaferetických procedurách klesá poněkud množství hemoglobinu a krevních destiček, ale pokles je při použití uvedených moderních separátorů krevních tělísek menší, nežli býval u starších typů separátorů. Procedury jsou tedy po stránce ovlivnění krevního obrazu bezpečné. Pokles α2-makroglobulinu, IgM, fibrinogenu a lipoproteinů ovlivnil rheologické poměry: viskozita plné krve klesla o 15 % a viskozita plazmy o 12 %. Výsledkem je jistě zlepšení průtoku v mikrocirkulaci, což je základní předpoklad pro zvýšení průtoku také v cévnatce a zlepšení metabolismu sítnice.
Prokázali jsme, že některé z výše hodnocených ukazatelů svědčí pro pokles aktivity endotelu cév nebo zánětlivých změn u našich pacientů po léčbě rheoferézou. Zlepšení prokrvení tkání po rheoferéze může mít souvislost i s poklesem hladiny solubilních forem selektinových adhezních molekul E-selektinu a P-selektinu v periferní krvi [47]. Tyto molekuly, regulující počáteční fáze adheze leukocytů i trombocytů, jsou uloženy v nitrobuněčných granulích, ze kterých jsou po aktivaci velmi rychle transportovány na povrch. E-selektin se nachází výlučně ve Weibel-Paladeho tělíscích endoteliálních buněk, P-selektin je uložen jak v alfa-granulích trombocytů, tak ve Weibel - Paladeho tělíscích endoteliálních buněk. Bylo však prokázáno, že solubilní P-selektin (sP-selektin) v periferní krvi je prakticky výlučně uvolňován z alfa granulí trombocytů [48]. Měřením sP-selektinu a solubilního E-selektinu (sE-selektinu) lze zřejmě hodnotit vliv procedur na endoteliální výstelku cév. U našeho souboru hladina sP-selektinu po procedurách klesala, stejně jako endoglin. Hladinu sE-selektinu jsme vyšetřovali na začátku výzkumu, ale nedošli jsme k pozitívním výsledkům; protože se hladina neměnila, v dalším nebyla sledována.
U pacientů s VPMD jsme nalezli zvýšenou hladinu PCSK9 oproti kontrolám, ale korelace byla nalezena jen mezi hladinou PCSK9 a totálním cholesterolem, nebyla pozitivní mezi hladinou PCSK9 a hladinou LDL-cholesterolu. Náš soubor je ovšem relativně malý a může jít o chybu malých čísel. Shodné výsledky s touto prací [49] jsme však nalezli, pokud jde o výrazný pokles PCSK9. Pokles znamenal snížení hladiny PCSK9 o polovinu, stejně jako my, pozorovali Julius et al. [49]. Neměli jsme možnost měřit hladinu PCSK9 po 24 hodinách, jako to uvedení autoři provedli a zjistili, že návrat k původním hodnotám je rychlý. Pravděpodobné však je, že i u VPMD bude návrat k původním hodnotám rychlejší nežli u hladiny cholesterolu, která docílí původní hodnoty asi za 8 dní [49]. Potvrdili jsme však, že hladina PCSK9 v polovině léčby (před čtvrtou reoferézou) i na konci celé léčebné série (před osmou procedurou) se významně neliší oproti výchozím hodnotám.
Vyšetřovali jsme také MCP-1 vzhledem k podstatnému významu mikrofágů v mikrocirkulaci a zjistili jsme významný pokles u nemocných s familiární hypercholesterolemií [47,50]. Při tomto výzkumu byl zjištěn jeho pokles u VPMD. Jak je uvedeno v literatuře, může jít o významný faktor, který svědčí pro efektivitu ovlivnění aktivity zánětlivého procesu nebo aterosklerózy [25,47]. Mechanismus ovlivnění aktivity zánětlivého procesu rheoferézou v patogenezi rozvoje VPMD by mohl být také doložen významným poklesem zánětlivých markerů IL 10, Ig M, v případě aterosklerotického mechanismu pak poklesem hladin CD30 a sCD40L.
ZÁVĚR
Na základě výsledků dlouhodobé léčby a sledování pacientů lze uzavřít, že rheoferéza je možností, jak zlepšit chmurný osud nemocných se suchou formou VPMD, kteří jsou v nebezpečí progrese. Důležitá je také ekonomická stránka, kdy léčebné náklady stoupají zhruba třikrát při přechodu suché formy VPMD do vlhké, a tak by bylo možné zástavou progrese suché formy VPMD snížit již tak vysoké a stále rostoucí náklady na léčbu VPMD, a to vytvořením komplexního systému optimální dlouhodobé péče o pacienty se suchou formou VPMD. Proto je také tato léčebná metoda zakotvena v celosvětově uznávaných guidelines ASH (American Society for Apheresis) jako metoda první volby, k čemuž zřejmě přispěly i naše výsledky, kdy byla naše práce citována jako jedna z posledních randomizovaných studií v uvedených guidelines.
Autoři práce prohlašují, že vznik i téma odborného sdělení a jeho zveřejnění není ve střetu zájmu a není podpořeno žádnou farmaceutickou firmou. Práce nebyla zadána jinému časopisu ani jinde otištěna.
Prof. MUDr. Hana Langrová, Ph.D.,
FEBO
Oční klinika LF a FN
Sokolská 581
500 05 Hradec Králové
E-mail: hana.langrova@fnhk.cz
Do redakce doručeno dne: 16. 8. 2022
Přijato k publikaci dne: 12. 11. 2022
Čes. a slov. Oftal., 79, 2023, No. 1, p. 8–24
Sources
1. Seddon JM, Chen CA. The epidemiology of age-related macular degeneration. Int Ophthalmol Clin Fall. 2004;44(4):17-39.
2. Brown DM, Michels M, Kaiser PK, et al. Ranibizumab versus verteporfin photodynamic therapy for neovascular age-related macular degeneration: Two-year results of the ANCHOR study. Ophthalmology. 2009;116(1):57-65.e55.
3. Donaldson MJ, Pulido JS. Treatment of nonexudative (dry) age-related macular degeneration. Curr Opin Ophthalmol. 2006;17(3):267 - 274.
4. Rencová E, Bláha M, Blažek M, et al. Možnost ovlivnění suché formy věkem podmíněné makulární degenerace hemorheoferézou [Influence of haemorheopheresis in the dry form of the age related macular degeneration]. Cesk Slov Oftalmol. 2009;65(2):43-48. Czech.
5. Klein R. Overview of progress in the epidemiology of age-related macular degeneration. Ophthalmic Epidemiol. 2007;14(4):184-187.
6. Rencová E, Bláha M, Langrová H, et al. Haemorheopheresis could block the progression of the dry form of age-related macular degeneration with soft drusen to the neovascular form. Acta Ophthalmol. 2011;89(5):463-471.
7. Rencová E, Bláha M, Langrová H, et al. Preservation of the Photoreceptor Inner/Outer Segment Junction in Dry Age-Related Macular Degeneration Treated by Rheohemapheresis. J Ophthalmol. 2015;2015 : 359747.
8. Troutbeck RS, Al-qureshi RS, GUYME RH. Therapeutic targeting of the complement system in age-related macular degeneration: a review. Clin Experiment Ophthalmol. 2012;40(1)18-26.
9. Wang X, Zhang Y, Zhang MN. Complement factor B polymorphism (rs641153) and susceptibility to age-related macular degeneration: evidence from published studies. Int J Ophthalmol. 2013;6(6):861 - 867.
10. Bláha M, Andrýs C, Langrová H, et al. Changes of the complement system and rheological indicators after therapy with rheohemapheresis. Atheroscler Suppl. 2015;18 : 140-145.
11. Friedman E. The pathogenesis of age-related macular degeneration. Am J Ophthalmol. 2008;146(3):348-349.
12. De Amorim Garcia Filho CA, Yehoshua Z, Gregori G, et al. Change in drusen volume as a novel clinical trial endpoint for the study of complement inhibition in age-related macular degeneration. Ophthalmic Surg Lasers Imaging Retina. 2014;45(1):18-31.
13. Tamai KA, Matsubara K, Tomida A, et al. Lipid hydroperoxide stimulates leukocyte-endothelium interaction in the retinal microcirculation. Exp Eye Res. 2002;75(1):69-75.
14. Tserentsoodol Na, Sztein J, Campos N, et al. Uptake of cholesterol by the retina occurs primarily via a low density lipoprotein receptor - mediated process. Mol Vis. 2006;12 : 1306-1318.
15. Fliesler SJ, Florman R, RapP LM, et al. In vivo biosynthesis of cholesterol in the rat retina. FEBS Lett. 1993;335(2):234-238.
16. Benjannet S, Rhainds D, Essalmani R, et al. NARC-1/PCSK9 and its natural mutants: zymogen cleavage and effects on the low density lipoprotein (LDL) receptor and LDL cholesterol. J Biol Chem. 2004;279(47):48865-48875.
17. Age-related eye disease study research group: A randomized, placebo - controlled, clinical trial of high-dose supplementation with vitamins C and E, beta karotene and zinc for age-related macular degeneration and vision loss. AREDS Report 8. Arch Ophthalmol. 2001;119 : 1417-1436.
18. Klingel R, Fassbender C, Heibges A, et al. RheoNet registry analysis of rheopheresis for microcirculatory disorders with a focus on age-related macular degeneration. Ther Apher Dial. 2010;14(3):276-286.
19. Rencová E, Bláha M, Langrová H, et al. Reduction in the drusenoid retinal pigment epithelium detachment area in the dry form of age-related macular degeneration 2.5 years after rheohemapheresis. Acta Ophthalmol. 2013;91(5):e406-408.
20. Schwartz J, Winters JL, Padmanabhan A, et al. Guidelines on the use of therapeutic apheresis in clinical practice-evidence-based approach from the Writing Committee of the American Society for Apheresis: the sixth special issue. J Clin Apher. 2013;28(3):145-284.
21. Studnicka J, Rencova E, Blaha M, et al. Long-term outcomes of rheohaemapheresis in the treatment of dry form of age-related macular degeneration. J Ophthalmol. 2013; 135798.
22. Rozsíval P, Baráková D, Bláha M, et al. Trendy soudobé oftalmologie 7. Edition ed. Praha: Galén. 2011. 225 p. ISBN 978-80-7262-691-5.
23. Schwartz J, Padmanabhan A, Aqui N, et al. Guidelines on the Use of Therapeutic Apheresis in Clinical Practice-Evidence-Based Approach from the Writing Committee of the American Society for Apheresis: The Seventh Special Issue. J Clin Apher. 2016;31(3):149-162.
24. Klingel R, Fassbender C, Fassbender, et al. Rheopheresis: rheologic, functional, and structural aspects. Ther Apher. 2000;4(5):348-357.
25. Klingel R, Fassbender C, Fassbender T, Gohlen B. Clinical studies to implement Rheopheresis for age-related macular degeneration guided by evidence-based-medicine. Transfus Apher Sci. 2003;29(1):71-84.
26. Berrouschot J, Barthel H, Scheel C, et al. Extracorporeal membrane differential filtration--a new and safe method to optimize hemorheology in acute ischemic stroke. Acta Neurol Scand. 1998;97(2):126-130.
27. Brunner R Widder RA, Walter P, et al. Change in hemorrheological and biochemical parameters following membrane differential filtration. Int J Artif Organs. 1995;18(12):794-798.
28. Borberg H, Tauchert M. Rheohaemapheresis of ophthalmological diseases and diseases of the microcirculation. Transfus Apher Sci. 2006;34(1):41-49.
29. Bláha, M. Extracorporeal LDL-cholesterol elimination in the treatment of severe familial hypercholesterolemia. Acta Medica (Hradec Králové). 2003;46(1):3-7.
30. Bláha, M, Cermanová M, Bláha V, et al. Safety and tolerability of long lasting LDL-apheresis in familial hyperlipoproteinemia. Ther Apher Dial. 2007;11(1):9-15.
31. Bláha M, Rencová E, Bláha V, et al. Rheopheresis in vascular diseases. Int J Artif Organs. 2008;31(5):456-457.
32. Lánská M, Bláha M, Žák P. Extrakorporální eliminace cholesterolu u familiární hypercholesterolemie – srovnání dvou metod. Transfúze a hematologie dnes. 2014;20 : 67-75.
33. Stegmayr B, Pták J, Wikstrom B, et al. World apheresis registry 2003-2007 data. Transfus Apher Sci. 2008;39(3):247-254.
34. Bláha M, Lánská M, Tomšová H, Žák P. Apheresis data registration in WWA registry-10-year experience of our center. Transfus Apher Sci. 2017;56(5):738-741.
35. Bláha M, Pták J, Čáp J, et al. WAA apheresis registry in the Czech Republic: two centers experience. Transfus Apher Sci. 2009;41(1):27 - 31.
36. Witt VB, Stegmayr J, Ptak J, et al. World apheresis registry data from 2003 to 2007, the pediatric and adolescent side of the registry. Transfus Apher Sci. 2008;39(3):255-260.
37. Mortzell M, Berlin G, Nilsson T, et al. Analyses of data of patients with Thrombotic Microangiopathy in the WAA registry. Transfus Apher Sci. 2011;45(2):125-131.
38. Stegmayr B, Pták J, Nilsson T, et al. Panorama of adverse events during cytapheresis. Transfus Apher Sci. 2013;48(2):155-156.
39. Kojima S, Yoshitomi Y, Sotaome M, et al. Effects of losartan on low - -density lipoprotein apheresis. Ther Apher.1999;3(4):303-306.
40. Kojima S, Shida M, Takano H, et al. Effects of losartan on blood pressure and humoral factors in a patient who suffered from anaphylactoid reactions when treated with ACE inhibitors during LDL apheresis. Hypertens Res. 2001;24(5):595-598.
41. Winters JL. Low-density lipoprotein apheresis: principles and indications. Semin Dial. 2012;25(2):145-151.
42. Pulido J. Multicenter Investigation of Rheopheresis for AMD (MIRA-1) study Group, Multicenter prospective, randomised, double-masced, placebo-controlled study of rheopheresis to treat nonexudative age-related macular degeneration: interim analysis, Trans. Am. Ophthalmol. Soc. 2002;100 : 85-107.
43. Pulido JS, Winter JL, Boyer D. Preliminary analysis of the final multicenter investigation of rheopheresis for age related macular degeneration (AMD) trial (MIRAl) results, Trans Am Ophthalmol Soc. 2006;104 : 221-231.
44. Bláha M, Rencová E, Langrová H, et al. Rheohaemapheresis in the treatment of nonvascular age-related macular degeneration. Atheroscler Suppl. 2013;14(1):179-184.
45. Sikorski BL, Bukowska L, Kaluzny JJ, et al. Drusen with accompanying fluid underneath the sensory retina. Ophthalmology. 2011;118 : 82-92.
46. Khanifar AA, Koreishi AF, Izatt JA, Toth CA. Drusen ultrastructure imaging with spectral domain optical coherence tomography in age-related macular degeneration, Ophthalmology. 2008;115 : 1883-1890.
47. Bláha M, Krejsek J, Bláha M, et al. Selectins and monocyte chemotactic peptide as the markers of atherosclerosis activity, Physiol Res. 2004;53(3):273-278.
48. Michelson AD, Barnard MR, Hechtman HB, et al. In vivo tracking of platelets: circulating degranulated platelets rapidly lose surface P-selectin but continue to circulate and fiction. Proc Natl Acad Sci USA. 1996;93(21):11877-11882.
49. Julius U, Milton M, Stoellner D, et al. Effects of lipoprotein apheresis on PCSK9 levels. Atherosclerosis Supplements. 2015;18 : 180-6.
50. Bláha M, Skořepová M, Mašín V, et al. The role of erythrocytapheresis in secondary erythrocytosis therapy. Clin Hemorheol Microcirc. 2002;26(4):273-275.
Labels
OphthalmologyArticle was published in
Czech and Slovak Ophthalmology

2023 Issue 1
-
All articles in this issue
- RHEOFERÉZA A JEJÍ VYUŽITÍ V LÉČBĚ CHOROB S PORUCHOU MIKROCIRKULACE. PŘEHLED
- RHEOFERÉZA V LÉČBĚ VĚKEM PODMÍNĚNÉ MAKULÁRNÍ DEGENERACE
- VYUŽITIE FEMTOSEKUNDOVÉHO LASERA PRI OPERÁCII KATARAKTY
- RHEOHEMAFERÉZA V LÉČBĚ SUCHÉ FORMY VPMD. KAZUISTIKA
- PROF. DR CARL FERDINAND RITTER VON ARLT (1812–1887): HIS LIFE AND WORK DURING HIS OPHTHALMOLOGICAL CAREER IN PRAGUE
- ABNORMAL CORNEAL LESION FOLLOWING CATARACT SURGERY; A CORNEAL PYOGENIC GRANULOMA? A CASE REPORT
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- RHEOFERÉZA V LÉČBĚ VĚKEM PODMÍNĚNÉ MAKULÁRNÍ DEGENERACE
- RHEOFERÉZA A JEJÍ VYUŽITÍ V LÉČBĚ CHOROB S PORUCHOU MIKROCIRKULACE. PŘEHLED
- RHEOHEMAFERÉZA V LÉČBĚ SUCHÉ FORMY VPMD. KAZUISTIKA
- VYUŽITIE FEMTOSEKUNDOVÉHO LASERA PRI OPERÁCII KATARAKTY

