Neuromechanismy účinku návykových látek, systém odměn
Neuromechanisms of Addictive Substances, Reward System
Addiction on psychoactive substances is a complex, multifactorial illness, which evolves from the interaction of genetic predisposition and environmental factors. Several models describe the creation and evolution of addiction. One of the most important ones is the reward system, which is created on the basis of dopamine hypothesis. Basic interaction takes place between the ventral tegmental area, nucleus accumbens and the prefrontal cortex. Psychoactive substances (pathological sources of rewards) cause many sorts of biochemical changes in the brain, which have a similar reactive mechanism as physiological sources (sex, food). However, their reaction time and ease of achieving the feeling of pleasure differ significantly. There are no physiological mechanisms which would ensure the preference of natural rewards.
Key words:
dopamine hypothesis, nucleus accumbens, reward, prefrontal cortex, reward system, ventral tegmental area.
Authors:
P. E. Váchová; S. Racková; L. Janů
Authors‘ workplace:
Psychiatrická klinika LF UK a FN, Plzeň
přednosta doc. MUDr. J. Beran, CSc.
Published in:
Čes. a slov. Psychiat., 105, 2009, No. 6-8, pp. 263-268.
Category:
Comprehensive Reports
Overview
Závislost na psychoaktivních látkách je komplexní, multifaktoriální onemocnění, které se vyvine ze souhry genetických predispozic a faktorů okolního prostředí. Vznik a vývoj závislosti popisuje několik modelů. Mezi nejvýznamnější patří systém odměn (tzv. reward system), který souvisí s dopaminovou hypotézou. Základní interakce se odehrává mezi ventrální tegmentální oblastí (VTA), nucleus accumbens (NAc) a prefrontálním kortexem. Psychoaktivní látky a patologické zdroje odměn, působí v mozku různými cestami. Mají společný mechanismus působení jako fyziologické zdroje (sex, jídlo). Liší se jejich reakční čas a obtížnost dosažení pocitu libosti. Neexistují fyziologické mechanismy, které by zajistily preferenci přirozených odměn.
Klíčová slova:
dopaminová hypotéza, nucleus accumbens, odměna, prefrontální kortex, systém odměn, ventrální tegmentální area.
ÚVOD
Systém odměn
Systém odměn byl popsán v 50. letech 20. století. O dvacet let později se zjistilo, že syndrom závislosti je spojen se vzestupem dopaminu ve striatu. Výzkum se zaměřil i na procesuální změny a anatomické struktury a na význam dalších neurochemických systémů [9]. Předmětem zájmu výzkumů je působení psychoaktivní látky na mozek, jak dochází k behaviorálním změnám v podobě závislostního chování a komplexní rozpracování korelace mezi chováním a změnou mozkové funkce. Behaviorální změny zahrnují: kompulzivní charakter užívání psychoaktivních látek; silnou preferenci užívání psychoaktivních látek před přirozenými zdroji odměn (sex, sportovní aktivity, jídlo); podněty spojené s abúzem, které silně kontrolují chování; vysoké riziko relapsu, které významně neklesá ani po letech abstinence. Mezi hlavní predispoziční faktory patří změna v dopaminergním systému odměn.
Systém odměn je evolučně starý, neboť je jedním z hlavních autoregulačních mechanismů, které zajišťují životně důležité potřeby k přežití, k reprodukci, k navození příjemných pocitů. Všechny činnosti, které zachovávají rod a druh, jsou spojeny s libým pocitem (odměnou) z důvodu zvýšení pravděpodobnosti opakování tohoto chování. Mezi fyziologické zdroje odměny patří potrava, sex a komplexnější formy, jako je síť sociálních vztahů. Systém odměn má za úkol rozpoznat biologicky důležitý podnět, přidělit tomuto podnětu výši odměňující hodnoty, asociovat podnět s hodnotou, predikovat odměnu a nakonec spustit motivované behaviorální odpovědi [9].
Za klíčovou anatomickou i funkční strukturu systému odměn je považována oblast NAc (nucleus accumbens), která se dělí na jádro a obal. Základní anatomickou osu systému odměn tvoří spojení VTA (ventrální tegmentální arey) s NAc a propojení NAc s prefrontálním kortexem. Mezokortikolimbický systém je aktivován mnoha fyziologickými i patologickými odměnami. Hraje důležitou úlohu v systému odměn, ale podílí se také na závislosti, negativních emocionálních stavech a pocitech demotivace.
NAc je součástí striata, jeho ventrální části. Odměna, kterou může zprostředkovat i aplikace drogy, zde zvyšuje produkci DA (dopaminu). NAc je ve spojení i s dalšími limbickými strukturami (schéma 1). Základní strukturou NAc jsou GABAergní trnité neurony, které hrají klíčovou roli v systému odměn společně s excitačním zakončením (glutamátového systému) z prefrontálního kortexu, hippokampu a inhibičním zakončením dopaminových buněk z VTA [16]. Nefyziologicky zvýšený výdej DA z VTA do NAc je biologickým korelátem, reakcí mozku na podnět (situaci, aktivitu, látku…).
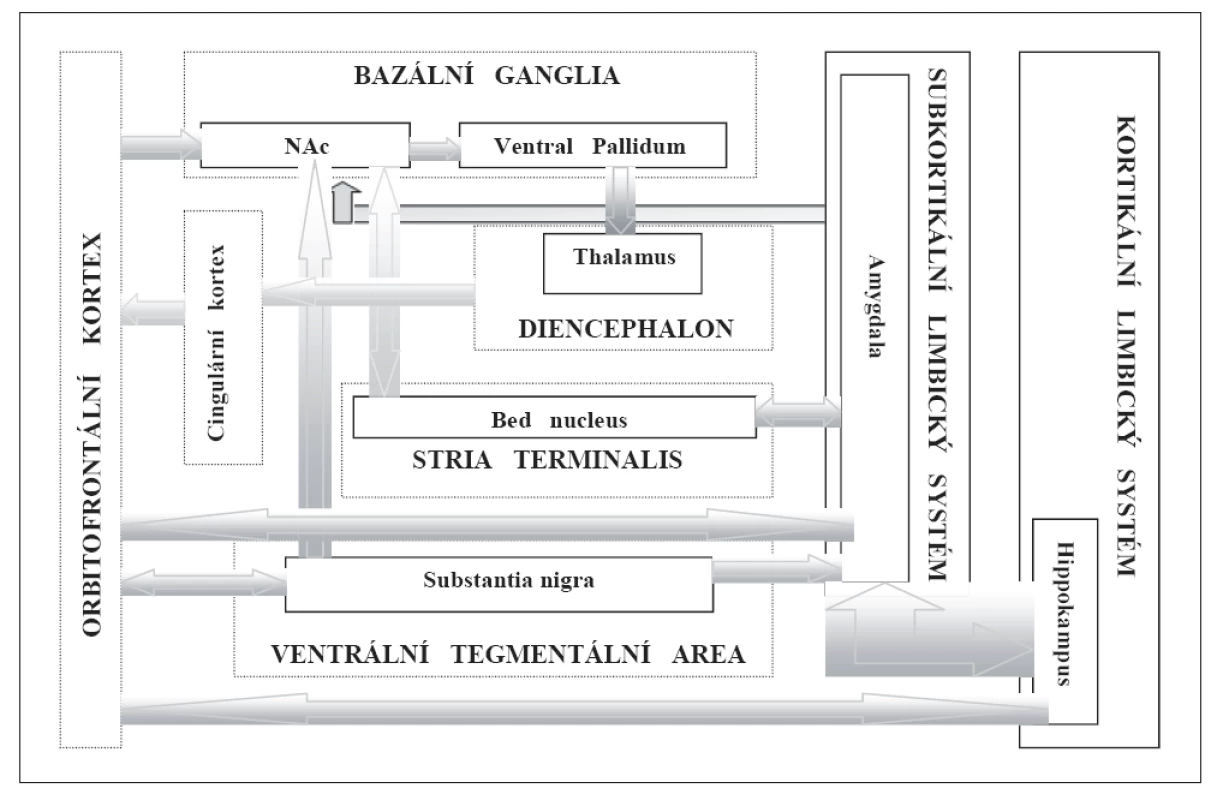
Výdej DA se uplatňuje pouze v počátcích těchto asociací, při opakovaných obdobných expozicích k větším výkyvům ve výdeji nedochází [9]. Výdej DA slouží jako počáteční funkční označení cesty spojení podnětu s libostí, aby byl tento proces lépe detekovatelný pro opakovanou stimulaci. Po vzniku tohoto spojení role DA klesá a do popředí nastupují jiné neurotransmitérové systémy.
Systém odměn je v úzké součinnosti s fungováním paměti. Do paměti se ukládá celkový obraz situace, při které došlo k zisku odměny. Poté jsou zapamatované vjemy v mozku seřazeny dle důležitosti a obtížnosti zisku libého pocitu, čímž člověk získává paletu zkušeností. Člověk si pamatuje účinnou strategii vlastního chování vedoucí k úspěšnému dosažení libosti aktuálními nebo odloženými podněty.
Stresové systémy jsou rovněž v úzkém kontaktu se systémem odměn. Jejich funkcí je vyvarovat se situacím, které by mohly vést k velké nelibosti, k ohrožení. Nepříjemné podněty vyvolávající pocit nelibosti jsou ve spolupráci s paměťovým systémem označeny negativním psychickým procesem, např. emocí.
Ve spojení se systémem odměn je i kortiko (prefrontální kortex)-talamo-striatální smyčka, která se uplatňuje při setrvání opakovaného chování, včetně užívání psychoaktivní látky. Prefrontální kortex se navíc uplatňuje ve výběru strategií chování potřebných k dosažení odměny.
Neuromechanismy účinku návykových látek
Účinky jednotlivých psychoaktivních látek závisí na jejich chemické struktuře, díky které rozdílným způsobem ovlivňují mechanismy centrálního nervového systému (CNS). Účinek psychoaktivních látek je způsoben vazbou nebo působením na specifické receptory pro neurotransmitéry, membránové přenašeče pro monoaminové neuromediátory, molekuly efektorových systémů a systémů druhých a třetích poslů. Všechny psychoaktivní látky působí zvyšování výdeje DA v NAc, jejich mechanismus není však zcela totožný. Většina psychoaktivních látek je schopna ovlivňovat více mechanismů CNS, jejichž nadřazené regulační systémy bývají vzájemně propojeny. Alkohol zvyšuje uvolňování dopaminu v NAc tím, že potencuje GABAA receptory nebo inhibuje NMDA receptory. Při odnětí dochází k útlumu dopaminergní a serotoninergní aktivity, k útlumu inhibice GABAA receptorů, ke zvýšení aktivity NMDA receptorů. Dále dochází k nadměrné stimulaci cholinergního, noradrenergního a opioidového systému. Opioidy se váží na opioidní receptory (μ, κ, δ, σ). Vazba na μ receptory vyvolává respirační depresi, supraspinální analgézii, vede k euforii, je nejdůležitější pro vznik závislosti v následujícím kontextu: Opioidy snižují tonickou inhibici dopaminergních neuronů, stimulací opioidní μ receptorů způsobí supresi výdeje GABA z jejích interneuronů, a tudíž se zvýší aktivita DA ve VTA. Stimulace κ receptorů způsobuje spinální analgezii, miózu a snižuje produkci dopaminu v NAc, vede k sedaci a dysforii. Vazba na δ receptory vyvolává euforii, někdy ale i dysforii, spinální analgezii. A vazba na σ receptory se projevuje mydriázou, dysforií. Opioidy zvyšují také množství dopaminu, prostřednictvím GABAA inhibičních interneuronů ve VTA. Opiáty jsou agonisty přirozeným endogenním látkám – endorfinům, enkefalinům, dinorfinům. Vykazují ovšem delší a výraznější účinek. Opioidy, kromě již zmíněných centrálních účinků, mají i účinky periferní. Snižují motilitu střev, což vede k obstipaci, k hypotenzi a k retenci moče. Kanabinoidy se váží na kanabinoidní receptory CB1, CB2. Receptory CB1 se nacházejí v hippokampu, BG, kortexu cerebella, hypotalamu, v některých periferních orgánech. CB2 jsou přítomny v imunokompetentních buňkách, v řadě periferních orgánů i v mozku. Je také znám specifický endogenní ligand těchto receptorů, jenž se nazývá anandamid. Pravděpodobným mechanismem působení kanabioidů je aktivace CB1 receptorů ve VTA. Axony v oblasti NAc jsou navíc stimulovány presynaptickou inhibicí glutamátergních a GABAergních synapsí [6]. Sedativa a hypnotika potencují převážně GABAA receptory. Stimulancia působí jako přímá i nepřímá sympatomimetika. Zvyšují koncentraci DA ve striatu. Dále dochází ke snížení jejich zpětného vychytávání (reuptake) obsazením zpětné pumpy DAT a k blokaci jejich biotransformace (inhibice MAO). Výsledkem je hromadění DA v synaptické štěrbině. Účinek kokainu také zvyšuje synaptickou koncentraci serotoninu blokádou zpětného vstřebávání. Zvýšené množství serotoninu snižuje (místně) přísun GABA k dopaminergním buňkám ve VTA, dochází k jejich desinhibici. Dále dochází ke zvýšení extracelulárního glutamátu a následně k senzitizaci mezolimbického dopaminergního systému [12]. Amfetaminy působí přímo na dopaminové vezikuly v presynaptickém neuronu, čímž zvyšují výdej DA. MDMA stimuluje syntézu, inhibuje degradaci a snižuje reuptake serotoninu. Dále stimuluje produkci DA. Halucinogeny se biologicky chovají jako agonisté a antagonisté specifických serotoninergních receptorů a mají účinek i na katecholaminy. LSD působí jako agonista 5-HT2 receptorů, má afinitu k NA, DA, acetylcholinovým (ACH) i histaminovým receptorům. Nevytvářejí závislost. Nikotin aktivuje nikotinové ACH receptory. Zvyšuje vyplavování DA v nervových synapsích a snižuje hladinu monoaminooxidázy (MAO). Organická rozpouštědla ovlivňují excitační ionotropní glutamátové receptory nebo inhibiční GABAA receptory.
V přenosu signálu se uplatňuje řada stimulačních i inhibičních zpětnovazebných mechanismů, proto je obtížné nalézt k objektivním biochemickým změnám odpovídající změny chování a myšlení.
Změny na celulární úrovni vyvolané psychoaktivními látkami
- Velmi rychlé změny (milisekundy) – změna polarizace membrány je způsobena otevřením nebo uzavřením iontových kanálů v aktivovaných receptorech, nebo změnou intracelulární koncentrace vápenatých iontů. Uplatňují se především v rámci akutní intoxikace.
- Středně rychlá odezva (sekundy až minuty) – procesy aktivace druhých poslů a proteinkináz, některé psychoaktivní látky mění i hladiny druhých poslů v buňkách. Návykové látky mohou také měnit dynamické vlastnosti buněčné membrány, nebo působit přímo na neurotransmitérové membránové přenašeče.
- Pomalé procesy (hodiny, dny) – jejich rozvoj začíná v postfosforylačním období, jedná se o změnu exprese a aktivity řady transkripčních faktorů, čímž se zvýší genová exprese buněčných proteinů. Zprostředkují návyk na účinek psychoaktivní látky.
Druzí poslové
Některé geneticky orientované teorie považují za jednu z hlavních příčin vzniku závislosti adaptaci druhých poslů. Jako příklad uvádějí působení na noradrenergní jádro mozku, locus coeruleus. Některé psychoaktivní látky (opioidy) inhibují přenos vzruchů v locus coeruleus, ale jejich dlouhodobé podávání, vznik tolerance, vede k normální frekvenci přenosu. Při neužívání se frekvence impulzů mnohonásobně zvýší, což je označováno za počátek rozvoje abstinenčního syndromu, včetně cravingu. Uvažuje se o hypotéze, která spojuje aktivaci locus coeruleus s up-regulací cesty přenosu pomocí cAMP. Do up-regulace je zavzato zvýšení hladiny adenylátcykláz, proteinkinázy A, ke zvýšení glutamátergní transmise. Tato teorie počítá i s průběhem obdobných změn v NAc, založených na adaptaci systému odměn.
Patologické změny odměny
Ačkoliv je chemické složení psychoaktivních látek různorodé, stejně tak jako jejich účinky, jejich zásadní a společnou vlastností je zvýšený výdej DA z VTA do NAc.
Prožití příjemné zkušenosti můžeme rozdělit na dvě fáze. První je fáze očekávání příjemného podnětu, druhou je prožívání příjemného stimulu. Dopamin hraje důležitou roli především v první fázi. Dopamin se v NAc vyplavuje nejvíce v momentě očekávání příjemné zkušenosti. Během realizace příjemného prožitku je DA nálož největší na jejím začátku a postupně se snižuje. Neočekávaná odměna způsobí výraznou DA stimulaci, která ale vymizí během opakování (tolerance). Naopak nedostatek očekávané odměny snižuje DA signál. Látka už neposkytuje takové uspokojení jako dříve, slouží spíše k úlevě od abstinenčního syndromu.
Podněty přispívající ke zvýšení DA v této oblasti mohou tedy být považovány za odměnu. Patologické zdroje odměny se od těch fyziologických významně liší. Psychoaktivní látky dosahují odměny rychleji a jednodušeji. Dalším rozdílem je síla odměny, míra účinnosti dopaminergního přenosu. Užívání psychoaktivních látek znamená silnější dopaminergní stimulaci, což znamená vyšší míru účinku. Lidský organismus má fyziologické adaptační mechanismy pro fyziologické podněty. Opakovaný nadměrný podnět (nefyziologický zdroj odměny) vyvolává patologickou adaptaci – závislost.
K vytvoření závislosti je nutná opakovaná expozice patologickému zdroji odměny, tedy opakovaně zvýšený výdej DA v NAc. Série reakcí organismu, jejichž společným působením se mění vlastnosti i funkce systému odměny, předchází změnám v chování (závislost) [18]. Na mozkovém procesu vzniku závislosti se podílejí další (nejen neuromediátorové) systémy, které dopaminergní cestu ovlivňují. Jedná se zejména o systémy glutamátergní, serotoninergní, neuropeptidové (substance P, enkefaliny, dynorfiny, neurotenzin), stresové a nejspíše i endokanabinoidní [13].
Glutamátergní systém se významně podílí na pokračujícím užívání a na udržení závislého chování (zvýšená projekce z prefrontálního kortexu do NAc). Této fáze se již dopaminový systém neúčastní nebo účastní ve zcela minimální míře. Během rozvoje závislostního chování lze detekovat více neurochemických změn, na jejichž základě lze závislost hierarchicky rozdělit do několika stupňů [9] (akutní intoxikace, přechod z abúzu do závislosti, závislost).
Akutní intoxikace
Základním mechanismem této fáze je zvýšený výdej dopaminu do NAc1, dále se na něm podílejí i systémy opioidních neuropeptidů, GABA a endokanabinoidů [12, 16].
Přesný způsob nadměrného výdeje DA a jeho následná modulace není prozatím známa. Zvýšený výdej DA v NAc je spouštěčem zisku odměny, libého pocitu. Výdej dopaminu není ovlivněn, pokud dochází k opakované stimulaci stejným podnětem, v totožné situaci za stejných podmínek. Dochází k asociaci podnětu s reakcí. Ke změně aktivity DA dojde ve chvíli, kdy jsou typ, intenzita a další faktory prožitku odlišné od původního očekávání nebo zkušenosti. Ke změně dopaminové aktivity dochází pouze v situaci, kdy se aktuální situace/prožitek liší od apriorní predikce. Tento mechanismus se uplatňuje v procesu učení, jehož výsledkem je zpřesnění původního předpokladu a následné zacílení behaviorální odpovědi [7].
Přechod abúzu v závislost
Výsledkem procesu je neuroadaptivní změna v systému odměn, přizpůsobení se na opakovanou expozici psychoaktivním látkám [12]. K této změně dochází na různých úrovních mozkových funkcí (úroveň změny exprese určitých genů, komplexnější intracelulární změny transdukčních cest, změny receptorové a synaptické, přeměna neuronových sítí) v systému odměny a v dalších pomocných neuromediátorových systémech. Funkční adaptace mozku na účinky psychoaktivních látek vedou ke změnám v hlavní transdukční cestě2, kde dochází k up-event. nebo down regulaci. Biologické podklady chování souvisejí se specifickými proteiny. Mechanismus, který vyvolává změny hladin specifických proteinů ve VTA a NAc a následně tak vytváří odpovídající změny v chování, není zcela přesně znám. Nejvíce pravděpodobná cesta vzniku je ovlivnění genové exprese [2]. Dlouhodobé užívání psychoaktivních látek vede k indukci a akumulaci transkripčních faktorů fos-related antigenů (FRA). Ke zvýšení množství FRA dochází pouze při nefyziologickém zisku odměny. Díky těmto faktorům dochází ke změně transkripce dalších genů, k produkci odlišných proteinů a ke změně funkce neuronální sítě systému odměn. Přechodné změny v chování jsou důsledkem adaptace průběhu neurochemických procesů, na rozdíl od trvalých přechodů. Ty jsou totiž pravděpodobně způsobeny strukturálními změnami v synaptických spojích [4].
Závislost
Syndrom závislosti je soubor behaviorálních, kognitivních a fyziologických fenoménů, které se postupně vyvinou opakovaným užíváním psychoaktivní látky [17]. Závislost reprezentuje jednotu fyzického prožitku vlastního těla a jednání člověka ústící do změn v chování. Závislost jako behaviorální změna se vyznačuje vysokou touhou užít psychoaktivní látku (craving), sníženou kontrolou nad cravingem a nad samotným užíváním (jak v množství užité látky, tak v opakování intoxikace), snížením hodnoty přirozených odměn v porovnání s patologickými zdroji. Podstatou rozvoje závislostního chování jsou pravděpodobně změny glutamátergních projekcí z prefrontálního kortexu3 do NAc4 na buněčné úrovni. Prefrontální kortex koriguje průběh a sílu odpovědi. Tyto změny jsou v přímé souvislosti s kompulzivním charakterem abúzu a se snížením hodnoty přirozené odměny. Ke zvýšené aktivitě prefrontálního kortexu dochází u pacientů s obsedantně-kompulzivní poruchou [9]. Podstata závislosti je dána nerovnováhou v regulaci systému odměny, který je popsán koncepcí alostázy [12]. Alostáza je definována jako proces udržování stability libostních funkcí změnami v mozkovém systému odměny [11]. Nejdůležitější neuromediátorové systémy (v systému odměn) jsou dopaminové a opioidní neuropeptidové systémy, které ale mají jen omezenou regulační kapacitu pro udržení homeostázy (fyziologického rozmezí). V počátku užívání psychoaktivních látek se kapacita regulačních funkcí zvyšuje, ale postupně dochází k rozvoji antagonisticky působících adaptačních mechanismů, jako je aktivace stresového systému s CRF a NA [12]. Závislost představuje patologické využití psychických procesů, kterými jsou učení, paměť, pozornost a emoce, které za běžných podmínek spojují biologicky nezbytné podněty s odměnou a napomáhají k jejich predikci [7]. Při závislosti je měněn systém odměn (zejména v mezolimbické oblasti).
Jedinci predisponovaní k závislosti mají již zřejmě vrozeně nižší reaktivitu dopaminergního systému, vlivem intoxikace psychoaktivními látkami dochází k nefyziologickému posílení dopaminergního přenosu (tvorba dopaminu, snížení aktivity dopaminového přenašeče i senzitizace D2/D3 postsynaptických receptorů atd). Při rozvinuté závislosti dochází ke kompenzatorním změnám. Ty jsou opačné než při intoxikaci. Situace se tedy dále prohlubuje. Tyto struktury se rozhodujícím způsobem podílejí i na dysforii a dalších poruchách nálady, které také souvisejí se schopností vnímat radost.
Systém odměn a klinické stavy
Po užití psychoaktivní látky dochází k perzistujícím změnám ve výše zmíněných systémech v důsledku vleklé preference jednoduché a efektivní strategie k dosažení libosti nebo zamezení nelibosti. Přirozené zdroje odměny (jídlo, sex, sportovní aktivity) jsou pro komplikovanost strategií vedoucích k jejímu zisku znevýhodněny a časem postupně opouštěny a nahrazeny těmi jednoduššími. V průběhu závislosti se uživatel dostane do situace, kdy již nevyhledává psychoaktivní látku pro její přímý odměňující efekt, ale kdy se snaží potlačit nelibý abstinenční syndrom. Toto negativní posilování se významně podílí na udržování užívání psychoaktivních látek. Obecně se soudí, že odvykací stav je projevem snížené činnosti dopaminergního systému v důsledku „chronické“ adaptace systému odměny na jednoduché reakční cesty (užívání psychoaktivních látek). To by bylo ovšem příliš zjednodušené. Různé skupiny psychoaktivních látek jsou manifestovány odlišným průběhem abstinenčního stavu. Nejvýraznější projevy odvykacího stavu se dostavují u uživatelů tlumivě působících psychoaktivních látek (alkohol, opioidy, BZP, barbituráty). Odvykací stav má dvě složky - psychickou a fyzickou. Fyzické příznaky souvisejí více s oblastmi mozku, které realizují tlumivý efekt psychoaktivních látek, než se změnami systému odměn [14]. K závislosti není tedy potřeba přítomnost fyzických příznaků odvykacího stavu, a tudíž tělesné závislosti a naopak, některé látky, které nezpůsobují odměňující efekt, mohou vyvolávat odvykací stav. Z toho vyplývá, že „síla“ psychoaktivní látky nemusí korespondovat se sílou tělesného odvykacího stavu.
V textu byla podrobněji popsána závislost z pohledu systému odměn. Z multifaktoriální etiologie je zřejmé, že se na výsledném stavu podílí ještě řada dalších faktorů (sociálních, vztahových…), jejichž popis přesahuje obsah tohoto článku. Zabývali jsme se spíše konečnými projevy těchto vlivů na biologické úrovni.
SHRNUTÍ TEORIE SYSTÉMU ODMĚN
Systém odměn je definován jako spojení VTA s NAc a s prefrontálním kortexem. Se systémem odměn je v součinnosti paměť a stresové systémy. Fyziologické i patologické odměny způsobují zvýšený výdej DA z VTA do NAc. Klinickým důsledkem výše popsaných změn jsou projevy člověka v jednotlivých fázích kontaktu s psychoaktivní látkou. Při prvních intoxikacích látka umožňuje vnímat libé pocity, které by tento člověk v identické době, prostředí, frekvenci a intenzitě jiných podnětů nemohl získat. Během rozvoje závislosti se vyvíjejí nové kompenzační mechanismy, aplikace se stává rutinou. Schází tedy jak dopaminergně podmíněný faktor neočekávané stimulace (predispozice k novelty seeking), tak i opioidně zprostředkovaný libý pocit uspokojení.
Při léčbě závislosti je třeba brát v úvahu craving (uvědomovaný nebo ne) a závislostní chování. Adaptace systému se kompenzuje jen pomalu díky dlouhodobé abstinenci, což není příjemné. Libé pocity bychom měli pacientům pomoci nahradit, jinak se člověk logicky vrací k dosud nejvýhodnější strategii chování, kterou je aplikace psychoaktivní látky. U závislých pacientů je tato činnost ještě těžší než u běžné populace.
1s intracellulární kaskádou receptor D1 G protein cAMP – CREB cesta (cAMP - responsive element binding protein) IEG (immediate early genes).
2Výdej dopaminu z VTA do NAc s intracellulární kaskádou receptor D1 G protein cAMP – CREB cesta IEG.
3 hl. přední cingulum, orbitofrontální kortex
4 hl. core area
Podpořeno projektem IGAMZ ČR NS 10253-3.
Petra Elizabeth Váchová
Psychiatrická klinika LF UK a FN
Husova 3
306 05 Plzeň
e-mail: petra.vachova@seznam.cz
Sources
1. Bečková, I., Višňovský, P.: Farmakologie drogových závislostí. Praha, Karolinum, 1999.
2. Berke, J. D., Hyman, S. E.: Adidction, dopamine, and the molecular mechanism of memory. Neuron, 25, 2000, pp. 515-532.
3. Bowirrat, A., Berman, M. O.: Relationship between dopaminergic neurotransmission, alcoholism, and reward deficiency syndrome. Americal Journal of Medical Genetics, 132B, 2005, pp. 29-37.
4. Charney, D. S., Nestler, E. J., Bunney, B. S.: Neurobiology of mental illness. New York, Oxford, Oxford University Press, 1999.
5. Fišar, Z.: Psychiatrie. Praha, Galén, Karolinum, 2001.
6. Hoffman, A. F., Oz, M., Caulder, T., Lupica, C. R.: Functional tolerance and blockade of long-term depression at synapse in the nucleus accumbens after chronic cannabinoid exposure. Journal of Neuroscience, 23, 2003, 12, pp. 4815-4820.
7. Hyman , S. E.: Addiction: a disease of learning and memory. American Journal of Psychiatry, 162, 2006, pp. 1414-1422.
8. Kalina, K. a kol.: Základy klinické adiktologie. Havlíčkův Brod, Grada, 2008.
9. Kalivas, P. W., Volkow, N. D.: The neural basis of addiction: a pathology of motivation and choice. American Journal of Psychiatry, 162, 2005, pp. 1403-1413.
10. Kelley, A. E., Berridge, K. C.: The neuroscience of natural rewards: Revalence to addictive drugs. The Journal of Neuroscience, 22, 2002, pp. 3306-3311.
11. Klennerová, V.: Strukturálně funkční změny u stresu a poruch chování. Psychiatrie, 10, Suppl. 2, 2006, pp. 17-22.
12. Koob, G. F., Le Moal, M.: Drug addiction, dysregulation of reward, and allostasis. Neuropsychopharmacology, 24, 2001, 2, pp. 97-129.
13. Koob, G. F.: The neurobiology of addiction: a neuroadaptational view relevant for diagnosis. Addiction, 101, 2006, Suppl. 1, pp. 23-30.
14. Nestler, E. J.: Total recall – the memory of addiction. Science, 292, 2001, (5525), pp. 2266-2267.
15. Nešpor, K.: Návykové chování a závislost. Praha, Portál, 2000.
16. Nicola, S. M., Surmier, D. J., Malenka, R. C.: Dopaminergic modulation of neuronal excitability in the striatum and nucleus accumbens. Annual Review of Neuroscience, 23, 2000, pp. 185-215.
17. Smolík, P.: Duševní a behaviorální poruchy. Praha, Maxdorf, 2002.
18. Weiss, F., Porrino, L. J.: Behavioral neurobiology of alcohol addiction: recent advances and challenges. Journal of Neuroscience, 22, 2002, 9, pp. 3332-3337.
Labels
Addictology Paediatric psychiatry PsychiatryArticle was published in
Czech and Slovak Psychiatry

2009 Issue 6-8
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Memantine Eases Daily Life for Patients and Caregivers
- Hope Awakens with Early Diagnosis of Parkinson's Disease Based on Skin Odor
- Deep stimulation of the globus pallidus improved clinical symptoms in a patient with refractory parkinsonism and genetic mutation
-
All articles in this issue
- HoNOS (Hodnocení zdravotního stavu) – adaptace nástroje na hodnocení symptomů a sociálních funkcí u závažně duševně nemocných v českých podmínkách a jeho použití
- Psychosomatická transformace periferní somatické poruchy
- Disociální porucha osobnosti v podmínkách výkonu trestu Analýza účinnosti prostředků korekce antisociálních forem chování v peninteciární praxi
- Neuromechanismy účinku návykových látek, systém odměn
- Gama oscilace elektroencefalogramu u schizofrenie
- Membrány V - závěr cyklu
- Závislostní chování na internetu a jeho léčba
- Schizofrenie u mentálně retardovaných pacientů, diagnostické rozvahy a praktické zkušenosti
- Czech and Slovak Psychiatry
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Neuromechanismy účinku návykových látek, systém odměn
- Schizofrenie u mentálně retardovaných pacientů, diagnostické rozvahy a praktické zkušenosti
- Psychosomatická transformace periferní somatické poruchy
- Závislostní chování na internetu a jeho léčba
