Léčba recidivujícího ovariálního karcinomu
Treatment of recurrent ovarian cancer
Objective:
The description of current treatment possibilities in recurrent ovarian cancer.
Design:
Review article.
Setting:
Obstetrics and Gynecology Department, Charles University 2nd Medical Faculty and University Hospital Motol, Prague.
Methods:
The review of literature on treatment of recurrent ovarian cancer. Current data on chemotherapy, surgery and targeted biological therapy in recurrent ovarian cancer.
Conclusions:
Chemotherapy is indicated in most cases of recurrent ovarian cancer, surgery does not play an important role. Standard treatment of platinum-sensitive recurrent ovarian cancer is based on platinum combination chemotherapy. Standard treatment of platinum-refractory ovarian cancer represents non-platinum monotherapy. Targeted biological therapy should be still used only in the studies.
Key words:
recurrent ovarian cancer, platinum refractory ovarian cancer, platinum sensitive ovarian cancer.
Authors:
Helena Robová
; Lukáš Rob
; M. Pluta; M. Halaška jr.; Roman Chmel
Authors‘ workplace:
Praha, přednosta prof. MUDr. L. Rob, CSc.
; Gynekologicko porodnická klinika 2. LF UK a FN Motol
Published in:
Ceska Gynekol 2009; 74(6): 464-468
Overview
Cíl studie:
Popis současných možností léčby recidivujícího karcinomu ovaria.
Typ studie:
Přehledový článek.
Název a sídlo pracoviště:
Gynekologicko-porodnická klinika 2. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Motol, Praha.
Metodika:
Shrnutí literárních údajů o léčbě recidiv karcinomu ovaria. Současné poznatky o cytostatické léčbě, chirurgické léčbě a cílené biologické léčbě.
Závěr:
U recidivujícího karcinomu ovaria je ve většině případů indikována cytostatická léčba, chirurgická terapie má jen okrajový význam. Standardní léčbou platina senzitivních karcinomů ovaria je kombinovaná léčba s platinovým derivátem. Monoterapie neplatinovým derivátem je indikována u platina rezistentních karcinomů. Cílená biologická léčba je stále používána ve studiích.
Klíčová slova:
recidivující karcinom ovaria, platina rezistentní karcinom ovaria, platina senzitivní karcinom ovaria.
ÚVOD
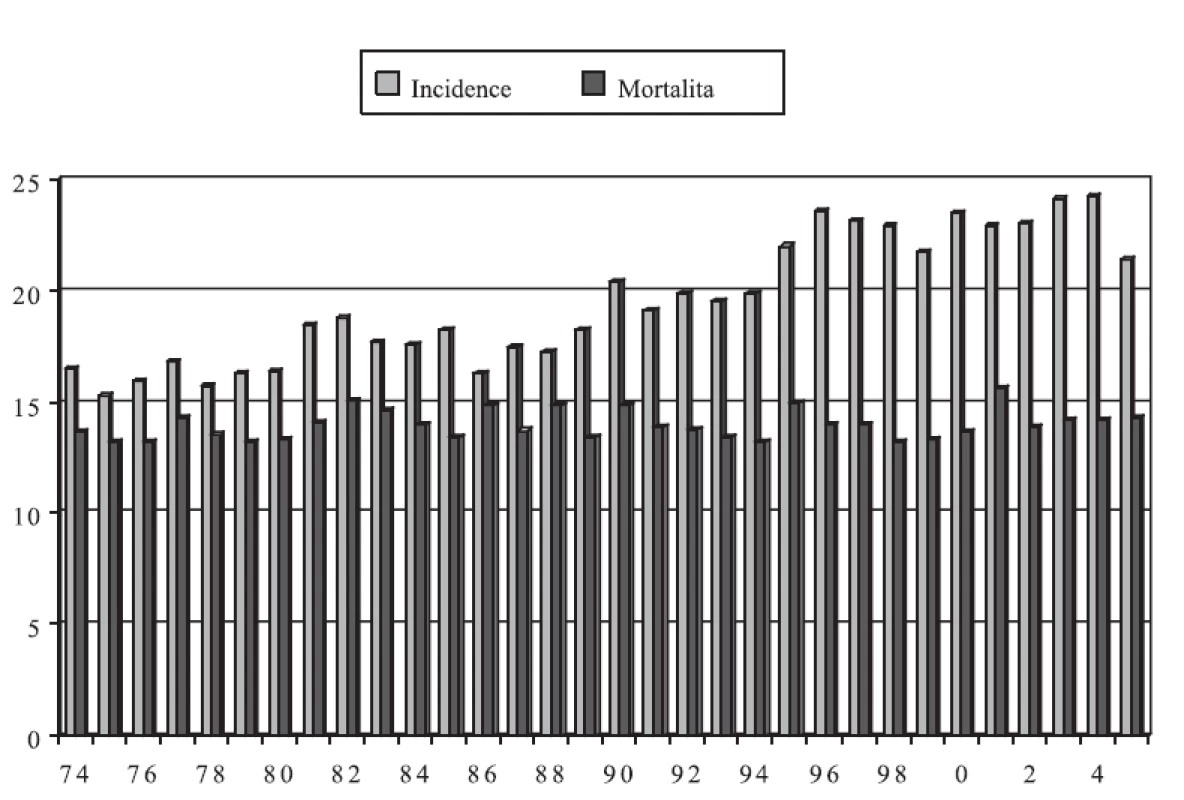
Incidence zhoubných nádorů vaječníků v České republice byla v roce 2005 celkem 21,4 na 100 000 žen a mortalita dosahovala 14,3 (graf 1). To znamená, že dvě třetiny žen, které tímto nádorem onemocní, bohužel zemře. Ovariální karcinomy - epiteliální zhoubné nádory - tvoří nejvýznamnější skupinu (85-90 %). Epiteliální zhoubné nádory se liší od neepiteliálních věkovým rozložením, biologickým chováním i strategií léčby, včetně chemoterapie.
V České republice je z ovariálních zhoubných nádorů 10-15 % neepiteliálních a 85-90 % epiteliálních nádorů, tedy ovariálních karcinomů (OC). Až 75-80 % ovariálních zhoubných nádorů je diagnostikováno v pozdních stadiích. Efektivní screening ovariálního karcinomu neexistuje a v nejbližší době existovat nebude. Je to podmíněno biologickým chováním těchto nádorů. Většina nádorů, které jsou zachyceny v časných stadiích, má odlišné biologické chování od těch, které jsou diagnostikovány ve stadiích pozdních. V časných stadiích se odhalí většinou pouze tzv. nádory s nízkým maligním potenciálem, které velmi pomalu rostou - pravděpodobně několik měsíců až let. Detekují se zpravidla při pravidelném gynekologickém vyšetření. Vzhledem k nízké růstové frakci jsou chemo i radiorezistentní a jsou prakticky léčitelné pouze chirurgicky, přičemž ženy s pokročilým nálezem obvykle přežívají mnoho let (často více než deset). Do této skupiny patří například serózní mikropapilární, mucinózní, endometroidní a clear cell karcinomy.
Většina nádorů diagnostikovaných v pozdních stadiích naproti tomu roste velmi rychle, metastazovat mohou i nádory velmi malé (10 mm a méně). Velké procento jich vzniká primárně na peritoneu, jsou obvykle chemosenzitivní, ale většina jich recidivuje. Přežití je závislé na stadiu onemocnění, kvalitě chirurgické léčby a věku ženy. Tuto skupinu nádorů je prakticky nemožné odhalit v časných stadiích. I proteomický screening, do kterého se vkládaly velké naděje, prozatím selhává. Do této skupiny patří především serózní papilární karcinom.
Pětileté přežití u časných stadií (I. a II.) se posune při dobré chirurgické léčbě a správně indikované adjuvantní chemoterapii nad 90 %. Časné recidivy (do 6 měsíců po skončení léčby) jsou vzácné, pozdní recidivy se vyskytují asi v 15 %. U pozdních stadií (III. a IV.) dosahuje pětileté přežití pouze 25-30 % (1). Význam primární cytoreduktivní chirurgie je u této skupiny žen zřejmý. Za optimální výsledek chirurgické léčby se dnes považuje nález bez makroskopického pooperačního rezidua. Standardní léčbou první linie u pozdních stadií po cytoreduktivní chirurgii je chemoterapie s platinovým derivátem a paclitaxelem. Tento „standardní režim“ platí již 15 let a stále čekáme na nový režim nebo modifikaci stávajícího, který by jej dokázal překonat. Primární léčba je úspěšná ve většině případů, ale u velké části pacientek nastává v různých intervalech relaps onemocnění. V praxi to znamená, že u více než 60 % žen s diagnózou ovariálního karcinomu je třeba zahájit léčbu druhou linií chemoterapie.
S výjimkou velmi malého množství žen, u nichž je možné provést kompletní cytoreduktivní druhou operaci, je chemoterapie druhé linie většinou léčbou paliativní. Význam chemoterapie druhé linie v odstranění aktuálních symptomů, zvýšení kvality života, prodloužení období bez symptomů, oddálení progrese onemocnění a prodloužení celkového přežití. Léčbu recidivujícího karcinomu ovaria ovlivňuje interval od ukončení primární léčby, toxicita předchozí chemoterapie (neurotoxocita, hematotoxicita), symptomy (ascites) a performance status.
V praxi se nejčastěji dělí recidivující karcinomy na „platina rezistentní“ (interval kratší než 6 měsíců) a „platina senzitivní“ onemocnění (interval delší než 6 měsíců). Někteří autoři stále používají tři kategorie recidivujících karcinomů: 1. „platina rezistentní“ (interval kratší než 6 měsíců), 2. „platina potencionálně senzitivní“ (interval 6 až 12 měsíců) a 3. „platina senzitivní“ (interval nad 12 měsíců). Nádory recidivující po 12 měsících od ukončení primární léčby mají mnohem vyšší šanci na léčebnou odpověď než nádory recidivující mezi 6-12 měsíci. Práce z posledních let prokázaly, že ve skupině žen s intervalem 6 až 12 měsíců jsou efektivnější kombinované chemoterapeutické režimy než prostá monoterapie, což svědčí pro logické dělení recidivujících karcinomů jen na dvě skupiny.
LÉČBA PLATINA REZISTENTNÍCH RECIDIV KARCINOMU OVARIA
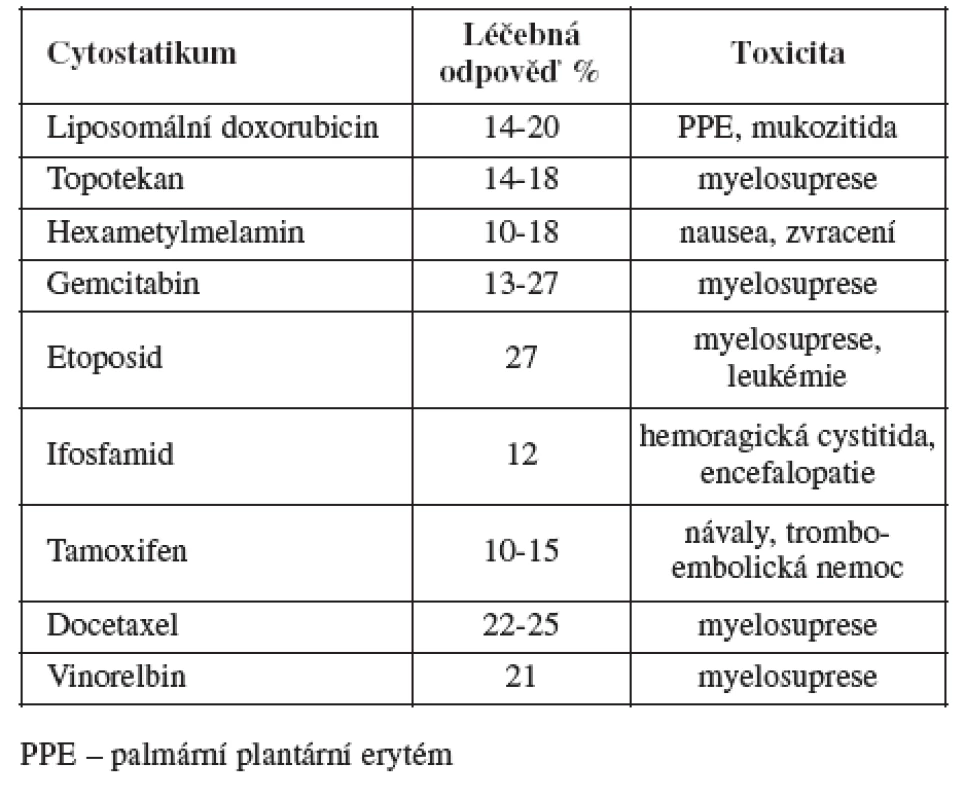
Do této skupiny patří ženy, u kterých je objektivně diagnostikována recidiva (ne pouze elevace CA 125) do šesti měsíců od ukončení primární léčby. Prognóza těchto žen je velmi nepříznivá. Celkové přežití se počítá jen na měsíce. Terapie se v této skupině snaží ovlivnit hlavně symptomy v zájmu zlepšení kvality života e existuje jen malá šance na významnější prodloužení celkového přežití. Chirurgická léčba hraje v této skupině pouze nevýznamnou roli, většinou se jedná jen o paliativní výkony (resekce střeva, stomie ap.). Pokud se podaří stabilizovat onemocnění a zmírnit symptomy, považujeme léčbu za úspěšnou. Kombinovaná chemoterapie obvykle jen zvyšuje toxicitu a snižuje kvalitu života, aniž by zvyšovala objektivní léčebnou odpověď. Existuje řada cytostatik, která lze v léčbě použít (viz tabulka). Tyto léky mají podobnou léčebnou odpověď, ale rozdílný profil toxicity.
Liposomální doxorubicin je pegylovaný liposomovaný doxorubicin. Jedná se o doxorubicin, který je opouzdřen v liposomech a poté pegylován (pokryt) polyetylenglykolem. Tyto dva procesy snižují jeho kardiotoxicitu a prodlužují jeho vylučování, což znamená, že je možné prodloužit interval mezi aplikacemi. Podáme-li liposomální doxorubicin v monoterapii u platina rezistentní recidivy, léčebná odpověď se pohybuje mezi 14-20 % [1, 2, 3]. Procento léčebné odpovědi je v průměru téměř stejné jako u topotekanu, ale spektrum toxicity je odlišné. Myelotoxicita je ve srovnání s topotekanem minimální. Nejzávažnější toxicitou, pro kterou je nutno snižovat dávky, prodlužovat interval chemoterapie či chemoterapii zcela ukončit, je zejména palmární-plantární erytém, méně často mukozitida. Liposomální doxorubicin se podává v dávce 50 mg/m2 každých 28 dnů. Vyskytne-li se těžší forma palmárního-plantárního erytému, je možné dávku zredukovat o 10 mg/m2.
Topotekan je inhibitorem topoizomerázy I. Topoizomeráza je enzym, který je důležitý pro reduplikaci DNA. Inhibicí topoizomerázy I dochází k přerušení řetězce DNA, a tím k apoptóze buněk. Léčebná odpověď je u platina rezistentních recidiv ovariálního karcinomu mezi 14-18 %, a navíc u 18-48 % žen lze pozorovat stabilní onemocnění [4, 5]. Myelosuprese, zejména neutropenie, je nejčastějším druhem toxicity, kvůli kterému je nutné prodloužit interval a redukovat dávku. Standardně se podává 1.-5. den 1,5 mg/m2 ve třicetiminutové infuzi v intervalu 21 dnů. Dávku je možné snížit na 1,25-1,0 mg/m2. Alternativou může být týdenní podání topotekanu, které má podobnou léčebnou odpověď a je lépe pacienty tolerováno [6].
Etoposid je inhibitorem topoizomerázy II. Topoizomeráza II se rovněž účastní reduplikace DNA. Potencuje účinek cisplatiny a zřejmě dokáže blokovat vznik rezistence na cisplatinu. Nemá zkříženou rezistenci s cisplatinou a alkylačními látkami. Je prokázáno, že účinnější je prolongované podávání malých dávek, než aplikace velkých dávek v několika málo dnech. Léčebná odpověď se pohybuje až kolem 27 % [7, 8, 9, 10, 11]. Limitující toxicitou je myelosuprese. Existuje zde riziko vzniku sekundárních malignit, zejména akutní myeloidní leukémie, což ovšem u časných recidiv ovariálního karcinomu nehraje velkou roli. Podává se perorálně v dávce 50mg/m2 denně, a to v různých schématech(10 dnů podávání a 14 dnů pauza, 14 dnů podávání a14 dnů pauza). Jeho největší výhodou perorální podávání.
Gemcitabin je nukleotidový antimetabolit, který se dokáže inkorporovat do DNA. Je relativně málo toxický. Limitující toxicitu představuje myelosuprese. Mohou se vyskytovat příznaky podobné chřipce a bylo pozorováno přechodné zvýšení jaterních enzymů. Léčebná odpověď se pohybuje okolo 16 % [12, 13, 14, 15, 16]. Podává se v týdenním režimu v dávce 800 mg/m2.
LÉČBA PLATINA SENZITIVNÍCH RECIDIV KARCINOMU OVARIA
Ženy, u nichž se objeví recidiva za více než 6 měsíců od ukončení léčby profitují z kombinované chemoterapie s platinovým derivátem. Randomizovaná studie ICON 4/AGO OVAR 2.2 srovnávala monoterapii platinovým derivátem (cisplatina nejméně 70mg/m2 nebo karboplatina nejméně 5 AUC) s kombinací platinový derivát (cisplatina nejméně 50 mg/m2 nebo karboplatina nejméně 5 AUC) a paklitaxel 175 mg/m2 v tříhodinové infuzi [17]. Všechny ženy měly v první linii chemoterapii s platinovým derivátem. Statisticky významně lepší výsledky byly v rameni kombinované chemoterapie ve všech parametrech: léčebná odpověď 54 % versus 66 %, interval do progrese onemocnění 10 versus 13 měsíců a celkové přežití 24 versus 29 měsíců.
Řada žen má po první linii chemoterapie výraznou neuropatii, a proto je třeba hledat do kombinace jiný lék než paklitaxel. Studie AGO-OVAR 2.5 srovnávala karboplatinu v monoterapii (5AUC) 1. den s karboplatinou (5 AUC) 1. den plus gemcitabin 1000 mg/m2 1. a 8. den [18]. V této studii také byly statisticky významně lepší výsledky u kombinace: léčebná odpověď 30,9 % versus 47,2 %, interval do progrese 5,8 versus 8,6 měsíců a celkové přežití 17,3 versus 18 měsíců. Výsledky byly výrazně lepší u pacientek, které měly od primární léčby interval delší než 12 měsíců oproti ženám s intervalem 6-12 měsíců.
Dalším vhodným lékem do kombinace je liposomální doxorubicin. Studie SWOG srovnávala karboplatinu v monoterapii s karboplatinou a liposomálním doxorubicinem [19]. Léčebná odpověď byla 32 versus 67 %, interval do progrese 8 versus 12 měsíců a celkové přežití 18 versus 26 měsíců ve prospěch kombinace. V současné době byly zveřejněny výsledky studie CALYPSO, která srovnávala u platina senzitivních recidiv ovariálního karcinomu karboplatinu 5 AUC plus liposomální doxorubicin 30 mg/m2 každé 4 týdny a karboplatinu 5 AUC s paklitaxelem 175 mg/m2 každé 4 týdny [20]. Interval do progrese byl v této studii 11.3 versus 9.4 měsíců ve prospěch karboplatiny s liposomálním doxorubicinem, celkové přežití zatím nebylo vyhodnoceno. Režimy mají rozdílný profil toxicity, zejména non-hematologické.
Kombinovaná chemoterapie je podle výsledků všech studií u platina senzitivních recidiv ovariálního karcinomu jednoznačně lepší a v současnosti je standardem léčby. Alternativou paklitaxelu do kombinace s karboplatinou může být liposomální doxorubicin nebo gemcitabin. Všechny tyto režimy mají srovnatelné účinky, ale odlišnou toxicitu. Vzhledem k tomu, že se u sekundární léčby téměř vždy jedná o léčbu paliativní, je jednou z jejích priorit kvalita života, přičemž nežádoucí účinky chemoterapie ji velmi negativně ovlivňují. Monoterapie platinovým derivátem je indikována u žen s platina senzitivními recidivami pouze v případě, že zdravotní stav pacientky neumožní léčit kombinovanou chemoterapií.
CÍLENÁ BIOLOGICKÁ LÉČBA
Buňky ovariálního karcinomu, stejně jako buňky jiných nádorů, mají „výhodu růstu“ v tom, že je porušena regulace růstu buněk díky řadě mutací. Cílená biologická léčba by měla blokovat tyto „výhody“, a tím za minimální toxicity pro ostatní buňky těla ovlivnit růst nádoru. Existuje celá řada léků, ale v léčbě ovariálního karcinomu má alespoň nějakou účinnost jen bevacizumab. Bevacizumab je monoklonální protilátka, která se váže na vaskulární ednoteliální faktor – A (VEGF-A), a tím zasahuje do angiogeneze. Léčebná odpověď se u recidiv karcinomu ovaria pohybuje mezi 16-21 % u platina rezistentních i senzitivních karcinomů [21, 22]. Vysoké hladiny VEGF byly nalezeny v ascitu, a proto má bevacizumab dobré výsledky u pacientek s ascitem. Nejproblematičtějším nežádoucím účinkem bavacizumabu je spontánní perforace střev, která se vyskytuje až v 11 %, a to zejména u těžce předléčených pacientek.
CHIRURGICKÁ LÉčBA U RECIDIV KARCINOMU OVARIA
Chirurgická léčba je u recidiv ovariálních karcinomů kontroverzní. Prospěch mají ze sekundární chirurgické léčby obvykle jen ženy, u kterých vznikne recidiva po více než 18 měsících od ukončení léčby, není přítomný ascites, nádor je lokalizovaný a existuje předpoklad nulového pooperačního nádorového rezidua. Do chirurgické léčby recidiv samozřejmě patří také paliativní výkony, jako stomie a další.
ZÁVĚR
U recidiv karcinomu ovaria je ve většině případů indikována cytostatická léčba, chirurgická terapie je spíše výjimečná. Standardní léčbou platina senzitivních karcinomů ovaria je kombinovaná terapie s platinovým derivátem. Monoterapie neplatinovým derivátem je indikována u platina rezistentních karcinomů. Přestože existuje mnoho nových cytostatik a léků pro cílenou biologickou léčbu jiných zhoubných nádorů, počet vyléčených a ani doba přežití se u ovariálního karcinomu za posledních 15 let nezměnily. Tento nepříliš optimistický stav by v budoucnu mohla změnit nová cílená biologická léčba nebo biomarkery, které umožní lépe selektovat pacienty pro vhodnou léčbu.
Doc. MUDr. Helena Robová, Ph.D.
Gynekologicko-porodnická klinika
Fakultní nemocnice Motol
V Úvalu 84
150 06 Praha 5
Sources
1. Gordon, AN., Granai, CO., Rose, PO., et al. Phase II study of liposomal doxorubicin in platinum and paclitaxel refractory epithelial ovarian cancer. J Clin Oncol 2000,18, p. 3093-3100.
2. Markman, M., Kennedy, A., Webster, K., et al. Phase 2 trial of liposomal doxorubicin (40 mg/m 2 ) in platinum/paclitaxel-refractory ovarian and fallopian tube cancers and primary carcinoma of the peritoneum. Gynecol Oncol 2000, 78, p. 369-372.
3. Muggia, FM., Hainsworth, JD., Jeffers, S., et al. Phase II study of liposomal doxorubicinin refractory ovarian cancer: antitumor activity and toxicity modification by liposomal encapsulation. J Clin Oncol, 1997, 15, p. 987-993.
4. Hoskins, P., Eisenhauer, E., Beare, S., et al. Randomized phase II study of two schedules of topotecan in previously treated patients with ovarian cancer: a National Cancer Institute of Canada Clinical Trials Group study. J Clin Oncol 1998, 16, p. 2233-2237.
5. ten Bokkel Huining, W., Gore, M., Carmichael, J., et al. Topotecan versus paclitaxel for the treatment of recurrent epithelial ovarian cancer. J Clin Oncol, 1997, 15, p. 2183-2193.
6. Whitney, AS., Leath, CA., Warner KH., et al. A phase II trial of weekly topotecan for patients with secondary platinum-resistant recurrent epithelial ovarian carcinoma following the failure of second-line therapy. Gynecol Oncol, 2007, 104, p. 591-595.
7. Eckhardt, S., Hernádi, Z., Thurzó, L., et al. Phase II clinical evaluation of etoposide (VP-16-213, Vepesid) as a second-line treatment in ovarian cancer. Results of the South-East European Oncology Group (SEEOG) study. Oncology, 1990, 47, p. 289-295.
8. Alici, S., Saip, P., Eralp, Y., et al. Oral etoposide (VP16) in platinum-resistant epithelial ovarian cancer (EOC). Am J Clin Oncol, 2003, 26, p. 358-362.
9. de Wit, R., van der Burg, M., Gaast, A., et al. Phase II study of prolonged oral etoposide in patients with ovarian cancer refractory to or relapsing within 12 months after platinum-containing chemotherapy. Ann Oncol 1994, 5, p. 656-657.
10. Hoskins, PJ., Swenerton, KD. Oral etoposide in active against platinum-resistant epithelial ovarian cancer . J Clin Oncol, 1994, 12, p. 60-63.
11. Markman, M., Hakes, T., Reichman, B., et al. Phase 2 trial of chronic low-dose oral etoposide as salvage therapy of platinum-refractory ovarian cancer. J Cancer Res Clin Oncol 1992, 119, p. 55-57.
12. Ferrandina, G., Ludovisi, M., Lorusso, D., et al. Phase III trial of gemcitabine compared with pegylated liposomal doxorubicin in progressive or recurrent ovarian cancer. J Clin Oncol 2008, 26, p. 890-896.
13. D’Agostino, G., Amant, F., Berteloot, P., et al. Phase II study of gemcitabine in recurrent platinum-and paclitaxel-resistant ovarian cancer. Gynecol Oncol 2003, 88, p. 266-269.
14. Mutch, DG., Orlando, M., Goss, T., et al. Randomized phase III trial of gemcitabine compared with pegylated liposomal doxorubicin in patients with platinum-resistant ovarian cancer. J Clin Oncol 2007, 25, p. 2811-2818.
15. Bilgin, TOS., Yalcin, OT., Zorlu G., et al. Efficacy of gemcitabine in heavily pretreated advanced ovarian cancer patients. Eur J Gynecol Oncol 2003, 24, p. 169-170.
16. Friedlander, M., Milward, MJ., Bell, D., et al. A phase II study of gemcitabine in platinum pre-treated patients with advanced epithelial ovarian cancer. Ann Oncol 1998, 9, p. 1343-1345.
17. Parmar, MK., Colombo, N., du Bois, A., et al. Paclitaxel plus platinum-based chemotherapy versus conventional platinum–based chemotherapy in women with relapsed ovarian cancer; the ICON4/AGO-OVAR-2.2 trial. Lancet, 2003, 361, p. 2099-2106.
18. Pfisterer, J., Plante, M., Vergote I., et al. Gemcitabine plus carboplatin compared with carboplatin in patients with platinum–sensitive recurrent ovarian cancer: an intergroup trial of the AGO-OVAR, the NCIC CTG and the EORTC GCG. J Clin Oncol 2006, 24, p. 4699-4707.
19. Alberts, DS., Liu, PY., Wilczynski, SP., et al. Randomized trial of pegylated liposomal dexorubicin (PLD) plus carboplatin versus carboplatin in platinum sensitive (PS) patients with recurrent epithelial ovarian or peritoneal carcinoma after failure of initial platinum-based chemotherapy (Southwest Oncology Group Protocol S0200). Gynecol Oncol, 2008, 108, p. 90-94.
20. Pujade-Lauraine, E., Mahner, S., Kaern, J., et al. A randomized phase III study of carboplatin and pegylated liposomal dexorubicin versus carboplatin and paclitaxel in relapsed platinum-sensitive ovarian cancer (OC): CALYPSO study of the Gynecologic Cancer Intergroup (GCIG). J Clin Oncol 2009, Suppl. 27, p. 799.
21. Burger, RA., Sill, MW., Monk, BJ., et al. Phase II trial of bevacizumab in persistent or recurrent epithelial ovarian cancer or primary peritoneal cancer: a Gynecologic Oncology Group study. J Clin Oncol 2007, 25, p. 5165-5171.
22. Cannistra, SA., Matulonis, UA, Penson, RT., et al. Phase II study of bevacizumab in patients with platinum-resistant ovarian cancer or peritoneal serous cancer. J Clin Oncol 2007, 25, p. 5180-5186.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2009 Issue 6
-
All articles in this issue
- Porovnání produkce reaktivních kyslíkových částic v nativním ejakulátu a v suspenzi spermií
- Interleukin 6 v plodové vodě pacientek s předčasným odtokem plodové vody
- Denzitometrické nálezy u žen užívajících gestagenní hormonální antikoncepci
- Kombinovaná léčba symptomů hyperaktivního měchýře anticholinergiky a alfalytiky u žen – pilotní studie
- Fertilitu zachovávající terapie gynekologických malignit
- Molekulární charakteristiky borderline ovariálních tumorů ve vztahu k biologickému chování nádorů
- Reprodukční výsledky po laparoskopické myomektomii – retrospektivní analýza 1994-2007
- Torze ovaria v prvním trimestru gravidity po stimulaci v IVF-ET programu – kazuistika
- Prenatálně vzniklé intrakraniální krvácení – diagnostika a sledování
- Analýza perinatologických ukazatelů Olomouckého kraje v období 1994-2008
- Perioperační podávání kapslí s brusinkovým extraktem v profylaxi uroinfekcí po gynekologických operacích
- Komplikace laparotomické a laparoskopické léčby karcinomu endometria
- Léčba recidivujícího ovariálního karcinomu
- Czech Gynaecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Interleukin 6 v plodové vodě pacientek s předčasným odtokem plodové vody
- Prenatálně vzniklé intrakraniální krvácení – diagnostika a sledování
- Torze ovaria v prvním trimestru gravidity po stimulaci v IVF-ET programu – kazuistika
- Fertilitu zachovávající terapie gynekologických malignit