Vakcinace proti HPV a výhled nových možností
Vaccination against HPV and view of new possibilities
Objective:
Overview of available information on current vaccination options against HPV and possibilities for further development.
Design:
Review article.
Settings:
Clinic of Gynecology and Obstetrics, University Hospital in Ostrava; Clinic of Gynecology and Obstetrics, General University Hospital in Prague.
Methods and results:
Three prophylactic vaccines have been developed against HPV infection and are all now avaliable in Czech Repulbic; nonavalent (Gardasil 9), quadrivalent vaccine (Silgard) and bivalent vaccine (Cervarix). Therapeutic vaccines, designed to induce regression of existing HPV-associated lesions, are in development and not yet clinically available.
Conclusion:
All three avaliable prophylactic vaccines show high efficacy in prevention of vaccine-specific HPV-type infection. The highest degree of protection is achieved in the population of HPV-naive women.
Keywords:
human papillomavirus, cervical cancer, HPV vaccination, bivalent HPV vaccine, quadrivalent HPV vaccine, nonavalent HPV vaccine
Authors:
A. Mladěnka; J. Sláma
Authors‘ workplace:
Gynekologicko-porodnická klinika VFN a 1. LF UK, Praha, přednosta prof. MUDr. A. Martan, DrSc
; Gynekologicko-porodnická klinika FN, Ostrava-Poruba, přednosta doc. MUDr. O. Šimetka, Ph. D., MBA
Published in:
Ceska Gynekol 2018; 83(3): 218-225
Overview
Cíl studie:
Přehled dostupných informací o vakcinaci proti HPV a možnostech dalšího rozvoje.
Typ studie:
Souhrnný přehled.
Název a sídlo pracoviště:
Gynekologicko-porodnická klinika, Fakultní nemocnice Ostrava; Gynekologicko-porodnická klinika, Všeobecná fakultní nemocnice a 1. LF UK, Praha.
Metodika a výsledky:
Byly vyvinuty tři profylaktické vakcíny proti HPV infekci a nyní jsou všechny dostupné v České republice – nonavalentní vakcína (Gardasil 9), kvadrivalentní vakcína (Silgard) a bivalentní vakcína (Cervarix). Terapeutické vakcíny, které by měly indukovat regresi existujících HPV asociovaných lézí, jsou ve vývoji a zatím nejsou dostupné pro klinickou praxi.
Závěr:
Všechny tři dostupné profylaktické vakcíny mají vysokou efektivitu v prevenci infekce vyvolané typy HPV, které jsou obsaženy v konkrétní vakcíně. Nejvyššího stupně ochrany dosahují v populaci HPV naivních žen.
Klíčová slova:
karcinom děložního hrdla, lidský papilomavirus, HPV vakcinace, bivalentní HPV vakcína, kvadrivalentní HPV vakcína, nonavalentní HPV vakcína
ÚVOD
Již téměř 40 let je známá role lidských papillomavirů (human papilloma virus – HPV) v etiopatogenezi karcinomu děložního hrdla. Uvedenou hypotézu definitivně potvrdily nálezy HPV DNA v téměř všech biopsiích z cervikálního karcinomu [83]. Tento převratný objev, oceněný v roce 2008 Nobelovou cenou za medicínu, zcela změnil pohled na optimální metodiku efektivního screeningu karcinomu děložního hrdla a umožnil vývoj preventivních vakcín proti HPV [64]. Incidence karcinomu děložního hrdla v České republice mírně klesá, v roce 2015 byla 16,24/100 000 [6]. I přesto je v porovnání s vyspělými zeměmi vysoká – například Finsko v roce 2008 mělo incidenci pouze 5,6/100 000 [5]. Je proto velmi žádoucí, aby byly vynaloženy všechny snahy o významné snížení počtu nových případů. Současný screening karcinomu děložního hrdla v ČR má však řadu limitů a i přes adresné zvaní se jej účastní jen o málo více než polovina cílové populace [21]. Významnou roli proto může sehrát vakcinace proti HPV, která je cílená na odlišnou populační skupinu.
Objev HPV vakcinace otevřel nové možnosti v primární prevenci benigních, premaligních a maligních onemocnění ženského genitálu [59].
Očkování je nejspolehlivější metodou primární prevence karcinomu děložního hrdla. V současné době jsou v Evropě na trhu dostupné tři typy vakcín proti HPV. Nejvyšší účinnost bude mít vakcinace u HPV naivní populace, nelze však opomenout fakt, že každá žena může z vakcinace profitovat, vzhledem k nízké postinfekční sérokonverzi a celoživotnímu riziku akvírování nové infekce včetně opakované infekce stejným genotypem. V současnosti je v České republice legislativně zajištěna možnost dobrovolného a zároveň plně hrazeného očkování dívek a nově i u chlapců ve věku 13 až 14 let, která je realizována jako součást pravidelné prohlídky u praktického lékaře pro děti a dorost. Sérokonverze proběhne u více než 97,5 % očkovaných žen bez ohledu na typ vakcíny [49].
CHARAKTERISTIKY DOSTUPNÝCH VAKCÍN
Cervarix je bivalentní vakcína, která je tvořena viru podobnými částicemi (virus-like particles – VLPs), vyrobenými rekombinantní DNA technologií za použití bakulovirového expresního systému, který využívá buněk Hi-5 Rix4446 získaných z Trichoplusia ni (můra z rodu Noctuidea). Cervarix obsahuje VLPs pro HPV typy 16 a 18 s adjuvantním systémem AS04 jako nosičem (3-O-deacyl-4‘-monofosforyl-lipid A (MPL) adsorbovaným na hydroxid hlinitý, hydratovaným (Al(OH)3)), schopným navodit tvorbu signifikantně vyšších titrů protilátek v porovnání s vakcínou s klasickým hliníkovým adjuvans (obsahuje 0,5 mg iontů hliníku). Je indikována pro ženy a muže ve věku 9 až 25 let k prevenci premaligních genitálních lézí a cervikálního karcinomu a análního karcinomu. Především díky přítomnosti inovativního adjuvantního systému vykazuje významnou zkříženou protekci vůči HPV 31, 33 a 45. Protekce proti HPV 16, 18 a 45 je klinicky podstatná v prevenci obtížně detekovatelných adenokarcinomů [12, 50, 51, 63].
Ve věku od 9 do 14 let včetně se přípravek Cervarix aplikuje ve dvou dávkách, každá po 0,5 ml. Druhá dávka se podává mezi 5. a 13. měsícem po první dávce. Pokud je druhá dávka vakcíny podána před pátým měsícem po první dávce, vždy musí být podána ještě třetí dávka.
Ve věku od 15 let je nutno pro dosažení adekvátní ochrany aplikovat tři dávky po 0,5 ml ve schématu 0., 1. a 6. měsíc. Pokud je nutná flexibilita očkovacího schématu, druhá dávka může být podána mezi jedním a 2,5 měsíci po první dávce a třetí dávka mezi 5 a 12 měsíci po první dávce. Potřeba podání posilovací dávky nebyla dosud stanovena [63, 66].
Silgard je kvadrivalentní vakcína, která obsahuje rekombinantní L1 protein ve formě VLPs vyrobený v kvasinkách (Saccharomyces cerevisiae CANADE 3C-5 (kmen 1895)) rekombinantní DNA technologií. Zajišťuje ochranu proti HPV 6, 11, 16 a 18. Adjuvantní systém je tradiční hydroxid hlinitý (0,225 mg iontů hliníku). Je doporučena pro ženy a muže ve věku od 9 do 45 let k prevenci premaligních genitálních a análních lézí, cervikálních a análních karcinomů a kondylomat genitálu. Pravděpodobně v důsledku méně potentního adjuvans vykazuje zkříženou protekci pouze vůči HPV 31 [50, 51, 53]. Dosud nejasný je klinický dopad klesajících hladin protilátek, které pro HPV 18 a 11 po 36 měsících sledování nedosahují hladin indukovaných přirozenou infekcí.
Jedincům ve věku 9 až 13 let věku včetně lze přípravek Silgard podávat podle identického dvoudávkového schématu jako u bivalentní vakcíny (0,5 ml v 0. a 6. měsíci), pokud se druhá dávka očkovací látky podá dříve než šest měsíců po první dávce, je nutno vždy podat třetí dávku. U starších je třeba přípravek Silgard podat podle třídávkového schématu (0,5 ml v 0., 2. a 6. měsíci). Druhou dávku je nutno podat nejméně jeden měsíc po první dávce a třetí dávku je nutno podat nejméně tři měsíce po druhé dávce. Všechny tři dávky musí být podány během období jednoho roku [53, 66].
Gardasil 9 je nonavalentní vakcína, která obsahuje rekombinantní L1 protein ve formě VLPs vyrobený v kvasinkách (Saccharomyces cerevisiae CANADE 3C-5 (kmen 1895)) rekombinantní DNA technologií. Zajišťuje ochranu proti HPV 6, 11, 16, 18, 31, 33, 45, 52 a 58; vázané na nosič hydroxid hlinitý (0,5 mg iontů hliníku). Zajímavé je, že ve srovnání s vakcínou Silgard došlo kromě navýšení počtu genotypů i k navýšení množství antigenů pravděpodobně s cílem dosáhnout dlouhodobější ochrany. Je indikován k aktivní imunizaci jedinců ve věku od devíti let věku proti premaligním lézím dolního genitálního traktu, cervikálnímu, vulválnímu, vaginálnímu a análnímu karcinomu a genitálním bradavicím způsobeným HPV typy obsaženými ve vakcíně – prevalence genitálních bradavic v ČR je 0,89 % [24].
Ve věku od 9 do 14 let včetně se přípravek Gardasil 9 aplikuje ve dvou dávkách, každá po 0,5 ml. Druhá dávka se podává mezi 5. a 13. měsícem po první dávce. Pokud je druhá dávka vakcíny podána před pátým měsícem po první dávce, vždy musí být podána ještě třetí dávka.
Ve věku od 15 let je nutno pro dosažení adekvátní ochrany aplikovat tři dávky po 0,5 ml ve schématu 0., 2. a 6. měsíc. Pokud je nutná flexibilita očkovacího schématu, druhá dávka může být podána mezi jedním a 2,5 měsíci po první dávce a třetí dávka mezi 5 a 12 měsíci po první dávce. Potřeba podání posilovací dávky nebyla dosud stanovena [20].
Podle dostupných dat lze dokončit již zahájené očkování jinou vakcínou, bezpečně Gardasilem 9, anebo k rozšíření protekce pacientku s již dokončeným očkováním přeočkovat [78].
Očkovací látky je nutno aplikovat intramuskulární injekcí. Preferovaným místem aplikace je oblast deltového svalu horní paže nebo horní anterolaterální oblast stehna. Vakcíny nesmí být aplikovány intravaskulárně, subkutánně ani intradermálně [20, 53, 63].
BEZPEČNOST VAKCÍN
Nejen na základě rozsáhlých dat z provedených klinických studií, ale i podle hlášení o nežádoucích účincích po uvedení na trh je zřejmé, že vakcíny jsou bezpečné a jsou dobře tolerovány. Vyskytují se obvykle pouze mírné reakce v místě vpichu [33, 68]. Objevila se hlášení o synkopách mezi adolescenty, ale tato hlášení jsou taktéž u ostatních běžných vakcín [2, 68]. Závažné nežádoucí reakce, jako je přetrvávající bolest hlavy, hypertenze, gastroenteritida a bronchospazmus, se vyskytly ne více než v 0,5 % aplikací [29]. Některé menší práce poukazují na možnost negativního ovlivnění autonomního nervového systému v souvislosti s aplikací kvadrivalentní vakcíny, vzhledem k velmi podobně popisovaným nežádoucím účinkům. Jasná kauzalita ale nebyla potvrzena, ani vyvrácena [14]. Nebyly ani nalezeny důkazy zvýšeného rizika autoimunitních chorob [30].
Studie zahrnující téměř milion dívek ve věku mezi 10 až 17 lety v Dánsku a Švédsku neshledala rozdíl mezi hlášenými nežádoucími událostmi u dívek očkovaných kvadrivalentní vakcínou nebo neočkovaných. Nenašla žádné důkazy podporující vztah vakcíny k autoimunitním a neurologickým onemocněním či žilní trombóze [10].
Objevují se i studie zkoušející použití vakcín v kombinaci s jinými bez průkazu vzájemného ovlivnění nebo zhoršení tolerance [45].
I když nejsou vakcíny schváleny pro použití u těhotných žen, z registračních studií vyplynulo, že při aplikaci kvadrivalentní vakcíny nebyly nalezeny rozdíly nežádoucích účinků na těhotenství mezi očkovanými a neočkovanými [25]. Pokud žena otěhotní, měla by očkování dokončit až po porodu. Stejné výsledky jsou k dispozici i u bivalentní vakcíny [9, 58]. Podobně i u HIV infikovaných žen je použití vakcíny bezpečné a imunogenní, ale zatím nejsou dostupná data o dlouhodobém efektu [40, 44].
IMUNOGENITA
V klinických studiích byla doložena dostatečná tvorba protilátek po očkování jak u bivalentní, kvadrivalentní, tak u nonavalentní vakcíny [33, 60, 79, 80]. Bivalentní proti kvadrivalentní vakcíně indukuje průměrně 2,3krát až 4,8krát vyšší titr sérových protilátek proti HPV 16 a 6,8–9,1krát vyšší proti HPV [22]. Imunogenita nonavalentní vakcíny mezi ženami ve věku od 9 do 26 let je srovnatelná s kvadrivalentní vakcínou pro sdílené HPV typy [39, 79]. Titr protilátek sedm měsíců po očkování nonavalentní vakcínou byl dvakrát vyšší u dívek i chlapců ve věku 9 až 15 let než u žen ve věku 16 až 26 let. V nižším věku byla zjištěna i nižší incidence nežádoucích reakcí v místě aplikace [78]. Vysoká séropozitivita pro bivalentní vakcínu přetrvává 9,4 let, pro kvadrivalentní až devět let po aplikaci a pro nonavalentní máme zatím k dispozici data za dobu pěti let [32, 55, 56]. Není stanovena hladina titru protilátek, která by dostatečně chránila před infekcí. Hladina protilátek po přirozené infekci ve srovnání po vakcinaci je velmi nízká, ale přesto snižuje riziko možné následné infekce [51, 63].
Existují důkazy, že základem dlouhodobé ochrany zprostředkované vakcínami jsou paměťové B-lymfocyty [69]. V této souvislosti je prokázána vyšší odpověď CD4+ T-lymfocytů i paměťových B-lymfocytů 24 měsíců po aplikaci u bivalentní vakcíny než u kvadrivalentní [23].
ÚČINNOST
Několik rozsáhlých randomizovaných dvojitě zaslepených a placebem kontrolovaných klinických studií potvrdilo vysokou efektivitu bivalentní, kvadrivalentní i nonavalentní vakcíny [1, 26, 39, 57]. Srovnání účinnosti jednotlivých vakcín podle dostupných dat ukazuje tabulka 1.
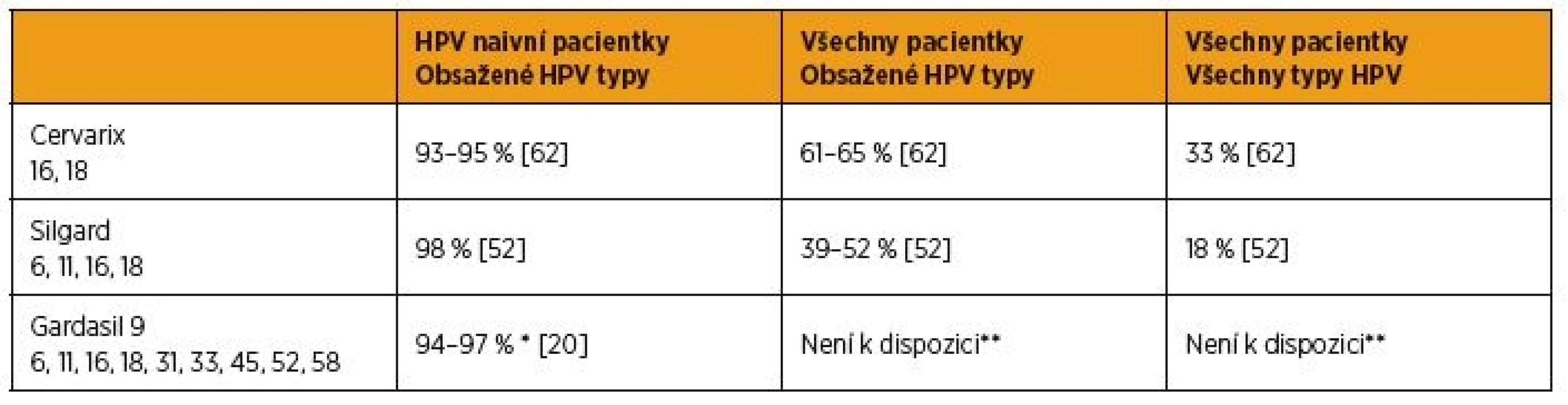
** V porovnání proti Silgardu byl nalezen stejný počet případů v obou skupinách
I když se jednotlivé prediktivní modely liší, předpovídají v německé populaci s proočkovaností 50% snížení incidence a mortality cervikálního karcinomu o 70 %, při použití nonavalentní vakcíny pak další snížení incidence o 24 % [46, 67]. Data mimo výsledky výrobců vakcín jsou také velmi slibná, například efektivnost bivalentní vakcíny prokazuje snížení prevalence HPV 16/18 u žen ve věku 16 až 24 let z 19,1 % na 6,5 % v Anglii [54].
U žen, které měly v době aplikace první dávky známky infekce, nedošlo ke změně průběhu onemocnění. Nejsou tedy žádné důkazy o terapeutickém efektu v součastnosti dostupných vakcín [26, 31, 35].
Účinnost a bezpečnost očkování u chlapců jsou důležité nejen z důvodu prevence HPV asociovaných onemocnění (genitální bradavice, anální či penilní karcinom), ale také pro snížení přenosu HPV infekce a pravděpodobně jako prevence orálního karcinomu [27]. Podle metaanalýzy je u evropské mužské populace prevalence HPV 12,4 %, u rizikové 30,9 % [34]. U HPV naivních mužů ve věku 16 až 26 let prokázala kvadrivalentní vakcína efekt proti vzniku genitálních lézí asociovaných HPV typy obsaženými ve vakcíně v 90,4 % v porovnání s placebem [28]. Bezpečnost a imunitní odpověď je u mužů mezi kvadrivalentní a tetravalentní vakcínou srovnatelná [77]. Očkování dívek a zároveň chlapců je doporučováno v USA, Kanadě, Austrálii, Švýcarsku, části Itálie, a dokonce v sousedním Rakousku a Sasku [7, 70]. Větší efekt má zvýšení proočkovanosti žen, pohlavně nespecifický očkovací program by byl ekonomicky výhodný pouze v populaci s nízkou proočkovaností žen [15, 70].
Některé výsledky naznačují, že očkování po konizaci je spojeno s nižší rekurencí cervikálních lézí. V retrospektivní studii se sledováním v délce tři a půl roku porovnávající více než 700 žen po konizaci byla zjištěna rekurence u žen očkovaných v 2,5 % proti 8,5 % žen neočkovaných [41]. Převážná většina rekurencí je ale způsobena perzistencí nákazy, a ne infekcí de novo, vysvětlení mechanismu přínosu vakcinace tak není dosud jasné [81]. Podle přehledové studie žádná ze sedmi studií, které se zabývaly použitím vakcinace v sekundární prevenci u pacientek s pozitivitou HPV DNA, neukázala klinický přínos [19].
Proočkovanost je u povinných vakcín v České republice dlouhodobě všeobecně velmi vysoká, 97–99 % [3]. Přesná data o proočkovanosti proti HPV u nás nejsou dostupná. Data ale lze odvodit od největšího plátce zdravotní péče – Všeobecná zdravotní pojištovna vykázala v roce 2012 celkem 53%, roku 2013 pak 52,7%, 2014 65,4% a v roce 2015 62,2% proočkovanost v cílové kohortě 13letých až 14letých dívek [16, 17]. Celosvětově je situace různorodá, ale například Itálie dosahuje dlouhodobě proočkovanosti více než 70 % [13], Švédsko dokonce 98 % [48]. Mnoho evropských zemí začlenilo vakcinaci proti HPV do svého očkovacího kalendáře, většinou ve věku 12 let. Nejdříve začínají s očkováním v Německu, a to už od 9 let [4].
VÝHLEDY
Hledají se nové a levnější cesty ve vývoji HPV vakcín, jak v primární prevenci, tak v terciární prevenci k navození imunitní odpovědi proti již vzniklým cervikálním tumorům. Jako velmi výhodná se ukazuje možnost subkutánní aplikace [11] nebo aplikace transdermální ve formě náplasti, u které mohla být v myším modelu významně redukována dávka [18]. Úspěšně byla otestována možnost sublingválního podání bivalentní vakcíny, která vyvolala srovnatelnou buněčnou i humorální imunitní odpověď v porovnání k intramuskulárnímu podání, a to bez nutnosti použití adjuvans [47].
V preklinických studiích se pracuje na vakcíně, která má potenciál na protekci proti širokému spektru HPV, neboť obsahuje obal tvořený proteinem L2, který je pro všechny HPV stejný, a je navíc stabilní i při pokojové teplotě [73]. Imunitní odpověď po setkání s L2 proteinem je ale výrazně slabší než po setkání s L1 proteinem [24, 37, 66, 74, 75]. Zkoumají se i vakcíny využívající oba proteiny L1 i L2 [36, 53, 65].
Dalším krokem je vývoj terapeutických vakcín. Jako velmi slibné by mohly být vakcíny s obsahem proteinů E6 a E7. Tyto vakcíny by mohly kontrolovat vzniklou HPV infekci, a tím zabránit malignizaci buňky. Nové vektory (živé, bakteriální) by mohly přinést geny nebo proteiny E6 a E7 přímo k antigen prezentujícím buňkám a tak zahájit lepší imunitní odpověď [49].
Recentně byly publikovány nadějné výsledky, které ukazují klinickou odpověď u 79 % pacientů. Té bylo dosaženo za dvanáct měsíců při použití terapeutické vakcíny s proteiny E6 a E7 HPV 16 v kohortě 20 žen s HPV 16 pozitivní VIN 3 [43]. V jiné studii naopak nepřineslo použití chimérické vakcíny HPV 16 L1E7 VLPs u pacientů s HPV 16 pozitivním CIN 2/3 žádné klinické zlepšení [42]. Ve studii s použitím vakcíny pNGVL4a-CRT-E7(detox) bylo dosaženo 30% regrese [8] a ve studii s vakcínou VGX-3100 dokonce 49,5% regrese CIN 2/3, které jsou asociovány s HPV 16 a HPV 18 [72]. Na myším modelu s použitím oslabeného rekombinatního viru chřipky při aplikaci do tumoru prokázala VGX-3100 částečnou regresi nádoru u 50 % a kompletní u 25 % subjektů [38].
V klinické studii fáze III, ve které byla použita terapeutická vakcína MVA-E2 (Modified Vaccinia Ankara) u 1176 žen a 180 mužů s intraepiteliálními HPV asociovanými lézemi, bylo dosaženo kompletní eliminace lézí u 89,3 % žen a u 100 % mužů. HPV DNA nebylo po léčbě nalezeno u 83 % pacientů [61]. Dokonce již byly publikovány nadějné výsledky u pacientek s metastatickým karcinem děložního hrdla. Ke kompletní regresi došlo u dvou z devíti pacientů po jedné infuzi reaktivovaných T-lymfocytů cílících na HPV16 E6 a E7 [71]. Kromě zmíněných studií probíhá celá řada dalších klinických studií s terapeutickými vakcínami různého typu (živé, peptidy, proteiny, DNA, RNA, buněčné) zaměřujícími se převážně na proteiny E6 a E7 [82].
ZÁVĚR
Incidence onemocnění asociovaných s HPV infekcí bude klesat v závislosti na zvyšujícím se počtu očkovaných žen v populaci. Předpokládá se, že snížení incidence karcinomu děložního hrdla bude zaznamenáno až po 20 letech plošné vakcinace, vzhledem k vysoké prevalenci HPV infekce v populaci a pomalému procesu karcinogeneze [49]. Všechny dostupné profylaktické vakcíny prokázaly v klinických studiích vysokou efektivitu v prevenci HPV typů v nich obsažených [26, 31, 39, 57]. Nejvyššího stupně ochrany dosahují v populaci HPV naivních žen, proto je velmi důležitá dostatečná informovanost pediatrů, kteří mohou proočkovanost velmi ovlivnit. Brzy snad budou k dispozici i účinné terapeutické vakcíny.
Korespondující autor
Doc. MUDr. Jiří Sláma, Ph.D.
Gynekologicko-porodnická klinika
VFN a 1. LF UK
Apolinářská 18
128 51 Praha 2
e-mail: jiri.slama@vfn.cz
Sources
1. Quadrivalent vaccine against human papillomavirus to prevent high-grade cervical lesions. N Engl J Med, 2007, 356, 19, p. 1915–1927.
2. Syncope after vaccination–-United States, January 2005–July 2007. MMWR Morb Mortal Wkly Rep, 2008, 57, 17, p. 457–460.
3. WHO vaccine-preventable diseases: monitoring system. 2015 global summary. 2014, World health organisation, URL: <http://apps.who.int/immunization_monitoring/globalsummary/coverages?c=CZE>.
4. Vaccine Schedule. 2016, European Centre for Disease Prevention and Control, URL: <http://vaccine-schedule.ecdc.europa.eu/Pages/Scheduler.aspx>.
5. C53 – Hrdlo děložní – cervicis uteri, ženy, srovnání incidence v ČR s ostatními zeměmi Evropy, přepočet na 100 000 osob. 2017, Ústav zdravotnických informací a statistiky ČR, URL: <http://www.svod.cz/graph/?sessid=hs4f0rfuklirjvnu08j46rqtv5&typ=zahranici_2008&diag=C53&incmor=inc&pohl=z&kraj=w&vek_od=0&vek_do=18&zobrazeni=table&incidence=1&mortalita=1&vypocet=c&obdobi_od=1977&obdobi_do=2013&stadium=&t=&n=&m=&pt=&pn=&pm=&t=&n=&zije=&umrti=&lecba=&ref=>.
6. C53 – ZN hrdla děložního – cervicis uteri, ženy, Časový vývoj, Počet případů na 100 000 osob. 2017, Ústav zdravotnických informací a statistiky ČR, URL: <http://www.svod.cz/graph/?sessid=ppnedc27vcpp664210c3b9nr64&typ=incmor&diag=C53&pohl=z&kraj=&vek_od=1&vek_do=18&zobrazeni=table&incidence=1&mortalita=1&mi=0&vypocet=c&obdobi_od=1977&obdobi_do=2015&stadium=&t=&n=&m=&pt=&pn=&pm=&t=&n=&zije=&umrti=&lecba=>.
7. Abramowitz, LP., Descamps, F., Denis, M., et al. Papillomavirus and cancers: should we extend vaccination to boys in France? J Public Health (Oxf), 2016.
8. Alvarez, RD., Huh, WK., Bae, S., et al. A pilot study of pNGVL4a-CRT/E7(detox) for the treatment of patients with HPV16+ cervical intraepithelial neoplasia 2/3 (CIN2/3). Gynecol Oncol, 2015.
9. Angelo, MG., Zima, J., Tavares Da Silva, F., et al. Post-licensure safety surveillance for human papillomavirus-16/18-AS04-adjuvanted vaccine: more than 4 years of experience. Pharmacoepidemiol Drug Saf, 2014, 23, 5, p. 456–465.
10. Arnheim-Dahlstrom, L., Pasternak, B., Svanstrom, H., et al. Autoimmune, neurological, and venous thromboembolic adverse events after immunisation of adolescent girls with quadrivalent human papillomavirus vaccine in Denmark and Sweden: cohort study. BMJ, 2013, 347, p. f5906.
11. Bharti, B., Grewal, A., Kalia, R., Pathak, P. Vaccine related reactogenicity for primary immunization: a randomized controlled trial of 23(wider) vs. 25(narrower) gauge needles with same lengths. Indian J Pediatr, 2010, 77, 11, p. 1241–1246.
12. Bissett, SL., Godi, A., Jit, M., Beddows, S. Seropositivity to non-vaccine incorporated genotypes induced by the bivalent and quadrivalent HPV vaccines: A systematic review and meta-analysis. Vaccine, 2017, 35, 32, p. 3922–3929.
13. Bonanni, P., Ferro, A., Guerra, R., Iannazzo, S., et al. Vaccine coverage in Italy and assessment of the 2012–2014 National Immunization Prevention Plan. Epidemiol Prev, 2015, 39, 4, Suppl. 1, p. 146–158.
14. Brinth, L., Theibel, AC., Pors, K., Mehlsen, J. Suspected side effects to the quadrivalent human papilloma vaccine. Dan Med J, 2015, 62, 4.
15. Burger, EA., Sy, S., Nygard, M., Kristiansen, IS., et al. Prevention of HPV-related cancers in Norway: cost-effectiveness of expanding the HPV vaccination program to include pre-adolescent boys. PLoS One, 2014, 9, 3, p. e89974.
16. Cabrnochová, H. 2015. Aktuality v očkování 2015. In Proceedings of the XI. Hradecké vakcinologické dny 2015, Hradec Králové, 01-OCT-2015 2015.
17. Cabrnochová, H. Očkování dětíi? – novinky 2017. In.: Zdravotnické noviny plus, 2017, vol. 2017.
18. Corbett, HJ., Fernando, GJ., Chen, X., et al. Skin vaccination against cervical cancer associated human papillomavirus with a novel micro-projection array in a mouse model. PLoS One, 2010, 5, 10, p. e13460.
19. Dion, GR., Teng, S., Boyd, LR., et al. Adjuvant human papillomavirus vaccination for secondary prevention: a systematic review. JAMA Otolaryngol Head Neck Surg, 2017, 143, 6, p. 614–622.
20. Dohme, MS. Souhrn údajů o přípravku Gardasil 9. In European Medicines Agency. 2015.
21. Duskova, J., Bekova, A., Dvorak, V., et al. [Results of the Czech National Cervical Cancer screening programme]. Klin Onkol, 2014, 27, Suppl. 2, p. 79–86.
22. Einstein, MH., Baron, M., Levin, MJ., et al. Comparison of the immunogenicity and safety of Cervarix and Gardasil human papillomavirus (HPV) cervical cancer vaccines in healthy women aged 18–45 years. Hum Vaccin, 2009, 5, 10, p. 705–719.
23. Einstein, MH., Baron, M., Levin, MJ., et al. Comparative immunogenicity and safety of human papillomavirus (HPV)-16/18 vaccine and HPV-6/11/16/18 vaccine: follow-up from months 12–24 in a Phase III randomized study of healthy women aged 18–45 years. Hum Vaccin, 2011, 7, 12, p. 1343–1358.
24. Fait, T., Dvorak, V., Skrivanek, A., et al. [Epidemiology of genital warts in female population of Czech Republic]. Ces Gynek, 2012, 77, 4, s. 360–363.
25. Gambhira, R., Gravitt, PE., Bossis, I., et al. Vaccination of healthy volunteers with human papillomavirus type 16 L2E7E6 fusion protein induces serum antibody that neutralizes across papillomavirus species. Cancer Res, 2006, 66, 23, p. 11120–11124.
26. Garland, SM., Ault, KA., Gall, SA., et al. Pregnancy and infant outcomes in the clinical trials of a human papillomavirus type 6/11/16/18 vaccine: a combined analysis of five randomized controlled trials. Obstet Gynecol, 2009, 114, 6, p. 1179–1188.
27. Garland, SM., Hernandez-Avila, M., Wheeler, CM., et al. Quadrivalent vaccine against human papillomavirus to prevent anogenital diseases. N Engl J Med, 2007, 356, 19, p. 1928–1943.
28. Gillison, ML., Broutian, T., Pickard, RK., et al. Prevalence of oral HPV infection in the United States, 2009–2010. JAMA, 2012, 307, 7, p. 693–703.
29. Giuliano, AR., Palefsky, JM., Goldstone, S., et al. Efficacy of quadrivalent HPV vaccine against HPV Infection and disease in males. N Engl J Med, 2011, 364, 5, p. 401–411.
30. Goncalves, AK., Cobucci, RN., Rodrigues, HM., et al. Safety, tolerability and side effects of human papillomavirus vaccines: a systematic quantitative review. Braz J Infect Dis, 2014, 18, 6, p. 651–659.
31. Grimaldi-Bensouda, L., Guillemot, D., Godeau, B., et al. Autoimmune disorders and quadrivalent human papillomavirus vaccination of young female subjects. J Intern Med, 2014, 275, 4, p. 398–408.
32. Group, FIS. Quadrivalent vaccine against human papillomavirus to prevent high-grade cervical lesions. N Engl J Med, 2007, 356, 19, p. 1915–1927.
33. Guevara, A., Cabello, R., Woelber, L., et al. Antibody persistence and evidence of immune memory at 5years following administration of the 9-valent HPV vaccine. Vaccine, 2017, 35, 37, p. 5050–5057.
34. Harper, DM., Franco, EL., Wheeler, CM., et al. Sustained efficacy up to 4.5 years of a bivalent L1 virus-like particle vaccine against human papillomavirus types 16 and 18: follow-up from a randomised control trial. Lancet, 2006, 367, 9518, p. 1247–1255.
35. Hebnes, JB., Olesen, TB., Duun-Henriksen, LK., et al. Prevalence of genital human papillomavirus among men in Europe: systematic review and meta-analysis. J Sex Med, 2014, 11, 11, p. 2630–2644.
36. Hildesheim, A., Herrero, R., Wacholder, S., et al. Effect of human papillomavirus 16/18 L1 viruslike particle vaccine among young women with preexisting infection: a randomized trial. JAMA, 2007, 298, 7, p. 743–753.
37. Jagu, S., Kwak, K., Garcea, RL., Roden, RB. Vaccination with multimeric L2 fusion protein and L1 VLP or capsomeres to broaden protection against HPV infection. Vaccine, 2010, 28, 28, p. 4478–4486.
38. Jagu, S., Kwak, K., Karanam, B., et al. Optimization of multimeric human papillomavirus L2 vaccines. PLoS One, 2013, 8, 1, p. e55538.
39. Jindra, C., Huber, B., Shafti-Keramat, S., et al. Attenuated recombinant influenza a virus expressing HPV16 E6 and E7 as a novel therapeutic vaccine approach. PLoS One, 2015, 10, 9, p. e0138722.
40. Joura, EA., Giuliano, AR., Iversen, OE., et al. A 9-valent HPV vaccine against infection and intraepithelial neoplasia in women. N Engl J Med, 2015, 372, 8, p. 711–723.
41. Kahn, JA., Xu, J., Kapogiannis, BG., et al. Immunogenicity and safety of the human papillomavirus 6, 11, 16, 18 vaccine in HIV-infected young women. Clin Infect Dis, 2013, 57, 5, p. 735–744.
42. Kang, WD., Choi, HS., Kim, SM. Is vaccination with quadrivalent HPV vaccine after loop electrosurgical excision procedure effective in preventing recurrence in patients with high-grade cervical intraepithelial neoplasia (CIN2-3)? Gynecol Oncol, 2013, 130, 2, p. 264–268.
43. Kaufmann, AM., Nieland, JD., Jochmus, I., et al. Vaccination trial with HPV16 L1E7 chimeric virus-like particles in women suffering from high grade cervical intraepithelial neoplasia (CIN 2/3). Int J Cancer, 2007, 121, 12, p. 2794–2800.
44. Kenter, GG., Welters, MJ., Valentijn, AR., et al. Vaccination against HPV-16 oncoproteins for vulvar intraepithelial neoplasia. N Engl J Med, 2009, 361, 19, p. 1838–1847.
45. Kojic, EM., Kang, M., Cespedes, MS., et al. Immunogenicity and safety of the quadrivalent human papillomavirus vaccine in HIV-1-infected women. Clin Infect Dis, 2014, 59, 1, p. 127–135.
46. Kosalaraksa, P., Mehlsen, J., Vesikari, J., et al. An open-label, randomized study of a 9-valent human papillomavirus vaccine given concomitantly with diphtheria, tetanus, pertussis and poliomyelitis vaccines to healthy adolescents 11–15 years of age. Pediatr Infect Dis J, 2015, 34, 6, p. 627–634.
47. Largeron, N., Petry, KU., Jacob, J., et al. An estimate of the public health impact and cost-effectiveness of universal vaccination with a 9-valent HPV vaccine in Germany. Expert Rev Pharmacoecon Outcomes Res, 2017, 17, 1, p. 85–98.
48. Lee, HJ., Cho, H., Kim, MG., et al. Sublingual immunization of trivalent human papillomavirus DNA vaccine in baculovirus nanovector for protection against vaginal challenge. PLoS One, 2015, 10, 3, p. e0119408.
49. Leval, A., Herweijer, E., Ploner, A., et al. Quadrivalent human papillomavirus vaccine effectiveness: a Swedish national cohort study. J Natl Cancer Inst, 2013, 105, 7, p. 469–474.
50. Lin, K., Doolan, K., Hung, CF., WK., Wu, TC. Perspectives for preventive and therapeutic HPV vaccines. J Formos Med Assoc, 2010, 109, 1, p. 4–24.
51. Lin, K., Roosinovich, E., Ma, B., et al. Therapeutic HPV DNA vaccines. Immunol Res, 2010, 47, 1–3, p. 86–112.
52. Lin, SW., Ghosh, A., Porras, C., et al. HPV16 seropositivity and subsequent HPV16 infection risk in a naturally infected population: comparison of serological assays. PLoS One, 2013, 8, 1, p. e53067.
53. Ltd, M. S. D. Souhrn údajů o přípravku Silgard. In European Medicines Agency. Merck Sharp & Dohme Ltd, 2014.
54. McGrath, M., de Villiers, GK., Shephard, E., et al. Development of human papillomavirus chimaeric L1/L2 candidate vaccines. Arch Virol, 2013, 158, 10, p. 2079–2088.
55. Mesher, D., Soldan, K., Howell-Jones, R., et al. Reduction in HPV 16/18 prevalence in sexually active young women following the introduction of HPV immunisation in England. Vaccine, 2013, 32, 1, p. 26–32.
56. Naud, PS., Roteli-Martins, CM., De Carvalho, NS., et al. Sustained efficacy, immunogenicity, and safety of the HPV-16/18 AS04-adjuvanted vaccine: final analysis of a long-term follow-up study up to 9.4 years post-vaccination. Hum Vaccin Immunother, 2014, 10, 8, p. 2147–2162.
57. Nygard, M., Saah, A., Munk, C., et al. Evaluation of the long-term anti-human papillomavirus 6 (HPV6), 11, 16, and 18 immune responses generated by the quadrivalent HPV vaccine. Clin Vaccine Immunol, 2015, 22, 8, p. 943–948.
58. Paavonen, J., Naud, P., Salmeron, J., et al. Efficacy of human papillomavirus (HPV)-16/18 AS04-adjuvanted vaccine against cervical infection and precancer caused by oncogenic HPV types (PATRICIA): final analysis of a double-blind, randomised study in young women. Lancet, 2009, 374, 9686, p. 301–314.
59. Panagiotou, OA., Befano, BL., Gonzalez, P., et al. Effect of bivalent human papillomavirus vaccination on pregnancy outcomes: long term observational follow-up in the Costa Rica HPV Vaccine Trial. BMJ, 2015, 351, p. h4358.
60. Peltecu, G., Bari, M., Lancu, G., Popa, F. Human papilloma virus and cervical preinvasive disease. J Med Life, 2009, 2, 4, p. 373–377.
61. Romanowski, B., de Borba, PC., Naud, PS., et al. Sustained efficacy and immunogenicity of the human papillomavirus (HPV)-16/18 AS04-adjuvanted vaccine: analysis of a randomised placebo-controlled trial up to 6.4 years. Lancet, 2009, 374, 9706, p. 1975–1985.
62. Rosales, R., Lopez-Contreras, M., Rosales, C., et al. Regression of human papillomavirus intraepithelial lesions is induced by MVA E2 therapeutic vaccine. Hum Gene Ther, 2014, 25, 12, p. 1035–1049.
63. S.a., GlaxoSmithKline Biologicals. Souhrn údajů o přípravku Cervarix. In European Medicines Agency. GlaxoSmithKline Biologicals s.a., 2015.
64. Safaeian, M., Porras, C., Schiffman, M., et al. Epidemiological study of anti-HPV16/18 seropositivity and subsequent risk of HPV16 and -18 infections. J Natl Cancer Inst, 2010, 102, 21, p. 1653–1662.
65. Sarid, R., Gao, SJ. Viruses and human cancer: from detection to causality. Cancer Lett, 2011, 305, 2, p. 218–227.
66. Sehnal, B., Neumannova, N., Driak, D., et al. [The 2-dose schedule of HPV vaccines in young adolescents]. Ces Gynek, 2015, 80, 1, s. 50–56.
67. Schellenbacher, C., Roden, R., Kirnbauer, R. Chimeric L1-L2 virus-like particles as potential broad-spectrum human papillomavirus vaccines. J Virol, 2009, 83, 19, p. 10085–10095.
68. Schellenbacher, C., Roden, RB., Kirnbauer, R. Developments in L2-based human papillomavirus (HPV) vaccines. Virus Res, 2017, 231, p. 166–175.
69. Schneider, A., Schwarz, TF., Hammerschmidt, T., Siebert, U. [Impact of vaccination against oncogenic human papillomavirus on the incidence and mortality of cervical cancer in Germany]. Med Klin (Munich), 2007, 102, 7, p. 515–523.
70. Slade, BA., Leidel, L., Vellozzi, C., et al. Postlicensure safety surveillance for quadrivalent human papillomavirus recombinant vaccine. JAMA, 2009, 302, 7, p. 750–757.
71. Stanley, M. Potential mechanisms for HPV vaccine-induced long-term protection. Gynecol Oncol, 2010, 118, 1 Suppl., p. S2–7.
72. Stanley, M. HPV vaccination in boys and men. Hum Vaccin Immunother, 2014, 10, 7, p. 2109–2111.
73. Stevanovic, S., Draper, LM., Langhan, MM., et al. Complete regression of metastatic cervical cancer after treatment with human papillomavirus-targeted tumor-infiltrating T cells. J Clin Oncol, 2015, 33, 14, p. 1543–1550.
74. Trimble, CL., Morrow, MP., Kraynyak, KA., et al. Safety, efficacy, and immunogenicity of VGX-3100, a therapeutic synthetic DNA vaccine targeting human papillomavirus 16 and 18 E6 and E7 proteins for cervical intraepithelial neoplasia 2/3: a randomised, double-blind, placebo-controlled phase 2b trial. Lancet, 2015, 386, 10008, p. 2078–2088.
75. Tumban, E., Muttil, P., Escobar, CA., et al. Preclinical refinements of a broadly protective VLP-based HPV vaccine targeting the minor capsid protein, L2. Vaccine, 2015.
76. Tumban, E., Peabody, J., Peabody, DS., Chackerian, B. A universal virus-like particle-based vaccine for human papillomavirus: longevity of protection and role of endogenous and exogenous adjuvants. Vaccine, 2013, 31, 41, p. 4647–4654.
77. Tyler, M., Tumban, E., Chackerian, G. Second-generation prophylactic HPV vaccines: successes and challenges. Expert Rev Vaccines, 2014, 13, 2, p. 247–255.
78. Van Damme, P., Bonanni, P., Bosch, FX., et al. Use of the nonavalent HPV vaccine in individuals previously fully or partially vaccinated with bivalent or quadrivalent HPV vaccines. Vaccine, 2016, 34, 6, p. 757–761.
79. Van Damme, P., Meijer, CJ., Kieninger, D., et al. A phase III clinical study to compare the immunogenicity and safety of the 9-valent and quadrivalent HPV vaccines in men. Vaccine, 2016, 34, 35, p. 4205–4212.
80. Van Damme, P., Olsson, SE., Block, S., et al. Immunogenicity and safety of a 9-valent HPV vaccine. Pediatrics, 2015, 136, 1, p. e28–39.
81. Vesikari, T., Brodszki, N., Van Damme, P., et al. A randomized, double-blind, phase iii study of the immunogenicity and safety of a 9-valent human papillomavirus l1 virus-like particle vaccine (V503) versus Gardasil(R) in 9–15-year-old girls. Pediatr Infect Dis J, 2015, 34, 9, p. 992–998.
82. Villa, LL., Ault, KA., Giuliano, R., et al. Immunologic responses following administration of a vaccine targeting human papillomavirus types 6, 11, 16, and 18. Vaccine, 2006, 24, 27–28, p. 5571–5583.
83. Vintermyr, OK., Iversen, O., Thoresen, S., et al. Recurrent high-grade cervical lesion after primary conization is associated with persistent human papillomavirus infection in Norway. Gynecol Oncol, 2014, 133, 2, p. 159–166.
84. Yang, A., Farmer, E., Lin, J., et al. The current state of therapeutic and T cell-based vaccines against human papillomaviruses. Virus Res, 2017, 231, p. 148–165.
85. zur Hausen, H. Papillomaviruses and cancer: from basic studies to clinical application. Nat Rev Cancer, 2002, 2, 5, p. 342–350.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2018 Issue 3
-
All articles in this issue
- Jak dlouho přetrvává léčba mirabegronem u úspěšně léčených pacientů s hyperaktivním močovým měchýřem? Analýza multicentrické studie
- Význam hladin bazického fibroblastového růstového faktoru u pacientek s tumorem ovaria
- Ovlivňuje použití transferového média EmbryoGlue úspěšnost embryotransferu?
- Porovnání incizionální a epidurální analgezie v léčbě pooperační bolesti po císařském řezu
- Hodnocení sestupu a mobility uretrovezikální junkce u žen se stresovou inkontinencí moči – ultrazvuková studie
- Primární maligní melanom pochvy, kazuistika a review z literatury
- Plánovaný domácí porod – Česká republika 2018
- Obezita a snížení plodnosti mužů
- Vakcinace proti HPV a výhled nových možností
- Potenciál survivínu pre liečbu gynekologických tumorových ochorení
- Prolaktin a poruchy reprodukce
- Roboticky asistovaná laparoskopická abdominální cerkláž: dvě kazuistiky
- Czech Gynaecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Prolaktin a poruchy reprodukce
- Ovlivňuje použití transferového média EmbryoGlue úspěšnost embryotransferu?
- Vakcinace proti HPV a výhled nových možností
- Plánovaný domácí porod – Česká republika 2018
