Význam doplnění cytologického screeningu karcinomu děložního hrdla o HPV DNA test a třídění nálezu imunocytochemickým barvením p16/Ki67 u žen ve věku 35 a 45 let
Analýza dat studie LIBUŠE
Importance of addition of HPV DNA testing to the cytology based cervical cancer screening and triage of findings with p16/Ki67 immunocytochemistry staining in 35 and 45 years old women
LIBUSE trial data analysis
Objective: The study evaluates results of 2-years follow-up of patients in ages 35–36 and 45–46, who are participating in the project LIBUSE, that deals with efficacy of HPV DNA and Pap smear co-testing and p16/Ki67 dual staining in the Czech national cervical screening.
Design: Prospective observational study.
Setting: Department of Obstetrics and Gynecology, General University Hospital and 1st Medical Faculty, Charles University, Prague.
Materials and methods: Out of all women enrolled in the project LIBUSE only those who were at the beginning of the study 35–36 and 45–46 years old were sellected. Conventional Pap smear and HPV DNA test (Cobas 4800, Roche Diagnostics) had been collected at the baseline. Women were stratified according to their results in the three risk groups: 1. low-risk, 2. high-risk and 3. intermediate risk, who subsequently underwent p16/Ki67 dual staining. All high-risk patients and those with positive result of dual staing were refered to the expert colposcopy. The cases with biopsy proven precancers or cancers were considered as „positive findings“.
Results: Altogether 352 women meet the age requirements. In 26 (7.6%) women had been proven HPV DNA positivity and out of the them 9 cases were HPV 16/18 positive. Severe cytological abnormality was found only in one patient (0.3%), who was simultaneously HPV positive. Ten women (2.8%) were classified as high-risk and directly refered to colposcopy. Another 18 patients underwent p16/Ki67 dual staining and 4 positive cases were refered to colposcopy too. After one year further 9 patients were classified as intermediate risk and 6 more were identified after two years of follow-up. Within two years 9 more patient were refered to colposcopy. After the entire period of follow-up in 10 patients biopsy confirmed precancer lesions, none of them had invasive cancer.
Conclusions: Addition of HPV DNA testing with selective HPV 16/18 genotyping to the cytology based screening significantly increases sensitivity and safety of our cervical screening program
Keywords:
HPV test – cervical cancer – precancer lesion – p16/Ki67 – screening
Authors:
J. Sláma 1; V. Dvořák 2; M. Trnková 3; A. Skřivánek 4; K. Hurdálková 5; P. Ovesná 5; Marta Nováčková 5
Authors‘ workplace:
Gynekologicko‑porodnická klinika VFN a 1. LF UK, Praha, přednosta prof. MUDr. A. Martan, DrSc.
1; Centrum ambulantní gynekologie a primární péče, s. r. o., Brno, vedoucí lékař MUDr. V. Dvořák, Ph. D.
2; AeskuLab Patologie, k. s., Praha, vedoucí lékařka MUDr. M. Trnková
3; G‑Centrum, s. r. o., Olomouc, vedoucí lékař MUDr. A. Skřivánek, Ph. D.
4; Institut biostatistiky a analýz, s. r. o., Brno, jednatel Ing. P. Brabec, Ph. D.
5
Published in:
Ceska Gynekol 2020; 85(6): 368-374
Category:
Overview
Cíl studie: Práce hodnotí výsledky dvouletého sledování kohorty žen ve věku 35–36 a 45–46 let, které se účastní projektu LIBUŠE, jehož cílem je ověřit účinnost společného vyšetření HPV DNA testu, cytologického stěru a cytologického barvení p16/Ki67 v národním cervikálním screeningu.
Typ studie: Prospektivní observační studie.
Název a sídlo pracoviště: Gynekologicko-porodnická klinika VFN a 1. LF UK, Praha.
Materiál a metodika: Ze všech žen zařazených do studie LIBUŠE byly vybrány pouze ty, kterým bylo při vstupu do studie 35–36 a 45–46 let. Pacientkám byl odebrán konvenční cytologický stěr a HPV DNA test (Cobas 4800, Roche Diagnostics). Ženy byly podle vstupních výsledků stratifikovány do tří úrovní rizika: 1. nerizikové, 2. vysoce rizikové a 3. se střední mírou rizika, které byly tříděny pomocí imunocytochemického barvení p16/Ki67. Vysoce rizikové pacientky a pacientky s pozitivitou duálního barvení byly referovány k expertnímu kolposkopickému vyšetření. Případy s biopticky verifikovanou prekancerózou nebo karcinomem byly považovány za „pozitivní nálezy“.
Výsledky: Věkové kritérium splnilo 352 žen. U 26 (7,4 %) žen byla zjištěna HPV DNA pozitivita, z toho u devíti pozitivita HPV 16/18. Závažná cytologická abnormita byly zjištěna pouze u jedné pacientky (0,3 %), která byla současně HPV pozitivní. K expertní kolposkopii bylo primárně referováno deset (2,8 %) žen splňujících kritérium vysokého rizika. U dalších 18 pacientek bylo doplněno barvení p16/Ki67 a čtyři pozitivně testované byly rovněž referovány k expertní kolposkopii. Při kontrole po roce bylo identifikováno devět pacientek středního rizika, při druhé kontrole po dalším roce bylo identifikováno dalších šest pacientek středního rizika. Během dvouletého sledování bylo ke kolposkopii referováno dalších devět pacientek. Za dobu sledování byla zjištěna prekanceróza u deseti pacientek a u žádné pacientky nebyl zjištěn invazivní karcinom.
Závěr: Doplnění stávajícího cytologického screeningu o HPV DNA test se selektivní genotypizací HPV 16/18 umožňuje významně zvýšit citlivost a bezpečnost našeho cervikálního screeningového programu.
Klíčová slova:
HPV test – karcinom děložního hrdla – prekanceróza – p16/Ki67 – screening
ÚVOD
Téměř všechny karcinomy děložního hrdla jsou způsobeny perzistentní infekcí onkogenními genotypy lidských papilomavirů (human papillomavirus, HPV) [1, 2, 5]. Znalosti o etiopatogenezi a přirozeném vývoji karcinomů děložního hrdla však z této malignity činí jedno z nejlépe odvratitelných onkologických onemocnění. Unikátní jsou již možnosti primární prevence, která disponuje profylaktickými vakcínami proti nejčastějším genotypům HPV. Jenom díky vakcinaci HPV-naivní kohorty je tak možno zabránit vzniku 70–92 % případů karcinomů děložního hrdla [10]. Nedílnou součástí prevence je i organizovaný screening, jehož cílem je detekce závažných prekanceróz děložního hrdla a jejich další management. Při kombinaci obou postupů je teoreticky možné uvažovat o eradikaci karcinomu děložního hrdla. Efektivita preventivních postupů je však v prvé řadě podmíněna dostatečnou participací jedinců v cílových věkových skupinách a v případě screeningu pak navíc i metodikou s vysokou senzitivitou pro detekci závažných prekanceróz.
Všechny preventivní postupy jsou v České republice velmi dobře nastaveny. Pro kohortu HPV-naivních jedinců je mezi 13. a 14. rokem života k dispozici profylaktická vakcinace hrazená z prostředků veřejného zdravotního pojištění, pro všechny ženy je rovněž k dispozici screening, který je zakotven legislativně, metodicky i organizačně. Přestože incidence karcinomu děložního hrdla vykazuje klesající trend, absolutní hodnoty nových případů, a především počty pacientek, které každý rok na onemocnění zemřou, dosahují ve srovnání s vyspělými státy nepřiměřeně vysokých hodnot. Navíc je obtížné očekávat, že by stávající situace mohla v dohledné době doznat zásadního zlepšení. Podíl vakcinovaných každým rokem klesá a ročních screeningových kontrol se pravidelně účastní méně než 60 % cílové populace [3, 9, 10].
Zatímco navýšení podílu vakcinovaných lze dosáhnout pouze setrvalou edukací odborné i laické veřejnosti, efektivitu screeningu lze zlepšit zvýšením účasti cílové populace především mezi 25. a 65. rokem života a zapojením vysoce senzitivních testů s dlouhodobou negativní prediktivní hodnotou [5]. Snahy o navýšení účasti českých žen na ročních kontrolách ale trvale selhávají a málo účinným se ukázal i systém aktivního zvaní ze strany plátců zdravotní péče. Na druhou stranu při kalkulaci dvouletého nebo tříletého intervalu kontrol dosahuje účast více než 80 % [3, 9]. Úspěšnost cytologického screeningu je proto v našich podmínkách zjevně nedostatečná a zapojení senzitivnějšího testu s dlouhodobou negativní prediktivní hodnotou je strategií s nejvyšším potenciálem na další zlepšení výsledků. Podle Světové zdravotnické organizace by měl být takový test realizován minimálně ve věku 35 a 45 let, tedy v obdobích, kdy lze očekávat vysoký záchyt závažných prekanceróz s přímým dopadem na oploštění vrcholů výskytu invazivních karcinomů. V souvislosti s tím je proto Ministerstvem zdravotnictví České republiky od roku 2021 doporučeno zařadit do stávajícího systému screeningu testování HPV.
Cílem této práce je zhodnocení výsledků dvouletého sledování kohorty žen ve věku 35–36 a 45–46 let, které se účastní projektu LIBUŠE (Algoritmus pro screening karcinomu děložního hrdla v České republice s využitím detekce HPV DNA se selektivní HPV 16/18 genotypizací a speciálního cytologického barvení CINtec Plus), jehož cílem je ověřit účinnost společného vyšetření HPV DNA testu, cytologického stěru a speciálního cytologického barvení p16/Ki67 v rutinním screeningu žen ve věku vyšším než třicet let v České republice.
METODIKA
Ze všech žen zařazených do studie LIBUŠE byly vybrány pouze ty, kterým bylo v kalendářním roce při vstupu do studie 35–36 a 45–46 let. Při vstupním screeningovém vyšetření v některé z participujících dvanácti gynekologických ambulancí z celé České republiky byl pacientkám odebrán konvenční cytologický stěr a HPV DNA test (Cobas 4800, Roche Diagnostics). Vyšetření odebraných stěrů a testů proběhla v akreditovaných laboratořích AeskuLab Patologie, k.s., v souladu s doporučeními pro správnou klinickou praxi a návodem výrobce. Výsledky cytologického vyšetření byly hodnoceny podle klasifikace Bethesda 2014, výsledky HPV DNA testu byly hodnoceny jako: 1. negativní, 2. negativní pro HPV 16/18, ale pozitivní pro 12 dalších onkogenních genotypů (HPV 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 a 68) a 3. pozitivní pro HPV 16 a/nebo HPV 18 s nebo bez pozitivity jiných genotypů HPV.
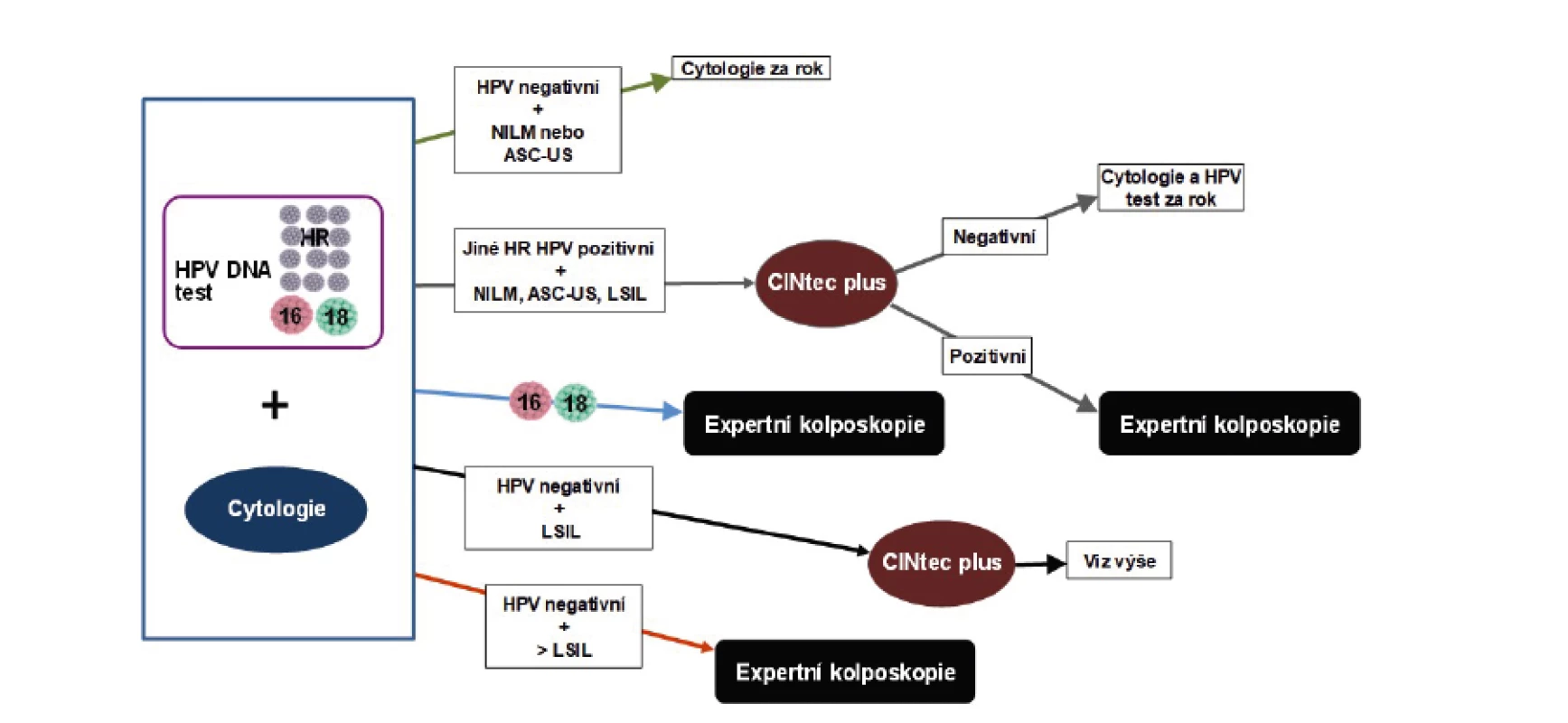
Ženy byly podle vstupních výsledků stratifikovány do tří úrovní rizika: 1. „nerizikové pacientky“ s normálním vstupním cytologickým vyšetřením a/nebo nálezem ASC-US a současně negativním HPV DNA testem byly sledovány v ročním intervalu; 2. „vysoce rizikové pacientky“ s HPV 16/18 pozitivitou bez ohledu na výsledek cytologického stěru a pacientky se „závažným“ cytologickým stěrem (ASC-H, HSIL, AGC-NEO, AIS, invazivní karcinom) byly bez ohledu na výsledek HPV DNA testu referovány k expertnímu kolposkopickému vyšetření; 3. „pacientky se střední mírou rizika“ s non-16/18 pozitivitou HPV bez ohledu na výsledek cytologického stěru, s non-16/18 pozitivitou HPV a cytologickým nálezem ASC-US a/nebo s mírnou cytologickou abnormitou (LSIL, AGC-NOS) bez ohledu na výsledek HPV testu měly provedeno imunocytochemické vyšetření p16/Ki67 (CINtec Plus, Roche Diagnostics). Pozitivně testované pacientky byly referovány k expertnímu kolposkopickému vyšetření. Pacientky, kterým byla biopticky verifikována jakákoliv prekanceróza (LSIL, low-grade skvamózní léze; HSIL, high-grade skvamózní léze nebo AIS, adenokarcinom in situ) nebo invazivní karcinom, byly považovány za „pozitivní případy“ a dále vyřazeny ze studie. Pacientky s abnormálními nálezy, ale bez průkazu onkologicky relevantní patologie byly dále kontrolovány cytologicky. Opakování HPV testu bylo indikováno v případě vstupní HPV DNA pozitivity nebo při cytologickém nálezu ASC-US nebo AGC-NOS. Postup při řešení cytologických abnormit se řídil doporučením Sekce pro cervikální patologii a kolposkopii ČGPS. Metodiku studie shrnuje obrázek 1. Všechny zařazené ženy podepsaly informovaný souhlas a práce byla schválena etickou komisí.
VÝSLEDKY
Do studie LIBUŠE bylo zařazeno celkem 2409 žen ve věkovém rozmezí 30–60 let. Z nich 352 (14,6 %) splnilo věkové kritérium a při vstupu do studie jim bylo 35–36 let (n = 164) a 45–46 let (n = 188). U 26 (7,4 %) žen byla zjištěna HPV DNA pozitivita, z toho u devíti (34,6 % z HPV pozitivních a 2,6 % z celého souboru) byla zjištěna pozitivita genotypů HPV 16/18. Závažná cytologická abnormita byly zjištěna pouze u jedné pacientky (0,3 %), která byla současně HPV pozitivní. Mírná cytologická abnormita byla zjištěna u 22 (6,3 %) pacientek, z toho 15 (68,2 %) žen bylo současně HPV pozitivních. Souhrn vstupních výsledků uvádí tabulka 1.
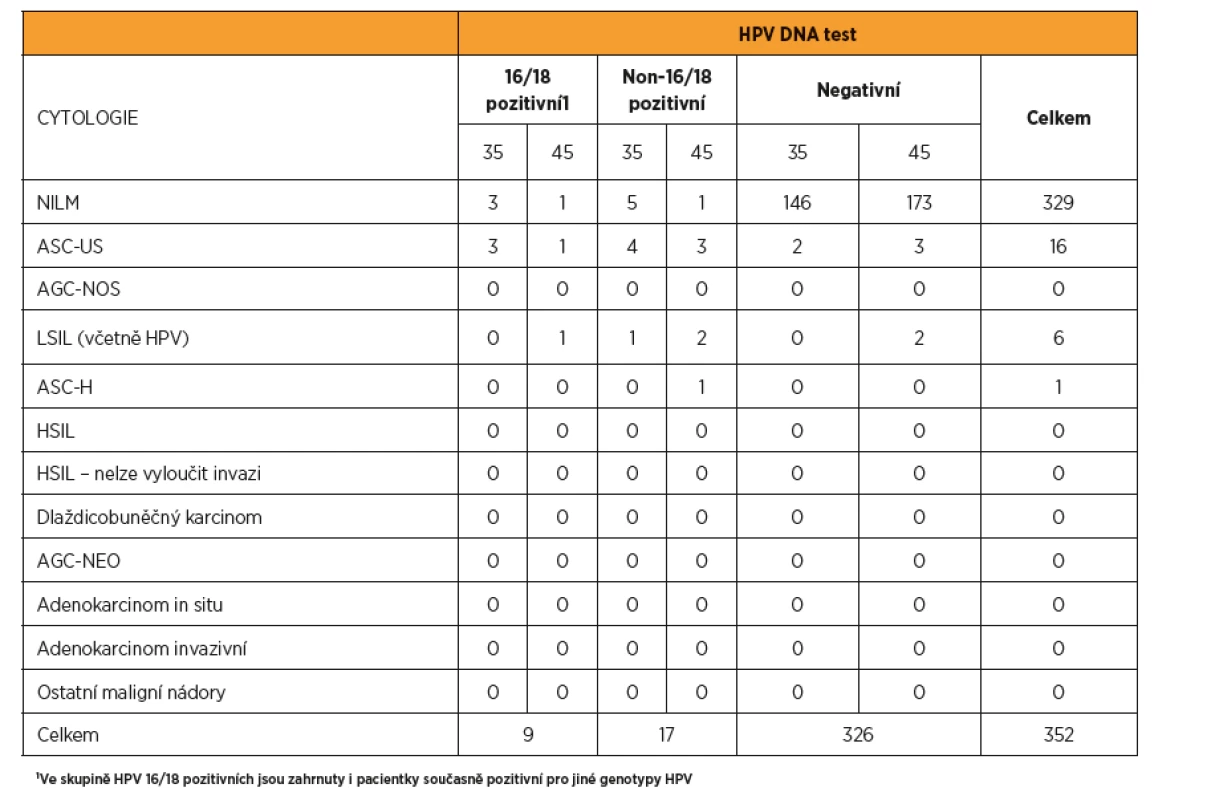
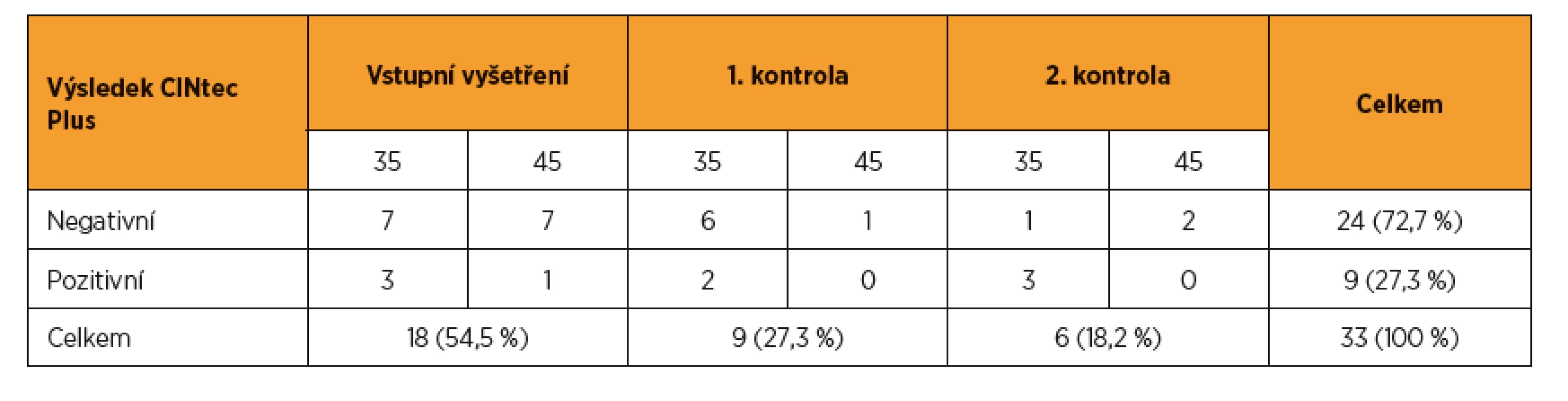
K expertní kolposkopii bylo primárně referováno deset (2,8 %) žen splňujících kritérium vysokého rizika. U dalších 18 pacientek ze skupiny se střední mírou rizika bylo doplněno barvení p16/Ki67 a čtyři pozitivně testované byly rovněž referovány k expertní kolposkopii. Při následujících dvou ročních kontrolách nebyla identifikována žádná nová pacientka splňující kritérium vysokého rizika, která by iniciálně neměla prokázánu HPV infekci. Při kontrole po roce však bylo navíc identifikováno devět pacientek středního rizika, při druhé kontrole po dalším roce bylo identifikováno dalších šest pacientek středního rizika. U všech bylo doplněno imunocytochemické barvení p16/Ki67. Pozitivní výsledek byl zjištěn u dvou pacientek po prvním roce a u tří pacientek po druhém roce sledování. Všechny pozitivně testované ženy byly referovány k expertní kolposkopii (tab. 2).
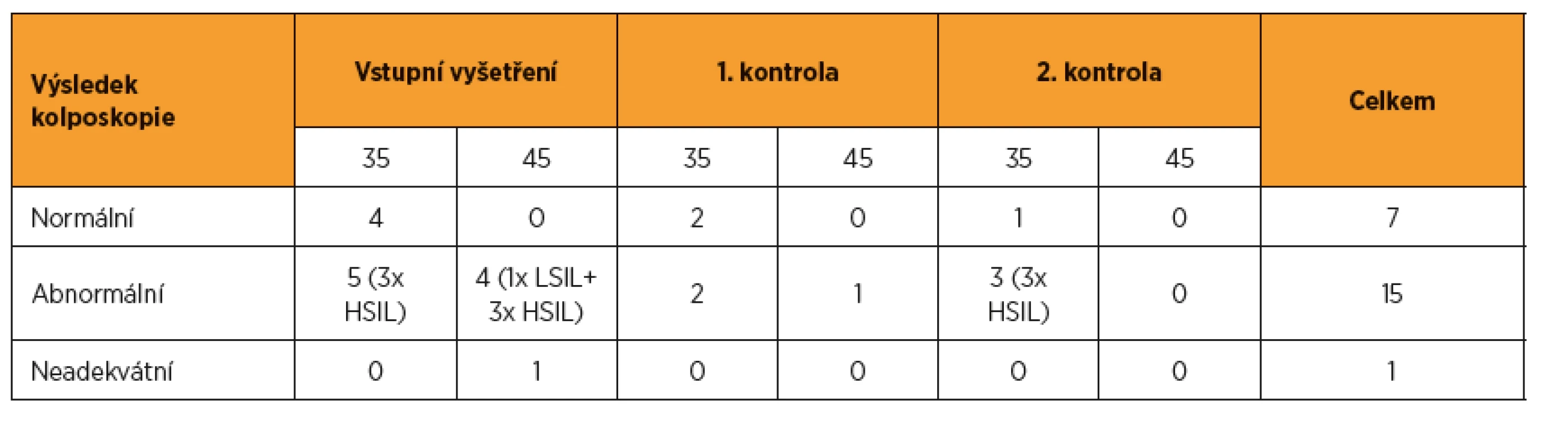
Po vstupním vyšetření bylo ke kolposkopii referováno 14 pacientek, u devíti byl zjištěn abnormální kolposkopický nález a odebrána biopsie. Prekanceróza (1x LSIL a 6x HSIL) byla prokázána u sedmi pacientek. Během dvouletého sledování bylo ke kolposkopii referováno dalších devět pacientek, u šesti byla kolposkopie abnormální a biopsie prokázala u tří pacientek prekancerózu (3x HSIL). Celkem tak byla za dobu sledování zjištěna prekanceróza u deseti pacientek (tab. 3). Všechny byly HPV pozitivní a pouze u jedné byla závažná cytologie. U žádné ze zařazených žen nebyl iniciálně ani během sledování zjištěn invazivní karcinom. Třebaže je patrný rozdíl ve frekvenci zjištěných prekanceróz díky HPV testu a díky cytologickému vyšetření, počty případů jsou nízké, protože analýza hodnotí pouze ženy vybraného věkového spektra, a neumožňuje tak stanovit statistickou významnost.
Během dalších dvou let sledování došlo u 13 z 26 (50,0 %) pacientek k eliminaci HPV infekce a v případě vstupní mírné cytologické abnormity i k normalizaci cytologického nálezu.
DISKUSE
V České republice jsou zavedeny všechny postupy, které by mohly významnou měrou snížit incidenci karcinomu děložního hrdla, narážejí však na řadu obtížně ovlivnitelných bariér, především na nízkou účast žen na screeningu a na pokles vakcinace HPV-naivní populace. V současnosti je tak jediným dobře ovlivnitelným postupem pro snížení incidence doplnění cytologického screeningu o HPV DNA test. Díky jeho vysoké citlivosti lze dosáhnout enormní spolehlivosti závěrů screeningu alespoň pro ženy, které se jej pravidelně účastní. Důležitost tohoto faktu vychází ze skutečnosti, že 24–32 % žen s diagnostikovaným karcinomem děložního hrdla bylo podle literárních údajů pravidelně vyšetřováno [9]. Česká data o frekvenci karcinomů ve screenované populaci sice chybějí, ale odhadované údaje se od zahraničních pravděpodobně liší jen minimálně [13].
Náš soubor zahrnoval pouze ženy, které se screeningu pravidelně účastní, přesto byla již po prvním screeningovém kole zjištěna díky kombinaci HPV DNA testu a cytologického stěru u šesti pacientek závažná prekanceróza, zatímco cytologický stěr prokázal pouze jedinou. Důležitým faktem navíc je, že pacientka se závažnou cytologickou abnormitou (ASC-H) byla současně HPV pozitivní. Další tři pacientky se závažnou prekancerózou byly diagnostikovány v průběhu následujících dvou let díky metodice, která zohledňuje při sledování stratifikaci rizika podle vstupních vyšetření. Všechny pacientky se zjištěnou prekancerózou byly HPV pozitivní, a za celou dobu sledování tak nebyl zaznamenán žádný případ falešné negativity HPV testu. Ještě důležitější je, že prekanceróza byla zjištěna i u osmi HPV pozitivních pacientek s normálním vstupním cytologickým nálezem nebo s nálezem ASC-US. Signifikantně vyšší citlivost HPV testu pro diagnostiku závažných prekanceróz již doložila i řada zahraničních prací. Průměrný rozdíl citlivosti mezi cytologií a HPV testem v nich dosahoval 35,7 % ve prospěch HPV testu [10]. Minimálně tři randomizované prospektivní multicentrické studie, které zahrnovaly více než 200 tisíc pacientek, navíc potvrdily, že již v prvním kole dojde díky významně vyšší citlivosti HPV DNA testu k odhalení signifikantně vyššího podílu prekanceróz a invazivních karcinomů bez ohledu na to, zda je současně doplněn cytologický stěr, nebo nikoliv [7, 8, 12]. V italské randomizované studii, kde pacientky podstoupily během šesti let sledování dvě kola screeningového vyšetření, dokonce nebyl ve skupině žen sledovaných jen pomocí HPV testu zjištěn při druhém vyšetření už žádný případ invazivního karcinomu, zatímco ve větvi využívající tradiční cytologický stěr bylo zjištěno sedm nových případů [8].
Pro strategii třídění rizika pacientek je vhodné klasifikovat ženy do tří skupin tak, jak bylo realizováno v naší kohortě. U pacientek s nízkým rizikem, které byly iniciálně HPV negativní a měly normální cytologický nález nebo ASC-US, nebyla za celou dobu sledování odhalena žádná prekanceróza, a navíc u většiny z nich došlo již při roční kontrole k normalizaci cytologického nálezu. Naše data tak dokládají také vysokou efektivitu primárního třídění cytologického nálezu ASC-US pomocí HPV testu. Stejné závěry jsou doloženy i z analýzy dat rozsáhlé americké studie ATHENA, která ukázala, že HPV negativní pacientky s cytologií ASC-US mají minimální riziko (0,8 %) rozvoje závažné léze, identicky s HPV negativními pacientkami s normální cytologií [1, 2, 12].
Druhá skupina pacientek zahrnovala ženy s vysokým rizikem, které byly při vstupním vyšetření HPV 16/18 pozitivní a/nebo měly zjištěnou závažnou cytologickou abnormitu. Ve studovaném souboru tvořily HPV 16/18 pozitivní 2,6 % celé kohorty, zatímco závažná cytologická abnormita byla zjištěna jen u 0,3 %. V případě pozitivity HPV DNA testu je doplnění informace o přítomnosti HPV 16/18 způsobem, jak významně zvýšit specifitu testu. Díky selektivní genotypizaci je tak k expertní kolposkopii primárně referována skupina žen s nejvyšší pravděpodobností dosud neidentifikované závažné prekancerózy nebo karcinomu. Pravděpodobnost diagnostiky závažné léze dosahuje při cytologické negativitě, ale současné HPV 16/18 pozitivitě až 17,2 % a není ovlivněna pozitivitou nebo negativitou ostatních genotypů HPV. Naopak, i mírná cytologická abnormita může v případě současné HPV 16/18 pozitivity představovat významné navýšení rizika dosud nerozpoznané závažné prekancerózy. Podle studie ATHENA narůstá takové riziko na 31,5 % [1, 12]. V našem souboru bylo k expertní kolposkopii referováno devět žen s prokázanou pozitivitou HPV 16/18. U žádné nebyla současně zjištěna závažná cytologická abnormita, a přesto byla prekanceróza biopticky verifikována u pěti (55,6 %) případů.
Třetí skupinu tvořily ženy se střední mírou rizika. Byly to pacientky infikované jinými onkogenními genotypy HPV s normálním cytologickým nálezem nebo s nálezem ASC-US nebo pacientky s cytologickým nálezem LSIL nebo AGC-NOS s infekcí nebo bez infekce non-16/18 HPV. Asi u 3,0–8,6 % takových pacientek lze očekávat přítomnost dosud nerozpoznané prekancerózy nebo karcinomu [1, 2, 11]. Na druhou stranu podstatná část pacientek nemá žádný patologický nález a může být pouze sledována. Právě proto tato skupina představuje vhodný cíl pro využití citlivého třídicího testu. Referovat všechny ženy se středním rizikem primárně ke kolposkopii je možná strategie, ale povede přibližně ke zdvojnásobení počtu expertních kolposkopií [11, 12]. Je proto vhodnější referovat jen pacientky s lépe definovaným rizikem. V našem souboru jsme pro třídění využili duální imunocytochemické barvení prokazující biomarkery p16/Ki67. Podle recentních dat poskytuje duální barvení nejspolehlivější závěry při identifikaci biologicky aktivní léze u non-16/18 HPV pozitivních pacientek. Kromě toho jde dosud o jediný test, který se efektivně uplatní při třídění rizika u cytologického nálezu LSIL ve fertilním věku [4–6]. Při vstupním vyšetření a při první kontrole po roce byla frekvence pozitivity testu CINtec Plus shodně 22,2 % (4/18 respektive 2/9). Ve druhém roce dosáhla 50 %, ale příčinou byl nízký počet případů (3 z 6). Zajímavá byla vyšší potřeba využití testu u žen mladší věkové skupiny způsobená častějším zastoupením infekce non-16/18 HPV a také častějším nálezem mírné cytologické abnormity.
Dvouleté sledování pacientek zatím dokládá absolutní negativní prediktivní hodnotu společné HPV DNA a cytologické negativity. Doba sledování je ale pro možnost stanovit naše vlastní závěry nedostatečná. Z literatury je však zřejmé, že kohorta negativně testovaných žen reprezentuje populaci s mimořádně nízkým rizikem rozvoje závažné prekancerózy nebo invazivního karcinomu, jehož trvání je minimálně tři až pět let. V souboru 20 810 žen ve věku vyšším než 30 let se vstupní HPV DNA a cytologickou negativitou bylo riziko závažné prekancerózy a invazivního karcinomu po uplynutí deseti let pouze 0,8 % (0,6–1,1) [1].
Aktuálně zaváděná změna screeningu s provedením HPV DNA testu ve 35 a ve 45 letech tak umožňuje bezpečné prodloužení screeningového intervalu při negativitě obou vyšetření, a naopak zintenzivnění péče o ženy s cytologickou abnormitou a/nebo HPV DNA pozitivitou.
ZÁVĚR
Doplnění stávajícího cytologického screeningu o HPV DNA test se selektivní genotypizací HPV 16/18 umožňuje významnou měrou zvýšit citlivost a bezpečnost našeho cervikálního screeningového programu. Již po vstupním vyšetření bylo díky pozitivitě HPV DNA testu detekováno více závažných prekanceróz, než by bylo zjištěno samostatným cytologickým vyšetřením. Kromě toho umožňuje nová strategie identifikovat pacientky se střední mírou rizika, u kterých se jako efektivní třídicí test uplatnilo duální barvení stanovující markery p16/Ki67. Nejzásadnější je ale značné navýšení bezpečnosti a předpoklad dlouhodobé negativní predikce v případě současného negativního cytologického vyšetření a negativity HPV DNA testu. Naše data tak podporují předpoklad, že od inovace národního screeningu lze očekávat nejen vyšší přesnost závěrů screeningových vyšetření, ale především přímý dopad na incidenci a mortalitu karcinomu děložního hrdla v České republice.
Poděkování
Velký dík patří všem dvanácti spolupracujícím gynekologickým ambulancím, které v rámci protokolu zajišťují péči o zařazené pacientky.
prof. MUDr. Jiří Sláma, Ph.D.
Gynekologicko-porodnická klinika
VFN a 1. LF UK
Apolinářská 18
128 00 Praha 2
e-mail: Jiri.Slama@vfn.cz
Sources
1. Khan, MJ., Castle, PE., Lorincz, AT., et al. The elevated 10-years risk of cervical precancer and cancer in women with human papillomavirus (HPV) type 16 or 18 and the possible utility of type-specific HPV testing in clinical practice. J Natl Cancer Inst, 2005, 20, 97(14), p. 1072–1079.
2. Kjaer, SK., Frederiksen, K., Munk, C., Iftner, T. Long-term absolute risk of cervical intraepithelial neoplasia grade 3 or worse following human papillomavirus infection: role of persistence. J Natl Cancer Inst, 2010, 102, p. 1478–1488.
3. Májek, O., Dušek, L., Dvořák, V. Výsledky screeningu karcinomu hrdla děložního v ČR. Ústní sdělení, 12. konference Sekce kolposkopie a cervikální patologie ČGPS ČLS JEP, Orea Hotel Pyramida, Praha, 29. 11.–1. 12. 2019.
4. McMenamin, M., McKenna, M., McDowell, A. Clinical utility of CINtec PLUS Triage in Equivocal Cervical Cytology and Human Papillomavirus Primary Screening. Am J Clin Pathol, 2018, 24, 150(6), p. 512–521.
5. Meijer, CJ., Berkhof, J., Castle, PE., et al. Guidelines for human papillomavirus DNA test requirements for primary cervical cancer screening in women 30 years and older. Int J Cancer, 2009, 124, p. 516–520.
6. Petry, KU., Schmidt, D., Scherbring, S., et al. Triaging Pap cytology negative, HPV positive cervical cancer screening results with p16/Ki-67 Dual-stained cytology. Gynecol Oncol, 2011, 1, 121(3), p. 505–509.
7. Rijkaart, DC., Berkhof, J., Rozendaal, L., et al. Human papillomavirus testing for the detection of high-grade cervical intraepithelial neoplasia and cancer: final results of the POBASCAM randomised controlled trial. Lancet Oncol, 2012, 13(1), p. 78–88.
8. Ronco, G., Dillner, J., Elfström, KM., et al. International HPV screening working group. Efficacy of HPV-based screening for prevention of invasive cervical cancer: follow-up of four European randomised controlled trials. Lancet, 2014, 8, 383(9916), p. 524–532.
9. Sehnal, B., Sláma, J. Jak dále ve screeningu karcinomu děložního hrdla? Čes Gynek, 2020, 85(4), s. 236–243.
10. Sheikh, S., Biundo, E., Courcier, S., et al. A report on the status of vaccination in Europe. Vaccine, 2018, 9, 36(33), p. 4979–4992.
11. Whitlock, EP., Vesco, KK., Eder, M., et al. Liquid-based cytology and human papillomavirus testing to screen for cervical cancer: a systematic review for the U.S. Preventive Services Task Force. Ann Intern Med, 2011, 15, 155(10), p. 687–697.
12. Wright, TC. Jr, Behrens, CM., Ranger-Moore, J., et al. Triaging HPV-positive women with p16/Ki-67 dual-stained cytology: Results from a sub-study nested into the ATHENA trial. Gynecol Oncol, 2017, 144(1), p. 51–56.
13. Wright, TC., Stoler, MH., Behrens, CM., et al. Primary cervical cancer screening with human papillomavirus: end of study re-sults from the ATHENA study using HPV as the first-line screening test. Gynecol Oncol, 2015, 136(2), p. 189–197.
14. www.svod.cz
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2020 Issue 6
-
All articles in this issue
-
Importance of addition of HPV DNA testing to the cytology based cervical cancer screening and triage of findings with p16/Ki67 immunocytochemistry staining in 35 and 45 years old women
LIBUSE trial data analysis - A model for predicting unscheduled caesarean section in nulliparae
- Total laparoscopic hysterectomy – clinical comparison of the method using two types of uterine manipulators
- Preeclampsia-associated homeostasis changes in pregnant woman after ART
- Laparotomic myomectomy of a spontaneous perforated leiomyoma mimicking pseudomyxoma peritonei at 27 weeks of pregnancy
- Immunological principle of development of red blood cell alloimmunization in pregnancy, hemolytic disease of the fetus and prevention of RhD alloimmunization in RhD negative women
- Idiopathic polyhydramnios
- Prenatal care for woman after fertility-sparing surgery for cervical cancer
- Conservative treatment options for polycystic ovary syndrome: the importance of exercise
-
Mythology and rational explanation in the history of medicine
The case of molar pregnancy - Dienogest in the treatment of endometriosis
- Anti-Nairobi: A Statement against the Nairobi Statement
- Suplementace vitaminem D a kalciem – význam v gynekologii
- NEKROLOG
-
Importance of addition of HPV DNA testing to the cytology based cervical cancer screening and triage of findings with p16/Ki67 immunocytochemistry staining in 35 and 45 years old women
- Czech Gynaecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Idiopathic polyhydramnios
- Total laparoscopic hysterectomy – clinical comparison of the method using two types of uterine manipulators
- Dienogest in the treatment of endometriosis
-
Importance of addition of HPV DNA testing to the cytology based cervical cancer screening and triage of findings with p16/Ki67 immunocytochemistry staining in 35 and 45 years old women
LIBUSE trial data analysis