Nový nástroj pro personalizaci ovariální stimulace: výsledky studie CERES při použití nového gonadotropinu – folitropinu delta
A new instrument to personalize ovarian stimulation: results of the CERES study after using a novel gonadotropin – follitropin delta
: Objective: The aim of the study CERES (CzEch REkovelle real life Study) was to gather experience with the use of a novel gonadotrophine, to evaluate the efficacy of follitropin delta in Czech clinical settings and to compare our results with the clinical trial ESTHER-1. Methods: Individualized follitropin delta daily dose in µg based on the patient’s anti-Müllerian hormone (AMH) level and body weight (AMH < 15 pmol/ L: 12 µg/ d; AMH > 15 pmol/ L: 0.10–0.19 µg/ kg/ d; max. 2 µg/ d). Results: A total of 85 women (aged 24–42 years) was included in the study. The average patient’s age was 32.9 years, the average body weight was 67.8 kg, and the mean level of AMH was 23.2 pmol/ L. There were initiated 85 controlled ovarian stimulations with follitropin delta and 84 egg collections. Forty patients (47%) had optimal number of retrieved eggs (8–14), 75 patients (88%) had embryotransfer, 10 patients (12%) had no embryo suitable for transfer, 65 patients had single embryo transfer and 10 patients had 2 embryos for transfer. There were reported 37 clinical pregnancies (43.5% cPR – clinical pregnancy rate), 30 live births (35.3% LBR – live birth rate), 3 (3.5%) early moderate ovarian hyperstimulation syndroms (OHSS) and no hospitalization due to the treatment. Conclusion: Individualized ovarian stimulation optimizes ovarian response, maintains treatment efficacy and improves safety by reducing OHSS incidence. The results of the Czech population study are fully comparable with the international, randomized, assessor-blinded trial ESTHER-1.
Keywords:
follitropin delta – controlled ovarian stimulation – anti-Müllerian hormone – ovarian response – ovarian hyperstimulation syndrome – personalized medicine
Authors:
Bagócsi T. 1; Rumpík D. 2; Křenek O. 2; Machač Š. 3; Vrublovský P. 3; Štěpán J. 4; Černý M. 5; Mardešićová N. 6; Dvořák J. 7; Višňová H. 8
Authors‘ workplace:
Reprofi t International s. r. o., Brno
1; Klinika reprodukční medicíny a gynekologie, Zlín
2; IVF Clinic a. s., Olomouc
3; Sanatorium Sanus, Hradec Králové
4; GENNET, s. r. o., Praha
5; PRONATAL Sanatorium, Praha
6; PRONATAL Kolín
7; IVF Cube SE, Praha
8
Published in:
Ceska Gynekol 2021; 86(2): 86-92
Category:
Original Article
doi:
https://doi.org/10.48095/cccg202186
Overview
Cíl: Cílem studie CERES (CzEch REkovelle real life Study) bylo shromáždit první zkušenosti s užíváním zcela nového gonadotropinu, vyhodnotit účinnost folitropinu delta v běžné české klinické praxi a srovnat získané výsledky s výstupy studie ESTHER-1. Metodika: Ovariální stimulací individualizovanou denní dávkou folitropinu delta v mikrogramech na základě hladiny antimüllerického hormonu (AMH) a tělesné hmotnosti pacientky (AMH < 15 pmol/ l: fixní dávka 12 µg/ d; AMH > 15 pmol/ l: 0,10–0,19 µg/ kg/ d; max. 12 µg/ d). Výsledky: Celkem bylo zařazeno 85 pacientek ve věku 24–42 let, průměrný věk 32,9 let, průměrná tělesná hmotnost 67,8 kg, průměrná hodnota AMH 23,2 pmol/ l. Bylo zahájeno 85 kontrolovaných ovariálních stimulací s folitropinem delta a 84 odběrů vajíček. U 40 pacientek (47 %) byl optimální zisk počtu vajíček (8–14), 75 pacientek (88 %) mělo embryotransfer, 10 (12 %) nemělo embryo vhodné k transferu. U 65 pacientek byl proveden single embryo transfer, u 10 byla transferována dvě embrya. Počet klinických gravidit byl 37 (43,5 % cPR – clinical pregnancy rate), počet porodů živého bylo plodů 30 (35,3 % LBR – live birth rate). Byly hlášeny tři (3,5 %) časné ovariální hyperstimulační syndromy (OHSS) mírného typu. Hospitalizace související s léčbou byla 0. Závěr: Individualizace ovariální stimulace vede k optimalizaci ovariální odpovědi a při zachování účinnosti zvyšuje bezpečnost léčby cestou snížení incidence OHSS. Výsledky získané u české populace jsou zcela srovnatelné s výstupy velké mezinárodní randomizované zaslepené klinické zkoušky ESTHER-1.
Klíčová slova:
folitropin delta – řízená ovariální stimulace – antimülleriánský hormon – ovariální odpověď – ovariální hyperstimulační syndrom – personalizovaná medicína
Úvod
Používání gonadotropinů je nedílnou součástí asistované reprodukce. První účinné látky byly ještě zvířecího původu (PMSG – pregnant mare serum gonadotropin) neboli gonadotropin izolovaný z krve těhotné klisny a jejich první léčebná aplikace – v tomto případě za účelem indukce ovulace – je zaznamenána koncem 30. let minulého století [1]. Od té doby udělal vývoj folitropních léků obrovský pokrok. Zvířecí preparáty byly vystřídány lidskými urinárními produkty, které byly od roku 1995 postupně nahrazovány léky vznikajícími rekombinantní technikou [2]. Každá nová generace gonadotropinu zlepšila konzistenci a účinnost léku, snížila vedlejší účinky, a tím zvýšila bezpečnost a pohodlnost aplikace pro pacienta. V poslední jmenované skupině, ve skupině tzv. rekombinantních FSH (folikuly stimulující hormon) preparátů, se nachází několik představitelů: folitropin alfa, folitropin beta a corifolitropin alfa. Všechny tyto folitropní hormony spojuje rekombinantní produkce na zvířecích buněčných liniích – na tzv. CHO-buňkách (chinese hamster ovary cell line – ovariální buňky čínského křečka) [3]. Nový gonadotropin – folitropin delta – se odlišuje od všech předchozích rekombinantních FSH preparátů především v tom, že vzniká na lidských buněčných liniích PER.C6 (kultura fetálních retinálních buněk) [4]. A právě samotná vektorová buňka provádějící tvorbu molekuly FSH zodpovídá i za následnou posttranslační modifikaci vzniklého proteinu – v případě FSH se jedná o důležitý proces glykosylace. Druh glykosylace rozhoduje o biologické dostupnosti daného proteinu, především určuje afinitu k receptoru a poločas eliminace s clearence, ale také ovlivňuje imunologické vlastnosti a potenciální imunogenecitu proteinu [5]. CHO-buňky obsahují jen á2,3 sialyltransferázy, který je podobný, nikoli však identický s glykosylačním procesem v lidských buňkách. Folitropin delta (Rekovelle®, Ferring Pharmaceuticals) je první lidský rekombinantní FSH s původem v humánních buňkách, jejichž glykosylační profil zcela odpovídá tomu lidskému (obsahují á2,3, á2, i á2,8 sialyltransferázy). Díky tomu je finální FSH více glykosylován (má vyšší aciditu), in vivo dosahuje vyšších sérových hladin, má nižší clearence a především vykazuje vyšší biologickou aktivitu (tzn. folikulární růst, hladina estradiolu a inhibinu B) při podání ekvivalentní dávky například ve srovnání s folitropinem á [6].
Folitropin delta a personalizovaná medicína
Cílem kontrolované ovariální stimulace (COS) s následným přenosem čerstvého embrya (tzv. fresh IVF cycle) je dosažení optimální ovariální odpovědi, zisku optimálního počtu vajíček, při současné minimalizaci rizika vzniku ovariálního hyperstimulačního syndromu (OHSS). Retrospektivní analýzy čerstvých IVF cyklů, při kterých byly hodnoceny počty živě narozených dětí (LBR) a vzniklých OHSS na počet získaných oocytů, ukazují, že LBR od 15 získaných vajíček již dál nestoupá (dokonce začíná mírně klesat) na rozdíl od OHSS, u něhož riziko vzniku exponenciálně roste při počtu vajíček > 15 (graf 1) [7]. Opačným nežádoucím výsledkem COS je špatná odpověď na ovariální stimulaci (tzv. POR pacientky – poor ovarian responders) a zisk příliš nízkého počtu vajíček. Tyto pacientky s nedostatečnou ovariální odpovědí jsou od roku 2016 rozlišovány v tzv. klasifikaci POSEIDON [8]. Nejhorší prognózu, a tudíž i nejnižší LBR, mají pacientky se ziskem vajíček < 4. Nejen autoři práce POSEIDON zdůrazňují existenci ještě další skupiny pacientek s tzv. suboptimální odpovědí na stimulaci (SR – suboptimal responders), kde zisk 4–9 vajíček je taktéž asociován s nižší LBR ve srovnání s optimální ovariální odpovědí [9]. Principem personalizované medicíny a individualizované COS je snaha o dosažení výše uvedeného optimálního terapeutického okna. K tomu slouží různé biomarkery a diagnostické postupy, které mají za úkol co nejpřesněji předpovídat ovariální odpověď na stimulaci. Mezi takové biomarkery můžeme řadit např. sérové hodnoty antimüllerického hormonu (AMH), hodnotu FSH v časné folikulární fázi cyklu, bazální hladiny estradiolu nebo inhibinu B. Z ultrazvukových markerů to mohou být AFC (antral follicle count), ultrazvukový objem ovarií či doppler-score ovarií, ale také bychom zde mohli zařadit věk, hodnotu BMI (body mass index) nebo kuřáctví. Ze všech uvedených stratifikačních modalit je AMH považován v současnosti za nejrobustnější prediktivní marker ovariální reakce na gonadotropiny (funkční ovariální rezervy) a jeho hodnota nejvíc koreluje s počtem získaných oocytů [10–12]. Během farmakokinetických testů folitropinu delta byla prokázána inverzní korelace mezi tělesnou hmotností a sérovými hladinami exogenního FSH s přímým negativním dopadem na folikulární růst. S narůstající tělesnou hmotností totiž proporčně narůstá distribuční objem a množství extracelulární tekutiny, do níž se FSH po podání distribuuje [13]. Z tohoto důvodu bylo nutné při vývoji personalizovaného dávkovacího algoritmu folitropinu delta brát do úvahy kromě AMH i hmotnost pacientky [14]. Klinická validace popsaného výpočetního algoritmu dávky nového gonadotropinu byla ověřena v rámci mezinárodní multicentrické randomizované noninferioritní studie ESTHER-1 na 1 329 ženách podstupujících IVF [15]. Cílem této klinické zkoušky bylo srovnat účinnost a bezpečnost individualizovaně dávkovaného folitropinu delta vůči konvenčně dávkovanému folitropinu alfa. Studie ESTHER-1 prokázala zcela srovnatelnou oPR (ongoing pregnancy rate) v obou skupinách, ale s přesnější cílovou ovariální odpovědí a s menším výskytem OHSS u individualizovaného dávkování. Folitropin delta je první a jediný gonadotropin na trhu s individuálním nastavením denní dávky FSH. Pro výpočet denní dávky v mikrogramech (místo obvyklých mezinárodních jednotek – IU) je nutné znát jak tělesnou hmotnost pacientky, tak hodnotu jejího AMH stanovenou přístrojem Roche Elecsys® AMH Plus. Na základě těchto údajů pak lze snadno stanovit množství denní dávky v mikrogramech díky různým výpočetním pomůckám (tabulka, „kolečko“, mobilní aplikace). Cílem naší studie CERES bylo shromáždit první zkušenosti s užíváním nového gonadotropinu, vyhodnotit účinnost folitropinu delta v běžné české klinické praxi a srovnat naše výsledky s výstupy studie ESTHER-1.
Graph 1. Percentage of OHSS (ovarian hyperstimulation syndrome) and live birth
by number of oocytes obtained from IVF (in vitro fertilisation), analysis of data
from 256,381 fresh IVF cycles in 2008–2010.

Soubor pacientek a metodika
Prospektivní, observační, neintervenční multicentrická studie CERES probíhala od prosince 2018 do srpna 2019. Výzkumu se účastnilo celkem osm center asistované reprodukce z celé České republiky (viz CERES studijní skupina). Zařazena mohla být jakákoli pacientka podstupující IVF/ ICSI léčbu (in vitro fertilisation / intracytoplasmic sperm injection), která byla starší 18 let, měla pravidelnou menstruaci, měla oba vaječníky a zahajovala stimulaci s folitropinem delta v prvním, v druhém nebo ve třetím za sebou jdoucím léčebním cyklu. Vyřazovacím kritériem byla buď přítomnost závažné endometriózy III. nebo IV. stupně, anebo kontraindikace podání přípravku dle platného SPC (souhrn údajů o přípravku). U každé zařazené pacientky bylo nutné stanovit její AMH přístrojem Roche Elecsys® AMH Plus a znát její aktuální tělesnou hmotnost. Dle těchto informací pak lékař stanovil denní dávku folitropinu delta v mikrogramech (Rekovelle®, Ferring Pharmaceuticals). Ovariální stimulace byla zahájena 2.–3. den menstruačního cyklu v GnRH (gonadotropiny uvolňující hormon) antagonistickém protokolu. Antagonista (cetrorelix acetát, Cetrotide 0,25 mg/ d, Merck Europe nebo ganirelix, Orgalutran 0,25 mg/ d, MSD) mohl být nasazen fixně od 6. dne cyklu nebo podle ultrazvukové kontroly při přítomnosti folikulů > 14 mm. Načasování spuštění folikulární maturace bylo ponecháno na zvyklostech a zkušenostech každého pracoviště a bylo provedeno s pomocí rekombinantního hCG (choriogonadotropin alfa, Ovitrelle 250 µg, Merck Europe). V případě hrozícího OHSS (> 25 folikulů větších než 12 mm) byl místo hCG aplikován analog GnRH (triptorelin-acetát, Diphereline 2× 0,1 mg, Ipsen Pharma nebo triptorelin-acetát, Decapeptyl 2× 0,1 mg, Ferring Pharmaceuticals). Lékařům byla ponechána i možnost cyklus zcela přerušit při přítomnosti > 35 rostoucích folikulů. Odběr vajíček proběhl 36 hod (± 2 hod) po podání hCG/ GnRH analogu. Embryotransfer byl plánován na 5. den po odběru. Počet embryí na transfer nebyl striktně určen. Vycházelo se z obecného doporučení pro SET (single embryo transfer). Přespočetná embrya se kryokonzervovala 5. nebo 6. den kultivace pro pozdější kryoembryotransfer. Standardní luteální podpora formou vaginálního progesteronu zahrnovala buď aplikaci utrogestanu 2× 400 mg (progesteron, Utrogestan 100 mg, Laboratoires Besins-International, Paříž), nebo podání Crinonu 1× denně (progesteron, Crinone 8% vaginální gel, Merck Praha) zahájené nejpozději od 1. dne po odběru vajíček. Těhotenský test nebo odběr na hCG byl doporučen 14 dní po provedeném transferu. Ultrazvukové potvrzení vitální gravidity bylo provedeno v 7.–8. týdnu gravidity. Následně byly pacientky ještě 2× kontaktovány s ohledem na vývoj těhotenství, jednou po uplynutí prvního trimestru a naposledy 4–6 týdnů po předpokládaném termínu porodu. Primárním cílovým ukazatelem studie CERES byl jednak počet celkově získaných vajíček, ale především podíl stimulací s ideálním ziskem oocytů (8–14). Sekundárními ukazateli byly jednak informace týkající se těhotenství – počet živých plodů (cPR) a počet živě narozených dětí (LBR – live birth rate) – a také údaje o délce léčby a o denních a celkových dávkách gonadotropinů použitých během stimulace a v neposlední řadě bezpečnostní ukazatele (počet pacientek s OHSS mírného stupně, počet preventivních opatření – tzv. freeze all postup, procento přerušených stimulací z důvodu OHSS závažného stupně a počet hospitalizovaných pacientek). Při finální analýze byly nakonec srovnávány všechny naše výstupy ze studie CERES s výsledky multicentrické, randomizované a zaslepené klinické zkoušky ESTHER-1, a to přesněji jen s podskupinou pacientek léčených právě folitropinem delta (n = 665).
Výsledky
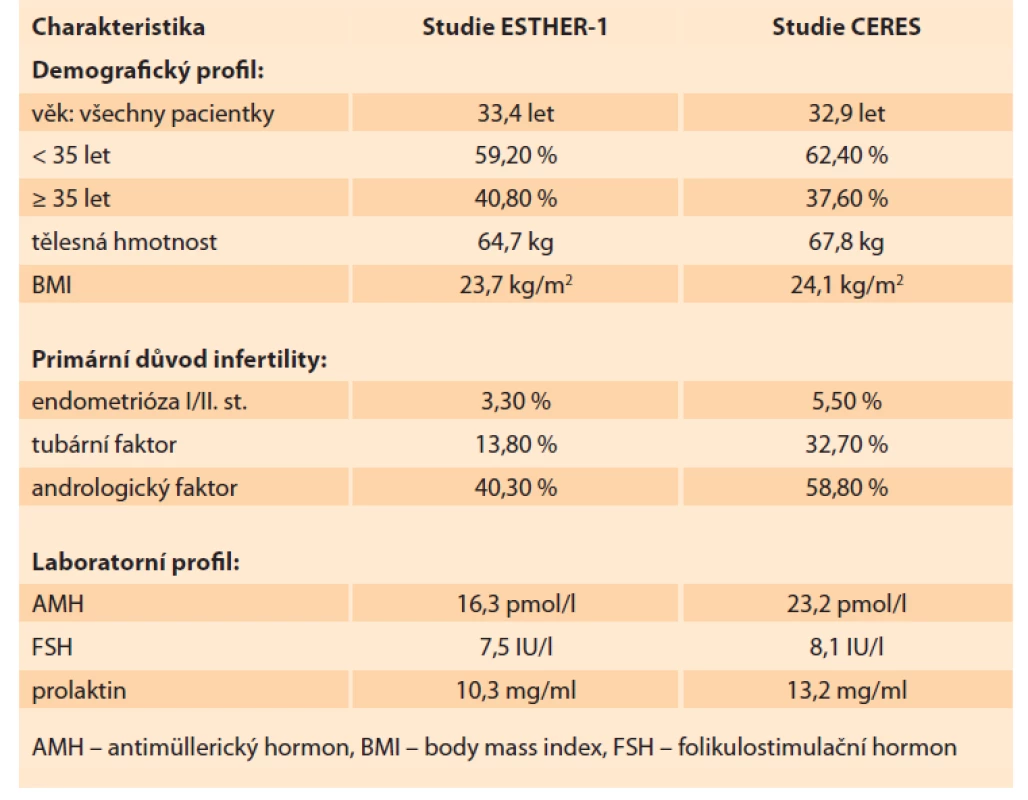
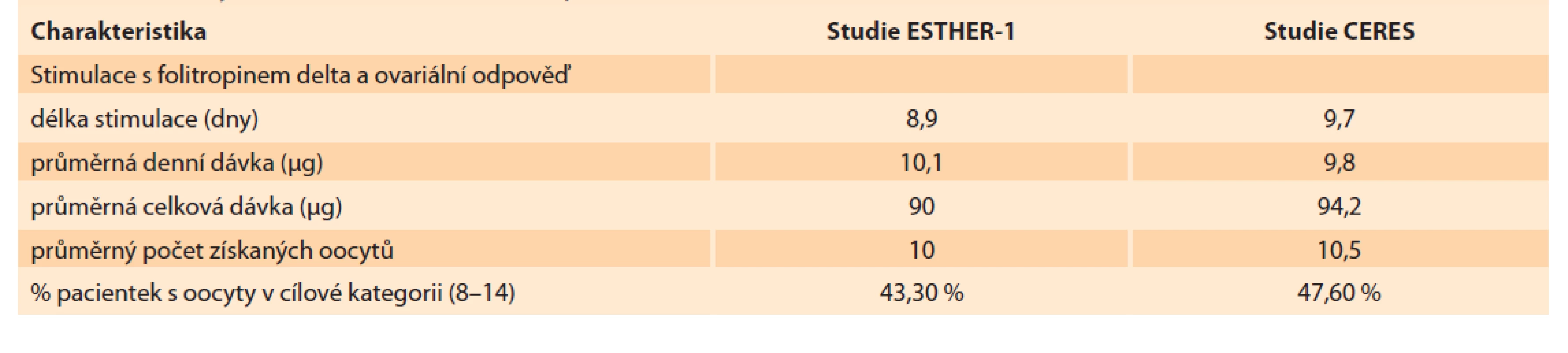
Pacientky byly přijímány do studie CERES v období od prosince 2018 do srpna 2019. Follow-up pacientek po porodu byl ukončen v srpnu 2020. Celkem bylo do studie zařazeno 85 pacientek z osmi různých center v ČR. Demografická charakteristika zařazených pacientek je uvedena v tabulce 1 spolu se srovnáním charakteristiky pacientek z ESTHER-1. Průměrný věk pacientek ve studii CERES byl 32,9 let. Z toho podíl pacientek > 35 let byl 37,6 %. Průměr tělesné hmotnosti byl o 3,1 kg vyšší v CERES (67,8 kg). Nejčastější příčinou neplodnosti byl andrologický faktor (58,8 %) následovaný tubárním faktorem (32,7 %) a faktorem ovariálním (5,5 %). Podíl primární sterility byl 62,4 %. V laboratorním profilu pacientek je výrazně vyšší průměrná hodnota AMH u českých pacientek (23,2 vs. 16,3 pmol/ l) při srovnatelné hodnotě bazálního FSH (8,1 vs. 7,5 IU/ l). V tabulce 2 vidíme detailní srovnání průběhů stimulace spolu s výsledky odběru vajíček. Stimulace byla v českých podmínkách téměř o jeden celý den delší (8,9 vs. 9,7 dnů). Průměrná celková dávka folitropinu delta byla vyšší v CERES (94,2 µg) při nižší průměrné denní dávce (9,8 µg) než v ESTHER-1. Průměrný počet získaných oocytů v obou skupinách byl zcela srovnatelný (10,0 vs. 10,5 dnů). Procento pacientek s počtem vajíček v cílovém rozsahu 8–14 bylo v CERES o 4,3 % vyšší (43,3 vs. 47,6 %). Ze všech 85 pacientek, které zahájily stimulaci s folitropinem delta, podstoupilo odběr vajíček 84 (u jedné pacientky byla z nemedicínských důvodů stimulace přerušena). Odběr vajíček podstoupilo 84 pacientek, rozsah počtu získaných vajíček byl 1–42. Rozsah počtu zralých oocytů MII byl 0–28 s průměrem 8,2. Podíl pacientek, které měly 5. den embryokultivace alespoň jedno kvalitní embryo k transferu, byl 88 % (n = 75). Zbývajících 12 % pacientek (n = 10) nemělo embryo vhodné na transfer. U 86,8 % transferů byl proveden tzv. single embryo transfer. Dvě embrya byla současně přenášena v 13,2 % případů. Průměrný počet kryokonzervovaných embryí byl 2,5 s rozsahem 0–22 blastocyst. Ze 75 provedených transferů vzniklo 37 klinických gravidit s akcí srdeční, což vyjadřuje 49,3% PR (pregnancy rate) na počet provedených transferů, a celkově to znamená 43,5% PR ze všech pacientek v CERES (pro srovnání v ESTHER-1 to bylo 31,7% PR z celkového počtu pacientek). Počet porodů byl 30, což odpovídá 35,3 % LBR za celý soubor CERES (v ESTHER-1 byl LBR 29,8 %). Celkový počet živě narozených dětí byl 32, počet gemini porodů byl dva (obě vícečetná těhotenství byla monozygotická, vzniklá po přenosu jen jedné blastocysty). Celkově bylo u čtyř pacientek získáno přes 25 oocytů, z toho u jedné dokonce 42. U třech pacientek byl hlášen mírný průběh časného OHSS bez další komplikace. Počet hospitalizovaných pacientek v souvislosti s léčbou byl 0. U žádné z pacientek nebyla přerušena stimulace z důvodu nedostatečné reakce na stimulaci nebo z důvodu hyperstimulace.
Tab. 1. Basic characteristics of the patients in the CERES group and comparison
with ESTHER-1 studies.
Tab. 2. Summary of stimulation results, comparison of CERES and ESTHER-1 fi les.
Diskuze
Po srovnání výsledků obou studií – studie CERES a studie ESTHER-1 – můžeme potvrdit, že IVF/ ICSI léčba pomocí aplikace nového individuálně dávkovaného gonadotropinu folitropinu delta založená na kalkulaci denní dávky FSH na základě výše AMH a tělesné hmotnosti je stejně účinná v běžné české klinické praxi, jako byla potvrzená její účinnost v 3. fázi klinického testování v rámci mezinárodní multicentrické zaslepené studie ESTHER-1. Výsledky obou studií jsou srovnatelné, avšak některé statistické rozdíly vyžadují detailnější prozkoumání. Cílem již zmíněného individualizovaného přístupu je získat u co nejvyššího počtu pacientek ideální počet oocytů, v našem případě 11 oocytů s rozsahem 8–14 oocytů. Tento výpočetní algoritmus individualizované denní dávky FSH byl vytvořen pomocí matematického modelování na základě výsledků studií z 2. fáze klinického testování během tzv. zkoušek zkoumajících dávku–odpověď [16]. Při vytvoření modelu bylo odhadnuto, že přibližně 42 % pacientek bude mít optimální zisk vajíček. V rámci studie ESTHER-1 to bylo 43 %, v naší studii dokonce 47,6 % pacientek dosáhlo optimálního zisku vajíček s průměrným ziskem 10,5 oocytů. Tento 4,6% rozdíl nelze ale považovat za statisticky významný vzhledem k tomu, že při našem počtu pacientek (n = 85) to odpovídá jen 3,6 pacientkám navíc. Co ale za statisticky významný rozdíl považovat lze, je délka samotné stimulace, která byla v české praxi o téměř jeden den delší (rozdíl 0,8 dní). O délce každé stimulace rozhoduje lékař provádějící ultrazvukovou folikulometrii individuálně u každé pacientky na základě toho, v jakém počtu a v jaké velikosti jsou přítomné folikuly na obou vaječnících, přičemž dbá na to, aby se stimulace neukončovala na „příliš malých folikulech“, kde by hrozil nižší zisk vajíček. Ovšem strategie ukončování stimulace a načasování podání tzv. triggeru (trigger injekce spouští konečné zrání, tzv. maturaci oocytů před odběrem, provádí se pomocí hCG nebo pomocí analogu GnRH) se liší nejen v závislosti na typu protokolu (agonistický vs. antagonistický), ale i podle země a pravděpodobně i podle kliniky, kde stimulace probíhá. Například v české odborné literatuře se podle Řežábka má ukončovat antagonistický protokol při přítomnosti jednoho vedoucího folikulu o velikosti 18 mm [17], na druhé straně (hranic) německá odborná literatura podle Dietricha et al doporučuje ukončovat antagonistickou stimulaci až při přítomnosti 2–3 folikulů o velikosti 17–18 mm [18]. V anglosaských učebnicích také nacházíme mírně odlišná doporučení. Například Brinsden doporučuje aplikace hCG při přítomnosti min. jednoho folikulu o velikosti 18 mm spolu s přítomností dalších dvou folikulů o velikosti alespoň 16 mm spojené s měřením hladiny estradiolu [19]. Ovšem Gardner kromě doporučení přítomnosti 2–3 folikulů o velikosti 17 mm v den triggeru popisuje navíc i možnost posunu aplikace hCG a samotného odběru vajíček o jeden celý den bez dopadu na PR, např. z důvodu ovlivnění pracovního nasazení o víkendu [20,21]. Pokud tedy uvážíme všechna fakta od rychlosti folikulárního růstu, který se pohybuje od 1 do 1,5 mm za den, přes diverzní strategie aplikace triggeru v praxi podle velikostí a počtu dominantních folikulů od 17–18 mm až po fakt, že posunutí aplikace hCG o jeden den v antagonistických protokolech nevede ke klinickým rozdílům, můžeme tvrdit, že naměřený rozdíl v délce stimulace sice vedl k vyšším nákladům na léky, vedl také k častějším folikulometriím, ale v konečném důsledku výsledek léčby – jak v počtu získaných vajíček, tak v cPR či v LBR – vůbec negativně neovlivnil. Toto tvrzení umocňuje i fakt, že v designu studie ESTHER-1 bylo explicitně doporučeno provést trigger a ukončit stimulaci již při přítomnosti tří folikulů o velikosti 17 mm, zatímco v CERES bylo ponecháno rozhodnutí o aplikaci hCG individuálně na každém lékaři. Také autor článku měl tendenci prodlužovat ovariální stimulace s folitropinem delta alespoň o jeden den z důvodu subjektivního pocitu menších přítomných folikulů během folikulometrií. Při vyšší celkové dávce FSH a při delší stimulaci pak vychází nižší průměrná denní dávka. Tato denní dávka folitropinu delta, jak již bylo uvedeno, byla vypočítávána dle algoritmu na základě AMH a tělesné hmotnosti. Průměrná hmotnost českých pacientek byla o 3,1 kg neboli o necelých 5 % vyšší než ve studii ESTHER-1, což by předpokládalo vyšší denní dávku, ale ta byla směrem dolů kompenzována především díky statisticky výrazně vyšším průměrným hodnotám AMH ve skupině CERES. Výrazný rozdíl hodnot AMH ve výši 6,9 pmol/ l (0,96 ng/ l) nelze čistě vysvětlit jen o necelý půlrok mladší kohortou pacientek ve prospěch české populace. Další z možných vysvětlení by mohl být i fakt, že do studie CERES byl, na rozdíl od studie ESTHER-1, zařazen menší počet pacientek se závažnou ovariální příčinou neplodnosti, jako jsou např. pacientky s POF (premature ovarian failure) nebo již zmíněné POR pacientky. V rámci CERES bylo totiž až 90 % příčin neplodnosti buď tubárního, nebo andrologického původu. Na druhé straně do studie ESTHER-1 nesměly být zařazeny pacientky s anovulačním typem PCO syndromu (neboli ženy, pro něž je typická několikanásobně vyšší hodnota AMH, než jakou mají ženy ve stejném věku bez PCO), kdežto anovulační stav ovarií nebyl vylučovacím kritériem v CERES (pouze samotná amenorea). Možná právě tyto rozdíly v selekci pacientek do studie CERES vysvětlují 11,8% rozdíl v PR a 5,5% rozdíl v LBR vůči studii ESTHER-1. Navíc přibývá důkazů o tom, že hodnota AMH předpovídá pravděpodobnost LBR nezávisle na věku ženy nebo na hodnotě bazální FSH, a právě ženy s nízkými až velmi nízkými hodnoty AMH mohou mít výrazně nižší šance na otěhotnění[22,23]. Povinný odběr a nutnost určení hodnoty AMH ne starší než 12 měsíců před plánovanou léčbou s folitropinem delta může mít pro pacientku i další přínos. Jak píše Mardešić, stanovení AMH určí nejen aktuální ovariální rezervu pacientky, ale také může posloužit jako diagnostika skrytého ovariálního selhání, můžeme díky němu predikovat menopauzu, ale především můžeme v některých případech zdůraznit naléhavost léčby [24]. Na druhou stranu, nutný odběr AMH, který není hrazen pojišťovnou, představuje vícenáklad (asi 600 Kč) pro pacientku podstupující již tak finančně nákladnou léčbu. Řešením by mohla být úhrada z veřejného zdravotnictví, tak jak je tomu např. na Slovensku. Další komplikací může být nutnost vyhledání takové laboratoře, která disponuje přístrojem Roche Elecsys® AMH Plus immunoassay, protože jen hodnoty zjištěné touto diagnostikou jsou validní pro kalkulaci denní dávky folitropinu delta. Je to z toho důvodu, že při všech studiích sloužících jak k vytvoření, tak k validaci výpočetního algoritmu denní dávky folitropinu delta byla použita jen uvedená laboratorní metoda. Rovněž je ale třeba dodat, že v současné době se jedná o nejpřesnější laboratorní metodu k určení hodnoty AMH s nejkonzistentnějšími výsledky [25,26]. V současné době neexistují žádné zkušenosti s aplikací folitropinu delta v GnRH agonistickém režimu, ať již v krátkém, nebo dlouhém agonistickém protokolu. Z toho důvodu může představovat povinná aplikace antagonistického protokolu při plánovaném použití folitropinu delta potenciální překážku pro kliniky nebo pro lékaře, kteří preferují protokoly jiného než antagonistického typu nebo s nimi mají více zkušeností. Zároveň ale může být tento způsob plánování ovariální stimulace spolu s jednoznačným a objektivním určením denní dávky FSH přínosem pro začínající nebo méně zkušené kolegy v oboru, kterým zjednoduší rozhodování ohledně správné dávky FSH pro danou pacientku. Ovariální hyperstimulační syndrom zůstává nadále jednou z nejobávanějších a nejzávažnějších komplikací ovariální stimulace [27]. Z toho důvodu je nutné (nejen) při zavádění nových postupů stimulací důkladně monitorovat a hlásit jak vzniklé OHSS, tak i symptomy hyperstimulace včetně zdravotních komplikací nebo nutných hospitalizací pacientek. V rámci studie ESTHER-1 bylo prokázáno, že individualizovaná dávka folitropinu delta má z hlediska bezpečnosti stimulace výhodu nad konvenční stimulaci s folitropinem alfa – vedla totiž celkově k nižšímu počtu OHSS, k menšímu počtu závažných průběhů OHSS, 3× méně pacientek bylo hospitalizováno a délka hospitalizace byla poloviční v případě folitropinu delta. Bylo potřeba i méně preventivních opatření. V rámci CERES byly celkově hlášeny tři pacientky s mírným průběhem časného OHSS, ale bez nutností hospitalizace. To odpovídá 3,5% incidenci (3/ 85) OHSS. V rámci ESTHER-1 bylo hlášeno časných OHSS 2,6 % (17/ 665) a celkový počet všech OHSS nezávisle na stupni závažnosti byl 23 z 665, což procentuálně vychází na 3,5 %. I přesto, že do studie CERES bylo zařazeno několikanásobně méně pacientek než v rámci studie ESTHER-1, se nám povedlo prokázat stejnou účinnost i bezpečnost ovariální stimulace s folitropinem delta v českých klinických podmínkách, tak jak tomu bylo v rámci studie ESTHER-1. S jistou dávkou opatrnosti můžeme tvrdit, že výstupy z ESTHER-1 jsou generalizovatelné i pro českou populaci. Jasnou limitací studie CERES zůstává relativně menší počet pacientek, chybějící údaje o kumulativních léčebných výsledcích, chybějící údaje o následných stimulacích a určitý nesoulad v příčinách neplodností zařazených pacientek vůči výzkumnému souboru.
Závěr
Personalizovaný přístup založený na biomarkerech při plánování kontrolované ovariální stimulace spolu s použitím nového a zatím jediného gonadotropinu lidského původu – folitropinu delta – vykazuje vysokou účinnost a výbornou bezpečnost pro pacientky podstupující IVF léčbu. Současná studie prokázala, že i v českých klinických podmínkách lze použitím individualizované denní dávky FSH dosáhnout optimálního zisku počtu vajíček spolu s velmi dobrou šancí na otěhotnění při současné minimalizaci rizika vzniku ovariálního hyperstimulačního syndromu. Všechny uvedené výsledky jsou navíc zcela srovnatelné s výstupy velké mezinárodní randomizované zaslepené klinické studie ESTHER-1, která srovnávala individualizovanou ovariální stimulaci vůči konvenční stimulaci. Domnívám se, že optimalizace ovariální odpovědi a minimalizace rizik spojené s ovariální stimulací by měly být jedním z nejdůležitějších aspektů při plánování léčby. Z toho důvodu si myslím, že individualizovaná léčba s folitropinem delta má svoje nezastupitelné místo na poli moderního IVF.
Doručeno/ Submitted: 16. 2. 2021,Přijato/ Accepted: 3. 3. 2021
MU Dr. Tomáš Bagócsi
Reprofit International s.r.o.,Hlinky 48/ 122,603 00 Brno-Pisárky
Publikační etika: Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Publication ethics: The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Konflikt zájmů: Autoři deklarují, že v souvislosti s předmětem studie/ práce nemají žádný konflikt zájmů.
Conflict of interests: The authors declare they have no potential conflicts of interest concerning the drugs, products or services used in the study.
Poděkování: Poděkování patří všem centrům a lékařům, kteří zařazovali své pacientky do studie CERES a následně se podíleli na sběru dat.Zvláštní díky patří zejména dr. Pavlu Otevřelovi, který mi byl při psaní této práce největší oporou a trpělivým rádcem.
Acknowledgmet:Thanks are due to all centers and physicians who included their patients in the CERES study and subsequently participated in data collection. Special thanks go especially to Pavel Otevřel, MD, who was my greatest support and patient advisor in writing this work.
Sources
1. Cartland GF, Nelson JW. The preparation and purification of extracts containing the gonad-stimulating hormone of pregnant mare serum. J Biol Chem 1937; 119(1): 59–67.
2. Howles CM. Genetic engineering of human FSH (Gonal-F). Hum Reprod Update 1996; 2(2): 172–191. doi: 10.1093/ humupd/ 2.2.172.
3. Leao RB, Esteves SC. Gonadotropin therapy in assisted reproduction: an evolutionary perspective from biologics to biotech. Clinics 2014; 69(4): 279–293. doi: 10.6061/ clinics/ 2014(04)10.
4. Cottingham I, Plaksin D, White RB. Recombinant Fsh including alpha 2,3 - and alpha 2,6-sialylation. World Intellectual Property Organization, Patent: WO 2009/ 127826 A1. 2009 [online]. Available from: https:/ / lens.org/ 199-058-359-047-42X.
5. Ulloa-Aguirre A, Timossi C, Damián-Matsumura P et al. Role of glycosylation in function of follicle-stimulating hormone. Endocrine 1999; 11(3): 205–215. doi: 10.1385/ ENDO:11 : 3:205.
6. Olsson H, Sandström R, Grundemar L. Different pharmacokinetic and pharmacodynamic properties of recombinant follicle-stimulating hormone (rFSH) derived from a human cell line compared with rFSH from a non-human cell line. J Clin Pharmacol 2014; 54(11): 1299–1307. doi: 10.1002/ jcph.328.
7. Steward RG, Lan L, Shah AA et al. Oocyte number as a predictor for ovarian hyperstimulation syndrome and live birth: an analysis of 256,381 in vitro fertilization cycles. Fertil Steril 2014; 101(4): 967–973. doi: 10.1016/ j.fertnstert. 2013.12.026.
8. Humaidan P, Alviggi C, Fischer R et al. The novel POSEIDON stratification of ‘low prognosis patients in assisted reproductive technology’ and its proposed marker of successful outcome. F1000Res 2016; 5 : 2911. doi: 10.12688/ f1000research.10382.1.
9. Drakopoulos P, Blockeel C, Stoop D et al. Conventional ovarian stimulation and single embryo transfer for IVF/ ICSI. How many oocytes do we need to maximize cumulative live birth rates after utilization of all fresh and frozen embryos? Hum Reprod 2016; 31(2): 370–376. doi: 10.1093/ humrep/ dev316.
10. La Marca A, Sighinolfi G, Radi D et al. Anti-Müllerian hormone (AMH) as a predictive marker in assisted reproductive technology (ART). Hum Reprod Update 2010; 16(2): 113–130. doi: 10.1093/ humupd/ dmp036.
11. Iliodromiti S, Anderson RA, Nelson SM. Technical and performance characteristics of anti-Müllerian hormone and antral follicle count as biomarkers of ovarian response. Hum Reprod Update 2015; 21(6): 698–710. doi: 10.1093/ humupd/ dmu062.
12. Vrublovský P. Hodnota AMH jako prediktor výsledku ovariální stimulace. Ceska Gynekol 2016; 81(1): 23–26.
13. Klein BM, Arce JC. Impact of body weight of IVF/ ICSI patients on the pharmacokinetics and pharmacodynamic responses to FE 999049, a recombinant FSH derived from a human cell-line. Hum Reprod 2014; 29(Suppl 1): i322.
14. Arce JC, Klein BM, Erichsen L. Using AMH for determining a stratified gonadotropin dosing regimen for IVF/ ICSI and optimizing outcomes. In: Seifer DB, Tal R (eds). Anti-Müllerian hormone: biology, role in ovarian function and clinical significance. USA: Nova Science Publishers 2016 : 83–102.
15. Nyboe Andersen A, Nelson SM, Fauser BC et al. Individualized versus conventional ovarian stimulation for in vitro fertilization: a multicenter, randomized, controlled, assessor-blinded, phase 3 noninferiority trial. Fertil Steril 2017; 107(2): 387–396. doi: 10.1016/ j.fertnstert.2016.10.033.
16. Arce JC, Nyboe Andersen A, Fernández-Sánchez M et al. Ovarian response to recombinant human follicle-stimulating hormone: a randomized, antimüllerian hormone-stratified, dose-response trial in women undergoing in vitro fertilization/ intracytoplasmic sperm injection. Fertil Steril 2014; 102(6): 1633–1640. doi: 10.1016/ j.fertnstert.2014.08.013.
17. Řežábek K. Asistovaná reprodukce. 2. vyd. Praha: Maxdorf 2014.
18. Diedrich K, Ludwig M, Griesinger G. Reproduktionsmedizin. Berlin: Springer Medizin 2013.
19. Brinsden PR. Textbook of in vitro fertilization and assisted reproduction: the Bourn Hall guide to clinical and laboratory practice. 3rd ed. London: Taylor & Francis 2005.
20. Gardner DK, Weissman A, Howles CM et al. Textbook of assisted reproductive techniques. 5th ed. Boca Raton: CRC Press 2018.
21. Gordon K, Levy MJ, Ledger W et al. Reducing the incidence of weekend oocyte retrievals in a rFSH/ GnRH antagonist protocol by optimizing the start day of rFSH and delaying human chorionic gonadotropin (hCG) by 1 day. Fertil Steril 2011; 95(4): S16.
22. Gleicher N, Weghofer A, Barad DH. Anti-Müllerian hormone (AMH) defines, independent of age, low versus good live-birth chances in women with severely diminished ovarian reserve. Fertil Steril 2010; 94(7): 2824–2827. doi: 10.1016/ j.fertnstert.2010.04.067.
23. Nelson SM, Yates RW, Fleming R. Serum anti-Müllerian hormone and FSH: prediction of live birth and extremes of response in stimulated cycles – implications for individualization of therapy. Hum Reprod, 2007; 22(9): 2414–2421. doi: 10.1093/ humrep/ dem204.
24. Mardešić T. Antimülleriánský hormon v moderní reprodukční medicíně. Gynekol Porod 2019; 3(4): 213–219.
25. Anderson RA, Anckaert E, Bosch E et al. Prospective study into the value of the automated Elecsys antimüllerian hormone assay for the assessment of the ovarian growing follicle pool. Fertil Steril 2015; 103(4): 1074–1080. doi: 10.1016/ j.fertnstert.2015.01.004.
26. Gassner D, Jung R. First fully automated immunoassay for anti-Müllerian hormone. Clin Chem Lab Med 2014; 52(8): 1143–1152. doi: 10.1515/ cclm-2014-0022.
27. Practice committee of the american society for reproductive medicine. Ovarian hyperstimulation syndrome. Fertil Steril 2008; 90(Suppl 5): S188–S193. doi: 10.1016/ j.fertnstert.2008.08.034
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2021 Issue 2
-
All articles in this issue
- Role of umbilical interleukin-6, procalcitonin and C-reactive protein measurement in the diagnosis of fetal inflammatory response syndrome
- A new instrument to personalize ovarian stimulation: results of the CERES study after using a novel gonadotropin – follitropin delta
- Results of treatment of gestational trophoblastic neoplasia in the Slovak Republic in the years 1993–2017
- Analysis of selected perinatological indicators in the Slovak Republic in the years 2007–2018
- Giant breast fibroadenoma in pregnancy
- Obstetric anal sphincter injury and anal incontinence
- Current possibilities in the prevention and therapy of ovarian hyperstimulation syndrome
- Quality of life and sexuality in women with urinary incontinence
- Fetal lower urinary tract obstruction: a current overview of intrauterine diagnosis and treatment
- Solved problems of reproductive medicine in the Czech Republic 2020
- Bloodless surgery and gynecological patients among Jehovah’s Witnesses
- Czech Gynaecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Current possibilities in the prevention and therapy of ovarian hyperstimulation syndrome
- Giant breast fibroadenoma in pregnancy
- Obstetric anal sphincter injury and anal incontinence
- A new instrument to personalize ovarian stimulation: results of the CERES study after using a novel gonadotropin – follitropin delta
