Vrozený srdeční blok plodu způsobený mateřskými autoprotilátkami anti-SSA/Ro a anti-SSB/La
Congenital heart block caused by maternal autoantibodies anti-SSA/Ro and anti-SSB/La
Neonatal lupus syndrome represents a model of passively acquired autoimmunity caused by specific maternal autoantibodies anti-SSA/Ro a anti-SSB/La, which cross the placenta and are associated with the development of congenital heart block in the fetus and/or a transient rash or various liver and blood cell abnormalites in the newborn. Complete form of congenital heart block is a permanent condition that entails significant morbidity, with nearly all affected infants requiring pacemakers. Perinatal mortality may aprroach up to 20 %. An intensive search is therefore ongoing for the specific etiopathophysiology and for diagnostic markers to approach and treat this disease.
Key words:
congenital heart block, neonatal lupus syndrome, autoantibodies anti-SSA/Ro a anti-SSB/La
:
M. Podrazil; J. Bartůňková; A. Šedivá
:
Ústav imunologie UK 2. LF a FN Motol, Praha
:
Čes. Revmatol., 16, 2008, No. 4, p. 163-168.
:
Overview Reports
Syndrom neonatálního lupusu představuje zajímavý model pasivně získaného autoimunitního onemocnění, u kterého sérum těhotných žen obsahuje specifické autoprotilátky anti-SSA/Ro a anti-SSB/La, které přecházejí placentou a jsou asociovány s možným vývojem vrozeného srdečního bloku plodu a/nebo přechodnými kožními změnami či různými jaterními a krevními abnormalitami u novorozenců. Kompletní vrozený srdeční blok je v současné době považován za ireverzibilní a má významnou morbiditu s nutností implantace trvalého kardiostimulátoru u postižených dětí v různém časovém období po porodu. Perinatální mortalita dosahuje až 20 %. Proto probíhá intenzivní výzkum se zaměřením na patofyziologii vzniku vrozeného srdečního bloku, hledání časných markerů k diagnostice ještě před jeho rozvojem a vhodných léčebných i profylaktických prostředků.
Klíčová slova:
vrozený srdeční blok, syndrom neonatálního lupusu, autoprotilátky
anti-SSA/Ro a anti-SSB/La
Úvod
Neonatální lupus erythematodes (NLE) představuje zajímavý model pasivně získaného auto-imunitního onemocnění, které se může vyvinout u plodů v důsledku transplacentárně přenesených mateřských autoprotilátek anti-SSA/Ro a anti-SSB/La. Matky mohou mít systémový lupus erythematodes (SLE), Sjögrenův syndrom (SS) a téměř v polovině případů jsou asymptomatické pouze s pozitivitou uvedených autoprotilátek. V průběhu těhotenství autoprotilátky gravidních žen přecházejí placentou a již časně v 11. gestačním týdnu (GT), když se nahromadí ve fetální cirkulaci, jsou asociovány právě s vývojem neonatálního lupusu. Stupeň postižení plodu je různý a manifestuje se kožními, jaterními a hematologickými klinickými projevy, které jsou přechodné a obvykle spontánně odezní 6–8 měsíců po porodu po vymizení přenesených mateřských autoprotilátek z dětské cirkulace. Trvalý vrozený srdeční blok (CHB) jako součást neonatálního lupusu má nejzávažnější klinický dopad (1).
Vrozený srdeční blok bez strukturálního postižení srdce je vzácné onemocnění s incidencí 1/ /15 000–1/20 000 porodů a je výhradně asociován s mateřskými autoprotilátkami proti SSA/Ro nebo SSB/La ribonukleoproteinům (2, 3). Vyvine se u 2–5 % plodů těhotných matek, které mají v séru pozitivitu autoprotilátek anti-SSA/Lo a anti-SSB/La (4). Riziko opětovného vzniku vrozeného srdečního bloku v následujícím těhotenství je přibližně 18 %. Více než 80 % případů CHB je diagnostikováno před 30. gestačním týdnem s největší incidencí mezi 18. a 24. týdnem na základě fetální bradykardie. CHB představuje významnou perinatální mortalitu okolo 20 %. Pokud je CHB spojen s následným rozvojem endokardiální fibroelastózy nebo dilatační kardiomyopatie, může být mortalita i vyšší. Více než 65 % z přeživších novorozenců vyžaduje implantaci kardiostimulátoru (5, 6).
V posledních letech se výzkum zaměřuje zejména na etiopatofyziologii a zároveň na nové klinické možnosti v diagnostice a léčbě CHB. Vzhledem k vysoké morbitidě a mortalitě CHB je třeba nalézt co nejpřesnější a nejspolehlivější (nejlépe neinvazivní) diagnostické markery vhodné k detekci časných, potenciálně reverzibilních známek CHB a profylaktickou léčbu, která by v tomto reverzibilním stadiu mohla zabránit definitivnímu poškození a jizvení převodního systému u plodů. Výzkum se zaměřuje zejména na profylaktickou léčbu matek, které již porodily dítě s vrozeným srdečním blokem.
Ačkoliv se léčba dexamethasonem v průběhu těhotenství se stala velice populární, výsledky nejsou zcela konklusivní a je třeba dokončit více studií na toto téma. Ty jsou však limitované bezpečností léčby v průběhu těhotenství, neboť představují potencionální mortalitu jak pro matku, tak pro plod.
Etiopatogeneze
Je všeobecně známo, že v rámci etiopatogeneze je pro vznik CHB nutný transplacentární přenos mateřských autoprotilátek anti-SSA/Ro a anti-SSB/La. Tuto skutečnost nejvíce objasnila Buyon et al. Novější práce přináší Salomonsson, která zároveň pomohla blíže identifikovat specifitu mateřských protilátek na 52 kd SSA/Ro, 60 kd SSB/Ro a 48 kd SSB/La. Nicméně vrozený srdeční blok se vyvine jen u 2–5% plodů matek s pozitivitou těchto autoprotilátek a riziko opětovného vzniku v následujícím těhotenství je kolem 18 %. Je proto zřejmé, že přítomnost autoprotilátek je nezbytná, avšak sama o sobě nedostačující pro vznik vrozeného srdečního bloku (7–10). Právě studie monozygotních dvojčat ukazuje na komplexnost vzniku CHB. Cooley s jeho kolektivem studovali soubor monozygotních dvojčat, která měla při narození podobné titry autoprotilátek anti-SSA/Ro a anti-SSB/La v pupečníkové krvi měřené nepřímou imunofluorescencí a ELISOU s výskytem CHB pouze u jednoho z dvojčat (11).
Proces, kterým mateřské autoprotilátky způsobují fibrózu převodního systému u plodu, není doposud přesně znám, přestože probíhá intenzivní výzkum v posledním desetiletí a existuje několik hypotéz.
Antigen SSA/Ro se skládá z 52 kDa proteinu (Ro52) a nehomologního 60 kDa proteinu (Ro60), zatímco antigen SSB/La je jednoduchý 48 kDa protein. Salomonsson a kol. z Karolinska institutu identifikoval autoprotilátky proti peptidu 200–239 (p200) z 52 kDa SSA/Ro antigenu jako klíčové v patogenezi a zároveň jako nejvýraznější specifický marker rizika vzniku vrozeného srdečního bloku. V prospektivní studii, ve které byla prováděna dopplerovská echokardiografie týdně v 18.–24. gestačním týdnu u Ro52 pozitivních matek s vyššími hodnotami anti-p200, měly plody signifikantně prodloužen atrioventrikulární převodní interval (12, 13).
V průběhu těhotenství autoprotilátky anti-SSA/Ro a anti-SSB/La přestupují placentou. Samotný patogenetický proces vzniku vrozeného srdečního bloku se děje ve dvou krocích.
Vzhledem k tomu, že antigeny SSA/Ro a SSB/La jsou intracelulární proteiny nebo protein-RNA komplexy, nemohou se mateřské autoprotilátky vázat přímo na tyto antigeny na povrchu fetálních kardiomyocytů. Mateřské autoprotilátky se proto váží na zkříženě reagující antigeny na kardio - myocytech. Uvažuje se o několika kandidátních molekulách. Jde zejména o α1C a α1D podjednotky L-typu kalciového kanálu, T-typu kalciového kanálu anebo atriálního seretoninergního 5-HT4 receptoru (14, 15).
V prvním kroku se tedy autoprotilátky anti-Ro52 vážou na zkříženě reagující epitopy na fetálních kardiomyocytech, deregulují kalciovou homeostázu s následnou indukcí apoptózy v postižených buňkách. Autoprotilátky anti-SSB/La se poté navážou na antigen SSB/La vystavený na povrchu apoptotických kardiomyocytů (16). Takto označené mrtvé buňky jsou fagocytovány makrofágy a to vede k následné produkci prozánětlivých a fibrotizujících cytokinů TNF a TGFß aktivovanými makrofágy. Zánětlivá odpověď mediovaná uvolněním zejména TGFß vyúsťuje k diferenciaci fibroblastů na myofibroblasty s postupnou fibrotizací, kalcifikací a irreverzibilním jizvením srdeční tkáně s klinickým výsledkem kompletního AV bloku III. stupně u geneticky citlivých plodů (17). Nyní přichází na řadu druhý krok v patogenezi vzniku CHB. Tím jsou fetální rizikové faktory, které způsobují, že pouze u některých plodů se vyvine CHB i přes přítomnost mateřských autoprotilátek anti-SSA/Ro a anti-SSB/La. U plodů s genetickou rezistencí vzniklý AV blok I. stupně spontánně regreduje. Naproti tomu u plodů s citlivými geny vniká AV blok II. anebo III. stupně s trvalým poškozením převodního srdečního systému a event. nutností implantace kardiostimulátoru. Ze studií vyplývá, že dva hlavní genetické faktory, které mají vliv u celé řady autoimunitních onemocnění, pohlaví a MHC, nemají význam v patogenezi vzniku CHB. Za hlavní faktor, týkající se genetického polymorfismu v procesu vzniku CHB, je považován polymorfismus genu pro transformující růstový faktor β (TGFβ), jehož vyšší produkce je asociována s profibrotizujícími vlastnostmi (1, 18) (obr. 1).
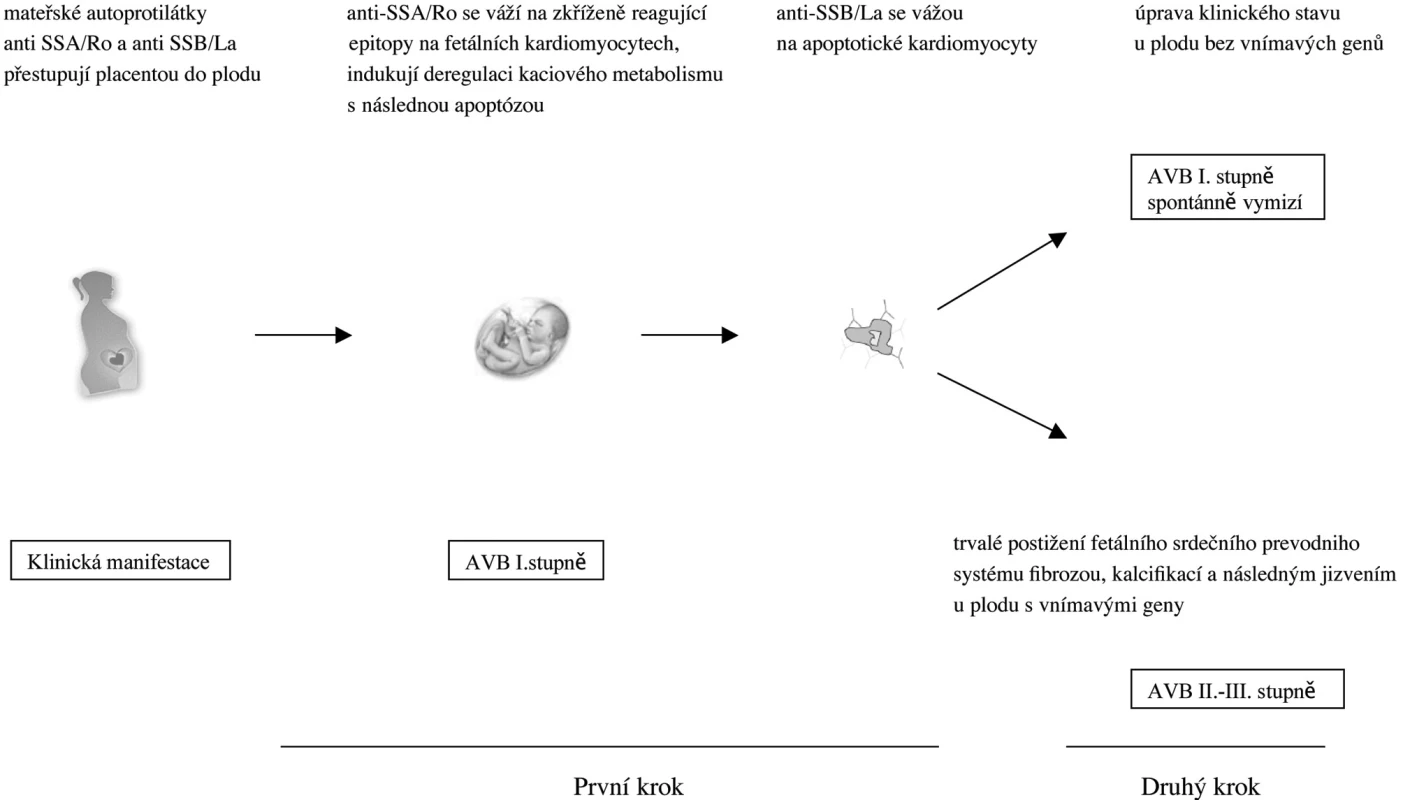
Choroby matek a jejich další vývoj
Výsledky vycházejí z národního amerického registru pro výzkum neonatálního lupusu (Research Registry for Neonatal Lupus = RRNL), který byl založen v září 1994 (19).
Matky jsou do tohoto registru zařazovány na základě pozitivity autoprotilátek anti-SSA/Ro nebo anti-SSB/La bez ohledu na jejich diagnózu. Do roku 2007 bylo zaregistrováno 321 matek a mnohé byly v době registrace asymptomatické či nesplňovaly kritéria konkrétního revmatologického onemocnění: 73 (23 %) matek bylo asymptomatických, 78 (24%) mělo nediferencované onemocnění pojiva (UCTD), 47 (15 %) mělo systémový lupus erythematodes (SLE), 70 (22 %) Sjögrenův syndrom (SS) a 53 (16 %) SLE/SS. Z původního souboru 321 jich bylo následně 229 (71 %) sledováno průměrně po dobu 6 let, kdy přibližně u poloviny z 51 zpočátku asymptomatických žen se po průměrném 3ročním sledování vyvinuly příznaky revmatologických onemocnění: 14 (27 %) mělo UCTD, 4 (2 %) SLE, 7 (14 %) SS a 1 SLE/SS. Z 56 s původní diagnozou UCTD se při sledování vyvinul u 7 SLE, 8 SS a u 4 SLE/SS.
Nejen z této, ale i z dalších studií vyplývá, že v období porodu dítěte s projevy NLS jsou matky nejméně ve 30 % asymptomatické a pouze u 40–50 % z nich se objeví symptomy revmatologických onemocnění v průměrné době 3 let (20).
Klinické projevy neonatálního lupusu u dětí
V americkém národním registru bylo k únoru 2007 prospektivně sledováno 229 matek a jejich 499 dětí. Klinické manifestace postižených 275 dětí s NLS byly následující: 168 (61 %) mělo kompletní vrozený srdeční blok (91 dívek, 77 chlapců); 74 (26,9 %) mělo pouze kožní projevy (42 dívek, 32 chlapců); 24 (8,7 %) mělo současně srdeční a kožní projevy NLS (12 dívek, 12 chlapců) a 9 (3,2 %) jaterní a hematologické projevy (6 dívek, 3 chlapci). V rámci klinické manifestace nebyl mezi pohlavím zaznamenán signifikantně významný rozdíl. Ze souboru 100 matek s dítětem s CHB byla v následném těhotenství zaznamenána recidiva CHB u 18 dětí (18 %), u 3 (3 %) pacientů zároveň s kožními projevy NLS. Sedm (7 %) potomků v následném těhotenství mělo pouze kožní projevy NLS. Celková pravděpodobnost pro postižení i druhého dítěte v následujícím těhotenství jakýmkoliv projevem NLS v tomto souboru byla tedy 25 %. Po porodu dítěte s kožními projevy NLS bylo následně těhotných 48 matek, kdy 13 (27 %) potomků mělo CHB, z toho 5 (10 %) spojený s kožním NLS, 15 (31 %) dětí pouze kožní projevy NLS a 20 (42 %) bylo bez projevů NLS (19, 21, 22).
Diagnostika vrozeného srdečního bloku
Nejvíce případů CHB je diagnostikováno in utero na základě auskultačního nálezu fetální bradykardie. V tu chvíli však již může být atrioventrikulární uzel nahražen rozsáhlou fibrózní tkání a bradykardie tudíž ireverzibilní. Tyto pozdní případy pokročilého srdečního bloku (II. a III. stupeň) mohou být navíc asociovány s hydropsem plodu a vysokou morbiditou a mortalitou. AVB I. stupně se může manifestovat jako pouhé klinicky němé prodloužení PR intervalu. Již přes 6 let je za zlatý standard časné neinvazivní diagnostiky AVB I. stupně (prodloužení PR intervalu nad 150 ms) považována fetální dopplerovská echokardiografie, též známá jako mechanický dopplerovský PR interval. U matek s pozitivitou autoprotilátek anti-SSA/Ro a anti-SSB/La se doporučuje provádět fetální echokardiografii zahrnující měření neinvazivního dopplerovského PR intervalu týdně od 16.do 26. gestačního týdne a s dvoutýdenním intervalem mezi 26. a 32. GT. jako marker k monitorování časných a potenciálně reverzibilních změn srdečního převodního systému plodu (23–25) (obr. 2).

Léčba vrozeného srdečního bloku
K zastavení autoimunitního procesu poškozujícího fetální srdce je v současné době používána léčba založená na fluoridovaných kortikosteroidech (dexamethasonu a betamethasonu), které přecházejí placentou v aktivní formě. Jejich snahou je omezení zánětlivého procesu rezultujícího v následné jizvení a poškození srdečního převodního systému u plodů (26). V běžné praxi se těhotné matce podává denní perorální dávka 4mg dexamethasonu.
Avšak v recentních studiích se začíná ukazovat problematická její účinnost a zejména rizikovost, přestože mateřská perorální léčba dexamethasonem byla zpopularizovaná několika skupinami. Salleb a kol. zkoumal léčbu fluoridovanými kortikosteroidy: u 28 z 50 těhotenství (u 47 matek) s plodem s vrozeným srdečním blokem byla zahájena léčba dexa - či betamethasonem. U 21 léčených případů s AVB III. stupně blok zůstal ireverzibilní. Tři léčené plody se střídajícím se AVB II. a III. stupně nakonec vytvořily kompletní AVB. Ve 4 případech se sice AVB II. stupně do porodu vylepšil na I. stupeň, avšak v rámci dlouhodobého sledování po porodu u 2 dětí srdeční blok opět progredoval. Ze 22 gravidit, kde nebyla podávána kortikosteroidní léčba, v 18 případech byl diagnostikován kompletní AVB III. stupně, 2 plody měly měnící se AVB II. a III. stupně, který nakonec stejně progredoval do kompletního, a zbylé 2 plody měly AVB II. stupně, který se nakonec též stal kompletním. Ze závěrů této retrospektivní studie vyplývá, že nebyl žádný rozdíl ve výsledném stupni srdečního bloku, mortalitě a časové nutnosti implantace kardiostimulátoru mezi plody léčenými či neléčenými kortikosteroidy. Na druhou stranu se perikardiální či pleurální výpotek, ascites anebo hydrops plodu na steroidní léčbě zlepšil. Právě tento výzkum provedený na omezeném počtu pacientů a založený na retrospektivním sběru dat zpopularizoval léčbu vrozeného srdečního plodu fluoridovanými kortikosteroidy in utero (27). Jaeggi a kol. uveřejnil v roce 2004 výsledky prenatální (transplacentární) léčby plodů s kompletním vrozeným srdečním blokem bez strukturálního postižení srdce. V časovém období let 1990 až 1996 bylo diagnostikováno 16 gravidit s plodem s CHB (4 léčeni dexamethasonem, 1 pouze β-adrenergní léčbou, kdy 80 % dětí se narodilo živých a 1roční přežití bylo 47 %. Mezi lety 1997 a 2003 bylo léčeno dalších 18 plodů s CHB současně dexamethasonem a β-adrenergní stimulací (jejichž srdeční frekvence byla pod 55 úderů za minutu), kdy 95 % dětí bylo živě narozených a zároveň přežívajících 1 rok. V celkovém souboru (1990–2003) plody léčené dexamethasonem měly 1roční přežití 90 % oproti 46 % neléčeným. Při kombinované léčbě dexamethasonem spolu s β-adrenergní stimulací stouplo 1roční přežití na 95 %. Autoři považují současnou kombinaci léčby dexamethasonem a β-adrenergní stimulací pro bradykardii za efektivní léčebný program (28).
Breur a kol. shrnuje 93 případy pacientů s CHB léčených in utero dexamethasonem. Upozorňuje zejména na řadu nežádoucích účinků vyplývajících z kortikosteroidní léčby zahrnující spontánní aborty, předčasné porody, intrauterinní růstovou retardaci, oligohydramnion, prodlouženou supresi nadledvin, zpomalený mozkový růst, možný pozdní vznik arteriální hypertenze, diabetu mellitu a poruch učení. Považuje proto podávání dexamethasonu v rámci prevence a léčby CHB stále za sporné a ne bezpodmínečně doporučované (29).
Další léčebné modality jsou popisovány spíše v ojedinělých kazuistických sděleních a pro jejich event. rozšíření a zavedení do běžné klinické praxe je třeba ještě prospektivních, randomizovaných, kontrolovaných studií. Některé skupiny použily u pacientů s úspěchem sympatomimetik za účelem zvýšení srdeční frekvence (30). Invazivní zavedení fetálního kardiostimulátoru jako pokus o záchranu plodu se sekundárním hydropsem při kompletním vrozeném srdečním bloku bylo pouze dočasně účinné (31), stejně tak vzácné užití plazmaferézy se snahou o odstranění mateřských autoprotilátek (32). Naopak určitý úspěch mělo podávání intravenózních imunoglobulinů (IVIG) v rámci profylaxe vzniku CHB. IVIG jsou již z minulosti známé svou bezpečností a účinností při podávání v těhotenství většinou pro cytopenie autoimunitní etiologie (33, 34).
Další případ popisuje pokus o profylaktické podávání prednisonu u matek s pozitivitou autoprotilátek jako prevenci vzniku CHB (35). S tímto doporučením ale řada dalších autorů důrazně nesouhlasí. Dříve publikované práce totiž jasně dokazují neschopnost přestupu prednisonu placentou v aktivní formě, dokazují vznik CHB i u plodů matek léčených prednisonem, rizikovost této léčby pro matku i plod a stejně tak malé riziko vývoje (2–5 %) vrozeného srdečního bloku plodu u matek s pozitivitou autoprotilátek anti.SSA/Ro a SSB/La. Stejně tak není v současné době doporučeno preventivní podávání i fluoridovaných kortikosteroidů (dexa a betamethasonu) v průběhu dalšího těhotenství u matek s předchozí anamnézou plodu s CHB, jestliže v tomto dalším těhotenství plod nejeví známky CHB. Je tomu právě z důvodů možného vzniku celé řady nežádoucích účinků a relativně nízkému 18 % riziku vzniku CHB v následujícím těhotenství.
Závěr
Kompletní vrozený srdeční blok bez strukturálního postižení srdce plodu představuje zajímavý model pasivně získaného autoimunitního onemocnění. Vzniká v důsledku transplacentárně přenesených mateřských autoprotilátek anti-SSA/Ro a anti-SS/R/La a vyvine se u 2–5 % plodů matek s pozitivitou těchto protilátek. Riziko vzniku CHB v dalším těhotenství je 18 %. Má významnou perinatální mortalitu dosahující až 20 % a morbiditu, kdy více než 65 % z narozených dětí vyžaduje implantaci trvalého kardiostimulátoru v různém časovém intervalu po narození.
Všechny těhotné ženy s pozitivitou autoprotilátek anti-SSA/Ro a anti-SSB/La by měly být proto považované za rizikové vzhledem k možnému rozvoji NLS projevů u svých dětí s nejzávažnější klinickou manifestací vzniku CHB. Současná mezinárodní doporučení zahrnují monitorování event. prodlužování PR intervalu pomocí fetální echokardiografie k detekci časných a potenciálně reverzibilních změn na fetálním srdečním převodním systému s 1týdenním intervalem mezi 16. a 26. GT a poté s 2týdenním intervalem mezi 26. a 32. GT. Při známkách možného rozvoje vrozeného srdečního bloku se zahajuje léčba fluoridovanými kortikosteroidy in utero (nejčastěji 4 mg dexamethasonu denně), které v aktivní formě přestupují placentou a snižují zánětlivý proces rezultující v následné jizvení převodního systému v srdečním svalu. K léčbě dexamethasonem se přidává medikamentozní ß-adrenergní stimulace či sympatomimetika při výraznější fetální bradykardii za účelem zvýšení srdeční frekvence.
V dalším výzkumu a studiích je však třeba ještě identifikovat další fetální faktory kromě TGFβ, podílející se na vzniku vrozeného srdečního bloku, které nám poskytnou důležité informace k novým léčebným možnostem tohoto imunologicky velice zajímavého onemocnění.
Práce byla podpořena výzkumnými záměry MSM 0021620812 a MZČR 00064203.
MUDr. Michal Podrazil
Ústav imunologie
Fakultní nemocnice v Motole
V Úvalu 84
150 06 Praha 5
e-mail: michal.podrazil@fnmotol.cz
Sources
1. Friedman DM, Rupel A, Buyon JP. Epidemiology, etiology, detection, and treatment of autoantibody-associated congenital heart block in neonatal lupus. Curr Rheumatol Rep 2007 May; 9(2): 101–8.
2. Michaelsson M, Engle MA. Congenital complete heart block: an international study of the natural history. Cardiovasc Clin 1972; 4 : 85–101.
3. Waltuck J, Buyon JP. Autoantibody-associated congenital heart block: outcome in mothers and children. Ann Intern Med 1994; 120 : 544–551.
4. Brucato A, Frassi M, Franceschini F, Cimaz R, Faden D, Pisoni MP, et al. Risk of congenital complete heart block in newborns of mothers with anti-Ro/SSA antibodies detected by nterimmunoelectrophoresis: a prospective study of 100 women. Arthritis Rheum 2001; 44 : 1832–1835.
5. Buyon JP, Hiebert R, Copel J, et al. Autoimmune-associated congenital heart block: mortality, morbidity, and recurrence rates obtained from a national neonatal lupus registry. J Am Coll Cardiol 1998; 31 : 1658–66.
6. Buyon JP, Clancy RM. Dying right to live longer: positing apoptosis as a link between maternal autoantibodies and congenital heart block. Lupus. 2008; 17(2): 86–90.
7. Wolin SL, Cedervall T. The La protein. Annu Rev Biochem 2002; 71 : 375–403.
8. Chen X, Wolin SL. The Ro 60 kDa autoantigen: insights into cellular function and role in autoimmunity. J Mol Med 2004; 82 : 232–239.
9. Espinosa A, Zhou W, Ek M, Hedlund M, Brauner S, Popovic K, et al. The Sjögren’s syndrome-associated autoantigen Ro52 is an E3 ligase that regulates proliferation and cell death. J Immunol 2006; 176 : 6277–6285.
10. Salomonsson S, Dörner T, Theander E, Bremme K, Larsson P, Wahren-Herlenius M. A serologic marker for fetal risk of congenital heart block. Arthritis Rheum 2002; 46 : 1233–1241.
11. Cooley HM, Keech CL, Melny BJ, et al. Monozygotic twins discordant for congenital complete heart block. Arthritis Rheum 1997; 40 : 381–4.
12. Fritsch C, Hoebeke J, Dali H, Ricchiuti V, Isenberg DA, Meyer O, Muller S. 52-kDa Ro/SSA epitopes preferentially recognized by antibodies from mothers of children with neonatal lupus and congenital heart block. Arthritis Res Ther 2005; 8:R4.
13. Clancy RM, Buyon JP, Ikeda K, Nozawa K, Argyle DA, Friedman DM, et al. Maternal antibody responses to the 52-kd SSA/Ro p200 peptide and the development of fetal conduction defects. Arthritis Rheum 2005; 52 : 3079–3086.
14. Eftekhari P, Salle L, Lezoualc’h F, Mialet J, Gastineau M, Briand JP, et al. Anti - SSA/Ro52 autoantibodies blocking the cardiac 5-HT4 serotoninergic receptor could explain neonatal lupus congenital heart block. Eur J Immunol 2000; 30 : 2782–2790.
15. Kamel R, Eftekhari P, Clancy R, Buyon JP, Hoebeke J. Autoantibodies against the serotoninergic 5-HT4 receptor and congenital heart block: a reassessment. J Autoimmun 2005; 25 : 72–76.
16. Salomonsson S, Sonesson SE, Ottosson L, Muhallab S, Olsson T, Sunnerhagen M, et al. Ro/SSA autoantibodies directly bind cardiomyocytes, disturb calcium homeostasis, and mediate congenital heart block. J Exp Med 2005; 201 : 11–17.
17. Buyon JP, Clancy RM. Autoantibody-associated congenital heart block: TGFbeta and the road to scar. Autoimmun Rev 2005; 4 : 1–7.
18. Solomon DG, Rupel A, Buyon JP. Birth order, gender and recurrence rate in autoantibody-associated congenital heart block: implications for pathogenesis and family counseling. Lupus 2003; 12 : 646–647.
19. Buyon JP, Hiebert R, Copel J, et al. Autoimmune-associated congenital heart block: mortality, morbidity, and recurrence rates obtained from a national neonatal lupus registry. J Am Coll Cardiol 1998; 31 : 1658–66.
20. Julkunen H, Eronen M. Long-term outcome of mothers of children with isolated heart block in Finland. Arthritis Rheum 2001; 44 : 647–652.
21. Izmirly PM, Rivera TL, Buyon JP. Neonatal lupus syndromes. Rheum Dis Clin North Am 2007 May; 33(2): 267-85, vi.
22. Skog A, Wahren-Herlenius M, Sundström B, Bremme K, Sonesson SE. Outcome and growth of infants fetally exposed to heart block-associated maternal anti-Ro52/SSA autoantibodies. Outcome and growth of infants fetally exposed to heart block-associated maternal anti-Ro52/SSA autoantibodies. Pediatrics 2008 Apr.; 121(4): e803–9.
23. Glickstein J, Buyon J, Kim M, Friedman D. PRIDE investigators. The fetal Doppler mechanical PR interval: a validation study. Fetal Diagn Ther 2004 Jan-Feb; 19(1): 31–4.
24. Buyon JP, Askanase AD, Kim MY, Copel JA, Friedman DM. Identifying an early marker for congenital heart block: when is a long PR interval too long? Comment on the article by Sonesson et al. Arthritis Rheum 2005 Apr; 52(4): 1341–2.
25. Friedman DM, Kim MY, Copel JA, Davis C, Phoon CK, Glickstein JS, et al. PRIDE investigators: Utility of cardiac monitoring in fetuses at risk for congenital heart block: the PR Interval and Dexamethasone Evaluation (PRIDE) prospective study. Circulation. 2008 Jan 29; 117(4): 485–93. Epub 2008 Jan 14.
26. Blanford AT, Murphy BE. In vitro metabolism of prednisolone, dexamethasone, betamethasone, and cortisol by the human placenta. Am J Obstet Gynecol 1977; Feb 1;127(3): 264–7.
27. Saleeb S, Copel J, Friedman D, et al. Comparison of treatment with fluorinated glucocorticoids to the natural history of autoantibody-associated congenital heart block. Arthritis Rheum 1999; 42 : 2335–45.
28. Jaeggi ET, Fouron J-C, Silverman ED, et al. Transplacental fetal treatment improves the outcome of prenatally diagnosed complete atrioventricular block without structural heart disease. Circulation 2004; 110 : 1542–8.
29. Breur JMPJ, Visser GHA, Kruizc AA, et al. Treatment of fetal heart block with maternal steroid therapy: case report and review of the literature. Ultrasound Obstet Gynecol 2004; 24 : 467–72.
30. Robinson BV, Ettedgui JA, Sherman FS. Use of terbutaline in the treatment of complete heart block in the fetus. Cardiol Young 2001; 11 : 683–6.
31. Carpenter RJ Jr, Strasburger JF, Garson A Jr, et al. Fetal ventricular pacing for hydrops secondary to complete atrioventricular block. J Am Coll Cardiol 1986; 8 : 1434–6.
32. Van der Leij JN, Visser GH, Bink-Boelkens MT, et al. Successful outcome of pregnancy after treatment of maternal anti-Ro (SSA) antibodies with immunosuppressive therapy and plasmapheresis. Prenat Diagn 1994; 14 : 1003–7.
33. Wong JP, Kwek KY, Tan JY, et al. Fetal congenital complete heart block: prophylaxis with intravenous gammaglobulin and treatment with dexamethasone. AustNZ J Obstet Gynaecol 2001; 41 : 339–41.
34. Branch DW, Porter TF, Paidas MJ, et al. Obstetric uses of intravenous immunoglobulin: successes, failures and promises. J Allergy Clin Immunol 2001; 108: S133–8.
35. Shinohara K, Miyagawa S, Fujita T, et al. Neonatal lupus erythematosus: results of maternal corticosteroid therapy. Obstet Gynecol 1999; 93 : 952–7.
Labels
Dermatology & STDs Paediatric rheumatology RheumatologyArticle was published in
Czech Rheumatology

2008 Issue 4
-
All articles in this issue
- Adiponectin may be related to skin remodelling in patients with systemic sclerosis
- Efficacy evaluation of nonpharmacological treatment (regular exercise), pharmacotherapy (glucosamine sulphate, GS Condro Forte®) and the combination of both methods in symptomatic osteoarthritis of the knee. Results of open, randomized, controlled study
- Congenital heart block caused by maternal autoantibodies anti-SSA/Ro and anti-SSB/La
- Specific and associated autoantibodies in polymyositis and dermatomyositis
- Czech Rheumatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Specific and associated autoantibodies in polymyositis and dermatomyositis
- Congenital heart block caused by maternal autoantibodies anti-SSA/Ro and anti-SSB/La
- Efficacy evaluation of nonpharmacological treatment (regular exercise), pharmacotherapy (glucosamine sulphate, GS Condro Forte®) and the combination of both methods in symptomatic osteoarthritis of the knee. Results of open, randomized, controlled study
- Adiponectin may be related to skin remodelling in patients with systemic sclerosis
