Kognitivní dysfunkce u české populace nemocných se systémovým lupus erytematodes
Cognitive dysfunction in the Czech population of patients with systemic lupus erythematosus
Background:
Involvement of the nervous system occurs in as much as 80% of patients with systemic lupus erythematosus (SLE). Diagnosis of neuropsychiatric involvement (NPSLE) is very difficult due to a variability of clinical presentation. Cognitive dysfunction (CD) is one of the most common manifestations of NPSLE. Its cause has not yet been entirely elucidated.
Objective:
The aim of this study was to assess the prevalence of NPSLE in patients with SLE, and the prevalence of CD in the Czech population of patients with SLE, and to determine an association of CD with other types of NPSLE, brain MRI findings of blood-brain barrier disorders, positivity for certain autoantibodies, and disease activity.
Methods:
A group of 100 patients diagnosed with SLE according to ACR criteria was examined. Disease activity was evaluated using the SLEDAI index. All patients underwent a clinical neurological, psychiatric, and psychological examination, and based on the results of all three examinations, diagnosis and the type of NPSLE was established according to the ACR criteria. Autoantibody activity was examined in all patients.
Results:
Based on a neurological examination alone, diagnosis of NPSLE was established in 31% of patients. Following completion of a psychiatric and psychological examination, the occurrence of NPSLE increased to 73%. A various degrees of cognitive deficit were found in most of our patients (91%). A mild degree of cognitive deficit was found in 35% of patients, and cognitive dysfunction (i.e. a moderate to severe degree of cognitive deficit) was diagnosed in 57% of patients. In the group of patients with CD, occurrence of involvement of the nervous system was four times higher than in the group without cognitive dysfunction; furthermore, occurrence of cardiac involvement (22.8 % vs. 14.0 %; p < 0.05) and antiphospholipid syndrome (28.1% vs. 20.9%; p< 0.05) was also higher in patients with CD. In the group of patients with CD, occurrence of positivity for antiphospholipid antibodies was two times higher than in the group without dysfunction.
Conclusion:
Cognitive dysfunction is a very frequent clinical manifestation of SLE; most of the patients (57% in our group) suffer from a moderate to severe degree of cognitive deficit. Cognitive dysfunction can evade diagnosis, when only routine, standard neurological and psychiatric examinations are performed. A targeted psychological examination can increase the chance of diagnosis of CD up to 10 times. Since cognitive dysfunction can significantly decrease mental performance of a patient with SLE, his or her role in the society and at work, we recommend performing psychological evaluations in all patients with SLE on regular basis.
Key words:
systemic lupus erythematosus, neuropsychiatric lupus, cognitive dysfunction
:
R. Svobodová; M. Pošmurová; V. Peterová 1; P. Kozelek 2; I. Půtová; M. Fojtíková; C. Dostál; M. Olejárová
:
Revmatologický ústav Praha, 1Neurologická klinika 1. LF UK a VFN Praha, 2Psychiatrická klinika 1. LF UK a VFN Praha
:
Čes. Revmatol., 18, 2010, No. 2, p. 85-91.
:
Original Papers
Postižení nervového systému se objevuje až u 80 % pacientů se systémovým lupusem erytematodes (SLE). Diagnóza neuropsychiatrického postižení (NPSLE) je velmi obtížná vzhledem k rozmanitosti klinických projevů. Kognitivní dysfunkce (KD) je jednou z nejčastějších manifestací NPSLE. Příčina jejího vzniku není dosud zcela objasněna.
Cíl:
Cílem práce bylo stanovit prevalenci NPSLE u pacientů se SLE a prevalenci KD u populace českých nemocných se SLE a stanovit asociaci KD s dalšími typy NPSLE, s poruchou hematoencefalické bariéry dle MR mozku, s přítomností určitých autoprotilátek a aktivitou onemocnění.
Metodika:
Byla vyšetřena skupina 100 nemocných s diagnózou SLE podle kritérií ACR. Aktivita SLE byla hodnocena pomocí indexu SLEDAI. U všech nemocných bylo provedeno klinické neurologické, psychiatrické a psychologické vyšetření a na základě výsledků všech tří vyšetření byla stanovena diagnóza a typ NPSLE podle kritérií ACR. U všech nemocných byla stanovována autoprotilátková aktivita.
Výsledky:
NPSLE byl diagnostikován na podkladě samotného neurologického vyšetření u celkem 31 % nemocných. Po doplnění psychiatrického a psychologického vyšetření se výskyt NPSLE zvýšil až na 73 %. Kognitivní deficit různého stupně byl zjištěn u většiny našich nemocných (91 %). Mírný kognitivní deficit byl nalezen u 35 % nemocných, kognitivní dysfunkce (tedy deficit středně těžký až těžký) byla diagnostikována u 57 % nemocných. U skupiny s KD byl zjištěn čtyřikrát vyšší výskyt postižení nervového systému oproti skupině bez dysfunkce, dále se u pacientů s KD častěji vyskytovalo kardiální postižení (22,8 % vs. 14,0 %; p < 0,05) a antifosfolipidový syndrom (28,1 % vs. 20,9 %; p< 0,05). Ve skupině s KD byl zjištěn dvojnásobný výskyt pozitivity antifosfolipidových protilátek v porovnání se skupinou bez dysfunkce.
Závěr:
Kognitivní dysfunkce je velmi častou manifestací SLE; středně těžký až těžký kognitivní deficit může postihovat většinu nemocných (v našem souboru 57 %). Při běžném, standardním neurologickém či psychiatrickém vyšetření však může uniknout diagnóze. Cílené psychologické vyšetření zvyšuje záchyt kognitivní dysfunkce až desetinásobně. Vzhledem k tomu, že může kognitivní dysfunkce významně snižovat psychickou výkonnost, sociální a pracovní uplatnění pacientů se SLE, doporučujeme provádět psychologické vyšetření u všech pacientů se SLE.
Klíčová slova:
systémový lupus erytematodes, neuropsychiatrický lupus, kognitivní dysfunkce
Úvod
Kognitivní dysfunkce (KD) je spolu s bolestí hlavy nejčastější neuropsychiatrickou manifestací systémového lupus erytematodes (SLE). Vyskytuje se až u 80 % pacientů se SLE. V dosud největší vyšetřené skupině nemocných s neselektovaným SLE Breyové et al. (n=67) byla kognitivní dysfunkce, podložená standardním neuropsychologickým vyšetřením, zjištěna u většiny subjektů (79 %) (1). Mírný kognitivní deficit byl pozorován u 43 %, středně těžký u 30 % a těžký u 6 % nemocných; u 21 % pacientů byl nález v normě. K podobné prevalenci dospěli i Ainkala s kolektivem, kteří vyšetřili 42 pacientů s neuropsychiatrickým lupusem a kognitivní dysfunkci zjistili u 37 pacientů (80 %) (2). Glanz et al. pozorovali kognitivní dysfunkci u 15 ze 30 vyšetřených pacientů se SLE bez předcházející cerebrovaskulární patologie (3). Prevalence kognitivní dysfunkce se podle jednotlivých autorů pohybuje v rozmezí od 20 do 80 %. K rozptylu hodnot přispívá zejména nejednotná metodika hodnocení kognitivních funkcí a zejména pak rozdílná kritéria pro diagnostiku kognitivní poruchy.
Diagnostika kognitivní dysfunkce obecně je založena na kompletním psychologickém vyšetření všech podstatných oblastí kognitivních funkcí: hodnotí se percepce, pozornost, paměť, motorické a jazykové dovednosti, řešení problémů, exekutivní (řídící) též výkonové funkce (schopnosti plánovat, účelně jednat a dosáhnout cíle). Validní zhodnocení kognitivních funkcí je proto poměrně časově náročné, trvá přibližně 90 minut. Diagnostika kognitivní dysfunkce byla navržena ACR v r. 1999 a zahrnuje tyto testy: Test čtení pro dospělé S Amerika, Test symbolů z prstů, Stroopův test barev a slov, Kalifornský test učení slov, Rey-Osterriethův test kreslení komplexního obrázku, WAIS III (Wechsler Adult Intelligence Scale) – sekvence čísel, Kontrolovaný mluvený test volných asociací, Názvy zvířat, Test ťukání prsty (4). Metodicky jednoduchý test Mini Mental State Examination (5), který je v běžné klinické praxi nejčastěji užíván, odhalí pouze těžší poruchy kognitivních funkcí. K detekci kognitivní dysfunkce u SLE proto nestačí, ze stejného důvodu není vhodný ani jako test screeningový.
Hloubka kognitivního deficitu u lupusu je značně variabilní, nejčastěji jsou diagnostikovány mírné, subklinické formy, které se obvykle vyvíjejí pozvolna, plíživě a často si jich pacient ani ošetřující lékař nemusí být vědomi a mohou tak uniknout diagnóze. Středně závažné poruchy, které se podle Breyové objevují u třetiny nemocných se SLE, již mohou negativně ovlivňovat společenské a pracovní uplatnění těchto pacientů, zvláště pak duševně pracujících jedinců (1). Důležitým pozorováním je, že se kognitivní porucha může vyvíjet i bez jiných neuropsychiatrických projevů v minulosti či současnosti, které by na poškození kognitivních funkcí upozornily (6). Pozitivní korelace však byla zjištěna mezi kognitivní dysfunkcí a délkou trvání onemocnění, rovněž progrese kognitivní dysfunkce koreluje i s progresí onemocnění.
U pacientů se SLE se kognitivní porucha manifestuje nejčastěji postižením paměti a koncentrace, poruchou verbální či neverbální paměti, poklesem verbální výkonnosti, porušením vizuálně prostorových schopností, poklesem psychomotorického tempa a postižením kognitivní flexibility (7, 8).
Patogeneze kognitivních poruch u NPSLE je nejasná. V původní klasifikaci neuropsychiatrického lupusu, resp. postižení CNS u SLE (difuzní a fokální typy postižení), byla kognitivní dysfunkce řazena k difuzním formám na základě představy, že k postižení mozku dochází difuzním nespecifickým zánětem nebo přímým neuropatogenním působením určitých autoprotilátek, které do mozkové tkáně pronikají porušenou hematoencefalickou bariérou (HEB) či jsou přímo syntetizovány intrathekálně (9). Druhým typem mozkového postižení bylo podle této klasifikace tzv. fokální postižení (např. epilepsie, cévní mozkové příhody), kde se předpokládalo fokální morfologické poškození mozkové tkáně, způsobené tromboembolií nebo vaskulitidou za patogenní účasti antifosfolipidových protilátek. Tato původní klasifikace byla se zkvalitněním diagnostických zobrazovacích metod postupně opuštěna, neboť se ukázalo, že se drobné ložiskové změny, odpovídající vaskulopatii či vaskulitidě vyskytují u většiny nemocných s NPSLE, včetně difuzních forem postižení. Podle novější klasifikace NPSLE (4) byla zařazena kognitivní dysfunkce spolu s psychózami, poruchami nálady, stavy zmatenosti a úzkostnými poruchami do skupiny tzv. difuzních psychiatrických a neuropsychiatrických syndromů NPSLE, u nichž se rovněž předpokládá, že vznikají patogenním působením autoprotilátek s afinitou k nervové tkáni.
V osmdesátých letech minulého století byla popsána asociace protilátky proti ribozomálnímu P-proteinu s psychózou a depresí u lupusu (10, 11); recentní práce Brianiho et al. prokázala až 51 % výskyt těchto protilátek u pacientů s NPSLE, kde byly zjištěny jak v séru, tak v likvoru (12). Asociace antiribozomálních P protilátek s kognitivní dysfunkcí však dosud jednoznačně prokázána nebyla (13, 14) stejně tak ani asociace dysfunkce s antineuronálními protilátkami (15, 16).
Dalšími zvažovanými protilátkami v patogenezi NPSLE jsou protilátky proti N-methyl-D-aspartátovému receptoru (NMDA) neboli anti-NR2 protilátky. Byla popsána např. asociace těchto protilátek se zhoršením krátkodobé paměti a depresivní náladou (16). Nedávná studie prokázala, že zvýšené hladiny anti-NR2 protilátek v cerebrospinálním moku byly častější u pacientů s difuzním NPSLE, z nichž 12,5 % mělo kognitivní dysfunkci (18). Jiní autoři však toto pozorování již nepotvrdili (19–22).
Řada studií však nalezla oproti původnímu předpokladu korelaci kognitivní dysfunkce s přítomností antifosfolipidových protilátek (APLA). Denburg např. popsal se svými spolupracovníky pozitivní korelaci mezi antifosfolipidovými protilátkami a poškozením paměti, kognitivní flexibility a psychomotorického tempa u pacientů se SLE, kteří neměli v minulosti žádné neuropsychiatrické příznaky (23). V dalších studiích – pětileté studii Hanlyho a dvouleté studii Menona et al. – byla rovněž kognitivní dysfunkce sdružena s přítomností antikardiolipinových protilátek (aCL). U pacientů s trvale pozitivními protilátkami IgG-aCL byl pokles psychomotorického tempa výraznější ve srovnání s pacienty s negativními aCL. Pacienti s trvale pozitivními IgA aCL podávali signifikantně horší výkon v logickém myšlení a výkonnostních schopnostech (23, 25). Tyto výsledky naznačují, že by mohly být aCL protilátky spoluzodpovědné za deterioraci kognitivních funkcí.
Otázka mechanismu vzniku kognitivní dysfunkce u SLE tedy není dosud uspokojivě zodpovězena stejně tak jako s ním související problém léčby tohoto stavu (imunosupresivní versus antikoagulační léčba).
Cílem této studie bylo zjistit prevalenci NPSLE a kognitivní dysfunkce u neselektované české populace pacientů s definitivní diagnózou SLE, popsat formy dysfunkce, které se v této populaci vyskytnou a stanovit její asociaci s některými klinickými parametry (délka trvání a aktivita choroby), přítomností cirkulujících autoprotilátek (anti-P, antineuronální, APLA) a poruchou hematoencefalické bariéry a zodpovědět otázku, zda kognitivní dysfunkce vzniká působením autoprotilátek pronikajících do mozkové tkáně porušenou hematoencefalickou bariériou, či spíše nezánětlivým – trombotickým mechanismem.
Soubor a metodika
Pacienti. Do studie bylo zařazeno celkem 100 neselektovaných pacientů se SLE podle kritérií ACR (4) z ambulance a lůžkového oddělení Revmatologického ústavu. Demografická charakteristika pacientů je uvedena v tabulce 1. U všech nemocných bylo provedeno klinické psychologické, neurologické a psychiatrické vyšetření a na základě výsledků všech tří vyšetření byla stanovena diagnóza a typ NPSLE podle kritérií ACR (4).
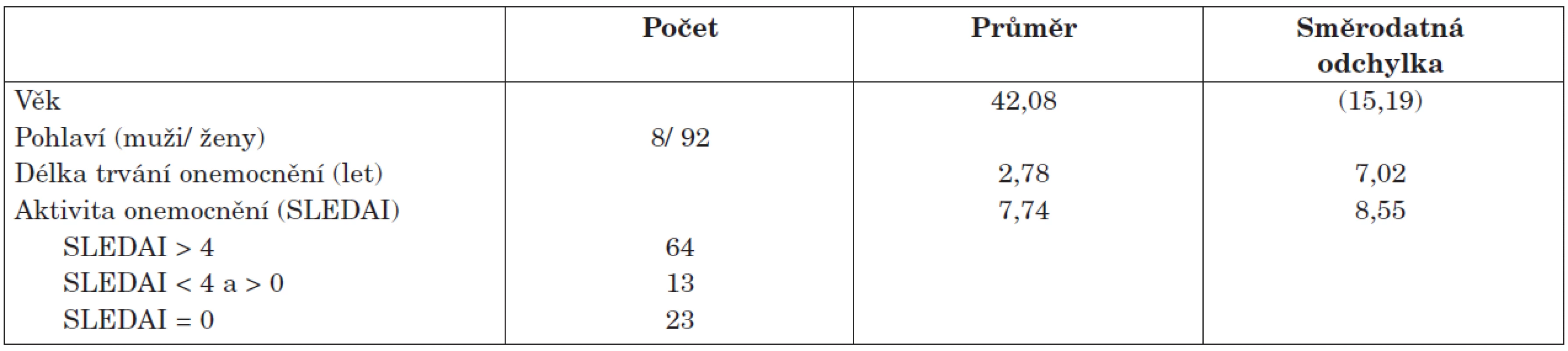
Kognitivní funkce byly hodnoceny erudovaným klinickým psychologem dle doporučení ACR (4), přičemž všechny pacienty vyšetřoval stejný psycholog. K hodnocení kognitivních funkcí a diagnostice poruch byla použita baterie následujících psychologických testů: subtesty z Wechslerova inteligenčního testu pro dospělé (WAIS-R) (266), subtesty z Wechslerovy paměťové škály (WMS-III) (277), Reyův-Oesterriethův test kreslení komplexního obrázku (TKF) (288) a Test cesty – část A, část B (Trail Making Test – TMT A,B) (29).
Výsledky všech testů byly hodnoceny podle norem vytvořených pro zdravou populaci v závislosti na věku. Ve WAIS-R a WMS-III jsou normy dány profilovými skóry (PS), které vyjadřují výkon probanda v jednotlivých subtestech ve srovnání s populací jeho věkového pásma (průměr je 10, standardní odchylka SD 3). Výsledkem testu bylo celkem 15 skóré, přičemž hodnoty PS 8 a 7 (SD –0,51 až –1,00) odpovídaly mírnému kognitivní deficitu, hodnoty PS 6-4 (SD –1,01 až –2,00) středně těžkému a hodnoty PS 3-1 (SD –2,01 až –5,00) pak těžkému kognitivnímu deficitu. Kognitivní dysfunkce pak byla diagnostikována na základě dvou kritérií: poškození minimálně 1 funkce a pokles významný (tj. středně těžký nebo těžký deficit).
Hodnocení aktivity SLE. Aktivita základního onemocnění byla hodnocena pomocí indexu SLEDAI (30).
Vyšetření autoprotilátek. U všech nemocných byly v séru vyšetřeny následující autoprotilátky: anti-dsDNA, anti-P protein, antifosfolipidové protilátky, lupusové antikoagulans a antineuronální protilátky. Anti-dsDNA byly stanoveny imunofluorescenčně, protilátky proti ribozomálnímu P-proteinu jsme detekovali imunoblottingem, antifosfolipidové protilátky byly stanoveny metodou ELISA (komerční kity). Stanovení aktivity lupusového antikoagulans (LA) bylo provedeno podle pravidel Mezinárodní společnosti pro trombózu a hemostázu (International Society on Thrombosis and Haemostasis). Antineuronální protilátky byly stanoveny metodou ELISA (komerční kity).
Hodnocení poruchy hematoencefalické bariéry. Funkce HEB byla hodnocena pomocí vyšetření MR mozku v T1WI po intravenózní aplikaci kontrastní látky (gadolinia) vizuálně z MR monitoru. Poruchu značilo každé zvýšení signálu v mozkovém parenchymu oproti nativním snímkům; pokud byl signál mozkového parenchymu nativně i postkontrastně stejný, bez zesílení signálu, byla funkce hematoencefalické bariéry hodnocena jako neporušená.
Statistická analýza výsledků. Výsledky byly statisticky zpracovány. Veškeré statistické testy byly aplikovány na celý soubor primárních dat bez předchozího vylučování hodnot a pacientů. Hladina významnosti byla stanovena na hodnotě p < 0,05 ve všech použitých testech. Ke statistickému zpracování výsledků byla použita analýza rozptylu (ANOVA), ke stanovení statistické významnosti byl použit Pearsonův korelační koeficient a Studentův t-test. Byla provedena demografická charakteristika souboru, stanovení frekvence postižení NPSLE a kognitivní dysfunkce u vzorku nemocných. Byla stanovena korelace kognitivní dysfunkce s aktivitou SLE a přítomností antifosfolipidového syndromu. Dále byla stanovena asociace kognitivní dysfunkce a poruchy HEB a přítomnosti autoprotilátek (anti-dsDNA, anti-P protein, antineuronální protilátky, antifosfolipidové protilátky) v séru.
Výsledky
V rámci naší studie bylo vyšetřeno celkem 100 pacientů se SLE. Všichni pacienti byli vyšetřeni klinicky, včetně revmatologického, neurologického a psychiatrického vyšetření, u všech bylo provedeno podrobné psychologické vyšetření a vyšetřen výskyt autoprotilátek. Jedná se tak dle dosud dostupných informací o největší sestavu pacientů se SLE na světě, u které byly vyšetřeny kognitivní funkce. Breyová et al. (1) ve své práci popisuje sice větší sestavu celkem 128 pacientů se SLE, ale kognitivní funkce byly v této studii vyšetřeny pouze u 67 nemocných. Funkce HEB byla vyšetřena popsanou metodou mozkové MR.
NPSLE byl diagnostikován na podkladě samotného neurologického vyšetření u celkem 31 % nemocných. Po doplnění psychiatrického a psychologického vyšetření se výskyt NPSLE zvýšil až na 73 %. Frekvence jednotlivých typů NPSLE je shrnuta v tabulce 2. Nejčastěji se v našem souboru v souladu s pozorováním dalších autorů vyskytly bolesti hlavy a psychiatrické syndromy (změny nálady, úzkostné stavy). Frekvence bolestí hlavy byla v naší skupině nižší, stejně tak jako změny nálady a úzkostné stavy. V naší skupině jsme však nalezli vyšší procento kognitivní dysfunkce (57 % vs. 35 % ve skupině Breyové). Podstatně nižší je i záchyt polyneuropatie (2 % vs. 22 %). Tyto rozdíly jsou pravděpodobně způsobeny odlišnou věkovou a etnickou skladbou souborů, spíše než metodikou diagnostiky NPSLE, která byla v obou případech shodná. Breyová připouští i problém nedostupnosti některých jazykových variant psychologických testů u multietnické populace, tento problém ale v našich podmínkách odpadá, všichni vyšetření pacienti byli české národnosti.
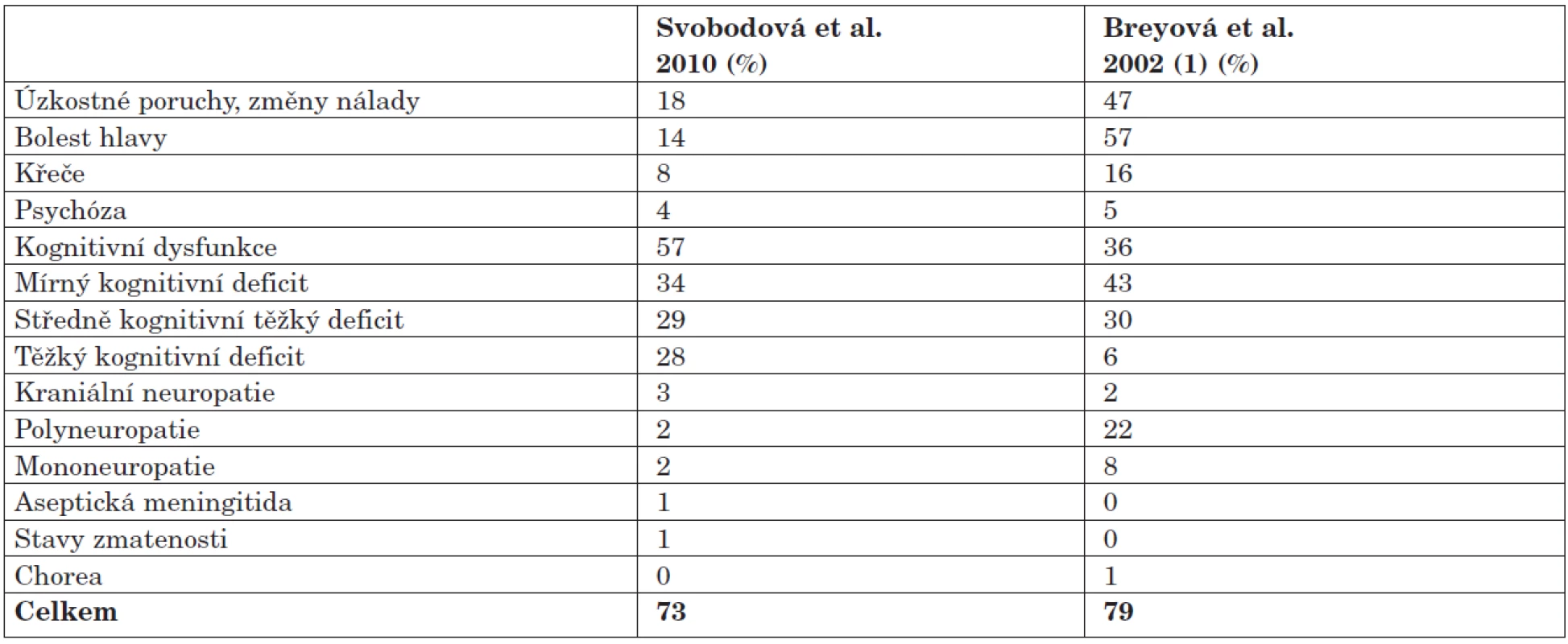
Kognitivní deficit různého stupně byl zjištěn u většiny našich nemocných (91 %). Mírný kognitivní deficit byl nalezen u 35 % nemocných, kognitivní dysfunkce (tedy deficit středně těžký až těžký) byla diagnostikována u 57 % nemocných. Záchyt kognitivní dysfunkce byl v našem souboru poměrně vysoký. S ohledem na skutečnost, že bylo při prostém neurologickém vyšetření diagnostikováno pouze 5 případů kognitivní dysfunkce a při psychologickém vyšetření téměř 12x více, je přínos tohoto vyšetření v diagnostice NPSLE nesporný.
Skupiny s dysfunkcí a bez dysfunkce se v demografických a klinických datech příliš nelišily, výskyt dysfunkce však významně koreloval s aktivitou onemocnění (SLEDAI), která byla ve skupině s dysfunkcí statisticky významně vyšší, vyšší bylo i poškození zdravotního stavu (SLICC). Data jsou uvedena v přehledu v tabulce 3.
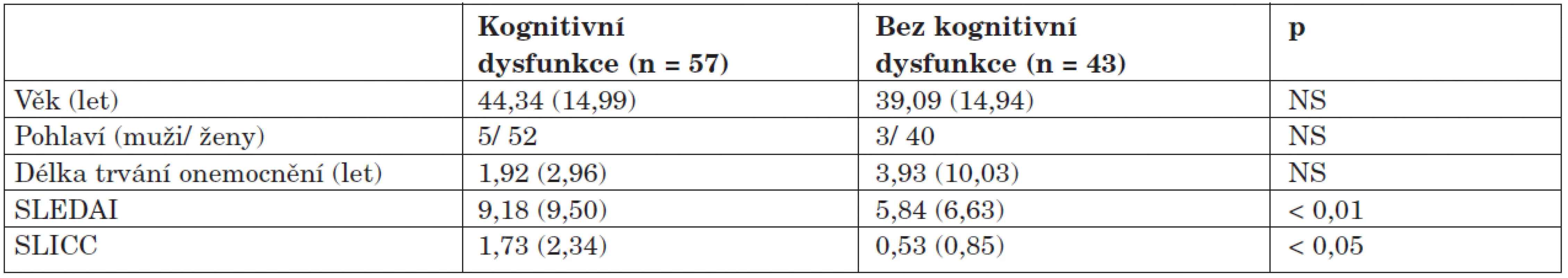
Zajímavé poznatky přineslo porovnání orgánového postižení u obou skupin, kdy byl u skupiny s dysfunkcí zjištěn čtyřikrát vyšší výskyt postižení nervového systému oproti skupině bez dysfunkce, dále se u pacientů s KD častěji vyskytovalo kardiální postižení (22,8 % vs. 14,0 %; p < 0,05) a antifosfolipidový syndrom (28,1 % vs. 20,9 %; p < 0,05). Skupina bez dysfunkce měla častěji postiženy ledviny, klouby a kůži (tab. 4).
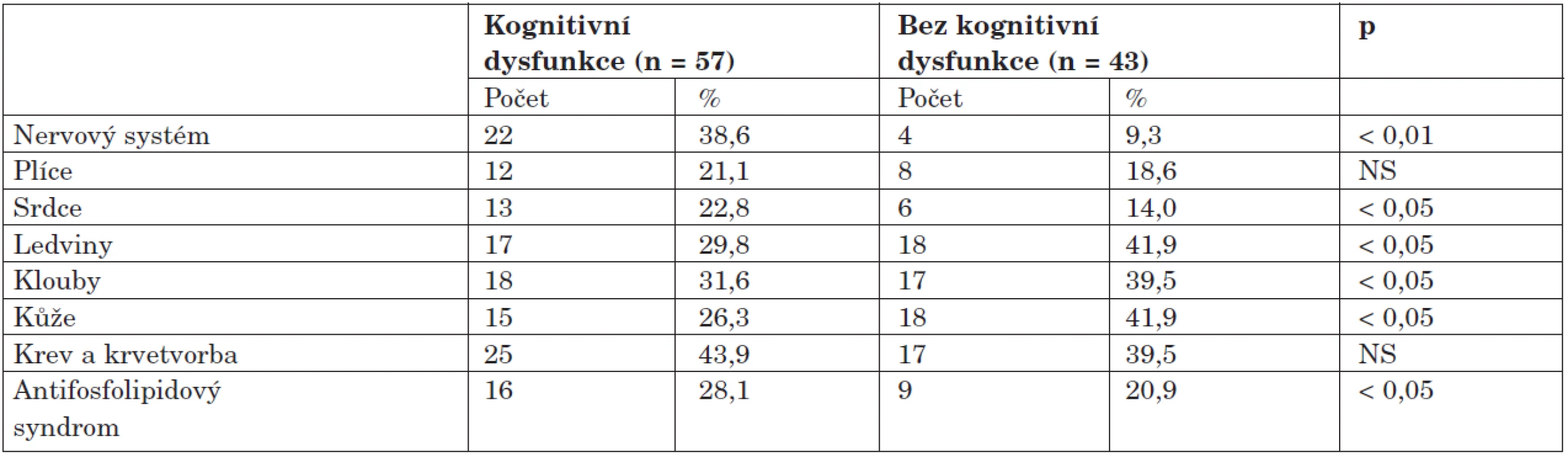
Při srovnání výskytu ostatních typů NPSLE byly ve skupině s dysfunkcí zaznamenány zhruba pětinásobně častější výskyt bolestí hlavy a téměř čtyřnásobně vyšší frekvence poruch nálady a úzkostných stavů v porovnání se skupinou bez dysfunkce (tab. 5).
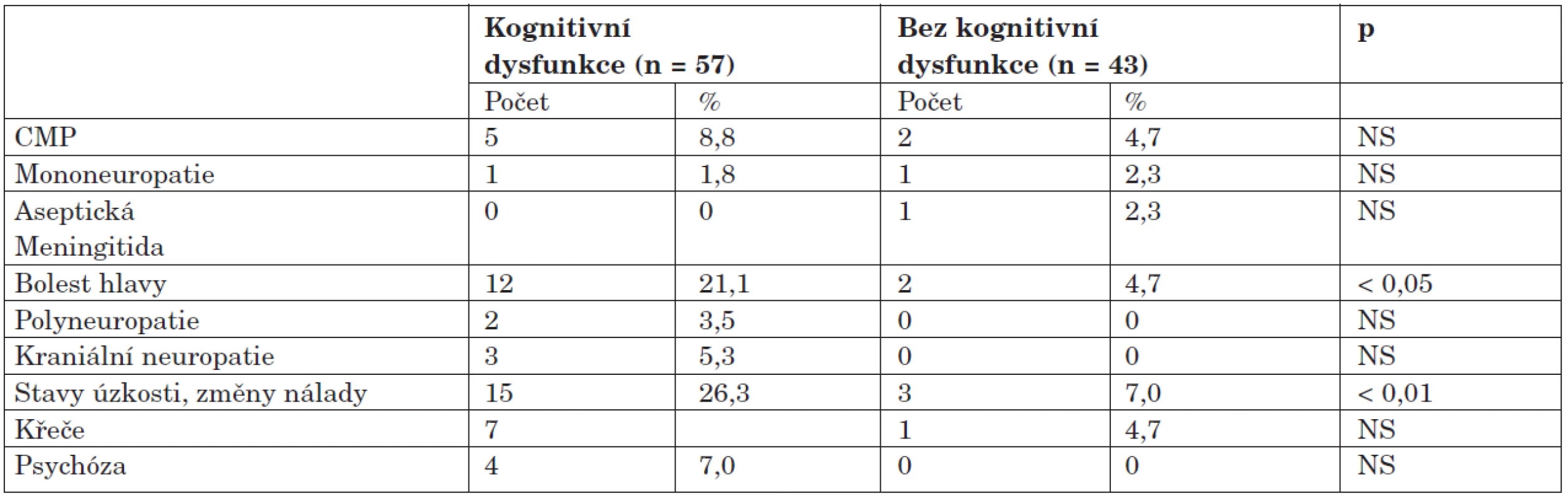
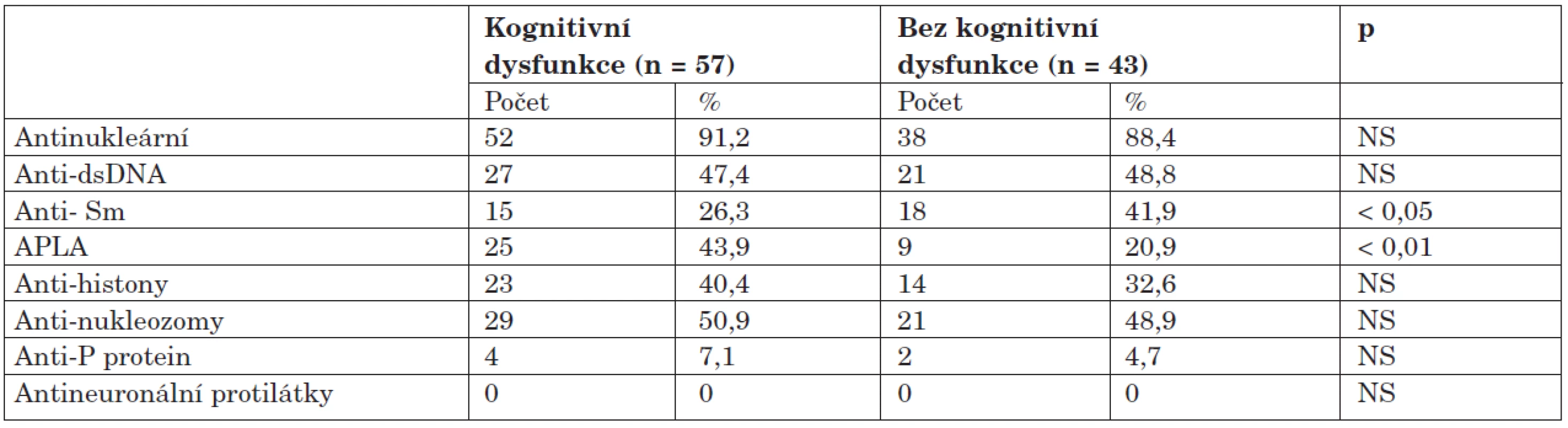
Výskyt autoprotilátek je zdokumentován v tabulce 6. Ve skupině s dysfunkcí byl zjištěn statisticky vysoce významný rozdíl v pozitivitě antifosfolipidových protilátek; jejich výskyt byl v porovnání se skupinou bez dysfunkce dvojnásobný. Žádná z dalších protilátek nevykazovala signifikantní asociaci s kognitivní dysfunkcí. Protilátka proti ribozomálnímu P-proteinu se sice vyskytla u čtyř nemocných s dysfunkcí a dvou bez dysfunkce, tento rozdíl ale nebyl vzhledem k malým číslům statisticky významný (7,1 % vs. 4,7 %; NS). Antineuronální protilátky nebyly překvapivě zjištěny u žádného z nemocných. Ve skupině bez dysfunkce byly naopak častěji detekovány protilátky anti-Sm, klinický význam tohoto pozorování je ale nejasný.
Nejčastějším nálezem na MR mozku u pacientů s dysfunkcí byly drobné ložiskové hyperintenzity v T2 vážených obrazech a FLAIR, které odpovídají vaskulitidě či spíše vaskulopatii. Tento obraz byl zjištěn u necelé poloviny pacientů s kognitivní dysfunkcí (45,6 %). Porucha hematoencefalické bariéry nebyla překvapivě zjištěna u žádného z nemocných. Náš předpoklad, že kognitivní dysfunkce je způsobena poruchou hematoencefalické bariéry, difuzí některých autoprotilátek a jejich přímou interakcí s buněčnými elementy nervové tkáně se nepotvrdil.
Asociace antifosfolipidového syndromu s kognitivní dysfunkcí, popsaná již dříve na menších skupinách pacientů, svědčí spolu se zvýšeným výskytem antifosfolipidových protilátek spíše pro účast nezánětlivých – trombotických mechanismů při vzniku tohoto stavu. Naopak na rozdíl od všech ostatních forem difuzních neuropsychiatrických postižení se zde pravděpodobně patogeneticky neuplatňují protilátky proti ribozomálnímu P-proteinu, antineuronální protilátky ani porucha hematoencefalické bariéry. Tato pozorování dokládají značnou heterogenitu původu neuropsychiatrických manifestací a v budoucnu bude pravděpodobně třeba znovu otevřít otázku klasifikace NPSLE, neboť kognitivní dysfunkce vzniká na rozdíl od ostatních psychiatrických syndromů nezánětlivým mechanismem. Tuto skutečnost je také třeba zohlednit při volbě terapie pacientů s dysfunkcí, která je vázána na antifosfolipidový syndrom a ještě silněji na samotný výskyt antifosfolipidových protilátek. Domníváme se proto, že progredující kognitivní dysfunkce vzniká mikrotrombotizací v mozkovém řečišti a je třeba ji v případě současné pozitivity APLA chápat jako manifestaci antifosfolipidového syndromu, aniž by byla exaktně splněna klasifikační kritéria APS, jež vyžadují instrumentální nebo histologický průkaz trombózy. Ten je v této lokalizaci prakticky nedostupný. Vzhledem k tomu, že kognitivní dysfunkce vzniká i u pacientů bez přítomnosti antifosfolipidových protilátek, domníváme se, že v patogenezi KD se uplatňují i jiné mechanismy. Tím je např. akcelerovaná ateroskleróza (AS), která je u pacientů se SLE častější než u normální populace bez SLE a riziko vzniku KD v kombinaci AS s nezánětlivou mikrovaskulopatií je vyšší. U každého nemocného se SLE s progredující kognitivní dysfunkcí a s pozitivními antifosfolipidovými protilátkami je proto třeba zvážit antiagregační, resp. antikoagulační léčbu.
Diskuse
Patogeneze NPSLE zůstává stále málo objasněna, je pravděpodobné, že je do ní zapojeno více mechanismů (31).
Kognitivní dysfunkce je velmi častou manifestací SLE; středně těžký až těžký kognitivní deficit může postihovat většinu nemocných (v našem souboru 57 %). Při běžném, standardním neurologickém či psychiatrickém vyšetření však může uniknout diagnóze. Cílené psychologické vyšetření zvyšuje záchyt kognitivní dysfunkce až desetinásobně. Vzhledem k tomu, že může kognitivní dysfunkce významně snižovat psychickou výkonnost, sociální a pracovní uplatnění pacientů se SLE, doporučujeme provádět psychologické vyšetření u všech pacientů se SLE, vyšetřovaných pro posudkové účely. Dále doporučujeme toto vyšetření provádět u nemocných s vyšším rizikem vzniku kognitivní dysfunkce (jiné neuropsychiatrické postižení, vysoká aktivita onemocnění, sekundární APS a pozitivita antifosfolipidových protilátek). Vzhledem ke skutečnosti, že při jejím vzniku převládají nezánětlivé mechanismy, je třeba u všech nemocných s kognitivní dysfunkcí zvážit mimo léčbu základního onemocnění také antiagregační a antikoagulační léčbu. Samotná imunosupresivní léčba nemusí být v těchto případech dostatečně účinná.
MUDr. Radka Svobodová
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
e-mail: svobodova.r@revma.cz
Sources
1. Brey RL, Holliday SL, Saklad AR, et al. Neuropsychiatric syndromes in lupus. Prevalence using standardized definitions. Neurology 2002; 58(8): 1214-20.
2. Ainiala H, Hietaharju A, Loukkola J, et al. Validity of the new American College of Rheumatology criteria for neuropsychiatric lupus syndromes: a population-based evaluation. Arthirits rheum 2001; 45 : 419-23.
3. Glanz BI, Schur PH, Lew RA, Khoshbin S. Lateralized cognitive dysfunction in patients with systemic lupus erythematosus. Lupus 2005;14(11):896-902.
4. ACR ad hoc committee on neuropsychiatric lupus nomenclature „The American College og Rheumatology nomenclature and case definitions for neuropsychiatric lupus syndromes“. Arthritis Rheum 1999;42 : 599-608.
5. Marshal F. Folstein, MD and Susan E. Folstein, MD; User‘s Manual by Marshal F. Folstein, MD, Susan E. Folstein, MD, Travis White, PhD, and Melissa A. Messer, MHS Mini-Mental® State Examination, 2nd Edition™ (MMSE®-2™)
6. Denburg SD, Carbotte RM, Denburg JA. Psychological aspects of systemic lupus erythematosus: cognitive function, mood, and self-report. J Rheumatol 1997;24 : 998-1003.
7. Kozora E, Laudenslager M, Lemieux A, et al. Inflammatory and hormonal measures predict neuropsychological functioning in systemic lupus erythematosus and rheumatoid arthritis patients. J Int Neuropsychol soc 2001;7 : 745-54.
8. Fisk J, eastwood B, Sherwood G, et al. Patterns of cognitive impairment in patients with systemic lupus erythematosus. Br J Rheumatol 1993;33(Suppl):S103.
9. Dostál C. Postižení mozku. In: Dostál, Vencovský J, et al. Systémový lupus erythematosus. Praha, Medprint, 1997, strana 99
10. Bonfa E, Golombek SJ, Kaufman LD, et al. Association between lupus psychosis and anti-ribosomal P protein antibodies. N engl J Med 1987;317 : 265-271.
11. Teh LS, Isenberg DA. Antiribosomal P protein antibodies in systemic lupus erythematosus. A reappraisal. Arthritis Rheum 1994;37 : 307-315.
12. Briani C, Lucchetta M, Ghirardello A, et al. Neurolupus is associated with anti-ribosomal P protein antibodies: An inception cohort study. J Autoimmunity 2009;32 : 79-84.
13. Hanly JG, Walsh NM, Fisk J, et al. Cognitive impairment and autoantibodies in systemic lupus erythematosus. Br J Rheumatol 1993;32 : 291-6.
14. Kozora E, Thompson LL, West SG, et al. Analysis of cognitive and psychological deficits in systemic lupus erythematosus patients without overt central nervous system disease. Arthritis Rheum 1996;39 : 2035-45.
15. Denburg SD, Carbotte RM, Denburg JA. Cognitive impairment in systemic lupus erythematosus: a neuropsychological study of individual and group deficits. J Clin Exp Neuropsychol 1987;9 : 323-39.
16. Omdal R, Brokstad K, Waterloo K, et al. Neuropsychiatric disturbances in SLE are associated with antibodies against NMDA receptor. Eur J Neurol 2005;12 : 392-8.
17. Lapteva L, Nowak M, Yarboro CH, et al. Anti-N-methyl-D-aspartate receptor antibodies, cognitive dysfunction, and depression in systemic lupus erythematosus. Arthritis Rheum 2006;54 : 2505-14.
18. Arinuma Y, Yanagida T, Hirohata S. Association of cerebrospinal fluid anti-NR2 glutamate receptor antibodies with diffuse neuropsychiatric systemic lupus erythematosus. Arthritis Rheum 2008;58 : 1130-5.
19. Hanly JG, Robichaud J, Fisk JD. Anti-NR2 glutamate receptor antibodies and cognitive function in systemic lupus erythematosus. J Rheumatol 2006;33 : 1553-8.
20. Harrison MJ, Ravdin LD, Lockshin MD. Relationship between serum NR2a antibodies and cognitive dysfunction in systemic lupus erythematosus. Arthritis rheum 2006;54 : 2515-22.
21. Steup-Beekman G, Steens S van Buchem M, et al. Anti-NMDA receptor autoantibodies in patients with systemic lupus erythematosus and their first-degree relatives. Lupus 2007;16 : 329-34.
22. Denburg SD, Carbotte RM, Denburg JA. The relationship of antiphospholipid antibodies to cognitive function in patients with systemic lupus erythematosus. J Int Neuropsychol Soc 1997;3 : 377-86.
23. Hanly JG, Hong C, Smith S, et al. A prospective analysis of cognitive function and anticardiolipin antibodies in systemic lupus erythematosus. Arthritis Rheum 1999;42 : 728-34.
24. Menon S, Jameson-Shortall E, Newman SP, et al. A longitudinal study of anticardiolipin antibody levels and cognitive funcioning in systemic lupus erythematosus. Arthritis Rheum 1999;42 : 735-41.
25. Tan EM, Cohen AS, Fries JF, et al. The 1982 revised criteria for the classification of systemic lupus erythematosus. Arthritis Rheum 1982;25(11):1271-7.
26. Říčan P, Šebek M, Vágnerová M. WAIS-R. Wechslerův inteligenční test pro dospělé. Příručka. Psychodiagnostické a didaktické testy, Bratislava, 1983.
27. WMS-III. Wechslerova paměťová škála – třetí vydání. Technická příručka pro WAIS-III a WMS-III. Příručka pro administrování a skórování WMS-III. Experimentální verze. Překlad z angličtiny. Psychodiagnostika, Brno, 1999.
28. Reyova-Oesterriethova komplexní figura – TKF. Příručka k testu. Autoři českého manuálu Košč M, Novák J. Psychodiagnostika, Brno, 1997.
29. Test cesty. Trail Making Test. Příručka pro děti i dospělé. Preiss M, Preiss J, Panamá J. Psychodiagnostika, Brno, 1997.
30. Bombardier C, Gladman DD, Urowitz EE, et al. Derivation of SLEDAI: a disease activity index for lupus patients. Arthritis Rheum 1992;35 : 630-40.
31. Kang EH, Shen GQ, Morris R. Flow cytometric assessment of anti-neuronal antibodies in central nervous system involvement of systemic lupus erythematosus and other autoimmune diseases 2008;17 : 21-25.
Labels
Dermatology & STDs Paediatric rheumatology RheumatologyArticle was published in
Czech Rheumatology

2010 Issue 2
-
All articles in this issue
- Jaccoud´s arthropathy in systemic lupus erythematosus
- Assessment of functional ability in patients with rheumatoid arthritis; validation of the Czech version of the Stanford Health Assessment Questionnaire (HAQ)
- Cognitive dysfunction in the Czech population of patients with systemic lupus erythematosus
- Current view on genetics of alkaptonuria
- Treatment resistant myositis
- Czech Rheumatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Treatment resistant myositis
- Assessment of functional ability in patients with rheumatoid arthritis; validation of the Czech version of the Stanford Health Assessment Questionnaire (HAQ)
- Jaccoud´s arthropathy in systemic lupus erythematosus
- Cognitive dysfunction in the Czech population of patients with systemic lupus erythematosus
