Existují prediktivní ukazatele úspěšnosti biologické léčby?
Are there any predictive markers for efficacy of biological therapy?
The goal of the treatment of rheumatic diseases is an early and long-term remission. The number of available biological drugs in rheumatology increases, nevertheless 30% of patients does not respond to this therapy. Therefore, there has been a search for biomarkers associated with good response which would allow us to start optimally effective treatment tailored for individual patients on time with minimal risk of side effects and at minimal costs. Nowadays, genetic and non-genetic predictors for efficacy of biological therapy are being studied. The latter ones comprise acute phase reactants, autoantibodies, cytokines and receptors that are studied at both protein and RNA transcript levels in blood and synovial tissue. The study of the predictive value of response to therapy shifts from monitoring individual parameters to examination of protein and transcription profiles. The topic has been elaborated as an informative report about current options of finding predictors for response to biological treatment.
Key words:
biological therapy, biomarkers, farmakogenetic predictors, protein and expression profiles, TNFα blocking drugs
Authors:
O. Kryštůfková
Authors‘ workplace:
Revmatologický ústav a Klinika revmatologie, 1. lékařská fakulta, UK, Praha
Published in:
Čes. Revmatol., 19, 2011, No. 2, p. 68-72.
Category:
Posts from Congress
Overview
Cílem léčby revmatických onemocnění je dosáhnout včasné a dlouhodobé remise. Možnosti biologické léčby v revmatologii se rozšiřují a přitom až 30 % nemocných na ni neodpovídá. Proto se hledají biomarkery dobré odpovědi, které by nám umožnily včas zahájit – pro individuální nemocné – optimálně účinnou léčbu, s minimálním rizikem nežádoucích účinků a s minimálními náklady. V současné době jsou studovány prediktory účinnosti biologické léčby genetické i negenetické. K těm druhým patří reaktanty akutní fáze, autoprotilátky, cytokiny a receptory, které jsou studovány na úrovni proteinu i transkriptů RNA v krvi i v synoviální tkáni. Přístup ke studiu prediktivní hodnoty odpovědi na léčbu směřuje od sledování jednotlivých parametrů ke studiím bílkovinných a transkripčních profilů. Téma bylo zpracováno jako informativní sdělení o současných možnostech tohoto hledání prediktorů biologické léčby.
Klíčová slova:
biologická léčba, biomarkery, farmakogenetické prediktory, proteinové a expresní profily, TNFα blokující léky
Referát z I. kongresu biologické léčby v Praze 12.–13. 11. 2010
Koncept individualizované terapie
V současné době máme k dispozici biologická léčiva cílená na různé patogenetické mechanismy revmatických onemocnění. Ideálem je dosáhnout včasné a dlouhodobé remise. K tomu bychom potřebovali u individuálních nemocných včas zahájit optimálně účinnou léčbu, s minimálním rizikem nežádoucích účinků a s minimálními náklady. Přitom vždy existuje část pacientů, kteří na léčbu neodpovídají primárně, nebo ztratí účinnost během delšího období. Potřebujeme znát příčiny nedostatečné odpovědi či její ztráty, abychom případně mohli včas přejít na jinou a individuálně volenou, účinnou terapii. Cílem je vyvinout testy biomarkerů předpovídajících dobrou odpověď na léčbu, které by bylo možno stanovit levnými genetickými a proteomickými skríninkovými postupy s vysokou kapacitou (1). V dalším textu bude podán průřezový pohled na současné přístupy k hledání prediktivních biomarkerů účinnosti léků blokujících tumor nekrotizující faktor alfa (TNFα) u revmatoidní artritidy (RA), protože jsou dostupné již delší dobu pro dostatečně velkou populaci nemocných. Pro podrobnější informaci doporučuji přehledné práce Hanse Scherera (2) a Laury Gibbons (3).
Přístupy k hledání biomarkerů
Studie biomarkerů vychází ze dvou hlavních strategií. Cíleně hodnotí již známé významné rizikové faktory onemocnění [např.: polymorfismy HLA – sdílený epitop, TNFα, FγcRIIIA (receptor pro Fc fragment IgG), PTPN22 (protein tyrosine phosphatase N22), PADI4 (Peptidyl arginine deiminase4), CD40 (4–6)] a prediktory progrese a závažnosti RA [pozitivita autoprotilátek (ACPA / anti-CCP, RF), radiologický nález erozí, markery kostní degradace, výška FW či CRP, HAQ skóre, kouření (7–9)]. Druhým přístupem je mapování profilů. Multifaktoriální povaha patogeneze SRO znemožňuje nalézt jednoduché prediktory. Výpovědní hodnotu mají kombinace biomarkerů, tzv. Biomarker signatures – odvozené od genetických expresních studií a proteomických „microarrays“, které stanovují velké spektrum cytokinů a autoprotilátek v jednom testu spolu s klinickými ukazateli aktivity onemocnění.
První výsledky studií musí být ověřeny na nezávislých skupinách a studovaná populace by měla být reprezentativní pro celou léčenou populaci nemocných. Dostupné studie navíc mnohdy nejsou srovnatelné z hlediska (ne)selekce podle autoprotilátkového profilu, etnického původu (interakce genetického pozadí), způsobu hodnocení aktivity, či odpovědi na léčbu (DAS, EULAR, ACR, Rtg, doba setrvání na léku), počtu chorobu modifikujících léků, doby do zahájení terapie a také hodnocených anti-TNFα preparátů.
Z dosud registrovaných anti-TNFα léků k jsou dispozici dostatečně reprezentativní skupiny pacientů léčených infliximabem, adalimumabem a etanerceptem. Sekundární ztráta účinku se spíše přikládá vzniku protilátek proti léčivu a jiný anti-TNFα preparát je ještě účinný (10–12). Zhruba 30 % pacientů však na anti-TNFα neodpoví vůbec, především podává-li se v monoterapii. Příčiny primární nedostatečné odpovědi však jsou méně zřejmé.
Farmakogenetické prediktory odpovědi na TNFα blokující léky
Dosud nebyl zjištěn jednoduchý genetický marker předpovídající odpověď na anti-TNFα, který by byl ověřen na ostatních skupinách i když probíhají extenzivní studie. Zjednodušený přehled polymorfismů asociovaných s dobrou odpovědí je uveden v tabulce 1. Více studií polymorfismu promotorové oblasti genu pro TNFα zjistilo asociaci varianty, která souvisí k rychlostí přepisu (TNFα -308G >A) a nedostatečné odpovědi na léčbu. Vzhledem k nesrovnatelným výsledkům různých skupin byla provedena meta-analýza 12 studií, shrnující výsledky 2576 zkoumaných jedinců kavkazského etnika a neprokázala významný efekt tohoto polymorfismu na účinnost léčby hodnocenou zlepšením DAS28 (13). Na úrovni polymorfismu genu TNFα, tedy není žádné doporučení pro klinickou praxi.
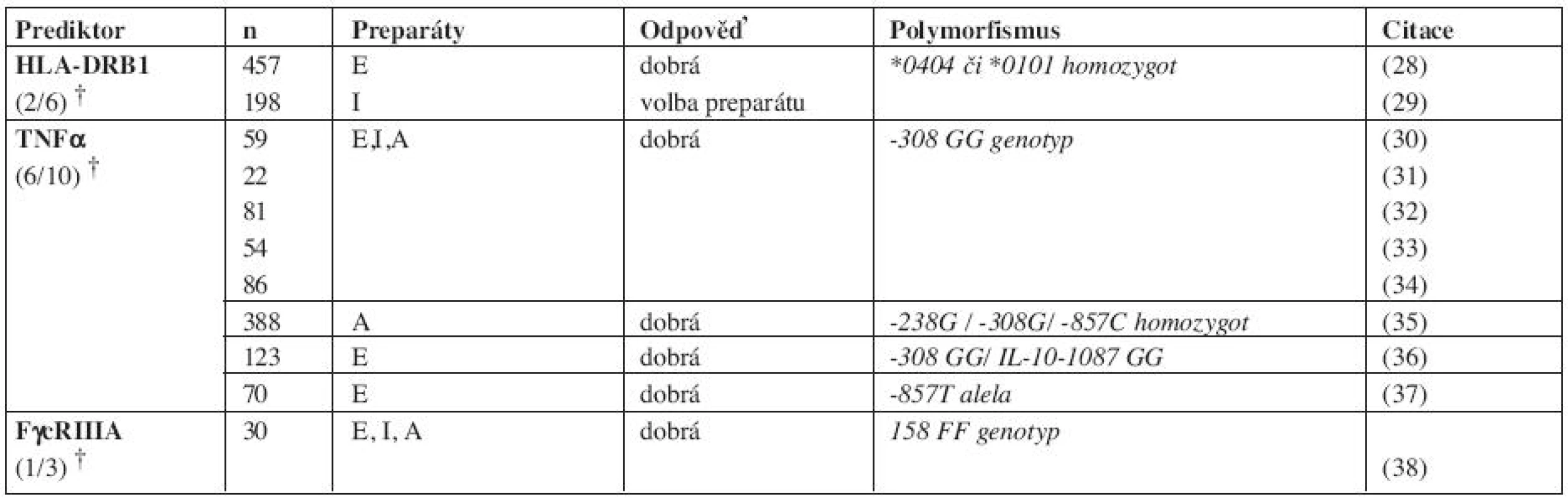
Další studie ukázaly potenciální biomarkery ve variantách genů pro oblasti: HLA-DRB1 Interleukin (IL)-1, IL-10, lymfotoxin α, TNFRSF1A/B (TNF receptor superfamily), Fγc receptor (FCGR2A, FCGR3A and FCGR3B), transforming growth factor β1, MAFB (v-maf musculoaponeurotic fibrosarcoma oncogene homolog B), IFNκ (type 1 interferon) a PON1 (paraoxonase 1). Vzhledem k tomu, že studie byly provedené na různě charakterizovaných skupinách s různým genetickým pozadím a čekají na potvrzení na větších souborech, žádný z kandidátních genů nelze doporučit pro klinické použití.
Prediktory účinnosti anti-TNFα na úrovni jednotlivých proteinů
Existuje mnoho různě koncipovaných studií, které dávají do vztahu hladiny autoprotilátek, reaktantů akutní fáze, cytokinů a hladin léků s odpovědí na léčbu. Níže jsou zmíněny některé příklady (tab. 2). Hodnocení vztahu odpovědi a pozitivity autoprotilátek v séru daly rozdílné výsledky. Byla nalezena jak lepší (14), tak horší odpověď (15) u nemocných s pozitivitou RF nebo anti-CCP. Nemocní s nižší hladinou anti-CCP na počátku a s poklesem IL-6 během terapie měli lepší odpověď na infliximab (16). Stále větší je zájem o studium výpovědní hodnoty izotypů RF pro předpověď účinnosti léčby. Vysoká hladina IgA RF byla asociovaná s horší odpovědí na anti-TNFα terapii (17).
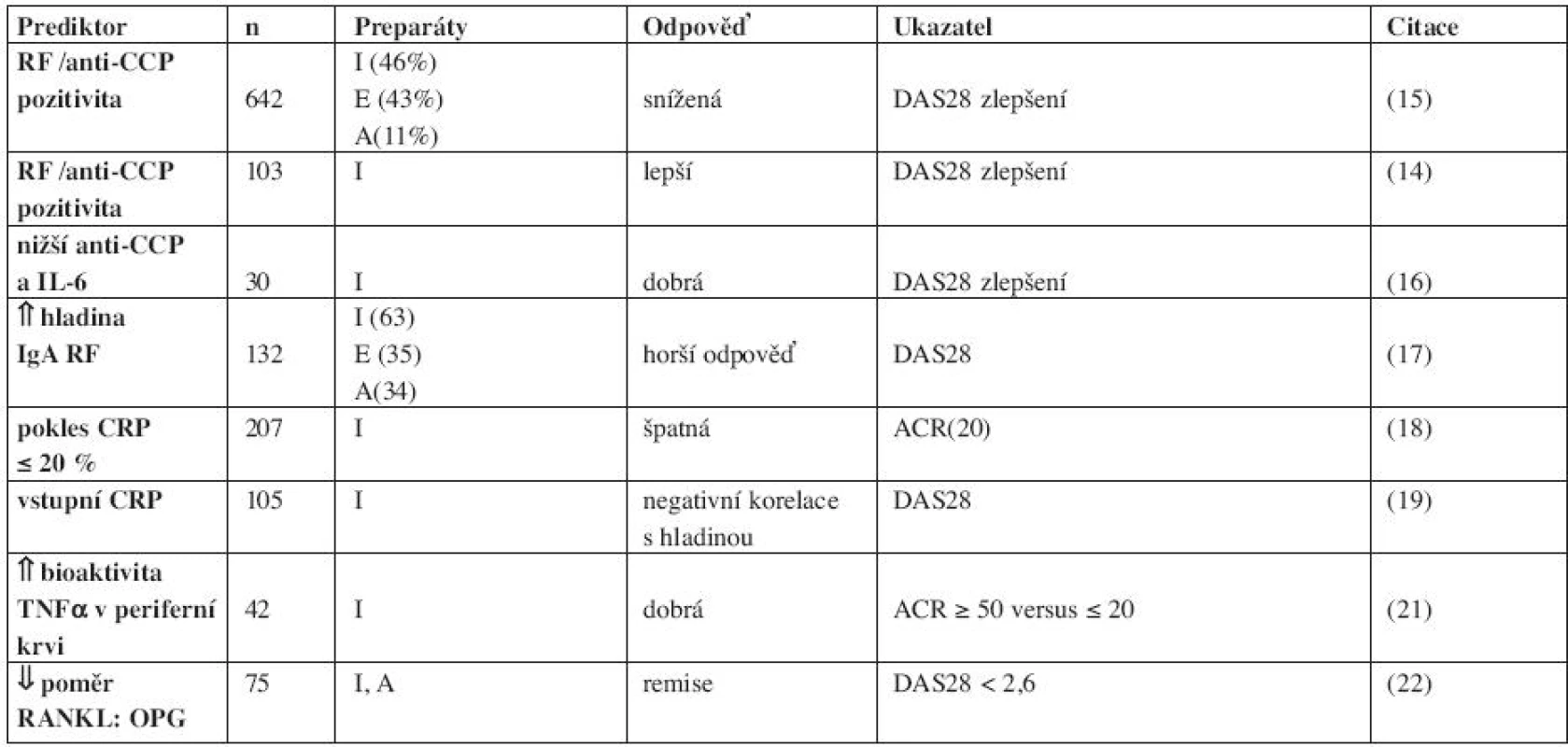
Mezi pacienty u kterých došlo 2 týdny po zahájení terapie infliximabem k malému poklesu CRP o (≤ 20 %) byla vyšší frekvence (86 %) případů s nedostatečnou odpovědí (ACR ≤ 20) 12 týdnů od zahájení léčby (18). Zatímco ve skupině s poklesem CRP bylo 57 % nemocných, kteří dosáhli odpovědi ACR20. Sérový CRP před zahájením léčby koreloval negativně (rs= -0,43; p< 0,001) s hladinou infliximabu, 14 dní po zahájení terapie a nemocní s dobrou odpovědí (podle DAS28) měli vyšší hladiny léku (19). Podrobně je rozebrán vztah hladin C-reaktivního proteinu (CRP) v séru k progresi RA a odpovědi na léčbu a jeho role v patogeneze onemocnění v přehledné práci P. Emeryho a spol. (20). Hladiny CRP mohou být užitečné pro volbu dávek léků (tab. 2).
Bioaktivita TNFα v periferní krvi, měřená produkcí IL-6 a osteoprotegerinu (OPG) byla vyšší u nemocných s dobrou odpovědí na infliximab (podle ACR ≥ 50) ve srovnání s pacienty, kteří na léčbu neodpověděli (ACR ≤ 20) (21). Nižší poměr sérových hladin cytokinu RANKL (ligand pro receptor aktivující nukleární faktor κB): OPG, měřená před terapií infliximabem a adalimumabem, predikoval remisi ve 3. a 7. měsíci po zahájení léčby (22).
Proteinové a expresní profily v predikci odpovědi na anti-TNFα
Výše uvedené studie mají tu nevýhodu, že mají nesrovnatelná uspořádání, charakteristiky studovaných skupin a metodické přístupy k hodnocení aktivity a jednotlivých biomarkerů. Lépe interpretovatelné budou zřejmě studie proteomických a transkripčních profilů. Následují 3 příklady takových přístupů. Blíže k principům a významu profilových studií u RA lze najít v přehledných referátech (23, 24).
Etanercept
Skupina autorů replikovala proteomický profil na 3 skupinách nemocných různých etnik (USA n = 29, Švédsko n = 43, Japonsko n = 21) léčených etanerceptem. V sérech z odběrů před zahájením léčby detekovali protilátky proti 500 autoantigenům na mikročipu a měřili hladiny 12 cytokinů pomocí multiplex array a ELISA testů. Výsledná kombinace 12 autoprotilátek a 12 cytokinů měla pozitivní prediktivní hodnotu pro odpověď na léčbu 58–72 % a negativní prediktivní hodnotu 63 – –78 % (25).
Adalimumab
Další zajímavý marker byl nalezen německou skupinou pomocí expresního profilu monocytů izolovaných z periferní krve nemocných před léčbou (testovací soubor n = 7 / ověřovací n = 70). Z několika kandidátů byla vytipována zvýšená exprese mRNA pro CD11c (integrinový receptor; adhesní molekula, důležitá pro odstraňování opsonizovaných částic a imunitních komplexů, přítomná také na NK buňkách) a byla potvrzena pomocí reverzní transkripční polymerázové řetězové reakce (RT-PCR). U nemocných léčených monoterapií adalimumabem se specificitou 80–100 % a senzitivitou 100 % (síla = 99,6 %; alpha = 0,01) vyšší exprese odlišila pacienty s dobrou odpovědí podle kritérií ACR (26).
Infliximab
Třetí studií tohoto typu je práce skupiny holandských a švédských autorů, kteří hodnotili expresní profil vzorků synoviální tkáně nemocných s RA léčených infliximabem. Nejprve zjistili, že artroskopické vzorky synoviální tkáně odebrané před terapií nemocným s dobrou odpovědí na léčbu (DAS 28 ≥ 1,2) ve srovnání s nemocnými s nedostatečnou odpovědí mají větší obsah TNFα a infiltráty buněk, které jej tvoří – a to makrofágů a T lymfocytů (podle pozitivity CD3, CD68, CD163) (14). V následující práci zjistili, že extrakty RNA z tkání s agregáty lymfocytů (n = 62) se liší v expresním profilu 38 transkriptů (ze 17 972 studovaných genů) u pacientů s dobrou odpovědí dle EULAR kritérií. Jde o geny, které ukazují na vyšší úroveň metabolismu a tedy nepřímo na vyšší aktivitu zánětu u nemocných s dobrou odpovědí (27). Všechny tyto zajímavé nálezy čekají na ověření v nezávislém prospektivním experimentu.
Závěr
V současné době tedy nemáme žádné spolehlivé jednoduché prediktory odpovědi na biologickou léčbu. Budoucnost mají tzv. High througput microarrays, neboli kombinace autoprotilátkových, cytokinových a genových expresních profilů ve spojení s klinickými údaji. Výsledky studií ukazují zajímavé kandidáty biomarkerů dobré odpovědi na biologickou léčbu blokující TNFα. Všechny hypotetické prediktory je nutno ověřit na větších, nezávislých a standardně definovaných skupinách.
Poděkování: Podpořeno výzkumným záměrem
MZČR 0002372801
MUDr. Olga Kryštůfková
Revmatologický ústav
Na Slupi 4
128
50 Praha 2
e-mail:
krys@revma.cz
Sources
1. Verweij CL. Predicting the future of anti-tumor necrosis factor therapy. Arthritis Res Ther 2009; 11 : 115.
2. Scherer HU, Dorner T, Burmester GR. Patient-tailored therapy in rheumatoid arthritis: an editorial review. Curr Opin Rheumatol 22 : 237-45.
3. Gibbons LJ, Hyrich KL. Biologic therapy for rheumatoid arthritis: clinical efficacy and predictors of response. BioDrugs 2009; 23 : 111-24.
4. van der Linden MP, Feitsma AL, le Cessie S, et al. Association of a single-nucleotide polymorphism in CD40 with the rate of joint destruction in rheumatoid arthritis. Arthritis Rheum 2009; 60 : 2242-7.
5. Scherer HU, van der Linden MP, Kurreeman FA, et al. Association of the 6q23 region with the rate of joint destruction in rheumatoid arthritis. Ann Rheum Dis 69 : 567-70.
6. Hoppe B, Haupl T, Egerer K, et al. Influence of peptidylarginine deiminase type 4 genotype and shared epitope on clinical characteristics and autoantibody profile of rheumatoid arthritis. Ann Rheum Dis 2009; 68 : 898-903.
7. van der Helm-van Mil AH, le Cessie S, van Dongen H, et al. A prediction rule for disease outcome in patients with recent-onset undifferentiated arthritis: how to guide individual treatment decisions. Arthritis Rheum 2007; 56 : 433-40.
8. Mjaavatten MD, Uhlig T, Haugen AJ, et al. Positive anti-citrullinated protein antibody status and small joint arthritis are consistent predictors of chronic disease in patients with very early arthritis: results from the NOR-VEAC cohort. Arthritis Res Ther 2009; 11: R146.
9. van der Helm-van Mil AH, Detert J, le Cessie S, et al. Validation of a prediction rule for disease outcome in patients with recent-onset undifferentiated arthritis: moving toward individualized treatment decision-making. Arthritis Rheum 2008; 58 : 2241-7.
10. Buch MH, Bingham SJ, Bejarano V, et al. Therapy of patients with rheumatoid arthritis: outcome of infliximab failures switched to etanercept. Arthritis Rheum 2007; 57 : 448-53.
11. Cohen G, Courvoisier N, Cohen JD, et al. The efficiency of switching from infliximab to etanercept and vice-versa in patients with rheumatoid arthritis. Clin Exp Rheumatol 2005; 23 : 795-800.
12. Hyrich KL, Lunt M, Watson KD, et al. Outcomes after switching from one anti-tumor necrosis factor alpha agent to a second anti-tumor necrosis factor alpha agent in patients with rheumatoid arthritis: results from a large UK national cohort study. Arthritis Rheum 2007; 56 : 13-20.
13. Pavy S, Toonen EJ, Miceli-Richard C, et al. Tumour necrosis factor alpha -308G->A polymorphism is not associated with response to TNFalpha blockers in Caucasian patients with rheumatoid arthritis: systematic review and meta-analysis. Ann Rheum Dis 69 : 1022-8.
14. Wijbrandts CA, Dijkgraaf MG, Kraan MC, et al. The clinical response to infliximab in rheumatoid arthritis is in part dependent on pretreatment tumour necrosis factor alpha expression in the synovium. Ann Rheum Dis 2008; 67 : 1139-44.
15. Potter C, Hyrich KL, Tracey A, et al. Association of rheumatoid factor and anti-cyclic citrullinated peptide positivity, but not carriage of shared epitope or PTPN22 susceptibility variants, with anti-tumour necrosis factor response in rheumatoid arthritis. Ann Rheum Dis 2009; 68 : 69-74.
16. Braun-Moscovici Y, Markovits D, Zinder O, et al. Anti-cyclic citrullinated protein antibodies as a predictor of response to anti-tumor necrosis factor-alpha therapy in patients with rheumatoid arthritis. J Rheumatol 2006; 33 : 497-500.
17. Bobbio-Pallavicini F, Caporali R, Alpini C, et al. High IgA rheumatoid factor levels are associated with poor clinical response to tumour necrosis factor alpha inhibitors in rheumatoid arthritis. Ann Rheum Dis 2007; 66 : 302-7.
18. Buch MH, Seto Y, Bingham SJ, et al. C-reactive protein as a predictor of infliximab treatment outcome in patients with rheumatoid arthritis: defining subtypes of nonresponse and subsequent response to etanercept. Arthritis Rheum 2005; 52 : 42-8.
19. Wolbink GJ, Voskuyl AE, Lems WF, et al. Relationship between serum trough infliximab levels, pretreatment C reactive protein levels, and clinical response to infliximab treatment in patients with rheumatoid arthritis. Ann Rheum Dis 2005; 64 : 704-7.
20. Emery P, Gabay C, Kraan M, et al. Evidence-based review of biologic markers as indicators of disease progression and remission in rheumatoid arthritis. Rheumatol Int 2007; 27 : 793-806.
21. Marotte H, Maslinski W, Miossec P. Circulating tumour necrosis factor-alpha bioactivity in rheumatoid arthritis patients treated with infliximab: link to clinical response. Arthritis Res Ther 2005; 7: R149-55.
22. Gonzalez-Alvaro I, Ortiz AM, Tomero EG, et al. Baseline serum RANKL levels may serve to predict remission in rheumatoid arthritis patients treated with TNF antagonists. Ann Rheum Dis 2007; 66 : 1675-8.
23. Verweij CL. Transcript profiling towards personalised medicine in rheumatoid arthritis. Neth J Med 2009; 67 : 364-71.
24. van Baarsen LG, Bos CL, van der Pouw Kraan TC, et al. Transcription profiling of rheumatic diseases. Arthritis Res Ther 2009; 11 : 207.
25. Hueber W, Tomooka BH, Batliwalla F, et al. Blood autoantibody and cytokine profiles predict response to anti-tumor necrosis factor therapy in rheumatoid arthritis. Arthritis Res Ther 2009; 11: R76.
26. Stuhlmuller B, Haupl T, Hernandez MM, et al. CD11c as a transcriptional biomarker to predict response to anti-TNF monotherapy with adalimumab in patients with rheumatoid arthritis. Clin Pharmacol Ther 0000; 87 : 311-21.
27. Lindberg J, Wijbrandts CA, van Baarsen LG, et al. The gene expression profile in the synovium as a predictor of the clinical response to infliximab treatment in rheumatoid arthritis. PLoS One, 5: e11310.
28. Criswell LA, Lum RF, Turner KN, et al. The influence of genetic variation in the HLA-DRB1 and LTA-TNF regions on the response to treatment of early rheumatoid arthritis with methotrexate or etanercept. Arthritis Rheum 2004; 50 : 2750-6.
29. Marotte H, Pallot-Prades B, Grange L, et al. The shared epitope is a marker of severity associated with selection for, but not with response to, infliximab in a large rheumatoid arthritis population. Ann Rheum Dis 2006; 65 : 342-7.
30. Mugnier B, Balandraud N, Darque A, et al. Polymorphism at position -308 of the tumor necrosis factor alpha gene influences outcome of infliximab therapy in rheumatoid arthritis. Arthritis Rheum 2003; 48 : 1849-52.
31. Fonseca JE, Carvalho T, Cruz M, et al. Polymorphism at position -308 of the tumour necrosis factor alpha gene and rheumatoid arthritis pharmacogenetics. Ann Rheum Dis 2005; 64 : 793-4.
32. Cuchacovich M, Soto L, Edwardes M, et al. Tumour necrosis factor (TNF)alpha -308 G/G promoter polymorphism and TNFalpha levels correlate with a better response to adalimumab in patients with rheumatoid arthritis. Scand J Rheumatol 2006; 35 : 435-40.
33. Seitz M, Wirthmuller U, Moller B, et al. The -308 tumour necrosis factor-alpha gene polymorphism predicts therapeutic response to TNFalpha-blockers in rheumatoid arthritis and spondyloarthritis patients. Rheumatology (Oxford), 2007; 46 : 93-6.
34. Guis S, Balandraud N, Bouvenot J, et al. Influence of -308 A/G polymorphism in the tumor necrosis factor alpha gene on etanercept treatment in rheumatoid arthritis. Arthritis Rheum 2007; 57 : 1426-30.
35. Miceli-Richard C, Comets E, Verstuyft C, et al. A single tumour necrosis factor haplotype influences the response to adalimumab in rheumatoid arthritis. Ann Rheum Dis 2008; 67 : 478-84.
36. Padyukov L, Lampa J, Heimburger M, et al. Genetic markers for the efficacy of tumour necrosis factor blocking therapy in rheumatoid arthritis. Ann Rheum Dis 2003; 62 : 526-9.
37. Kang CP, Lee KW, Yoo DH, et al. The influence of a polymorphism at position -857 of the tumour necrosis factor alpha gene on clinical response to etanercept therapy in rheumatoid arthritis. Rheumatology (Oxford), 2005; 44 : 547-52.
38. Tutuncu Z, Kavanaugh A, Zvaifler N, et al. Fcgamma receptor type IIIA polymorphisms influence treatment outcomes in patients with inflammatory arthritis treated with tumor necrosis factor alpha-blocking agents. Arthritis Rheum 2005; 52 : 2693-6.
Labels
Dermatology & STDs Paediatric rheumatology RheumatologyArticle was published in
Czech Rheumatology

2011 Issue 2
-
All articles in this issue
- Malé molekuly RNA a jejich význam v imunitní odpovědi organismu
- Existují prediktivní ukazatele úspěšnosti biologické léčby?
- Jak vybrat preparát mezi biologickými léky?
- Jak se dívat na strukturální progresi u biologické léčby?
- Mimokloubní projevy revmatických onemocnění a možnosti jejich ovlivnění biologickou léčbou
- Výskyt infekcí při léčbě antagonisty TNF alfa v registru ATTRA
- Biologická léčba revmatoidní artritidy a riziko nádorových onemocnění
- Biologická léčba a speciální situace (těhotenství, kojení, vakcinace a perioperační období)
- Czech Rheumatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Biologická léčba a speciální situace (těhotenství, kojení, vakcinace a perioperační období)
- Mimokloubní projevy revmatických onemocnění a možnosti jejich ovlivnění biologickou léčbou
- Biologická léčba revmatoidní artritidy a riziko nádorových onemocnění
- Výskyt infekcí při léčbě antagonisty TNF alfa v registru ATTRA
