Extracelulární miRNA – biogeneze, funkce a využití jako biomarkerů u revmatických onemocnění
Extracellular miRNA – biogenesis, function and their use as biomarkers in rheumatic diseases.
MicroRNAs (miRNAs) are small non-coding single-stranded RNAs of about 22 nucleotides in length that act as post-transcriptional regulators of gene expression. Depending on the complementarity between miRNA and target mRNA, cleavage or destabilization or translational suppression of mRNA occurs within RISC complex (RNA induced silencing complex). More than 50% of the genes are controlled by at least one miRNA. Moreover, one miRNA can regulate the expression of several genes, and one gene can be regulated by multiple miRNAs. As gene expression regulators, miRNAs are involved in a variety of biological functions. Dysregulation of miRNAs and their target genes contribute to pathophysiology of many diseases including rheumatological disorders. MiRNAs are also present extracellularly in their stable form in body fluids. Their incorporation into membrane vezicles or protein complexes with Ago2, HDL or nucleophosmin 1 protect them against RNases. Cell-free miRNAs can be delivered to another cell in vitro and maintain their functional potential. Therefore, miRNAs can be considered mediators of intercellular communication. Remarkable stability of cell-free miRNAs and their accessibility in body fluid makes them potential diagnostic or prognostic biomarkers and potential therapeutic targets.
Key words:
miRNA, biomarker, therapy
Authors:
K. Prajzlerová; M. Filková
Authors‘ workplace:
Revmatologická klinika, 1. lékařská fakulta, Univerzita Karlova a Revmatologický ústav, Praha
Published in:
Čes. Revmatol., 26, 2018, No. 4, p. 171-179.
Category:
Review Article
Overview
MikroRNA (miRNA) jsou malé nekódující jednořetězcové RNA o velikosti přibližně 22 nukleotidů, které se podílejí na tlumení genové exprese na post-transkripční úrovni. V závislosti na komplementaritě vazby mezi miRNA a cílovou mRNA dochází v rámci inhibičního komplexu RISC (RNA induced silencing complex) buď ke štěpení, nebo destabilizaci mRNA, případně k potlačení translace. Minimálně 50 % genů je řízeno alespoň jednou miRNA, přičemž jedna miRNA může regulovat expresi několika genů a jeden gen může být regulován více miRNA. Jako regulátory genové exprese se miRNA podílí na řízení všech základních buněčných funkcí a jejich dysregulace byla popsána u řady onemocnění, včetně revmatických. MiRNA jsou přítomny i extracelulárně ve stabilní formě v tělních tekutinách. Jejich inkorporace v membránových vezikulách nebo v proteinových komplexech s Ago2, HDL nebo nucleophosminem 1 jim zabezpečuje ochranu před RNázami. Volné (extracelulární) miRNA mohou být v prostředí in vitro vychytávány buňkami, kde si poté udržují svoji regulační funkci. Lze se rovněž domnívat, že tuto funkci mohou plnit i na úrovni organismu. MiRNA se proto považují za prostředek intercelulární komunikace. Vzhledem k jejich lehké dostupnosti a vysoké stabilitě v periferní krvi mohou představovat cirkulující miRNA nadějný diagnostický a prognostický ukazatel, případně i terapeutický cíl.
Klíčová slova:
miRNA, biomarker, terapie
1. Úvod
V roce 1993 byl u Caenorhabditis elegans (C. elegans) objeven gen lin-4 kódující malou RNA s komplementaritou ke genu lin-14 (1). Později byl u stejného modelového organismu popsán gen let-7 kódující 21 nukleotidů dlouhou RNA ovlivňující několik genů regulujících larvální vývoj C. elegans (2). Tyto malé RNA byly později pojmenovány jako mikroRNA (miRNA) (3).
MiRNA jsou jednořetězcové RNA o velikosti přibližně 22 nukleotidů patřící do skupiny malých nekódujících RNA. Podílejí se na tlumení genové exprese na post-transkripční úrovni při procesu tzv. RNA interference (4). Každá miRNA může ovlivňovat několik genů a předpokládá se, že více než 50 % lidských genů je ovlivňováno alespoň jednou miRNA (5). Změny v expresi miRNA a jejich cílových genů přispívají nejenom k udržování fyziologie buňky a organismu jako celku, ale k patofyziologii mnoha onemocnění.
MiRNA se vyskytují nejenom uvnitř buněk, ale i extracelulárně v tělních tekutinách. Značná stabilita těchto extracelulárních (nebo volných či cirkulujících) miRNA a jejich relativně snadná dostupnost z tělních tekutin z nich dělá potencionální diagnostické a prognostické biomarkery řady onemocnění, včetně autoimunitních. V současné době se nejvíce využívají jako biomarkery kardiovaskulárních onemocnění (6).
2. Biogeneze intracelulárních miRNA
Vznik miRNA je poměrně složitý, několikastupňový proces (obr. 1). V jádře buňky jsou nejprve geny pro miRNA přepsány pomocí RNA polymerázy II a tak vznikne primární transkript (pri-miRNA) (7). Jeden primární transkript může obsahovat sekvence několika různých miRNA (4). V následujícím kroku je pri-miRNA štěpena pomocí nukleázy Drosha a proteinu DGCR8 (8), dohromady tvořící tzv. mikroprocesorový komplex (9). DGCR8 se přímo váže na dvouvláknovou oblast pri-miRNA a určuje místo, kde proběhne štěpení nukleázou Drosha. Dojde tak ke vzniku 70 nukleotidové prekurzorové miRNA vlásenky (pre-miRNA) s 2–3 nukleotidovým přesahem na jedné straně (8). Pre-miRNA je následně exportována ven z jádra do cytoplazmy pomocí Exportinu-5, který se váže na její nukleotidový přesah na 3´konci. K vazbě dochází pouze za přítomnosti kofaktoru Ran-GTP. V cytoplazmě interaguje pre-miRNA s enzymem Dicer, který odstraní vlásenkovou smyčku a vznikne tak 20–22 nukleotidové dvojvlákno miRNA:miRNA* (10, 11). Následně je jedno vlákno začleněno do komplexu RISC (RNA-induced silencing complex), který je schopen utlumovat expresi genů, zatímco druhé vlákno (passenger strand) je obvykle degradováno. O tom, které vlákno zůstane a které bude degradováno, rozhoduje jejich termodynamická stabilita (7). V některých případech dojde ke vzniku miRNA z obou vláken (4). Mnohé publikace používají pro odlišení jednotlivých miRNA nomenklaturu miR-3p/miR-5p. Přestože se jedná o miRNA pocházející ze stejného transkriptu, nejsou -3p a -5p navzájem plně komplementární a cílí tedy na jiné geny (12). Existuje několik studií popisujících funkci „passenger strand“. Například u pacientů s revmatoidní artritidou přispívá miR-34a* k rezistenci synoviálních fibroblastů k apoptóze (13).
3. Mechanismus regulace genové exprese pomocí miRNA
RISC komplex má v tlumení genové exprese zásadní význam. Jeho hlavní složku tvoří proteiny z argonautové skupiny (AGO1 – AGO4). Vazebná oblast miRNA (2–8 párů bází) směřuje ven z RISC komplexu (14) a váže se na cílovou mRNA, i když tato vazba není vždycky úplná. Komplementarita s miRNA nukleotidy 2–7 stačí k utlumení exprese cílové mRNA (15). V případě úplné komplementarity s miRNA dojde k degradaci mRNA, v případě částečné komplementarity dojde pouze k blokaci translace mRNA. AGO2 má schopnost přímo štěpit mRNA (4). Ještě častější než přímé štěpení mRNA je snížení stability mRNA (deadenylace poly(A) konce a hydrolýza 5´čepičky) a její následné degradace (16).
Tím, jak miRNA regulují genovou expresi, zasahují prakticky do všech buněčných procesů včetně buněčné proliferace, diferenciace a smrti (apoptózy) (17). Exprese samotných miRNA může být ovlivněna například chromozomovými abnormalitami, mutacemi v primárním transkriptu, jednonukleovým polymorfismem (SNP) nebo defekty ovlivňující proces biogeneze miRNA (změny v aktivitě proteinů Dicer a Drosha) (5). Například u pacientů s chronickou lymfocytární leukémií dochází k deleci oblasti chromozomu 13q14, která obsahuje i geny pro některé miRNA (miR-15 a miR-16), což přispívá k patogenezi onemocnění (18). Snížena exprese miRNA totiž často způsobí rozvoj rakovinných onemocnění, což může být následkem toho, že většina miRNA slouží jako nádorové supresory (5). Rovněž epigenetické mechanismy jako DNA metylace nebo histonová acetylace ovlivňují expresi miRNA (19). Bylo popsáno, že přibližně polovina genů pro miRNA se nachází v oblasti CpG ostrůvků, tedy oblastí s vysokým zastoupením CpG dinukleotidů náchylných k metylaci (20). Hypermetylace promotorových oblastí genů nádorových supresorů způsobí jejich útlum v rakovinných buňkách (21). Nejenom metylace, ale také inhibice histonové deacetylázy může ovlivňovat expresi miRNA (5). Jednotlivé miRNA se mohou ovlivňovat i navzájem. Například myší miR-709 se v jádře buňky váže na pri-miR-15a/16-1 a tím potlačuje tvorbu těchto miRNA (22).
4. Extracelulární miRNA v tělních tekutinách
4.1. Přítomnost extracelulárních miRNA v tělních tekutinách
Dlouho byly miRNA detekovány pouze uvnitř buněk a analyzovány jejich intracelulární funkce. Velkou výzvu v oblasti výzkumu přinesl jejich objev v tělních tekutinách (23). Vzhledem k jejich lehké dostupnosti se nabízí jejich využití jako biomarkerů a rozličné formy, které v extracelulárním prostředí zaručují jejich stabilitu, vedou k hypotézám o jejich funkci v mezibuněčné komunikaci. Přítomnost cirkulujících miRNA byla postupně popsána v séru, plazmě i v dalších tělních tekutinách (24, 25). MiRNA v exozomech izolovaných ze slin jsou ideální neinvazivní biomarker patologií slinných žláz, například u Sjögrenova syndromu (26). MiRNA se vyskytují i v mateřském mléce. Během prvních 6 měsíců laktace zde bylo nalezeno velké množství miRNA se vztahem k imunitě (27). Přítomnost miRNA byla také popsána ve spermatu, vaginálním sekretu a menstruační krvi (28), dále pak ve výplachu průdušek, mozkomíšní a peritoneální tekutině, pleurálním výpotku, moči a slzách. Stanovení miRNA v slzách může pomoci v časné diagnostice glaukomu, makulární degenerace nebo malignit oka (29).
Extracelulární miRNA se vyskytují buďto v mikropartikulích (exozomy, mikrovezikuly a apoptotická tělíska), nebo jsou asociovány s proteiny vázající RNA (Ago2, NPM1), případně lipoproteinovými komplexy (HDL, LDL). To zajišťuje cirkulujícím miRNA vysokou stabilitu a ochranu před všudypřítomnými RNázami. Díky tomu mohou regulovat expresi genů i u vzdálených buněk a podílet se na intracelulární komunikaci (6, 30, 31). Přítomnost miRNA byla popsána v mikropartikulích pocházejících z různých buněčných linií. Při porovnání množství extracelulárních miRNA v supernatantech bylo prokázáno, že většina miRNA je z buňky exportována mimo exozomy (32). Odhaduje se, že až 90 % extracelulárních miRNA je asociováno s proteinovými komplexy, nejčastěji s proteinem AGO2 (33). Kromě AGO2 se mohou extracelulární miRNA vázat na AGO1, AGO3 a AGO4 (34). Extracelulární miRNA se vyskytují také v komplexech s HDL cholesterolem. U pacientů s familiární hypercholesterolémií byl rozdílný profil HDL-miRNA než u zdravých jedinců (35). Přítomnost miRNA byla popsána také v komplexech s LDL cholesterolem, ale ve výrazně nižších koncentracích než u HDL. Nicméně například prozánětlivá miR-155 má vyšší zastoupení u LDL než u HDL (36). Dalším proteinem schopným vázat miRNA je nucleophosmin (NPM1), fosfoprotein exprimovaný proliferujícími buňkami sloužící jako regulátor exportu ribozomů (37).
4.2. Sekreční mechanismy extracelulárních miRNA
Do sekrece miRNA do extracelulárního prostředí jsou zapojeny ceramid-sekreční mechanismy a sphingomyelináza (nSMase). Experimentální inhibice nSMase způsobuje snížení sekrece miRNA a opačně – zvýšená exprese nSMase způsobuje zvýšení hladin extracelulárních miRNA (38). Také bylo prokázáno, že inhibice nSMase nemá vliv na intracelulární obsah miRNA, ale ovlivňuje hladiny této miRNA v exozomech (39). Přesné selekční mechanismy toho, jaké miRNA se dostávají z buněk do cirkulace, nejsou doposud známé. K sekreci miRNA ale může docházet i nespecificky, například během programované buněčné smrti (40). V tom případě se miRNA dostává do cirkulace ve formě apoptotických tělísek vylučovaných buňkou během apoptózy (41). Existuje určitá podobnost mezi exozomy a apoptotickými buňkami. Phospatidylserin, který se vyskytuje na povrchu apoptotických buněk a je rozpoznáván fagocyty, se vyskytuje také na povrchu exozomů (30).
Existuje velký rozdíl v zastoupení miRNA vyskytujících se uvnitř mikropartikulí, nebo vázaných na proteiny: bylo zjištěno, že některé miRNA (např. miR-let-7a) se vyskytují uvnitř mikrovezikul, některé je ale možné detekovat pouze v asociaci s proteiny (např. miR-122) (33). Některé miRNA byly více exprimovány v buňkách, některé v supernatantech (39, 42) a některé miRNA byly detekovány výhradně v exozomech (39). Rozdíly mohou být podmíněny tím, z jakých buněk jsou miRNA exportovány. Například pro játra specifická miR-122 může být exportována z hepatocytů společně s dalšími proteiny, zatímco miR-let-7a pravděpodobně pochází z buněk produkujících mikrovezikuly (33).
4.3. Funkční důsledky extracelulárních miRNA a jejich terapeutické možnosti
Experimentálně bylo prokázáno, že různé typy lidských buněk aktivně exportují miRNA ve formě mikropartikulí nebo v komplexech s proteiny a tyto miRNA mohou být dopravovány do jiných buněk a zde být opět funkční (32, 35, 42). S ohledem na jejich funkce in vitro se nabízí i podobná funkce na úrovni organismu a využití extracelulárních miRNA v terapii např. maligních tumorů, zánětlivých revmatických onemocnění, diabetu mellitu, infekčních onemocnění a dalších.
Bioaktivní obsah exozomů může mít imunomodulační potenciál, jak bylo prokázáno v in vitro experimentech transportu exozomálních miRNA z T lymfocytů do antigen prezentujících buněk, čímž dochází k ovlivnění imunitní reakce (43). Dále se např. miRNA v exozomech uvolněných z nádorových buněk vážou na Toll-like receptory, indukují tvorbu pro-metastatických zánětlivých cytokinů s následným růstem tumorů a tvorbou metastáz, což potvrdily i in vivo experimenty (44). Potlačení růstu nádoru in vivo aplikací exozomů obohacených o miRNA, a tím i jejich funkci v intercelulární komunikaci, potvrdily i další studie (45).
Normální jaterní buňky produkují miR-26a, která se u nádorů podílí na brždění buněčného cyklu, a u karcinomů je její produkce výrazně snížena. Na myším modelu bylo u nádorů po podání miR-26a pozorováno výrazné utlumení proliferace, indukce apoptózy a tím i inhibice růstu nádoru (46).
Krom nádorové terapie se nabízí i možnost využití miRNA také při léčbě revmatických onemocnění. MiR-15a se váže na antiapoptotický protein Bcl-2 a tím indukuje apoptózu. V synoviální tkáni myší s indukovanou artritidou je exprese miR-15 snížena. In vivo aplikace této miRNA do kolenního kloubu u myšího modelu artritidy měla za následek snížení tvorby Bcl-2 a následnou indukci apoptózy v synoviální tkáni (47). MiR-146a jako negativní regulátor imunitních dějů je zvýšeně exprimována u pacientů s revmatoidní artritidou jak lokálně (synoviální tkáni), tak systémově (v periferních mononukleárních buňkách) (48, 49). V in vitro experimentech byla potvrzena funkce této miRNA jako inhibitoru osteoklastogeneze (tvorby osteoklastů podílejících se na odbourávání kostní tkáně) a následně bylo potvrzeno, že podání miR-146a in vivo chrání myši s indukovanou artritidou před destrukcí kloubu (50). Naopak miR-223, která je také zvýšená u pacientů s revmatoidní artritidou, diferenciaci osteoklastů stimuluje. Inhibice miR-223 u artritických myší vedla ke snížení tvorby kostních erozí a zlepšení lokálního zánětu (51). U myšího modelu lupusu se splenomegalií byly u B a T buněk popsány vyšší hladiny miR-21, která je známá jako regulátor apoptózy a buněčné proliferace. In vivo inhibice této miRNA měla za následek zmenšení sleziny a potlačení autoimunitních projevů tohoto onemocnění (52).
Terapeutické využití miRNA se nabízí i u diabetu mellitu, kde např. miR-103 a miR-107 se podílejí na regulaci inzulinové senzitivity. In vivo podání miR-107 zhoršuje glukózovou toleranci a inzulinovou senzitivitu, zatím co podání inhibitorů těchto miRNA vede ke stabilizaci inzulinového receptoru, posílení signálních drah a zvýšení vychytávání glukózy stimulované inzulinem u obézních myší (53).
Průlom ve využití miRNA v terapii bylo klinické hodnocení fáze II (NCT01200420) u pacientů s chronickou hepatitidou C, které testovalo bezpečnost, tolerabilitu, farmakokinetiku a antivirovou aktivitu antagonisty miR-122 s cílem léčby hepatitidy C (54, 55). Toto hodnocení vycházelo z esenciální role jaterní miR-122 v replikaci viru HCV a inhibice replikace viru a zlepšení jaterní léze u in vivo modelu (56-58).
4.4. Extracelulární miRNA a jejich využití jako biomarkerů
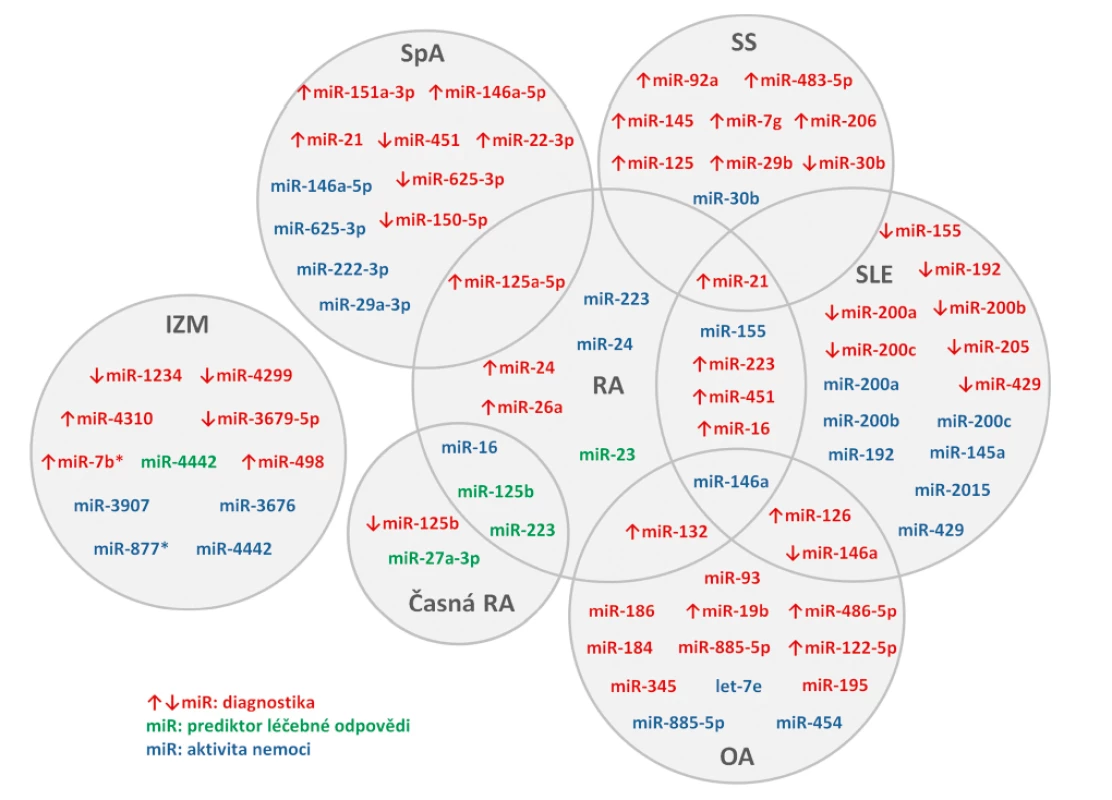
Funkce buněčných miRNA i jejich využití jako biomarkerů revmatických onemocnění byla popsána v mnoha publikacích, ale u extracelulárních miRNA je odborných prací výrazně méně (obr. 2). Tyto mohou sloužit jako diagnostické markery, markery aktivity nemoci nebo odpovědi na léčbu.
Revmatoidní artritida
Porovnání hladin miRNA v plazmě a synoviální tekutině prokázalo vyšší hladiny miR-16, miR-132, miR-146a a miR-223 v plazmě než v synoviální tekutině u pacientů s etablovanou revmatoidní artritidou (RA) (n = 30) a osteoartrózou (OA) (n = 30), zatímco korelace mezi hladinami v plazmě a synoviální tekutině nalezena nebyla. V synoviální tekutině u RA byly nalezeny vyšší hladiny miR-16, miR-146a, miR-155 a miR-223 než u OA. Výrazně vyšší hladiny miR-132 byly v plazmě zdravých kontrol (ZK) (n = 30) v porovnání s RA i OA, které na základě ROC analýzy odlišily pacienty s RA a OA od ZK s vysokou senzitivitou i specificitou (59). V jiné práci byly nalezeny výrazně vyšší hladiny miR-24, miR-26a a miR-125a-5p v plazmě RA (n = 102) oproti ZK (n = 104) schopné odlišit RA pacienty od zdravých jedinců, zejména však kombinace obou miR-24 a miR-125a-5p. Sama miR-24 pak korelovala s CRP, VAS a DAS28, což naznačuje její potencionální využití jako biomarker aktivity nemoci (60).
U pacientů s časnou RA (early RA, ERA) (n = 34) byly zjištěny nižší sérové hladiny miR-146a, miR-155 a miR-16 v porovnání s pacienty s etablovanou RA (n = 28). U ERA byl sledován efekt terapie DMARDs na sérové hladiny miRNA. Nárůst miR-16 z měsíce 0 do měsíce 3 koreloval s poklesem DAS28 z měsíce 3 na 12. Vyšší miR-223 u pacientů před zahájením léčby pozitivně korelovala s CRP a DAS28 a poklesem aktivity onemocnění v následujících měsících. (61). MiR-27a-3p v plazmě se ukázala jako potencionální prediktivní biomarker dosažení remise pacientů s ERA (n = 180) léčenými adalimumabem v kombinaci s DMARDs (disease modifying antirheumatic drugs) (62). Plazmové hladiny miR-125b byly u pacientů s ERA (n = 58) nižší než u zdravých kontrol (n = 54) a po třech měsících TNFα terapie došlo k jejich zvýšení (63). Vyšší sérové hladiny miR-125b u pacientů s RA (n = 32) byly asociovány s dobrou odpovědí pacientů na léčbu rituximabem, naopak pacienti s nízkou expresí miR-125b měli menší šanci na klinické zlepšení po 3 měsících terapie (64). V jiné studii se sérové hladiny miR-125b spolu s miR-16-5p, miR-23 miR-126, miR-146a, miR-23 a miR-223 zvýšily po podání šestiměsíční kombinované terapie TNFα-inhibitory a DMARDs u RA pacientů s dobrou odpovědí na léčbu (n = 85). Výsledky ROC analýzy ukázaly jako ideální prediktor léčebné odpovědi kombinaci miR-23 a miR-223 (65).
Osteoartróza
Při stanovení cirkulujících miRNA v séru pacientů s OA (n = 816) byly miR-let-7e, miR-454 a miR-885-5p asociovány s těžkou OA kolenního a kyčelního kloubu. Zejména miR-let-7e byla popsána jako negativní prediktor totální kloubní náhrady (66). V nedávné studii byla v plazmě pozorována vyšší exprese miR-19b, miR-92a, miR-122-5p, miR-320b a miR-486-5p u pacientů s OA kolene (n = 100) v porovnání se ZK (n = 100). Další analýza potvrdila miR-19b, miR-122-5p a miR-486-5p jako rizikové pro rozvoj OA a jejich kombinace byla popsána jako potencionální biomarker pro diagnostiku a posouzení závažnosti tohoto onemocnění (67). V jiné studii byl popsán signifikantní rozdíl u 8 miRNA v plazmě pacientů s OA (n = 27) v porovnání ze ZK (n = 27) (miR-93, miR-126, miR-146a, miR-184, miR-186, miR-195, miR-345, miR-885-5p). Predikční algoritmy zjistily, že minimálně 6 cílových genů těchto miRNA má etablovanou roli v patogenezi OA (68).
Systémový lupus erythematodes
U pacientů se systémovým lupus erythematodes (SLE) (n = 30) byly popsány vyšší hladiny miR-21, miR-451, miR-223, miR-16 a miR-126 v porovnání se ZK (n = 20). První čtyři zmiňované miRNA byly navíc vyšší i u RA (n = 25). Bioinformatická analýza dále potvrdila, že tyto miRNA se podílí v regulaci transdukčních drah a buněčné interakci u SLE (69). V jiných pracích byly u SLE pacientů (n = 40) porovnávány sérové a močové hladiny miRNA. Několik miRNA (miR-146a, miR-155, miR-200a, miR-200b, miR-200c, miR-429, miR-205 a miR-192) mělo u pacientů se SLE nižší hladiny v séru v porovnání se ZK (n = 30). Zatím co miR-200a, miR-200c, miR-141, miR-429 a miR-192 byly v moči SLE pacientů nižší, tak hladiny miR-146a v moči byly u SLE pacientů vyšší než u ZK. Sérové hladiny miR-145a, miR-155, miR-200b, miR-200c, miR-429, miR-2015 a miR-192 korelovaly s renálními funkcemi (eGFR), sérové miR-146a a miR-200a negativně korelovaly s aktivitou nemoci dle indexu SLEDAI a s proteinurií (70, 71). Kromě dalších různě exprimovaných miRNA u pacientů se SLE je řada z nich zvýšena nebo snížena (např. miR-342-3p, miR-223, miR-20a) u SLE pacientů s aktivní nefritidou (72, 73).
Systémová sklerodermie
U pacientů se systémovou sklerodermií (SSc) (n = 61) byly popsány miRNA, které měly vyšší expresi v séru SSc pacientů oproti zdravým kontrolám (n = 18) (miR-7g, miR-21, miR-29b, miR-92a, miR-125, miR-145, miR-206) (74, 75). Naproti tomu miR-30b měla u pacientů se SSc (n = 50) sníženou expresi a její hladiny negativně korelovali s aktivitou nemoci posuzovanou dle Rodanova kožního skóre (76). V nedávné práci byla zjištěna zvýšená exprese miR-483-5p u SSc pacientů (n = 107), včetně časné fáze onemocnění, v porovnání se ZK (n = 24), jejíž hladiny korelovaly s modifikovaným Rodnanovým kožním skóre. Její zvýšena exprese v dermálních fibroblastech a endoteliálních buňkách s vlivem na expresi profibrotických genů odráží fakt, že miR-483-5p by mohla sloužit jako biomarker u časných fází SSc (77).
Spondyloartritidy
U ankylozující spondylitidy (AS) (n = 122) byla v séru popsána vyšší exprese miR-21 než u ZK (n = 122), která ale nekorelovala s radiografickým skóre. Vzhledem k pozitivní korelaci s markerem kostní osteoresorpce (C-terminální telopeptid kolagenu I, CTX) a v souvislosti s regulací proteinu, který se podílí na osteoklastogenezi, se rovněž předpokládá její role ve vývoji této nemoci (78). Komplexní analýza plazmatických hladin miRNA u pacientů se spondyloartritidou (SpA) (n = 68) s rozdílnou mírou postižení páteře prokázala odlišnou expresi několika miRNA. Hladiny miR-625-3p byly nižší u pacientů s neradiografickou SpA oproti ZK (n = 39). MiR-29a-3p, miR-146a-5p a miR-222-3p byly u pacientů s AS asociované s mírou postižení páteře a aktivitou nemoci dle BASDAI skóre, miR-625-3p reflektovala aktivitu nemoci u pacientů s AS stadia III-V (79). V jiné práci byly v plazmě AS pacientů popsány miRNA se zvýšenou (miR-146a-5p, miR-125a-5p, miR-151a-3p a miR-22-3p) a se sníženou (miR-150-5p, miR-451) expresí v porovnání se ZK (80).
Idiopatické zánětlivé myopatie
V séru pacientů se zánětlivými idiopatickými myopatiemi (IZM) (n = 28) byla v porovnání se ZK (n = 16) popsána zvýšená exprese miR-7b*, miR-498 a miR-4310 a snížená exprese miR-1234, miR-3679-5p a miR-4299. Dále byly nalezeny 3 miRNA (miR-877*, miR-3676 a miR-3907) s vyšší expresí u pacientů s vysokou aktivitou nemoci oproti pacientům s nízkou aktivitou (81). V jiné studii u pacientů s IZM (n = 10) byly plazmatické hladiny miR-4442 výrazně vyšší než u pacientů s RA (n = 10), SLE (n = 12) nebo u ZK (n = 10), korelovaly s aktivitou onemocnění a hladiny signifikantně poklesly po účinné léčbě (82).
5. Závěr
MiRNA jsou významnými regulátory genové exprese ovlivňující mimo jiné patofyziologii revmatických onemocnění. Extracelulární miRNA jsou navíc velice snadno dostupné. Přestože převažují výzkumy týkající se buněčných miRNA, existuje mnoho prací poukazujících na potencionální využití extracelulárních miRNA jako diagnostických i prognostických biomarkerů.
Doposud však nebyly objasněny přesné sekreční mechanismy extracelulárních miRNA, a tak není jasné, do jaké míry jsou vylučovány specifickou sekrecí nebo pasivně, co rozhoduje o tom, jaká miRNA se uvolní do cirkulace nebo zůstane intracelulárně, nebo do jaké míry dochází k sekreci nezralých miRNA a jestli jsou tyto schopny následného dozrávání. Také nejsou zcela jasné funkce jednotlivých cirkulujících miRNA, zda jsou orgánově nebo tkáňově specifické či nikoliv, a v případě že ano, tak jakým mechanismem miRNA rozpoznávají cílovou buňku a jaké množství uvolněné miRNA již může mít funkční účinek. Všechny tyto otázky zůstávají víceméně nezodpovězené a pro jejich objasnění je potřeba další výzkum.
adresa pro korespondenci:
Ing. Klára Prajzlerová
Revmatologický ústav
Na Slupi 4, Praha 2, 128 50
Email: prajzlerova@revma.cz
Sources
1. Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell 1993; 75(5): 843–54. PubMed PMID: 8252621.
2. Reinhart BJ, Slack FJ, Basson M, Pasquinelli AE, Bettinger JC, Rougvie AE, et al. The 21-nucleotide let-7 RNA regulates developmental timing in Caenorhabditis elegans. Nature 2000; 403(6772): 901–6. doi: 10.1038/35002607. PubMed PMID: 10706289.
3. Lagos-Quintana M, Rauhut R, Lendeckel W, Tuschl T. Identification of novel genes coding for small expressed RNAs. Science 2001; 294(5543): 853–8. doi: 10.1126/science.1064921. PubMed PMID: 11679670.
4. Filipowicz W, Bhattacharyya SN, Sonenberg N. Mechanisms of post-transcriptional regulation by microRNAs: are the answers in sight? Nature reviews Genetics 2008; 9(2): 102–14. doi: 10.1038/nrg2290. PubMed PMID: 18197166.
5. Iorio MV, Croce CM. Causes and consequences of microRNA dysregulation. Cancer journal (Sudbury, Mass) 2012; 18(3): 215–22. Epub 2012/06/01. doi: 10.1097/PPO.0b013e318250c001. PubMed PMID: 22647357; PubMed Central PMCID: PMCPMC3528102.
6. Creemers EE, Tijsen AJ, Pinto YM. Circulating microRNAs novel biomarkers and extracellular communicators in cardiovascular disease? Circulation research 2012; 110(3): 483 95.
7. Krol J, Loedige I, Filipowicz W. The widespread regulation of microRNA biogenesis, function and decay. Nature reviews Genetics 2010; 11(9): 597–610. doi: 10.1038/nrg2843. PubMed PMID: 20661255.
8. Han J, Lee Y, Yeom KH, Nam JW, Heo I, Rhee JK, et al. Molecular basis for the recognition of primary microRNAs by the Drosha-DGCR8 complex. Cell 2006; 125(5): 887–901. doi: 10.1016/j.cell.2006.03.043. PubMed PMID: 16751099.
9. Gregory RI, Yan KP, Amuthan G, Chendrimada T, Doratotaj B, Cooch N, et al. The Microprocessor complex mediates the genesis of microRNAs. Nature 2004; 432(7014): 235–40. doi: 10.1038/nature03120. PubMed PMID: 15531877.
10. Lund E, Guttinger S, Calado A, Dahlberg JE, Kutay U. Nuclear export of microRNA precursors. Science 2004; 303(5654): 95–8. doi: 10.1126/science.1090599. PubMed PMID: 14631048.
11. Kim VN. MicroRNA precursors in motion: exportin-5 mediates their nuclear export. Trends in cell biology 2004;14(4):156-9. PubMed PMID: 15134074.
12. Bhayani MK, Calin GA, Lai SY. Functional relevance of miRNA sequences in human disease. Mutation research 2012; 731(1–2): 14–9. Epub 2011/11/17. doi: 10.1016/j.mrfmmm.2011.10.014. PubMed PMID: 22085809.
13. Niederer F, Trenkmann M, Ospelt C, Karouzakis E, Neidhart M, Stanczyk J, et al. Down-regulation of microRNA-34a* in rheumatoid arthritis synovial fibroblasts promotes apoptosis resistance. Arthritis and rheumatism 2012; 64(6): 1771–9. doi: 10.1002/art.34334. PubMed PMID: 22161761.
14. Pratt AJ, MacRae IJ. The RNA-induced silencing complex: a versatile gene-silencing machine. The Journal of biological chemistry 2009; 284(27): 17897–901. doi: 10.1074/jbc.R900012200. PubMed PMID: 19342379; PubMed Central PMCID: PMC2709356.
15. Lewis BP, Burge CB, Bartel DP. Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets. Cell 2005; 120(1): 15–20. doi: 10.1016/j.cell.2004.12.035. PubMed PMID: 15652477.
16. Eulalio A, Huntzinger E, Nishihara T, Rehwinkel J, Fauser M, Izaurralde E. Deadenylation is a widespread effect of miRNA regulation. Rna 2009; 15(1): 21–32. doi: 10.1261/rna.1399509. PubMed PMID: 19029310; PubMed Central PMCID: PMC2612776.
17. Esteller M. Non-coding RNAs in human disease. Nature reviews Genetics. 2011;12(12):861-74. doi: 10.1038/nrg3074. PubMed PMID: 22094949.
18. Calin GA, Dumitru CD, Shimizu M, Bichi R, Zupo S, Noch E, et al. Frequent deletions and down-regulation of micro - RNA genes miR15 and miR16 at 13q14 in chronic lymphocytic leukaemia. Proceedings of the National Academy of Sciences of the United States of America. 2002; 99(24): 15524-9. doi: 10.1073/pnas.242606799. PubMed PMID: 12434020; PubMed Central PMCID: PMCPMC137750.
19. Iorio MV, Piovan C, Croce CM. Interplay between microRNAs and the epigenetic machinery: an intricate network. Biochemical et Biophysica Acta (BBA)-Gene Regulatory Mechanisms 2010; 1799(10): 694–701.
20. Weber B, Stresemann C, Brueckner B, Lyko F. Methylation of human microRNA genes in normal and neoplastic cells. Cell cycle 2007; 6(9): 1001–5. Epub 2007/04/26. doi: 10.4161/cc.6.9.4209. PubMed PMID: 17457051.
21. Baylin SB, Jones PA. A decade of exploring the cancer epigenome - biological and translational implications. Nat Rev Cancer 2011; 11(10): 726–34. doi: 10.1038/nrc3130. PubMed PMID: 21941284; PubMed Central PMCID: PMCPMC3307543.
22. Tang R, Li L, Zhu D, Hou D, Cao T, Gu H, et al. Mouse miRNA-709 directly regulates miRNA-15a/16-1 biogenesis at the posttranscriptional level in the nucleus: evidence for a microRNA hierarchy system. Cell Res 2012; 22(3): 504–15. Epub 2011/08/25. doi: 10.1038/cr.2011.137. PubMed PMID: 21862971; PubMed Central PMCID: PMCPMC3292299.
23. Chim SS, Shing TK, Hung EC, Leung TY, Lau TK, Chiu RW, et al. Detection and characterization of placental microRNAs in maternal plasma. Clinical chemistry. 2008;54(3):482-90. doi: 10.1373/clinchem.2007.097972. PubMed PMID: 18218722.
24. Chen X, Ba Y, Ma L, Cai X, Yin Y, Wang K, et al. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases. Cell research. 2008; 18(10): 997–1006.
25. Mitchell PS, Parkin RK, Kroh EM, Fritz BR, Wyman SK, Pogosova-Agadjanyan EL, et al. Circulating microRNAs as stable blood-based markers for cancer detection. Proceedings of the National Academy of Sciences of the United States of America. 2008; 105(30): 10513–8. doi: 10.1073/pnas.0804549105. PubMed PMID: 18663219; PubMed Central PMCID: PMCPMC2492472.
26. Michael A, Bajracharya SD, Yuen PS, Zhou H, Star RA, Illei GG, et al. Exosomes from human saliva as a source of microRNA biomarkers. Oral Dis 2010; 16(1): 34–8. doi: 10.1111/j.1601-0825.2009.01604.x. PubMed PMID: 19627513; PubMed Central PMCID: PMCPMC2844919.
27. Kosaka N, Izumi H, Sekine K, Ochiya T. microRNA as a new immune-regulatory agent in breast milk. Silence. 2010;1(1):7. doi: 10.1186/1758-907X-1-7. PubMed PMID: 20226005; PubMed Central PMCID: PMCPMC2847997.
28. Zubakov D, Boersma AW, Choi Y, van Kuijk PF, Wiemer EA, Kayser M. MicroRNA markers for forensic body fluid identification obtained from microarray screening and quantitative RT-PCR confirmation. Int J Legal Med 2010; 124(3): 217–26. doi: 10.1007/s00414-009-0402-3. PubMed PMID: 20145944; PubMed Central PMCID: PMCPMC2855015.
29. Weber JA, Baxter DH, Zhang S, Huang DY, Huang KH, Lee MJ, et al. The microRNA spectrum in 12 body fluids. Clinical chemistry. 2010; 56(11): 1733–41. doi: 10.1373/clinchem.2010.147405. PubMed PMID: 20847327; PubMed Central PMCID: PMC4846276.
30. Kosaka N, Iguchi H, Ochiya T. Circulating microRNA in body fluid: a new potential biomarker for cancer diagnosis and prognosis. Cancer Sci. 2010; 101(10): 2087–92. doi: 10.1111/j.1349-7006.2010.01650.x. PubMed PMID: 20624164.
31. Cocucci E, Racchetti G, Meldolesi J. Shedding microvesicles: artefacts no more. Trends in cell biology. 2009;19(2):43-51. Epub 2009/01/16. doi: 10.1016/j.tcb.2008.11.003. PubMed PMID: 19144520.
32. Wang K, Zhang S, Weber J, Baxter D, Galas DJ. Export of microRNAs and microRNA-protective protein by mammalian cells. Nucleic acids research. 2010;38(20):7248-59. doi: 10.1093/nar/gkq601. PubMed PMID: 20615901; PubMed Central PMCID: PMCPMC2978372.
33. Arroyo JD, Chevillet JR, Kroh EM, Ruf IK, Pritchard CC, Gibson DF, et al. Argonaute2 complexes carry a population of circulating microRNAs independent of vesicles in human plasma. Proceedings of the National Academy of Sciences. 2011; 108(12): 5003–8.
34. Turchinovich A, Weiz L, Langheinz A, Burwinkel B. Characterization of extracellular circulating microRNA. Nucleic acids research. 2011; 39(16): 7223–33. doi: 10.1093/nar/gkr254. PubMed PMID: 21609964; PubMed Central PMCID: PMCPMC3167594.
35. Vickers KC, Palmisano BT, Shoucri BM, Shamburek RD, Remaley AT. MicroRNAs are transported in plasma and delivered to recipient cells by high-density lipoproteins. Nature cell biology. 2011; 13(4) :423–33.
36. Wagner J, Riwanto M, Besler C, Knau A, Fichtlscherer S, Roxe T, et al. Characterization of levels and cellular transfer of circulating lipoprotein-bound microRNAs. Arterioscler Thromb Vasc Biol. 2013; 33(6): 1392–400. doi: 10.1161/ATVBAHA.112.300741. PubMed PMID: 23559634.
37. Maggi LB, Kuchenruether M, Dadey DY, Schwope RM, Grisendi S, Townsend RR, et al. Nucleophosmin serves as a rate-limiting nuclear export chaperone for the Mammalian ribosome. Molecular and cellular biology. 2008; 28(23): 7050-65.
38. Kosaka N, Iguchi H, Yoshioka Y, Takeshita F, Matsuki Y, Ochiya T. Secretory mechanisms and intercellular transfer of microRNAs in living cells. The Journal of biological chemistry. 2010;285(23):17442-52. doi: 10.1074/jbc.M110.107821. PubMed PMID: 20353945; PubMed Central PMCID: PMC2878508.
39. Kogure T, Lin WL, Yan IK, Braconi C, Patel T. Intercellular nanovesicle-mediated microRNA transfer: a mechanism of environmental modulation of hepatocellular cancer cell growth. Hepatology. 2011;54(4):1237-48. Epub 2011/07/02. doi: 10.1002/hep.24504. PubMed PMID: 21721029; PubMed Central PMCID: PMCPMC3310362.
40. Turchinovich A, Samatov TR, Tonevitsky AG, Burwinkel B. Circulating miRNAs: cell-cell communication function? Front Genet. 2013; 4 : 119. doi: 10.3389/fgene.2013.00119. PubMed PMID: 23825476; PubMed Central PMCID: PMCPMC3695387.
41. Zernecke A, Bidzhekov K, Noels H, Shagdarsuren E, Gan L, Denecke B, et al. Delivery of microRNA-126 by apoptotic bodies induces CXCL12-dependent vascular protection. Sci Signal. 2009; 2(100): ra81. doi: 10.1126/scisignal.2000610. PubMed PMID: 19996457.
42. Valadi H, Ekstrom K, Bossios A, Sjostrand M, Lee JJ, Lotvall JO. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nature cell biology. 2007;9(6):654-9. doi: 10.1038/ncb1596. PubMed PMID: 17486113.
43. Mittelbrunn M, Gutierrez-Vazquez C, Villarroya-Beltri C, Gonzalez S, Sanchez-Cabo F, Gonzalez MA, et al. Unidirectional transfer of microRNA-loaded exosomes from T cells to antigen-presenting cells. Nat Commun. 2011; 2 : 282. doi: 10.1038/ncomms1285. PubMed PMID: 21505438; PubMed Central PMCID: PMCPMC3104548.
44. Fabbri M, Paone A, Calore F, Galli R, Gaudio E, Santhanam R, et al. MicroRNAs bind to Toll-like receptors to induce prometastatic inflammatory response. Proceedings of the National Academy of Sciences of the United States of America 2012; 109(31): E2110-6. doi: 10.1073/pnas.1209414109. PubMed PMID: 22753494; PubMed Central PMCID: PMCPMC3412003.
45. Iguchi H, Kosaka N, Ochiya T. Secretory microRNAs as a versatile communication tool. Communicative & integrative biology. 2010; 3(5): 478–81. doi: 10.4161/cib.3.5.12693. PubMed PMID: 21057646; PubMed Central PMCID: PMC2974086.
46. Kota J, Chivukula RR, O’Donnell KA, Wentzel EA, Montgomery CL, Hwang HW, et al. Therapeutic microRNA delivery suppresses tumorigenesis in a murine liver cancer model. Cell 2009; 137(6): 1005–17. doi: 10.1016/j.cell.2009.04.021. PubMed PMID: 19524505; PubMed Central PMCID: PMCPMC2722880.
47. Nagata Y, Nakasa T, Mochizuki Y, Ishikawa M, Miyaki S, Shibuya H, et al. Induction of apoptosis in the synovium of mice with autoantibody-mediated arthritis by the intraarticular injection of double-stranded MicroRNA-15a. Arthritis and rheumatism 2009; 60(9): 2677–83. doi: 10.1002/art.24762. PubMed PMID: 19714650.
48. Stanczyk J, Pedrioli DM, Brentano F, Sanchez-Pernaute O, Kolling C, Gay RE, et al. Altered expression of MicroRNA in synovial fibroblasts and synovial tissue in rheumatoid arthritis. Arthritis and rheumatism 2008; 58(4): 1001–9. doi: 10.1002/art.23386. PubMed PMID: 18383392.
49. Pauley KM, Satoh M, Chan AL, Bubb MR, Reeves WH, Chan EK. Upregulated miR-146a expression in peripheral blood mononuclear cells from rheumatoid arthritis patients. Arthritis research & therapy 2008; 10(4): R101. doi: 10.1186/ar2493. PubMed PMID: 18759964; PubMed Central PMCID: PMCPMC2575615.
50. Nakasa T, Shibuya H, Nagata Y, Niimoto T, Ochi M. The inhibitory effect of microRNA-146a expression on bone destruction in collagen-induced arthritis. Arthritis and rheumatism 2011; 63(6): 1582–90. doi: 10.1002/art.30321. PubMed PMID: 21425254.
51. Li YT, Chen SY, Wang CR, Liu MF, Lin CC, Jou IM, et al. Brief report: amelioration of collagen-induced arthritis in mice by lentivirus-mediated silencing of microRNA-223. Arthritis and rheumatism 2012; 64(10): 3240–5. doi: 10.1002/art.34550. PubMed PMID: 22674011.
52. Garchow BG, Bartulos Encinas O, Leung YT, Tsao PY, Eisenberg RA, Caricchio R, et al. Silencing of microRNA-21 in vivo ameliorates autoimmune splenomegaly in lupus mice. EMBO Mol Med 2011; 3(10): 605–15. doi: 10.1002/emmm.201100171. PubMed PMID: 21882343; PubMed Central PMCID: PMCPMC3258486.
53. Trajkovski M, Hausser J, Soutschek J, Bhat B, Akin A, Zavolan M, et al. MicroRNAs 103 and 107 regulate insulin sensitivity. Nature 2011; 474(7353): 649–53. doi: 10.1038/nature10112. PubMed PMID: 21654750.
54. Janssen HL, Reesink HW, Lawitz EJ, Zeuzem S, Rodriguez-Torres M, Patel K, et al. Treatment of HCV infection by targeting microRNA. The New England journal of medicine 2013; 368(18): 1685–94. doi: 10.1056/NEJMoa1209026. PubMed PMID: 23534542.
55. Ottosen S, Parsley TB, Yang L, Zeh K, van Doorn LJ, van der Veer E, et al. In vitro antiviral activity and preclinical and clinical resistance profile of miravirsen, a novel anti-hepatitis C virus therapeutic targeting the human factor miR-122. Antimicrobial agents and chemotherapy 2015; 59(1): 599–608. doi: 10.1128/AAC.04220-14. PubMed PMID: 25385103; PubMed Central PMCID: PMCPMC4291405.
56. Jopling CL, Yi M, Lancaster AM, Lemon SM, Sarnow P. Modulation of hepatitis C virus RNA abundance by a liver-specific MicroRNA. Science 2005 ;309(5740): 1577–81. doi: 10.1126/science.1113329. PubMed PMID: 16141076.
57. Jopling CL, Schutz S, Sarnow P. Position-dependent function for a tandem microRNA miR-122-binding site located in the hepatitis C virus RNA genome. Cell Host Microbe 2008; 4(1): 77–85. doi: 10.1016/j.chom.2008.05.013. PubMed PMID: 18621012; PubMed Central PMCID: PMCPMC3519368.
58. Lanford RE, Hildebrandt-Eriksen ES, Petri A, Persson R, Lindow M, Munk ME, et al. Therapeutic silencing of microRNA-122 in primates with chronic hepatitis C virus infection. Science 2010; 327(5962): 198–201. doi: 10.1126/science.1178178. PubMed PMID: 19965718; PubMed Central PMCID: PMCPMC3436126.
59. Murata K, Yoshitomi H, Tanida S, Ishikawa M, Nishitani K, Ito H, et al. Plasma and synovial fluid microRNAs as potential biomarkers of rheumatoid arthritis and osteoarthritis. Arthritis research & therapy 2010; 12(3): 1.
60. Murata K, Furu M, Yoshitomi H, Ishikawa M, Shibuya H, Hashimoto M, et al. Comprehensive microRNA analysis identifies miR-24 and miR-125a-5p as plasma biomarkers for rheumatoid arthritis. PloS one. 2013; 8(7): e69118. doi: 10.1371/journal.pone.0069118. PubMed PMID: 23874885; PubMed Central PMCID: PMC3715465.
61. Filkova M, Aradi B, Senolt L, Ospelt C, Vettori S, Mann H, et al. Association of circulating miR-223 and miR-16 with disease activity in patients with early rheumatoid arthritis. Annals of the rheumatic diseases 2014;73(10):1898-904. Epub 2013/07/31. doi: 10.1136/annrheumdis-2012-202815. PubMed PMID: 23897768; PubMed Central PMCID: PMCPmc4173742.
62. Sode J, Krintel SB, Carlsen AL, Hetland ML, Johansen JS, Horslev-Petersen K, et al. Plasma MicroRNA Profiles in Patients with Early Rheumatoid Arthritis Responding to Adalimumab plus Methotrexate vs Methotrexate Alone: A Placebo-controlled Clinical Trial. The Journal of rheumatology 2018; 45(1): 53–61. doi: 10.3899/jrheum.170266. PubMed PMID: 29142030.
63. Hruskova V, Jandova R, Vernerova L, Mann H, Pecha O, Prajzlerova K, et al. MicroRNA-125b: association with disease activity and the treatment response of patients with early rheumatoid arthritis. Arthritis research & therapy 2016; 18(1): 124. doi: 10.1186/s13075-016-1023-0. PubMed PMID: 27255643; PubMed Central PMCID: PMCPMC4890522.
64. Duroux-Richard I, Pers Y-M, Fabre S, Ammari M, Baeten D, Cartron G, et al. Circulating miRNA-125b is a potential biomarker predicting response to rituximab in rheumatoid arthritis. Mediators of inflammation 2014; 2014.
65. Castro-Villegas C, Perez-Sanchez C, Escudero A, Filipescu I, Verdu M, Ruiz-Limon P, et al. Circulating miRNAs as potential biomarkers of therapy effectiveness in rheumatoid arthritis patients treated with anti-TNFalpha. Arthritis research & therapy 2015; 17 : 49. Epub 2015/04/11. doi: 10.1186/s13075-015-0555-z. PubMed PMID: 25860297; PubMed Central PMCID: PMCPmc4377058.
66. Beyer C, Zampetaki A, Lin N-Y, Kleyer A, Perricone C, Iagnocco A, et al. Signature of circulating microRNAs in osteoarthritis. Annals of the rheumatic diseases 2014: annrheumdis-2013-204698.
67. Kong R, Gao J, Si Y, Zhao D. Combination of circulating miR-19b-3p, miR-122-5p and miR-486-5p expressions correlates with risk and disease severity of knee osteoarthritis. American journal of translational research 2017; 9(6): 2852–64. PubMed PMID: 28670374; PubMed Central PMCID: PMCPMC5489886.
68. Cuadra VMB, González-Huerta NC, Romero-Córdoba S, Hidalgo-Miranda A, Miranda-Duarte A. Altered expression of circulating microRNA in plasma of patients with primary osteoarthritis and in silico analysis of their pathways. PloS one 2014; 9(6): e97690.
69. Wang H, Peng W, Ouyang X, Li W, Dai Y. Circulating microRNAs as candidate biomarkers in patients with systemic lupus erythematosus. Translational research: the journal of laboratory and clinical medicine 2012;160(3):198-206. Epub 2012/06/12. doi: 10.1016/j.trsl.2012.04.002. PubMed PMID: 22683424.
70. Wang G, Tam L-S, Li EK-M, Kwan BC-H, Chow K-M, Luk CC-W, et al. Serum and Urinary Cell–free MiR-146a and MiR-155 in Patients with Systemic Lupus Erythematosus. The Journal of rheumatology 2010; 37(12): 2516-22.
71. Wang G, Tam L, Li E, Kwan B, Chow K, Luk C, et al. Serum and urinary free microRNA level in patients with systemic lupus erythematosus. Lupus 2011; 20(5): 493–500.
72. Carlsen AL, Schetter AJ, Nielsen CT, Lood C, Knudsen S, Voss A, et al. Circulating microRNA expression profiles associated with systemic lupus erythematosus. Arthritis & Rheumatism 2013; 65(5): 1324–34.
73. Navarro-Quiroz E, Pacheco-Lugo L, Navarro-Quiroz R, Lorenzi H, Espana-Puccini P, Diaz-Olmos Y, et al. Profiling analysis of circulating microRNA in peripheral blood of patients with class IV lupus nephritis. PloS one. 2017; 12(11):e0187973. doi: 10.1371/journal.pone.0187973. PubMed PMID: 29136041; PubMed Central PMCID: PMCPMC5685598.
74. Sing T, Jinnin M, Yamane K, Honda N, Makino K, Kajihara I, et al. microRNA-92a expression in the sera and dermal fibroblasts increases in patients with scleroderma. Rheumatology 2012: kes120.
75. Koba S, Jinnin M, Inoue K, Nakayama W, Honda N, Makino K, et al. Expression analysis of multiple microRNAs in each patient with scleroderma. Experimental dermatology 2013; 22(7): 489–91.
76. Tanaka S, Suto A, Ikeda K, Sanayama Y, Nakagomi D, Iwamoto T, et al. Alteration of circulating miRNAs in SSc: miR-30b regulates the expression of PDGF receptor –. Rheumatology 2013;52(11):1963-72.
77. Chouri E, Servaas NH, Bekker CPJ, Affandi AJ, Cossu M, Hillen MR, et al. Serum microRNA screening and functional studies reveal miR-483-5p as a potential driver of fibrosis in systemic sclerosis. Journal of autoimmunity 2018. doi: 10.1016/j.jaut.2017.12.015. PubMed PMID: 29371048.
78. Huang C, Wei J, Chang W, Chiou S, Chou C, Lin Y, et al. Higher expression of whole blood microRNA-21 in patients with ankylosing spondylitis associated with programmed cell death 4 mRNA expression and collagen cross-linked C-telopeptide concentration. The Journal of rheumatology 2014; 41(6): 1104.
79. Prajzlerova K, Grobelna K, Husakova M, Forejtova S, Jungel A, Gay S, et al. Association between circulating miRNAs and spinal involvement in patients with axial spondyloarthritis. PloS one. 2017;12(9):e0185323. doi: 10.1371/journal.pone.0185323. PubMed PMID: 28938006; PubMed Central PMCID: PMCPMC5609864.
80. Perez-Sanchez C, Font-Ugalde P, Ruiz-Limon P, Lopez-Pedrera C, Castro-Villegas MC, Abalos-Aguilera MC, et al. Circulating microRNAs as potential biomarkers of disease activity and structural damage in ankylosing spondylitis patients. Human molecular genetics 2018; 27(5): 875–90. doi: 10.1093/hmg/ddy008. PubMed PMID: 29329380.
81. Misunova M, Salinas-Riester G, Luthin S, Pommerenke C, Husakova M, Zavada J, et al. Microarray analysis of circulating micro RNAs in the serum of patients with polymyositis and dermatomyositis reveals a distinct disease expression profile and is associated with disease activity. Clinical and experimental rheumatology 2016;34(1):17-24. PubMed PMID: 26574749.
82. Hirai T, Ikeda K, Tsushima H, Fujishiro M, Hayakawa K, Yoshida Y, et al. Circulating plasma microRNA profiling in patients with polymyositis/dermatomyositis before and after treatment: miRNA may be associated with polymyositis/dermatomyositis. Inflamm Regen 2018; 38 : 1. doi: 10.1186/s41232-017-0058-1. PubMed PMID: 29321815; PubMed Central PMCID: PMCPMC5757292.
Labels
Dermatology & STDs Paediatric rheumatology RheumatologyArticle was published in
Czech Rheumatology

2018 Issue 4
-
All articles in this issue
- Stanovisko České revmatologické společnosti k terapii antirevmatiky v graviditě a laktaci
- Dlouhodobé výsledky léčby revmatoidní artritidy adalimumabem v národním registru ATTRA
- Klinicky suspektní artralgie: současný pohled na preklinickou fázi revmatoidní artritidy
- Extracelulární miRNA – biogeneze, funkce a využití jako biomarkerů u revmatických onemocnění
- Nefarmakologická terapie u idiopatických zánětlivých myopatií – cvičení a jeho účinky na pacienty s IZM, od roku 1993 až po dnes
- Czech Rheumatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Klinicky suspektní artralgie: současný pohled na preklinickou fázi revmatoidní artritidy
- Stanovisko České revmatologické společnosti k terapii antirevmatiky v graviditě a laktaci
- Dlouhodobé výsledky léčby revmatoidní artritidy adalimumabem v národním registru ATTRA
- Extracelulární miRNA – biogeneze, funkce a využití jako biomarkerů u revmatických onemocnění