Současný význam séronegativní revmatoidní artritidy
Current impact of seronegative rheumatoid arthritis
Seronegative rheumatoid arthritis (SNRA) is defined as rheumatoid factor (RF) negative and antibodies to citrullinated peptide antigen (ACPA) negative disease. Seropozitive rheumatoid arthritis (SPRA) is defined as RF and/or ACPA positive disease, but also other Abs as valid biomarkers should be used. SNRA pts represent about 20% of RA in general population, largely on late-onset. Minor prevalence of SNRA is not predictive for minor difficulties in clinical practice. Comparative analysis of DMARD (disease modyfying anti-rheumatic drugs) naive SNRA and SPRA pts demonstrated significantly higher values of disease activity using DAS28/ESR (disease activity score/erythrocyte sedimentation rate), incl. 28TJC (tender joint count) and 28SJC (swollen joint count) parameters, and good response to csDMARD (conventional synthetic DMARD) therapy within 2 years follow-up study. Unfortunately, initial activity of SNRA disease is not predictive for easy diagnosis of early SNRA, because exclusion from other possible causes of early seronegative arthritis should be difficult or even actually impossible. In a 10 years. prospective observation study of pts classified as early SNRA (No:435) a reclassification to definite diagnosis was frequent, espec. in relation to polymyalgia rheumatica, psoriatic arthritis, osteoarthritis and gout, but also in a large number of rare conditions (Jaccoud’s arthropathy in systemic lupus erythematosus, ect.) and „orphan“ diseases with mimicry of SNRA. In a long-term 30 years follow up study was demonstrated a significant increased frequency of extra-articular manifestations in SPRA as in SNRA pts, but in SNRA with low risk of rheumatoid pulmonary fibrosis, peripheral/central neuropathy and systemic rheumatoid granulomatosis. Concomitant fibromyalgia, toxicity of long-term DMARD therapy and multimorbidity of SNRA pts should be always evaluated. Early positive identification of SNRA by means of novel perspective biomarkers (antibodies to progranulin, sulphate glycans, ect.) should be a hope for future.
Keywords:
seronegative rheumatoid arthritis – rheumatoid factors – antibodies to citrullinated peptide antigen – antibodies to progranulin – sulphated glycans – score DAS28/ESR – misdiagnosis – concomitant fibromyalgia
Authors:
Z. Hrnčíř
Authors‘ workplace:
II. interní gastroenterologická klinika LF UK a FN, Hradec Králové
Published in:
Čes. Revmatol., 28, 2020, No. 3, p. 152-159.
Category:
Review Article
Overview
Séronegativní revmatoidní artritida (SNRA) je definována negativitou revmatoidních faktorů (RF) a protilátek proti citrulinovaným peptidům (anti-citrullinated peptide antibodies – ACPA). Séropozitivní revmatoidní artritida (SPRA) je definována séropozitivitou RF a/nebo ACPA, popř. i dalších validních autoprotilátkových biomarkerů. SNRA představuje asi 20 % všech RA v populaci s častějším zastoupením při pozdější manifestaci. Menšinová prevalence SNRA neznamená menší nesnáze v klinické praxi. Komparativní analýza DMARD (disease modyfying anti-rheumatic drugs) naivní SNRA a SPRA ukázala významně vyšší aktivitu SNRA v kompozitním skóre DAS28 (disease activity score), včetně parametrů bolestivých a oteklých kloubů, ale s dobrou odpovědí na csDMARD (conventional synthetic DMARD) při následném sledování po dobu 2 let. Významná vstupní aktivita SNRA neznamená predikci pro snadnější diagnózu časné SNRA, protože u časné séronegativní artritidy je řada dalších možných příčin, které je obtížné/nemožné aktuálně vyloučit. V 10leté prospektivní observační studii časné SNRA (N:435) byla zaznamenána reklasifikace nejčastěji na diagnózu polymyalgia rheumatica, psoriatická artritida, osteoartróza, dna, široké spektrum vzácnějších asociací (např. Jaccoudova artropatie u systémového lupus erythematodes) a raritních nemocí s mimikry SNRA. Analýza extraartikulárních manifestací s vyhodnocením v rozmezí 30 let ukázala signifikantní vzestup u SPRA i SNRA, ale prognosticky závažné mimokloubní projevy (fibróza plicního intersticia, periferní/centrální neuropatie, systémová revmatoidní granulomatóza) byly u SNRA vzácné. V širším kontextu je vždy třeba vyhodnotit možnost konkomitantní fibromyalgie, toxicitu dlouhodobé DMARD terapie a multimorbiditu. Včasná pozitivní identifikace SNRA novými validními biomarkery, jak to naznačují např. předběžné údaje o protilátkách proti progranulinu, detekce sul-fátových glykanů atd., je oprávněnou nadějí pro budoucnost.
Klíčová slova:
séronegativní revmatoidní artritida – revmatoidní faktory – protilátky proti citrulinovaným peptidům – protilátky proti progranulinu – sulfátové glykany – skóre DAS28 – misdiagnóza – konkomitantní fibromyalgie
ÚVOD
Revmatoidní artritida (RA) je klíčovým problémem klinické i experimentální revmatologie. Podle vztahu k asociovaným autoprotilátkám se rozlišuje na séropozitivní a séronegativní RA. Výzkum i klinická praxe se přirozeně soustřeďují na většinově séropozitivní RA, protože séronegativní RA se zdá být méně významnou nejen pro menšinovou prevalenci, ale také z hlediska diagnózy a dalšího průběhu nemoci. Cílem přehledu je upozornit na úskalí, která představuje séronegativní RA v každodenní praxi revmatologické ordinace.
DEFINICE A IMUNOLOGICKÁ CHARAKTERISTIKA
Séronegativní RA je onemocnění, které splňuje klasifikační kritéria pro diagnózu ACR/EULAR 2010 (resp. revidovaná kritéria ACR/1987 u etablované RA) a současně vykazuje dvojí autoprotilátkovou séronegativitu, tj., nebyla zjištěna diagnosticky významná hodnota („cut-off“) revmatoidních faktorů (RF) ani protilátek proti citrulinovaným peptidům (anti-citrullinated peptide antibodies – ACPA). U RF jde dominantně o IgM-RF, ale některé komparativní studie vyžadují i negativní výsledek při vyšetření izotypu IgA-RF (1). U antigenů ACPA jde standardně o protilátky proti cyklickým citrulinovaným peptidům při ACCP2 (anti-cyclic citrullinated peptide 2) testu. Pro klinické využití se však nabízí i detekce protilátek proti citrulinovanému vimentinu, resp. mutovanému citrulinovanému vimentinu (MCV), protilátek proti karbamylovaným peptidům (anti-CarP) a dalším perspektivním biomarkerům. U ACPA séronegativní RA s anti-CarP séropozitivitou byla identifikována specifická asociace s HLA-DRB1*03 (2). Séropozitivní RA je v tomto kontextu onemocnění, které splňuje uvedená klasifikační kritéria pro diagnózu včetně RF nebo ACPA nebo RF+ACPA. V každém případě to znamená, že postačuje jednoduchá séropozitivita, včetně autoprotilátek mimo RF/ACPA, pokud splňují podmínku validního biomarkeru.
Aktuální koncept dvojitě séronegativní RA je východiskem zvláště pro klinické a epidemiologické studie. Nechybí mu však ani patofyziologická rovina modelových hypotéz o vzájemném vztahu RA a ACPA (obr. 1), která je záchytným bodem v obtížném rozpoznávání překryvů a rozdílností v patogenních drahách u séropozitivní a séronegativní RA (3). Analýza na úrovni pracovních modelů je inspirativní, ale nejdůležitější je zřejmě to, že u séronegativní RA se a priori neuplatňují patogenní dráhy imanentní pro RF a ACPA. Nepřímo o tom svědčí i data z 10leté prospektivní studie časné séronegativní RA: pozdní séropozitivita byla zjištěna jenom u čtyř ze 435 nemocných (4).
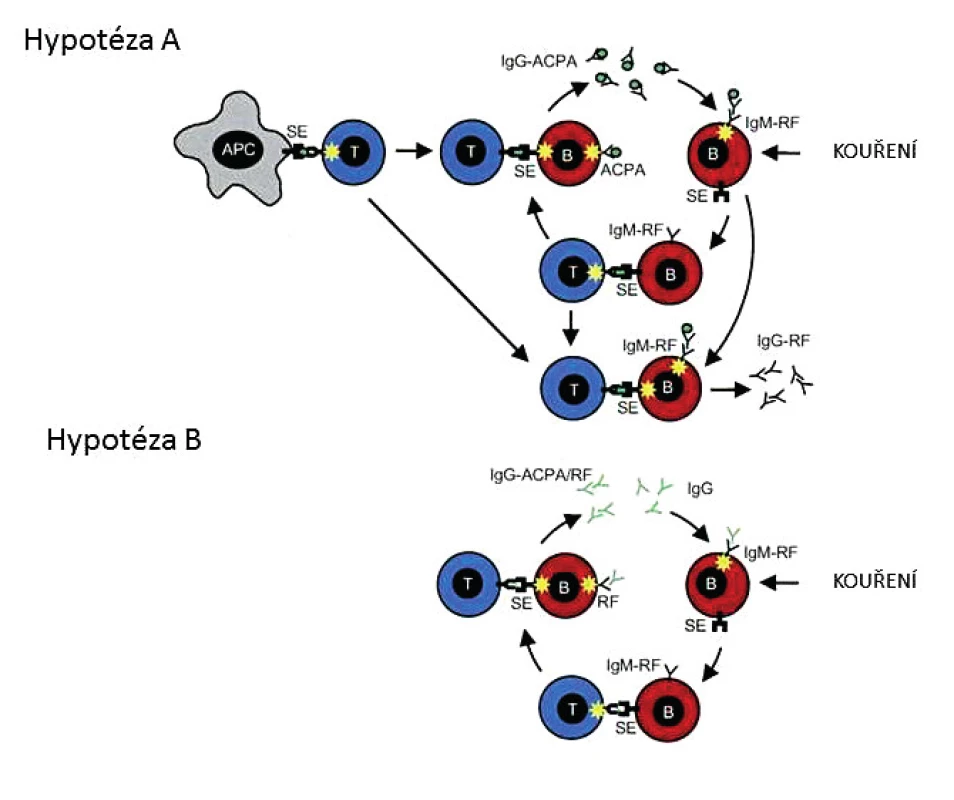
Analýza prevalence dvojitě séronegativní RA je otevřena průběžné redukci při identifikaci nových biomarkerů na bázi autoprotilátek nebo i jinak. Podnětným přístupem je detekce proinflamatorních autoprotilátek proti progranulinu (PGRN); patofyziologickým důsledkem je narušení rovnováhy v antagonismu protizánětlivého PGRN a prozánětlivé aktivity TNF. Anti-PGRN protilátky signalizují autoimunitní mechanismy už u nediferencovaného kloubního zánětu a podle předběžných údajů mohou redukovat status séronegativní RA zhruba o 20 % (5).
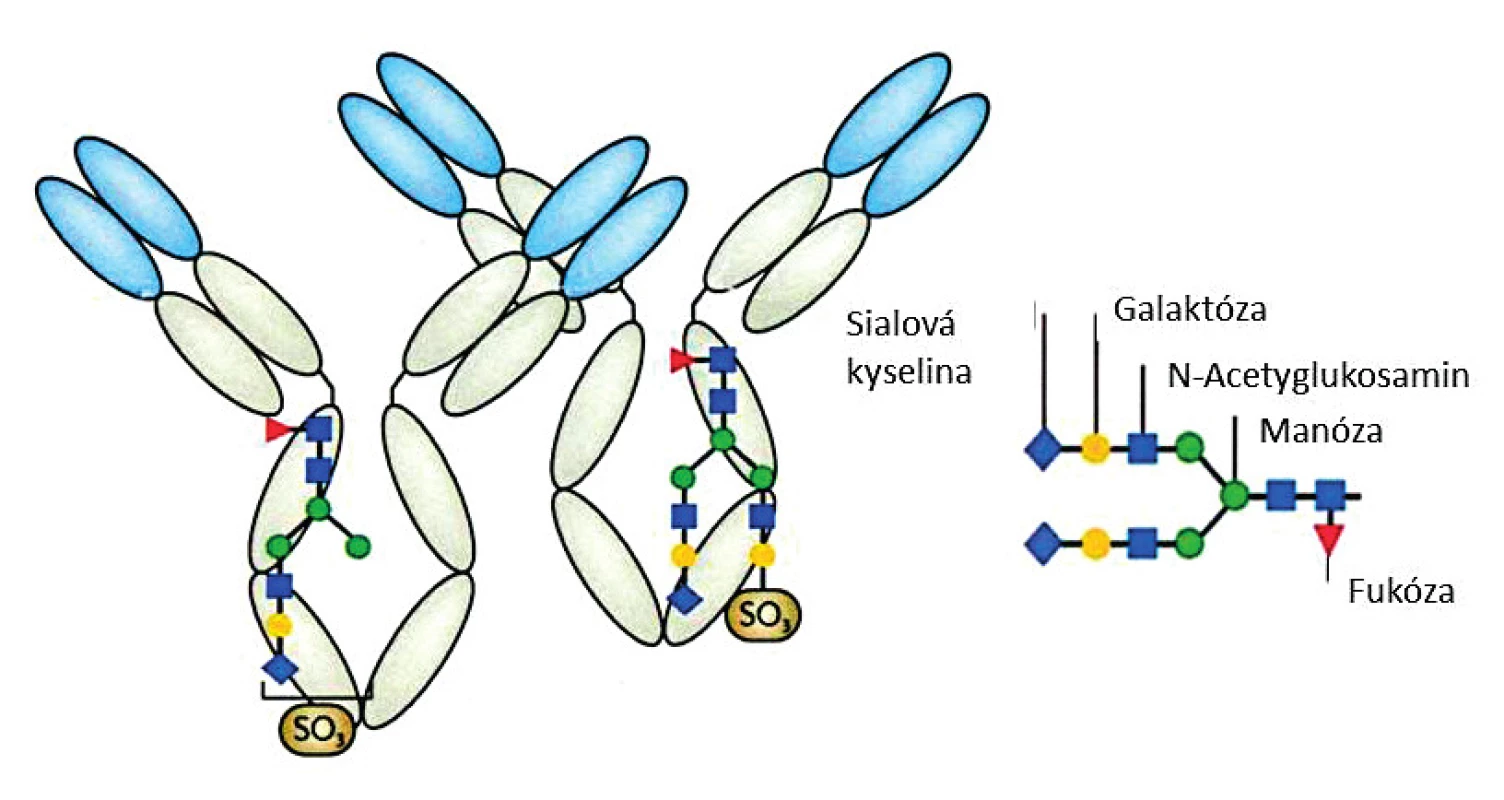
Glykosylace molekuly IgG se uplatňuje mimo jiné při rozpoznávání antigenů. Ve vztahu k pozitivnímu vymezení séronegativní RA se přikládá význam glykanům s N vazbou na asparagin v pozici 297 na obou doménách CH2 IgG molekuly (6); bližší analýzou se zjistilo, že důležité jsou hlavně sulfátové glykany (obr. 2) (7, 8). Podle některých údajů představují glykany veličinu s prvky umělé inteligence, které umožnily pozitivní identifikaci u 43,8 % nemocných zkoumané kohorty séronegativních RA (9). Příkladem z hlediska molekulární genetiky je analýza anti-CCP2 pozitivních a negativních RA ve vztahu k pozici aspartové kyseliny ve struktuře HLA-DRB1 (10). Jednotící motivací všech nestejných přístupů k bližší identifikaci séronegativní RA je klinická naléhavost pro řešení tohoto úkolu i metodami experimentální revmatologie.
EPIDEMIOLOGIE
Údaje o prevalenci séronegativní RA v populaci většinou vycházejí z extrapolace epidemiologických dat o RA; přibližně jde o 20 % všech RA, což je asi 20/10 000 obyvatel s tím, že častější je manifestace u starších osob (11). Přesnější analýzu relace mezi faktorem věku a manifestací RA umožnila data Celonárodního registru zdravotních sester v USA (12): u žen po menopauze bylo zjištěno HR 2,1 (95% CI 1,4–3,0), ale u žen s přirozenou menopauzou ve věku ≤ 44 let HR 2,4 (95% CI 1,5–5,0). V genderové studii byla hodnota mediánu pro dobu od primoataky kloubního zánětu do splnění kritérií ACR/EULAR 2010 významně delší u žen než u mužů (p = 0,035) (13). Z vyhodnocení obsáhlých vstupních dat (status ACPA hodnocen u 53 849 a status RF u 79 926 RA) vyplynulo, že dvojitě séropozitivní RA má významně vyšší riziko mortality než dvojitě séronegativní RA (p < 0,001) (14). Za předpokladu 0,8 % prevalence RA v populaci ČR (15) lze usuzovat 15–20 tisíc nemocných séronegativní RA.
KLINICKÝ OBRAZ, DIAGNÓZA A ODPOVĚĎ NA TERAPII
Východiskem pro hodnocení klinické manifestace séronegativní RA jsou nepočetné komparativní studie DMARD (disease modyfying anti-rheumatic drugs) naivních pacientů se séropozitivní a séronegativní RA. Oproti očekávání se ukázalo, že séronegativní RA má významně bouřlivější začátek při hodnocení aktivity ve formátu DAS28 (disease activity score) v počtu bolestivých i oteklých kloubů (obr. 3 a 4), ale s komparativně významně dobrou odpovědí na csDMARD (conventional synthetic DMARD) při následném hodnocení v rozmezí 2 let; ve vzestupu CRP a sedimentace nebyly zjištěny významné rozdíly vstupně ani při poklesu obou ukazatelů během dvouletého sledování. Kohorta séronegativní RA měla signifikantně vyšší vstupní DAS28/SE (p = 0,043) a v podskupině s výchozí hodnotou nad 5,1 i signifikantně lepší odpověď na csDMARD při hodnocení za dobu 1 roku (p = 0,037) (16). Norská multicentrická komparativní studie disponuje daty 234 DMARD naivních RA (u séronegativní RA, včetně absence IgA-RF) (1): Ve formátu 44 kloubů byl medián oteklých kloubů u séronegativní RA 17, u séropozitivní RA jenom 7 (p = 0,001). Paralelní hodnocení podle ultrasonografického (US) skóre kloubů a US skóre šlach ukázalo v obou případech výrazně vyšší mediánové hodnoty u séronegativní RA s významným rozdílem oproti séropozitivní RA (p = 0,001). Údaje o dobré odpovědi séronegativní RA na csDMARD terapii přirozeně nevylučují dílčí rezistenci a indikaci cílené terapie: pro boDMARD (biologic original DMARD) a pro bsDMARD (biologic similar DMARD) zatím není komparativní RKS (randomizovaná kontrolovaná studie) k dispozici, pro tsDMARD (target synthetic DMARD), jmenovitě via tofacitinib, se předběžně ukázalo, že u anti-CCP+/RF+ RA byla odpověď (ACR20/50/70 nebo remise) významnější než u dvojitě séronegativní RA (17). Je nutné dodat, že podle epidemiologických analýz má séropozitivní RA s csDMARD terapií setrvale vyšší mortalitní riziko než séronegativní RA, ale bDMARD (biologic DMARD) medikace je eliminuje na úroveň séronegativní RA (14).
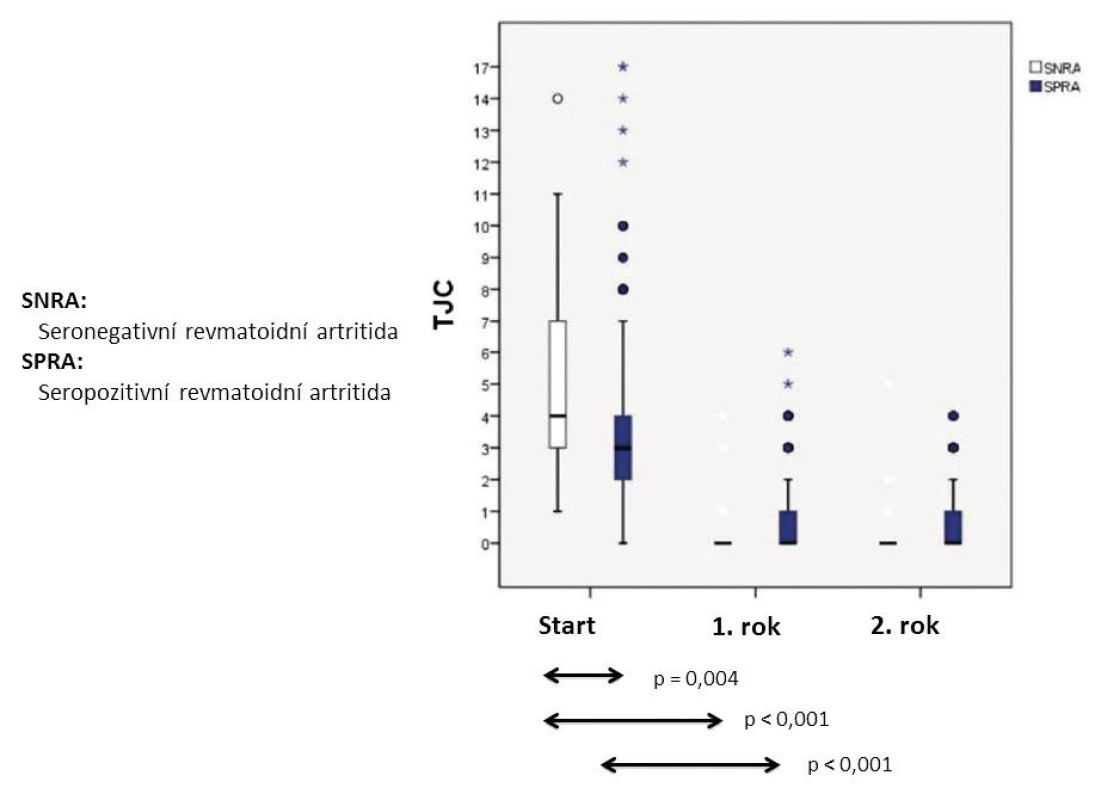
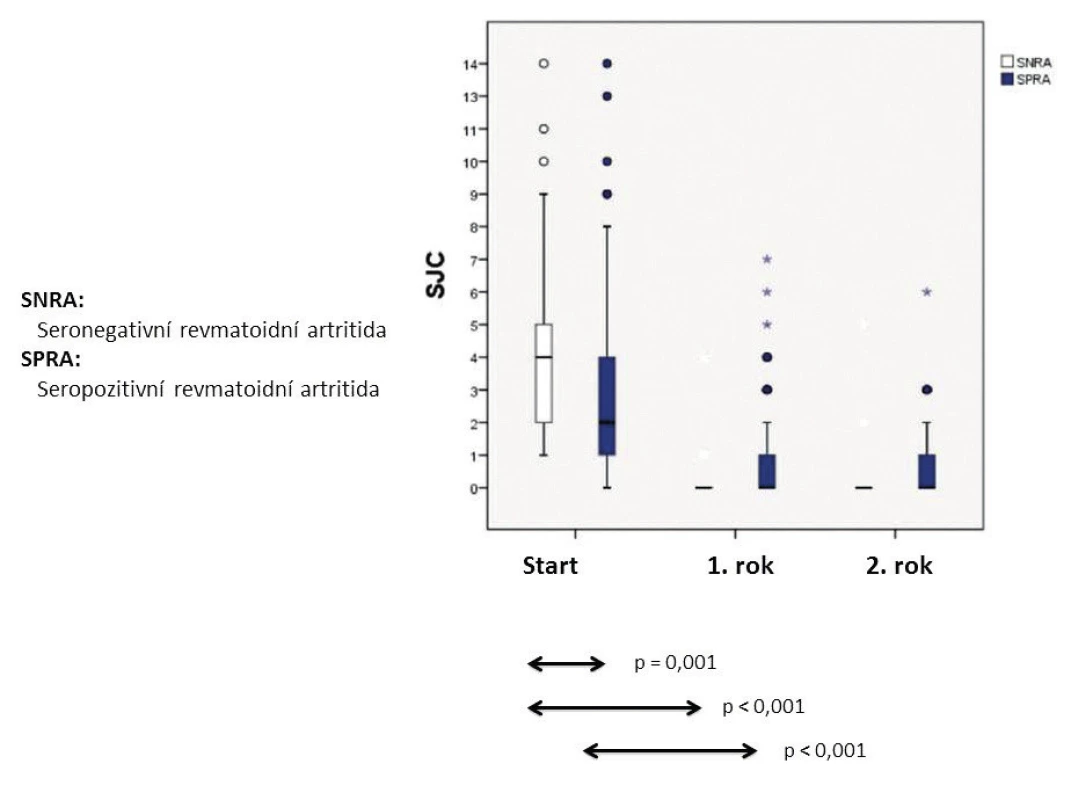
Bouřlivější začátek klinické manifestace séronegativní RA neznamená předpoklad spolehlivé diagnózy s poměrně malým rizikem reklasifikace. Příkladem, který nabádá k obezřetnosti, je desetiletá monocentrická prospektivní studie (centrální Finsko) 435 nemocných s časnou séronegativní RA (3), protože ne vždy vyústila do definitivní diagnózy séronegativní RA; k nejčastějším alternativám patřila polymyalgia rheumatica (16 %), psoriatická artritida (11 %), osteoartróza (10 %), dna/pseudodna (5,3 %). Významným poznatkem je v této studii také skutečnosti, že u 32 % nebylo možné ani při dlouhodobém sledování nemocných stanovit jednoznačnou definitivní diagnózu nebo bylo rozpoznáno některé ze vzácných onemocnění s mimikry séronegativní RA. V tomto kontextu může jít např. o RS3PE (remitting seronegative symmetrical synovitis with pitting edema) syndrom (obr. 5) (18, 19), deformity typu Jaccoudovy artropatie (obr. 6), t. č. zpravidla u systémového lupus erythematodes (20), popř. o artropatii u hereditární hemochromatózy (obr. 7). Do této skupiny lze zařadit i postižení drobných ručních kloubů u vzácné, ale antibiotiky dobře léčitelné Whippleovy nemoci (21), u mnohočetného myelomu, choroby IgG4, a dokonce u lepry (22–24). Záměna kloubních projevů napodobujících séronegativní RA má u vzácných onemocnění tuto rámcovou charakteristiku:
- dlouhá doba (měsíce – léta) do stanovení definitivní diagnózy
- neúčinnost DMARD terapie, která může být i kontraindikována
- riziko kritického opoždění startu účinné medikace potom, co byla rozpoznána diagnóza vzácného onemocnění
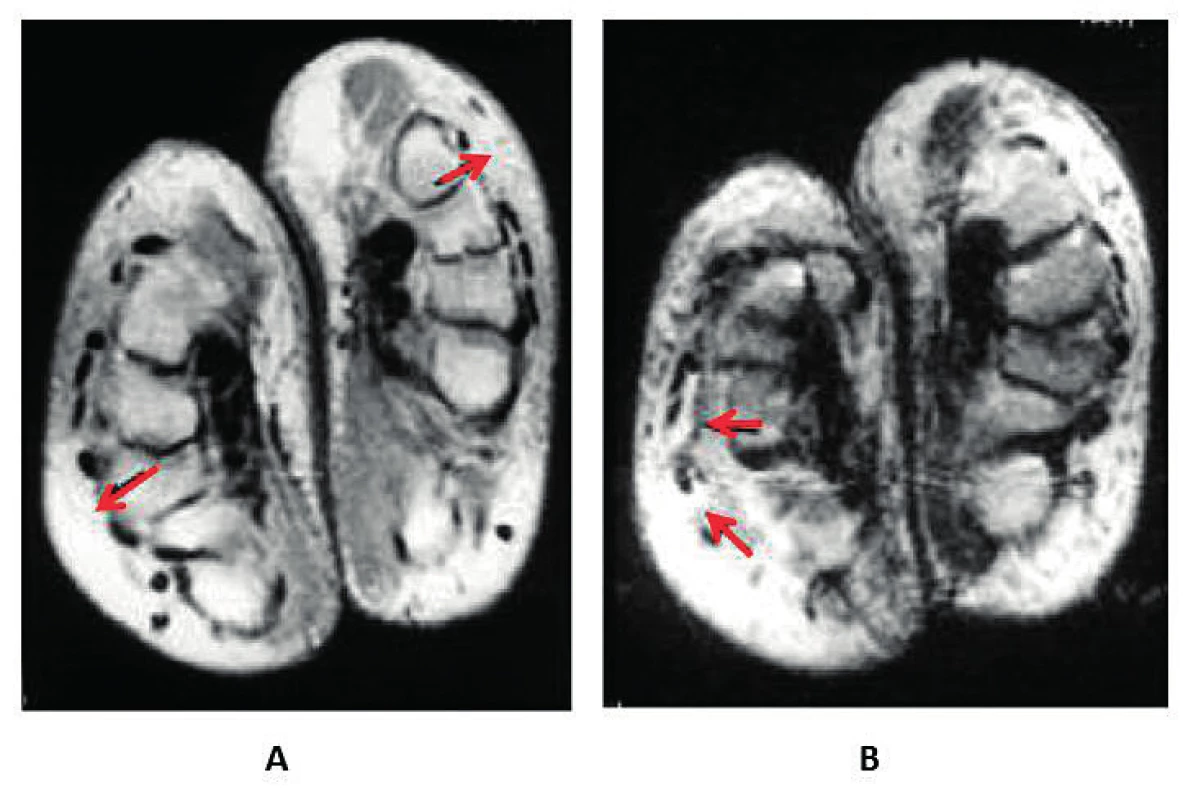
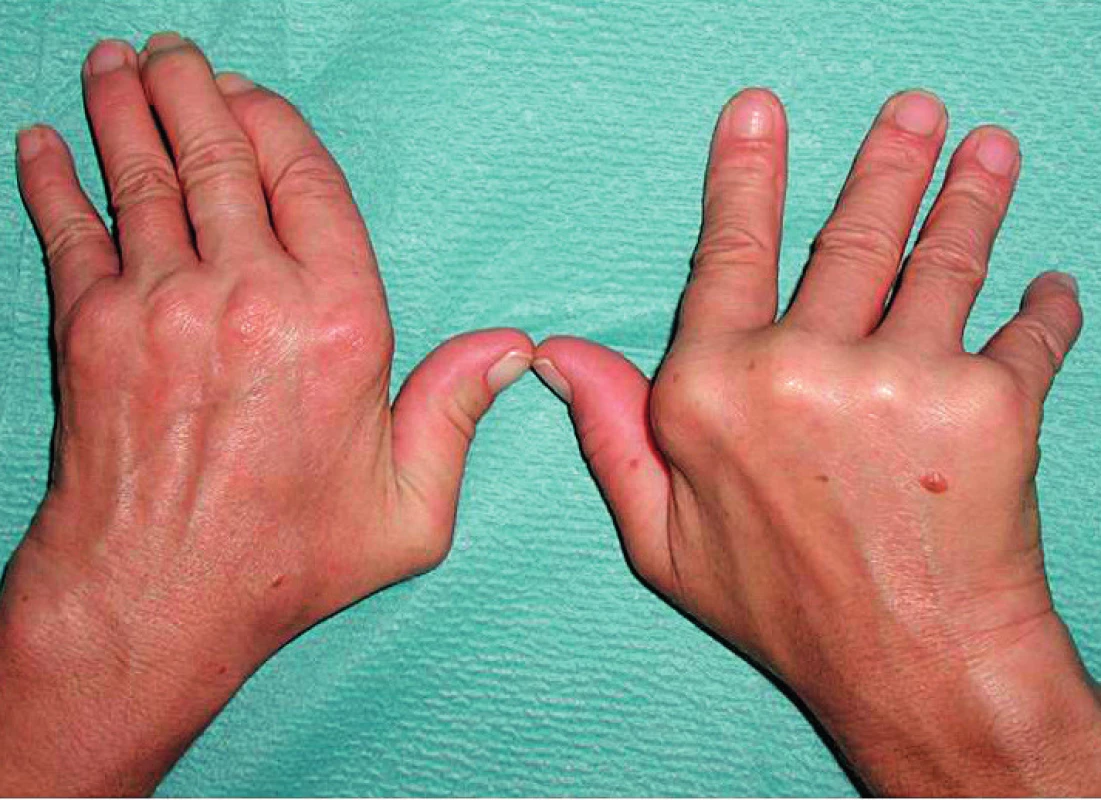
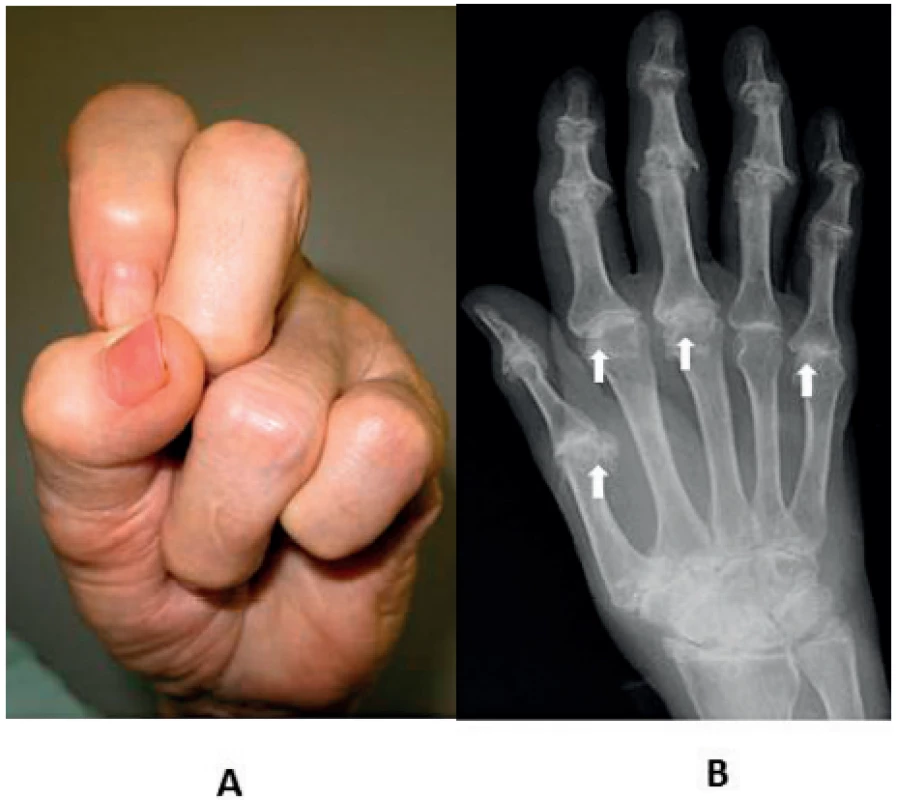
Nehledě na tuto náročnou diferenciální diagnostiku by mělo být už při vstupním vyšetření jednoznačně zjištěno, že opravdu jde o první epizodu kloubního zánětu. Zvláště u mladších pacientů totiž může jít o reaktivaci některého ze syndromů většinově RF i ACPA séronegativní juvenilní idiopatické artritidy (JIA) a nelze vyloučit ani vzácnou pozdně začínající JIA (25). Za určitých okolností je včasná diagnóza séronegativní RA natolik neobvyklá, že to opravňuje kazuistickou publikaci (26).
PROGNÓZA A KONKOMITANCE
Po zklidnění počátečních projevů aktivity je dlouhodobá prognóza séronegativní RA otázkou základního významu. Věrohodnost mají zejména dlouhodobé studie s paralelním hodnocením séropozitivní a séronegativní RA v rozsahu 10–30 let. K základním ukazatelům dlouhodobé prognózy patří hodnocení strukturních změn postižených kloubů. Radiografické diference mezi séropozitivní a séronegativní RA přitom nezahrnují jenom rozsah poškození (např. početnost erozí), ale také nestejnou topografickou prevalenci a dílčí charakteristiky strukturních změn (27). Při analýze radiografických změn na ručních kloubech formou Sharpova skóre (v modifikaci van der Heide) v horizontu 10 let se ukázalo, že kumulativní hodnoty jsou dlouhodobě výrazně rozdílné (28). Širší posouzení radiografických odlišností vedlo i k úvaze o nestejných patogenetických mechanismech u séropozitivní a séronegativní RA (27). V kloubní manifestaci RA (s rizikem náhlé smrti) má prvořadý význam nestabilita atlanto-axiálního skloubení, vyjádřená hodnotou atlanto-axiálního intervalu: Ve studii se sledováním ≥ 5 let byla zjištěna výrazně častěji u RF séropozitivní RA (29). Frekvence extraartikulárních manifestací RA byla vyhodnocena v rozmezí 30 let (30): Signifikantní vzestup byl zjištěn u séropozitivní i séronegativní RA, ale s rozdíly v jejich závažnosti. Riziko intersticiální plicní fibrózy, centrální/periferní neuropatie nebo systémové revmatoidní granulomatózy je u séronegativní RA menší, ale nedá se zcela vyloučit. U 56letého pacienta se séronegativní RA tak např. došlo k náhlé cévní mozkové příhodě při vmetku z abakteriální vegetace na mitrální chlopni a mikroskopickou analýzou OP preparátu byl následně prokázán revmatoidní granulom (31). Na mimokloubních projevech se může podílet i toxicita mnohaleté, zvláště nedostatečně kontrolované DMARD terapie a překryvná multimorbidita, zvláště u chronicky nemocných (diabetes mellitus aj.).
Konkomitancí je nejčastěji syndrom fibromyalgie (FM), který může při souběhu s RA navyšovat některé deskriptory DAS28, jako např. VAS (vizuální analogová škála) bolesti. Kumulativní incidence FM a ACPA séropozitivní RA (N:1198, doba sledování 36 měsíců) s HR 0,48 (95% CI 0,26–0,88) umožňuje předpokládat inverzně pozitivní vztah mezi FM a séronegativní RA (32); pro toto hodnocení svědčí i data souboru RA s konkomitantní RA v české populaci (33).
ZÁVĚR
V revmatologické ordinaci je séronegativní RA výzvou pro uvážlivé rozhodování o nemocných, kteří splňují skóre klasifikačních kritérií ACR/EULAR 2010, ale jsou dvojitě séronegativní, tj. RF i ACPA; nedílnou součástí tohoto normativu je totiž i vstupní podmínka o nemožnosti lepšího vysvětlení jiným onemocněním. Je důležité si uvědomit, že při první návštěvě nebo jednorázovém (konsiliárním) vyšetření může být obtížné, popř. nemožné, splnit věrohodně tuto podmínku. Racionální přístup k posouzení dilema naléhavosti a obezřetnosti vyžaduje kvalitní analýzu u každého konkrétního nemocného s možností revize při následných kontrolách. Minimálně u části nemocných je vstupní diagnóza séronegativní RA diagnózou pracovní a náročnost finálního dořešení se může stát testem pro sebehodnocení. Bouřlivý začátek séronegativní RA nevylučuje možnost reklasifikace; platí to hlavně u nemocí s věkovým překryvem, jako např. u polymyalgia rheumatica, ale i jinak. Séronegativní RA vesměs dobře reaguje na repertoár csDMARD; o cílené terapii zatím nejsou spolehlivá data k dispozici. V dlouhodobé prognóze séronegativní RA se významně zvyšuje frekvence extraartikulárních manifestací, ale prognosticky závažné mimokloubní projevy jsou vzácné, popř. jsou projevem toxicity DMARD nebo multimorbidity. Konkomitantní fibromyalgie může zkreslit DAS28, např. ukazatel VAS bolesti. Optimistickým předpokladem je to, že s novými validními biomarkery bude v budoucnu možné alespoň část séronegativních RA identifikovat pozitivně a dříve redukovat pracovní povahu vstupní diagnózy; s redukcí intelektuální náročnosti ovšem počítat nelze.
Práce byla podpořena výzkumným projektem Univerzity Karlovy PROGRES Q40-15.
Konflikt zájmů: žádný.
adresa pro korespondenci:
prof. MUDr. Zbyněk Hrnčíř, DrSc.
II. interní gastroenterologická klinika LF UK a FN
Sokolská 581, 500 05 Hradec Králové
e-mail: hrncir@fnhk.cz
Sources
1. Nordberg LB, Lillegraven S, Lie E, Aga AB, Olsen ICh, Hammer HB, et al. Patients with seronegative RA have more inflammatory aktivity compared with patients with seropositive RA in an inception cohort of DMARD-naive patients classified according to the 2010 ACR/EULAR criteria. Ann Rheum Dis 2017; 76 : 341–345.
2. Reguiero C, Rodriguez-Rodriguez L, Triguero-Martinez A, Nuño L, Castaño-Nuñez AL, Villalva A, et al. Specific association of HLA-DRBl*03 with anti-carbamylated protein antibodies in patients with rheumatoid arthritis. Arthritis Rheumat 2019; 71 : 331–339.
3. Shelef M. New relations for old autoantibodies in rheumatoid arthritis. Arthritis Rheumat 2019; 71 : 1396–1399.
4. Paalanen K, Rannio K, Rannio T, Asikainen J, Hannonen P, Sokka J. Does early seronegative arthritis develop into rheumatoid arthritis? A 10-year observational study. Clin Exp Rheumatol 2019; 37 : 37–43.
5. Assmann G, Zinke S, Gerling M, Bittenbring JT, Preuss KD, Thurner L. Progranulin-autoantibodies in sera of rheumatoid arthritis patients negative for rheumatoid factor and anti-citrullinated peptide antibodies. Clin Exp Rheumatol 2019; 37 [Epubl ahead of print].
6. Hoffmann MH, Trouw LA, Steiner G. Autoantibodies in rheumatoid arthritis. In: Hochberg MC, Gravallese EM, Silman AJ, Smolen JS, Weinblatt ME, Weisman MH (ed.) Rheumatology, 7th ed. Philadelphia: Elsevier 2019; 803–810.
7. Seeling M, Brückner Ch, Nimmerjahn F. Differential antibody glycosylation in autoimmunity: sweet biomarker or modulator of disease aktivity? Rheumatology 2017; 13 : 621–630.
8. Collison J. Seronegative RA-specific biomarkers indentified. Nat Rew Rheumat 2017; 13 : 633.
9. Chocholova E, Bertok T, Jane E, Lorencova L, Holazova A, Belicka L, et al. Glycomics meets artificial intelligence – Potential of glycan analysis for identification of seropositive and seronegative rheumatoid arthritis patients revealed. Clin Chim Acta 2018; 481 : 49–55.
10. Terao C, Brynedal B, Chen Z, Jiang X, Westerlind H, Hansson M, et al. Distinct HLA associations with rheumatoid arthritis subsets defined by serological subphenotype. Am J Hun Genet 2019; 105 : 616–624.
11. Turkcapar N, Demir O, Atli T, Kopuk M, Turgay M, Kinikli G, et al. Late onset rheumatoid arthritis: Clinical and laboratory comparisons with younger onset patients. Arch Geront Geriatr 2006; 42 : 225–231.
12. Bengtsson C, Malspeis S, Orellana C, Sparks JA, Contenbader KH, Karlson EW. Association between menopausal factors and the risk of seronegative and seropositive rheumatoid arthritis: results from the nurses’ health studies. Arthritis Care Res 2017; 69 : 1676–1684.
13. Coffey CM, David JM, Crowson CS. The impact of gender on time to rheumatoid arthritis classifications: a retrospective analysis of a population-based cohort. Rheumatol Int 2019; 39 : 2025–2030.
14. Alemao E, Bao Y, Weinblatt ME, Shadick N. Association of seroposivity and mortality in rheumatoid arthritis and the impact of treatment with disease-modifying antirheumatic drugs. Arthritis Care Res 2020; 72 : 176–183.
15. Vencovský J. Revmatoidní artritida. In: Pavelka K, Vencovský J, Šenolt L, Mann H, Štěpán J, a kol. Revmatologie. 2. vydání, Praha: Maxdorf 2018; 340–360.
16. Choi S, Lee KH. Clinical managment of seronegative and seropositive rheumatoid arthritis: A comparative study. PLoS ONE 2018; 13: e0195550.
17. Bird P, Hall S, Nash P, Connell CA, Kwok K, Witconbe D, et al. Treatment outcomes in patients with seropositive versus seronegative rheumatoid arthritis in Phase III randomized clinical trials of tofacitinib. RMD Open 2019; 5: e000724.
18. Mc Carty DJ, O’Duffy JD, Pearson L, Hunter JB. Remmiting seronegative symmetrical synovitis with pitting edema. RS3 PE syndrome. JAMA 1985; 254 : 2763–2767.
19. Cantini F, Salvarani C, Olivieri I. Paraneoplastic remitting seronegative symmetrical synovitis with pitting edema. Clin Exp Rheumatol 1999; 17 : 741–744.
20. Hrnčíř Z, Drahošová M, Bradna P, Soukup T, Tomš J. Jaccoudova artropatie u systémového lupus erythematodes. Čes. Revmatol. 2010; 18 : 68–72.
21. Glaser C, Rieg S, Wiech T, Scholz Ch, Endres D, Stich O, et al. Whipple’s disease mimicking rheumatoid arthritis can cause misdiagnosis and tratment failure. Orphanet J Hare Dis 2017; 12 : 99–107.
22. Shinoda K, Matsui S, Taki H, Hounoki H, Ogawa R, Ishizawa S, et al. Deforming arthropathy in a patient by Stone et al. Arthritis Care Res 2011; 63 : 172–174.
23. Schoninger S, Homsi Y, Kreps A, Milojkvovic N. A case of multiple myeloma misdiagnosed as seronegative rheumatoid arthritis and review of relevant literature. Case Rep Rheumatol 2018; 2018 : 9746241.
24. Alsaed O, Hadwan H, Khanjar I, Al-Allaf AW. Seronegative bilateral symmetrical inflammatory polyarthritis: think twice before starting immunosuppression. Eur J Case Rep Intern Med 2018; 5 : 000895.
25. Chapel H, Haenez M, Misbach S, Snowden N. Essentials in clinical imunology. 6. vydání John Wiley Lmt. 2014; český překlad 1. vydání, Praha: Triton 2018 : 108–205.
26. Davaraj NK. The difficult rheumatology diagnosis. Ethiop J Health Sci 2017; 28 : 101–102.
27. Syversen SW, Gaarder PI, Goll GL, Odengard S, Haavardsholm EA, Mowickel P, et al. High anti-cyclic citrullinated peptide levels and an algorithm of four variables predict radiographic progression in patients with rheumatoid arthritis: results from a 10-year longitudinal study. Ann Rheum Dis 2008; 67 : 212–217.
28. Gadeholt O, Hausotter K, Eberle H, Klink T, Pfeil A. Differing X-ray patterns in seronegative and seropositive rheumatoid arthritis. Clin Rheumatol 2019; 38 : 2403–2410.
29. Yurube T, Sumi M, Nishida K, Miyamoto H, Kohyama K, Matsubara T, Miura Y, Hirata H, et al. Accelerated development of cervical spine instabilities in rheumatoid arthritis: A prospective minimum 5-year cohort study. PLoS ONE 2014; 9: e88970.
30. Sahatciu-MekaV, Rexhepi S, Manxihuka-Kerliu S, Rexhepi M. Extra-articular manifestations of seronegative and seropositive rheumatoid arthritis. Bosnian J Basic Med Sci 2010; 10 : 26–31.
31. Watrease A, Trabue Ch, Atkinson J, Behrend N. Large endocardial rheumatoid nodules: a case report and review of the literature. J Comm Hosp Intern Med Perspect 2017; 7 : 175–177.
32. Lee YC, Lu B, Boire G, Haraoui B, Hitchon CA, Pope JE, et al. Incidence and predictors of secondary fibromyalgia in an early arthritis cohort. Ann Rheum Dis 2013; 72 : 949–954.
33. Tomš J, Soukup T, Bradna P, Hrnčíř Z. Konkomitující fibromyalgie u pacientů s revmatoidní artridiou. Čes. Revmatol. 2009; 17 : 120–126.
Labels
Dermatology & STDs Paediatric rheumatology RheumatologyArticle was published in
Czech Rheumatology

2020 Issue 3
-
All articles in this issue
- National registry of biological and targeted therapy of rheumatic diseases ATTRA – 20 years of experience
- Validation of Czech versions of questionnaires assessing fatigue and physical acti- vity in patients with rheumatic diseases: Fatigue Impact Scale (FIS), Multidimensional Assessment of Fatigue Scale (MAF), Human Activity Profile (HAP)
- Current impact of seronegative rheumatoid arthritis
- The role of viruses in the development of autoimmune diseases
- Differential diagnosis of systemic scleroderma from the perspective of dermatologist
- Diet in gout – should we reduce the intake of purines?
- Vzpomínka na profesora Lenocha
- Czech Rheumatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Current impact of seronegative rheumatoid arthritis
- Validation of Czech versions of questionnaires assessing fatigue and physical acti- vity in patients with rheumatic diseases: Fatigue Impact Scale (FIS), Multidimensional Assessment of Fatigue Scale (MAF), Human Activity Profile (HAP)
- The role of viruses in the development of autoimmune diseases
- Diet in gout – should we reduce the intake of purines?
