Úloha virů při vzniku autoimunitních onemocnění
The role of viruses in the development of autoimmune diseases
Autoimmune diseases affect an increasing percentage of our population and are the third leading cause of morbidity and mortality in developed countries, after cardiovascular diseases and cancer. Currently, more than 80 identified autoimmune diseases are known, which represent a significant clinical problem due to their chronicity, which requires long-term and often lifelong therapy. Current therapies seek to suppress the symptoms of these diseases but have difficulty targeting the true causes of these diseases and addressing them effectively and without further side effects. At the same time, the identification of the trigger of the autoimmune disease and its removal could ensure the cure of the patient. The problem is that the exact etiology of most autoimmune diseases is not fully known. However, in addition to the genetic profile, the lifestyle of an individual with environmental triggers, such as bacterial, fungal, parasitic, and viral infections, are probably involved. And it is the viruses that have been shown to influence the development of the clinical picture of a number of autoimmune diseases, whether rheumatological, such as systemic lupus erythematosus, rheumatoid arthritis, Sjögren’s syndrome, and many others, as well as non-rheumatic conditions including type 1 diabetes, celiac disease, autoimmune thyroiditis, and multiple sclerosis. Viral infections elicit a strong immune response, which is necessary to suppress the infection. However, in some cases, failure to regulate this immune response can lead to deleterious immune responses directed against host antigens. This article focuses on the role of the most common and well-known viruses and the mechanism by which they interact with the infected host's immune system, eliciting inflammatory responses that potentially lead to the development or exacerbation of rheumatic autoimmune diseases.
Keywords:
autoimmunity – autoimmune diseases – viruses – viral infection
Authors:
R. Moravcová
Authors‘ workplace:
Revmatologický ústav Praha
Published in:
Čes. Revmatol., 28, 2020, No. 3, p. 160-168.
Category:
Review Article
Overview
Autoimunitní onemocnění postihují čím dál větší procento naší populace a dostávají se po nemocech oběhové soustavy a nádorových onemocněních na třetí místo příčin morbidity a mortality lidí v rozvinutých zemích. V současné době je známo více než 80 identifikovaných autoimunitních onemocnění, které představují význačný klinický problém vzhledem k jejich chronicitě, která vyžaduje dlouhodobou a často celoživotní terapii. Současné terapeutické postupy se snaží potlačit symptomy těchto nemocí, ale mají potíže zacílit na skutečné příčiny těchto onemocnění a efektivně a bez dalších vedlejších účinků je vyřešit. Přitom právě identifikace spouštěče autoimunitního onemocnění a jeho odstranění by mohlo zajistit vyléčení pacienta. Problém je, že přesná etiologie většiny autoimunitních onemocnění není zcela známá, nicméně kromě genetického profilu se na ní zřejmě podílí i životní styl jedince se spouštěcími faktory životního prostředí, jako jsou bakteriální, plísňové, parazitární a virové infekce. A právě viry, jak se ukazuje, ovlivňují vznik i klinický obraz celé řady autoimunitních onemocnění, ať už revmatologických, jako je např. systémový lupus erythematodes, revmatoidní artritida, Sjögrenův syndrom a celé řady dalších, ale i jiných včetně diabetes mellitus 1. typu, celiakie, autoimunitní tyreoiditidy a roztroušené sklerózy. Virové infekce vyvolávají silnou imunitní odpověď, která je nutná k potlačení infekce, ale v některých případech selhání regulace této imunitní odpovědi může vést ke škodlivým imunitním reakcím namířeným proti antigenům hostitele. Tento článek se zaměřuje na roli nejčastějších a nejznámějších virů a na mechanismus, kterým interagují s infikovaným imunitním systémem hostitele, což vyvolává zánětlivé reakce, které pak potencionálně vedou k rozvoji nebo exacerbaci revmatických autoimunitních onemocnění.
Klíčová slova:
autoimunita – viry – virová infekce – autoimunitní onemocnění
ÚVOD
Autoimunita je selhání imunologické tolerance, kdy dochází k aberantní imunologické odpovědi při rozpoznávání vlastních a cizích antigenů, které vede k imunitní odpovědi proti vlastním hostitelským antigenům. Jasná příčina vzniku autoimunitního onemocnění dosud nebyla přesně definována, studie však naznačují, že je potřeba kombinace různých faktorů, mezi něž patří genetická predispozice, věk, porucha imunitní regulace, faktory životního prostředí a virové infekce. Viry jsou považovány za hlavní faktory prostředí, které spouštějí autoimunitní reakce u geneticky vnímavých jedinců. Tento autoimunitní útok může být proveden různými zbraněmi a součástmi imunitního systému a prostřednictvím různých možných mechanismů. Viry nesou strukturně podobné antigeny jako vlastní antigeny, které aktivují B - a T-buňky, a vedou pak ke zkřížené reaktivní reakci jak proti vlastním, tak proti cizím antigenům, což je mechanismus známý jako „molekulární mimikry“ (1). Po aktivaci samovolně reagujících B - a T-lymfocytů dochází k poškození tkáně, které se může vyvinout do různých autoimunitních onemocnění. Dalším předpokládaným mechanismem je „bystander activation“, kdy nespecifická a nadměrně reaktivní antivirová imunitní odpověď vytváří lokalizované prozánětlivé prostředí spolu s uvolňováním vlastních antigenů z poškozené tkáně. Tyto vlastní antigeny jsou následně prezentovány antigen prezentujícími buňkami (APB) ke stimulaci původně nereagujících T-buněk, které pak vyvolávají autoimunitní reakci v okolí (2). Tento související mechanismus se nazývá „rozšiřování epitopů“, ve kterém virová infekce spouští uvolňování více autoantigenů a de novo aktivaci autoreaktivních buněk, které se zaměřují na vlastní epitopy (3). Virové infekce tedy spouštějí několik imunitních procesů, z nichž některé mohou přemoci imunitní regulační mechanismy, indukovat imunitní reakce namířené proti virovým, ale i hostitelským antigenům, a vyvolat tak autoimunitní onemocnění. Diagnostika virových infekcí není zcela snadná, je samozřejmě založena hlavně na klinickém obraze, ale ten může být probíhajícím autoimunitním onemocněním modifikován. Z laboratorních metod jsou k dispozici jednak nepřímé diagnostické metody založené na průkazu specifických protilátek nebo přímé metody průkazu virového materiálu v klinických vzorcích. Při sérologickém vyšetření je nutné odlišit protilátky, které mají anamnestický charakter od protilátek souvisejících s aktivní infekcí. Stanovení protilátek je důležité hlavně pro diagnostiku primární infekce. U reaktivovaných infekcí, u chronicky nemocných a u imunodeficientních nebo imunosuprimovaných pacientů je interpretace sérologických nálezů nejednoznačná (4).
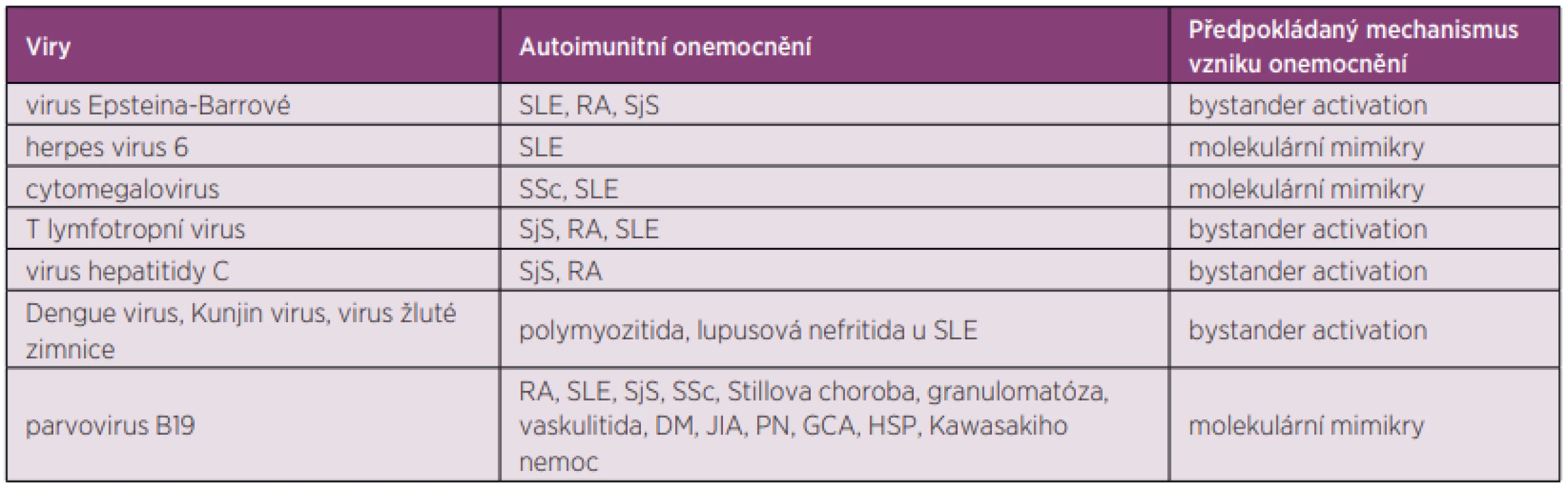
Mezi viry asociované s autoimunitními, převážně revmatickými onemocněními, patří především herpetické viry, flaviviry, retroviry, parvoviry a další.
HERPETICKÉ VIRY
Existuje stále více důkazů, které spojují infekci herpetickými viry s rozvojem mnoha autoimunitních poruch. Velké epidemiologické studie prokazují, že citlivost k roztroušené skleróze (RS) je získávána v dětství a jako její spouštěcí faktor působí virová infekce. Proto jsou herpetické viry, které vyvolávají dětské infekce, považovány za vhodné kandidáty přispívající k rozvoji RS. Herpetické viry také přetrvávají v hostiteli jako latentní infekce a při jejich reaktivaci mohou přispět ke vzniku systémových autoimunitních onemocnění.
Virus Epsteina-Barrové (EBV)
EBV, který patří mezi herpetické viry a způsobuje infekční mononukleózu (IM), je již po dlouhou dobu spojován s autoimunitními onemocněními, jako je systémový lupus erythematodes (SLE) a revmatoidní artritida (RA). U těchto onemocnění prokázaly některé studie vyšší titry protilátek proti EBV i vyšší virovou zátěž mononukleárních buněk v periferní krvi ve srovnání se zdravými kontrolami (5). Kromě toho byly v séru těchto pacientů častěji detekovány virové kapsidové antigeny (VCA), jaderný antigen EBV-1 (EBNA-1) a rané antigeny (EA). Protilátky IgG a IgM proti EBNA-1 a VCA byly detekovány u dospělých i dětí se SLE u 100 % testovaných pacientů, zatímco u zdravých kontrol jen v 66 % (6). Dále byly pozorovány zvýšené titry IgA zaměřené na EA u více než poloviny dospělých pacientů se SLE, zatímco u zdravých kontrol nebyl detekován žádný (7). Bylo také prokázáno, že u pacientů se SLE je snížená aktivita CD8+ T-buněk, které hrají hlavní roli při likvidaci buněk infikovaných EBV, což vede k nedostatečnému potlačení infekce (8).
U pacientů s RA byly v synoviálních tekutinách a v séru nalezeny výrazně vyšší hladiny protilátek proti EBNA-1, EA a VCA oproti zdravým kontrolám (9) a počet B-lymfocytů infiltrovaných EBV byl dokonce 10krát vyšší (10). Kromě toho byla DNA z EBV detekována také v mononukleárních buňkách periferní krve a slinách pacientů s RA (9). Bylo též zjištěno, že významná část plazmatických buněk produkujících protilátky proti cyklickým citrulinovaným peptidům v synoviálních membránách a synoviálních tekutinách pacientů s RA obsahuje DNA viru EBV (11). U pacientů s RA bylo nalezeno významně nižší procento CD8+ T-buněk produkujících IFNγ, které jsou namířeny proti antigenům EBV, což svědčí o horší odpovědi IFNγ na proteiny EBV (12). Další studie uvádí, že reaktivita T-buněk z periferní krve pacientů s RA k proteinu EBV Gp110, který hraje důležitou roli u vstupu viru do T-lymfocytů, byla nižší než u zdravých kontrol (13).
Dalším autoimunitním revmatickým onemocněním, které může být vyvoláno EBV, je Sjögrenův syndrom (SjS). Bylo prokázáno, že pacienti se SjS měli větší virovou nálož EBV a více protilátek proti EBV (14). Kromě virové částice byla u těchto pacientů detekována ve vysokých hladinách i DNA EBV v epiteliálních buňkách a v B-lymfocytech slinných žláz (15). Slzné žlázy pacientů se SjS obsahovaly kromě EBV latentního a lytického proteinu také DNA EBV. V celé řadě studií byla v séru pacientů se SS detekována vysoká hladina protilátek proti EBNA, VCA a EA (16). Jedna studie navíc prokázala, že procento anti-EA/D IgG protilátek u pacientů se SjS (36 %) bylo signifikantně vyšší ve srovnání se zdravými kontrolami (4,5 %) (14).
DNA EBV stimuluje produkci prozánětlivého cytokinu interleukinu 17A (IL-17A) u myší (17). Toto zvýšení IL-17 bylo pozorováno i u lidí, přičemž u pacientů s RA byla na rozdíl od kontrolní skupiny prokázána lineární korelace hladin IL-17A se zatížením DNA EBV (18). Také je velmi dobře známo, že IL-17A hraje zásadní roli při vývoji různých autoimunitních chorob (19). Navíc studie z roku 2018 ukázala, že se protein EBNA-2 váže přibližně na 50 % geneticky rizikových lokusů pro SLE, což demonstruje náhodnou interakci mezi genem a prostředím. Tato asociace s EBNA-2 byla pozorována i pro další autoimunitní onemocnění, jako jsou zánětlivá střevní onemocnění, diabetes mellitus typu 1, celiakie, juvenilní idiopatická artritida, Kawasakiho choroba, RA a RS (20).
Lidský herpes virus 6 (HHV-6)
V roce 1993 byly identifikovány dvě varianty HHV-6:HHV-6A a HHV-6B. Mají velmi podobné genomy, ale liší se biologicky a imunologicky (21). První důkaz asociace HHV-6 viru s rozvojem autoimunitního onemocnění byl prokázán ve studii u pacientů s RS, kde byla nalezena přítomnost HHV-6A antigenu v oligodendrocytech těchto pacientů, zatímco kontrolní skupina tyto antigeny neměla (22). Častá reaktivace HHV-6A/B byla kromě jiných systémových onemocnění nalezena také u pacientů se SLE (23, 24). HHV-6 byl také nalezen ve tkáních u pacientů s Hashimotovou tyreoiditidou (25).
Lidský cytomegalovirus (HCMV)
Dalším lidským herpesvirem, který je asociován s určitými autoimunitními onemocněními, je cytomegalovirus (CMV). Ve většině případů mají jedinci infikováni CMV mírné, nebo nemají žádné symptomy, ale u lidí s oslabenou imunitou může infekce CMV vést k závažným systémovým projevům, jako je kolitida, nefritida, splenomegalie, retinitida a encefalitida (26).
CMV je spojován se systémovou sklerodermií (SSc). U těchto pacientů je vyšší koncentrace protilátek proti CMV v porovnání se zdravými kontrolami. Výskyt těchto protilátek je asociován s heterozygocií pro alely f a Z těžkého řetězce IgG u pacientů se SSc, což ukazuje na klíčovou roli genetického profilu pacienta na rozvoj onemocnění (27). Dále bylo zjištěno, že u systémové difuzní formy sklerodermie jsou podstatně vyšší hladiny protilátek proti peptidové sekvenci sdílené s CMV proteinem UL94, což je v souladu s hypotézou, že CMV zhoršuje průběh SSc (28).
Studie, které se zabývaly souvislostí CMV a SLE, jsou vzácné a jejich výsledky rozporuplné. Většina z nich neprokázala korelaci mezi zvýšenými hladinami protilátek proti CMV IgM u pacientů se SLE ve srovnání se zdravými kontrolami, takže je pravděpodobnější, že u pacientů léčených imunosupresivní léčbou dochází k reaktivaci latentní CMV infekce, než že by byl CMV spouštěčem SLE (29). Jedna studie naznačila, že u pacientů s vyššími hladinami anti-CMV IgG byly častěji nalezeny protilátky anti-Sm (30).
Souhrnně lze říci, že mechanismy, kterými herpetické viry vyvolávají autoimunitu, jsou variabilní. Při autoimunitě vyvolané EBV a HHV byly hlášeny jak molekulární mimikry, tak „bystander activation“. EBV má nejen schopnost imortalizovat autoreaktivní infikované B-buňky, ale kromě toho mohou herpesviry jako neurotropní viry infikovat a zabíjet buňky CNS přímo, což vede k několika typům autoimunitních neurologických onemocnění.
FLAVIVIRY
Virus hepatitidy C (HCV)
Virus hepatitidy C byl poprvé popsán v roce 1989. Má schopnost chronicky infikovat hostitele, trvale se replikovat a způsobit specifické orgánové postižení i širokou škálu extrahepatálních manifestací. Nejčastěji byla souvislost viru hepatitidy C prokázána s Hashimotovou tyreoiditidou (31). Souvislost s jinými autoimunitními onemocněními, jako je SjS nebo RA, není tak dobře stanovena. Není jisté, zda HCV hraje roli při vývoji samotného SjS nebo napomáhá jen vzniku sialoadenitidy (32). Významná korelace mezi SjS a infekcí HCV byla prokázána na velkém počtu subjektů na Tchaj-wanu (33). Bylo navrženo několik mechanismů pro vysvětlení nemoci spojených s HCV, z nichž dva nejvýznamnější jsou smíšená kryoglobulinemie a cytokiny indukovaná zánětlivá odpověď vyvolaná přímou synoviální invazí viru (34). Smíšená kryoglobulinemie může být přítomna až u 35–54 % pacientů s hepatitidou C. Jen u 5–25 % těchto pacientů se vyvinou specifické příznaky kryoglobulinemické vaskulitidy se snížením C4 složky komplementu (až v 90 %) a pozitivitou revmatoidních faktorů (v 75 %). Nález protilátek proti viru hepatitidy C nebo virové ribonukleové kyseliny (RNA), která se nachází až u 96 % pacientů s MC, se považuje za definitivní průkaz souvislosti mezi HCV a smíšenou kryoglobulinemií. Protože biologickým znakem smíšené kryoglobulinemie je expanze B-buněk produkujících revmatoidní faktor, je pravděpodobné, že je aktivita revmatoidního faktoru v kombinaci s kryoprecipitabilitou odpovědná za vznik vaskulitidy. Ve studii Ferriho et al. byla prokázána přítomnost HCV infekce u 92 % případů smíšené kryoglobulinemie (anti-HCV protilátka 92 %, HCV RNA 90 %), zatímco virus hepatitidy B byl příčinou smíšené kryoglobulinemie pouze u 1,8 % případů (HBV DNA) (35).
Ostatní flaviviry
Hlavním nálezem dokazující souvislost mezi infekcí ostatními flaviviry (virus žluté zimnice, virus Dengue, Kunjin virus, virus západního Nilu, virus japonské encefalitidy) a autoimunitou je nález zvýšené exprese MHC-I (hlavní histokompatibilní komplex) na povrchu různých typů hostitelských buněk (36). V důsledku vysokých hladin v expresi MHC-I jsou aktivovány autoreaktivní cytotoxické T-buňky, které následně napadají vlastní tkáň, což vede ke vzniku autoimunitních onemocnění, jako jsou encefalomyelitida nebo polymyozitida (37). Dengue virus (DENV) byl také spojen se vznikem SLE a lupusové nefritidy (38). Proti viru žluté zimnice se lze očkovat, podle mezinárodního zdravotního řádu může být očkování vyžadováno jako podmínka vstupu do země, ve kterých se vyskytuje komár, přenašeč nemoci, ale nikoliv onemocnění. Jde o jednu dávku vakcíny, očkování je celoživotní. Očkování proti japonské encefalitidě je možné vakcínou ve dvou dávkách s přeočkováním za 1–2 roky s ochranou na minimálně 10 let.
RETROVIRY
Lidský T-lymfotropní virus typu 1 (HTLV-1)
HTLV-1 je známý tím, že většinou způsobuje HTLV-1 asociovanou myelopatii/tropickou spastickou paraparézu, ale byla nalezena souvislost se vznikem jiných onemocnění, jako je SjS nebo uveitida. Možným spouštěcím faktorem těchto onemocnění by mohla být infekce CD4+ T-buněk pomocí HTLV-1, což vede ke změnám hladin a/nebo aktivity klíčových transkripčních faktorů a mediátorů signálních drah (39). U pacientů s RA byly v synoviální membráně a v synoviální tekutině nalezeny T-buňky infikované HTLV-1 a DNA z HTLV proviru. Také byly u těchto pacientů zaznamenány zvýšené titry anti-HTLV-1 protilátek (40). Pacienti, kteří měli kloubní onemocnění a infekci způsobenou HTLV-1, měli ve svých synoviálních buňkách exprimovánu Tax mRNA (41).
U pacientů se SjS byla pozorována vyšší exprese prozánětlivých cytokinů a chemokinů, což naznačuje, že HTLV-1 infikuje a indukuje změny v epiteliálních buňkách slinných žláz a tím zřejmě ovlivňuje vývoj SjS. HTLV-1 také zřejmě hraje významnou roli v exacerbaci tohoto onemocnění, protože u jedinců infikovaných HTLV-1 byla nalezena vyšší proliferace mononukleárních buněk než u pacientů se SjS bez infekce HTLV-1 (42). Asociace HTLV-1 se SLE zůstává nejasná.
Virus lidské imunodeficience (HIV)
Nejčastěji se vyskytujícími revmatickými projevy při infekci HIV před zavedením vysoce aktivní retrovirové terapie (HAART) byla reaktivní artritida (ReA), psoriatická artritida (PsA) a bolestivý artikulární syndrom, jejichž prevalence kolísala od 3 do 71 %. Systémový lupus erythematodes a revmatoidní artritida se objevovaly velmi zřídka, protože tato onemocnění jsou vyvolána procesem zprostředkovaným CD4+ T-buňkami a virus HIV cílí právě na tyto buňky, proto snižuje rozvoj těchto dvou nemocí. Po zavedení HAART došlo k významnému poklesu prevalence revmatických projevů, ale objevila se nová skupina revmatických (polymyozitida, Kawasakiho choroba, Behçetova choroba, SLE, RA a Stillova choroba) i nerevmatických systémových autoimunitních a autoinflamatorních onemocnění (např. Hashimotova tyreoiditida, roztroušená skleróza, myasthenia gravis, autoimunitní hepatitida a další). Pacienti s RA a HIV mají většinou nízké titry revmatoidního faktoru a protilátek proti cyklickým citrulinovaným peptidům (anti-CCP), které se při léčbě HAART ještě dále snižují, což může vést k nepoznání diagnózy RA. Některé klinické projevy (horečka, artralgie, myalgie, kožní vyrážka, lymfadenopatie a další orgánová postižení) i laboratorní odchylky (cytopenie, pozitivní antinukleární a antifosfolipidové protilátky) pacientů se SLE a HIV mohou vyvolat diagnostické potíže. K rozlišení aktivity SLE od infekce HIV může pomoci hypokomplementemie, která u HIV infekce nebyla popsána. Polymyozitida asociovaná s HIV má obvykle mírnou aktivitu a je často obtížně diagnostikovatelná, protože pacienti s HIV infekcí mají generalizovanou svalovou slabost. Vaskulitida se u infekce HIV vyskytuje asi v 1 % případů a může postihnout malé, střední, ale i velké cévy. Častěji se vyskytuje u osob s hlubokou imunosupresí. Asociace mezi infekcí HIV a systémovou sklerodermií je vzácná. Dá se říci, že po zavedení HAART došlo k poklesu incidence séronegativních artritid, SLE, RA a polymyozitidy, avšak zvýšil se výskyt metabolických onemocnění kostí (osteoporóza, avaskulární kostní nekróza) a zánětlivých onemocnění, zvláště sarkoidózy, autoimunitní hemolytické anemie, Gravesovy choroby, psoriázy, autoimunitní trombocytopenie a nespecifického střevního zánětu (43).
PIKORNAVIRY
Enteroviry
Enteroviry jsou považovány za hlavní virové kandidáty způsobující diabetes mellitus 1. typu. Opakovaně byl hlášen sezonní nárůst incidence diabetu po enterovirových infekcích. Tato významná souvislost enterovirů a autoimunity byla navíc podpořena systematickou analýzou 24 publikací, jejíž výsledky byly nedávno publikovány australskými autory (44). Nejčastějším enterovirem u pacientů s prediabetem a diabetem je virus Coxsackie B.
PARVOVIRY
Lidský parvovirus B19 (PVB19)
Parvovirus je často spojován se vznikem mnoha autoimunitních onemocnění včetně revmatoidní artritidy, systémového lupusu, SjS, SSc, Stillovy choroby, granulomatózy, systémové vaskulitidy, Kawasakiho choroby, Henochovy-Schönleinovy purpury, dermatomyozitidy, juvenilní idiopatické artritidy, obrovskobuněčné arteriitidy a polyarteriitis nodosa. U pacientů infikovaných parvovirem B19 byla prokázána přítomnost četných protilátek proti hostiteli, např. protilátek proti retikulinu, proti hladkému svalu a parietálním buňkám, protilátek anti-DNA, antifosfolipidových a antinukleárních protilátek a revmatoidních faktorů. Kromě toho protilátky proti parvovirovým proteinům Vp1 a Vp2 zkříženě reagují s četnými hostitelskými antigeny (45).
PARAMYXOVIRY
Virus spalniček
Infekce virem spalniček je většinou asociována se vznikem roztroušené sklerózy. Vysoké titry protilátek byly ale také nalezeny u pacientů s diskoidním lupus erythematodes (46), chronickou aktivní hepatitidou a infekční mononukleózou.
Protilátky IgM a IgG jsou syntetizovány během primární imunitní reakce a lze je zjistit v séru během několika dnů od výsevu vyrážky s maximem za 7–10 dnů. Opakovaná expozice viru spalniček vyvolává silnou anamnestickou imunitní reakci s rychlou tvorbou protilátek IgG, zabraňující vzniku klinického onemocnění. K prevenci vzniku spalniček a zarděnek se používá kombinovaná živá očkovací látka, která se aplikuje dětem starších 15 měsíců, druhá dávka se podává mezi 5. a 6. rokem věku. V pozdějším věku i dospělosti je možné přeočkování (epidemiologická situace, kontakt s rizikovou populací, cestování) jednou dávkou.
TOGAVIRY
Virus rubeoly
Virus rubeoly se podílí nejčastěji na vzniku autoimunitních onemocnění štítné žlázy a diabetes mellitus 1. typu. U pacientů s autoimunitními onemocněními byly častěji nalezeny protilátky proti viru zarděnek (IgM i IgG) ve srovnání se zdravou populací (47).
Chikungunya virus (CHIKV)
Virus Chikungunya (CHIKV) je členem rodu Alphavirus a čeledi Togaviridae. Poprvé byl izolován v roce 1952 v Tanzanii. Jedná se o RNA virus s pozitivním jednořetězcovým genomem přibližně 11,6 kb. Virus Chikungunya se přenáší na člověka kousnutím infikovaného komára a vyvolává horečku doprovázenou akutní nebo chronickou artritidou (CCA). Patogeneze infekce chikungunya u lidí je i přes nedávná ohniska stále špatně pochopena. Je předpoklad, že v kloubech zůstávají nízké hladiny replikujícího se viru, virová RNA perzistuje v synovii a indukuje autoimunitu, tak jak to bylo prokázáno na myších modelech (48). Ale podle závěrů recentní analýzy 33 pacientů po 22 měsících od akutní infekce, u kterých nebyla nalezena žádná virová RNA ani proteiny v synoviální tekutině, se zdá, že perzistence viru není pro přetrvávání artritidy nezbytná. Autoři naznačují, že na chronické artritidě by se mohly podílet autoantigeny nebo autoreaktivní lymfocyty přítomné v synovii nebo ve svalové tkáni (49). Tato domněnka byla podpořena imunohistologickými nálezy virových antigenů ve svalové tkáni, získané svalovou biopsií pacientů infikovaných CHIKV s myozitickým syndromem. V synoviální i svalové tkáni pacientů s chronickou artritidou byla také detekována virová RNA (50). Rozhodně je chronická chikungunyová artritida doprovázena vysokými hladinami zánětlivých cytokinů a chemokinů, jako jsou cirkulující interleukin-6, faktor stimulující kolonie granulocytů a makrofágů (GM-CSF), interferon α a interleukin 17 (51).
ANELLOVIRY
Torque teno virus (TTV)
Torque teno virus je vysoce rozšířený nepatogenní jednovláknový DNA virus, který patří do čeledi Anelloviridae. Byl poprvé izolován v roce 1997 od japonského pacienta s potransfuzní hepatitidou. Je široce rozšířen v lidské populaci a nízká úroveň viremie je detekovatelná až u 90 % zdravých jedinců. Považuje se za virus, který dosud nemá žádné důkazy o patogenitě ani o specifické souvislosti s konkrétními klinickými chorobami. Zvýšené hladiny replikace TTV byly popsány během sepse, infekce HIV a po transplantaci. Byla popsána přímá souvislost mezi vyšším zatížením TTV a sklonu k potransplantační oportunní infekci, a proto je předpoklad, že stanovení viremie by mohlo být potencionálním biomarkerem imunosuprese.
V tomto roce publikovaná studie španělských autorů prokázala, že pacienti s chronickou artritidou, léčení různou imunosupresí, mají podobně zvýšené hladiny TTV viremie, ale ve srovnání s pacienty po transplantaci jsou tyto hladiny mnohem nižší. Celkově byla zvýšená viremie nalezena u pacientů léčených biologickými léky, ale nikoliv léčených DMARDs nebo anti-IL17. Zatížení TTV je také mnohem vyšší u pacientů na dlouhodobé terapii biologickými léky oproti pacientům, kteří terapii zahajují poprvé, kdy po několika měsících léčby bylo pozorováno jen relativně malé, přesto významné zvýšení viremie (52). V několika nezávislých studiích nebyly nalezeny významné rozdíly v procentech pozitivity TTV DNA ve vzorcích séra od pacientů s RA a SSc ve srovnání se séry pacientů s osteoartrózou a s normálními dárci krve. Byla nalezena jen zvýšená prevalence TTV u pacientů se SLE a zdá se, že pacienti s idiopatickými zánětlivými myopatiemi infikováni TTV mají horší klinické projevy tohoto onemocnění. Jinak je TTV většinou považován za běžný a neškodný virus (53).
KORONAVIRY
Koronaviry jsou pozitivní jednovláknové RNA viry patřící do rodiny Coronaviridae. Nový typ koronaviru s odborným označením SARS-CoV-2 (Severe Acute Respiratory Syndrome CoronaVirus 2) způsobuje onemocnění COVID19, které je nyní celosvětovým problémem. Jedná se o vysoce infekční onemocnění, které se projevuje zejména horečkami, respiračními potížemi (suchý kašel, dušnost), bolestí svalů a únavou. Až 80 % infekcí má lehký nebo zcela asymptomatický průběh, ale u starších a chronicky nemocných osob se může rozvinout pneumonie s potencionálně závažným, v některých případech i fatálním průběhem. Pro vstup viru SARS-CoV-2 do hostitelské buňky je klíčový jeden z glykoproteinů virionového obalu („korony“), S-protein (spike-protein). Ten se váže na angiotenzin konvertující enzym 2 (ACE2) exprimovaný na povrchu vnímavých buněk a využívá jej jako receptor (54).
Laboratorní diagnostika je založena na průkazu virového genomu pomocí RT-PCR v nazofaryngeálním nebo orofaryngeálním stěru, sputu, popřípadě v aspirátu z dýchacích cest (55). Konfirmace se provádí pomocí RT-PCR s jinou sadou primerů nebo sekvenováním. Při odběru materiálu se nedoporučuje indukce sputa. Z bezpečnostních důvodů se u pacientů s podezřením na COVID-19 neprovádí virologická kultivace (56). Z pomocných laboratorních vyšetřovacích metod jsou nicméně dostupné i rychlé diagnostické testy založené na průkazu IgG a IgM proti viru SARS-CoV-2. Jejich výhodou je rychlost provedení (řádově minuty oproti několika hodinám potřebným pro RT-PCR) a nízká cena. Nevýhodou je především několikadenní diagnostické okno. Senzitivita rychlých diagnostických testů je u symptomatických osob kolem 85–90 %, specificita kolem 90 % (57). Zkoušejí se i další laboratorní postupy, které detekují virovou RNA. Jde o postupy využívající rychlé amplifikace úseku virové nukleové kyseliny pomocí RT-RPA a detekce založené na specifickém štěpení pomocí CRISPR. Výhodou by mělo být rychlejší provedení (řádově desítky minut) a menší nároky na laboratorní vybavení ve srovnání s klasicky prováděnou RT-PCR při zachování vysoké citlivosti i specificity (58). Co se týká pacientů se systémovými revmatickými autoimunitními onemocněními, k dnešnímu dni neexistuje důkaz, že tito pacienti mají vyšší riziko nákazy nebo horší prognózu onemocnění SARS-CoV-2 než jednotlivci bez systémových revmatických onemocnění. Ale obecně známé rizikové faktory pro těžký průběh COVID-19, jako je vyšší věk, mužské pohlaví, kardiovaskulární onemocnění, kouření a obezita, se vztahují i na pacienty se systémovými revmatickými onemocněními (59). Zdá se, že ani imunosupresivní terapie včetně biologických přípravků nezhoršuje průběh infekce COVID-19, jak vyplývá ze závěrů prospektivního sledování 86 pacientů se známými autoimunitními onemocněními (RA, PsA, AS, psoriáza, idiopatické střevní záněty), u kterých byla potvrzena nebo byla vysoce suspektní infekce COVID-19. Z těchto 86 pacientů 62 (72 %) dostalo biologické léky nebo inhibitory Janusových kináz a celkový výskyt hospitalizace byl 16 % (14 z 86 pacientů). Hospitalizovaní pacienti byli starší než ambulantní pacienti. Ačkoliv distribuce diagnóz autoimunitních onemocnění byla ve skupině ambulantních i hospitalizovaných podobná, vyšší procento přijatých pacientů mělo revmatoidní artritidu a zároveň koexistující hypertenzi, cukrovku nebo chronické obstrukční plicní onemocnění. Ačkoliv byla analýza omezena na velikost vzorku, data odhalují výskyt hospitalizace u pacientů s autoimunitními onemocněními, který byl konzistentní s výskytem mezi pacienty s Covid-19 v běžné populaci v New Yorku (60).
Očkování proti SARS-CoV-2 zatím není k dispozici. Pro vývoj vakcíny byly identifikovány potenciální epitopy (61, 62), o přípravu očkovací látky se pokouší několik farmaceutických firem. V současné době jsou dvě vakcíny v klinické fázi I. testování u zdravých dobrovolníků (63).
ZÁVĚR
Virové infekce jsou hlavním spouštěčem autoimunity. Autoimunita vyvolaná virem je vícesměrný proces. Není za ní odpovědný jediný faktor, ale vývoj autoimunitních onemocnění po virových infekcích je multifaktoriální proces, který může být ovlivněn různými proměnnými. Současná data naznačují, že viry mohou iniciovat autoimunitu několika cestami, včetně molekulární mimikry, rozšiřování epitopů, „bystander activation“ nebo i mortalizací infikovaných B-buněk. A naopak, rostoucí důkazy podporují ochrannou roli virů proti autoimunitě (64), kde virové infekce vedou k aktivaci regulačních imunitních odpovědí, což následně potlačuje rozvoj autoimunitních reakcí. Tento duální účinek virových infekcí na autoimunitu je ovlivňován různými hostitelskými, virovými a environmentálními faktory. Stanovení, zda virová infekce povede k autoimunitě nebo bude chránit před určitými imunitními poruchami, jako je například diabetes mellitus 1. typu nebo Crohnova choroba, závisí na mnoha faktorech, včetně typu virového kmene, genetické predispozice, imunitní odpovědi hostitele, infekční dávky a doby infekce. Rovněž stojí za zmínku, že velká část pacientů s autoimunitním onemocněním je léčena imunosupresivními léky, které mohou přispívat k exacerbaci infekce nebo navozovat vhodné prostředí pro reaktivaci a replikaci latentního viru, čímž se vytváří dojem, že vývoj dotyčného onemocnění je spojen s tímto konkrétním patogenem. Ať už určitý patogen přispívá k nárůstu autoimunitního onemocnění, nebo ne, značné množství důkazů sdružujících virové infekce diskutované v tomto přehledu naznačuje, že tyto viry jsou schopné přinejmenším exacerbovat vyvíjející se autoimunitní reakci (65). V souladu s tím je třeba další epidemiologický a molekulární výzkum, aby se získal přehled o souhře mezi virovými infekcemi a autoimunitními odpověďmi hostitele a aby byl poskytnut jasný mechanistický popis toho, jak virová infekce může spustit autoimunopatie.
Konflikt zájmů: žádný.
adresa pro korespondenci:
MUDr. Radka Moravcová
Revmatologický ústav
Na Slupi 4, 128 50 Praha 2
e-mail: moravcovar@revma.cz
Sources
1. Kim B, Kaistha SD, Rouse BT. Viruses and autoimmunity. Autoimmunity 2006; 39(1): 71–77.
2. Fujinami RS, von Herrath MG, Christen U, et al. Molecular mimicry, bystander activation, or viral persistence: infections and autoimmune disease. Clin Microbiol Rev 2006; 19(1): 80–94.
3. Getts DR, Chastain EM, Terry RL, et al. Virus infection, antiviral immunity, and autoimmunity. Immunol Rev 2013; 255(1): 197–209.
4. Roubalová K. Laboratorní diagnostika herpetických virů. Med praxi 2010; 7(5): 241–244.
5. Poole BD, Templeton AK, Guthridge JM, et al. Aberrant Epstein-Barr viral infection in systemic lupus erythematosus. Autoimmun Rev 2009; 8(4): 337–342.
6. James JA, Neas BR, Moser KL, et al. Systemic lupus erythematosus in adults is associated with previous Epstein-Barr virus exposure. Arthritis Rheum 2001; 44(5): 1122–1126.
7. Draborg AH, Duus K, Houen G. Epstein-Barr virus and systemic lupus erythematosus. Clin Dev Immunol 2012; 2012 : 370516.
8. Larsen M, Sauce D, Deback C, et al. Exhausted cytotoxic control of Epstein-Barr virus in human lupus. PLoS Pathog 2011; 7(10): e1002328.
9. Blaschke S, Schwarz G, Moneke D, et al. Epstein-Barr virus infection in peripheral blood mononuclear cells, synovial fluid cells, and synovial membranes of patients with rheumatoid arthritis. J Rheumatol 2000; 27(4): 866–873.
10. Balandraud N, Meynard JB, Auger I, et al. Epstein-Barr virus load in the peripheral blood of patients with rheumatoid arthritis: Accurate quantification using real-time polymerase chain reaction. Arthritis Rheum 2003; 48(5): 1223–1228.
11. Croia C, Serafini B, Bombardieri M, et al. Epstein-Barr virus persistence and infection of autoreactive plasma cells in synovial lymphoid structures in rheumatoid arthritis. Ann Rheum Dis 2013; 72(9): 1559–1568.
12. Klatt T, Ouyang Q, Flad T, et al. Expansion of peripheral CD8+ CD28 – T cells in response to Epstein-Barr virus in patients with rheumatoid arthritis. J Rheumatol 2005; 32(2): 239–251.
13. Toussirot E, Wendling D, Tiberghien P, et al. Decreased T cell precursor frequencies to Epstein-Barr virus glycoprotein Gp110 in peripheral blood correlate with disease activity and severity in patients with rheumatoid arthritis. Ann Rheum Dis 2000; 59(7): 533–538.
14. Pasoto SG, Natalino RR, Chakkour HP, et al. EBV reactivation serological profile in primary Sjögren’s syndrome: an underlying trigger of active articular involvement? Rheumatol Int 2013; 33(5): 1149–1157.
15. Mariette X, Gozlan J, Clerc D, et al. Detection of Epstein-Barr virus DNA by in situ hybridization and polymerase chain reaction in salivary gland biopsy specimens from patients with Sjögren’s syndrome. Am J Med 1991; 90(3): 286–294.
16. Toda I, Ono M, Fujishima H, et al. Sjögren’s syndrome (SS) and Epstein-Barr virus (EBV) reactivation. Ocul Immunol Inflamm 1994; 2(2): 101–109.
17. Rahal EA, Hajjar H, Rajeh M, et al. Epstein-Barr virus and human herpes virus 6 type A DNA Enhance IL-17 Production in Mice. Viral Immunol 2015; 28(5): 297–302.
18. Salloum N, Hussein HM, Jammaz R, et al. Epstein-Barr virus DNA modulates regulatory T-cell programming in addition to enhancing interleukin-17A production via Toll-like receptor 9. PLoS One 2018; 13(7): e0200546.
19. Tabarkiewicz J, Pogoda K, Karczmarczyk A, et al. The role of IL-17 and Th17 lymphocytes in autoimmune diseases. Arch Immunol Ther Exp (Warsz) 2015; 63(6): 435–449.
20. Harley JB, Chen X, Pujato M, et al. Transcription factors operate across disease loci, with EBNA2 implicated in autoimmunity. Nat Genet 2018; 50(5): 699–707.
21. Pietiläinen J, Virtanen JO, Uotila L, et al. HHV-6 infection in multiple sclerosis. A clinical and laboratory analysis. Eur J Neurol 2010; 17(3): 506–509.
22. Challoner PB, Smith KT, Parker JD, et al. Plaque-associated expression of human herpesvirus 6 in multiple sclerosis. Proc Natl Acad Sci USA 1995; 92(16): 7440–7444.
23. Broccolo F, Drago F, Paolino S, et al. Reactivation of human herpesvirus 6 (HHV-6) infection in patients with connective tissue diseases. J Clin Virol 2009; 46(1): 43–46.
24. Broccolo F, Drago F, Cassina G, et al. Selective reactivation of human herpesvirus 6 in patients with autoimmune connective tissue diseases. J Med Virol 2013; 85(11): 1925–1934.
25. Scotet E, Peyrat MA, Saulquin X, et al. Frequent enrichment for CD8 T cells reactive against common herpes viruses in chronic inflammatory lesions: towards a reassessment of the physiopathological significance of T cell clonal expansions found in autoimmune inflammatory processes. Eur J Immunol 1999; 29(3): 973–985.
26. Schottstedt V, Blümel J, Burger R, et al. Human cytomegalovirus (HCMV) – revised. Transfus Med Hemother 2010; 37(6): 365–375.
27. Pandey JP. Immunoglobulin GM genes and IgG antibodies to cytomegalovirus in patients with systemic sclerosis. Clin Exp Rheumatol 2004; 22(3, Suppl 33): S35–37.
28. Namboodiri AM, Rocca KM, Pandey JP. IgG antibodies to human cytomegalovirus late protein UL94 in patients with systemic sclerosis. Autoimmunity 2004; 37(3): 241–244.
29. Halenius A, Hengel H. Human cytomegalovirus and autoimmune disease. Biomed Res Int 2014; 2014 : 472978.
30. Palafox Sánchez CA, Satoh M, Chan EK, et al. Reduced IgG anti-small nuclear ribonucleoprotein autoantibody production in systemic lupus erythematosus patients with positive IgM anti-cytomegalovirus antibodies. Arthritis Res Ther 2009; 11(1): R27.
31. Huang MJ, Tsai SL, Huang BY, et al. Prevalence and significance of thyroid autoantibodies in patients with chronic hepatitis C virus infection: a prospective controlled study. Clin Endocrinol (Oxf) 1999; 50(4): 503–509.
32. Carrozzo M. Oral diseases associated with hepatitis C virus infection. Part 1. Sialadenitis and salivary glands lymphoma. Oral Dis 2008; 14(2): 123–130.
33. Yeh CC, Wang WC, Wu CS, et al. Association of Sjögrens syndrome in patients with chronic hepatitis virus infection: a population-based analysis. PLoS One 2016; 11(8): e0161958.
34. Aktas GE, Sarikaya A, Kandemir O. Hepatitis C virus-related arthritis: bone scintigraphic appearances. Indian J Nucl Med 2017; 32(1): 30–32.
35. Ferri C, Sebastiani M, Giuggioli D, et al. Mixed cryoglobulinemia: demographic, clinical, and serologic faetures and survival in 231 patients. Semin Arthritis Rheum 2004; 33(6): 355–374.
36. Lobigs M, Blanden RV, Müllbacher A. Flavivirus-induced up-regulation of MHC class I antigens; implications for the induction of CD8+ T-cell-mediated autoimmunity. Immunol Rev 1996; 152 : 5–19.
37. Bao S, King NJ, Dos Remedios CG. Flavivirus induces MHC antigen on human myoblasts: a model of autoimmune myositis? Muscle Nerve 1992; 15(11): 1271–1277.
38. Talib SH, Bhattu S, Bhattu R. Dengue fever triggering systemic lupus erythematosus and lupus nephritis: a case report. Int Med Case Rep J 2013; 6 : 71–75.
39. Fuzii HT, da Silva Dias GA, de Barros RJ, et al. Immunopathogenesis of HTLV-1-associated myelopathy/tropical spastic paraparesis (HAM/TSP). Life Sci 2014; 104(1–2): 9–14.
40. Brzustewicz E, Bryl E. The role of cytokines in the pathogenesis of rheumatoid arthritis – practical and potential application of cytokines as biomarkers and targets of personalized therapy. Cytokine 2015; 76(2): 527–536.
41. Nishioka K, Nakajima T, Hasunuma T, et al. Rheumatic manifestation of human leukemia virus infection. Rheum Dis Clin North Am 1993; 19(2): 489–503.
42. Nakamura H, Takahashi Y, Yamamoto-Fukuda T, et al. Direct infection of primary salivary gland epithelial cells by human T lymphotropic virus type I in patients with Sjögren’s syndrome. Arthritis Rheumatol 2015; 67(4): 1096–1106.
43. Vega LE, Espinoza LR. Human immunodeficiency virus infection (HIV)-associated rheumatic manifestations in the pre - and post-HAART eras. Clin Rheumatol 2020; 15 : 1–8.
44. Yeung WC, Rawlinson WD, Craig ME. Enterovirus infection and type 1 diabetes mellitus: systematic review and meta-analysis of observational molecular studies. BMJ 2011; 342: d35.
45. Lunardi C, Tinazzi E, Bason C, et al. Human parvovirus B19 infection and autoimmunity. Autoimmun Rev 2008; 8(2): 116–120.
46. Hollinger FB, Sharp JT, Lidsky MD, et al. Antibodies to viral antigens in systemic lupus erythematosus. Arthritis Rheum 1971; 14(1): 1–11.
47. Altman A, Szyper-Kravitz M, Agmon-Levin N, et al. Prevalence of rubella serum antibody in autoimmune diseases. Rev Bras Reumatol 2012; 52(3): 307–318.
48. Poo YS, Rudd PA, Gardner J, et al. Multiple immune factors are involved in controlling acute and chronic chikungunya virus infection. PLoS Negl Trop Dis 2014; 8(12): e3354.
49. Chang AY, Martins KAO, Encinales L, et al. Chikungunya arthritis mechanisms in the americas: a cross-sectional analysis of chikungunya arthritis patients twenty-two months after infection demonstrating no detectable viral persistence in synovial fluid. Arthritis Rheumatol 2018; 70(4): 585–593.
50. McCarthy MK, Morrison TE. Persistent RNA virus infections: do PAMPS drive chronic disease? Curr Opin Virol 2017; 23 : 8–15.
51. Amaral JK, Taylor PC, Teixeira MM, et al. The clinical features, pathogenesis and methotrexate therapy of chronic chikungunya arthritis. Viruses 2019; 11(3).
52. Martín-López M, Albert E, Fernández-Ruiz M, et al. Torque teno virus viremia in patients with chronic arthritis: Influence of biologic therapies. Semin Arthritis Rheum 2020; 50(1): 166–171.
53. Gergely P Jr, Perl A, Poór G. Possible pathogenic nature of the recently discovered TT virus: does it play a role in autoimmune rheumatic diseases? Autoimmun Rev 2006; 6(1): 5–9.
54. Liu Z, Xiao X, Wei X, et al. Composition and divergence of coronavirus spike proteins and host ACE2 receptors predict potential intermediate hosts of SARS-CoV-2. J Med Virol 2020; doi:10.1002/jmv.25726
55. World Health Organisation. Coronavirus disease (COVID-19) technical guidance: Laboratory testing for 2019-nCoV in humans [online].
56. UpToDate: Coronavirus disease 2019 (COVID-19) [databáze]. Wolters Kluwer Health, ©2020. Poslední revize 2020-03-20 cit. 2020-03-22].
57. Li Z, Yi Y, Luo X. Development and clinical application of a rapid IgM-IgG combined antibody test for SARS-CoV-2 infection diagnosis. J Medical Virol 2020; doi:10.1002/jmv.25727
58. Broughton JP, Deng J, Yu G. Rapid detection of 2019 novel coronavirus SARS-CoV-2 using a CRISPR-based DETECTR lateral flow assay. medRxiv 2020; doi:10.1101/2020.03.06.20032334
59. Landewé RB, Machado PM, Kroon F, et al. EULAR provisional recommendations for the management of rheumatic and musculoskeletal diseases in the context of SARS-CoV-2. Ann Rheum Dis 2020; 79(7): 851–858.
60. Haberman R, Axelrad J, Chen A, et al. Covid-19 in immune-mediated inflammatory diseases – case series from New York. N Engl J Med 2020; NEJMc2009567.
61. Ahmed SF, Quadeer AA, McKay MR. Preliminary identification of potential vaccine targets for the COVID-19 coronavirus (SARS-CoV-2) based on SARS-CoV immunological studies. Viruses 2020; 3(12): 254.
62. Prompetchara E, Ketloy Ch, Palaga T. Immune responses in COVID-19 and potential vaccines: Lessons learned from SARS and MERS epidemic. Asian Pac J Allergy Immunol 2020; 38(1): 1–9.
63. Craven J. OVID-19 vaccine tracker [online]. Regulatory Affairs Professionals Society, Poslední revize 2020-03-21.
64. Lerner A, Arleevskaya M, Schmiedl A, et al. Microbes and viruses are bugging the gut in celiac disease. Are they friends or foes? Front Microbiol 2017; 8 : 1392.
65. Hussein HM, Rahal EA. The role of viral infections in the development of autoimmune diseases. Crit Rev Microbiol 2019; 45(4): 394–412.
Labels
Dermatology & STDs Paediatric rheumatology RheumatologyArticle was published in
Czech Rheumatology

2020 Issue 3
-
All articles in this issue
- National registry of biological and targeted therapy of rheumatic diseases ATTRA – 20 years of experience
- Validation of Czech versions of questionnaires assessing fatigue and physical acti- vity in patients with rheumatic diseases: Fatigue Impact Scale (FIS), Multidimensional Assessment of Fatigue Scale (MAF), Human Activity Profile (HAP)
- Current impact of seronegative rheumatoid arthritis
- The role of viruses in the development of autoimmune diseases
- Differential diagnosis of systemic scleroderma from the perspective of dermatologist
- Diet in gout – should we reduce the intake of purines?
- Vzpomínka na profesora Lenocha
- Czech Rheumatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Current impact of seronegative rheumatoid arthritis
- Validation of Czech versions of questionnaires assessing fatigue and physical acti- vity in patients with rheumatic diseases: Fatigue Impact Scale (FIS), Multidimensional Assessment of Fatigue Scale (MAF), Human Activity Profile (HAP)
- The role of viruses in the development of autoimmune diseases
- Diet in gout – should we reduce the intake of purines?
