Doporučení České revmatologické společnosti pro farmakologickou léčbu axiálních spondyloartritid Část I. Strategie léčby a farmakoterapie
Pavelka K. and the Committee of the Czech Society for Rheumatology. Recommendations of the Czech Society for Rheumatology the Pharmacological Treatment of Axial Spondyloarthritis Part I. Treatment and pharmacotherapy strategies
The recommendations of the Czech Society for Rheumatology (ČRS) for the treatment of ankylosing spondylitis (AS) were published in 2012, and, therefore, the decision of the ČRS committee proceeded to the innovation of these criteria. It was based on the ASAS / EULAR recommendations for the treatment of axial spondyloarthritis, published in 2017, which are based on published records and the consensus of leading experts. Compared to the older criteria, there are several important innovations. The first and fundamental difference is the fact that these recommendations already apply to patients with a wider range of axial spondyloarthritis (SpA), i.e., radiographic and non-radiographic SpA and not just ankylosing spondylitis. There is also some innovation in views on the evaluation of disease activity so that the ASDAS score is now preferred. The intentions of this score also define a threshold for the initiation of biologic therapy (ASDAS ≥ 2.1) and more specifically defined treatment targets. Another new element is the introduction of newer drugs, i.e., IL-17 inhibitors. The current recommendations list IL-17 inhibitors as an alternative to first-line treatment with TNF inhibitors. These recommendations also include instructions on how to proceed in patients with extra-articular symptoms, i.e., acute anterior uveitis, idiopathic inflammatory bowel disease, and osteoporosis.
Keywords:
axial spondyloarthritis – biological treatment – disease activity – recommended procedures
Authors:
K. Pavelka; Výbor České Revmatologické Společnosti
Authors‘ workplace:
Revmatologický ústav Praha
Published in:
Čes. Revmatol., 29, 2021, No. 1, p. 5-19.
Category:
Recomendation
Overview
Doporučení České revmatologické společnosti (ČRS) pro léčbu ankylozující spondylitidy (AS) byla publikována v roce 2012, a proto rozhodnutím výboru společnosti bylo přistoupeno k inovaci těchto kritérií. Vycházelo se přitom z Doporučení ASAS/EULAR pro léčbu axiálních spondyloartritid, publikovaných v roce 2017, která jsou vytvářena na základě publikované evidence a konsenzu předních odborníků. Oproti starším kritériím je zde několik důležitých inovací. Prvním a zásadním rozdílem je fakt, že se tato doporučení již týkají pacientů širšího spektra axiálních spondyloartritid, tzn. radiografické a neradiografické SpA a nikoliv jen ankylozující spondylitidy. Dochází také k určité inovaci názorů na hodnocení aktivity onemocnění, takže se nyní upřednostňuje skóre ASDAS. V intencích tohoto skóre je také definována prahová hodnota pro nasazení biologické léčby (ASDAS ≥ 2,1) a konkrétněji definované cíle léčby. Dalším novým prvkem je uvedení novějších léků, tzn. inhibitorů IL-17. V aktuálních doporučeních jsou uváděny jako alternativa první linie léčby inhibitory TNF-α. Součástí těchto doporučení jsou i návody jak postupovat u pacientů s extraartikulárními příznaky, tzn. akutní přední uveitidou, idiopatickými střevními záněty a osteoporózou.
Klíčová slova:
axiální spondyloartritidy – biologická léčba – aktivita nemoci – doporučené postupy
ÚVOD
Axiální spondyloartritidy (ax-SpA) jsou chronická, zánětlivá revmatická onemocnění, která postihují páteř ve formě sakroiliitidy a spondylitidy, dále pak periferní struktury ve formě artritidy, entezitidy a daktylitidy. Časté jsou i tzv. extraskeletální manifestace, přičemž nejčastější jsou akutní přední uveitidy, idiopatické střevní záněty a psoriáza. Celá skupina ax-SpA je tudíž fenotypicky pestrá. Termín axiální SpA v sobě zahrnuje jak formu s rentgenově průkaznou sakroiliitidou (rd ax-SpA) nebo také bez rentgenově průkazné sakroiliitidy (tzv. neradiografická, nr-ax-SpA). Skupina Assessment of SpondyloArthritis International Society/European League Against Rheumatism (ASAS/EULAR) publikovala pro ax-SpA klasifikační kritéria (1). I když jde o primárně kritéria klasifikační, zkušený revmatolog je může použít i jako diagnostická. Je nutné také zdůraznit, že u ax-SpA jsou na rozdíl od periferních spondyloartritid axiální příznaky převažující (bolesti v zádech) nad periferními (ale mohou být také přítomny).
Stále je diskutována otázka, zda mají být radiografická a neradiografická SpA považovány za odlišné klinické jednotky, nebo jde o pokračující vývojové spektrum jedné nemoci. V poslední době začíná převažovat názor, že jde o jedno spektrum nemoci (2). Nicméně jenom část pacientů s nr-ax-SpA přejde do ankylozující spondylitidy (AS). Také ne všichni pacienti se sakroiliitidou vyvinou syndesmofyty. Je také známo, že při hodnocení rentgenové sakroiliitidy vznikají velké rozdíly. Z toho všeho vyplývá, že dělení axiálních spondyloartritid na radiografické a neradiografické z hlediska terapie nemá velký význam. Historicky byly biologické léky zkoušeny u ankylozující spondylitidy a regulatorní agentury vyžadovaly pro indikaci neradiografické ax-SpA separátní studie. Aktuálně již jsou doporučovány studie s indikací axiální spondyloartritidy. Proto také nová doporučení ASAS-EULAR (3), ale i doporučení České revmatologické společnosti (ČRS) hovoří o léčbě axiálních spondyloartritid a nikoliv AS. Přispívá k tomu také fakt, že při srovnávání kohort s radiografickou a neradiografickou SpA byla zjištěna stejná aktivita, stejná úroveň ukazatelů hodnocených pacientem (PRO) a stejné zhoršení funkce u obou forem ax-SpA. Řada nových studií s biologickými léky také prokázala podobnou účinnost biologického chorobu modifikujícího léku u radiografické i neradiografické formy ax-SpA (4–6)
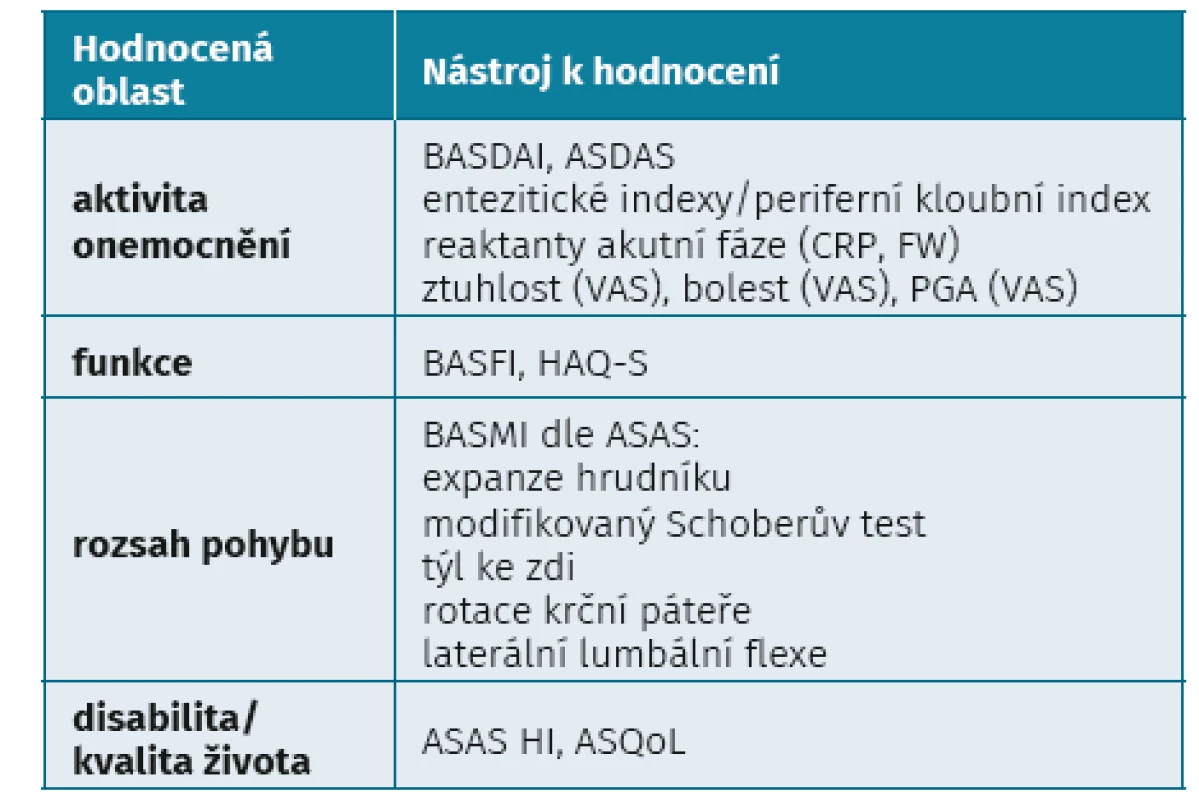
HODNOCENÍ AKTIVITY AXIÁLNÍ SPONDYLOARTRITIDY A FUNKČNÍHO OMEZENÍ
Hodnocení aktivity (jinak také monitorování léčby) je základním pilířem úspěšné léčby. Axiální spondyloartritidy jsou heterogenní onemocnění, takže jejich monitorování vyžaduje použití celé řady ukazatelů. Důležitým dokumentem stále zůstává tzv. ASAS core set, který obsahuje přehled validovaných ukazatelů pro hodnocení aktivity SpA (7) (tab. 1). Zhodnocení aktivity nemocného s ax-SpA se sestává z hodnocení bolesti, ztuhlosti, únavy, fyzické funkce a kvality života související se zdravotním stavem (HR-Qol), dále globálního hodnocení aktivity pacientem a lékařem.
Clinical assessment of axial spondyloarthritis. In: Mease P, Khanm M,
et al. Axial spondyloarthritis. St. Louis: Elsevier 2020; 121–133)
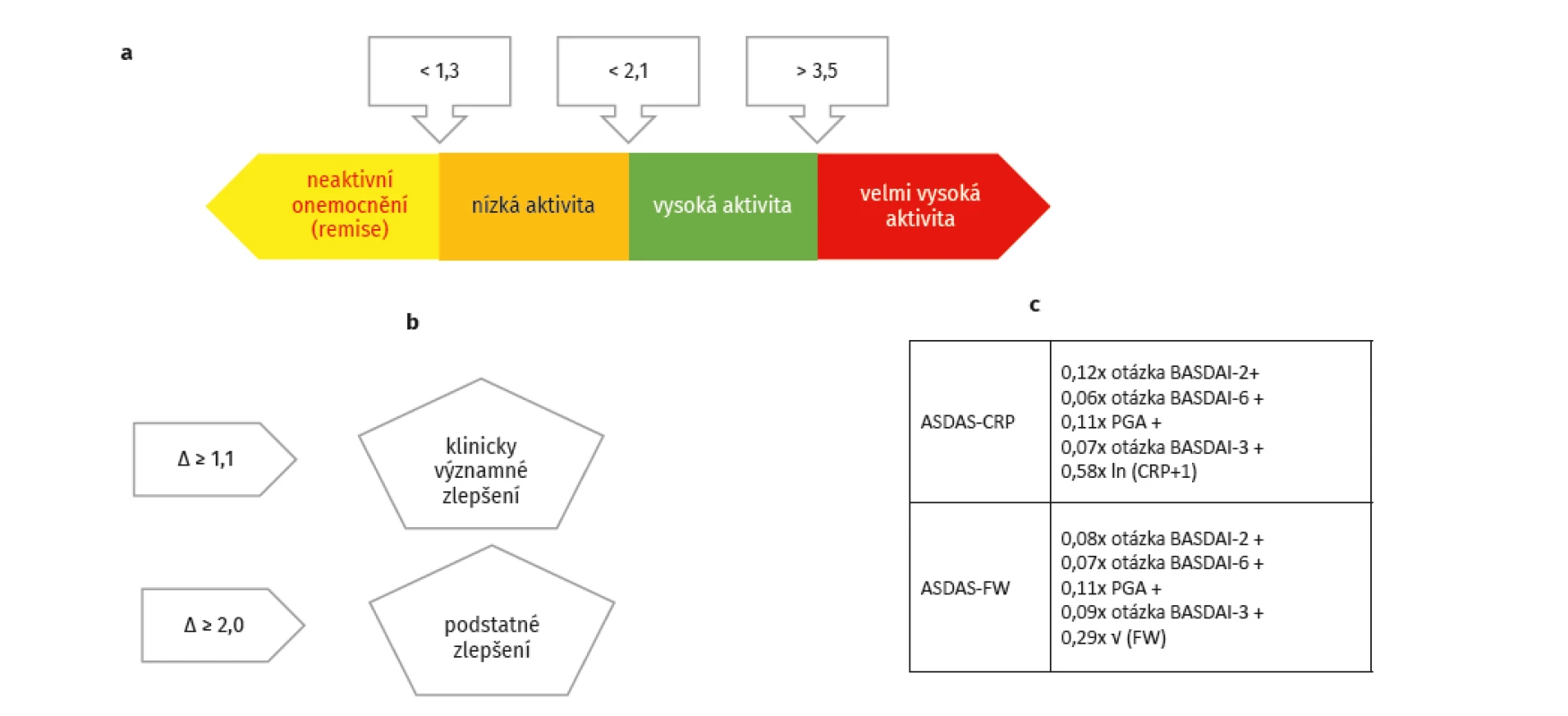
Z validovaných indexů aktivity se historicky stále často užívá skóre Bath Ankylosing Spondylitis Disease Activity Index (BASDAI) (8), jehož hodnota 4 a více je stále v České republice ustanovena prahovou pro zahájení biologické léčby. Problémem BASDAI je, že obsahuje pouze subjektivní údaje pacienta. Stále více se proto doporučuje používat skóre ASDAS, které zvyšuje objektivitu hodnocení přidáním reaktantu akutní fáze (CRP nebo FW) (9). Kohortové studie prokázaly, že hodnoty skóre Ankylosing Spondylitis Disease Activity Score (ASDAS) lépe korelovaly s nálezy aktivních zánětlivých změna na magnetické rezonanci (MR) sakroiliakálních (SI) kloubů a páteře i s rentgenovou progresí ax-SpA.
Pro hodnocení mobility páteře ASAS doporučuje pět měření (expanze hrudníku, modifikovaný Schoberův test, vzdálenost týlní kosti ke zdi, rotace krční páteře a laterální lumbální flexi) nebo alternativně index BASMI (10).
Pro hodnocení funkce index Bath Ankylosing Functional Index (BASFI) (11). Pro hodnocení entezitid byla vyvinuta celá řada indexů, přičemž nejvíce je používán index Maastricht Ankylosing Spondylitis Enthesitis Score (MASES) (12).
Pro hodnocení kvality života je možné použít dotazník HAQ nebo vlastní nástroj vyvinutý skupinou ASAS, kterým je ASAS Health Index (ASAS HI) (13).
Pro běžnou klinickou praxi lze doporučit především skóre ASDAS (obr. 1a–c). Prahová hodnota pro zahájení léčby by měla být hodnota ≥ 2,1. Frekvence monitorování aktivity se liší podle aktivity ax-SpA. U aktivních forem ax-SpA by měla být každé 3 měsíce, u málo aktivních forem každých 6 měsíců a u pacientů v dlouhodobé remisi postačí jednou za 12 měsíců.
https://doi.org/10.1016/j.jaut.2019.102398)
PGA – celková aktivita nemoci hodnocená pacientem
Zobrazovací metodou, která může přinést objektivní informaci o intenzitě zánětu, je magnetická rezonance (MR). U časných forem SpA je nejvhodnější metodou MR sakroiliakálních kloubů, u pozdějších forem onemocnění také MR páteře. Problémem je, že korelace klinických nálezů aktivity a nálezu na MR je poměrně slabá (14). K tomu přistupuje problematika při interpretaci nálezů na MR, její dostupnost MR i cena. Lze konstatovat, že úloha MR při monitorování aktivity SpA v běžné praxi není jasná a spíše je vhodné ji nedoporučit. Nicméně v individuálních případech může intenzita zánětu na MR přispět ke globálnímu hodnocení lékaře a jeho rozhodování o zahájení nebo pokračování v léčbě.
Hlavní význam MR u SpA je nutné vidět v časné diagnostice SpA a případně odhadu prognózy SpA než v monitorování aktivity.
Byly vytvořeny také indexy aktivity na MR, jako je kanadské skóre Spondyloarthritis Research Consortium of Canada (SPARCC) a Berlínské skóre, která jsou však poměrně náročná na hodnocení a používají s v klinických studiích a vědecké práci. V běžné klinické praxi nejsou proveditelná (13).
HODNOCENÍ STRUKTURÁLNÍ PROGRESE
Hlavním argumentem proč vůbec hodnotit rentgenovou progresi u SpA je, že řada kohortových studií prokázala, že strukturální progrese SpA má spolu s aktivitou vztah ke zhoršování funkce páteře (15). Hodnocení SI kloubů nemá význam pro monitorování aktivity, nicméně je důležité pro zhodnocení pacienta na začátku léčby, a to včetně údajů nutných pro splnění indikačních kritérií a úhradu léčby. Naopak hodnocení páteře a např. vývoj syndesmofytů může přinášet cenné informace o prognóze jednotlivého pacienta. Existuje evidence o tom, že přítomnost syndes-mofytů je velkým rizikovým faktorem vzniku dalších syndesmofytů. Nicméně kontinuální monitorování rentgenové progrese páteře má jen omezený význam, protože rentgenová progrese na páteři je u většiny pacientů velmi pomalá. Pokud je hodnocení rentgenové progrese prováděno, pak nejkratším doporučovaným intervalem jsou 2 roky.
Především pro účely lékových studií a vědecké práce se doporučuje používat modifikované Stoke skóre (mSASSS) (13).
Evropské kohortové studie s ax-SpA identifikovaly některé ukazatele, které jsou nezávisle na sobě asociovány s rentgenovou progresí (přítomnost syndesmofytů již na začátku sledování, mužské pohlaví, kouření, pozitivita HLA B 27 a zvýšené CRP) (16).
STRATEGIE LÉČBY
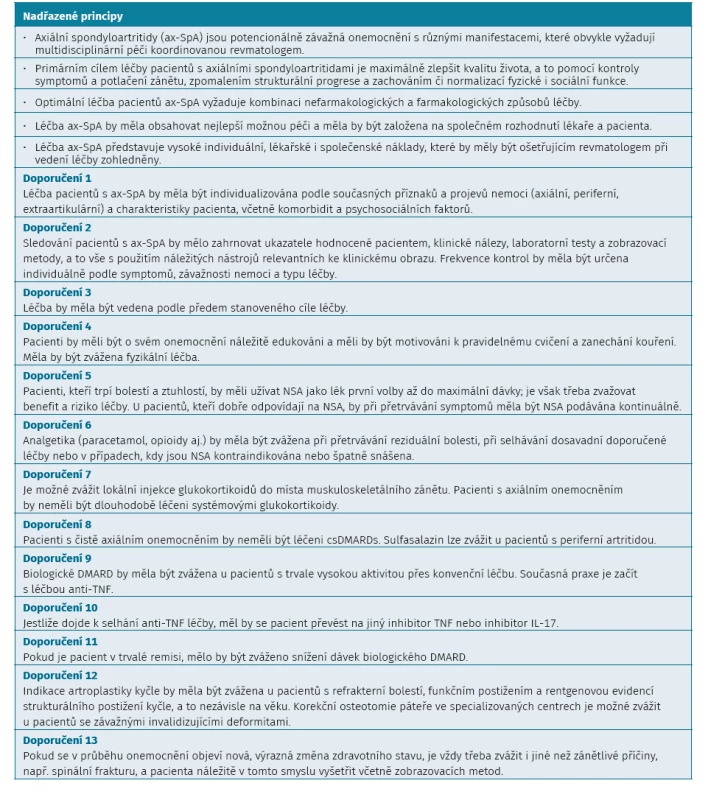
Strategie léčby pacientů s ax-SpA by měla být navržena individuálně podle přítomných symptomů onemocnění (axiální, periferní, extraartikulární). Každý z těchto příznaků může být sám o sobě důvodem pro rozhodnutí o určité léčbě.
Léčba pacientů s ax-SpA by měla být směřována k určitému cíli. Podobně jako při strategii léčby revmatoidní artritidy byl i u ax-SpA navržen koncept léčby k cíli (Treat to target – T2T), jehož nová verze byla publikována v roce 2017 (17). Jako nejvhodnější ukazatel cíle bylo navrženo skóre ASDAS (9), přičemž jeho hodnota pro remisi by měla být nižší než 1,3 a hodnota pro stav nízké aktivity pak méně než 2,1. Optimálním cílem je tedy hodnota < 1,3, která může být ale velmi obtížně dosažitelná, takže pro praxi je akceptovatelná hodnota ASDAS < 2,1 (při normálním CRP). Při biologické léčbě by měla být patrná odpověď na léčbu po 3 měsících a cíle by mělo být dosaženo po 6 měsících.
Skóre ASDAS však hodnotí pouze aktivitu onemocnění na skeletu. Pokud má pacient i extraskeletální příznaky, je nutné je při hodnocení aktivity a odpovědi rovněž zohlednit.
Tato doporučení se věnují dále léčbě farmakologické, neboť doporučení pro nefarmakologickou a chirurgickou léčbu, jež jsou neoddělitelnou součástí komplexní péče o axiální spondyloartritida, jsou obsažena ve druhé, samostatné části doporučení.
Nesteroidní antirevmatika
Nesteroidní antirevmatika (NSA) tlumí zánět a bolest a jsou základním lékem SpA. Při použití doporučovaných dávek NSA je docíleno příznivé odpovědi do 2–4 týdnů přibližně u 70 % pacientů. Selhání léčby NSA (nejméně dvou, podávaných po dobu 1 měsíce) je také jedním z indikačních kritérií po zahájení biologické léčby. Při léčbě SpA je možné použít jakékoliv NSA, výhodná jsou především NSA s dlouhým poločasem, která zajistí nemocnému klidný spánek a ovlivní ranní ztuhlost. Protizánětlivý účinek NSA útlumem cyklooxygenázy je pravděpodobně příčinou toho, že při dlouhodobé, kontinuální léčbě NSA (konkrétně celekoxibu) bylo prokázáno zpomalení růstu syndesmofytů, tedy tzv. strukturální efekt.
Strukturální efekt NSA byl hodnocen v několika studiích (18), přičemž nejkvalitnější dvě studie byly randomizované a kontrolované placebem. Výsledky byly kontroverzní. Zatímco ve studii s celekoxibem bylo prokázáno zpomalení rentgenové progrese při kontinuálním podávání, v novější studii s diklofenakem zpomalení rentgenové progrese prokázáno nebylo. Při post hoc analýze bylo zjištěno, že efekt celekoxibu byl patrný pouze u pacientů s vysokými reaktanty akutní fáze. Kohortová studie GESPIC pak prokázala, že rentgenová progrese může být zpomalena u pacientů s častějším užíváním NSA oproti pacientům s nižším užíváním.
V poslední době se diskutuje i otázka vhodného dávkování NSA u SpA. Jednou z alternativ je podávání NSA pouze při bolesti, tedy systém pouze, když potřebuji („on demand“). Druhou alternativou je každodenní podávání. Argumentem pro první alternativu je menší riziko nežádoucích účinků, argumentem pro druhou alternativu je možný strukturální efekt na zpomalení rentgenové progrese.
NSA mohou vyvolávat řadu nežádoucích účinků, z nichž nejzávažnější je vznik gastropatie indukované NSA a jejich komplikací a kardiovaskulární nežádoucí účinky. U každého pacienta by mělo být proto riziko gastrointestinálních (GIT) nežádoucích účinků vyhodnoceno a měl by být zajištěn efektivní gastroprotektivní princip (u pacientů s GIT rizikem současná aplikace inhibitoru protonové pumpy nebo aplikace antirevmatika s lepším bezpečnostním profilem (koxiby). Koxiby jsou ale kontraindikovány u nemocných se zvýšeným kardiovaskulárním rizikem.
ACR doporučuje NSA podávat kontinuálně pouze u aktivních forem SpA a „on demand“ u pacientů se stabilní neaktivní SpA (20). NSA nejsou dále vhodná u pacientů se SpA a aktivní ulcerózní kolitidou a Crohnovou nemocí, kde mohou vyvolat exacerbaci střevního zánětu. U forem s inaktivní ISZ je vhodná pouze krátkodobá aplikace koxibů (21).
Analgetika
Čistá analgetika typu paracetamolu jsou doporučována jako doplňková, symptomatická léčba, přestože není mnoho objektivních důkazů o jejich účinnosti v této indikaci. To samé lze říci i o slabých či silných opioidech, které se nyní více používají v léčbě chronické, nemaligní bolesti pohybového aparátu jako léky druhé volby u nemocných s intolerancí NSA nebo jejich nedostatečným účinkem. Další indikací pro použití analgetik může být bolest v zádech, která není způsobena vysokou aktivitou zánětu AS (např. bolest při osteoporotické kompresívní fraktuře nebo bolest neuropatická). Při použití opioidů jsou zejména vhodné retardované formy v transdermálních aplikacích.
Glukokortikoidy
Není žádný důkaz o tom, že by systémově podávané glukokortikoidy (GK) byly u SpA účinné, a proto jejich aplikaci nelze doporučit. Panel expertů ACR připouští, že ve velmi omezených situacích může být krátkodobá aplikace GK užitečná. Jako příklad je uvedeno přechodné vzplanutí periferní artritidy, vzplanutí během gravidity nebo při exacerbaci ISZ. GK mohou zhoršovat průběh osteoporózy. Naopak lze doporučit lokální aplikaci GK při mono - či oligoartritidě a aplikaci do entezitid, což by však měl provádět jen lékařem s dobrou znalostí těchto technik, a přínosem je i pod kontrolou zobrazovací techniky (např. ultrazvuku).
Konvenční syntetické chorobu modifikující antirevmatické léky
Zatímco v léčbě revmatoidní artritidy hrají konvenční syntetické chorobu modifikující léky (csDMARD) zásadní roli, u spondyloartritid tomu tak není. U axiálních forem SpA nebyla jejich účinnost prokázána vůbec, existuje určitá omezená evidence o účinnosti csDMARD u periferních SpA.
Sulfasalazin
Sulfasalazin (SAS) je nejvíce testovaným lékem u SpA. Cochranská analýza jedenácti studií se sulfasalazinem ukázala určitý efekt na sedimentaci a ztuhlost, ale ostatní ukazatele se oproti placebu nelišily (22). Byly provedeny dvě studie u axiální SpA s trváním kratším než 5 let, přičemž jedna ukazovala určitý efekt, ale ve druhé studii nebyl žádný rozdíl mezi sulfasalazinem a placebem. Naopak několik studií prokázalo účinnost sulfasalazinu na periferní artritidu (23). Na základě těchto výsledků lze tedy konstatovat, že sulfasalazin není indikován pro léčbu axiálních manifestací SpA, může však být doporučen pro léčbu periferní artritidy u nemocných se SpA. Standardní dávka SAS je 2 g denně; dávka může být zvýšena na 3 g denně. Rozhodnutí o účinnosti léčby by mělo být provedeno nejméně po 4 měsících léčby.
Methotrexát
Methotrexát (MTX) je základním a kotevním lékem léčby revmatoidní artritidy, ale jeho úloha v léčbě SpA je neprůkazná. Je zajímavé, jak málo studií s MTX bylo u SpA ve srovnání s RA provedeno. Byly provedeny tři starší randomizované studie u SpA, které používaly nízké dávky MTX mezi 7,5 a 10 mg týdně. Dvě byly zcela negativní, v jedné byl určitý vliv na některé ukazatele periferní artritidy. V novější studii s dávkami MTX 20 mg subkutánně týdně však rovněž nebyl žádný průkazný efekt oproti placebu (24).
Biologická léčba axiálních spondyloartritid
Inhibitory TNF-α
Evidence o účinnosti biologické léčby byla získávána v průběhu posledních 20 let a je podpořena několika desítkami randomizovaných klinických studií. Biologická léčba ax-SpA působí rychle a mohutně. Ovlivňuje jak klinické symptomy, tak laboratorní ukazatele aktivity. Protizánětlivý efekt biologické léčby je průkazný i objektivně na základě dokladů o potlačení intenzity zánětu na MR sakroiliakálních kloubů a páteře (25). V poslední době přibývá i důkazů tom, že biologická léčba zpomaluje strukturální progresi ax-SpA na páteři. Kohortové studie totiž prokázaly, že vysoká aktivita onemocnění koreluje s rychlostí strukturální progrese na páteři (26). Strukturální progrese pak koreluje s funkčním zhoršováním (27). Rychlé a trvalé potlačení aktivity je tedy stěžejném pilířem léčby ax-SpA. Biologické léky navíc prokázaly komplexní účinek, tedy že kromě axiálních příznaků (bolest v zádech), ovlivňují i periferní příznaky (artritida, entezitida, daktylitida) a mimokloubní projevy (oční, kožní, gastrointestinální).
Prvními a dlouho i jedinými účinnými biologickými chorobu modifikujícími anirevmatickými léky (bDMARD) u ax-SpA byly inhibitory TNF-α. Oficiální indikaci ax-SpA má všech pět inibitorů TNF-α (adalimumab, infliximab, etanercept, golimumab a certolizumab) (28–33) (tab. 2). Protože nebyly provedeny srovnávací studie mezi jednotlivými anti-TNF preparáty, je nutné považovat je za rovnocenné a není důvod preferovat jeden před druhým. Určitou výjimku jsou pacienti s přítomným idiopatickým střevním zánětem, u kterých jsou monoklonální protilátky účinné, zatímco solubilní receptor nikoliv. Kromě infliximabu mají všechny inhibitory TNF-α indikaci jak radiografickou, tak neradiografickou formu. Kromě bio-originálních anti-TNF léčiv jsou k dispozici i jejich referenční biosimilární produkty, které prokázaly ve studiích stejnou účinnost i bezpečnost.
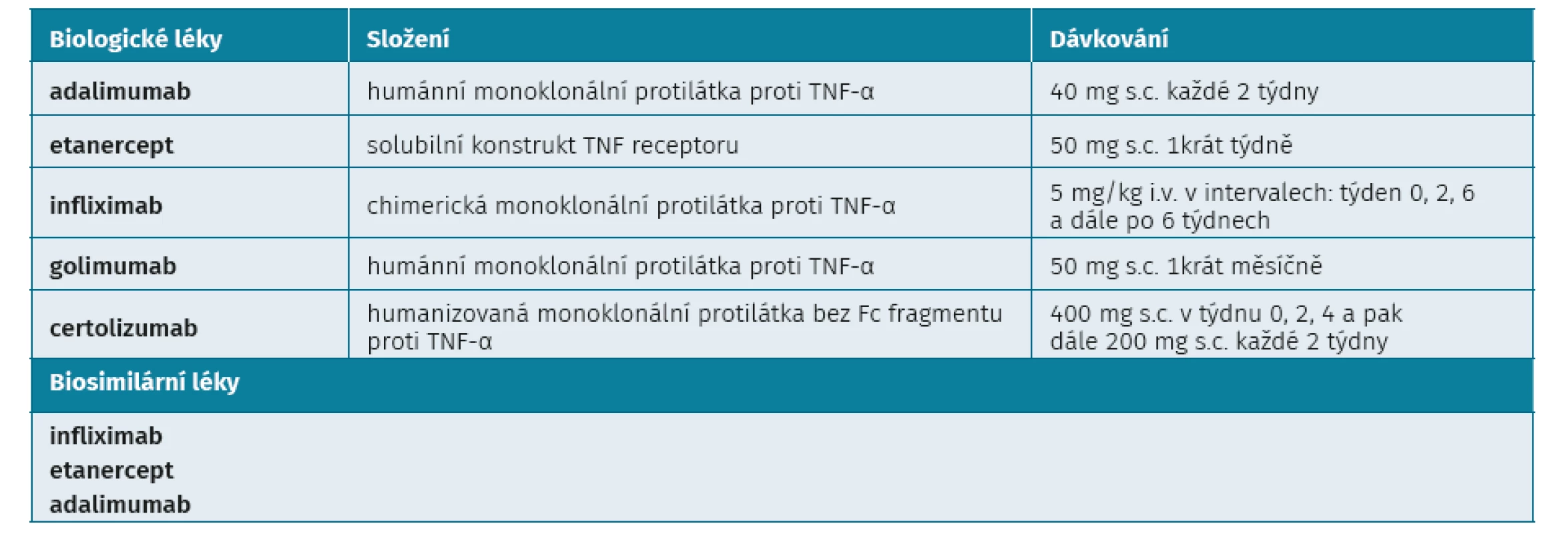
Inhibitory IL-17
Druhou skupinou bDMARD, schválených pro léčbu ax-SpA,jsou inhibitory IL-17, a to secukinumab (34, 35) a ixekizumab (36). Nebyly provedeny zatím žádné srovnávací přímé studie mezi inhibitory TNF-α a IL-17 u ax-SpA. Při volbě prvního bDMARD je proto nutné považovat obě skupiny za rovnocenné, a to se týká jak účinnosti, tak toxicity. Opět jsou ale rozdíly v ovlivnění extraartikulárních manifestací. IL-17 inhibitory nejsou účinné u idiopatických střevních zánětů a uveitidy (37), naopak jsou účinnější při ovlivnění případné psoriázy. Monoklonální protilátky proti TNF-α (ale nikoliv golimumab – chybí studie) jsou účinnější v prevenci rekurentní uveitidy. Etanercept se zdá být méně účinný na psoriatické kožní léze, i když srovnávací studie nebyly provedeny (3).
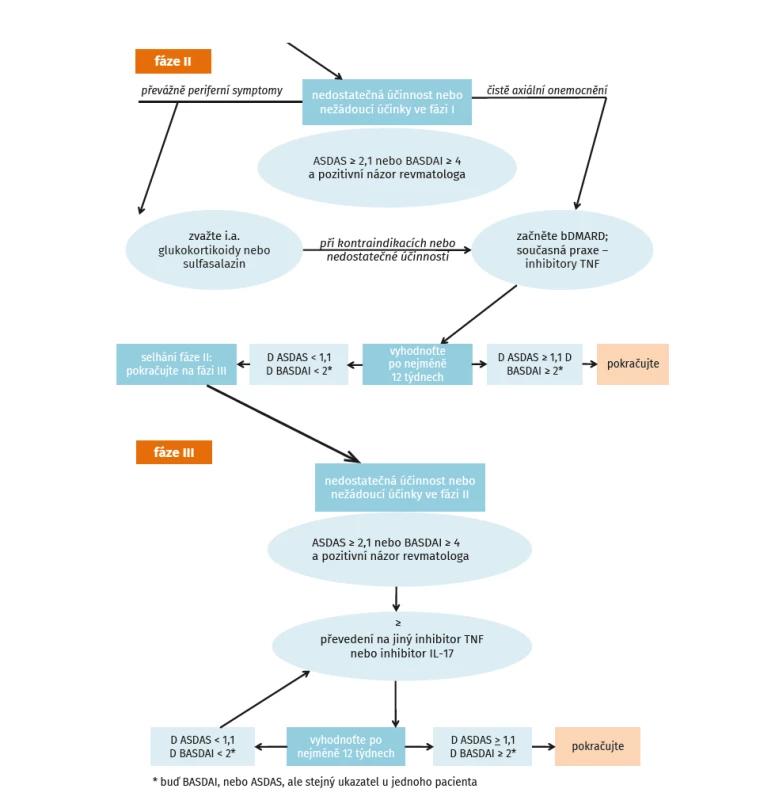
Indikace biologické léčby radiografických axiálních SpA
Inovované indikační schéma EULAR biologické léčby pro ax-SpA je uvedeno na obrázku 2 (3). Prvním předpokladem indikace léčby bDMARD je diagnóza ax-SpA revmatologem dle kritérií ASAS. Druhým krokem při indikaci biologické léčby ax-SpA je vyhodnocení kritéria selhání léčby. Kritéria jsou celkem jasná a proti minulým doporučením se nemění. U čistě axiálních forem ax-SpA se podávají NSA, a to v maximální možné dávce v intervalu 2 × 14 dní. Protože se jedná o dominantně symptomatický efekt, navrhujeme následující definici: snížení BASDAI o 50 %. Při přítomnosti periferní artritidy či entezitidy je v prvé linii indikována jedna až dvě lokální aplikace glukokortikoidů. Pro hodnocení účinku léčby je rozhodující názor specialisty. Při přítomnosti polyartritidy je indikována léčba sulfasalazinem. Léčba by měla trvat nejméně 6 měsíců, a to v dávce 3 g denně, pokud je tolerována. Pokud není dosaženo hodnoty ASDAS < 2,1 nebo BASDAI < 4, je to považováno za selhání prvního kroku léčby.

Zásadní otázkou zůstává stanovení konkrétní prahové hodnoty aktivity pro iniciaci biologické léčby. Je pravdou, že v některých zemích žádná, konkrétní prahová hodnota ve formě číselné hodnoty vybraného valorizovaného ukazatele stanovena není. Nicméně ve většině zemí je tato hodnota definována, i když ne identickým způsobem. Na kohortových studiích bylo prokázáno, že ASDAS je nejvhodnějším ukazatelem aktivity ax-SpA. A to především proto, že nejlépe koreluje se strukturální progresí ax-SpA na páteři (16). Hodnoty ASDAS lépe korelovaly se strukturální progresí než kombinace zvýšeného CRP a hodnoty BASDAI. Problém s CRP spočívá v tom, že na jedné straně je nejsilnějším prediktorem strukturální progrese ax-SpA a také nejsilnějším prediktorem příznivé terapeutické odpovědi na léčbu bDMARD, na druhé straně není málo ani pacientů s aktivním onemocněním a normálními hladinami CRP, a to platí pro radiografické i neradiografické formy ax-SpA.
ČRS tedy ve shodě s ASAS doporučuje jako kritéria pro zahájení biologické léčby následující alternativy: vysoká aktivita nemoci ASDAS ≥ 2,1 nebo BASDAI > 4 a 2krát zvýšené CRP nad normu a pozitivní názor revmatologa. Hodnota ASDAS ≥ 2,1 se zdá být nejvhodnějším kritériempro zahájení biologické léčby (34). Kritérium pozitivní názor revmatologa umožňuje specialistovi vyhodnotit i další potenciálně závažné aspekty nemoci, které neodrážejí ASDAS či BASDAI. Příkladem může být např. závažné extraartikulární postižení nebo závažná destrukce kloubu.
Další otázkou zůstává výběr vhodného léku. Podle mechanismu účinku lze bDMARD aktuálně registrované pro léčbu ax-SpA dělit na léky blokující TNF-α a léky blokující IL-17.
V doporučeních EULAR z roku 2016 je při výběru bDMARD uvedeno, že současná praxe je zahájit léčbu inhibitorem TNF. Vzhledem k novým datům z klinických studií s inhibitory IL-17 z let 2016–2020 je nutné považovat inhibitory TNF a inhibitory IL-17 za rovnocenné. Inhibitory IL-17 nejsou vhodné u pacientů s idiopatickými střevními záněty, mohou ale být vhodnější volbou u pacientů se současnou psoriázou.
Indikace biologické léčby neradiografické axiální SpA (nr-ax-SpA)
Indikace nr-ax-SpA byla v některých státech včetně USA zpočátku odmítnuta s argumenty, že klinické projevy nr-ax-SpA jsou nejasné, rovněž tak progrese a prognóza a že nr-ax-SpA může být nemoc s časově omezeným průběhem a s potenciálem spontánní remise. Nicméně další výzkum tyto předpoklady vyvrátil a dnes je aplikace bDMARD u aktivní nr-ax-SpA všeobecně akceptována (38).
Nově byla publikována studie se secukinumabem u nr-ax-SpA. Studie byla zajímavá tím, že měla dva časově odlišné primární cíle, a to v týdnu 16 a 52, což odráží debaty o možné spontánní remisi této formy ax-SpA. Primárního kritéria ASAS 40 bylo dosaženo po secukinumabu ve 40 %, zatímco po placebu ve 28 %. Parciální remise bylo dosaženo ve 21 % po 52 týdnech léčby, zatímco po placebu pouze v 7 %. Studie tedy potvrzuje účinnost secukinumabu v indikaci nr-ax-SpA. Zároveň také ukazuje, že spontánní remise jsou velmi řídké, a tudíž biologická léčba je i v této indikaci plně oprávněná (39).
Indikační kritéria pro nr-ax-SpA se v řadě států neliší od indikačních kritérií pro radiografické ax-SpA (AS). Vychází to ze studií, které ukazují stejnou klinickou závažnost obou forem, a dále pak z faktu, že klinické studie prokázaly stejnou účinnost u obou forem. Nicméně na druhé straně v řadě zemí jsou prahová kritéria pro nr-ax-SpA odlišná, a to na základě určitých přetrvávajících pochybností nad přesností diagnózy, např. při obtížích při interpretaci MR nálezu na sakroiliakálních kloubech. Dále je nutné také vycházet z oficiální registrované licence léku. V řadě stávajících evropských doporučení byla aktivita definována jako zvýšení CRP (buď nad normu nebo nad dvojnásobek normy) nebo pozitivní nález na MR. V České republice byla dosavadní prahová kritéria definována jako současná přítomnost pozitivního nálezu na MR SI kloubů a dvojnásobně zvýšené CRP. Expertní Výbor ČRS se po diskuzi kloní k modifikaci indikaci pro nr-ax-SpA v České republice a akceptovat doporučení EULAR, tzn. přítomnost MR sakroiliitidy nebo dvojnásobně zvýšené CRP. Samozřejmě, že by měl pacient splňovat i další kritéria pro SpA – tedy selhání konvenční léčby, ASDAS ≥ 2,1 nebo BASDAI vyšší než 4,0 a pozitivní názor revmatologa (tab. 3).

Selhání biologické léčby
Pokud není dosaženo cíle léčby, hovoříme o selhání léčby. Selhání léčby může být buď primární (vůbec nebylo dosaženo cíle léčby), nebo sekundární (po počátečním dosažení cíle je efekt léčby ztracen). Příčinou selhání léčby může být nedostatečná účinnost nebo nežádoucí účinky nebo kombinace obou.
První časový interval, kdy je vhodné uvažovat o pokračování v léčbě, je 12 týdnů a navržený algoritmus léčby dle ASAS-EULAR (3) je uveden na obrázku 3. Při indikaci druhého biologického léku je vhodné příčiny selhání definovat. Nejvíce evidence o účinnosti je při aplikaci druhého anti-TNF léku po selhání prvního inhibitoru TNF-α. Druhý anti-TNF lék je v léčbě ax-SpA účinný, ale jeho účinnost může být nižší než u prvního (37). Stejně tak i u secukinumabu byla prokázána nižší účinnost, pokud byl podáván u pacientů selhávajících na léčbě inhibitorem anti-TNF než u nemocných dosud biologicky neléčených (40). Nová studie MEASURE 3 pak prokázala, že pokud je secukinumab podáván u selhávajících na anti-TNF léčbě, může být výhodnější podání dávky 300 mg s.c. měsíčně (41). Zatím nebyly provedeny randomizované studie, které by vyhodnotily, zda je vhodnější po selhávání prvního inhibitoru TNF-α podávat druhý anti-TNF lék nebo biologický lék s jiným mechanismem účinku. Zdá se ale, že v případě primárního selhání je racionálnějším postupem podání bDMARD s jiným mechanismem účinku. Zvláště při toxicitě anti-TNF léčby je vhodné přímé převedení na léčbu inhibitory IL-17. Nicméně nová studie ze Švýcarského registru neukázala žádný rozdíl při změně na druhý anti-TNF lék nebo inhibitor IL-17 (42). Rovněž tak není mnoho evidence o účinnosti anti-TNF léků po selhání inhibitoru IL-17. Před rozhodnutím o změně biologické léčby je ale doporučováno pečlivě vyhodnotit, zda byla prvotní indikace biologické léčby korektní.
Detrakce léčby
Ax-SpA je chronické a zatím nevyléčitelné onemocnění. Léčba musí být dlouhodobá, ale otázkou zůstává, zda celoživotní, nebo zda je možné léčbu ukončit, přerušit či snížit její intenzitu. Důvody pro tyto úvahy jsou dvojí, a to medicínské a ekonomické. Dlouhodobá imunosuprese mírně zvyšuje výskyt nežádoucích účinků, a to i závažných, a je otázkou, zda je nutné u všech pacientů, včetně těch v remisi tento stupeň imunosuprese udržovat. Ekonomický důvod je jasný, biologická léčba je přes určité zlevnění stále ekonomicky náročná. Kompletní vysazení biologické léčby se neosvědčilo, protože vede ve vysokém procentu případů ke vzplanutí aktivity onemocnění (43). Výhodnější strategií se zdá pomalá detrakce léčby. V otevřené, kohortové studii z registru ATTRA bylo prokázáno, že individuálně detrahovaná léčba u pacientů s AS je efektivní a snižuje náklady (44). V randomizované, dvojitě slepé studii u pacientů s časnou aktivní ax-SpA byli pacienti léčeni certolizumabem a ti, kteří dosáhli remise ve 48. týdnu, byli randomizováni do tří skupin. První pokračovala v léčbě v obvyklých dávkách, druhá měla prodloužené intervaly a u třetí skupiny byla léčba ukončena (45). Při aplikaci anti-TNF léčby v prodloužených intervalech nedocházelo častěji ke vzplanutí aktivity, zatímco při ukončení léčby ano.
Tato detrakce by ale měla jen zřídka a u vybraných pacientů směřovat až k nule. Není zcela jasně definováno, jaký pacient je k úvaze o detrakci vhodný. V určité analogii k revmatoidní artritidě by i u ax-SpA mělo jít o pacienta, který je v trvalé remisi. První problém je jak definovat termín trvalá remise. Určitý konsenzus mluví o trvání remise nejméně 6 měsíců, tzn. dvě kontroly v tříměsíčních intervalech po sobě. Jde o požadavek minimální, je možné akceptovat i trvání remise delší. Druhým problémem je definice remise, ale zdá se, že hodnota ASDAS méně než 1,3 je nejčastěji zmiňovanou hodnotou. Zatím je nejasné, zda např. reziduální zánětlivá aktivita na MR může být prediktorem vzplanutí při detrakci léčby. Není také jasné, zda je vhodnější snižovat dávky nebo prodlužovat intervaly, přičemž preklinická data příliš nepomáhají.
Přes určitý nedostatek informací lze ale detrakci biologické léčby u pacientů v dlouhodobé remisi doporučit.
Terapie pacientů se spondyloartritidou a akutní přední uveitidou
Akutní přední uveitida (AU) je silně asociována s antigenem HLA B27. Výskyt AU u HLA B27 pozitivní populace je kumulativně celoživotně 1 %, zatímco v běžné populaci dosahuje jen 0,2 %. Až 47 % pacientů s AU má pozitivní antigen HLA B27. Průměrná prevalence akutní přední uveitidy je u SpA dle přehledu literatury 33 %. AU může být někdy i úvodním příznakem SpA.
Akutní přední uveitida je tradičně léčena oftalmology lokálně podávanými glukokortikoidy a cykloplegiky. Při výrazném zánětu mohou být glukokortikoidy používány i systémově. Při nutnosti podávat glukokortikoidy dlouhodobě podávají oftalmologové i další imunosupresiva, např. azathioprin nebo methotrexát ve snaze snížit nutnou dávku glukokortikoidů, avšak tato imunosupresiva nemají žádný vliv na ax-SpA. Existuje sice určitá evidence o účinnosti sulfasalazinu na snížení frekvence AU, ale celkově je vliv csDMARD na extraskeletální příznaky AS velmi malý.
Lékem volby u refrakterní AU s komplikacemi jsou infliximab a adalimumab. Lékem volby pak může být adalimumab, který byl schválen pro léčbu neinfekční intermediální a zadní uveitidy a panuveitidy a při nedostatečném efektu glukokortikoidů (3).
Výskyt atak AU během léčby anti-TNF pacientů se SpA byl sledován v četných studiích. V retrospektivní studii ve Francii byla prokázána výrazná redukce atak AU během léčby v porovnání se stavem před léčbou adalimumabem a infliximabem, nikoliv však etanerceptem. V prospektivní studii z databáze v USA bylo zjištěno poloviční riziko exacerbace AU při léčbě monoklonálními protilátkami oproti etanerceptu (46). Snížené riziko vzplanutí rizika AU u pacientů se SpA, kteří neměli žádnou exacerbaci AU 2 roky před léčbou, bylo také zjištěno v dánském registru, které také potvrdilo téměř poloviční riziko u infliximabu a adalimumabu než u etanerceptu (47). V nepřímém srovnání různých anti-TNF preparátů zjistili autoři redukci frekvence uveitid u všech těchto léků, ale např. u adalimumabu činila redukce 80 % a u etanerceptu jen 39 %. Redukce frekvence vzplanutí byla také zaznamenána při léčbě certolizumabem a golimumabem, ale evidence je mnohem menší než u infliximabu a adalimumabu.
Terapie pacientů s axiální spondyloartritidou
a idiopatickým střevním zánětem
Výskyt idiopatických střevních zánětů (ISZ) u spondyloartritid se udává v 5–10 %, nicméně až 50 % pacientů s ax-SpA má subklinický zánět střevní sliznice. Z druhého úhlu pohledu se u pacientů s idiopatickými střevními záněty vyskytují kloubní příznaky v širokém rozmezí 17–39 %. Artritida asociovaná s ISZ bývá označována jako samostatná klinická jednotka s názvem enteropatická spondyloartritida (eSpA). Muskuloskeletální manifestace eSpA lze rozdělit na dva odlišné subsety: první skupinu tvoří pacienti s axiálním postižením (včetně sakroiliitidy nebo bez sakroiliitidy) a druhou skupinu pak tvoří pacienti s výhradně periferním postižením. Periferní postižení se dále dělí na podskupinu s oligoartritidou (artritida méně než čtyř kloubů) a podskupinu s polyartritidou (postiženo pět a více kloubů).
Enteropatické SpA představují multiorgánové systémové onemocnění, a proto by pacienti s touto diagnózou měli být v týmové péči revmatologa a gastroenterologa. Algoritmus péče o pacienty se SpA je uveden na obrázku 4 (48).
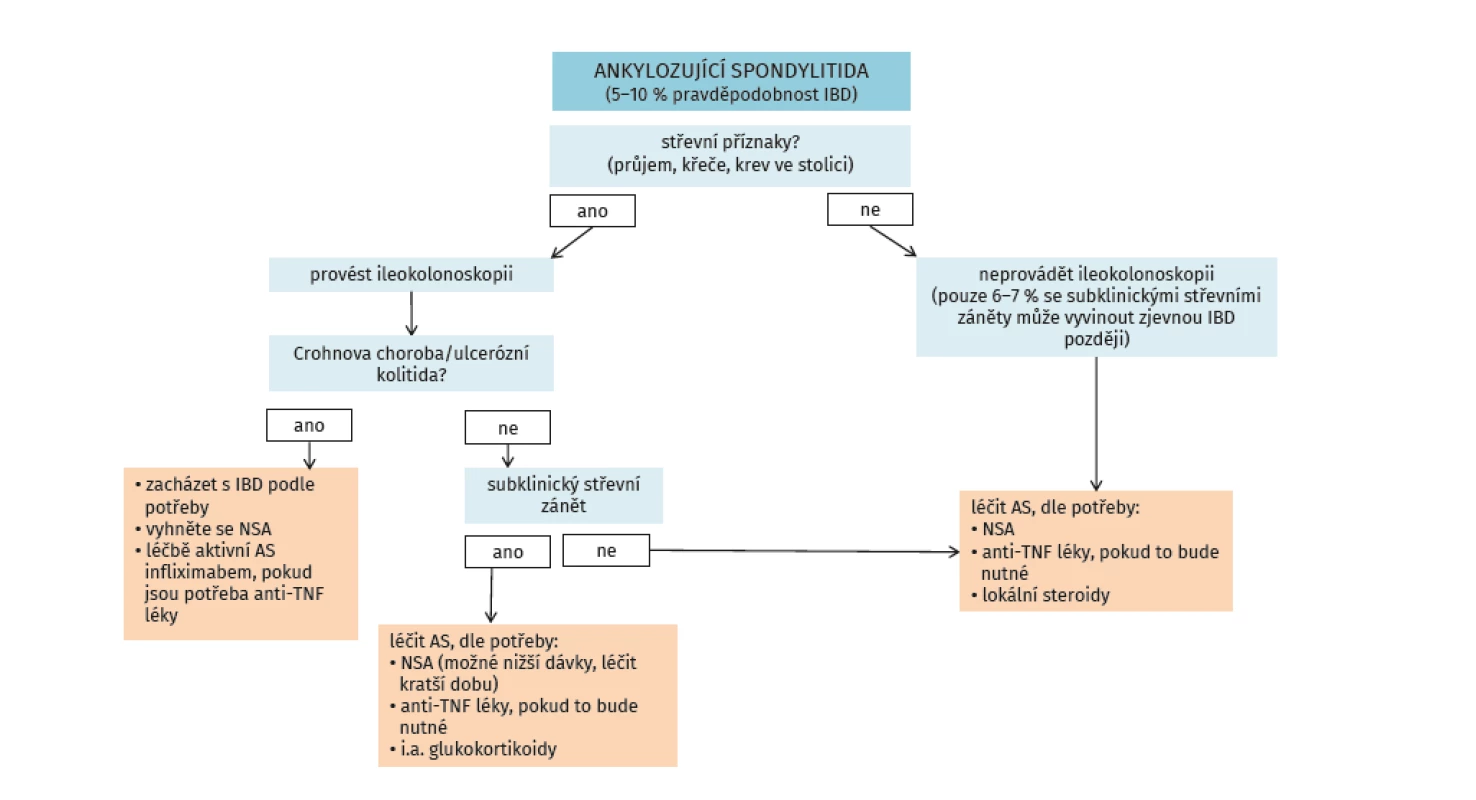
Nesteroidní antirevmatika by neměla být při ax-SpA a současné aktivní formě Crohnovy nemoci nebo ulcerózní kolitidy používána vůbec, a to neselektivní ani selektivní. Při aktivní formě SpA (axiální či periferní) a ISZ v remisi je možné aplikovat NSA krátkodobě (2 týdny), neselektivní NSA se nedoporučují. Klinické studie prokázaly, že při aplikaci celekoxibu a etorikoxibu nebyl vyšší počet exacerbací než po placebu (49).
Glukokortikoidy nejsou v léčbě SpA obecně doporučovány s výjimkami uvedenými výše. Jednou z nich může být aktivní periferní SpA s aktivním ISZ. V této situaci je vhodné konzultovat pacienta s gastroenterologem. V situacích neaktivní SpA, ale aktivní ISZ rozhoduje o indikaci léčby glukokortikoidy gastroenterolog.
Sulfasalazin je z hlediska revmatologického indikován u SpA s periferní polyartritidou. Sulfasalazin může být i vhodným lékem u nemocného s ax-SpA a mírnou formou Crohnovy nemoci, kde může být výhodnější než mesalazin, protože sulfasalazin ovlivňuje jak střevní zánět, tak periferní artritidu. Sulfasalazin se podává v dávkách 3–4 g denně.
Inhibitory TNF-α jsou optimálními léky pro pacienty s eSpA. Hlavním důvodem je fakt, že ovlivňují příznivě jak kloubní, tak střevní syndrom (50, 51). Aplikace systémové léčby včetně eSpA se řídí dle doporučení odborných společností. Koordinace léčby mezi gastroenterologem a revmatologem je nutná. Aktivita ISZ a především závažné projevy a komplikace ISZ mají přednost před léčbou ax-SpA, protože hrozí vitálními následky. K léčbě eSpA jsou vhodné infliximab a adalimumab, v případě ulcerózní kolitidy i golimumab. Při dlouhodobé kloubní a střevní remisi je možné uvažovat o snížení dávek léku či prodloužení intervalu nebo jeho vysazení. Kompletní vysazení anti-TNF léku se doporučuje pouze při remisi ax-SpA (ASDAS méně než 1,3) a komplexní remisi ISZ (klinické, endoskopické a biochemické).
Etanercept a inhibitory IL-17 nejsou účinné u ISZ, naopak je spíše diskutováno riziko exacerbace či vzniku nového ISZ, a proto nejsou pro léčbu eSpA vhodné. Další biologické léky používané k léčbě ISZ, např. vedolizumab nebo ustekinumab, nemají indikaci SpA, nejsou proto z revmatologického hlediska rovněž optimální alternativou léčby eSpA.
Osteoporóza u nemocných se SpA
Osteoporóza (OP) je jednou z nejčastějších komorbidit u SpA. Ve výše zmíněné studii COMOSPA byl výskyt osteoporózy 13 %, ale v literatuře se údaje pohybují od 18 % do 62 %. Údaje velmi kolísají podle použité metodologie, zda byla prováděna DEXA a rentgeny páteře. Pokles BMD je časný a postihuje především trabekulární kost, ale kortikální kost je postižena rovněž. Pokles BMD je častější u mužů.
Prevalence vertebrálních fraktur ve studiích velmi kolísá od 4 % do 41 %. Uvádí se také, že pouze ¼ vertebrálních fraktur je diagnostikována. Prvním důvodem je, že pacientova bolest v zádech je přičítána aktivitě AS, a i když je rentgen proveden, mohou vznikat další problémy: přehlédnutí fraktury, obtížná diagnostika fraktur kvůli lokalizaci, dostupnost pouze snímků LS a nikoliv TH páteře, definice vertebrální fraktury, odlišení od spondylodiscitidy (Romanusovo znamení). DEXA je někdy nepoužitelná a kvantitativní CT nedostupné.
Geussens (52) uvádí relativní riziko vertebrálních fraktur jako poměr šancí (odds ratio – OR) 7,7 (95% CI 4,3–12,6). Kumulativní riziko pro muže je 10,67 a 4,2 pro ženy. Ve studii Praye (53) bylo riziko vertebrální fraktury zvýšené (OR = 1,96). Rizikovými faktory byly nízká kostní denzita, mužské pohlaví, nižší BASFI, idiopatický střevní zánět. Je zajímavé, že prevalence non-vertebrálních fraktur zvýšena není.
Jeden z rizikových faktorů fraktury jsou i pády. U pacientů s AS nebylo systematicky nikdy hodnoceno. Jisté ale je, že riziko fraktury při pádu u AS je větší vzhledem k větší křehkosti páteře při ankylóze.
Prevence a terapie osteoporózy a AS je ve zkratce uvedena v tabulce 4. Léčba by měla být komplexní, tzn. nefarmakologická a farmakologická. Pravidelné cvičení má význam jak pro udržování hybnosti páteře, tak pro prevenci OP.
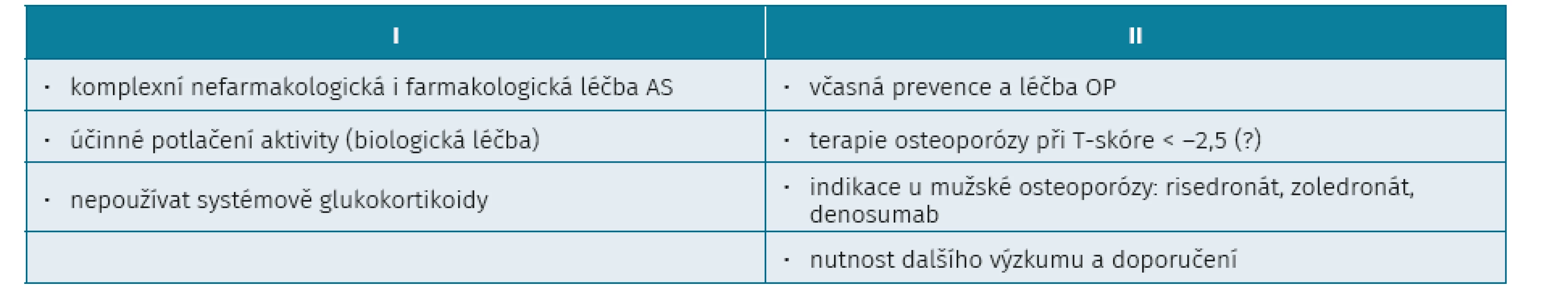
Dalším preventivním opatřením je neužívání systémových glukokortikoidů. Řada studií prokázala asociaci poklesu BMD a aktivity SpA. Proto je účinné potlačení aktivity SpA anti-TNF léčbou možným důležitým faktorem prevence osteoporózy.
V klinické praxi je ale velmi málo důkazů o tom, že by anti-TNF léčba snižovala výskyt fraktur. Např. ve studii ASSERT docházelo po aplikaci infliximabu ke zvýšení BMD na páteři o 2,5 % a placebu 0,5 % (p < 0,001). Ke zvýšení BMD docházelo i v menší britské studii, ale překvapivě progredovaly více syndesmofyty, což mohlo ovlivňovat hodnocení. Ve studii Maase během 4 let anti-TNF léčby vznikly nové vertebrální fraktury u 20 % pacientů.
Další otázkou zůstává vlastní léčba osteoporózy. Zda by intervenční práh pro léčbu antiporotiky neměl být výše než –2,5 SD. Indikaci mužské osteoporózy mají risedronát, zoledronát, denosumab. Aplikace vápníku je samozřejmá.
ZÁVĚR
Závěrem lze zdůraznit některé důležité aspekty léčby, které publikoval EULAR/ASAS a které jsou rovněž ukotveny v Doporučení ČRS. Léčba k cíli, indikační podmínky pro bDMARD léčbu, použití IL-17 inhibitorů, léčení ax-SpA jako kontinuum nemoci a dále zvažování nákladů léčby lékaři. Protože doporučení ČRS principiálně vycházejí z doporučení ASAS/EULAR, uvádíme v tabulce 5 jejich přímý překlad.
prof. MUDr. Karel Pavelka, DrSc.
Revmatologický ústav Praha
Na Slupi 4
128 50 Praha 2
e-mail: pavelka@revma.cz
Autoři prohlašují, že nejsou v konfliktu zájmů.
Do redakce doručeno: 17. 12. 2020
Poděkování:
Práce byla podpořena projektem MZ ČR Koncepčního rozvoje výzkumné organizace 00023728 Revmatologický ústav a grantem AZV MZ ČR 17 - 33127A.
Sources
1. Rudwaleit M, van der Heide D, Landewe R. Development of ASAS classification criteria for axial spondyloarthritis (part II): validation and final section. Ann Rheum Dis 2009; 68 : 777–783.
2. Sieper J, van der Heijde D. Review non-radiographic axial spondyloarthritis new definition of old disease? Arthritis Rheum 2013; 65 : 543–551.
3. van der Heide D, Ramiro S, Landewe R, et al. 2016 update of the ASAS-EULAR management recommendations for axial spondyloarthritis. Ann Rheum Dis 2017; 76 : 978–991.
4. van der Heide D, Joshi A, Pangan AL. ASAS 40 and ASDAS clinical trial translate to meaningful improvements in physical function health related quality of life and work productivity in patients with non-radiographic axial spondyloarthritis. Rheumatology (Oxford) 2016; 55 : 80–88.
5. Landewé R, Strand V, van der Heijde D. From inhibition of radiographic progression to maintaining structural integrity: a methodological framework for radiographic progression in rheumatoid arthritis and psoriatic arthritis clinical trial. Ann Rheum Dis 2013; 72(7): 1113–1117.
6. Deodhar A, van der Heijde D, Gensler LS, Kim TH, Maksymowych WP, Østergaard M, Poddubnyy D, et al. Ixekizumab for patients with non–radiographic axial spondyloarthritis (COAST–X): a randomised, placebo–controlled trial. COAST–X Study Group. Lancet 2020; 395(10217): 53–64.
7. Sieper J, Rudwaleit M, Baraliakos X, et al. The Assessment of Spondyloarthritis International Society (ASAS) handbook a guide to asses spondyloarthritis. Ann Rheum Dis 2009; 68(Suppl 2): ii–44.
8. Garret S, Jenkinson T, Kennedy LG, et al. A new approach to define disease activity in ankylosing spondylitis: the Bath Ankylosing Spondylitis Diasease Activity Index. J Rheumatol 1994; 21 : 286–291.
9. Machado PM, Lamdewe R, van der Heide D. Assessment of ASAS. Ankylosing Spondylitis Disease Activity Score (ASDAS). 2018 update of the nomenclature fir disease activity states. Ann Rheum Dis 2018; 77 : 1539–1540.
10. Jenkinson TR, Mallorie PA, Whitelock HC, et al. Defining spinal mobility in ankylosing spondylitis (AS). The Bath AS Metrology Index. J Rheumatol 1994; 21 : 1694–811.
11. Calin A, Garret S, Whitelock H, et al. A new approach to defining functional ability in AS the development of the Bath Ankylosing Spondylitis Functional Index. J Rheumatol 1994; 21 : 1281–1285.
12. Mease PJ, van der Bosch F, Sieper J, et al. Performance of 3 enthesitis indices in patients with peripheral spondyloarthritis during treatment with adalimumab. J Rheumatol 2017; 44 : 599–608.13. Landewe R, Tubergen A. Clinical tools to asses and monitor spondyloarthritis. Curr Rheumatol Rep 2015; 17 : 47.
14. Navarro-Compan V, Ramiro S, Landewe R, et al. Disease activity is longitudinally related to sacroiliac inflammation on MR in male patients with axial spondyloarthritis. 2 years of the DESIR cohort. Ann Rheum Dis 2016; 75 : 854–858.
15. Poddubnyy D, Listing J, Haibel H, et al. Functional relevance of radiographic spinal progression in axial spondyloarthritis: results from German Spondyloarthritis Inception Cohort. Rheumatology 2018; 57 : 703–711.
16. Ramiro S, Stoljwijk C, van Tubergen A, et al. Evolution of radiographic damage in ankylosing spondylitis: A 12 year prospective follow-up of the OASIS study. Ann Rheum Dis 2015; 74 : 52–59.
17. Smolen J, Schols M, Barun J, et al. Treating axial spondyloarthritis and peripheral spondyloarthritis especially psoriatic arthritis to target.2017 update of recommendations by international task force. Ann Rheum Dis 2018; 77 : 3–17.
18. Kroon F, Landewe R, Dougados M et al. Continuous NSAID use reverts the effects of inflammation on radiographic progression in patients with ankylosing spondylitis. Ann Rheum Dis 2012; 71 : 1623–1629.
19. Sieper J, Listing J, Poddubnyy D, et al. Effect of continuous versus on demand treatment of ankylosing spondylitis with diclofenac over 2 years on radiographic progression of the spine” results from a randomised multicentre trial (ENRADAS). Ann Rheum Dis 2016; 75 : 1438–1443.
20. Ward MM, Deodhar A, Gensler LS, et al. 2019 Update of the American College of Rheumatology / Spondylitis Association of America/ Spondylarthritis Research and Treatment Network Recommendations for the treatment of ankylosing Spondylitis and Nonradiographic Axial Spondyloarthritis Arthritis Rheumatol 2019; 71 : 1599–1613.
21. Dougados M. Treat to target in axial spondyloarthritis: from its concept to its implementation. Journal of Autoimmunity https://doi.org/1016/j.aut.2019.102398
22. Chen J, Liu C. Sulfasalazine for ankylosing spondylitis. Cochrane Database Syst Rev 2005; (2) CD0004800.
23. Dougados M, van der Linden S, Leirisalo-Repo M. Sulfasalazin in the treatment of spondyloarthropathy. A randomized, multicentre study. Arthritis Rheum 1995; 38 : 618–627.
24. Haibel H, Brandt HC, Song IH, et al. No efficacy of subcutaneous methotrexate in active ankylosing spondylitis: a 16 week, open label trial. Ann Rheum Dis 2007; 66 : 419–421.
25. Machado P, Landewe RBM, Braun J, et al. MR inflammation and its relation with measures of clinical activity and different treatment responses in patients with ankylosing spondylitis treated with a tumour necrosis factor inhibitor. Ann Rheum Dis 2012; 71 : 2002–2005.
26. Navarro-Compan V, Ramiro S, Landewe R, et al. Disease activity is longitudinally related to sacroiliac inflammation on MRI in male patients with axial spondyloarthritis: 2 years of the DESIR cohort. Ann Rheum Dis 2016; 5 : 874–878.
27. Protopopov M, Sieper J, Haibel J, et al. Relevance of structural damage in the sacroiliac joints with axial spondyloarthritis: results from the German Spondyloarthritis Inception Cohort Arthritis Res Ther 2017; 19(1): 240.
28. van der Heijde D, Dijkmans B, Geusens P, et al. Efficacy and safety of infliximab in patients with ankylosing spondylitis: results of a randomized, placebo-controlled trial (ASSERT). Arthritis Rheum 2005; 52 : 582–591.
29. Sieper J, van der Heide D, Dougados M. Efficacy and safety of adalimumab in patients with non-radiographic axial spondyloarthritis results of a randomised, placebo controlled trial (ABILITY-1). Ann Rheum Dis 2013; 72 : 815–822.
30. Braun J, van der Horst-Bruinsma IE, Huang F, et al. Clinical efficacy and safety of etanercept versus sulfasalazine in ankylosing spondylitis patients: a randomized double blind trial. Arthritis Rheum 2011; 63(6): 1543–1551.
31. Landewé R, Braun J, Deodhar A, et al. Efficacy of certolizumab pegol on signs and symptoms of axial spondyloarthritis including ankylosing spondylitis: 24-week results of a double-blind randomised placebo-controlled Phase 3 study. Ann Rheum Dis 2014; 73(1): 39–47.
32. Inman RD, Davis JC Jr, Heijde DV, et al. Efficacy and safety of golimumab in patients with ankylosing spondylitis: results of a randomized, double-blind, placebo-controlled, phase III trial. Arthritis Rheum 2008; 58 : 3402–3412.
33. Marona J, Sepriano A, Rodrigues-Manica S, et al. Eligibility for biologic disease-modifying antirheumatic drugs in axial spondyloarthritis: going beyond BASDAI. RMD Open 2020; 6: e001145.
34. Braun J, Baraliakos X, Deodhar A, Baeten D, Sieper J, Emery P, et al. Effect of secukinumab on clinical and radiographic outcomes in ankylosing spondylitis: 2-year results from the randomised phase III MEASURE 1 study. Ann Rheum Dis 2017; 76(6): 1070–1077.
35. Sieper J, Deodhar A, Marzo-Ortega H, Aelion JA, Blanco R, Jui-Cheng T, et al. Secukinumab efficacy in anti-TNF-naive and anti-TNF-experienced subjects with active ankylosing spondylitis: results from the MEASURE 2 Study. Ann Rheum Dis 2017; 76(3): 571–592.
36. Deodhar A, Poddubnyy D, Pacheco-Tena C, et al. Efficacy and safety of ixekizumab in the treatment of radiographic axial spondyloarthritis: sixteen-week results from a phase III randomized, double-blind, placebo-controlled trial in patients with prior inadequate response to or intolerance of tumor necrosis factor inhibitors. Arthritis Rheum 2019; 71 : 599–611.
37. Lie E, van der Heide D, Uhlig T, et al. Effectiveness of switching between TNF inhibitors in ankylosing spondylitis: data from nor DMARD register. Ann Rheum Dis 2011; 70 : 157–163.
38. Deodhar A, Gensler LS, Kay J, et al. A fifty – two week, randomized, placebo-controlled trial of certolizumab pegol in non--radiographic axial spondyloarthritis. Arthritis Rheumatology 2019; 71(7): 1101–1111.
39. Deodhar A, Blanco R, Dokoupilová E, et al. Improvement of signs and symptoms of nonradiographic axial spondyloarthritis in patients Ttreated with secukinumab: primary results of a randomized, placebo-controlled phase III study. Arthritis Rheumatol 2020;73(1): 110–120.
40. Baeten D, Sieper J, Braun J, et al. Secukinumab, an interleukin-17 inhibitor in ankylosing spondylitis. N Engl J Med 2015; 373 : 2534–2548.
41. Pavelka K, Kivitz AJ, Dokoupilová E, et al. Secukinumab 150/300 mg provides sustained improvements in the signs and symptoms of active ankylosing spondylitis: 3-year results from the phase 3 MEASURE 3 Study. ACR Open Rheumatol 2020; 2(2): 119–117.
42. Micheroli R, Tellenbach CH, Scherer A, et al. Effectiveness of secukinumab versus an alternative TNF inhibitor in patients with axial spondyloarthritis previously exposed to TNF inhibitor in the Swiss Clinical Quality Management cohort. Ann Rheum Dis 2020; 79 : 1203–1209.
43. Landewe R, Sieper J, Mease P, et al. Efficacy And safety of continuing versus withdrawing adalimumab therapy in maintaining remission in patients with non. – radiographic axial spondyloarthritis (ABILITY-3) a multicentre, randomised, double blind study. Lancet 2018; 392 (10142): 134–144.
44. Závada J, Uher M, Sisol K, et al. A tailored approach to reduce dose of anti-TNF drugs may be equally effective, but substantially less costly than standard dosing in patients with ankylosing spondylitis over 1 year: a propensity score – matched cohort study. Ann Rheum Dis 2016; 75 : 96–102.
45. Landewe R, van der Heide D, Dougados M, et al. Maintained of clinical remission in early axial spondyloarthritis following certolizumab pegol dose reduction. Ann Rheum Dis 2020; 79 : 920–928.
46. Wendling D, Joshi A, Reilly P, Jalundhwala YJ, Mittal M, Bao Y. Comparing the risk of developing uveitis in patients initiating anti-tumor necrosis factor therapy for ankylosing spondylitis: an analysis of a large US claims database. Curr Med Res Opin 2014; 30(12): 2515–2521.
47. Lie E, Lindstrom U, Zverkova-Sandstrom T, et al. Tumour necrosis factor inhibitor treatment and occurrence of anterior uveitis in ankylosing spondylitis: results from the Swedish biologics register. Ann Rheum Dis 2017; 76(9): 1515–1521.
48. Chimanti MS, Conigliari P, Trigianese P, et al. Use of synthetic and biological DMARD in patients with enteropathy spondyloarthritis: a combined gastro-rheumatological approach. Clin Exp Rheum 2019; 37 : 723–730.
49. Sandborn W, Stenson W, Brynskow J, et al. Safety of celekoxib in patients with ulcerative colitis in remission: a randomised, placebo controlled pilot. Clin Gastroenterol Hepatol 2006; 4 : 829–838.
50. Olivieri I, Cantini F, Castiglione F, et al. Italian Expert Panel on the management of patients with coexisting spondyloarthritis and inflammatory bowel disease. Autoimmunity Rev 2014; 13 : 822–830.
51. Sepriano A, Regel A, van der Heide D, et al. Efficacy and safety of biological and targeted synthetic literature review informing the 2016 update of the ASAS/EULAR recommendations for the management of axial spondyloarthritis. RMD Open 3; e000396.
52. Thomas T, Casado E, Geusens P, Lems WF, Timoshanko J, Taylor D, Hofbauer LC. Is a treat-to-target strategy in osteoporosis applicable in clinical practice? Consensus among a panel of European experts. Osteoporos Int 2020; 31(12): 2303–2311.
53. Pray C, Feroz NI, Nigil Haroon N. Bone mineral density and fracture risk in ankylosing spondylitis: a meta-analysis. Calcif Tissue Int 2017; 101(2): 182–192.
Labels
Dermatology & STDs Paediatric rheumatology RheumatologyArticle was published in
Czech Rheumatology

2021 Issue 1
-
All articles in this issue
- ÚVODNÍK
- Doporučení České revmatologické společnosti pro farmakologickou léčbu axiálních spondyloartritid Část I. Strategie léčby a farmakoterapie
- Osud kolena po parciální meniskektomii: analýza klinických a radiologických výsledků po minimálně 5 letech sledování
- Validace české verze dotazníků hodnotících sexuální funkci a funkci pánevního dna u žen
- Ukazatele aktivity a funkčního postižení u revmatoidní artritidy
- Rizika dlouhodobé léčby bisfosfonáty
- Czech Rheumatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Osud kolena po parciální meniskektomii: analýza klinických a radiologických výsledků po minimálně 5 letech sledování
- Rizika dlouhodobé léčby bisfosfonáty
- Doporučení České revmatologické společnosti pro farmakologickou léčbu axiálních spondyloartritid Část I. Strategie léčby a farmakoterapie
- Validace české verze dotazníků hodnotících sexuální funkci a funkci pánevního dna u žen

