Novinky v léčbě psoriázy biologiky a standardními systémovými léky
Update on the Psoriasis Treatment by Biologics and Standard Systemic Drugs
Authors give an updated review of recent knowledge regarding the pathogenesis of psoriasis and the development of new systemic drugs. Further information about comorbidities and their significance for praxis is provided. Recommended indication criteria of the Czech Society of Dermatology and related issues are mentioned. Efficacy, switching therapy to another biologic drug and combined treatment are discussed. Regarding safety of the treatment they introduce new specifications and recommendations for clinical and laboratory patient monitoring. The article includes basic information about a biological drug, adalimumab, recently implemented in the treatment of psoriasis. In conclusion, the significance of biologics is summarized as very promising drugs, the development of which led to better understanding of psoriasis pathogenesis and, moreover, indirectly increased the use of the standard systemic antipsoriatics.
Key words:
psoriasis – etiopathogenesis – new drugs – comorbidities – biologic treatment recommendations update
:
N. Benáková 1; J. Štork 2
:
Dermatologická ordinace NZZ Praha
vedoucí lékař MUDr. R. Klubal
1; Dermatovenerologická klinika 1. LF UK Praha a VFN
přednosta prof. MUDr. J. Štork, CSc.
2
:
Čes-slov Derm, 83, 2008, No. 4, p. 191-202
:
Innovations in Medicine
Autoři podávají přehled nových informací o patogenezi psoriázy a vývoji nových celkových léčiv. Rozvádí poznatky o doprovodných chorobách (komorbiditách) a jejich významu pro praxi. Uvádí odborná indikační kritéria ČDS ČLS JEP a s tím spojenou problematiku. Rozebírají téma účinnosti, přechodu na jiné biologikum a kombinované léčby. V oblasti bezpečnosti uvádí upřesnění a nová doporučení pro klinické a laboratorní vyšetřování a sledování. Součástí článku je i základní informace o nově zaváděném biologiku adalimumabu. V závěru shrnují význam biologik – jedná se o perspektivní lékovou skupinu, která s sebou přinesla větší porozumění patogenezi psoriázy a navíc nepřímo přispívá k žádoucímu používání stávajících celkových antipsoriatických léků.
Klíčová slova:
psoriáza – etiopatogeneze – nové léky – komorbidity – aktualizace doporučení pro biologickou léčbu
ÚVOD
Přestože od zavedení biologické léčby do klinické praxe uběhlo pouze několik let, stala se již důležitou součástí celkové léčby psoriázy. Během tohoto období výrazně přibylo praktických zkušeností s touto léčbou včetně údajů o její účinnosti při dlouhodobém podávání, o možnostech výměny jednoho biologika za druhé, o kombinacích s nebiologickými léky a metodami, o bezpečnosti, o nežádoucích účincích a jejich zvládání (45, 20).
I když je v současné době indikování a předepisování biologické léčby vázáno na „centra biologické léčby“, měl by každý dermatovenerolog mít povědomí o jejích možnostech, indikacích. Podle anamnézy, klinického a laboratorního vyšetření by měl být schopen posoudit, zda je pacient kandidátem na celkovou léčbu, zda splňuje kritéria biologické léčby a měl by pacientovi poskytnout orientační informace.
Proto předkládané sdělení, které navazuje na předchozí publikace věnované biologické léčbě psoriázy, uvádí nové praktické i teoretické poznatky týkající se této léčby (3).
Etiopatogeneze a nové léky
Současně s výzkumem nových léků pokračuje i výzkum etiopatogeneze psoriázy. V současnosti se stále více ukazuje významná role nespecifické imunity – dendritických, antigen prezentujících buněk (DC), které se uplatňují jak při vzniku, tak při udržování projevů psoriázy. Subpopulace DC, tzv. plazmocytoidní DC, je schopna tvorby INFα, který indukuje zánět zcela nezávisle na T-lymfocytech, nositelích specifické imunity. Dále se u psoriázy zjistila zvláštní subpopulace DC, která tvoří TNFα a volné dusíkaté radikály (iNOS), tzv. TIP - DC, která je schopna díky těmto cytokinům, opět nezávisle na specifické imunitě, indukovat lokální zánět (50). Nejnovějším objevem je IL-23, který je u psoriázy ve zvýšené míře tvořen právě dendritickými buňkami, ale i přímo keratinocyty. Cytokin IL-23 se zdá být klíčovým regulátorem pro ostatní cytokiny, a tak i pro různé buněčné populace (52). Ukazuje se, že TNF již není v centru patogeneze, má však výraznou roli v psoriatickém zánětu a navíc přispívá k stimulaci tvorby IL-23, který směruje T-lymfocyty (společně s IL-6 a TGFβ) k vývoji v Th17, což je nově objevená subpopulace T-helperů tvořící IL-22 a IL-17. Tyto dva cytokiny jsou zvýšeně přítomné v psoriatických projevech a jsou přímo zodpovědné za proliferaci, hyperplazii epidermis a zánět u psoriázy (a ne IFNγ). Keratinizaci v kůži přímo řídí gen, resp. protein STAT3. A cytokiny IL-22 a IL-23 vedou k jeho zvýšené expresi v psoriatické kůži. Ukázalo se také, že stávající anti-TNFα biologika působí u psoriázy proti hyperplázii také díky snížení právě IL-17 (49). Na vzniku projevů psoriázy se podílí i IL-12, který navozuje diferenciaci T-lymfocytů k typu Th1 a k imunitní reakci I. typu. Prokázalo se též, že T-lymfocyty v psoriatické kůži přetrvávají a jsou schopné proliferace a diferenciace (tzv. rezidentní T-lymfocyty), tzn. že nepronikají do kůže jen z krevního oběhu. Tím se vysvětluje jak lokální pohotovost k zánětu, tak potenciál pro vznik lymfoproliferativních chorob u psoriázy. Lymfocyty Th17 a Th1 navíc nepodléhají obvyklému utlumení regulačními T-lymfocyty, což klinicky vede k přetrvávání zánětu a chronicitě psoriázy.
Psoriáza je výlučně lidskou chorobou. Existuje hypotéza, že v důsledku selekčního evolučního tlaku velkých lidských populací došlo ke vzniku výhodných mutací (polymorfismů) faktorů nespecifické imunity, které jedinci poskytovaly sice relativní, ale rychlou obranu při infekčních epidemiích. Tato geneticky zvýšená pohotovost vrozené imunity (větší počet a upregulace genů) vedla k nižší frekvenci infekcí, současně ale při působení provokačních faktorů ke zvýšenému výskytu choroby, jako je psoriáza. Svědčí pro to na buněčné úrovni aktivace a proliferace keratinocytů, příliv neutrofilů do kůže, infiltrace plazmocytoidních dendritických buněk a přirozených zabíječů (NK) a aktivace Th 17 lymofocytů.
Podle současné koncepce mají tedy v patogenezi psoriázy centrální úlohu imunologicképatomechanismy, zejména lymfocyty Th17 a Th1 (k vyvolání obrazu psoriázy jsou zapotřebí současně obě tyto populace), které vstupují do interakce s dendritickými buňkami, makrofágy, mastocyty a neutrofily a vedou k zánětu prostřednictvím indukce tvorby cytokinů TNFα, IFNγ, IL-8, IL-12, IL-17, IL-19 včetně především IL-22 a 23. Z pohledu nových poznatků lze na psoriázu pohlížet jako na imunologicky navozenou, přestřelující zánětlivou reakci obdobnou neregulovanému procesu hojení ran. Nadále zůstává v platnosti charakteristika psoriázy jako geneticky komplexní choroby, kde genetický podklad je variabilní, a proto ve výsledné manifestaci choroby (fenotypu) existují odlišnosti jak v obraze histologickém a klinickém, tak v reakci na léčbu (50, 51).
Na základě výše uvedených poznatků vzniká skupina nových biologických léků, blokujících podjednotku p40, která je součástí IL-12 a IL-23, pro kterou byly nalezeny u psoriázy relevantní genetické mutace (ale i u jiných autoimunitních chorob, např. m. Crohn, m. Bechtěrev). Jedním z prvních je ustekinumab (Centocor), monoklonální protilátka blokující oba klíčové cytokiny IL-23 i IL-12. Proto má též oproti současným biologickým lékům výrazně vysokou účinnost. Zlepšení o 75 % (PASI 75) po 12 týdnech léčby dosahuje u 67 % pacientů při dávce 45 mg a u 76 % pacientů při dávce 90 mg. Klinický účinek (PASI 75) přitom přetrvával po 28 týdnech u 70–79 % pacientů, po 40. týdnu u 70–80 % a v 76. týdnu u 80 % pacientů. Dávkování v počáteční fázi představuje jednu injekci s.c. v 0. a 4. týdnu. Pro pacienty bude tento lék zajímavý též díky pozoruhodně dlouhému intervalu léčby – v udržovací fázi se s.c. injekce aplikuje 1x za 3 měsíce. Z nežádoucích účinků se objevují infekce horních cest dýchacích, močové infekce, artralgie, cefalea, únava, méně průjmy. Dosud se nezjistily imunosupresivní důsledky se vznikem tumorů či reaktivace latentní tuberkulózy, ale potenciální rizika existují. Lék byl již v prosinci 2007 přijat do schvalovacího řízeni americké FDA (51). Dalším novým biologikem jeABT 874 (Abbott), plně humánní monoklonální protilátka proti IL-12 a IL-23, která je ve fázi III. klinického zkoušení. V 12. týdnu PASI 75 dosáhlo 70–90 % pacientů. Po jednorázové dávce se PASI 75 ještě po 12. týdnech udrželo u 63 % pacientů. Počáteční jednorázová dávka je 200 mg s.c., pak se aplikuje 100 mg ob týden. Výzkum dávkovacích režimů nadále probíhá. Z nežádoucích účinků se objevují často infekce (18). Dalším perspektivním lékem je tocilizumab, monoklonální protilátka proti IL-6, který stimuluje vývoj výše zmiňované subpopulace Th17 lymfocytů. (51) Zatím jsou údaje pouze z revmatologie, mechanismem účinku by plně zapadal do této nové skupiny. Ve stadiu klinického výzkumu fáze III je kalcineurinový inhibitor ISA 247 v perorální formě, který má oproti cyklosporinu A nižší nefrotoxicitu, především díky rychlejší metabolizaci. V 12. týdnu při dávce 0,4 mg/kg/den PASI 75 dosáhlo 47 % pacientů. Prokázala se přímá souvislost mezi zlepšením PASI skóre a koncentracemi léku v krvi, což umožňuje titraci dávky a predikci klinické odpovědi, ale i lepší prevenci nežádoucích účinků (51).
Teoretické poznatky mají rychlý a přímý dopad do praxe. Reálnou účinnost těchto nových léků v denní klinické praxi a jejich dlouhodobou bezpečnost ukáže až zhodnocení v delším časovém úseku, protože nové léky mívají v běžné praxi poněkud menší účinnost než v klinických studiích (výběr pacientů, compliance, pokles účinnosti v čase aj. faktory).
Komorbidita a psoriáza jako rizikový faktor kardiovaskulárních chorob
Druhým velmi zajímavým „vedlejším“ produktem výzkumu zavedení biologik je odhalení, resp. prohloubení znalostí o chorobách spojených s psoriázou, tzv. komorbiditách.Komorbiditapředstavuje současný výskyt jednak imunologicky podmíněných chorob, jako jsou Crohnova choroba a ulcerózní kolitida (3-7x vyšší výskyt u psoriatiků), psoriatická artritida, Bechtěrevova choroba, roztroušena skleróza, a jednak chorob metabolického syndromu s chronickou zánětlivou složkou, jako jsou diabetes mellitus II. typu, dyslipidémie, arteriální hypertenze, hyperkoagulace, steatohepatitida a dna; ale též lymfomů a dokonce i deprese (5, 12, 26, 35). Nejedná se o přímou příčinnou souvislost s psoriázou, tj. její důsledek. Sdružený výskyt těchto chorob má velmi pravděpodobně společný genetický základ, na který pak působí vlivy zevního prostředí, životní styl a chování jedince (kouření, alkohol, obezita). Například výskyt klinicky zjevné psoriatické artropatie se odhaduje u 30 % psoriatiků, avšak podle současných poznatků má až 50 % asymptomatických pacientů již scintigraficky zjistitelné postižení (30). Riziko postižení těmito chorobami koreluje přímo se závažností, dobou trvání psoriázy a věkem pacienta.
Důsledky chorob provázejících psoriázu pro praxi:
- Představují obecné zdravotní riziko pro jedince, výraznou morbiditu a mortalitu.
- Léčba těchto chorob využívá léky, z nichž řada psoriázu může zhoršovat či vyvolávat (β-blokátory, inhibitory ACE; antikoagulancia, diuretika, thyreoidální preparáty, nesteroidní antiflogistika, lithium aj.).
- Tyto choroby samy mohou působit jako provokační faktory psoriázy a jejich výskyt je nepříznivým prognostickým ukazatelem průběhu psoriázy. Příčiny a následky psoriázy a jejích komorbidit jsou vzájemně provázané. Např. centrální obezita je rizikovým faktorem pro vznik a nepříznivý průběh psoriázy, ale může být i jejím důsledkem. Psoriatici mají vyšší riziko vzniku obezity; větší výskyt i vyšší míra obezity se pozoruje u těžké psoriázy.
- Jejich výskyt omezuje či vylučuje použití standardních celkových antipsoriatických léků, jejich léčba je rizikem vzniku interakcí s konvenčními antipsoriatiky (zejména cyklosporinu A); metotrexát, cyklosporin A i acitretin mohou (nežádoucími účinky na játra, ledviny, metabolismus tuků aj.) latentní komorbidity vyvolat.
U pacientů s těžkou psoriázou se prokazuje zvýšená kardiovaskulární mortalita – úmrtí u psoriatiků nastává o 3,5 až 4,5 roku dříve než u ostatní populace stejného věku (1). Nejvíce ohroženou skupinou z hlediska kardiovaskulární mortality, tedy úmrtí na infarkt myokardu, se zdají být mladí, obézní muži s těžkou psoriázou (11). Ischemická choroba srdeční (ICHS), resp. vznik a rozvoj aterosklerotického plátu, je významně podmíněna chronickým zánětem, což histologicky dokumentuje infltrace T-lymfocytů a makrofágů, přítomnost prozánětlivých cytokinů a proteolytických enzymů. Lokálně je v aterosklerotickém plátu stejné cytokinové prostředí (TNFα, IL-6, IL-8, and IL-17) jako ve střevní stěně pacientů s Crohnovou chorobou, v psoriatickém ložisku nebo v artritickém kloubu a podobně jako u těchto chorob patří k provokačním faktorům u ICHS také infekce a stres (34). Situace připomíná obecnou patofyziologii chorob zprostředkovaných T-lymfocyty. Buňkami zprostředkovaná imunitní dysregulace uplatňující se u ICHS je u pacientů s chorobami zprostředkovanými T-lymfocyty (revmatoidní artritida, psoriáza) výrazně zvýšená již na počátku, což vede k zvýšenému riziku kardiovaskulární mortality u těchto osob oproti ostatní populaci stejného věku. Klíčovou roli zde patrně hraje IL-17, který je zvýšeně přítomen nejen u psoriázy, ale (společně s C-reaktivním proteinem, IL-6 a IL-8) i v plazmě pacientů s nestabilní anginou pectoris a infarktem myokardu (16). Tento IL-17 byl též zvýšeně prokázán v artritických kloubech pacientů s revmatoidní artritidou, u Lymeské choroby, v zánětlivých ložiskách u Crohnovy choroby, u roztroušené sklerózy, experimentální autoimunitní encefalomyelitidy, u rejekce orgánových trasplantátů a cévních mozkových příhod. Prakticky každá buňka může být terčem pro IL-17, protože jeho receptory jsou ubikviterní a aktivují zánětlivou reakci cestou jaderného faktou NF-κB. Zánětlivé procesy u psoriázy jsou tedy obrazem obecných imunologických pochodů, které se objevují také v kloubech, střevě, cévách a jiných systémech, což podtrhuje systémový charakter psoriázy (21). Někteří autoři proto dokonce označují psoriázu jako marker skrytých systémových chorob (21).
Obezita představuje také imunopatologický stav, ať na ni pohlížíme jako na důsledek či provokační přičinu psoriázy. Tukové buňky jsou hormonálně i imunologicky aktivní (24). Adipocyty exprimují toll-like receptory (TLR), a tak v rámci nespecifické imunitní reakce jsou schopné po kontaktu s antigenem uvolňovat prozánětlivé cytokiny analogicky, jako je tomu u makrofágů. K těmto cytokinům tukové tkáně (adipokinům) patří adiponektin, rezistin, inhibitor plazminogenového aktivátoru 1 (PAI-1) a leptin – potlačuje Th2 a stimuluje Th1 odpověd (46). Adipocyty ale tvoří také IL-6 a TNFα – známé mediátory psoriatického zánětu. Poslední dva jmenované cytokiny též vyvolávají inzulinovou rezistenci, dyslipidémii (indukci oxidovaného LDL), endotelovou dysfunkci (exprese adhezivních molekul na endoteliích s následnou adhezí monocytů na cévní stěnu), což ukazuje na roli adipocytů při tvorbě tzv. pěnitých buněk v aterosklerotickém plátu. Také působí prokoagulačně a protromboticky, protože TNFα zvyšuje hladiny PAI-1 vedoucí ke zhoršení fibrinolýzy a nekontrolovanému krevnímu srážení. Interleukin 6 pak stimuluje tvorbu fibrinogenu a C-reaktivního proteinu v játrech (CRP). Oba cytokiny se nacházejí ve zvýšených hodnotách jak u psoriatiků, tak u obézních osob bez psoriázy. Zvýšená adipocytární sekrece IL-6 a TNFα přispívá ke zvýšeným hodnotám CRP, což dále ukazuje na obezitu jako stav chronického zánětu, který je přítomný jak u psoriázy (36), tak u ICHS (21).
V tomto kontextu lze na psoriázu pohlížet jako na rizikový faktor metabolického syndromu a aterogeneze (9). V obrovské analýze dvou amerických zdravotnických databází (19) s téměř 20 000 psoriatiky a 82 000 kontrolními osobami stejného věku se jednoznačně prokázalo, že osoby s psoriázou mají vyšší výskyt aterosklerózy, městnavé srdeční slabosti, diabetu 2. typu a ischemické choroby dolních končetin.
Obecně je třeba po komorbiditách pátrat (5). Včasná, dostatečně účinná a dlouhodobá léčba psoriázy může mít na rozvoj komorbidit, zejména kardiovaskulárních, preventivní vliv (47). Proto by i dermatolog měl rizikové pacienty vyhledávat a poskytnout základní poučení, popř. doporučit seriózní osvětové zdroje (např. www. metabolickysyndrom-klub.cz).
VOLBA CELKOVÉ TERAPIE A INDIKACE BIOLOGIK V PRAXI
Biologická léčba si, zejména pro svoji nákladnost, vynutila vypracovávání určitých kritérií a algoritmů při volbě léčby, především s ohledem na účelnost indikace. Z doporučení odborníků vyplynulo, že závažnost psoriázy nelze posuzovat jen podle rozsahu a intenzity postižení, ale i podle reakce na předchozí léčbu, podle průběhu a úrovně kvality života. Tento trend vyjádřila National Psoriasis Foundation (renomovaná pacientská organizace v USA zastřešená předními americkými dermatology, specialisty na problematiku psoriázy – Medical Board) doporučením nerozlišovat při rozhodování o léčbě rigidně mírnou, středně těžkou a těžkou psoriázu, ale psoriázu léčitelnou lokálně a psoriázu vyžadující systémovou léčbu. Do celkové léčby se počítá nejen acitretin, metotrexát a cyklosporin A, ale i fototerapie 311 nm UVB a fotochemoterapie PUVA. První volbu terapie tak představuje lokální léčba, v případě selhání pak následuje léčba systémová. V USA je ovšem tendence řadit biologika z hlediska indikace na roveň konvenčních celkových léků, ne do druhé linie jako v Evropě (51). Současné doporučení postupu pro celkovou léčbu tedy zní – používat všechny terapie a neopomíjet konvenční léky.
Volba celkové léčby se v praxi řídí podle (3):
- formy psoriázy a lokalizace
- přítomnosti psoriatické artropatie
- účinnosti a rychlost nástupu efektu
- bezpečnosti a délky udržení remise
- odpovědi na léčbu v minulosti
- výskytu přidružených chorob
- schopnosti spolupráce pacienta
- dostupnosti a ceny léčby (též vyšší dávka při vyšší hmotnosti pacienta)
- individuální zkušenosti lékaře aj. subjektivních faktorů.
Za léky s rychlým nástupem lze ze současných označit cyklosporin A a infliximab. Léky s dobrým udržovacím efektem jsou metotrexát, acitretin, etanercept a efalizumab. Relativně nejpříznivější účinek z hlediska udržení remise má fotochemoterapie PUVA, fototerapie 311 nm UVB a u nás nedostupný alefacept. Při přítomnosti současné psoriatické artropatie jsou léky volby metotrexát a anti-TNF biologika (obr. 1).
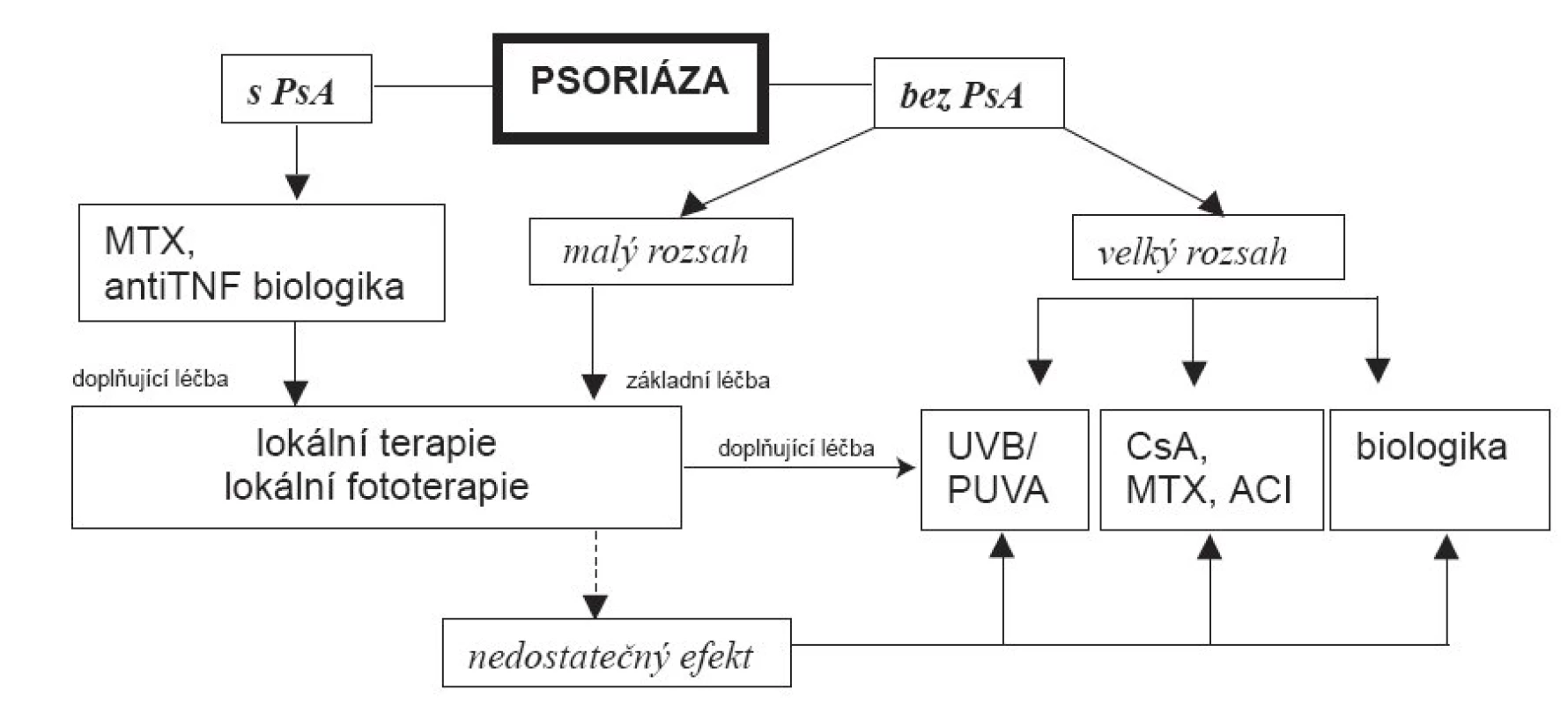
Ač byla odborná indikační kritéria pro biologickou léčbu psoriázy již několikrát publikována, dochází někdy k nejasnostem při jejich výkladu. Svůj podíl na tomto jevu může mít i přetrvávání původní pracovní verze indikačních kritérií v Seznamu léčiv, resp. Indikačních omezeních (viz dále).Výbor ČDS ČLS JEP se snaží o vyřešení této dvojkolejnosti k jednotnému výkladu. Proto považujeme za vhodné znovu na tomto místě uvést odborné „indikace pro celkovou léčbu psoriázy biologiky :
a) ložisková psoriáza dospělých s PASI > 10 či BSA > 10
b) a pacient je kandidátem celkové léčby
- psoriáza je refrakterní, tj. ke kontrole nemoci nestačí lokální léčba a fototerapie (pacient se v posledních 6 měsících nikdy nezhojil)
- psoriáza je nestabilní, tj. kde nastávají brzké exacerbace po ukončení léčby onemocnění (remise kratší než 1 měsíc)
- kvalita života je výrazně snížena, tj. např. v hodnocení DLQI > 10 bodů
c) a kde nelze pro nedostatečný efekt, kontraindikaci či intoleranci použít minimálně dva tyto celkové léčebné postupy:
- fototerapie (311 nm UVB, PUVA)
- acitretin
- metotrexát
- cyklosporin A
Zvláštní indikaci mimo uvedená kritéria může představovat nestabilní psoriáza se sklonem k rychlému vzniku erytrodermie, erytrodermická a generalizovaná pustulózní psoriáza – formy se závažnými, život ohrožující komplikacemi. V odborné literatuře je udáváno příznivé působení i na jiné formy psoriázy anebo lokalizace, které výrazným způsobem snižují pracovní schopnost, soběstačnost a kvalitu života (např. psoriáza na rukou či nohou; postihující obličej nebo nehty)“ (3).
Text z Číselníku (2008): „Biologikum předepisuje dermatolog specializovaného pracoviště – centra se zvláštní smlouvou se zdravotními pojišťovnami na léčbu tímto typem léčivého přípravku u pacientů s těžkou psoriázou postihující více než 10 % tělesného povrchu nebo PASI 10 a zároveň splňuje alespoň jedno z následujících kritérií:
- a) nelze použít nebo je riskantní jiná celková léčba (acitretin, metotrexát, cyklosporin A) – z důvodů vzniklých nežádoucích účinků či toxicitiy, intolerance či kontraindikace;
- b) pacient nereaguje na standardní léčbu těžké psoriázy (acitretin, metotrexát, cyklosporin A, PUVA, UVB 311nm), tj. po 3 měsících terapie není dostatečný efekt (zlepšení PASI nebo BSA >50 % oproti výchozímu stavu) nebo by se musela zvyšovat dávka nad bezpečné limity;
- c) onemocnění nebylo v posledních 3 letech nikdy zhojeno nebo relapsy nastávají do jednoho měsíce po skončení předcházející intezivní léčby.
Léčba trvá maximálně 2 roky a ukončí se, pokud po 3 měsících nedojde k zlepšení o 50–70 %.“
V některých zahraničních doporučeních (např. britských) se jako další indikace uvádí psoriáza se současnou psoriatickou artropatií, což v současnosti platí jen pro biologika blokující TNF. V našich podmínkách se takováto situace řeší ve spolupráci s revmatology a biologika preskribuje ten specialista, kde je závažnost postižení větší, tj. splňuje indikační kritéria příslušné odborné společnosti.
V praxi není podmínkou použití biologické léčby neúspěšnost aplikace všech prostředků standardní systémové terapie psoriázy, protože pro některá léčiva výskyt sdružených onemocnění (klinicky či laboratorně prokázaných) může představovat kontraindikaci použití dané léčby (např. hypertenze u cyklosporinu A). Pokud nemocný, kandidát systémové léčby, dosud nebyl celkově léčen a nemá kontraindikace, uplatňují se v léčbě nejprve standardní systémové léčebné postupy. Centra pro biologickou léčbu psoriázy jsou superkonziliárními pracovišti, která biologickou léčbu indikují a podávají, ale musí respektovat daná kritéria, a proto u těchto pacientů dosud neléčených doporučují systémovou léčbu a ve spolupráci s ošetřujícími dermatologem rozhodují o dalších možných terapeutických postupech. Před odesláním pacienta do centra by proto ošetřující dermatolog měl zvážit možnosti indikace biologické léčby. Měl by posoudit kontraindikace, výsledky či intoleranci standardní celkové léčby (acitretin, metotrexát, cyklosporin A, 311 nm UVB fototerapie či fotochemoterapie PUVA) a při splnění indikací odeslat nemocného s podrobnou anamnézou zahrnující uvedené údaje – včetně dávkování a délky předchozích léčebných postupů – do centra pro biologickou léčbu psoriázy. V případě svízelných případů je možné využít i superkonziliárních služeb center. Určitou nevůli k podávání systémové léčby dermatology (i v jiných zemích) prokazují některé průzkumy, dokládající tak určitou podléčenost nemocných s těžkou psoriázou (38).
Dalším zdrojem nejasností je přetrvávání úředně dosazeného limitu používání biologik na dva roky v Seznamu léčiv, které nemá odborné zdůvodnění. Výbor ČDS ČSL JEP opakovaně apeloval na příslušné instituce k jeho zrušení. Opět znovu uvádíme text z našich doporučených postupů, že kromě nespolupráce pacienta přichází „ukončení či přerušení léčby v úvahu v těchto situacích:
- závažné nežádoucí účinky léku, intolerance, kontraindikace
- těžká interkurentní infekce
- gravidita (existuje jen málo údajů o používání anti-TNF léčiv u žen)
- malignita
- očkování živou vakcínou
- velké chirurgické výkony (resp. individuální zvážení poměru rizika k přínosu)
- klinická neúčinnost: nenastane-li do 3 měsíců zlepšení PASI či BSA >50 %“ (3).
ÚČINNOST BIOLOGIK, PŘECHOD NA JINÉ BIOLOGIKUM, KOMBINACE
Není smyslem tohoto sdělení uvést přehled všech studií v mezidobí od vydání našich doporučených postupů (3). Uvádíme proto pouze zásadní informace, včetně údajů týkajících se bezpečnosti, nových indikací, dávkování, atd.
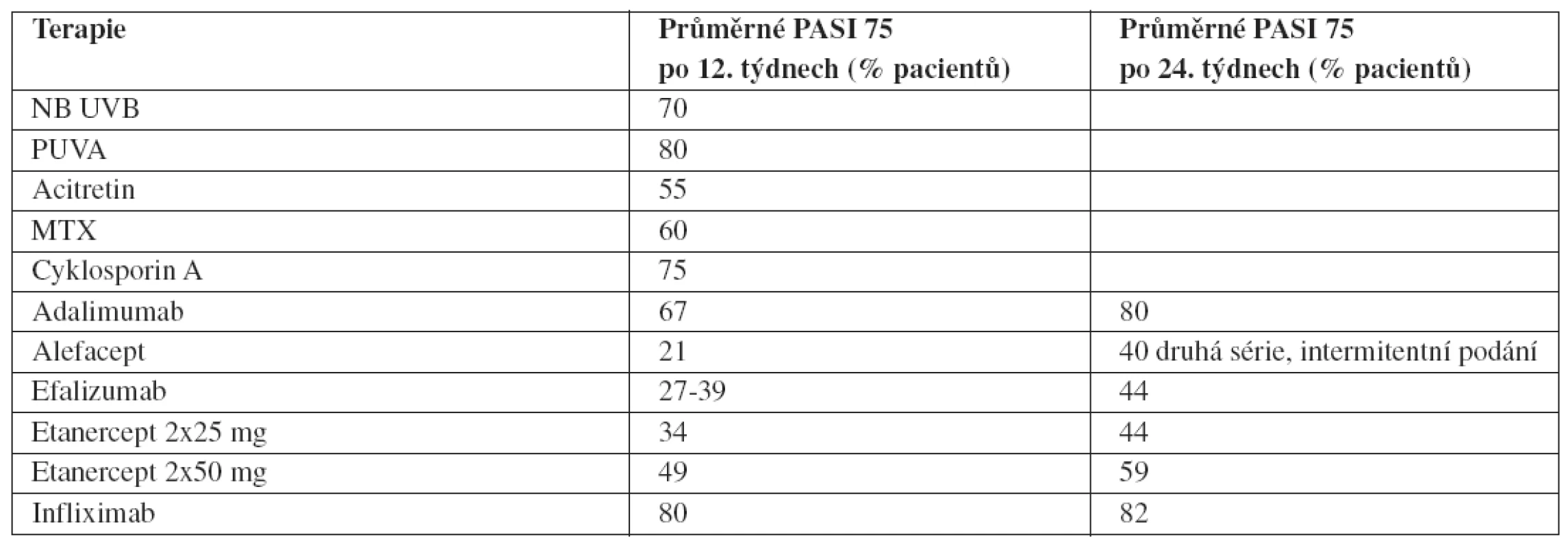
Variabilita v účinnosti biologik (ale obecně i všech antipsoriatických léků) je daná jejich farmakodynamikou a farmakokinetikou, ale i farmakogenomickým profilem jedince. Dále je ovlivňována zevními faktory, jako jsou: aktivita choroby, dávka, věk, váha, souběžná medikace, způsob podání, u perorálních léčiv též vliv potravy atd. Je známo, že obézní pacienti, kuřáci a konzumenti alkoholu reagují na léčbu hůře, bez ohledu na zvýšení dávky. Také se jen sporadicky a většinou na základě retrospektivních analýz objevuje hodnocení stávajících celkových léků stejně přísnými měřítky jako je tomu u biologik, tj. prostřednictvím procenta pacientů dosáhnuvších PASI 75. Na 66. meetingu Americké akademie dermatovenerologie v San Antoniu v roce 2008 se objevil zajímavý přehled (tab. 1), který orientačně (nejedná se o výsledky srovnávacích studií) tuto situaci mapuje. Též poukazuje na pozitivní fakt, že u řady biologik účinnost s dobou podávání narůstá.
Vzhledem k rozdílné, zatím nepředvídatelné odpovědi na lék a také k možnému poklesu účinnosti po jednom roce léčby („udržení klinické odpovědi“), je pro malou účinnost možný přechod z jednoho biologika na jiné biologikum („switching“), a to i ze stejné skupiny mechanismu účinku. Velmi pěkný a současný pohled na tuto problematiku podává článek (4), z něhož vyjímáme hlavní myšlenky.Přechod na jiné biologikum není ale jen otázkou vlastní klinické praxe, má totiž i velký vědecký význam – fakt, že jedno anti-TNF biologikum účinkuje u stejného pacienta, u kterého předchozí jiné anti-TNF biologikum selhalo, signalizuje cosi potenciálně důležitého o patofyziologii individuálního pacienta a vede k primárně nezamýšlenému výzkumu těchto skutečností. Téma přechodu na jiné biologikum má i farmakoekonomický rozměr a zajímá zdravotnické úřady, které se snaží posuzovat, do jaké míry a za jakých podmínek mají u pacienta hradit druhé nebo i třetí anti-TNF biologikum. Pro přesnější rozhodování však chybí kontrolované, prospektivní, randomizované studie. Základní příčinou k přechodu na jiné biologikum je tzv. selhání léčby, tedy neúčinnost. A to je zásadní moment, jehož rozboru by měla být věnována pozornost v observačních studiích i jednotlivých případech, aby bylo možno vyvodit potřebné obecné závěry a doporučení. Příčiny toho selhání mohou být v zásadě čtyři:
- pacient na lék primárně vůbec nereaguje – rezistence vůči léku (non-responder);
- v průběhu léčby dojde k poklesu účinnosti (acquired drug resistance), např. v důsledku tvorby protilátek proti léku;
- vznik nesnášenlivosti (drug intolerance), např. infúzní reakce, reakce v místě vpichu atp.;
- malá, jen částečná účinnost (partial responder).
Pro klinickou praxi jsou nejdůležitější dvě poslední příčiny. Klinická odpověď na anti-TNF léky není totiž dichotomická, ale má normální rozložení. A tak nás nepřekvapí, že z revmatologických registrů vyplývá, že po šesti měsících dosáhne podstatného zlepšení či remise přibližně 40 % pacientů při léčbě jakýmkoliv anti-TNF lékem, zatímco cca 60 % pacientů nikoliv. Z nich přibližně jednu třetinu tvoří skuteční, vůči léčbě primárně rezistentní pacienti a zbylé dvě třetiny jsou pacienti jen částečně reagující. Každý případ vyžaduje individuální přístup; v případě primární nereaktivity by použití jiného anti-TNF s dostatečnou klinickou odpovědí bylo prospěšné. Pokud pacient na léčbu reaguje jen mírným zlepšením, mají jak lékař, tak pacient zájem zkusit, zda jiné biologikum nedosáhne lepšího efektu. A tak vzhledem k omezeným objektivním informacím zůstává pro lékaře zvažování přechodu na jiné biologikum u pacienta se selháním předchozí léčby výzvou k optimálnímu rozhodnutí.
Ke zvýšení účinnosti (v případě malé účinnosti, poklesu klinické odpovědi, exacerbace psoriázy včetně přechodné papulární lokalizované erupce) se i u biologické léčby, byť byla původně zamýšlena jako monoterapie, používají kombinace s lokálními léky – především kortikoidy, ale i s analogy vitamínu D3, s fototerapií – především 311 nm UVB a dokonce i se systémovou standardní terapii – především acitretinem, neboť není imunosupresivní. Používá se i metotrexát (zejména u pacientů se současnou psoriatickou artropatií), který navíc brzdí tvorbu neutralizujících protilátek (10, 23, 37).
Výběr ze studií
Nárůst účinnosti s dobou podávání efalizumabu a udržení účinnosti se prokázaly ve studii (23)s 339 pacienty, kteří měli před léčbou průměrně PASI 17,2 a průměrný rozsah postižení 25 % a v první zaslepené částí měli k efalizumabu lokálně placebo nebo fluocinolon acetonid. Do nezaslepené fáze studie přešlo 290 pacientů, kde po 3 měsících léčby dosáhlo PASI 75 celkem 41,3 % pacientů. Stav se v následujících 18 měsících postupně zlepšoval i u pacientů s původně menší klinickou odpovědí. A tak po 33 měsících léčby dosáhlo PASI 75 celkem 47,2 % pacientů (analýza intention to treat – ITT), resp. 74,8 % (analýza as treated – AT). Studii dokončilo po 36 měsících 108 pacientů (cca 1/3 pacientů ze studie odpadla – malá účinnost, nepřišli na kontrolu aj. non-compliance, gravidita, stěhování atp.) a PASI 75 se udrželo u 45,4 % pacientů (ITT), resp. 72,6 % (analýza AT). Autoři studie hodnotí kontinuální léčbu efalizumabem jako vhodnou dlouhodobou léčbu pro řadu pacientů s ložiskovou psoriázou. Podobně se vyjadřují i autoři jiné práce (10). V ní je též na základě klinických analýz uvedeno, že hodnocení účinnosti biologik po 12 týdnech (jak vyžadují zdravotní pojišťovny pro rozhodnutí, zda v léčbě pokračovat či ne) není šťastné, protože účinnost (vyjádřená v procentu pacientů dosahujících PASI 75) se s dobou podávání u etanerceptu a efalizumabu zvyšuje a maximální efekt biologik nastává okolo 6. měsíce léčby. Citují, že podle EMEA (European Medicines Agency) se nedoporučuje ukončovat, resp. přerušovat léčbu etanerceptem po 24 týdnech, jak bylo původně uváděno v SPC přípravku, protože následně většina pacientů exacerbuje. I po formální stránce se na základě proběhlých studií (Crystel) a klinických zkušeností připravuje schválení etanerceptu pro kontinuální léčbu.
Etanercept má řadu nových studií léčby psoriázy u dětí, např. studie z chicagské dětské nemocnice(28). Dvojitě slepé studie se účastnilo 211 pacientů ve věku 4–17 let, dávka etanerceptu byla 0,8 mg/kg s.c. 1krát týdně. Po 12 týdnech léčby dosáhlo hodnoty PASI 75 celkem 57 % pacientů a v 36. týdnu to bylo 68 % pacientů. V amerických publikacích se objevují doporučení dávkovat etanercept v počáteční fázi 2x50 mg týdně po 12 týdnů a v udržovací fázi 1x50 mg týdně, což je stejně účinné jako dávkování 2x25 mg týdně a přitom pro pacienta snadnější (39).
Objevují se kazuistiky o úspěšné kombinaci biologik s acitretinem s cílem zlepšení účinnosti, resp. dlouhodobého udržení choroby pod kontrolou. Jediná studie kombinace biologika s acitretinem byla provedena s etanerceptem (13). Měla tří větvě – první s etanerceptem 25 mg s.c. 2krát týdně, druhá s acitretinem p.o. v dávce 0,4 mg/ kg/den a třetí s kombinací etanerceptu 25 mg s.c. 1krát týdně a acitretinu p.o. v dávce 0,4 mg/kg/den. Účinnost vyjádřena pomocí dosažení skóre PASI 75 po 24 týdnech byla v první skupině u 45 % pacientů, v druhé skupině u 30 % a v třetí skupině u 44 % pacientů. Ve studii se tedy prokázalo, že kombinace umožňuje snížení dávkování etanerceptu na 25 mg 1krát týdně se zachováním účinnosti jako při dávkování 2x25 mg týdně. Jiná studie prokázala vyšší účinnost dávky 1x50 mg týdně oproti 2x25 mg týdně (40).
Studie s infliximabem jednoznačně prokázaly výhodnost kontinuálního podávání oproti intermitentnímu (25). Také se ukázalo, že léčba infliximabem nepotlačuje kožní reaktivitu při epikutánním testování kontaktní přecitlivělostí, takže pro praxi není kontraindikací. Toto zjištění je významné např. pro pacienty s palmoplantárním postižením, kde bývá častá kontaktní koetiologie (31).
SCREENING, MONITORING A BEZPEČNOST
V platnosti zůstávají nadále původní doporučení klinických a laboratorních vyšetření a kontrol (3). Nově se podle současných doporučení považuje za dostačující u nerizikových pacientů léčených anti-TNF biologiky provádět screening na tuberkulózu při léčbě 1krát ročně. Existují však případy reaktivace latentní tuberkulózy (LTBC) i přes profylaxi, tedy individuální sledování je nutné. Dále se zvažuje, zda by se screening na LTBC před léčbou neměl provádět i před použitím konvenčních imunosupresivních antipsoriatik (metotrexát, cyklosporin A), protože tito pacienti jsou potenciálními uživateli anti-TNF biologik a testy na LTBC by mohly být touto předchozí imunosupresivní léčbou zkresleny. Screening na LTBC před celkovou léčbou u biologik nepůsobících blokádu TNF (efalizumab) se obvykle neprovádí, nicméně padá teoreticky v úvahu u vysoce rizikových pacientů, např. s přímým kontaktem s osobami s aktivní tbc, s anamnézou injekční drogové závislosti, s diabetem na inzulinu, silikózou, léčených dlouhodobě celkovými kortikoidy (včetně inhalačních) a jiných imunosupresiv (metotrexát, cyklosporin A), osob z endemických oblastí, osob s malnutricí, zdravotnických pracovníků atp. (Merck Serono Internal Data – Synopsis of tuberculosis assessment). Z nedávné konference zaměřené na systémovou léčbu psoriázy (Atény, březen 2008)vyplynulo doporučení provádět screening a monitoring na LTBC u všech biologik.
Pro lepší senzitivitu a specifitu se zvažuje zařazení testů využívajících měření uvolněného interferonu (IGRA – interferon gamma release assay) do standardního doporučení, čímž by se zlepšila záchytnost rizikových pacientů a též zabránilo nepotřebné chemoprofylaxi tbc a jejím nežádoucím účinkům u pacientů s falešně pozitivními tuberkulinovými kožními testy (2).
Vzhledem k hlášením reaktivace hepatitidy B se doporučuje u léčby anti-TNF biologiky provádět screening na HBV, resp. celý panel hepatitid. U infliximabu se doporučuje (podle FDA) monitorovat jaterní testy i v průběhu léčby. Pokud pacient nemá klinické příznaky, není třeba rutinně vyšetřovat před léčbou či během ní autoprotilátky (polékové lupus-like syndromy).
Vzhledem k potenciální asociaci mezi anti-TNF terapií a demyelinizujícími chorobami a faktu, že příbuzní I. linie osob s roztroušenou sklerózou mají velké riziko vzniku této choroby (mezi sourozenci 18–36 %) (7), neměla by se anti-TNF biologika u těchto osob vůbec podávat. Také u efalizumabu je třeba obezřetnosti, neboť byly, i když vysloveně vzácně, periferní demyelinizace hlášeny (26). Očkování inaktivovanými vakcínami lze za léčby anti-TNF biologiky provádět, je však možné, že imunizační efekt, resp. imunologická odpověď organismu, bude snížen. Záleží na typu biologika a typu vakcíny (6).
U pacientů s městnavou srdeční slabostí I. a II. stupně podle klasifikace NYHA je možné anti-TNF podávat, ale rozhodnutí závisí na kardiologickém vyšetření, resp. výsledku echokardiogramu. Pokud dojde u pacientů užívajících anti-TNF léčbu ke vzniku nových příznaků nebo zhoršení již existující kardiální insuficience, měl by se lék vysadit (26).
V případě jakékoliv infekce vyžadující celkovou antibiotickou léčbu se při léčbě inhibitory TNF doporučuje tuto léčbu přerušit. Z hlediska potenciálu k častějším infekcím existují mezi anti-TNF léky rozdíly – u monoklonálních protilátek byly hlášeny oportunní infekce častěji než u fúzních proteinů (26).
Otázka lymfomů je stále diskutována. Zdá se, že pacienti s psoriázou mají obecně zvýšené riziko jejich vzniku (kožní T-lymfomy a hodgkinské lymfomy), které může být potencováno užíváním imunosupresiv, případně fotochemoterapií PUVA. Proto by se u pacientů s takovouto anamnézou mělo použití anti-TNF léčiv pečlivě zvážit. Jinak z dosavadních bezpečnostních dat se zvýšený výskyt lymfomů u efalizumabu ani u anti-TNF biologik nejeví. Spíše se z revmatologických registrů ukazuje, že tito pacienti (ovšem léčení též řadou dalších léčiv včetně imunosupresiv) mají vyšší výskyt spinaliomů, bazaliomů a i melanomu. Zvýšené riziko solidních karcinomů se jednoznačně neprokázalo (26, 51).
Hematologické nežádoucí účinky (aplastická anémie, leukopenie, trombopenie) jsou u anti-TNF léčiv hlášeny řídce. Mělo by se ale na ně myslet, pokud je pacient nápadně bledý, má hematomy, krvácivost nebo horečku.
Pozoruhodnou skutečností je vznik pustulózních (psoriatických?) projevů při revmatologické či gastroenterologické anti-TNF léčbě u osob bez psoriázy anebo s psoriázou v dávné anamnéze (48). V nedávno publikované práci (15) autoři sledovali přes 9000 pacientů léčených anti-TNF a prakticky 3000 pacientů léčených celkovými antirevmatiky (DMARD) z britského revmatologického registru. Zjistili, že v první skupině je vznik psoriázy zvýšený (četnost 1,05 /1000 osob oproti 0/1000 osob u skupiny s DMARD). Patofyziologie nepochybně nebude jednotná, uvažuje se o možné zkřížené zpětnovazebné regulaci mezi TNFα a interferony I. typu, resp. IFNα; o psoriatické artritidě, která byla považována za revmatoidní a pak teprve došlo ke vzniku psoriázy na kůži; o relativně vysoké dispozici v populaci k psoriáze, která byla artritidou vyprovokována. Jiní autoři se domnívají, že se nejedná o psoriázu, ale polékovou reakci typu akutní generalizované exantematózní pustulózy (AGEP) nebo bakteriální infekci vzhledem k inhibici TNFα. To uvádí i jedna z nedávných prací (8) zkoumající palmoplantární pustulózní erupce, což jsou kromě psoriaziformního exantému nejčastější projevy při anti-TNF léčbě. Autoři považují tyto projevy za keratoderma blenorrhagicum, histologicky neodlišitelné jednotky od palmoplantární pustulózní psoriázy. Chlamydia trachomatis je totiž častým etiologickým agens u reaktivních artritid a autoři v postižené kůži nalezli DNA C. trachomatis. Z pokusů in vitro je také známo, že replikace chlamydií je v inverzním vztahu k hladinám TNFα.
Z metanalýz revmatologických studií a údajů registrů vyplývá, že anti-TNF biologika nemají v střednědobém používání výraznější rizika. Dlouhodobé sledování bezpečnostního profilu biologik v klinické praxi (farmakovigilance) je nadále nutné a potřebné (32). Proto mají velký význam registry pacientů, které musí být uvážlivě a smysluplně koncipovány pro maximální výtěžnost údajů (27).
Biologika blokující TNF (etanercept a infliximab) jsou v praxi více než 10 let (od roku 1992), takže je relativní dostatek údajů pro bezpečnostní analýzy. U etanerceptu (Enbrel®) to představuje přes 460 000 pacientů (přes 1 milion „pacientoroků“) a z hlediska počtu u psoriázy se počet odhaduje přes 96 000 pacientů. V připravovaném novém SPC se očekává registrace pro juvenilní psoriázu v dávkování 0,4 mg/kg s.c. 2krát týdně a možnost dalšího režimu dávkování 1x50 mg týdně (osobní oficiální sdělení firmy Wyeth). U infliximabu (Remicade®) to představuje doposud přes 1 000 000 léčených pacientů. Z hlediska počtu u psoriázy se odhaduje počet přes 10 000 pacientů (osobní oficiální sdělení firmy Schering-Plough). Infliximab je jediným biologikem s prokázanou účinností na psoriázu nehtů, uvedenou v SPC.
Efalizumab (Raptiva®) je v klinickém použití u psoriázy od roku 2003, výzkumné použití (klinické studie u psoriázy ) se datuje od roku 1997. Počet celosvětově léčených pacientů s psoriázou se odhaduje řádově na tisíce pacientů (35 000 „pacientoroků“) (osobní oficiální sdělení firmy Merck-Serono). Preparát není účinný na psoriatickou artropatii, naopak bylo v ojedinělých případech hlášeno zhoršení či vznik artralgií. Proto je vhodné u pacientů před zahájením léčby provést revmatologické vyšetření a takováto postižení vyloučit (37). Vzhledem k potenciálu vzniku trombocytopenie, hemolytické anémie či pancytopenie je třeba nadále provádět kompletní vyšetření krevního obrazu v prvních třech měsících 1x měsíčně a pokud nejsou abnormity, tak později po 3 měsících. Při vzniku trombocytopenie je třeba preparát ihned vynechat (37). V připravovaném novém SPC se očekává např. zvětšení balení a prodloužení doby použitelnosti.
Z hlediska gravidity patří efalizumab mezi kategorii C („riziko nelze vyloučit, studie na lidech neprovedeny; studie na zvířatech mohou či nemusí vykazovat riziko; potenciální prospěch léčby ospravedlňuje potenciální rizika“), zatímco anti-TNF biologika patří do kategorie B („bez rizika pro lidský fetus a možné riziko u zvířat nebo žádné riziko na zvířecích modelech při absenci studií na lidech“).
NOVĚ UVEDENÉ BIOLOGIKUM
Adalimumab (Humira®) je zcela lidská monoklonální protilátka třídy IgG1 proti TNFα. Váže s vysokou afinitou a specifitou solubilní i membránový TNFα. Aplikuje se s.c. Preparát je registrován v EU i USA k léčbě revmatoidní artritidy, psoriatické artritidy, ankylozující spondylitidy, Crohnovy choroby a nově též středně těžké až těžké ložiskové psoriázy.
Používá se ke kontinuální léčbě buď jako monoterapie nebo k posílení účinnosti a tlumení tvorby protilátek proti léku (cca 12 %, mohou být neutralizující) se adalimumab kombinuje s metotrexátem (zkušenosti z revmatologie). Dávkování je nezávislé na hmotnosti pacienta. Jednorázově se aplikuje 80 mg v iniciální s.c. dávce, po které následuje aplikace 40 mg 1krát týdně a pak se stejná aplikuje dávka ob týden (tj. injekce v 1. , 2., a pak 4., 6. týdnu atd.).
Jednou z prvních studií byla dvojitě slepá studie II. fáze u středně těžké až těžké ložiskové psoriázy u 147 pacientů z USA a Kanady (14). Měla dvě skupiny s účinnou látkou a jednu s placebem. Obě skupiny s aktivní léčbou začínaly nasycovací počáteční dávkou 1x 80 mg v prvním týdnu. První skupina pak pokračovala dávkou 1x 40 mg ob týden a druhá skupina dávkou 40 mg týdně. V 12. týdnu léčby dosáhlo PASI 75 v první skupině 53 % a v druhé 80 % pacientů, v placebové skupině pouze 4 %. Pacienti s aktivní léčbou pokračovali dále po 48 týdnů a klinická odpověď zůstala zachována po 60 týdnů. Účinnost se nelišila v závislosti na váze, pohlaví či věku. Adalimumab byl obecně dobře snášen. Nežádoucí účinky byly mírné až střední intenzity (zejména infekce horních cest dýchacích, reakce v místě vpichu, zvýšené hodnoty jaterních enzymů) a nezávisely na dávkovací frekvenci léku. Podobné výsledky přinesla obdobně koncipovaná studie z 18 center v USA a Kanadě. Po 24 týdnech léčby dosáhlo indexu PASI 75 ve skupině s dávkováním ob týden 64 %, ve skupině s dávkováním 1krát týdně pak 72 %. Zachování velmi dobré klinické odpovědi se ukázalo v 60. týdnu, kde PASI 75 mělo 60 % z prvé a 64 % z druhé skupiny. Bezpečnostní profil se nelišil od ostatních studií s adalimumabem u revmatoidní či psoriatické artritidy (22). Adalimumab má mezi svými studiemi i jednu unikátní, neboť srovnávacím prostředkem bylo nejen placebo, ale i standardní lék – metotrexát. Této multicentrické, randomizované studie fáze III (Champion) se účastnilo 271 pacientů z osmi evropských zemí. Adalimumab byl podáván v dávce 40 mg ob týden, metotrexát v dávce od 7,5 mg týdně p.o. podle tolerance a účinnosti až do 25 mg/týdně (v 1. týdnu 7,5 mg, od 2.–3. týdne 10 mg, od 4. týdne 15 mg; od 8. týdne 20 mg, od 12. týdne 25 mg, pokud PASI < 50). Po 16 týdnech léčby dosáhlo PASI 75 ve skupině adalimumabu 80 % pacientů, oproti 36 % pacientům s metotrexátem a 19 % pacientům s placebem (v 12. týdnu to bylo 77 % / 25 % / 15 %). Nástup klinické odpovědi na adalimumab byl rychlý, po prvním měsíci léčby dosáhlo 57 % pacientů PASI 75. Výskyt nežádoucích účinků nad 5 % se týkal reakcí v místě vpichu, zvýšení hodnot jaterních testů, infekcí horních cest dýchacích, artralgií a bolestí hlavy (35).
Adalimumab je první zcela lidská monoklonální protilátka proti TNFα. Má velmi dobré parametry účinnosti a díky delšímu biologickému poločasu má pro pacienty komfortní dávkování. Bezpečnostní profil podle dostupných údajů koreluje se skupinou ostatních anti-TNF léčiv, proto i pravidla pro screening a monitoring jsou stejná; k podrobnějšímu posouzení bude samozřejmě třeba údajů od většího počtu pacientů. Adalimumab je lékem, jehož zavedení do celkové léčby psoriázy v ČR představuje vítané rozšíření současné skupiny biologik.
ZÁVĚR
Biologika představují perspektivní lékovou skupinu, nejen pro léčbu psoriázy. Přinesla s sebou též větší porozumění patogenezi psoriázy. Tyto poznatky odhalují obecné mechanismy imunitních pochodů v kůži i v celém organismu – a tak i potenciální využití v léčbě dalších kožních, ale i systémových chorob. Dále biologika přispěla k hodnocení účinnosti současných konvenčních celkových léků a také k nepřímému tlaku na jejich používání. Předností biologik oproti konvenčním celkovým lékům je, že jsou vysoce účinná, zaměřená cíleně na pacienta a mají jasnější mechanismus účinnosti než současné léky. Díky své selektivitě jsou bezpečnější než současná léčiva – podle dosavadních zkušeností nemají orgánovou toxicitu a lékové interakce, nezhoršují komorbidity psoriázy a nastupují i indikace pro dětské pacienty.
Zavedení biologik s jejich podrobným klinickým a laboratorním sledováním pacientů včetně registrů též odhalilo širokou oblast komorbidit psoriázy. A v tomto kontextu včasná, dostatečně účinná a dlouhodobá léčba psoriázy může mít na rozvoj těchto onemocnění, především kardiovaskluárních, brzdící, a tedy i preventivní vliv. Dermatolog by měl proto do svého postupu při vyšetřování pacienta s psoriázou zařadit aktivní pátrání anamnestické, klinické a event. i laboratorní po nejzávažnějších komorbiditách, zejména metabolickém syndromu a psoriatické artropatii. Cílem je identifikovat rizikové pacienty a ty pak odeslat do péče internisty, praktického lékaře či revmatologa. Interdisciplinární spolupráce z hlediska diagnostiky a léčby (screening a management) těchto chorob hraje významnou roli. Problematika komorbidit psoriázy je relativně nová, a proto bychom o ní měli lékaře ostatních oborů, ale i relevantní instituce, informovat a vzdělávat je v tomto směru.
Došlo do redakce: 10. 6. 2008
MUDr. Nina Benáková
Dermatologická ordinace NZZ
Karlovo nám. 7
120 00 Praha 2
E-mail: nina.benakova@email.cz
Sources
1. BARCLAY, L. Severe but not mild psoriasis may increase mortality by 50%. Arch Dermatol, 2007,143, p. 1493-1499.
2. BEGLINGER, C. et al.. Screening for tuberculosis infection before initiation of anti-TNF therapy. SWISS Med Wkly, 2007, 137, p. 621-622.
3. BENÁKOVÁ, N., ŠTORK, J. Léčba psoriázy biologiky. Čes-slov Derm, 2006, 81 (4) Suppl.,S1-11.
4. BENÁKOVÁ, N., ETTLER, K., ŠTORK, J., VAŠKŮ, V. Psoriáza nejen pro praxi. Triton 2007. 190 s.
5. BENÁKOVÁ, N. Komorbidita psoriázy. Referátový výběr, Speciál Psoriáza 2008, s. 4-6.
6. BREZINSCHEK, HP., HOFSTAETTER, T., LEEB, BF. et al. Immunization of patients with rheumatoid arthritis with antitumor necrosis factor alpha therapy and methotrexat.Curr Opin Rheumatol, 2008, 20(3), p. 295-9.
7. BROADLEY, SA. et al. Autoimmune disease in first degree relatives of patients with mutiple sclerosis: a UK survey. J Am Acad Dermatol, 2000, 23, p. 1102-1111.
8. CARTER, JD., GERARD, HC.,HUDSON, AP. Psoriasiform lesions induced by TNF antagonists: a skin-deep medical conundrum. Ann Rheum Dis, 2008 (Feb 25) - on line early.
9. COHEN, AD., DREIHER, I., SHAPIRO, Y. et al. Psoriasis and diabetes: a population-based cross-sectional study. JEADV, 2008, 22, p. 585-589.
10. DRIESSEN, RJ., BEREND, MM., BOEZEMAN, JB. et al. Psoriasis treatment with etanercept and efalizumab: clinical strategies influencing treatment outcome. Br J Dermatol, 2008, 158, p. 1098-1108.
11. GELFAND, JM., TROXEL, AB., LEWIS, JD. et al. The risk of mortality in patients with psoriasis. Arch Dermatol, 2007, 143(12), p.1493-1499.
12. GISONDI, P., TESSARI, G., CONTI, A. et al. Prevalence of metabolic syndrome in patients with psoriasis: a hospital-based case-control study. Br J Dermatol, 2007, 157(1), p. 68-73.
13. G ISONDI, P. et al. Combining etanercept and acitretin in the therapy of chronic plaque psoriasis. Br J Dermatol, 2008, 158, p.134-149.
14. GORDON, KB,. LANGLEY, RG., LEONARDI, C. et al. Clinical response to adalimumab treatment in patients with moderate to severe psoriasis: double-blind, randomized controlled trial and open label extension study. JAAD, 2006, 55 (4), p. 598-606.
15. HARRISON, MJ., DIXON, WG.,WATSON, KD. et al. Rates of new-onset psoriasis in patients with rheumatoid arthritis receiving anti-TNFα therapy. Results from the British Society for Rheumatology Biologics Register. Ann Rheum Dis, 2008 (Apr 2) - on line early.
16. HASHMI, S., ZENG, QT. Role of interleukin-17 and interleukin-17-induced cytokines interleukin-6 and interleukin-8 in unstable coronary artery disease. Coron Artery Dis, 2006, 17(8), p. 699-706.
17. HERRON, M., HINCKLEY, M., HOFFMAN, MS. et al. Impact of obesity and smoking on psoriasis presentation and management. Arch Dermatol, 2005 141(12), p. 1527-34.
18. KIMBALL, AB. et al. Safety and efficacy of ABT-874, a fully human interleukin 12/23 monoclonal antibody in the treatment of moderate to severe chronic plaque psoriasis. Arch Dermatol, 2008, 144 (2), p. 200-207.
19. KIMBALL, AB. et al. Cardiovascular disease and risk factors among psoriasis patients in two US healthcare databases 2001-2002. Dermatology, 2008, 217, p. 27-37.
20. Kolektiv autorů: Léčba psoriázy efalizumabem. Čes-slov Derm, 2008, 83 (1), Suppl. S3 - S35.
21. KOUROSH, AS., MINER, A., MENTER, A. Psoriasis as the marker of underlying systemic disease. Skin Therapy Lett, 2008,13 (1), p.1-5.
22. LANGLEY, RG. et al. Adalimumab efficiacy in treatment of moderate to severe chronic plaque psoriasis is sustained through 60 weeks, with an acceptable safety profile. J Invest Dermatol, 2007, 127, p. 1820.
23. LEONARDI, C., MENTER, A., HAMILTON, T. et al. Efalizumab: results of a 3-year dosing study for the long term control of psoriasis. Br J Dermatol, 2008, 158, p. 1107-1116.
24. MAREK, J. Hormony, hormonální léčba a složky metabolického syndromu. Lék Listy, 2007,17, s. 24-26.
25. MENTER, A., FELDMAN, SR,, WEINSTEIN, GD et al. A randomized comparison of continuous vs. intermitent infliximab maintenance regimens over 1 year in the treatment of moderate-to-severe plaque psoriasis. J Am Acad Dermatol, 2007, 56 (1), p. 31-35.
26. MENTER, A., GOTTLIEB, A., FELDMAN, SR. et al. Guidelines of care for the management of psoriasis and psoriatic artritis. J Am Acad Dermatol, 2008, 58 (5), p. 826-850.
27. ORMEROD, A. Assessing the long-term safety of biologics for psoriasis. Dermatol Practice, 2008, 16 (1), p.8-11.
28. PALLER, AS. et al. Etanercept treatment for children and adolescents with plaque psoriasis. N Engl J Med, 2008, 358, p. 241-251.
29. PEARCE, DJ., FELDMAN, SR. Update on infliximab: an intravenous biologic therapy for psoriasis. Expert Res Dermatol, 2007, 2(6), p. 707-713.
30. RAZA, N. et al. Detection of subclinical joint involvement in psoriasis with bone scintigraphy and its response to oral methotrexate. Clin Exp Dermatol, 2008, 33 (1), p. 70-73.
31. ROSMARIN, D. et al.: Patch testing a patient with allergic contact hand dermatitis who is taking infliximab. J Am Acad Dermatol. 2008 (May 9) – on line early.
32. SAAD, AA., SYMMONS, DP., NOYCE, PR. et al. Risks and benefits of tumor necrosis factor-alpha inhibitors in the management of psoriatic arthritis: systematic review and metaanalysis of randomized controlled trials. J Rheumatol, 2008 (Mar 15) - v tisku.
33. SEURAT, J. et al. Champion phase III trial results: Adalimumab efficiacy and safety compared with methotrexate and placebo in patients moderate to severe psoriasis. Poster P035.165 na 16. kongresu EADV Vídeň 2007.
34. SHELLING, ML., FEDERMAN, DG., PRODANOVICH, S. et al. Psoriasis and vascular disease: an unsolved mystery. Am J Med, 2008, 121 (5), p. 360-365.
35. SOMMER, DM., JENISCH, S., SUCHAN, M. et al. Increased prevalence of the metabolic syndrome in patients with moderate to severe psoriasis. Arch Dermatol Res, 2007, 298 (7), p. 321-8.
36. STERRY, W., STROBER, BE., MENTER, A. Obesity in psoriasis: the metabolic, clinical and therapeutic implications. Report of an interdisciplinary conference and review. Br J Dermatol, 2007, 157 (4), p. 649-655.
37. STINGL et al. Raptiva: Pan-Europen Experience in psoriasis patients. Br J Dermatol, 2007, 150, Suppl. 2, p. 1-29.
38. ŠTORK, J. Systémová léčba psoriázy – kvantitativní výzkum mezi dermatology. Čs Derm, 2007, 82 (6) s. 352-5.
39. TZU, J. KERDEL, F. From conventional to cutting edge: the new era of biologics in treatment of psoriasis. Dermatol Ther, 2008, 21, p. 131-141.
40. VAN DE KERKHOF, P. Etanercept 50 mg once weekly is effective and well tolerated in patients with moderate to severe psoriasis. Poster na Fall Clinical Dermatology conference, October 2007, Las Vegas.
43. VANTUCHOVÁ, Y., SVOBODOVÁ, E. Naše zkušenosti s biologickou léčbou psoriázy. Referátový výběr z dermatovenerologie, 2008, Speciál I, s. 35-42.
44. VOOLENHOVEN, RF. Switching between anti-tumour necrosis factors: trying to get a nadle on a complex issue. Ann Rheum Dis, 2007, 66, p. 849-851.
46. WANG, Y.et al. Psoriasis is associated with increased levels of serum leptin. Br J Dermatol, 2008,158, p. 1134-35.
47. WAYNE, PG.: Importance of screening for comorbidities in psoriasis patients. Expert Rev Dermatol, 2008, 3 (2), p. 133-135.
48. WOLLINA, U. et al. Tumor necrosis factor-α inhibitor-induced psoriasis or psoriasiform exanthema: first 120 cases from the literature including a series of six new patients. Am J Clin Dermatol, 2008, 9 (1), p.1-14.
49. ZABA, LC., CARDINALE, I., GILLEAUDEA, P. et al. Amelioration of epidermal hyperplasia by TNF inhibition is associated with reduced Th17 responses. J Exp Med, 2007, 204 (13), p. 3183-3194.
50. Přednášky z 2. mezinárodního kongresu o psoriáze, Paříž, 21.-24.VI. 2007. JEADV 2007, 21, Suppl. 1, 69 s.
51. Přednášky z 66. Annual Meeting of American Academy of Dermatovenerology San Antonio, 1.-5. II. 2008.
Labels
Dermatology & STDs Paediatric dermatology & STDsArticle was published in
Czech-Slovak Dermatology

2008 Issue 4
-
All articles in this issue
- Newer Childhood Viral Exanthemas – Overview
- Patiens with Primary Lymphoedema Followed in the Lymphology Center of the Department of Dermatology of the 2nd Medical School and Bulovka University Hospital in the Years 2000–2006
- Update on the Psoriasis Treatment by Biologics and Standard Systemic Drugs
- Case Study of Patient with Blastic NK-cell Lymphoma also Termed CD4+/CD56+ Hematodermic Neoplasia or Early Plasmocytoid Leukaemia/ Dendritic Cell Lymphoma
- Czech Dermatovenereology at the Turn of the 19th to 20 th Century
- Czech-Slovak Dermatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Newer Childhood Viral Exanthemas – Overview
- Case Study of Patient with Blastic NK-cell Lymphoma also Termed CD4+/CD56+ Hematodermic Neoplasia or Early Plasmocytoid Leukaemia/ Dendritic Cell Lymphoma
- Update on the Psoriasis Treatment by Biologics and Standard Systemic Drugs
- Patiens with Primary Lymphoedema Followed in the Lymphology Center of the Department of Dermatology of the 2nd Medical School and Bulovka University Hospital in the Years 2000–2006
