Akutní a chronické rány – etiologie, rozdíly v hojení a léčba
Acute and Chronic Wounds – Etiology, Differences in Healing and Therapy
Recently, patients with various types of wounds – acute, chronic, complicated and non-healing get more publicity in dermatology and in other fields of medicine.
Wound is characterized by damage of skin surface continuity and organism integrity.
Chronic wounds usually arise in tissues trophically altered by previous disorders of vascular, mainly venous origin. Topical noxious impulses e.g. pressure or radiation represent another possible causes. Chronic wounds heal by new tissue formation (per secundam healing) with corresponding anatomical structure and that is why their reparation is usually long and individually influenced by origin and extent of damaged tissue.
Chronic wounds comprise leg ulcers, bedsores, ulcerating tumours and various wounds with postoperative healing or another complications.
This review deals with classification of wounds, differences in acute and chronic wound healing and last but not least with wound therapy. Article focuses on the most common chronic wounds in dermatology – leg ulcers.
Key words:
wounds – classification – healing - therapy
Authors:
A. Pospíšilová 1; M. Franců 2
Authors‘ workplace:
Dermatovenerologická klinika FN Brno a LF MU
přednostka prof. MUDr. Alena Pospíšilová, CSc.
1; Klinika popálenin a rekonstrukční chirurgie FN Brno a LF MU
přednosta prof. MUDr. Pavel Brychta, CSc.
2
Published in:
Čes-slov Derm, 83, 2008, No. 5, p. 232-244
Category:
Reviews (Continuing Medical Education)
Overview
V posledních letech se v dermatologii, ale i v jiných oborech dostávají do popředí zájmu také nemocní s různými typy ran – akutními, chronickými, komplikovanými a nezhojitelnými.
Pod pojmem rána se rozumí porušení kontinuity kožního povrchu a integrity organismu. Chronické rány vznikají většinou v troficky změněných tkáních předcházejícím onemocněním, nejčastěji cévního, hlavně žilního původu. Mohou vznikat také účinkem lokálně působících inzultů, např. tlakem, zářením apod. Chronické rány se hojí výstavbou nové tkáně (hojení „per secundam“) s odpovídající anatomickou strukturou, proto doba hojení je zpravidla dlouhá a individuálně podmíněná příčinou a rozsahem poškozené tkáně.
K chronickým ranám se řadí především bércové vředy, proleženiny (dekubity), dále nádory s vředovitým rozpadem a různé komplikovaně se hojící operační a jiné rány.
Předložený souhrnný článek pojednává o klasifikaci ran, o rozdílech v hojení akutních a chronických ran a v neposlední řadě o léčbě. Větší pozornost je věnována nejčastějším chronickým ranám v kožním lékařství – bércovým vředům.
Klíčová slova:
rány – dělení – hojení - léčba
Úvod
V posledních letech se v dermatologii, ale i v jiných oborech, dostávají do popředí zájmu také nemocní s různými typy ran – akutními, chronickými, komplikovanými a nezhojitelnými, které často představovaly „crux medicorum“. Zcela jistě se na této skutečnosti podílí nové léčebné prostředky a metody s ošetřováním ran spojenými. Léčba ran, zejména chronických, je založena na spolupráci lékařů a sester různých odborností, má mutidisciplinární a multiprofesní charakter.
Definice rány
Rána je obecně definována jako porušení kontinuity kožního povrchu a integrity organismu, porušení anatomické struktury a s ní související funkce kůže, způsobené různými příčinami.
Klasifikace ran
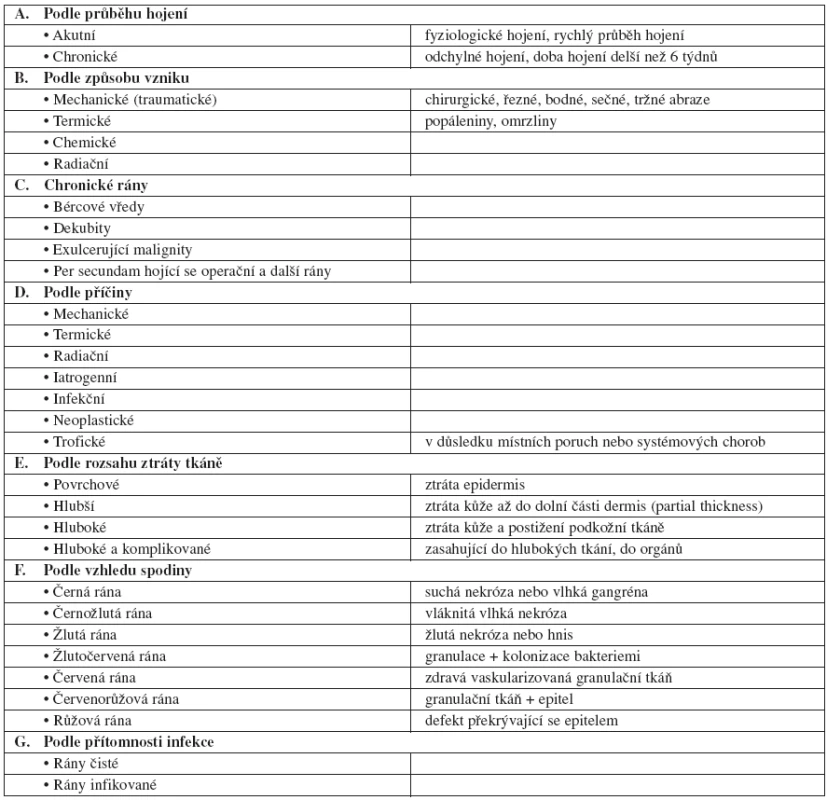
Rány lze klasifikovat různým způsobem, v některých případech může být rána hodnocena kombinací několika klasifikačních členění. Klasifikace ran vyplývá z jejich hodnocení, a proto se rány mohou dělit podle průběhu hojení, podle místa lokalizace, podle rozsahu ztráty tkáně, podle stáří, podle etiologie, popř. z dalších hledisek. Nutno však konstatovat, že neexistuje jednotné klasifikační schéma, podle kterého by se každá rána dala přesně zařadit (6, 18, 22, 24, 32, 36). Na základě prostudování různých literárních zdrojů, které se zabývají dělením ran, jsem si dovolila uvést následující klasifikaci ran z různých pohledů (tab. 1).
Základem klasifikace ran je dělení na rány akutní a chronické, které se od sebe zásadně liší průběhem hojení a většinou i způsobem vzniku.
Akutní rána je definována jako rána, která je výsledkem traumatu nebo operačního zásahu – incize, excize, s fyziologickým hojením v adekvátním časovém rozmezí, bez komplikací.
Chronická rána může vzniknout z jakékoliv rány akutní z místních příčin (přidruženou infekcí) nebo z příčin celkových. Nejčastěji je však výsledkem trofických tkáňových změn, na nichž se podílí současně několik faktorů. Chronická rána je definována jako rána, která má dobu potřebnou k hojení delší nežli 6 týdnů. Jiným způsobem vyjádření je chronická rána taková rána, u které je fyziologicky probíhající proces hojení v jednom nebo v několika místech narušen, neprobíhá v daném sledu a časovém rámci, formuje se méněcenná tkáň, případně dochází ke tvorbě nehojivého chronického defektu (4, 5). K chronickým ranám se řadí : bércové vředy, diabetické ulcerace, dekubity, exulcerující malignity, vaskulitidy ulcerózně se rozpadající, rozsáhlé popáleniny, amputační pahýly a ostatní per secundam se hojící rány.
Bércové vředy
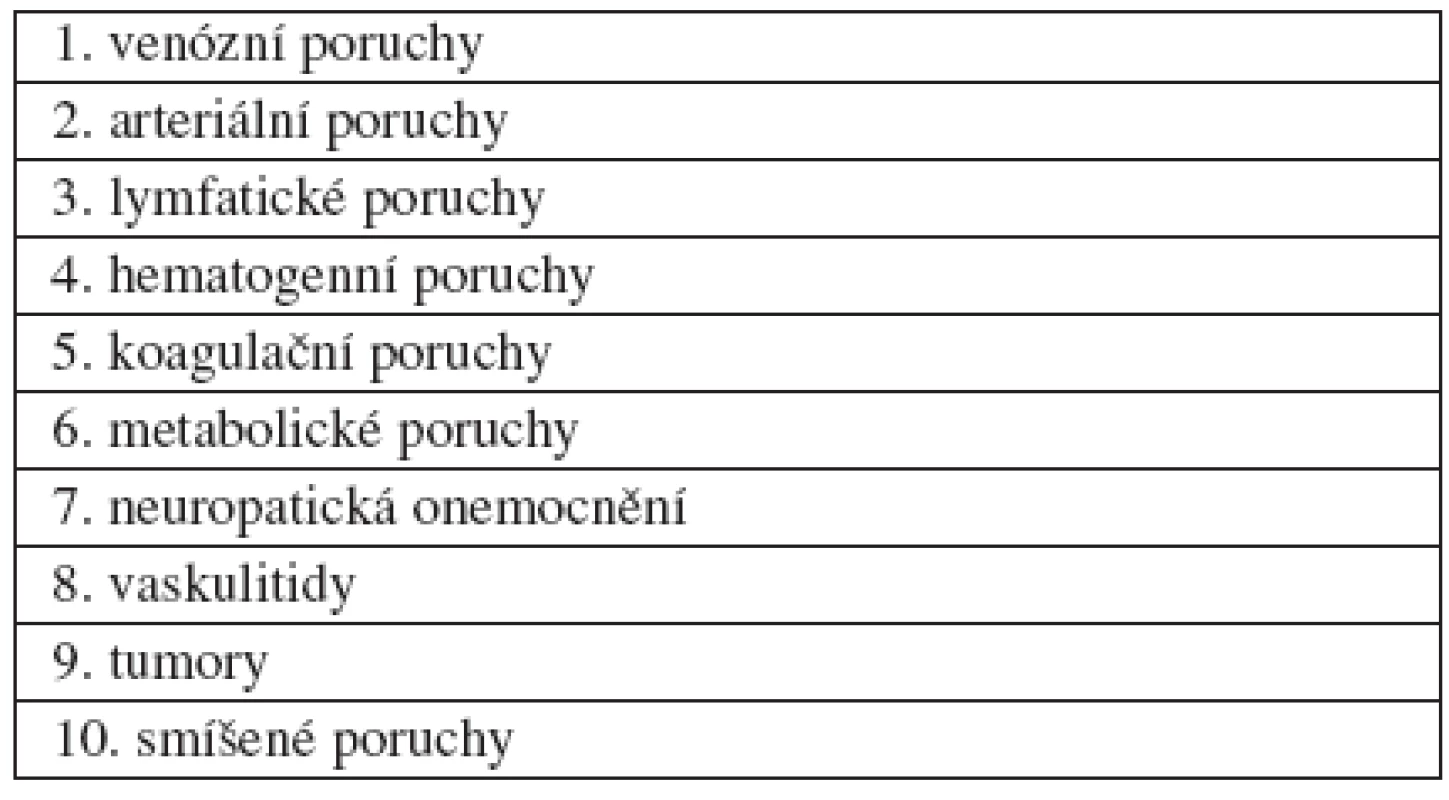
Nejčastějšími chronickými ranami, se kterými se setkáváme v oboru dermatovenerologie, jsou bércové vředy. Drtivá většina bércových vředů je podmíněna venózní insuficiencí, nicméně existuje i řada možností jiné etiologie. Diferenciace etiologických faktorů je nesmírně důležitá, neboť mnohdy zcela odlišné mechanismy mohou vyvolávat velmi podobné morfologické změny. Vzhledem k tomu bylo navrženo již mnoho klasifikačních schémat bércových vředů. Podobně jako při klasifikaci ran, i v tomto případě, žádné klasifikační schéma není úplné a obecně akceptovatelné, protože žádná klasifikace nemůže být tak dokonalá, aby postihla celý symptomový a problémový komplex, kterým bércové vředy jsou (18, 21, 22, 24, 26, 28, 32, 33).
Některé jednotky lze totiž současně zařadit do několika skupin. Na základě literárních poznatků je zde nastíněna jedna z možných klasifikací (tab. 2, 3).

Zevní příčiny
1. Ulcerace způsobené fyzikálními vlivy
Ulcerace posttraumatické vznikají následkem komplikovaných zlomenin dolních končetin při sportech, dopravních nehodách nebo při náhodném poranění. Bývají obvykle spojeny s větší ztrátou tkání, s nekrózou tkáně poraněné nebo zhmožděné a jsou provázeny příznaky infekce vzniklé při kontaminaci (obr. 1).
Ulcerace po radiační terapii. Chronické poradiační ulcerace se objevují po prolongované léčbě zářením v místech atrofické jizevnaté kůže popisované u radiodermatitdy. Většinou jsou nebolestivé s pomalým hojením.
Ulcerace z tepelných příčin. Ulcerace termického původu jsou projevem III. a IV. stupně popálenin. Vznikají po odloučení ulpívajících černohnědých příškvarůa kopírují původní rozsah nekróz.
Ulcerace chladového původu. Špatně hojivé ulcerace při omrzlinách III. stupně postihují většinou akrální části končetin. Na rozdíl od ulcerací předcházejících se objevují až po určité době latence.
Ulcerace tlakové – dekubitální – dekubity. Ulcerace tlakové vznikají v místech vystavených zvýšenému tlaku, většinou nad kostními výběžky. Na podkladě lokální ischémie kůže, podkožních tkání, event. svalů, vzniknou v zarudlých okrscích nekrotické příškvary, které se záhy přemění v ulcerující defekty. Při jejich vzniku obvykle spolupůsobí vnitřní faktory.
Podle stupně postižení kůže a podkoží se rozlišují čtyři stadia dekubitů:
- I. stadium: zarudnutí intaktní kůže – reverzibilní.
- II. stadium: tvorba puchýřů, erozí při ztrátě epidermis a mělkých vředů při porušení horní části dermis. Okolní kůže je zbarvena červenofialově. I tato fáze je reverzibilní.
- III. stadium: ztráta kůže v plné tloušťce včetně podkoží až po fascii.
- IV. stadium: rozsáhlá nekróza postihující kromě kůže i svaly, popř. kosti, klouby a jiné orgány (9).
2. Ulcerace z chemických příčin
K chemickým příčinám, které mohou výrazně poškodit kůži až vzniknou ulcerace, patří kyseliny, louhy, umělá hnojiva, rostlinné extrakty, dezinfekční prostředky a léky. V místě kontaktu s chemikálií nastupuje po předcházejícím zánětu nekróza, podle charakteru chemikálie kolikvační nebo koagulační. Kolikvační nekrózu způsobují koncentrované alkálie. Příškvary vzniklé jejich poleptáním jsou měkké, vzniklé ulcerace s neostře ohraničenými okraji. Naopak kyseliny způsobují koagulační nekrózu a vytvářejí příškvary tuhé, ostře ohraničené.
3. Ulcerace infekčního původu
Mezi onemocnění, která mohou vyústit v bércový vřed, patří např. erysipel, osteomyelitida, tuberkulóza, hluboké a vzácné mykózy, diftérie, lepra, leishmanióza, syfilis III. stadia, herpes zoster gangraenosum, event. další.
Erysipel – patří k nečastějším infekčním onemocněním, jejichž důsledkem mohou být bércové vředy. Akutní zánět kůže a podkoží se za určitých okolností může šířit krevními a lymfatickými cestami hluboko do tkání podkožních. Následně se zde vytváří nekróza spojená s tkáňovým rozpadem za vzniku rozsáhlých, špatně se hojících ulcerací (fasciitis necroticans) (obr. 2).
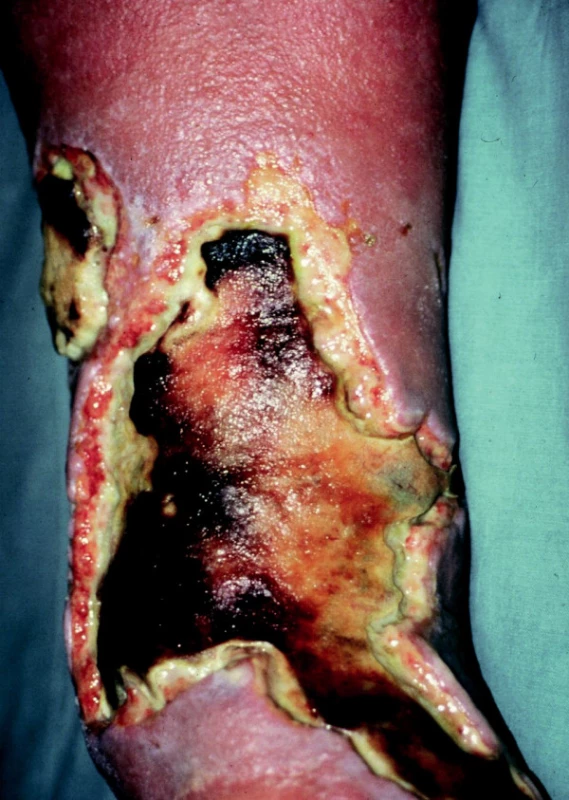
Erythema indurativum Bazin – je dalším exulcerujícím onemocněním. Začíná nebolestivými, bronzově zbarvenými uzly s tendencí k rozpadu. Ulcerace mají hnisavě povleklou spodinu a hladké okraje.
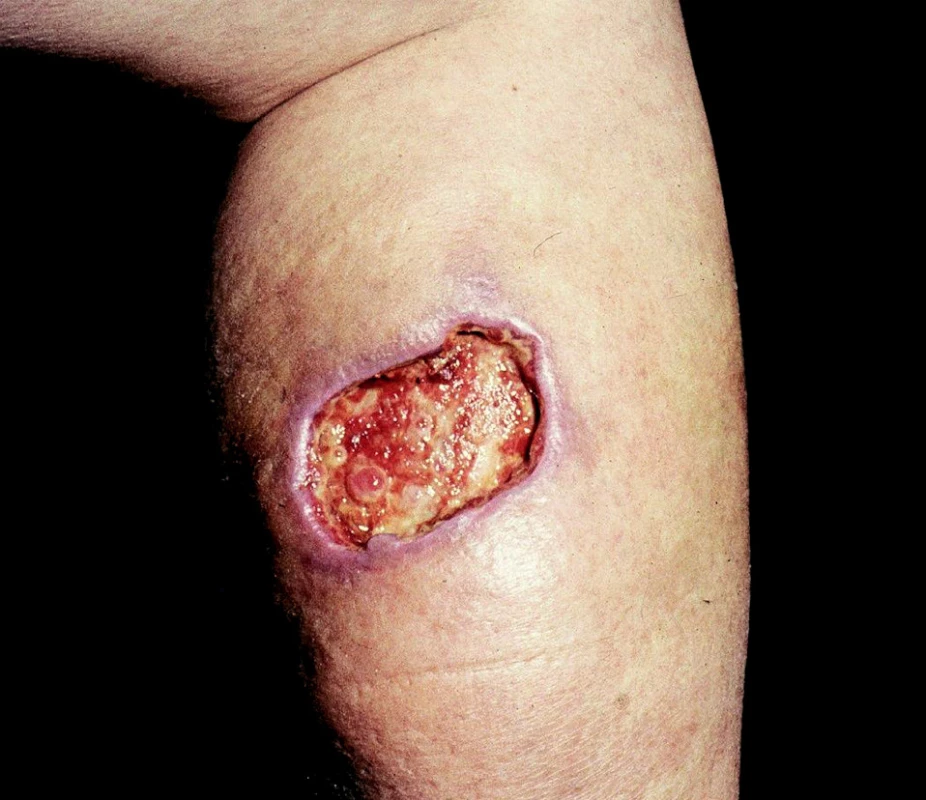
4. Ulcerace arteficiální
Arteficiální ulcerace se vyskytují na kterémkoliv místě těla, dolní končetiny nevyjímaje. Poškozující příčinou jsou látky chemické, které kůži poleptají, nebo účinky fyzikální, nejčastěji vysoké teploty (např. popálení cigaretou). Nápadným znakem takto navozených bércových vředů je zdravé a nepostižené okolí (obr. 3).
Vnitřní příčiny
1. Ulcerace venózní
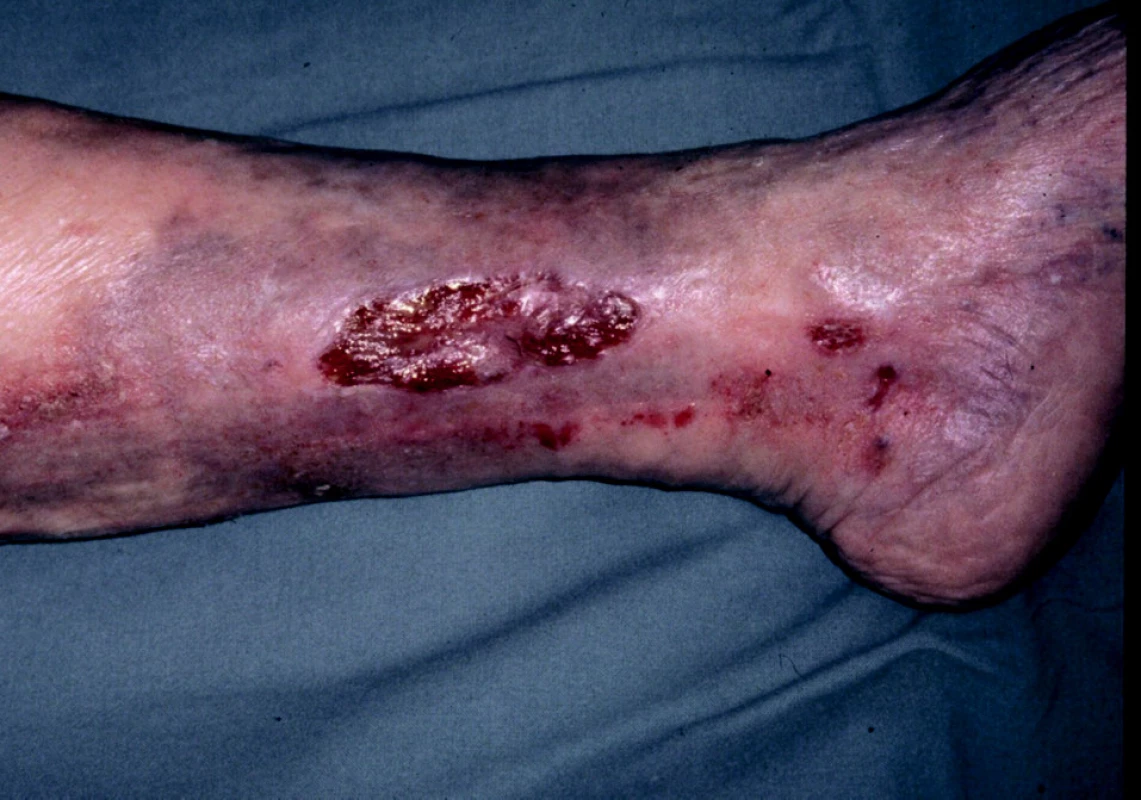
Bércový vřed žilního původu je výsledkem poruch látkové přeměny v kůži a podkoží na podkladě chronické žilní nedostatečnosti při primárních varixech nebo u posttrombotického syndromu.
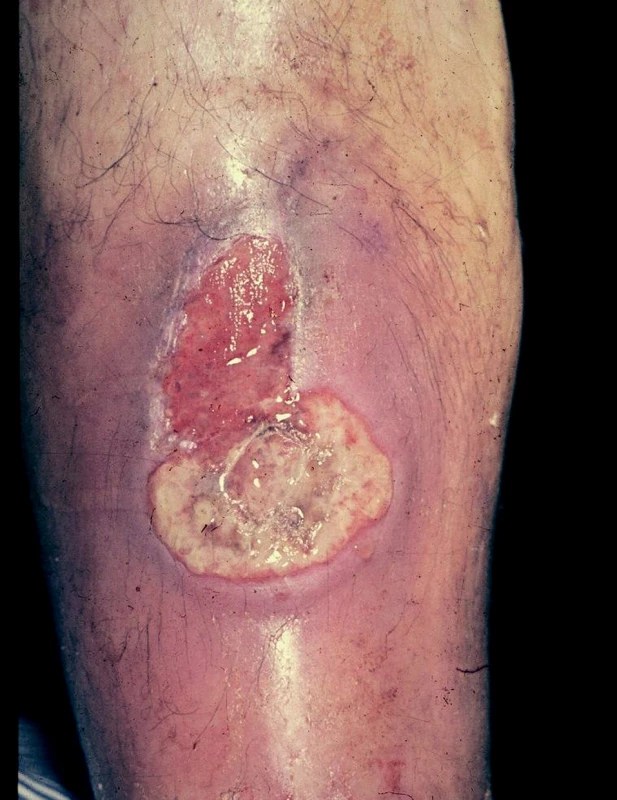
Bércové vředy při primárních varixech jsou obvykle menší, mají mělkou spodinu, hladké okraje, často jsou vícečetné. Vyskytují se většinou v dolní třetině bérce, často v krajině vnitřního kotníku, v místech insuficientních Cockettových perforátorů. Na postižené končetině jsou patrny různě vinuté, modravě prosvítající žíly a kožní změny způsobené žilní stázou (obr. 4).
Bércové vředy posttrombotické bývají hluboké, rozsáhlé, často cirkulární s podminovanými okraji, s povleklou a výrazně exsudativní spodinou. Kožní změny v okolí jsou výraznější, zejména otok, který se záhy mění v tuhý – skleredém. Posttrombotické ulcerace se rovněž vyskytují ponejvíce v dolní třetině bérce, v oblasti, která se označuje jako „kamašovitá” zóna.
Bércové vředy žilního původu patří k nejčastějším. V etiologickém spektru představují 57–85 % z celkového spektra ulcerací.
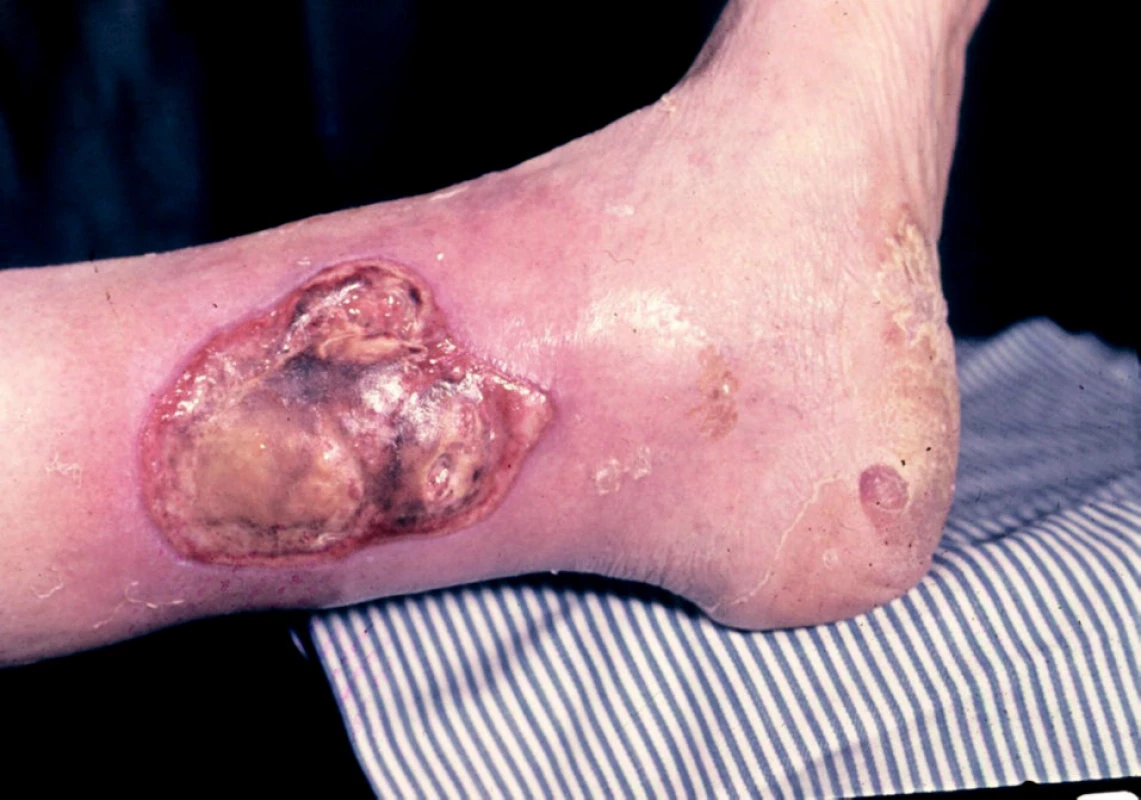
2. Ulcerace arteriální
Arteriosclerosis obliterans je příčinou vzniku ulcerací v důsledku parciálního nebo úplného arteriálního uzávěru. Rozsah cévních změn podmiňuje velikost a rychlost šíření ulcerace. Ulcerace arteriální jsou většinou kruhovitého tvaru a kromě lokalizace na předních, mediálních a laterálních stranách bérců se vyskytují také na nártech, prstech a patách. Jsou značně bolestivé, zejména ve vodorovné poloze nohou. Arteriální uzávěr se v postižené oblasti projeví na kůži nejdříve černohnědou nekrózou, po jejímž odloučení se vytvoří ulcerace (obr. 5).
Trombangiitis obliterans Bürger je chronické zánětlivé onemocnění arteriálního a venózního systému dolních končetin, které vede ke gangrénám, nekrózám a ulceracím na prstech nohou, na nártech a na dolních částech bérce. Tyto progresivně postupující změny jsou častou příčinou amputace končetiny.
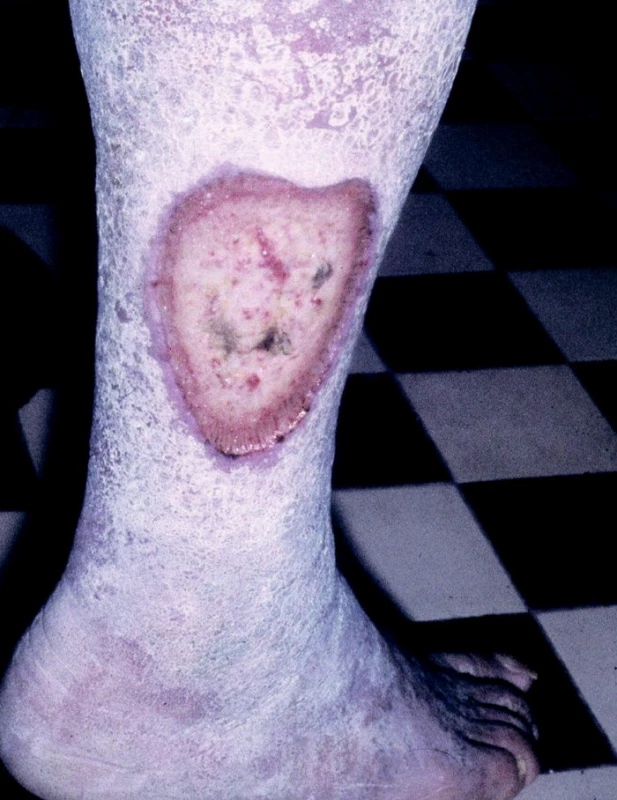
Ulcus cruris hypertonicum (Martorell) je dalším typem bércového vředu cévního původu u osob s vysokým krevním tlakem. Příčinou tkáňového rozpadu jsou degenerativní změny cévní stěny a její zbytnění. Bývá obvykle lokalizován na zevní nebo přední straně bérce (obr. 6).
3. Ulcerace lymfatické
Primární a sekundární lymfedém dolních končetin se manifestuje rozsáhlými otoky. Měkké otoky se postupně mění v tuhé, fibrotické, s hyperkeratotickými projevy a verukózním bujením. Pestrý klinický obraz kožních změn vzniklých na podkladě lymfostázy doplňuje lymforea. Následkem porušené trofiky tkáně dochází k tvorbě rozsáhlých ulcerací se silnou sekrecí.
4. Ulcerace hematopatogenní
Ulcerace hematopatogeního původu jsou spojeny s poruchami krevních elementů – erytrocytů, leukocytů, trombocytů a plazmatických bílkovin. Mezi hlavní příčiny patří:
Anémie – srpkovitá, sideroblastická, sférocytóza, thalasémie, hemolytická, hypochromní – které jsou příčinou snížené difuze kyslíku buněčným tkáním. Bércové vředy vznikají spontánně, většinou v krajinách kotníků, a vyznačují se silnou bolestí.
Myeloproliferativní onemocnění – polycythaemia vera a trombocytémie – jsou spojeny s vysokými hodnotami krevních elementů. U těchto onemocnění se vysvětluje vznik ulcerací trombózami v arteriálním a venózním řečišti. Proto mají často charakter ulcerací posttrombotických nebo periferního uzávěru.
Dysproteinémie – makroglobulinémie, mikroglobulinémie, kryoglobulinémie – jsou patologické stavy, které mohou být provázeny mnohočetnými ulceracemi na bércích.
Trombocytopenická purpuramůže být rovněž následována tkáňovým rozpadem.
5. Ulcerace při poruchách koagulace (hemostazeologické)
Poruchy koagulace jsou uváděny mezi příčinami bércového vředu teprve v posledních letech. Narušení rovnováhy mezi cévním endotelem a vnitřní hemostázou vede k závažným změnám v systému srážení krve, k poruchám difúze a látkové přeměny, z čehož rezultují trofické změny podmiňující vznik bércového vředu.
Nedostatek proteinu C(APC) blokuje srážlivé faktory Va a VII a vede k arteriálním a venózním trombózách s následnou tvorbou ulcerací.
Nedostatek proteinu S, který je kofaktorem proteinu C, rovněž souvisí se sklonem k trombózám a k ulceracím tohoto původu.
APC-rezistence je příčinou recidivujících flebotrombóz se všemi důsledky.
Nedostatek AT III (antitrombin III) je spojován stejně jako v předcházejících případech se zvýšeným sklonem k flebotrombózách a postflebitickým ulceracím.
Hyperhomocysteinémie je patologický stav, u kterého dochází k častým trombózám a arteriálním emboliím. Bércové vředy vznikají následkem periferního uzávěru nebo posttrombotických změn.
6. Ulcerace při metabolických onemocněních
Mezi metabolické příčiny, které mohou indukovat lokální nekrózu nebo zvýšit fragilitu kůže, patří především diabetes mellitus, dále kumulace látek syntetizovaných v organismu, jako jsou např. kyselina močová, amyloid, soli kalcia a metabolizované cizí látky, např. léky.
Diabetické ulcerace. Příčinou ulcerací u diabetu mohou být cévní změny postihující jak velké, tak i malé cévy, dále diabetická neuropatie, necrobiosis lipoidica a infekce. Velké cévy bývají u diabetu postiženy aterosklerózou a mediokalcinózou. Ulcerace při diabetické makroangiopatii bývají vícečetné, okrouhlého tvaru, s nekrotickou spodinou a s hladkými okraji. Další příčinou ulcerací u pacientů diabetiků bývá mikroangiopatie postihující nejmenší cévy kůže. Při jejich vzniku se uplatňuje řada metabolických změn, které se sníženým průtokem krve nutričními kapilárami a mikroembolizací vedou ke tkáňové ischémii a tvorbě menších ulcerací.
Necrobiosis lipoidica diabeticorum vytváří na kůži bérce bronzově zbarvená, nepravidelně tvarovaná ložiska s atrofickou kůží, často se ulcerózně rozpadající (obr. 7).
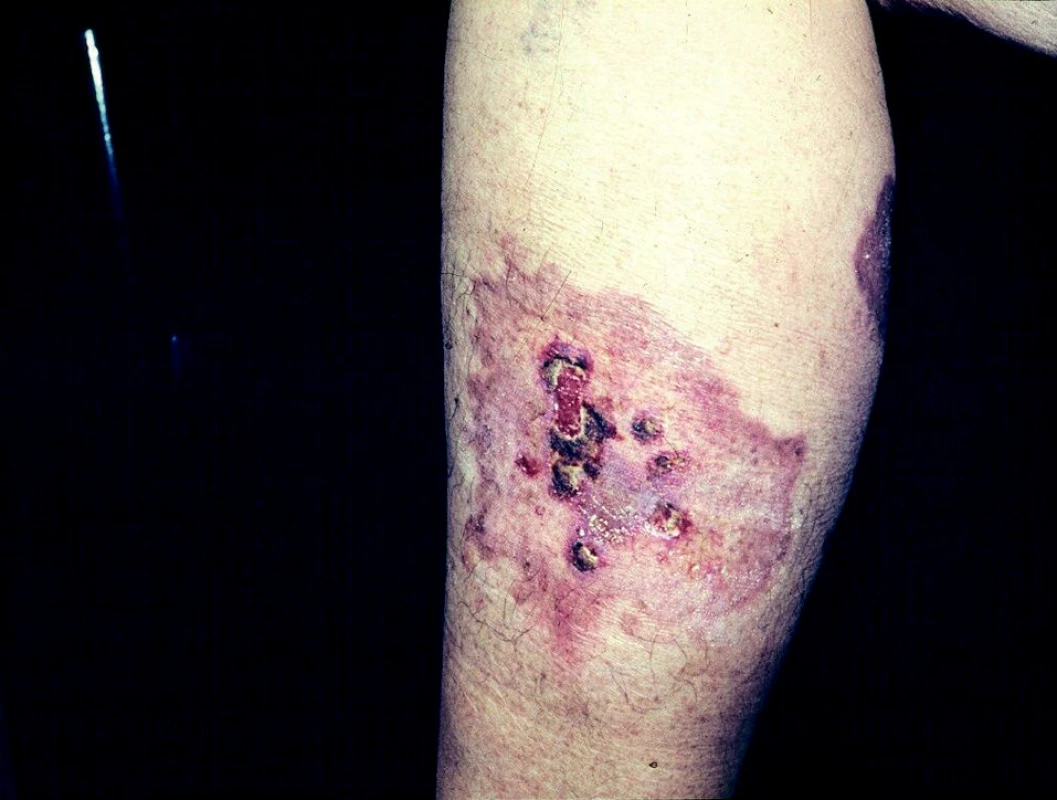
Ulcerace při amyloidóze vznikají rozpadem amyloidních uzlů na exponovaných místech.
Ulcerace při arthritis urica se vyskytují ponejvíce na patách a na prstech, zvláště na palcích. V kůži uložené urátové uzly se rozpadají v drobné, silně bolestivé ulcerace.
7. Ulcerace neuropatické
Neuropatické ulcerace jsou ostře ohraničené defekty s čistou spodinou, často nad kostními prominencemi. Většinou jsou nebolestivé. Objevují se u diabetické neuropatie, u sclerosis multiplex, u syringomyelie, u hereditární neuropatie, u polyneuropatie, u alkoholické neuropatie, u tabes dorsalis, u lepry, při nedostatku thiaminu. Podstatou jejich vzniku je porucha vazomotorické regulace.
Diabetická neuropatie je podmíněna periferní senzomotorickou polyneuropatií a autonomní senzomotorickou neuropatií. Kombinací těchto poruch vznikají nejčastěji nad hlavicí I. metatarzu nebolestivé ulcerace s hyperkeratotickým okrajem (obr. 8).
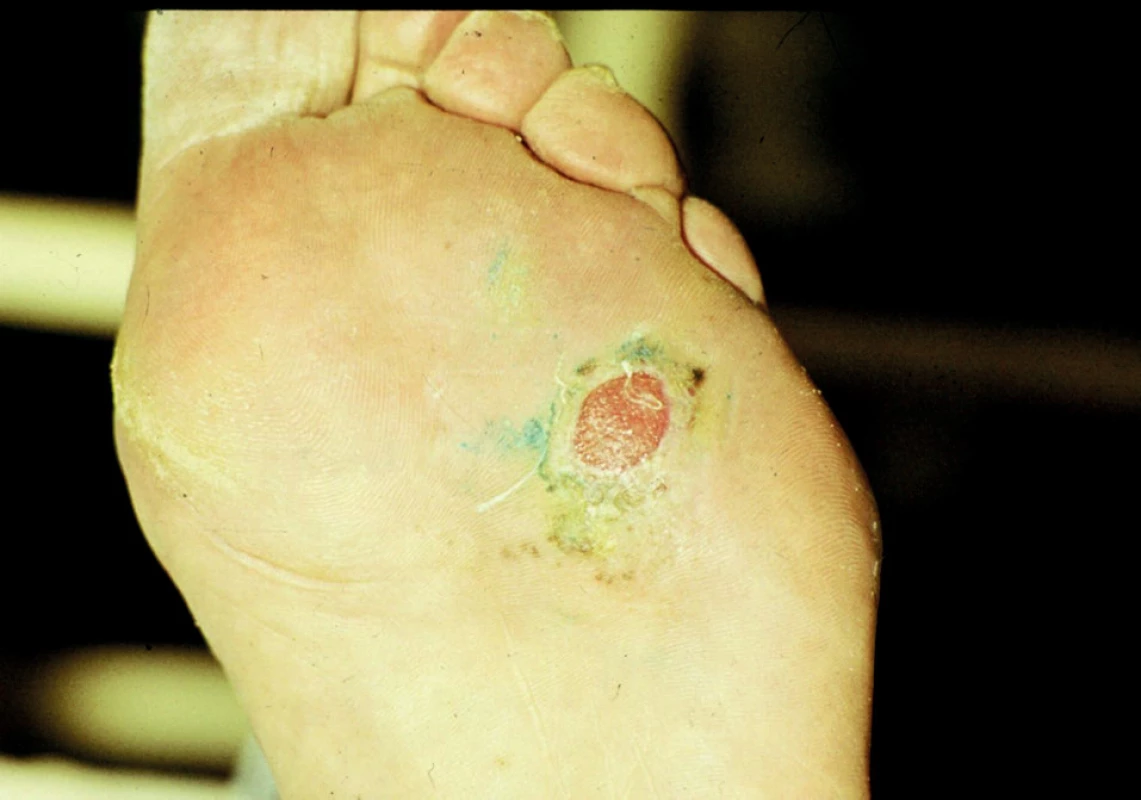
8. Ulcerující vaskulitidy
Vaskulitida je zánět cév, který může vést k ischémii a nekróze tkání. Zánětem mohou být postiženy velké, malé i střední cévy. V začátku onemocnění vždy dominuje v jejich klinickém obraze nekróza s červenofialovým okrajem.
Ulcerující vaskulitidy mohou být způsobeny léky, infekcí, potravinami, dále mohou provázet maligní onemocnění (leukémie), objevují se u livedo reticularis, u periarteriitis nodosa, u polyarteriitis nodosa, u kryoglobulinémie, u antifosfolipidového syndromu, u pyoderma gangraenosum, u Wegenerovy granulomatózy a u systémových onemocnění.
Pyoderma gangraenosum začíná jedním nebo více zánětlivými ložisky černé barvy, s četnými pustulami nejčastěji na dolních končetinách. Tato ložiska splývají a tvoří plošně se rozšiřující ulcerace s nekrotickou spodinou a tmavočervenými podminovanými okraji (obr. 9).
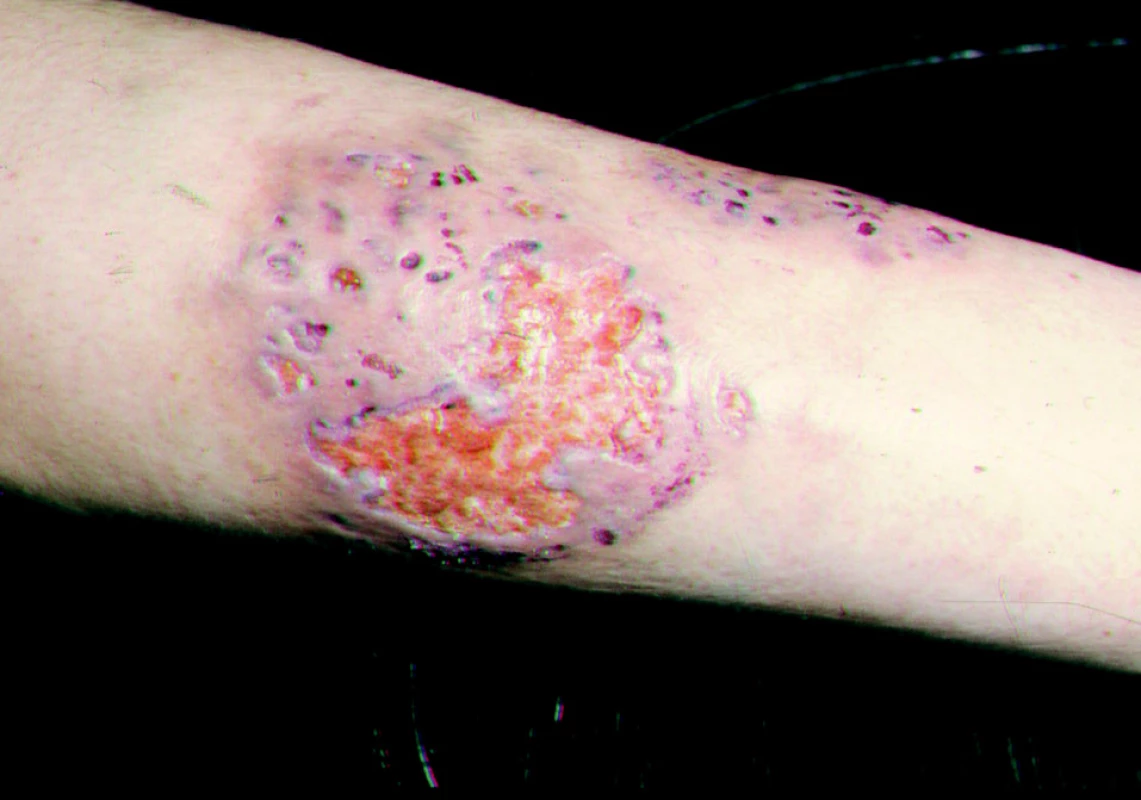
Polyarteriitis nodosa má velmi variabilní kožní obraz. Jedním z projevů je livedo racemosa s ulceracemi.
9. Ulcerující tumory
Jednou z příčin bércového vředu je rozpad tumoru. K nejčastějším nádorům, které vyúsťují v ulcerace patří: bazaliom, spinaliom, melanom, Kaposiho sarkom, angiosarkom, mycosis fungoides, metastázy vnitřních malignit do kůže. Na nádorovou příčinu onemocnění je třeba pomýšlet u nehojivých, na obvyklou léčbu nereagujících ulcerací (obr. 10).
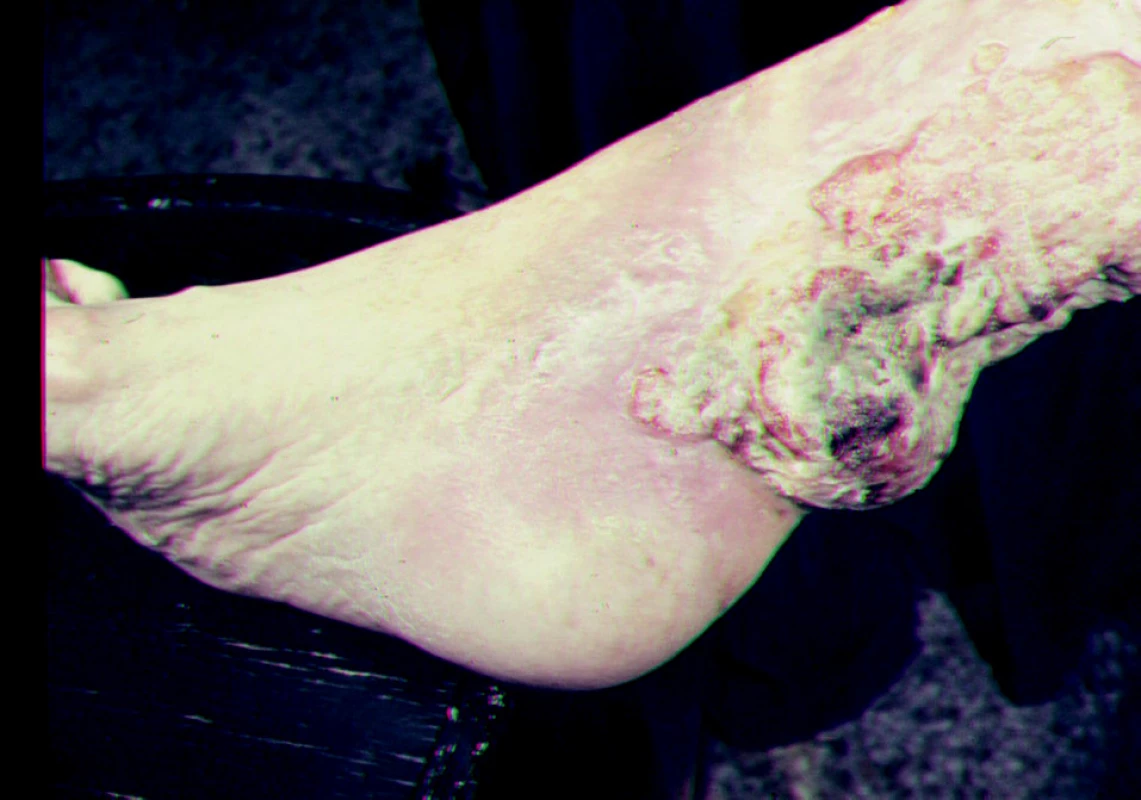
10. Ulcerace smíšené
Bércové vředy mohou být způsobeny kombinací dvou nebo více příčin. Nejčastější kombinací jsou však smíšené ulcerace arteriální a venózní příčiny.
Z výše uvedeného přehledu je patrno, že bércový vřed může mít rozmanité příčiny, často smíšené, a proto právem bývá označován jako polyetiologický syndrom.
Hojení ran
Hojení je proces, který vede k obnově poškozené tkáně a ke kompletnímu uzavření kožního povrchu (20).
Již od dob řeckého lékaře Galena se rozlišuje hojení ran „per primam intentionem“ a „per secundam intentionem“. Toto dělení má především kvantitativní a prognostický význam, neboť při sekundárním hojení se musí vybudovat nová, náhradní tkáň.
Příkladem hojení per primam je hojení ran chirurgických či jiných řezných ran, jejichž hladké okraje se při těsném přiložení k sobě uzavírají stehem, svorkami či jiným způsobem. Jiným příkladem jsou rány povrchové, kde došlo k minimálnímu poškození tkáně. Jde tedy o rány akutní, většinou způsobené mechanicky, bez přidružené infekce.
Rány, u kterých došlo k větším ztrátám nebo destrukcím tkáně, dále rány, které jsou komplikovány infekcí, popř. přítomností cizího tělesa, se hojí per secundam. V takovém případě jde o rány chronické s poruchou tkáňové trofiky, často komplikované infekcí. Proces hojení je podstatně delší, mnohdy z různých důvodů lokálního nebo systémového charakteru, stagnující.
V posledních třech desetiletích byla řada vědecko-výzkumných prací zaměřena na proces hojení, který byl studován na molekulární a biologické úrovni. Většina těchto studií, které vedly k rozšíření vědomostí a znalostí o procesu hojení, byla orientována na fyziologické hojení, které lze pozorovat u akutních ran. Na základě těchto poznatků pak byly studovány biochemické rozdíly v molekulárním prostředí a odchylky v hojení u ran chronických.
Hojení fyziologické
Proces hojení začíná v okamžiku porušení integrity kožního povrchu a probíhá ve třech časově se překrývajících fázích, které se označují jako: 1. fáze exsudativní, 2. fáze proliferační a 3. fáze reepitelizační, remodelační. Každá fáze je charakterizována specifickými buněčnými a biochemickými pochody, které probíhají v určitém sledu (10, 11, 14, 31).
1. Fáze exsudativní (zánětlivá, inflamační)
Cílem zánětlivé reakce je ránu vyčistit a vytvořit předpoklady pro následující fázi proliferační. Tato fáze začíná u akutních ran v okamžiku poranění a za fyziologických podmínek trvá přibližně 4 dny.
Prvním krokem reparačních procesů je zastavení krvácení. Z poškozených buněk jsou uvolňovány vazoaktivní substance, které vedou k vazokonstrikci, a tím zabrání větším ztrátám krve, dokud se agregací trombocytů nevytvoří první cévní uzávěr. Trombocyty jsou v této fázi klíčovými buňkami také proto, že secernují některé významné cytokiny včetně růstových faktorů, jako je např. PDGF (destičkově derivovaný faktor), který se uplatňuje i v dalších fázích hojení, IGF-1 (insulin-like růstový faktor-1), EGF (epidermální růstový faktor), TGF-β (transformační růstový faktor), TGF-α, VEGF (vaskulární endotelový faktor a další látky podporující zánět – histamin, serotonin, bradykinin, prostaglandiny, tromboxan aj. (31).
Vazokonstrikci po několika minutách střídá vazodilatace se zvýšenou permeabilitou cév, při které nastává zesílená exsudace krevní plazmy do intersticia a současně dochází k migraci neutrofilů a makrofágů do místa rány, kde fagocytují buněčný detritus, cizorodý materiál a choroboplodné zárodky. V iniciální fázi zánětu jsou dominantními buňkami neutrofilní granulocyty, které uvolňují mediátory zánětu – cytokiny, jako jsou TNF-α a IL-1, fagocytují bakterie a secernují proteázy, které se podílejí na odstranění devitalizované tkáně. Z ostatních leukocytů, zejména Th buňky jsou zdrojem cytokinu IL-2. Zásadní význam pro hojení rány mají makrofágy, které jsou chemotakticky přitahovány do místa rány o něco málo později nežli granulocyty. Uvolňují proteolytické enzymy, které rozvolňují poškozenou tkáň, pokračují ve fagocytární činnosti, secernují růstové faktory (b-FGF, EGF, TGF-α a TGF-β) a další cytokiny, podporující zánětlivý proces (IL-1a a IL-1b, IL-6 a TNF-α). Růstové faktory stimulují a regulují migraci a proliferaci buněk potřebných k novotvorbě vaskularizované tkáně. Exsudativní fáze hraje významnou roli v procesu hojení, kterou nelze obejít.
2. Fáze proliferační
V této fázi se tvoří nová granulační tkáň protkaná cévami. Velkou úlohu zde opět sehrávají cytokiny a růstové faktory b-FGF, TGF-β, VEGF a PDGF, které stimulují fibroblasty a buňky cévního endotelu. Fibroblasty migrují z okrajů rány do provizorní matrix, kde syntetizují glykosaminoglykany a proteoglykany, tvoří novou extracelulární matrix granulační tkáně a kolagen. Počet makrofágů v ráně klesá a produkci růstových faktorů přejímají fibroblasty, které kromě již jmenovaných faktorů secernují IGF-1a (insulin-like růstový faktor) a KGF (keratinocytový růstový faktor). Fibroblasty se stávají v této fázi hojení dominantními buňkami, jejich počet dosahuje vrcholu 7.–14. den, pak nastává jejich transformace do kolagenních fibril (31). Ačkoliv jsou fibroblasty považovány obvykle za jednotný buněčný typ, pro proces hojení rány je důležité, že se ve své funkci liší.
Souběžně s tvorbou vaziva začíná z intaktních krevních cév na okraji rány proces neovaskularizace. Endotelové buňky, které tvoří výstelku cév, aktivovány růstovými faktory, zejména VEGF, b-FGF a TGF-β migrují do oblasti rány. Buněčným dělením se zde vytvoří trubkovité útvary, které se navzájem spojují v kapilární klubíčka, ta se dále větví a vyúsťují do větších cév (11). Takto vytvořená vaskularizovaná granulační tkáň slouží jako „lůžko“ pro následnou epitelizaci.
3. Fáze epitelizační, remodelační
Tato fáze zahrnuje migraci, proliferaci a diferenciaci buněk za podpory růstových faktorů a vyzrávání kolagenních vláken. Buňky bazální vrstvy, které mají obrovský mitotický potenciál, stimulovány EGF, KGF a TGF-α, migrují k povrchu kůže a současně se přibližují amébovým pohybem od okrajů rány směrem do středu. V této fázi hojení sehrávají významnou roli proteolytické enzymy – matrix metaloproteinázy (MMPs), secernovány epitelovými buňkami. Ve finální fázi dochází k diferenciaci buněk, k definitivní přestavbě epidermis s jednotlivými vrstvami a funkcemi. Diferenciaci a keratinizaci epidermálních buněk urychluje především TGF-β.
Paralelně s tímto procesem probíhají strukturální změny ve škáře a původní rána se mění v jizevnatou tkáň. Granulační tkáň involuje, počet kapilár se redukuje agregací do větších cév, fibroblasty se diferencují v myofibroblasty a rána se začíná kontrahovat. Změny se týkají také kolagenu, kolagen III se mění na kolagen I, který se tak stává hlavním vazivovým kolagenem kožní tkáně. Tato tkáň je méně pružná nežli tkáň nepoškozená, označovaná jako riziková (11,15).
Hojení chronických ran
V důsledku příčiny, resp. příčin, které se na vzniku rány podílejí, hojení chronických ran neprobíhá přesně podle uvedeného třífázového, časově limitovaného schématu. Hojení chronických ran je nekoordinované, některé fáze jsou prodlouženy, zejména fáze inflamační a proliferační (14).
V každé fázi hojení ran sehrávají klíčovou roli cytokiny, růstové faktory, proteázy a endokrinní hormony, jejichž rovnováha, regulační a stimulační funkce u chronických ran je porušena (10,11). Za účelem podrobnějšího zjištění rozdílu v hojení byla řada vědecko-výzkumných prací zaměřena na analýzu molekulárního a buněčného prostředí u akutních a chronických ran (15) (graf 1).

Porovnáním exsudátu z akutních a z chronických ran bylo zjištěno, že v molekulárním prostředí chronických ran mají buňky sníženou mitotickou aktivitu. Další sledování prokázala, že exsudát z akutní rány stimuluje syntézu DNA a tím proliferaci buněk, sekret z chronické rány nikoliv (15).
Jiné srovnávací práce potvrdily, že v exsudátu z chronických ran je zvýšená hladina zánětlivých cytokinů a snížená hladina jejich inhibitorů. U ulcerací žilní etiologie bez známek hojení jsou zvýšeny hodnoty zejména TNF-α, IL-1 a IL-6 cytokinů, které se v průběhu hojení postupně snižují (13).
Další studie zaměřeny na analýzu proteázové aktivity v exsudátu z akutních a chronických ran potvrdily, že proteázová aktivita u chronických ran je podstatně vyšší než u ran akutních (38). Exsudát z ulcerací žilního původu vykazoval zvýšenou hladinu MMP-2 a MMP-9, a sníženou hladinu TIMP-1 (inhibitorů MMP-1) při srovnání s hodnotami u ran akutních. U dekubitálních defektů byly zvýšeny zejména MMP-8 a MMP-2, které se pokládají za hlavní faktor tkáňové destrukce. Zvýšená proteázová aktivita je jednou ze závažných příčin špatného hojení chronických ulcerací.
U chronických ran byly také sledovány biologické rozdíly reakce některých buněk na růstové faktory. Zjistilo se, že fibroblasty u chronických ran nejsou schopny reagovat na růstové faktory jako tytéž buňky u ran akutních, což se projevuje sníženou migrací a proliferací těchto buněk. Fibroblasty chronických ran mají také sníženou schopnost dělení, která vede k tomu, že v perzistujících ulceracích převažují fibroblasty stárnoucí se sníženou denzitou (14).
Faktory ovlivňující hojení
Hojení rány vyžaduje velkou buněčnou a tkáňovou regenerační schopnost a současně reparační schopnost celého organismu. Může být nepříznivě ovlivněno četnými lokálními faktory a celkovým stavem organismu.
1. Systémové faktory
Systémové faktory vycházejí z celkového stavu organismu, přidružených chorob a jejich léčby. Tyto faktory je třeba při léčbě ran, zejména chronických, kompenzovat, případně eliminovat (7).
Základní příčina: Na hojení rány se výrazně podílí základní příčina vzniku rány. Chronické rány, u kterých lze příčinu odstranit, mají dobrou hojivou tendenci, naopak rány, kde příčina je léčbou neodstranitelná a neovlivnitelná, v hojivém procesu stagnují, popř. rána progreduje.
Přidružená onemocnění: Mnozí nemocní, zvláště vyšší věkové kategorie, trpí velmi často dalšími, převážně chronickými chorobami, které se negativně podílejí na hojení. Patří k nim zcela určitě ischemická choroba srdeční, hypertenze, respirační onemocnění, diabetes mellitus, autoimunitní onemocnění, maloabsorpční syndromy, onemocnění nádorová, onemocnění pohybového aparátu, choroby pojiva a další.
Věk: Vysoký věk nemocného je jedním z důležitých faktorů ovlivňujících průběh hojení. Je všeobecně známo, že fyziologické stárnutí zpomaluje proces hojení, tlumí aktivitu a reprodukci všech tělesných buněk, což se projevuje i v hojení rány.
Nutriční stav: Stav výživy a hydratace organismu se rovněž odrážejí v procesu hojení ran. Nedostatečný přísun základních živin, zejména proteinů, ale také minerálů a stopových prvků, jednoznačně hojivý proces inhibuje.
Léky: Také mnohá farmaka, ačkoliv příznivě působí na některá onemocnění, mohou mít nepříznivý vliv na hojení rány, např. cytostatika, imunosupresiva, cytotoxické léky, léky s protizánětlivým účinkem, antikoagulancia a další.
Hematologické poruchy: Poruchy hemokoagulace, nedostatek neutrofilních granulocytů, erytrocytů – anémie, resp. nedostatek hemoglobinu, způsobují tkáňovou hypoxii a mohou být důvodem špatného hojení rány.
Centrální hypoxie: Postižení centrálního nervového systému (např. při centrální mozkové příhodě, tumorech) je většinou spojeno s navozením hypoxického stavu. Tato skutečnost nepříznivě ovlivňuje hojivý proces rány.
Imunita: Snížená obranyschopnost jedince se negativně podílí na všech pochodech organismu. Jedinci se sníženou imunitou jsou náchylní k infekcím bakteriálního, virového i plísňového původu.
Nádorová onemocnění: Maligní onemocnění má vliv na imunitní systém organismu, a tím nepřímo i na hojení rány. Hojení rány ovlivňuje nejen základní onemocnění, ale i protinádorová léčba – radioterapie, chemoterapie a další.
Spánek: Nedostatek spánku a odpočinku nežádoucím způsobem zasahuje do buněčného dělení a reparace tkání. Určitý klidový režim vyžadují zejména rány lokalizované nad klouby, u kterých při odpočinku nepůsobí fyzikální stres daný pohybem.
Psychický stav: Stresové situace způsobují zvýšenou sekreci glukokortikoidů v organismu, které mají protizánětlivý účinek a tlumí tvorbu granulační tkáně.
Systémová infekce: Jakákoliv systémová infekce je spojena se zánětlivou reakcí a má nepříznivý vliv na aktivitu fibroblastů.
Návyky: Mezi nežádoucí jevy, které ovlivňují hojení ran, patří abuzus alkoholu, kouření, drogy, případně další.
2. Místní faktory
Porucha hemodynamiky: Porucha krevního zásobení je spojena se sníženou perfuzí kyslíku a ostatních nutričních látek potřebných ke tkáňové reparaci.
Hloubka rány: Rána hluboká bude potřebovat k vytvoření vaskularizované granulační tkáně více času než rána povrchová. Navíc mohou být u hluboké rány rozsáhlým způsobem zasaženy tkáně podkožní.
Velikost rány: Rána velká obvykle vyžaduje delší dobu ke zhojení.
Spodina rány: Pevně lpějící nekróza, krevní sraženiny, fibrinové nálety a povlaky brzdí fázový průběh hojení. Nepříznivý vliv na hojení rány má také nadměrná sekrece.
Lokalizace rány: Rána v oblasti se sníženou nutricí vykazuje špatné známky hojení. Špatnou hojivou tendenci mají také rány, které jsou nad kostními prominencemi nebo nad klouby.
Okraje rány: Pod podminovanými okraji nachází vhodné podmínky mikrobiální flóra. Špatnou hojivou tendenci mají také rány s tuhými, kalózními okraji.
Mikrobiální infekce: Při hodnocení mikrobiální komponenty rány je třeba si uvědomit, že každá rána, i tzv. aseptická rána, je osídlena mikroby. Přítomnost bakterií v ráně však ještě nemusí znamenat infekci, nýbrž pouze kontaminaci. Na většině chronických ran nacházíme smíšenou mikroflóru patogenů nebo podmíněných patogenů. K nejčastěji se nacházejícím mikrobům v chronických ranách patří: Staphylococcus aureus, β-hemolytické streptokoky, enterokoky, Pseudomonas aeruginosa, Proteus vulgaris, Escherichia coli. Rozvoj klinických projevů infekce závisí na patogenitě mikroorganismu, na jeho virulenci, na interakci mezi mikrobem a organismem a na prostředí rány. Infekce rány se projeví zvýšenou, většinou purulentní sekrecí, zarudnutím, napětím, bolestí, zápachem. Každá infekce naruší průběh hojení.
Stáří rány: Chronické, dlouhotrvající rány se hojí pomalu.
Hypoxie rány: Mírná hypoxie stimuluje angiogenezi, což se využívá při léčbě rány okluzivními obvazy (hydrokoloidy). Výrazná hypoxie omezuje syntézu kolagenu a růst epitelových buněk a snižuje rezistenci tkáně k infekcím, danou sníženou fagocytární schopností leukocytů.
Teplota rány: Rána se nejlépe hojí při normální tělesné teplotě, kdy je zachována mitotická aktivita buněk. Při vysoké tělesné teplotě dochází k poškození tkání, stejně tak, je-li teplota rány snížena o pouhé 2 °C, hojení se zpomalí.
Cizí tělesa: Cizí tělesa v ráně jsou příčinou dráždění, prodlužují zánětlivou fázi a mohou být zdrojem infekce.
Macerace kůže v okolí: Okraje rány a nejbližší okolí mohou být drážděny a macerovány exsudátem z rány, potem, inkontinencí. Mokvající okolní kůže je náchylná k infekci bakteriální a plísňové, k senzibilizaci a iritaci.
Léčba
Znalost procesu hojení a faktorů, které mohou ovlivnit hojení, je jednou ze základních podmínek pro stanovení správného terapeutického postupu bércového vředu. Pro volbu nejvhodnějších prostředků k zevní léčbě chronické rány je nutné přesné zhodnocení spodiny rány.
Místní léčba rány
Cílem místní léčby rány je především sanace spodiny, podpora granulace a epitelizace vhodným krytím rány. Současně je nutno věnovat pozornost také léčbě okolí rány.
Místní terapie zaznamenala v posledních desetiletích výrazné změny. Do léčebného sortimentu vstoupily nové krycí prostředky, které umožňují tzv. „vlhký způsob“ hojení ran (1). Za základ „moist wound healing“ lze považovat práce G. Wintera z roku 1961, který prokázal, že ve vlhkém prostředí dojde k hojení rány signifikantně rychleji než v prostředí suchém (8, 25, 37). Tuto zkušenost potvrdily i pozdější práce Turnera z roku 1991 (19, 34). Koncept vlhkého způsobu ošetřování ran zahájil éru rozvoje a výroby desítek či stovek dalších produktů různých druhů, odlišných účinků, zaměřených k vytvoření vlhkého prostředí v ráně. Při současné výrobní explozi krycích prostředků nebyla však věnována dostatečná pozornost výzkumu a získání vědomostí o tom, v čem spočívá úspěch hojení rány a jaké lokální prostředí by mělo být vytvořeno v dané fázi, které by stimulovalo hojení. Proto se v poslední době věnuje stále více pozornosti přípravě rány k hojení, označované jako „wound bed preparation“.
„Wound bed preparation“
Termín „wound bed preparation“ (WBP) použil poprvé Falanga v roce 2000, kterým vyjadřuje, že bez správné přípravy rány nemohou být moderní a sofistikované produkty určené k léčbě ran, terapeuticky účinné (5, 29). WBP představuje určitou koncepci systematického přístupu k léčbě rány, zaměřující se na přesnou identifikaci stavu rány, na zhodnocení všech potenciálních faktorů bránících hojení v souvislosti s individuálně zaměřeným holistickým přístupem k nemocnému. WBP model se zaměřuje na 3 významné faktory, kterým je třeba v přípravě rány věnovat mimořádnou pozornost:
- debridement (odstranění povlaků a nekrotické tkáně);
- bakteriální infekce (infekce prodlužuje zánět);
- exsudát (vytvoření adekvátní vlhkosti).
Pro použití WBP v klinické praxi byl vytvořen tzv. TIME model, založený na systematickém objektivním zhodnocení rány, při sestavování strategie léčby u nehojivých chronických ran (3).
TIME model se skládá ze čtyř složek: Tissue management – ošetření tkáně, Inflammation/infection control – potlačení zánětu a infekce, Moisture balance – zajištění adekvátní vlhkosti, Epithelial advancement – podpora epitelizace. Cílem tohoto modelu je optimalizovat stav rány redukcí otoku, snížením exsudace a potlačením nežádoucí bakteriální flóry (3,28).
T = tissue management
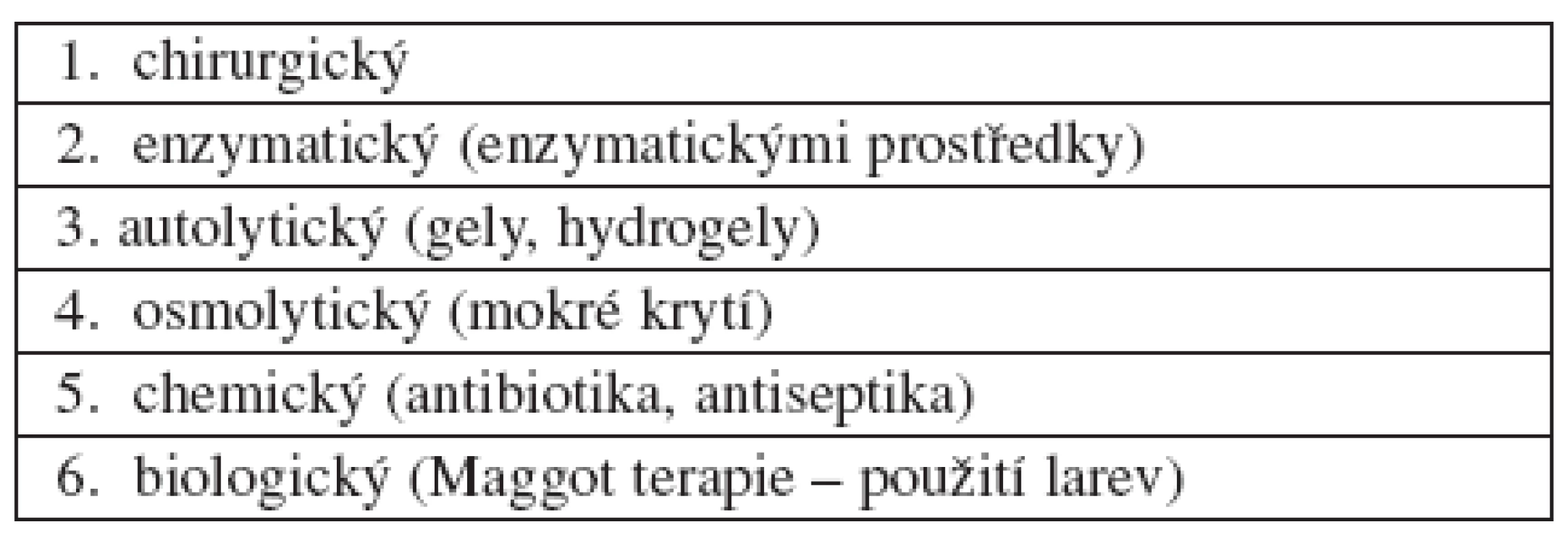
Základním předpokladem zdárného hojení chronické rány je odstranění nekrotické a devitalizované tkáně, bohatě osídlené mikroby. Odumřelá tkáň zabraňuje hojení, mnohdy se pod černým příškvarem shromažďuje hnisavý exsudát, který zesiluje zánětlivé projevy a bolest. Podobně působí na reparační proces fibrinové, žlutavě zbarvené nálety nebo šedozelené povlaky, svědčící o přítomnosti nežádoucí mikrobiální komponenty. Čištění rány – debridement – může být prováděno různým způsobem a podle toho rozlišujeme debridement enzymatický, osmolytický, chemický, autolytický, chirurgický a biologický (tab. 4). U chronických ran je mnohdy zapotřebí tento proces i několikrát opakovat.
I = inflamation/infection
Chronické rány jsou často silně kolonizovány bakteriemi, které mohou nepříznivě zasahovat do souhry reparačních fází hojení, prodlužovat fázi zánětu, tlumit fibroplazii a inhibovat epitelizaci. Poslední vědecko-výzkumné poznatky naznačují, že v chronických ranách, které nejeví tendenci k hojení, se tvoří určité biofilmy, což jsou kolonie bakterií obalené ochrannou vrstvou polysacharidů. Tyto biofilmy negativně zasahují do procesu hojení a jsou odolnější proti působení antimikrobiálních protilátek.
Přítomnost bakterií v ráně však ještě nemusí znamenat infekci, nýbrž pouze kontaminaci. Vždy je třeba posuzovat mikrobiální osídlení spodiny rány v závislosti na klinickém obraze a celkovém stavu pacienta (17). V souvislosti s přítomností mikrobů v ráně se hovoří o kontaminaci, kolonizaci, kritické kolonizaci a o infekci (16).
M = moisture balance
Vytvoření přiměřeně vlhkého prostředí stimuluje proliferaci fibroblastů, keratinocytů a endotelových buněk. Nadměrné množství exsudátu obsahuje velké množství matrix metaloproteináz, které štěpí bílkoviny extracelulární matrix, destruují růstové faktory, blokují proliferaci buněk a angiogenezi, zvyšují přítomnost infekce.
E - epithelial (edge) advancement
Čtvrtou součástí výše zmiňovaného modelu je podpora epitelizace. Epitelizační proces může být narušen ischémií, která inhibuje migraci keratinocytů, dále poruchami regulačních pochodů, špatnou pohyblivostí buněk nebo přílišnou adhezí keratinocytů. Je prokázáno, že u pacientů s bércovými vředy žilního původu je snížená proliferační schopnost fibroblastů a redukovaná odezva na PDGF.
TIME model, který je doporučován v terapeutickém postupu při ošetřování chronických ran, zohledňuje všechny okolnosti, které mohou být brzdou hojivého procesu a které je třeba vhodnými metodami eliminovat.
Krycí prostředky
Moderní krycí prostředky, které nabízí dnešní farmaceutický průmysl, jsou vyvinuty na základě nejnovějších poznatků o hojení ran. Jejich hlavní úlohou je zajištění vlhkého prostředí, které vytváří přirozené podmínky pro léčbu ulcerací.
Tyto prostředky používané k léčbě bércového vředu mají různou konzistenci, materiálové složení a z toho rezultující účinek. Jejich správné použití vyžaduje znalosti o procesu hojení, o složení a účinku jednotlivých prostředků, neboť když jsou správně indikovány, urychlí hojení a zmenší utrpení pacienta.
Podle složení a účinku jsou rozděleny do několika skupin:
Hydrokoloidní obvazy obsahují ve vnitřní vrstvě hydrokoloidní partikule, které při kontaktu s vlhkostí rány vytvářejí gelovou hmotu, která zabezpečuje vlhké prostředí v ráně. Jsou vhodné k léčbě ran s čistou spodinou se střední a silnou exsudací.
Hydropolymerová krytí podporují vlhký způsob hojení a mají mnoho společného s hydrokoloidy, neboť vnitřní vrstva obvazu obsahuje hydroaktivní partikule. Používají se při léčbě středně a silně secernujících ran.
Hydrogelová krytí se doporučují na rány se středně silnou i nižší sekrecí. Protože mají vysoký obsah vody (až 60 %), dokážou změkčit i suché, ulpívající povlaky, mají současně efekt i rehydratační.
Alginátová krytí jsou vyráběna z mořských řas a vyznačují se značnou nasávací schopností. Vlákna alginátu se sekretem rány změní v nepřilnavý gel, který účinkuje jako vlhký obvaz. Současně se sekretem rány se pojímají zbytky odumřelých buněk, hnis a bakterie, což poukazuje na jejich čistící efekt.
Prostředky s aktivním uhlím se rovněž uplatňují u silně secernujících ran v době čištění a granulace. Kromě sekretu z rány pohlcují i bakterie, ránu čistí a redukují zápach.
Mokré krytí TenderWet (bioaktivní) – savé polštářky s polyakrylátovým jádrem jsou dalším garantem vlhké terapie. Jsou indikovány ve fázi čištění rány a ve fázi granulační. Polštářek se aktivuje Ringerovým roztokem, který se průběžně do rány uvolňuje a současně se nasává sekret rány s odumřelými buňkami, bakteriemi a toxiny.
Pěnová polyuretanová krytí příznivě ovlivňují granulaci a epitelizaci. Jsou zhotovena z měkkých polyuretanových materiálů se širokými, či drobnými a hustými póry s různou drenážní schopností a absorpční kapacitou.
Hydroaktivní krytí jsou polopropustné neadherentní obvazy, vyrobené z pěnové polyuretanové hmoty se zakomponovanými gelovými superabsorbéry. Toto strukturální uspořádání umožňuje absorpci velkého množství exsudátu, který současně chrání ránu před vyschnutím. Účinek hydroaktivních obvazů je však selektivní, neboť ze sekretu rány absorbují vodu, bakterie a odumřelé buňky, zatímco nutriční látky v ráně ponechávají. Jsou vhodná k léčbě bércových vředů se silnou exsudací.
Krytí z hydrovláken jsou novější formou krytí určenou k léčbě bércových vředů, s vysokou absorpční a retenční schopností. Hydrovlákna jsou vyrobena ze 100% hydrokoloidu, který se spřádá do dutých vláken, z nichž se připravuje netkaný, měkký, rounu podobný krycí polštářek. Hydrovlákna se při kontaktu s exsudátem mění ze suché formy na kompaktní gel, který vytváří pro hojení ran ideální vlhké prostředí.
Lipo-koloidní krytí tvoří polyesterová síťka impregnovaná hydrokoloidními částicemi rozptýlenými ve vazelíně. Hydrokoloidní partikule absorbují exsudát a interakcí s vazelínou vzniká lipo-koloidní vrstva, která udržuje vlhké prostředí.
Krytí ze síťových materiálů jsou propustná pro vodu a kyslík, proto nacházejí terapeutické uplatnění především u povrchových ran. Gázové tkaniny z viskózy, bavlny či polyamidu jsou impregnovány masťovými základy s neutrálním účinkem na kůži nebo obsahují další účinné složky.
Enzymatické prostředky obsahují hydrolytické enzymy a používají se v terapii bércových vředů s fibrinovými povlaky a nekrotickou spodinou, kde nahrazují nedostatek vlastních enzymů zapojených do hojivého procesu. Jejich působením se docílí bezbolestného vyčištění rány. Proteolytický účinek enzymů se omezuje pouze na nekrotickou tkáň a nepůsobí na živé buňky. Aby se účinek enzymů mohl uplatnit, musí být rána vlhká.
Prostředky s kyselinou hyaluronovounahrazují tkáňový deficit kyseliny hyaluronové a tímto způsobem příznivě ovlivňují hojení. Kyselina hyaluronová je důležitou komponentou kůže, zejména extracelulární matrix. Sehrává významnou úlohu při regeneraci tkání, aktivuje buňky, které se zúčastňují procesu regenerace, zvyšuje jejich migraci a proliferaci.
Antibakteriální a antiseptické prostředky. K moderním antibakteriálním a antiseptickým prostředkům patří takové, jejichž schopnost vyvolat alergickou reakci je minimální. Těmto požadavkům odpovídají prostředky s obsahem 2% kyseliny mupirocinové, vysoce účinné na Gram-pozitivní i Gram-negativní mikroby, podobně i ty, které obsahují 2% natrium fusidát. Odstranění páchnoucích, zeleně zbarvených povlaků, nejčastěji obsahujících Gram-negativní mikrobiální flóru, lze excelentně dosáhnout opakovanou aplikací zevních přípravků s obsahem gentamicinu, který je většinou vázán na vysoce purifikovaný hovězí kolagen. Při kontaktu s ránou je kolagen resorbován a gentamicin se postupně uvolňuje do rány. K prostředkům s antiseptickým a antibakteriálním účinkem patří také externa obsahující jod, který signifikantně redukuje infekce způsobené Staphylococcus aureus, Pseudomonas aeruginosa a jinými patogeny. Baktericidní a antiseptický účinek mají také prostředky se stříbrem, které uvolňují ionty nebo radikály stříbra. Jiným prostředkem, který působí bakteriostaticky, je bizmut obsažený v některých neadherentních síťových krytí. K širokospektrým antiseptikům, působícím na Gram+ a i Gram-bakterie včetně MRSA patří chlorhexidin, obsažený v neadhezivním krytí z tylové tkaniny.
Kolagenová krytí. Krytí s obsahem kolagenu jsou indikována ve fázi granulace a epitelizace. Kolagen stimuluje migraci a proliferaci fibroblastů, proliferaci keratinocytů a chrání růstové faktory.
Krytí s obsahem chitoskinu. Jedná se o bioaktivní krytí podporující angiogenezi, granulaci, s antimikrobiálním účinkem a s výraznou absorpční schopností. Z těchto důvodů je určen pro terapii silně exsudativních a infikovaných ran.
Růstové faktory. Růstové faktory hrají významnou úlohu ve všech fázích hojení, neboť aktivují migraci, proliferaci a diferenciaci buněk zapojených do procesu hojení, regulují syntézu a degradaci extracelulární matrix. Za významný růstový faktor ve všech fázích hojení je považován rekombinovaný humánní destičkový růstový faktor (PDGF-BB), získaný inzercí genu řetězce lidského destičkového růstového faktoru do kvasinky Saccharomyces cerevisiae. PDGF-BB je obsažen v gelovém farmaceutickém prostředku. Stimuluje proliferaci buněk zapojených do zánětlivé fáze hojení, proliferaci a migraci fibroblastů a buněk hladkého svalstva. Důležitou roli hraje i ve fázi remodelační.
Inhibitory proteolytických enzymů K proteolytickým enzymům, jejichž aktivita je u chronických ran zvýšena, patří matrix proteinázy, které poškozují extracelulární proteinovou matrix a růstové faktory. Proto se strategie vývoje nových léčebných prostředků v současné době zaměřují na lokální aplikace proteinázových inhibitorů. Tyto prostředky inaktivují proteázy a současně vážou a před dalším poškozením chrání růstové faktory. Podporují proliferaci fibroblastů, absorbují destruktivně působící volné radikály a garantují vlhký způsob hojení.
Biologická krytí. Kromě klasických autogenních a alogenních kožních štěpů, izolovaných a kultivovaných jednotlivých kožních elementů – keratinocytů, složených kožních náhrad, se v poslední době začínají využívat biologické kožní kryty, vyrobené z prasečích kožních štěpů odstraněním epidermis a všech ostatních buněk. Zbylá matrix se používá k akceleraci hojení chronických ran.
Kromě uvedených forem krytí a léčebných prostředků používaných k ošetřování bércových vředů existuje řada prostředků dalších. Je třeba se také zmínit o krytí kombinovaných, složených ze dvou a více materiálových komponent, jejichž účinky se vzájemně potencují. Při výběru krycích prostředků se vychází z jejich léčebného účinku daného materiálovým složením, z fáze hojení bércového vředu a z intenzity sekrece. Každá skupina krytí se vyznačuje specifickým účinkem, kterého nelze obecně využívat ve všech fázích hojení (1, 2, 7, 23, 30). Lokální léčba chronických ran je jen jednou, i když významnou složkou komplexní péče o pacienta.
Komplexní péče
Přístup k léčbě nemocného s chronickými ranami musí mít komplexní charakter. Komplexní péče zahrnuje kromě místního ošetřování další terapeutické složky, ke kterým patří systémová léčba základní příčiny, léčba přidružených onemocnění, fyzikální terapie, léčba bolesti, v indikovaných případech léčba chirurgická (7, 12, 27, 35), ale také spolupráce různých odborníků.
Cílem komplexní léčby je eliminace všech faktorů, které nežádoucím způsobem ovlivňují hojení. Proto ke každému nemocnému je třeba zvolit individuální přístup podle jeho celkového zdravotního stavu a příčiny chronické rány.
Došlo do redakce: 24. 7. 2008
Prof. MUDr. Alena Pospíšilová, CSc.
Luční 32
616 00 Brno
E-mail: apospis@med.muni.cz
Sources
1. Barclay, L. Consensus statement describes dressings for acute and chronic wound management. Arch. Dermatol, 2007, 43, p. 1291-1294.
2. Calliano,C. How to choose the right treatment and dressing for the chronic wounds. Nursing. Hordám, 2003, 10, p. 6-14.
3. Dowsett, C., Stello, E. The principes of chronic wound bed preparation and treatment. Br J of Nursing, 2004, 13 (15), suppl. p.1-7.
4. Enoch, S., Harding, K. Wound bed preparation: the science behind theremoval of bariers to healing. Wounds, 2003, 15 (7), p. 213-217.
5. Falanga, V. Classification for wound bed preparation and stimulation of chronic wounds. Wound Repair and Regeneration, 2005, 8, 5, p. 347-352.
6. Flanagan, M. Assessment criteria. Nursing Times, 1994, 90 (35), p. 76-88.
7. Flanagan, M. Wound management, Churchill Livingstone, New York, 1997, p. 203.
8. Fletcher, J. Wound bed preparation and the TIME principles. Nursing Standard, 2005, 20 , 12, p. 57-65.
9. Franců, M. Dekubity. Dermatologie. Dvouměsíčník pro praktické lékaře a pediatry. 2007, 1(2), p. 68-80.
10. Harding, KG., Morris, HL., Patel, GK. Healing chronic wounds. BMJ, 2002, 324 (19), p. 160-164.
11. Goldmann, R. Growth factors and chronic wound healing: past, prezent and future. Advance in Skin X Wound Care, 2004, 17 (1), p.24-36.
12. Hakl, M., Hřib, R. Farmakologická léčba chronické nenádorové bolesti. Interní medicína pro praxi, 2005, 2, p. 97-100.
13. Harris, IR., Yee, KC., Walter, CE., Cunliffe, WJ. Kearney, JN., Wood, EJ., Ingham, E. Cytokine and protease in healing and non-healing leg ulcers. Exp Dermatol, 1995, 4, p. 342-349.
14. Hess, CT., Kirsner, RS. Orchestrating wound healing: assessing and preparing the wound. Advances in Skin x Wound care, 2003, 16 (5) p. 246-263.
15. Chin, GA., Diegelmann, RF., Schultz, GS. Cellular and mollecular regulation of wound healing. In: Fallabela, AF., Kirsner, RS.: Wound healing. Taylor x Francis, Boca Raton, 2005, p. 723.
16. Kingsley, A. Proactive approach to wound infection. Nursing Standard, 2001, 15, 30, p. 50-58.
17. Kingsley, A. The wound infection continuum and its application to clinical practise. Ostomy/Wound management, 2003, 49, 7A suppl. p. 1-7.
18. Klüken, N. Venenerkrankungen. In: Földi M., Klüken N., Dollare, M. Praxis der Lymphgeffässung Venenerkrankungen. Stuttgart, Fischer Verlag, 1974, p. 65-146.
19. Lait, ME., Smith, LN. Wound management: a literature review. J clin Nursing, 1998, 7, p. 11-17.
20. MacLellan, DG. Chronic wound management. Austr prescr, 2000, 23, p. 6-9.
21. Müller, A., Ruzicka, T. Differentialdiagnose des Ulcus cruris. Hautarzt, 2001, 7, p. 593-603.
22. Navrátilová, Z. Etiologie ran v oblasti bérce. Referátový výběr z dermatovenerologie, 2007, Speciál-II, p. 37-45.
23. Pospíšilová, A. Obvazy nové generace. Čas Lék čes, 1998, 137, 9, p. 264-266.
24. Pospíšilová, A. Etiologie a diferenciální diagnostika bércových vředů. Trendy v medicíně, 2000, 2, p. 8-10.
25. Pospíšilová, A., Švestková, S. Léčba chronických ran. IDVZP, Brno, 2001, p. 72.
26. Pospíšilová, A. Bércový vřed – etiologie, diagnostika a léčba. Postgraduální medicína, 2002, 6, p. 604-610.
27. Pospíšilová, A. Komplexní pojetí léčby chronických ran. Čs Derm, 2005, 80, p. 82-86.
28. Resl, V. Hojení chronických ran. Grada publishing, 1997, p. 425.
29. Schultz, G.S., Sibbald, R.G., Falanga, V. et al. Wound bed preparation: a systematic approach to wound management. Wound Repair and Regeneration, 2003, 11, suppl.1, p. 1-28.
30. Slonková, V., Vašků, V. Přehled krycích prostředků. Referátový výběr, 2007, 49, Speciál II, p. 53-64.
31. Stadelmann, WK., Digenis, AG., Tobin, GR. Physiology and healing dynamics of chronic wounds. Amer J Surg, 1998, 176 (2), p. 26-38.
32. Stryja, J. Nebojme se nových klasifikací. In: Bureš I. Léčba rány. Galén, 2006, p. 78.
33. Švestková, S. Diferenciální diagnostika bércových vředů. Diagnóza, 1999, 45 (7) p.7.
34. Turner, V. Standartisation of wound care. Nursing Standard, 1991, 5 (19), p. 25-28.
35. Veverková, L., Kalač, J., Chalupník, Š., Wechsler, J. Endoskopické přerušení perforátorů. Prakt Flebol, 1999, 8 (4) p. 148-150.
36. Westbay, S. Wound care. St. Louis, 1986, p.205.
37. Winter, GD. Formation of the scab and the rate of epithelization of superficial wounds in the skin of the young pig. Nature, 1962, 193, p. 293-294.
38. Yager, DR., Neomeh, BC. The proteolytic environment of chronic wounds. Wound Repair, 1999, 7, p. 342-349.
Labels
Dermatology & STDs Paediatric dermatology & STDsArticle was published in
Czech-Slovak Dermatology

2008 Issue 5
-
All articles in this issue
- Akutní a chronické rány – etiologie, rozdíly v hojení a léčba
- Vyhodnocení epidemiologických dat u pacientů s atopickým ekzémem starších 14 let
- Kožní nálezy u dialyzovaných pacientů s chronickým selháním ledvin
- Papillae coronae glandis - hirsuties papillaris penis
- Česká dermatologie na počátku 20. století
- Czech-Slovak Dermatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Papillae coronae glandis - hirsuties papillaris penis
- Akutní a chronické rány – etiologie, rozdíly v hojení a léčba
- Kožní nálezy u dialyzovaných pacientů s chronickým selháním ledvin
- Česká dermatologie na počátku 20. století