Pityriasis rubra pilaris
Pityriasis Rubra Pilaris
Pityriasis rubra pilaris (PRP) is the relatively rare inflammatory skin disease of unknown etiology. As possible trigger factors are considered infections, malignances or autoimmune disturbances, which were observed to precede occurrence of the disease. According to age, morphological features and clinical course the disease is classified into six forms. The most common is classic adult form, representing over 50 % of PRP cases, which is also characterized by high spontaneous remission. Typical skin lesion include erythematosquamous salmon-colored plaques and areas often evolving in erytroderma with well demarcated islands of normal skin, follicular papules, palmoplantar keratoderma. Histology shows hyperkeratosis with alternating orthokeratosis and parakeratosis in a chessboard pattern, and focal acantholytic dyskeratosis. Mainstay of the treatment is systemic therapy with retinoids, methotrexate and cyclosporine. Good effect of “biologics“ used in psoriasis was observed also in the therapy of PRP.
Key words:
pityriasis rubra pilaris – pathogenesis – classification – therapy
Authors:
P. Velčevský 1; O. Kodet 1,2; J. Štork 1
Authors‘ workplace:
Dermatovenerologická klinika 1. LF UK a VFN, Praha, přednosta prof. MUDr. Jiří Štork, CSc.
1; Anatomický ústav 1. LF UK, Praha, přednosta prof. MUDr. Miloš Grim, DrSc.
2
Published in:
Čes-slov Derm, 86, 2011, No. 3, p. 129-136
Category:
Reviews (Continuing Medical Education)
Overview
Pityriasis rubra pilaris (PRP) je relativně vzácné zánětlivé kožní onemocnění neznámé etiologie. Jako spouštěcí faktor onemocnění připadají v úvahu autoimunitní pochody, infekce nebo nádorové procesy, které občas předcházejí vzniku onemocnění. Podle věku, klinického obrazu a průběhu se rozlišuje šest typů onemocnění. Nejčastější je „klasická“, adultní forma, představující více než 50 % případů PRP, která většinou spontánně ustupuje. Klinicky jsou charakteristické červené folikulárně vázané papuly, erytematoskvamózní ložiska až plochy přecházející až v erytrodermii, s ostrůvky nepostižené kůže, bývá přítomna hyperkeratóza dlaní a plosek. Histologický obraz nejčastěji vykazuje hyperkeratózu s šachovnicovitě se střídajícími úseky parakeratózy a ortokeratózy, dále akantolytickou dyskeratózu. V léčbě se uplatňují především celkově podávané retinoidy, metotrexát a cyklosporin. Příznivý účinek byl pozorován při podávání biologik používaných v léčbě psoriázy.
Klíčová slova:
pityriasis rubra pilaris – patogeneze – klasifikace – léčba
ÚVOD
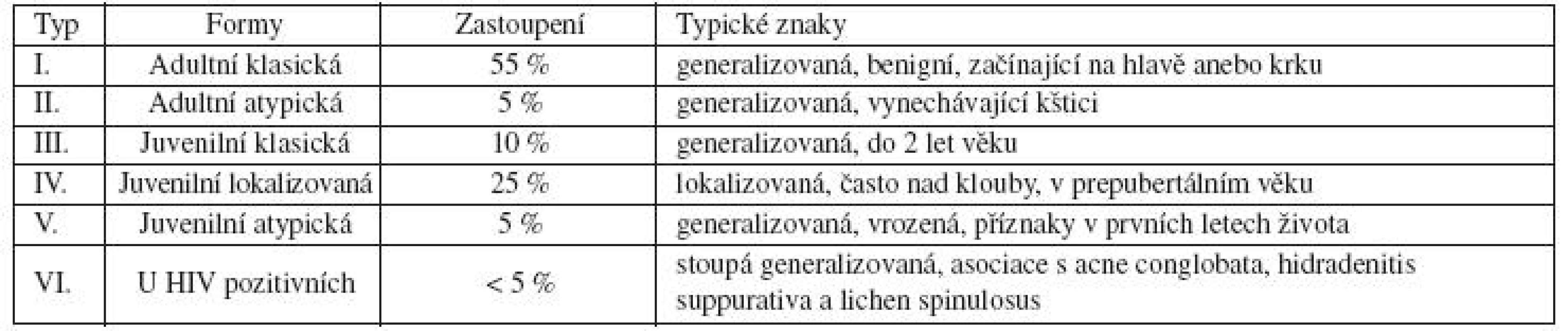
Pityriasis rubra pilaris (PRP) představuje méně častou chronickou zánětlivou dermatózu neznámé etiologie, postihující děti i dospělé. Charakterizují ji jemně se olupující (pityriasis) červené (rubra) splývající makuly a papuly vázané na folikuly (pilaris). Choroba často přechází až do erytrodermie. V současné době se rozlišuje šest klinických forem PRP (tab. 1), průběh je variabilní.
Onemocnění bylo poprvé popsáno nejspíše již roku 1835, tehdy ovšem mylně jako generalizovaná psoriáza [70]. Teprve profesor Alfons Devergie z Paříže roku 1856 onemocnění pojmenoval pityriasis pilaris, roku 1989 zavádí Besnier konečný název pityriasis rubra pilaris [7]. Roku 1910 byla popsána familiární forma [3], později i další varianty.
Výskyt PRP vykazuje určité etnické odlišnosti. Incidence se odhaduje ve Velké Británii na 1 : 5000, v Indii pak na 1 : 50.000 nových dermatologicky nemocných [27, 63]. V zastoupení jednotlivých klinických forem existují regionální rozdíly. Ve studiích ze Španělska převažuje typ I (55 %) [59], v Saúdské Arábií byl až v polovině případů diagnostikován typ IV [2]. Celkové zastoupení podle pohlaví je rovnoměrné. U klasické formy dospělých jsou častěji postiženi muži, v některých studiích je popsáno až pětinásobné postižení mužů [12]. Onemocnění se nejčastěji objevuje ve dvou obdobích: v 1.–2. a 5.–6. dekádě života. Familiární výskyt se popisuje až u 6,5 % nemocných PRP [17]. Ojediněle se vyskytují formy onemocnění vykazující autozomálně dominantní typ dědičnosti s variabilní expresivitou a nízkou penetrancí, bez přesně definované mutace genu. Popsán je i autozomálně recesivní typ [73]. Onemocnění se objevilo u monozygotních dvojčat [42]. Většina familiárně vázaných forem náleží k atypické dětské formě [44].
Etiologie choroby není dosud známá. Vzhledem k určitým obdobným histopatologickým změnám pozorovaným u nemocných s deficitem vitaminu A a především díky příznivému účinku retinoidů na PRP se uvažovalo o možné roli poruchy metabolismu tohoto vitaminu. Hladiny vitaminu A v séru jsou však normální a výsledky prací sledujících hladiny sérového proteinu vázajícího retinol (retinol binding protein) nejsou zcela jednoznačné [28, 53, 69, 72].
Dalším zvažovaným mechanismem podílejícím se na vzniku PRP je abnormální imunitní odpověď na určitý antigenní podnět. Sledovaly se bakteriální superantigeny (Staphyloccocus aureus, Streptococcus pyogenes sk. A) nebo hyperreaktivita na bakteriální produkty in vitro pozorovaná u stafylokokového enterotoxinu B [32]. Dále se zkoumala vazba na virové infekce, jako jsou CMV, EBV [8, 39] a zejména HIV [5, 9, 48]. Zvažoval se též autoimunitní proces pro popisovaný sdružený výskyt PRP s dermatomyozitidou, myastenia gravis, celiakií, poruchami štítné žlázy, reaktivní nebo séronegativní artritidou [35], hypoparatyreoidismem a brachyonychií [55]. Na abnormální imunologickou odpověď může také poukazovat koexistence s nádorovými procesy, jako jsou leukémie nebo metastazující karcinom (bronchogenní, hepatocelulární, Gravitzův tumor) [60, 65] nebo lokální léčba 5 % imiquimodem, po které došlo ke vzplanutí či exacerbaci PRP [24, 80].
DIAGNOSTIKA
V současné době se rozlišuje šest klinických forem PRP (viz tab. 1) [48], které se navzájem liší klinickým obrazem, věkem a průběhem. Klasifikace prodělala za předchozí léta různé proměny, smyslem je jejich zpřehlednění. Řada autorů předpokládá, že atypické formy budou mít zcela jinou etiologii než klasický I. typ [28].
I. typ – adultní („ klasická“) forma PRP
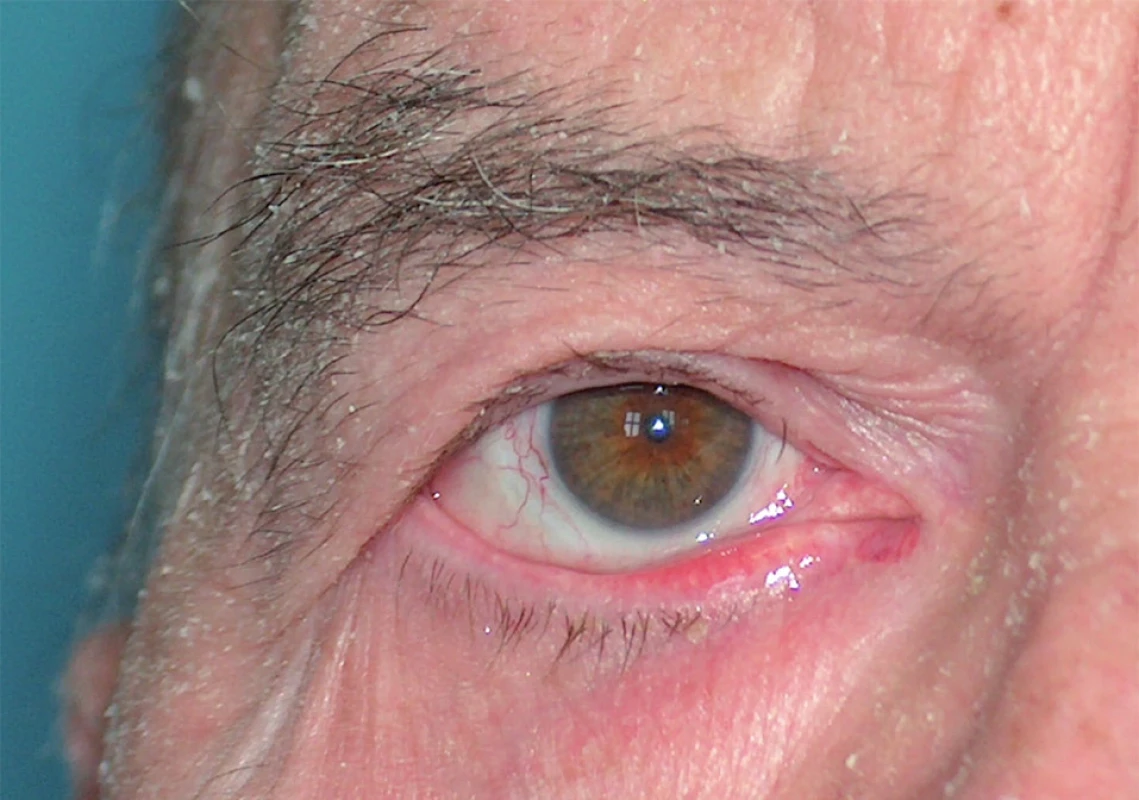
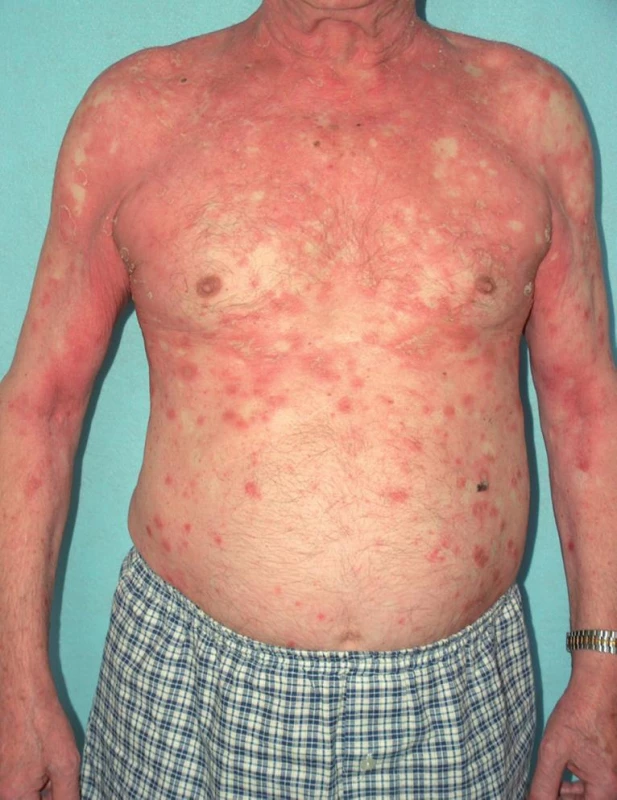
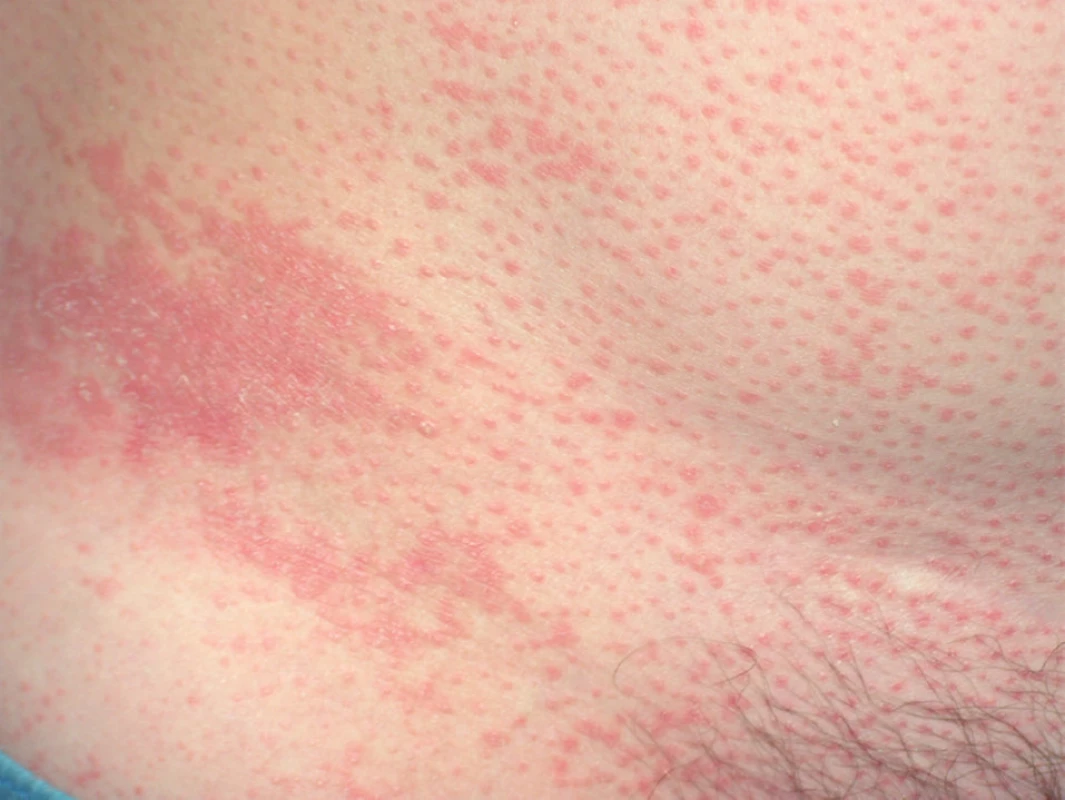
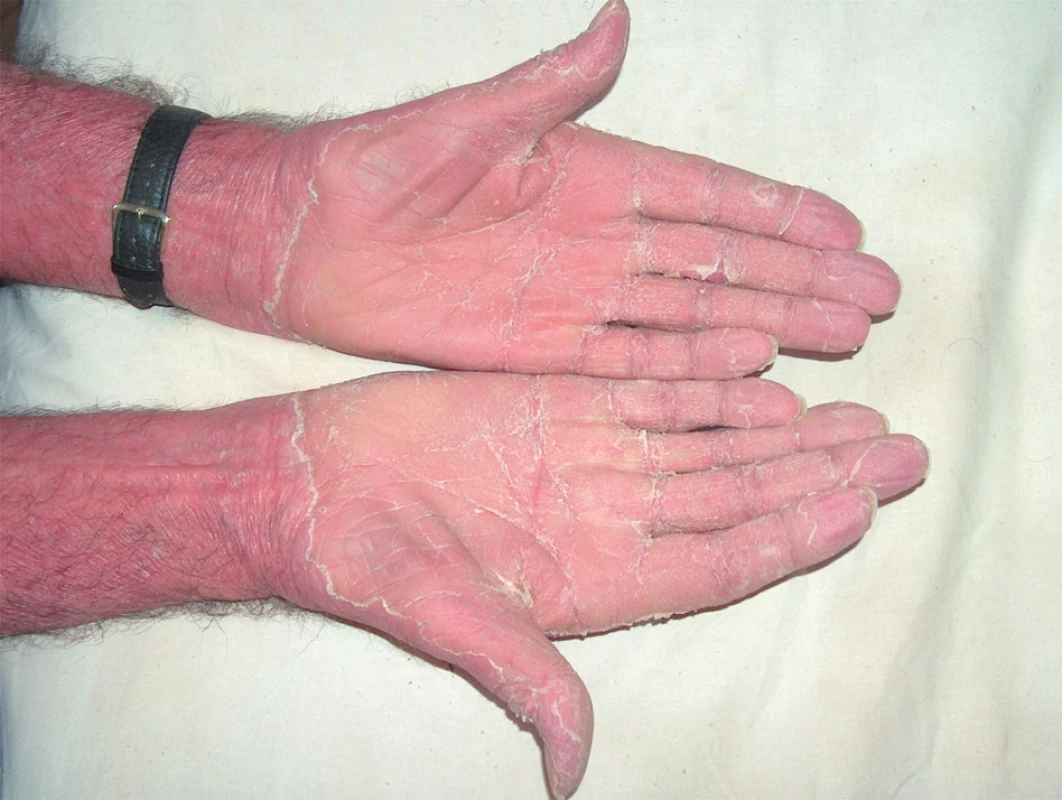
Představuje více než 50 % všech PRP, nejčastěji vzniká mezi 40. a 60. rokem věku. Typicky začíná na hlavě jako šupící erytém, zpravidla bez patrného spouštěcího faktoru. Postupně postihuje celou hlavu, dále se šíří kraniokaudálně na krk, trup i končetiny a často přechází během týdnů až do obrazu erytrodermie (obr. 1). Postižení víček může vést ke vzniku ektropia, vzácně je pociťována i suchost očí (obr. 2). Na hřbetech rukou a prstů vznikají folikulárně vázané červené konické papuly splývající do ložisek až ploch (obr. 3). V rozsáhlejších červených plochách bývá typický výskyt drobných ostře ohraničených bledých okrsků kůže normálního vzhledu, ve kterých mohou být patrné jednotlivé folikulárně vázané, konické, červené papuly (obr. 4). Zpočátku erytematoskvamózní ložiska postihují kštici či hrudník a jsou jen stěží odlišitelná od psoriázy či seboroické dermatitidy. Na dlaních a ploskách dochází k tvorbě difuzních, plátovitých, žluto-oranžových hyperkeratóz omezujících pohyb prstů s tvorbou prasklin (obr. 5). Nehty mohou být ztluštělé, s podélným rýhováním, tečkovitými hemoragiemi, distálně žlutohnědého zbarvení, se ztluštěním nehtového lůžka. Dolíčkování nehtů, olejové skvrny, onycholýza a větší vroubkování nehtového lůžka svědčí spíše pro psoriázu [68]. V dutině ústní může být vyšší citlivost, pocit podráždění, bělavý vzhled bukální sliznice, šedobílá ložiska, papuly, erytém i eroze [47]. Prolongovaný zánětlivý erytém může především u starších osob vést k periferním otokům.
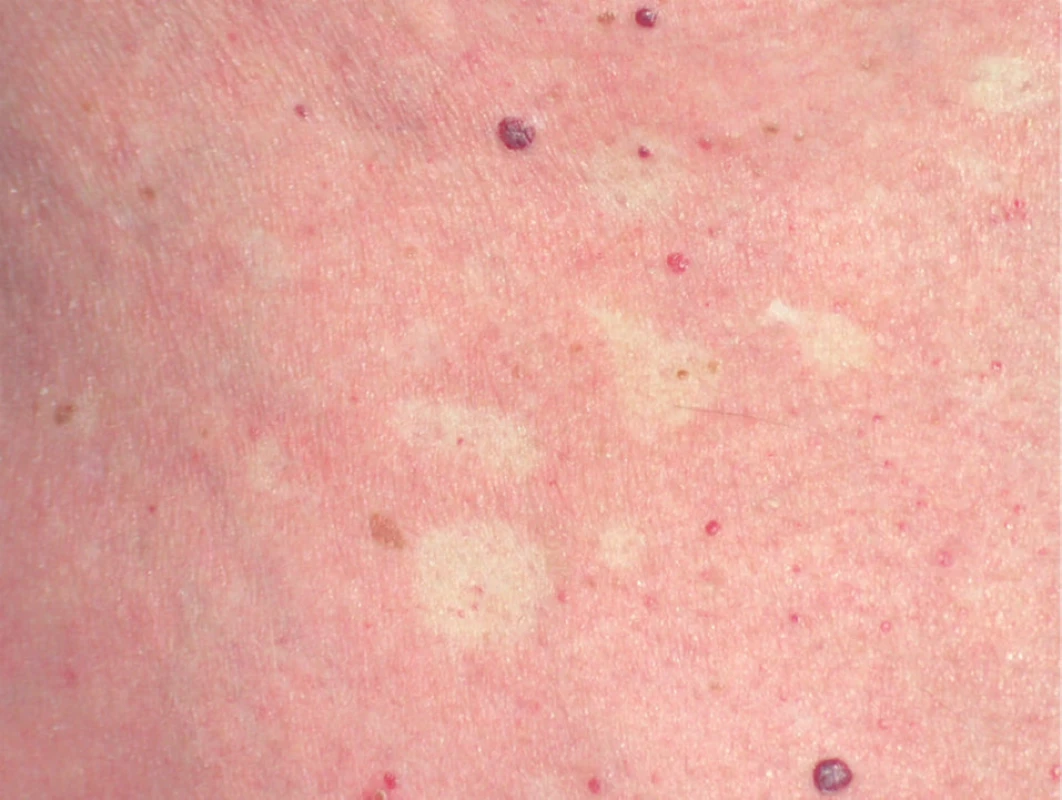
Klasický PRP I. typu odeznívá přibližně u 80 % pacientů do tří let od svého vzniku, jsou však známé případy spontánního ústupu až po 20 letech [1]. K ústupu projevů dochází ve stejném sledu jako při jejich vzniku – nejdříve mizí na hlavě, dále pak na trupu a končetinách.
II. typ – adultní atypická forma
Tato forma postihuje přibližně 5 % pacientů s PRP. Na rozdíl o klasické formy je provázena tvorbou velmi hrubých lamelózních šupin, ichtyoziformní deskvamací, především na dolních končetinách, místy s folikulárně akcentovanou hyperkeratózou. Není zde typická kraniokaudální progrese exantému, je zde menší tendence ke vzniku erytrodermie, může být přítomná alopecie. Tato forma přetrvává zpravidla řadu let, u 20 % případů dochází k remisi do tří let.
III. typ – juvenilní klasická forma
Tato forma začíná mezi 5. a 18. rokem života. Klinicky je obdobná klasickému adultnímu typu, někdy jí předchází akutní infekční onemocnění. Ke spontánnímu zhojení dochází nejčastěji do 1–2 let. Může přejít nebo splynout se IV. typem PRP.
IV. typ – juvenilní lokalizovaná forma
Tato forma představuje nejčastější z dětských forem PRP. Obvykle vzniká do 12 let věku. Jedná se o ostře ohraničená erytematózní ložiska s deskvamací postihující většinou trup nebo kštici. Občas je nápadná palmoplantární keratodermie. Prognóza quoad sanationem je nejistá. V některých případech dochází koncem dospívání ke spontánnímu vyhojení [43, 64].
V. typ – juvenilní atypická forma
Tato forma přípomíná typ II. dospělých, protože se často klinicky překrývá s ichtyózou a keratosis palmaris et plantaris. Při narození nacházíme erytém s hyperkatózou. Folikulární vazba projevů ukazuje na příslušnost k PRP, častá je palmoplantární keratodermie a u některých pacientů jsou popisované sklerodermiformní změny kůže prstů. Jedná se o chronickou formu.
VI. typ – u HIV pozitivních (folikulární syndrom asociovaný s HIV)
Klinické projevy PRP, které reagují na antiretrovirovou terapii, jsou popsány u HIV pozitivních pacientů. Někdy připomínají I. typ. Často se vyskytuje společně s acne conglobata, hidradenitis suppurativa a lichen spinulosus [5, 9, 48, 59].
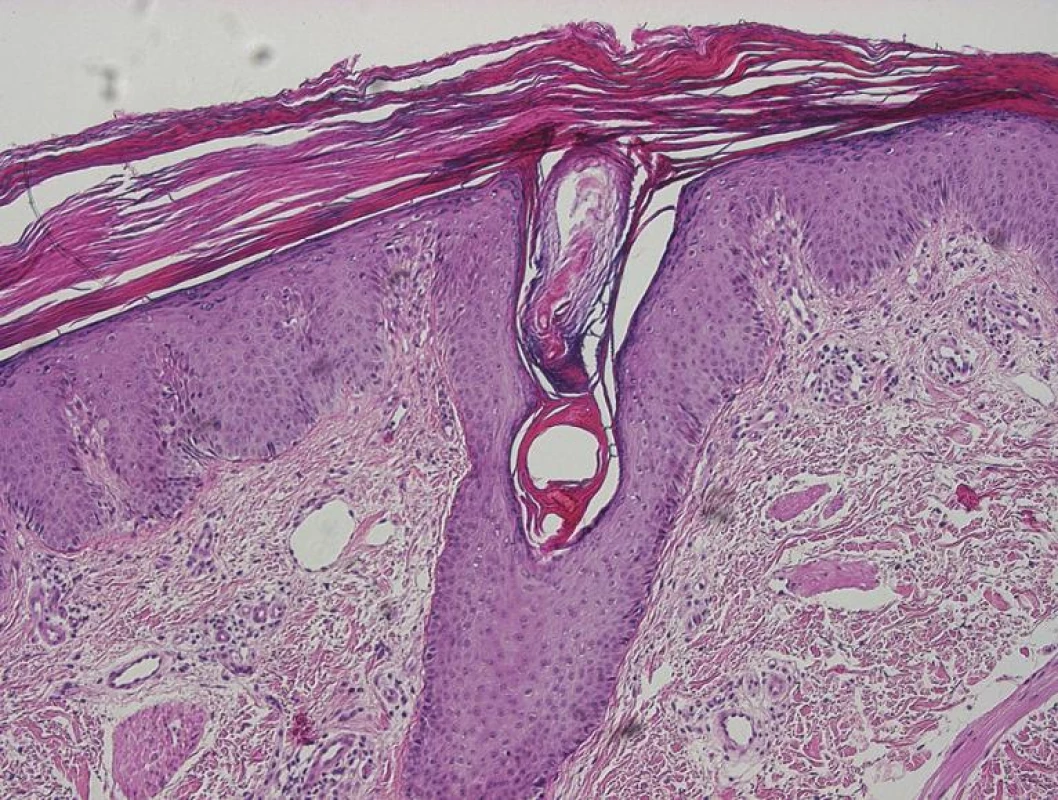
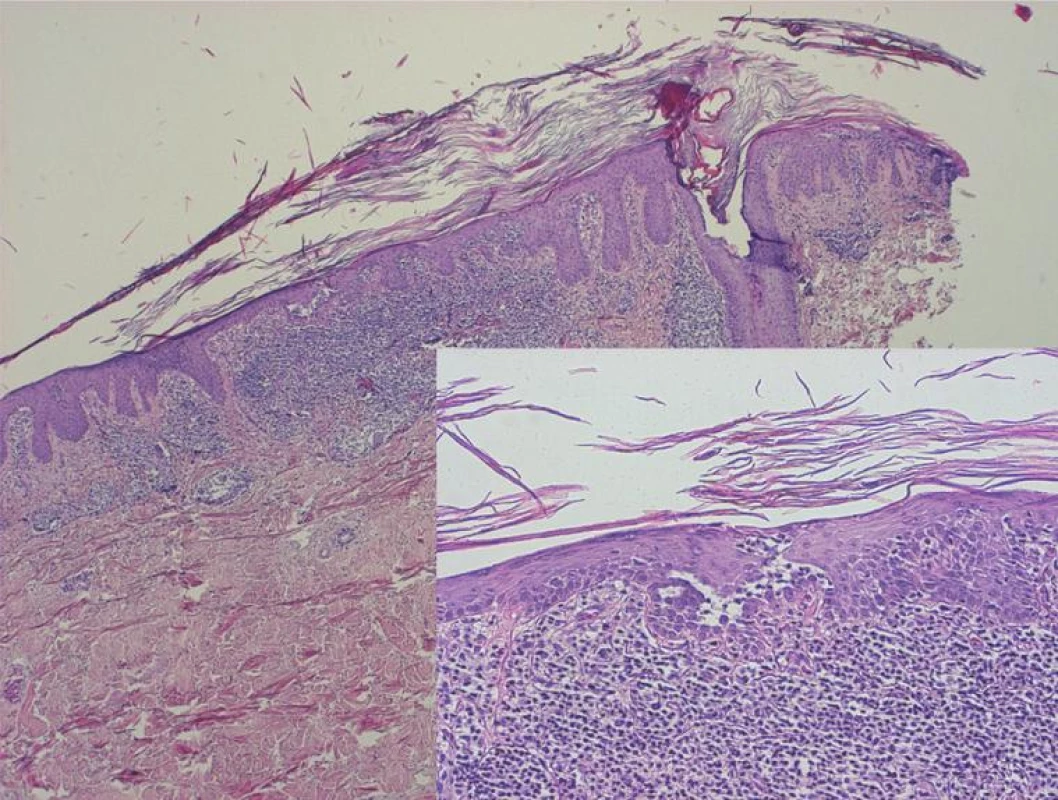
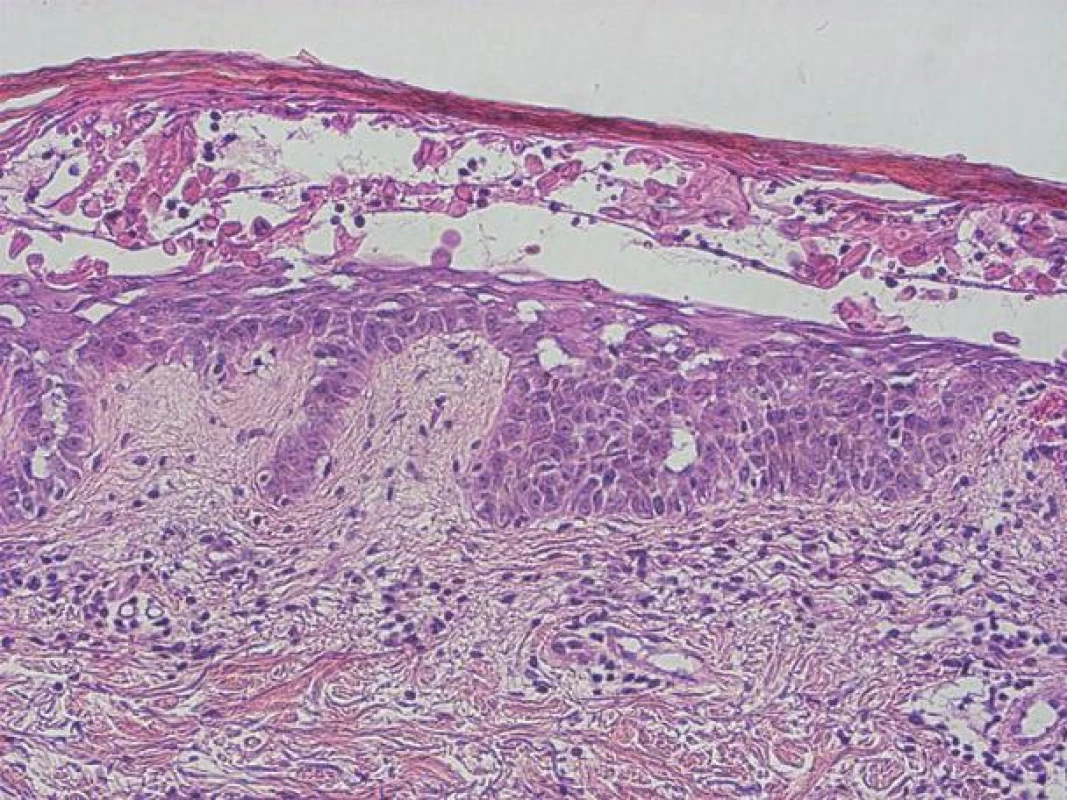
Histologické vyšetření je u PRP nutno považovat pouze za pomocné. Typickým nálezem u PRP je nepravidelně akantotická epidermis s širokými protaženými čepy s hypergranulózou, bez ztenčení nad úzkými dermálními papilami, krytá hyperkeratózou s šachovnicovitě se střídajícími úseky parakeratózy (obr. 6). Ústí vlasových folikulů, jejichž zastižení vyžaduje často důkladné prokrájení vzorku, jsou dilatovaná čepy hyperkeratózy lemovaných úseky parakeratózy. V horním koriu bývají nevýrazné perivaskulární lymfocytární infiltráty. Při akutním průběhu se v rohové vrstvě někdy nachází neutrofily, exsudát a bakterie, takže odlišení od psoriázy může být obtížné. Psoriáza, na rozdíl od PRP, vykazuje štíhlé protaženější epidermální čepy, ztenčení epidermis nad vrcholky širších papil koria, ve kterých můžeme nalézt nerovné, klubíčkovitě stočené kapiláry, redukci až chybění stratum granulosum, přítomnost Munroových mikroabscesů z neutrofilů v rohové vrstvě. V některých studiích u klasické PRP byla nejčastějším nálezem akantolytická dyskeratóza (obr. 7), což vede často k diagnóze jiného onemocnění jako např. morbus Grover, morbus Darier, morbus Hailey-Hailey [11, 14, 46]. V počátečních stadiích onemocnění můžeme zachytit subkorneální akantolýzu (obr. 8), která nutí vyloučit pemphigus foliaceus [61]. Někdy může být přítomná i epidermolytická hyperkeratóza [20].
V elektronovém mikroskopu je patrný nižší počet keratinových filament a desmozómů, zvětšení mezibuněčného prostoru, v parakeratóze mohou být patrné dutinky připomínající lipidové vakuoly, velké množství lamelózních granul a místy jsou patrné štěrbiny v bazální membráně.
Vzhledem k variabilitě histologického obrazu je při diagnóze PRP zásadní výběr vhodného projevu určeného k biopsii a klinickopatologická korelace založená na úzké spolupráci a komunikaci indikujícího klinického lékaře s dermatohistopatologem.
Diferenciální diagnostika má v popředí především odlišení psoriázy a seboroické dermatitidy. Cennými klinickými znaky svědčícími pro PRP je difuzní žlutooranžová hyperkeratóza dlaní a plosek, konické červené hyperkeratotické folikulárně vázané papuly, drobné ostře ohraničené („jakoby vyseknuté“) okrsky nepostižené kůže v difuzním erytému, negativní rodinná anamnéza. Změny na nehtech typické pro psoriázu nejsou přítomny. Postižení kštice v rané fázi PRP je obtížné odlišitelné od seboroické dermatitidy, která však, na rozdíl od PRP, lépe reaguje na konvenční léčbu. Z dalších diagnóz je nutno odlišit především jiné stavy vedoucí k erytrodermii jako např. kožní T lymfomy, generalizovanou kožní alergickou reakci, ekzém či subakutní kožní lupus erythematosus. V některých případech je třeba pomýšlet i na některé z puchýřnatých onemocnění jako pemphigus foliaceus. Folikulární vazba nutí zvažovat lichen planopilaris či morbus Darier. Palmární a plantární projevy kromě ekzémů je třeba odlišit od skupiny palmoplantárních keratodermií, projevy na dorzu rukou nutí zvážit dermatomyozitidu, deskvamace připouští úvahu o ichtyózách aj. [6, 50]. Při akutním začátku v dětství a dospívání je nutné odlišit Kawasakiho chorobu. Také u dětí dále vylučujeme běžné dermatózy jako psoriázu, seboroickou dermatitidu, ekzém, numulární ekzém, ichtyózu, symetrickou progresivní erytrokeratodermii, erythrokeratodermia variabilis, lichen spinulosus, syndrom deskvamující kůže („peeling skin syndrome“), keratosis circumscripta, frynoderma doprovázející jako folikulární hyperkeratóza deficity vitaminů a též sekundární syfilis [67].
LÉČBA
Léčba PRP je často svízelná. Cílem léčby je snížení morbidity a omezení případných komplikací. Vzhledem ke vzácnosti onemocnění nejsou zatím k dispozici dvojitě zaslepené klinické studie. Pro nejasnou etiologii je léčba i nadále empirická. Účinnost léčebných metod bývá zkreslená častým spontánním ústupem onemocnění. Oproti psoriáze je PRP podstatně odolnější vůči léčbě [27].
Lokální léčba zahrnuje emolencia, keratolytika, lokální kortikosteroidy, dehty, analoga vitaminu D, retinoid tazaroten [37] a pimekrolimus [26]. Ke zmírnění svědění byl popsán příznivý účinek kapsaicinu z chilli papriček [52]. Při hledání alternativních postupů je třeba varovat například před exacerbací PRP po 5% imiquimodu, která byla popsána při léčbě solárních keratóz [80].
Fototerapie je u PRP podstatně méně účinná než u psoriázy. Fotochemoterapie PUVA s 8-methoxypsoralenem se zdá být účinnou [38]. Úspěšná může být i fototerapie v kombinaci s retinoidy (Re-UVA nebo Re-PUVA) [31, 52]. V odborné literatuře se kazuisticky popisuje léčebný účinek úzkospektrého UVB u PRP nereagující na celkovou léčbu acitretinem [74]. Známé jsou však i případy fotosenzitivní PRP, kde po UVB ozáření došlo k exacerbaci [21, 36, 81], proto je třeba tuto indikaci zvažovat individuálně. Z příbuzných metod byla jako alternativní léčba s úspěchem aplikována extrakorporální fotochemoterapie v dávce 2 J/cm2/měsíc [30, 33].
Systémová léčba je obdobná léčbě psoriázy. Lékem první volby jsou retinoidy. Goldsmith et al. popsali u všech 32 pacientů dobrou terapeutickou odpověď na izotretinoin v dávce 1–2 mg/kg/den po dobu 12–16 týdnů [23]. Lečba etretinátem v dávce 0,5 mg/kg/den je další alternativou. U adultní formy PRP vykázal etretinát dokonce lepší účinnost než u izotretinoinu [10], u kterého je popisována lepší odpověď u dětí [4]. U dětí je největším rizikem dlouhodobé léčby retinoidy předčasné uzavření epifyzárních štěrbin s následnou poruchou růstu. Etretinát vystřídal acitretin, který se podává v obdobné dávce. U PRP rezistentní k léčbě acitretinem je v ojedinělých případech referována úspěšná léčba alitretinoinem v dávce 30mg/den [49].
Metotrexát (MTX) je lékem druhé volby a užívá se buď samostatně, nebo v kombinaci s retinoidy. Má však menší efekt než u psoriázy. Dávkování je obdobné, tedy 7,5–20 mg/týden. Úspěšně byl použit u III. typu PRP v dávce do 15 mg/týden [19]. V dávce 7,5 mg/týden po dobu šesti měsíců bylo MTX úspěšně léčeno sekundární jizevnaté ektropium rezistentní na léčbu retinoidy [76]. Na často zmiňovanou hepatotoxicitu MTX v kombinaci s acitretinem není jasné stanovisko [45]. U psoriázy jsou rizikovější pacienti s obezitou, diabetem a dyslipidémií, zda to platí i pro PRP dosud nebylo potvrzeno.
Cyklosporin se původně v léčbě PRP zdál být neúčinný [18]. Avšak poslední desetiletí ukazuje na možné léčebné účinky. U tří pacientů s PRP rezistentní k léčbě retinoidy došlo za 2–4 týdny při dávce cyklosporinu 5 mg/kg/den k výraznému zmírnění projevů. Při dávce 1,2 mg/kg/den však došlo k exacerbaci nemoci. Po navýšení na 2 mg/kg/den se stav opět zlepšil [71]. U čtyřletého chlapce s III. typem PRP došlo při dávce 3 mg/kg/den k rychlému ústupu erytrodermie během pěti týdnů [78].
Dále přicházejí do úvahy intravenózní imunoglobuliny 2 g/kg po tři dny v intervalu tří týdnů [40], azathioprin v dávce 50–200 mg/den [34] nebo u nás neregistrované deriváty kyseliny fumarové [13].
V posledních letech se objevily zprávy o dobrém léčebném účinku biologických preparátů na PRP užívaných v terapii psoriázy, především inhibitorů TNFαα. Příznivý účinek infliximabu byl pozorován v jednotlivých případech: z devíti pacientů byl u osmi z nich výborný efekt patrný již po dvou týdnech od první infuze infliximabu v dávce 5 mg/kg [51]. Etanercept byl s úspěchem použit u tří pacientů s PRP rezistentních k léčbě retinoidy a UVB, a to v dávce 50 mg 2krát týdně po 3–7 měsíců [16, 29, 62]. Kombinace etanerceptu (50 mg 1krát týdně) s acitretinem (0,2 mg/kg/den) vedla u čtyř pacientů ke klinickému zlepšení již za 4–12 týdnů [22]. U dospělé PRP bylo popsáno 75% zlepšení po 17týdenním podávání 50 mg 1krát týdně [74]. U dětského III. typu PRP nastala kompletní remise po 16týdenní léčbě [15]. Příznivý účinek byl popsán i při použití dalších biologik, jakými jsou adalimumab [54, 66, 77], ustekinumab [57, 79] a efalizumab [41].
U HIV pozitivních nemocných (VI. typ PRP) má antiretrovirová léčba dobrý efekt na projevy PRP.
Symptomaticky se ke zmírnění svědění u všech forem celkově používají antihistaminika [52].
ZÁVĚR
Onemocnění je sice známo od 19. století, ale jeho etiopatogeneze nadále zůstává velkou neznámou. Jedná se o onemocnění vyžadující zvýšenou diagnostickou obezřetnost, především v jeho počátcích. Na tuto diagnózu je třeba pomýšlet zejména při progredujících, klinickým obrazem odpovídajících exantémech nereagujících na lokální léčbu. I když histologické vyšetření není úplně příznačné, jeho nepostradatelnost s následnou klinickopatologickou korelací je zřejmá. V současnosti není standardní léčba pro PRP, využívá se léků jako u psoriázy, avšak jejich účinnost je u PRP nižší. U dětí převažuje léčba konzervativní, protože postižení bývá často jen lokalizované a prognóza obvykle dobrá. V dospělosti má lokální terapie – vzhledem k převaze generalizovaných forem – podružný význam, zásadní je léčba celková, především retinoidy. V druhém sledu lze použít další systémové léky, analogicky jako u psoriázy, a výhledově i inhibitory TNF. Fototerapie nemá u pityriasis rubra pilaris takový efekt jako u psoriázy, navíc se zde častěji setkáme s fotosenzitivitou. Perspektivní je tzv. cílená léčba zaměřující patogenetické pochody na molekulární úrovni, zahrnující i tzv. biologika a malé molekuly.
Podpořeno projektem UK: SVV 260 510.
Do redakce došlo dne 2. 5. 2011.
Kontaktní adresa:
MUDr. Petr Velčevský
Dermatovenerologická klinika 1. LF UK a VFN
U Nemocnice
2
128 08 Praha 2
e-mail: petr.velcevsky@vfn.cz
Sources
1. ABBOTT, R. A., GRIFFITHS, W. A. Pityriasis rubra pilaris type 1 spontaneously resolving after 20 years. Clin. Exp. Dermatol., 2009, 34, 3, p. 378–379.
2. AL-NATOUR. Pityriasis rubra pilaris: Report of 16 cases in Saudi Arabia. J. Am. Acad. Dermatol., 2010, P3330, p. AB130.
3. ALBERT, M. R., MACKOOL, B. I. Pityriasis rubra pilaris. Int. J. Dermatol., 1999, 38, 1, p. 1–11.
4. ALLISON, D. S., EL-AZHARY, R. A., CALOBRISI, S. D. et al. Pityriasis rubra pilaris in children. J. Am. Acad. Dermatol., 2002, 47, 3, p. 386–389.
5. AUFFRET, N., QUINT, L., DOMART, P. et al. Pityriasis rubra pilaris in a patient with human immunodeficiency virus infection. J. Am. Acad. Dermatol., 1992, 27, p. 260–261.
6. BERRY, M., KHACHEMOUNE, A. Extensive tinea versicolor mimicking Pityriasis rubra pilaris. J. Drugs Dermatol., 2009, 8, 5, p. 490–491.
7. BESNIER, E. Observation pour server a historic clinique du pityriasis rubra pilaris (In French). Am. Dermatol. Syphil. (Paris), 1889, 10, p. 253–287.
8. BETTO, P., VASSILOPOULOU, A., COLOMBARI, R., VELLER-FORNASA, C. Acute juvenile pityriasis rubra pilaris: a case report after mononucleosis infection. G. Ital. Dermatol. Venereol., 2008, 143, 4, p. 271–273.
9. BLAUVELT, A., NAHASS, G. T., PARDO, R. J. et al. Pityriasis rubra pilaris and HIV infection. J. Am. Acad. Dermatol., 1991, 24, p. 703–705.
10. BOROK, M., LOWE, N. J. Pityriasis rubra pilaris. J. Am. Acad. Dermatol., 1990, 22, p. 792–795.
11. BRAUN-FALCO, O., RYCKMANNS, F., SCHMOECKEL, C. et al. Pityriasis Rubra Pilaris: A Clinico-Pathological and Therapeutic Study with Speciál Reference to Histochemistry, Autoradiography, and Electron Microscopy. Arch. Dermatol. Res., 1983, 275, p. 287–295.
12. CLAYTON, BD., JORIZZO, JL., HITCHCOCK, MG., et al. Adult pityriasis rubra pilaris: a 10-year case series. J. Am. Acad. Dermatol., 1997, 36, p. 959–964.
13. CORAS, B., VOGT, T. H., ULRICH, H. et al. Fumaric acid esters therapy: a new treatment modality in pityriasis rubra pilaris? Br. J. Dermatol., 2005, 152, p. 388–389.
14. COWEN, P., O’KEEFE, R. Pityriasis rubra pilaris and focal acantholytic dyskeratosis. Australas J. Dermatol., 1997, 38, p. 40–41.
15. COX, V., LESESKY, E. B., GARCIA, B. D. et al. Treatment of juvenile pityriasis rubra pilaris with etanercept. J. Am. Acad. Dermatol., 2008, 59, 5, p. 113–114.
16. DAVIS, K. F., WU., J. J., MURASE, J. E. et al. Clinical improvement of pityriasis rubra pilaris with combination etanercept and acitretin therapy. Arch. Dermatol., 2007, 143, 12, p. 1597–1599.
17. DE BEURMANN, B. H. Pityriasis rubra pilaire familial. Ann. Dermatol. Syphiligr. (Paris) 1910, 1, 5, p. 609–619.
18. DICKEN, CH. Treatment of classic pityriasis rubra pilaris. J. Am. Acad. Dermatol., 1994, 31, p. 997–999.
19. DOOREN-GREEBE, R. J., KERKHOF, P. C. Extensive extraspinal hyperostoses after long-term oral retinoid treatment in a patient with pityriasis rubra pilaris. J. Am. Acad. Dermatol., 1995, 32, p. 322–325.
20. DOUGHTY, L. E., WELLS, M. J., STETSON, C. L. Pityriasis rubra pilaris with epidermolytic hyperkeratosis. J. Drugs Dermatol., 2008, 7, 10, p. 978–979.
21. EVANGELOU, G., MURDOCH, S. R., PALAMARAS, I. et al. Photoaggravated pityriasis rubra pilaris. Photodermatol. Photoimmunol. Photomed., 2005, 21, 5, p. 272–274.
22. GARCOVICH, S., DI GIAMPETRUZZI, A. R., ANTONELLI, G. et al. Treatment of refractory adult-onset pityriasis rubra pilaris with TNF-alpha antagonists: a case series. JEADV, 2010, 24, p. 881–884.
23. GOLDSMITH, L. A., WEINRICH, A. E., SHUPACK, J. Pityriasis rubra pilaris response to 13-cis-retinoic acid (isotretinoin). J. Am. Acad. Dermatol., 1982, 6, p. 710–715.
24. GÓMEZ-MOYANO, E., CRESPO-ERCHIGA, A., VERA CASA—O, A. et al. Pitiriasis rubra pilaris acantolítica durante tratamiento con imiquimod 5% Rema. Actas Dermosifiliogr, 2010, 101(10), p. 898-900.
25. GONZALEZ-LOPEZ, A., VELASCO, E., POZO, T. et al. HIV-associated pityriasis rubra pilaris responsive to triple antiretroviral therapy. Br. J. Dermatol., 1999, 140, p. 931–934.
26. GREGORIOU, S., ARGYRIOU, G., CHRISTOFIDOU, E. et al. Treatment of pityriasis rubra pilaris with pimecrolimus cream 1%. J. Drugs Dermatol., 2007, 6, 3, p. 340–342.
27. GRIFFITHS, W. A. Pityriasis rubra pilaris. Clin. Exp. Dermatol., 1980, 5, p. 105.
28. GRIFFITHS, W. A. Vitamin A and pityriasis rubra pilaris. J. Am. Acad. Dermatol., 1982, 7, p. 555.
29. GUEDES, R., LEITE, L. Treatment of pityriasis rubra pilaris with etanercept. Dermatol. Ther., 2011, 24, 2, p. 285–286.
30. HAENSSLE, H. A., BERTSCH, H. P., EMMERT, S. et al. Extracorporeal photochemotherapy for the treatment of exanthematic pityriasis rubra pilaris. Clin. Exp. Dermatol., 2004, 29, 3, p. 244–246.
31. HERBST, R. A., VOGELBRUCH, M., EHNIS, A. et al. Combined ultraviolet A1 radiation and acitretin therapy as a treatment option for pityriasis rubra pilaris. Br. J. Dermatol., 2000, 142, p. 574–575.
32. HIRAO, A., KAWADA, A., OISO, N. et al. Pityriasis rubra pilaris with preceding cytomegalovirus infection. J. Am. Acad. Dermatol., 2010, P3324, p. AB129.
33. HOFER, A., MÜLLEGGER, R., KERL, H. et al. Extracorporeal photochemotherapy for the treatment of erythrodermic pityriasis rubra pilaris. Arch. Dermatol., 1999, 135, p. 475–476.
34. HUNTER, G. A., FORBES, I. J. Treatment of pityriasis rubra pilaris with azathioprine. Br. J. Dermato., 1972, 87, 1, p. 42–45.
35. CHAN, H., LIU, F. T., NAGUWA, S. A Review of Pityriasis Rubra Pilaris and Rheumatologic Associations. Clinical & Developmental Immunology, 2004, 11, 1, p. 57–60.
36. IREDALE, H. E., MEGGITT, S. J. Photosensitive pityriasis rubra pilaris. Clin. Exp. Dermatol., 2006, 31, 1, p. 36–38.
37. KARIMIAN-TEHERANI, D., PARISSA, M., TANEW, A. Response of juvenile circumscribed pityriasis rubra pilaris to topical tazarotene treatment. Pediatr. Dermatol., 2008, 25, 1, p. 125–126.
38. KASKEL, P., KOLLMAN-GRUNDMANN, M., SCHILLER, M. I. et al. Bath-PUVA as treatment for pityriasis rubra pilaris provoked by ultraviolet B. Br. J. Dermatol., 1999, 140, p. 769–770.
39. KAWARA, S., MIYAKE, M., OISO, N. et al. Pityriasis rubra pilaris with preceding cytomegalovirus infection. Dermatology, 2009, 219, 4, p. 350–352.
40. KEER, A. C., FERGUSON, J. Type II adult-onset pityriasis rubra pilaris successfully treated with intravenous immunoglobulin. Br. J. Dermatol., 2007, 156, p. 1055–1056.
41. KLEIN, A., SZEIMIES, R. M., LANDTHALER, M. et al. Exacerbation of pityriasis rubra pilaris under efalizumab therapy. Dermatology, 2007, 215, 1, p. 72–75.
42. KNUDSEN, E. A. Pityriasis rubra pilaris in identical twins. Br. J. Dermatol., 1958, 70, p. 27–29.
43. KOLEY, S., CHOUDHARY, S., SALODKAR, A. et al. Circumscribed juvenile type pityriasis rubra pilaris (type 4): are we missing them. Journal of Pakistan Association of Dermatologists, 2010, 20, p. 98–102.
44. LIN, W. L., LIN, W. C., SHIH, I. H. et al. Juvenile pityriasis rubra pilaris in Chang Gung Memorial Hospital. Taipei and Linkou: a retrospective study in the past ten years. Dermatol. Sinica, 2007, 25, p. 248–55.
45. LOWENTHAL, K. E., HORN, P. J., KALB, R. E. Concurrent use of methotrexate and acitretin revisited. J. Dermatolog. Treat., 2008, 19, 1, p. 22–26.
46. MAGRO, C. M., CROWSON, A. N. The clinical and histomorphological features of pityriasis rubra pilaris – a comparative analysis with psoriasis. J. Cutan. Pathol., 1997, 24, p. 416–24.
47. MARTINEZ CALIXTO, L. E., SURESH, L., MATSUMURA, E. et al. Oral pityriasis rubra pilaris. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod., 2006, 101, 5, p. 604–607.
48. MIRALLES, E. S., NUNEZ, M., DE LAS HERAS, M. E. et al. Pityriasis rubra pilaris and human immunodeficiency virus infection. Br. J. Dermatol., 1995, 133, p. 990–993.
49. MOLIN, S., RUZICKA, T. Treatment of refractory pityriasis rubra pilaris with oral alitretinoin: case report. Br. J. Dermatol., 2010, 163, 1, p. 221–223.
50. MUHTEREM, P. et al. Dermatomyositis with a Pityriasis Rubra Pilaris-like Eruption: An Uncommon Cutaneous Manifestation in Dermatomyositis. Pediatr. Dermatol., 2007, 24, 2, p. 151–154.
51. MÜLLER, H., GATTRINGER, C., ZELGER, B. et al. Infliximab monotherapy as first-line treatment for adult-onset pityriasis rubra pilaris: case report and review of the literature on biologic therapy. J. Am. Acad. Dermatol., 2008, 59, 5, Suppl, p. 65–70.
52. NEESS, C. M., HINRICHS, R., DISSEMOND, J. Treatment of pruritus by capsaicin in a patient with pityriasis rubra pilaris receiving RE-PUVA therapy. Clin. Exp. Dermatol., 2000, 25, 3, p. 209–211.
53. NIEMI, K. M., KOUSA, M., STORGARDS, K. et al. Pityriasis rubra pilaris. A clinico-pathological study with a special reference to autoradiography and histocompatibility antigens. Dermatologica, 1976, 152, 2, p. 109–118.
54. O’KANE, D., DEVEREUX, C. E., WALSH, M. Y. et al. Rapid and sustained remission of pityriasis rubra pilaris with adalimumab treatment. Clin. Exp. Dermatol., 2010, 35, 4, p. e155–e156.
55. RASI, A., SOLTANI-ARABSHAHI, R., NARAGHI, Z. S. Circumscribed juvenile-onset pityriasis rubra pilaris with hypoparathyroidism and brachyonychia. Cutis, 2006, 77, 4, p. 218–222.
56. REINHARDT, L. A., ROSEN, T. Pityriasis rubra pilaris as the initial manifestation of leukemia. Cutis, 1983, 31, p. 100–102.
57. RUIZ, V. R., SÁNCHEZ, C. D. Successful treatment of type 1 pityriasis rubra pilaris with ustekinumab therapy. Eur. J. Dermatol., 2010, 20, p. 630–631.
58. SANCHEZ-REGANA, M., CREUS, L., UMBERT, P. Pityriasis rubra pilaris. A long-term study of 25 cases. Eur. J. Dermatol., 1994, 4, p. 593–597.
59. SANCHEZ-REGANA, M., FUENTES, C. G., CREUS, L. et al. Pityriasis rubra pilaris and HIV infection: a part of the spectrum of HIV-associated follicular syndrome. Br. J. Dermatol., 1995, 133, p. 818–819.
60. SANCHEZ-REGANA, M., LOPEZ-GIL, F., SALLERAS, M. et al. Pityriasis rubra pilaris as the initial manifestation of internal neoplasia. Clin. Exp. Dermatol., 1995, 20, p. 436–438.
61. SEBASTIAN, A., KOFF, A. B., GOLDBERG, L. J. PRP with subcorneal acantholysis: Case report and review. J. Cutan Pathol., 2010, 37, p. 99–101.
62. SECKIN, D., TULA, E., ERGUN, T. Successful use of etanercept in type I pityriasis rubra pilaris. Br. J. Dermatol., 2008, 158, 3, p. 642–644.
63. SEHGAL, V. N., JAIN, M. K., MATHUR, R. P. Pityriasis rubra pilaris in Indians. Br. J. Dermatol., 1989, 121, p. 821–822.
64. SEHGAL, V. N., SRIVASTAVA, G. (Juvenile) Pityriasis rubra pilaris. Int. J. Dermatol., 2006, 45, p. 438–446.
65. SHARMA, S., WEISS, G. R., PAULGER, B. Pityriasis rubra pilaris as an initial presentation of hepatocellular carcinoma. Dermatology, 1997, 194, 2, p. 166–167.
66. SCHREML, S., ZELLER, V., BABILAS, P. et al. Pityriasis rubra pilaris successfully treated with adalimumab. Clin. Exp. Dermatol., 2010, 35, 7, p. 792–793.
67. SCOTT, J., LEE, T. M. Differential Diagnosis for the Dermatologist. Berlin Heidelberg: Springer-Verlag, 2008, p. 1008–1010,
68. SONNEX, T. S., DAWBER, R. P., ZACHARY, C. B. et al. The nails in adult type 1 pityriasis rubra pilaris. A comparison with Sézary syndrome and psoriasis. J. Am. Acad. Dermatol., 1986, 15, p. 956–960.
69. STOLL, D. M., KING, L. E., CHYTIL, F. Serum levels of retinol binding protein in patients with pityriasis rubra pilaris. Br. J. Dermatol., 1983, 108, p. 375.
70. TARRAL C. General psoriasis. Desquamation from the parts covered with hair. In Rayer P. A Theoretical and Practical Treatise on the Diseases of the Skin. 2nd ed. London: Baillière, 1835, p. 648–649.
71. USUKI, K., SEKIYAMA, M., SHIMADA, T. et al. Three cases of pityriasis rubra pilaris successfully treated with cyclosporin A. Dermatology, 2000, 200, 4, p. 324–327.
72. VAHLQUIST, A. Retinol binding protein and pityriasis rubra pilaris. Br. J. Dermatol., 1982, 107, p. 125–127.
73. VANDERHOOFT, S. L., FRANCIS, J. S., HOLBROOK, K. A. et al. Familial pityriasis rubra pilaris. Arch. Dermatol., 1995, 131, 4, p. 448–453.
74. VASHER, M., SMITHBERGER, E., LIEN, M. H. et al. Familial pityriasis rubra pilaris: report of a family and therapeutic response to etanercept. J. Drugs Dermatol., 2010, 9, 7, p. 844–850.
75. VERGILIS-KALNER, I. J., MANN, D. J., WASSERMAN, J. et al. Pityriasis rubra pilaris sensitive to narrow band-ultraviolet B light therapy. J. Drugs Dermatol., 2009, 8, 3, p. 270–273.
76. VURAIRAJ, V. D., HORSLEY, M. B. Resolution of Pityriasis Rubra Pilaris-Induced Cicatricial Ectropion With Systemic Low-Dose Methotrexate. Am. J. Ophthal., 2007, 143, p. 709–710.
77. WALLING, H. W., SWICK, B. L. Pityriasis rubra pilaris responding rapidly to adalimumab. Arch. Dermatol., 2009, 145, p. 99–101.
78. WETZIG, T., STICHERING, M. Juvenilie pityriasis rubra pilaris: successful treatment with ciclosporin. Br. J. Dermatol., 2003, 149, p. 202–203.
79. WOHLRAB, J., KREFT, B. Treatment of Pityriasis Rubra Pilaris with Ustekinumab. Br. J. Dermatol., 2010, 163, p. 655–656.
80. YANG, F. C., JESSUP, C., DAHIYA, M. et al. Pityriasis rubra pilaris exacerbation with topical use of imiquimod. Int. J. Dermatol., 2008, 47, p. 1076–1078.
81. YANIV, R., BARZILAI, A., TRAU, H. Pityriasis rubra pilaris Exacerbated by Ultraviolet B Phototherapy. Dermatology, 1994, 189, p. 313.
Labels
Dermatology & STDs Paediatric dermatology & STDsArticle was published in
Czech-Slovak Dermatology

2011 Issue 3
Most read in this issue
- Pityriasis rubra pilaris
- Miliaria pustulosa
- Význam diagnostické hypoalergenní diety u pacientů s atopickým ekzémem
- Dispenzarizace pacientů s maligním melanomem