Chlamydiové infekce
Chlamydial Infections
Chlamydiae are ubiquitous obligate intracellular bacteria replicating in eucaryotic cells. They belong to the most common microorganisms in humans and animals and cause wide range of human and animal infections. In dermatovenereology they are important in differential diagnosis of sexually transmitted diseases (STD).
Key words:
urogenital chlamydia infections – epidemiology – clinical picture – therapy
Authors:
I. Kuklová 1; R. Trýzna 1; M. Kojanová 1; P. Velčevský 1
Authors‘ workplace:
Dermatovenerologická klinika 1. LF UK Praha
přednosta prof. MUDr. Jiří Štork, CSc.
1
Published in:
Čes-slov Derm, 86, 2011, No. 5, p. 219-223
Category:
Reviews (Continuing Medical Education)
Overview
Chlamydie jsou ubikviterní, obligátní, intracelulární bakterie, rozmnožují se v eukaryotických buňkách, způsobují u lidí i zvířat široké spektrum onemocnění a patří k nejrozšířenějším mikroorganismům v lidské i živočišné říši. Pro dermatovenerology jsou důležité z hlediska diferenciální diagnostiky sexuálně přenosných onemocnění (STD).
Klíčová slova:
urogenitální chlamydiové infekce – epidemiologie – klinický obraz – léčba
KLASIFIKACE
Jednotlivé druhy byly vyčleněny podle svých biologických a biochemických vlastností a více než 95 % homologie jejich 16S ribosomální RNA sekvence. V roce 1999 Everett et al. publikoval nový návrh na taxonomické třídění založené na fylogenetických analýzách 16S a 23S rRNA genů. Podle tohoto návrhu je doporučováno rozeznávat 2 rody: rod Chlamydia (s druhem Chlamydia trachomatis, Chlamydia muridarum a Chlamydia suis) a rod Chlamydophila (s druhy Chlamydophila pneumonaie, Chlamydophila psittaci a Chlamydophila pecorum) [5, 8].
Návrh na změnu taxonomie však nebyl odbornou veřejností všeobecně akceptován. Podle současné, všeobecně akceptované taxonomie je v rámci čeledi Chlamydiaceae rozeznáván jediný rod Chlamydia se čtyřmi druhy: Chlamydia trachomatis, Chlamydia pneumoniae, Chlamydia psittaci a Chlamydia pecorum. Podle typově specifických proteinových antigenů na povrchu elementárních tělísek se rod Chlamydia dělí na 18 sérotypů (sérovary); sérotypy A–C způsobují trachom, sérotypy D–K jsou původci urogenitálních infekcí a konjunktivitid, sérotypy L1–3 vyvolávají lymphogranuloma venereum [5, 8, 9, 22] – tabulka 1.

Na základě imunofluorescenčního vyšetření rozlišujeme tři biotypy (biovary): trachom (zahrnuje sérotypy A–C a sérotypy D–K ), LGV (lymphogranuloma venereum), třetí biovar zahrnuje původce pneumonitidy u myší (MPA-mouse pneumonitis agent). Biovar trachoma má afinitu k cylindrickému epitelu sliznic, biovar LGV k lymfatické tkáni [10, 13]. V humánní medicíně mají hlavní význam Ch. trachomatis a Ch. pneumonie, zatímco Ch. psittaci je primárně zvířecí patogen s možností přenosu na člověka. Výraz chlamydie se obvykle vztahuje k celé čeledi [5, 8, 9, 10, 21].
MORFOLOGIE
Chlamydie jsou příbuzné gramnegativním bakteriím. Mají obě nukleové kyseliny a stavba buněčné stěny je podobná jako u ostatních gramnegativních bakterií, ale na rozdíl od nich jsou intracelulární energetičtí paraziti, kteří nejsou vybaveni vlastním systémem pro tvorbu ATP a ke svým metabolickým procesům využívají ATP hostitelské buňky, proto se označují jako energetičtí parazité eukaryotických buněk. Jejich rozmnožovací cyklus je rovněž odlišný od ostatních gramnegativních bakterií. Jednotlivé fáze – extracelulární a intracelulární – jsou morfologicky a funkčně odlišné. Extracelulární forma, tzv. elementární tělísko (EB – elementary body), je metabolicky neaktivní, ale infekční. Má velikost 250–400 nm. Infekční tělísko se endocytózou dostává dovnitř hostitelské buňky a zde uvnitř endosomu probíhá druhá vývojová fáze – přeměna elementárního tělíska v retikulární tělísko (RB – reticular body) a jeho dělení. Retikulární tělísko je neinfekční, ale metabolicky aktivní a je schopné dělení. Jeho velikost je 800–1200 nm. Binární dělení retikulárních tělísek probíhá po dobu 24–60 hodin v závislosti na druhu. Po uplynutí této doby se retikulární tělíska opět transformují v elementární a cyklus je obvykle ukončen prasknutím buňky a uvolněním elementárních infekčních tělísek, která infikují další vnímavé buňky. Celý růstový cyklus trvá obvykle 48–72 hodin. Elementární i retikulární tělíska jsou obklopena dvojitou membránou, podobně jako ostatní gramnegativní bakterie. Vnější membrána EB je složena z proteinů, fosfolipidů a lipopolysacharidu (LPS). Hlavní membránový protein (MOMP) představuje až 60 % z celkového množství proteinů vnější membrány a je jedním z hlavních povrchových antigenů. Jeho molekulová hmotnost je přibližně 40 kDa a obsahuje druhově, poddruhově a typově specifické epitopy, jež umožňují, zejména u Ch. trachomatis, sérologickou typizaci kmenů. Lipopolysacharid je druhým hlavním povrchovým antigenem. Chlamydiový LPS je imunologicky podobný lipopolysacharidu enterobakterií. Je to rodově specifický antigen a v roce 1987 se podařilo identifikovat pro chlamydie specifický epitop – trisacharidovou sekvenci. Tato struktura se nachází pouze u chlamydií a posléze byla využita pro diagnostické účely. Chlamydie disponují také (z hlediska imunopatologie rizikovými) prozánětlivě působícími molekulami – chlamydiovými proteiny tepelného šoku (chHsp). Uvažuje se o jejich potenciální možnosti navodit mechanismem zkřížené reaktivity autoimunitní zánět proti lidskému Hsp [5, 11].
OČNÍ INFEKCE
Trachom je chronická konjunktivitida vyvolaná Ch. trachomatis, biovar trachoma, sérotypu A, B, Ba a C, je nejčastější příčinou endemické slepoty v rozvojových zemích, nepřenáší se sexuálně, ale přímým kontaktem se sekrety postižených osob nebo kontaminovanými předměty. Celosvětově postihuje 500 miliónů osob.
Oční infekce vyvolaná Ch. trachomatis, biovar trachoma, sérotypu D-K postihuje převážně dospělé, sexuálně aktivní osoby a děti, které bývají infikovány od matky. Projevuje se formou inkluzní konjunktivitidy (paratrachom). Novorozenci, kteří se narodí matkám s cervikální chlamydiovou infekcí, mají 60–70% pravděpodobnost, že budou nakaženi konjunktivitidou nebo pneumonií. U dospělých má většinou mírný průběh a spontánně vymizí [5, 11].
SEXUÁLNĚ PŘENOSNÉ INFEKCE
Existují dva odlišné typy sexuálně přenosných infekcí vyvolaných Ch. trachomatis:
- urogenitální chlamydiová infekce (Ch. trachomatis, biovar trachoma, sérotyp D-K)
- lymphogranuloma venereum (Ch. trachomatis, biovar LGV, sérotyp L1-L3)
Urogenitální chlamydiová infekce vyvolaná Ch. trachomatis sérotypu D-K je v Evropě i USA nejčastější bakteriální STD, odhaduje se, že v průmyslových zemích představuje kolem 50 % všech urogenitálních nákaz. Chlamydiové infekce jsou dnes častější než infekce gonokokové a často se s nimi kombinují. Velkým rizikem, zvláště pro ženy, je skutečnost, že průběh může být až v 80 % případů asymptomatický. Chlamydiové infekce podobně jako jiné cervicitidy a uretritidy zvyšuje riziko přenosu HIV.
Klinické příznaky akutní infekce Ch. trachomatis v urogenitálním ústrojí připomínají kapavku, ale výtok bývá na rozdíl od kapavky spíše hlenovitý. Primárně bývá postižen cylindrický epitel uretry, děložního čípku, případně epitel rekta, při orálním styku může dojít i k infekci faryngu. Neléčená infekce může vyvolat u mužů epididymitidu a sexuálně získanou reaktivní artritidu (SARA – sexually acquired reactive arthritis), u žen endometritidu, salpingitidu a Fitzův-Hughův-Curtisův syndrom (perihepatitida spojená s genitální chlamydiovou nebo gonokokovou infekcí). Pánevní záněty (pelvic inflammatory disease, PID) mohou vést k poškození vejcovodů, tubární neplodnosti a ektopickým graviditám a představují obrovský problém pro reprodukční zdraví žen. PID se může vyvinout u 10–40 % genitálních infekcí Ch. trachomatis [9, 11]. Infekce bývá také spojována s chronickou pánevní bolestí a se zvýšeným rizikem ovariálního karcinomu [17]. Riziko rozvoje následků urogenitálních chlamydiových infekcí stoupá s počtem PID epizod. Možnost přenosu chlamydiové infekce z matky na dítě během porodu je dalším závažným důsledkem této infekce. Při průchodu infikovanými porodními cestami se mohou nakazit až dvě třetiny novorozenců. Klinickým projevem je novorozenecká konjunktivitida s inkubační dobou nejčastěji 4–10 dnů, později se může rozvinout atypická pneumonie. Infikováni mohou být i novorozenci porození císařským řezem, nejčastěji se jedná o vzestupnou infekci při předčasném odtoku plodové vody.
EPIDEMIOLOGIE, HLÁŠENÍ
V západoevropských zemích, v USA a Kanadě jsou infekce častější u nižších sociálních skupin a ve velkoměstské populaci. Nejrizikovější skupinou jsou sexuálně aktivní adolescenti a mladí dospělí do 24 let [2, 7]. Hlášení v zemích východní Evropy je nedostatečné nebo se neprovádí, incidence se pohybuje od 21 do 276 na 100 000 obyvatel [3, 20]. V České republice chybí data týkající se incidence infekcí v běžné populaci, v souhlase s doporučeními aktualizovaných směrnic evropských společenství má každá osoba, která diagnostikuje onemocnění Ch. trachomatis, povinnost hlásit orgánu ochrany veřejného zdraví potvrzené a pravděpodobné případy onemocnění a úmrtí na toto onemocnění (malá „červená“ hlášenka). Kumulativní data hlásí jednou měsíčně také laboratoře. U pozitivních případů je nutné provést depistážní šetření, cílené vyšetření u všech kontaktů a příslušné kontroly za 6 týdnů po ukončení terapie [16].
Urogenitální chlamydiové infekce v materiálu Dermatovenerologické kliniky 1. LF UK
V období 12 měsíců, od 1. 7. 2009 do 30. 6. 2010 jsme vyšetřili ve spolupráci s oddělením Klinické biochemie a laboratorní diagnostiky 1. LF UK a VFN celkem 2 514 pacientů. Ch. trachomatis byla detekována pomocí RT-PCR (real-time PCR). Test obsahuje páry primerů a sond, které jsou specifické pro CT DNA kryptického plazmidu a pro CT DNA ompA gen. Byly testovány vzorky moče, výtěry z uretry a cervixu. Nález byl pozitivní u 438 pacientů (prevalence 17,4%; 14,7 % v souboru žen; 18,3 % v souboru mužů). Pacienti s prokázanou infekcí vyplňovali anonymní dotazník týkající se rizikového sexuálního chování. Na základě zpracovaných dat ze 400 vyplněných dotazníků bylo zjištěno, že celkem 28 % mužů a 9 % žen mělo recidivující chlamydiovou infekci. Koinfekci s gonoreou mělo 6,8 % mužů a 11,2 % žen; 38 % pacientů mělo výtok; v souboru bylo 8 % homo/bisexuálních mužů; 4,6 % pacientů uvádělo poskytování placených sexuálních služeb. V porovnání s kapavkou byla prevalence vyšší o 9,5 %. V porovnání se zahraničními studiemi byly v souboru zastoupeni pacienti vyšších věkových skupin (nad 25 let věku), tato skutečnost může být ovlivněna demografickou strukturou pražské populace. V porovnání s nálezy z let 1994–1995 došlo k mírnému poklesu prevalence. Preventivní aktivity by měly být směřovány především na pacienty s recidivující infekcí a s koinfekcí s jinými STD.
DIAGNOSTIKA
Podle aktuálních evropských doporučení jsou jediným testem vhodným pro diagnostiku urogenitálních infekcí amplifikační metody (NAATs – nucleic acid amplification techniques), např. polymerázová nebo ligázová řetězová reakce (PCR, LCR) (4, 9). Při PCR (polymerázová řetězová reakce) dochází k amplifikaci jedinečného úseku bakteriálního geonomu pomocí synteticky připravených sond (primerů) a termostabilní DNA polymerázy. Produkty reakce jsou detekovány po obarvení ethidium bromidem pomocí elektroforézy v agarovém gelu nebo pomocí hybridizace se značenými sondami, a to buď v průběhu reakce (real-time PCR) nebo na jejím konci (imunohistochemická detekce hybridů). Citlivost amplifikačních metod je odhadována na 90–98 %, další výhodou těchto metod je možnost současně detekovat Ch. trachomatis a N. gonorrhoeae z jednoho vzorku a možnost vyšetřování obou agens i z moči.
Základní podmínkou pro detekci je správně provedený odběr. Při odběru cervikálních vzorků je třeba vždy odstranit hlen z exocervixu a jiným tampónem provést rotačním pohybem po dobu cca 20 sekund vlastní stěr z endocervixu. Uretrální stěry je třeba odebírat z hloubky 2–4 cm, rotačním pohybem setřít epitel, před odběrem by pacient neměl alespoň 2 hodiny močit. U močových vzorků by se vždy mělo jednat o první porci moči, 15–20 ml do sterilní nádobky, interval od posledního močení 2 hodiny nebo první ranní moč. Transport se provádí při 2–8 °C do 24 hod. [5, 18, 11]. Sérologické vyšetření může být diagnostické u LGV infekcí (vysoké titry IgG a/nebo IgA) a u neonatální pneumonie (IgM), a naopak není indikováno u nekomplikovaných cervicitid a uretritid. Pokud není zachycena sérokonverze nebo signifikantní vzestup protilátek, má sérologické vyšetření poměrně malou výpovědní hodnotu. Lze použít metody detekce druhově specifických nebo rodově specifických protilátek. Při detekci druhově specifických protilátek se prokazují IgG, IgA a IgM protilátky proti druhově specifickým antigenům, hlavně proti MOMP metodou mikroimunofluerescenčního testu (MIF). Tento test má v porovnání s ostatními sérologickými metodami vysokou citlivost a specificitu. Druhou variantou je průkaz druhově specifických IgG a IgA pomocí ELISA testů, které využívají rekombinantní duhově specifické antigeny. Pro stanovení rodově specifických protilátek (antigeny jsou společné pro všechny druhy chlamydií) se používá test ELISA, imunodominantním antigenem je rekombinantní LPS komplex. Nevýhodou je, že rodově specifické IgA i IgM mohou po prodělané infekci dlouhodobě přetrvávat (několik měsíců), ale naopak při primoinfekci se vytvářejí dříve než druhově specifické protilátky. Samotný nález rodově specifických protilátek nelze považovat za průkaz infekce [18].
Jako suspektní probíhající nebo prodělanou infekci hodnotíme:
- průkaz druhově specifických IgG a IgM protilátek,
- nález vysokého titru druhově specifických IgG protilátek (1 : 512 a výše) a současně zvýšeného titru druhově specifických IgA protilátek (1 : 16 a výše),
- signifikantní vzestup druhově specifických protilátek v párových vzorcích séra.
Lymphogranuloma venereum
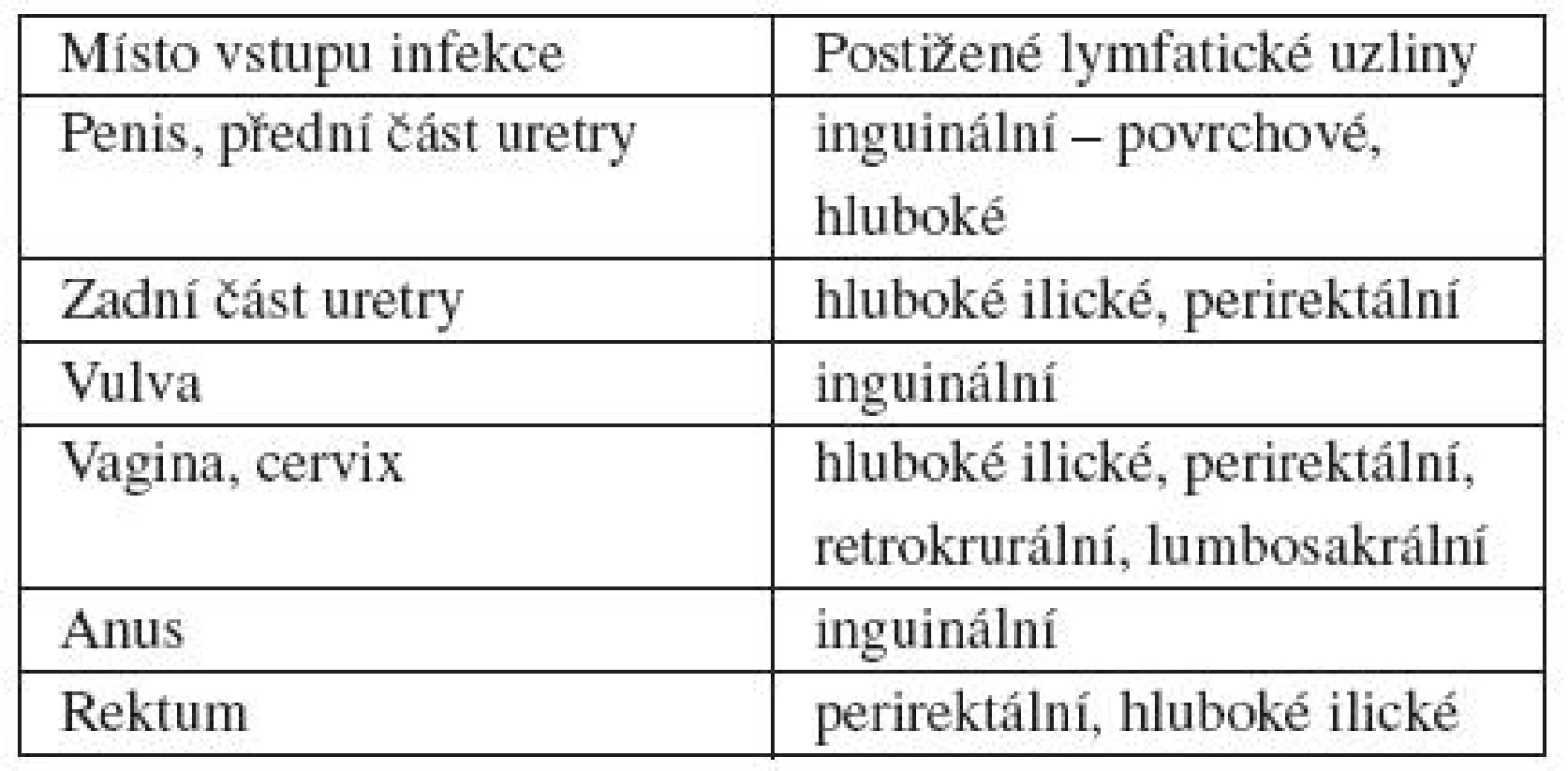
Lymphogranuloma venereum (LGV) je vyvoláno invazivnějším biovarem Ch. trachomatis (biovar lymphogranuloma venereum), sérotypy L1, L2 a L3. V tropických a subtropických zemích je nejčastější příčinou neplodnosti mužů a žen. Onemocnění postihuje převážně lymfatické cesty a bývá provázeno celkovými příznaky, např. třesavkou, bolestmi hlavy a kloubů. V typickém případě je primární lézí papula, která přechází do papulovezikuly nebo papulopustuly, později exulceruje. Vřed má většinou šedý povlak. U muže bývá primární projev lokalizován na glans penis včetně sulcus coronarius, preputiu nebo v přední části uretry, u ženy na vulvě, ve vagině nebo cervixu, u obou pohlaví v rektu, anu, vzácně v orofaryngu. Primární léze je nebolestivá a vzhledem ke krátkodobému trvání je často přehlédnuta. Postižení uzlin je závislé na lokalizaci primární léze. U heterosexuálních mužů jsou nečastěji postiženy uzliny inguinální (obvykle jednostranně) a femorální, u homosexuálních mužů uzliny rektální a u žen ilické a rektální (tab. 2). Komplikací je zánětlivá supurace uzlin, bolestivost, tvorba píštělí a následné jizvení. Rektální infekce žen a homosexuálních mužů vede k proktokolitidě, která se projevuje rektálním výtokem, bolestí anu, zácpou nebo průjmy, tenezmy a horečkami.
V západoevropských velkoměstech bylo po roce 2003 popsáno několik epidemií LGV vyvolaných sérotypem L2b u homosexuálních mužů. V klinickém obraze dominovaly proktokolitidy, ve většině případů byli postižení muži HIV pozitivní [6]. V České republice nebyl po druhé světové válce popsán žádný případ LGV. Plzeňští autoři upozorňují na jeden klinicky suspektní případ heterosexuálního muže s vředy na penisu a bolestivou oboustrannou lymfadenopatií, který měl syfilis a sérologicky prokázané anti-Ch. trachomatis IgG [19]. Podle posledního sdělení zachytila pracoviště FN Bulovka a Národní referenční laboratoř pro diagnostiku chlamydií SZÚ v Praze čtyři případy LGV u homosexuálních mužů (dosud nepublikovaná data). Lze předpokládat, že se u nás objeví i další případy LGV, které by mohly být zaměněny s proktokolitidami jiného původu. V diferenciální diagnostice proktokolitid, zvláště u homosexuálních mužů, by proto měla být zvažována možnost infekce LGV [10]. V současné době provádí v ČR testování na LGV pomocí PCR (firma Seegene) Národní referenční laboratoř pro diagnostiku chlamydií SZÚ, Praha. Před odběrem vzorku je nutno s laboratoří domluvit přesný způsob odběru.
LÉČBA
Lékem první volby je u nekomplikovaných urogenitálních infekcí azithromycin 1 g v jedné dávce. Alternativně lze podávat doxycyklin, 100 mg dvakrát denně po dobu 7 dnů nebo josamycin, 500–1000 mg dvakrát denně, eventuálně jiná makrolidová antibiotika. V těhotenství je lékem první volby rovněž azitromycin 1 g v jedné dávce. Alternativně lze použít amxocillin, 500 mg čtyřikrát denně 7 dní. Erytromycin není doporučován. U rektální (jiné než LGV) infekce je indikován doxycyklin, 100 mg dvakrát denně po dobu 1 týdne. U rektální LGV infekce se podává doxycyklin, 100 mg dvakrát denně 21 dnů [8, 13, 14].
Důležitá upozornění
- Pacienti s infekcí Ch. trachomatis by měli být testováni na hepatitidu B, gonoreu, syfilis a HIV.
- Onemocnění podléhá hlášení a depistážnímu šetření.
- Nejspolehlivějším diagnostickým testem jsou amplifikační metody; lze testovat vzorky moče, výtěry z uretry, cervixu, rekta a spojivek, eventuálně vaginální výtěry.
- Sérologické metody jsou doporučeny pouze v případě invazivních infekcí, např. LGV a pneumonie novorozenců.
- Lékem první volby nekomplikovaných urogenitálních infekcí je azithromycin, u LGV doxycyklin.
- Možnost infekce LGV by měla být zvažována v diferenciální diagnostice proktokolitid zvláště u homosexuálních mužů.
Grantová podpora: IGA MZ NS10292-3 v rámci pracovněprávního vztahu k 1. LF UK v Praze.
Do redakce došlo dne 15. 8. 2011.
Kontaktní adresa:
Doc. MUDr. Ivana Kuklová, CSc.
Dermatovenerologická klinika 1. LF UK a VFN
U Nemocnice 2
128 08 Praha 2
e-mail: ikuklova@post.cz
Sources
1. COOK, R. L., HUTCHISON, S. L., ØSTERGAARD, L., BRAITHWAITE, R. S., NESS, R. B. Systematic review: noninvasive testing for Chlamydia trachomatis and Neisseria gonorrhoeae. Ann. Intern. Med., 2005, 142 (11), p. 914–25.
2. DAS, S., SABIN, C., WADE, A., ALLAN, S. Sociodemography of genital co-infection with Neisseria gonorrhoeae and Chlamydia trachomatis in Coventry, UK. Int. J. STD AIDS, 2005, 16 (4), p. 318–22.
3. DOMEIKA, M. A., HALLÉN, A., KARABANOV, L. et al. Chlamydia trachomatis infections in eastern Europe: legal aspects, epidemiology, diagnosis, and treatment. Sex Transm. Infect., 2002, 78, p. 115–119.
4. Hadgu, A., Dendukuri, N., Hilden, J. Evaluation of nucleic acid amplification tests in the absence of a perfect gold-standard test: a review of the statistical and epidemiologic issues. Epidemiology, 2005, 16, p. 604-12.
5. HRUBÁ, D. Chlamydiové infekce. Postgraduální medicína, 2004, 4, p. 395–399.
6. JEBBARI, H. et al. Update on lymphogranuloma venereum in the United Kingdom. Sex Transm. Infect., 2007, 83, p. 324–326.
7. KAHN, R. H., MOSURE, D. J., BLANK, S. et al. Chlamydia trachomatis and Neisseria gonorrhoeae prevalence and coinfection in adolescents entering selected US juvenile detencion centers, 1997–2002. Sex Transm. Dis., 2005, 32, 4, p. 255–259.
8. KUKLOVÁ, I. Sexuálně přenosná onemocnění. In Weiss et al. Sexuologie. Praha. Grada, 2010, p. 579–612.
9. LANJOUW, E., OSSEWAARDE, J. M., STARY, A., BOAG, F., MEIJDEN, W. I. (edit) European guideline for the management of Chlamydia trachomatis infections, 2010.
10. McMILLAN, A. et al. The 2007 IUSTI/WHO guideline on the management of proctitis, proctocolitis and enteritis caused by sexually transmissible pathogens. Int. J. STD. AIDS, 2007, 18 (8), p. 514–520.
11. MEDKOVÁ, Z., KALOUSEK, I., JARČUŠKA, P. Chlamydiové infekce. 1. vydání, Praha: Triton, 2001, 111 s.
12. MIKL, J., SUDAR, Z., SMITH, P. F. et al. HIV infection and high risk behaviour among patients attending an STD referral clinic in Prague, Czech Republic. Sex Transm. Infect., 1998, 74, p. 128–130.
13. MMWR (CDC). Sexually transmitted diseases treatment guidelines 2010, 59, RR-12.
14. RADCLIFFE, K., European STD guidelines. Int. J. STD AIDS, 2001, 12, S3, p. 1–101.
15. RESL, V. Státní dozor ve venerologické práci. Čes-slov Derm, 2005, 80, 2, s. 102–103.
16. RESL, V., ZÁKOUCKÁ, H., KUKLOVÁ, I., SALAVEC, M., KŘEMENOVÁ, S. Aktuální informace a zpráva z venerologické sekce ČDS a Národní referenční laboratoře pro syfilis. Čes-slov Derm., 2011, 86, 1, s. 40–45.
17. RISCH, H., HOWE, G. Pelvic inflammatory disease and the risk of epithelial ovarian cancer. Cancer Epidemiol. Biomarkers Prev., 1995, 4, p. 447–451.
18. ROUBALOVÁ, K., JANEČKOVÁ, L. Doporučené metody pro diagnostiku Chlamydia trachomatis. Zprávy CEM (SZÚ, Praha), 2005, 14, 12, s. 510–514.
19. SNAKE, S., RESL, V., HRABÁK, J., HRUBÁ, D. Lymphogranuloma venereum: už i u nás? Čes-slov Derm., 2010, 85 (3), s. 164–168.
20. UUSKÜLA, A., PUUR, A., TOOMPERE, K., DEHOVITZ, J. Trends in the epidemiology of bacterial sexually transmitted infections in eastern Europe, 1995–2005. Sex Transm. Infect., 2010, 86, p. 6–14.
21. VOTAVA, M. et al. Lékařská mikrobiologie speciální. Brno, Neptun, 2003, 495 p.
22. ZÁKOUCKÁ, H., KUKLOVÁ, I. Diagnostika klasických pohlavních chorob. Čes-slov Derm., 2007, 82, 2, p. 65–74.
Labels
Dermatology & STDs Paediatric dermatology & STDsArticle was published in
Czech-Slovak Dermatology

2011 Issue 5
Most read in this issue
- Chlamydiové infekce
- Toxický erytém vyvolaný chemoterapií
- Scabies crustosa u dojčaťa
-
Léčba psoriázy v roce 2011
(komentovaný přehled novinek z amerických a německých doporučených postupů se zaměřením na ustekinumab)
