Pigmentové névy a jejich vztah ke vzniku kožního melanomu
Pigmented Naevi and Their Relationship to Malignant Melanoma
The development of a higher number of pigmented naevi is an important risk factor for melanoma. This is especially true for larger, so-called clinically atypical or dysplastic naevi. These naevi develop more frequently in people with a fair skin phototype. In the case of congenital naevi the melanoma risk is directly proportional to their size. For the development of the acquired naevi genetic factors appear to play more important role than the sun exposure. The exposure to sunlight can, however, result in the increasing number of naevi. According to various studies the protection with sunscreens is insufficient and, conversely, can lead to development of higher number of naevi. Relatively large number of naevocellular naevi can be often seen in patients with melanoma. Also the members of some families with familiar melanoma may develop increased number of (dysplastic) naevi. The evidence of familiar occurrence of melanoma is important for the identification of genetic factors which may play role in the melanoma initiation. Histopathologic evaluation of pigmented naevi belongs to the most complicated assessments in dermatopathology. The criteria used for lesions evaluation are not entirely specific and that is why some diagnostically relevant changes can be found in both benign and malignant lesions. It is, therefore, necessary to asses the all available data and to consider their mutual importance. The prevention of melanoma is of enormous importance and should particularly involve the patients with high numbers of pigmented, especially dysplastic naevi, patients with large congenital naevi, patients from the families with familiar melanoma and those who already had melanoma. This preventive care should be performed systematically by dermatologists.
Key words:
Pigmented naevi – melanoma – pigmentation – UV radiation
Authors:
S. Pavel; K. Pizinger
Authors‘ workplace:
přednosta prof. MUDr. Karel Pizinger, CSc.
; Dermatolovenerologická klinika LF UK a FN Plzeň
Published in:
Čes-slov Derm, 86, 2011, No. 6, p. 263-271
Category:
Reviews (Continuing Medical Education)
Overview
Větší množství pigmentových névů je důležitým rizikovým faktorem pro vznik melanomu. To platí zejména o větších, tzv. klinicky atypických či dysplastických névech. Tyto névy se vytvářejí častěji na kůži lidí se světlejším fototypem. U kongenitálních névů je riziko vzniku melanomu přímo úměrné jejich velikosti. Při vzniku získaných névocelulárních névů hrají genetické faktory patrně důležitější roli než sluneční záření. Sluneční záření může však počet těchto névů zvýšit. Výzkumy ukazují, že ochrana před slunečním zářením opalovacími krémy je nedostatečná a může naopak vést ke vzniku zvýšeného počtu těchto névů. Relativně velký počet névocelulárních névů se často nachází u pacientů s melanomem. Členové některých rodin s familiárním melanomem mají také vyšší počet (dysplastických) névů. Podchycení familiárního výskytu melanomu je důležité pro identifikace genetických faktorů, které vznik melanomu podmiňují. Histopatologické hodnocení pigmentových névů patří mezi nejkomplikovanější hodnocení v dermatopatologii. Kritéria, která se používají k posouzení lézí, nejsou zcela specifická a určité změny se najdou jak u benigních lézí, tak u melanomu. Nálezy je proto třeba hodnotit jako celek a navzájem porovnávat jejich váhu. Velmi důležitá je prevence vzniku melanomu, která by se měla zejména týkat pacientů s velkým počtem pigmentových, a zejména dysplastických névů, pacientů s velkými kongenitálními névy, pacientů s rodinným výskytem melanomu a pacientů, kteří již měli melanom. Tato preventivní péče by měla být prováděna systematicky kožními lékaři.
Klíčová slova:
pigmentové névy – melanom – pigmentace – UV záření
ÚVOD
Mnozí lidé se domnívají, že časté slunění je jediným rizikovým faktorem pro vznik kožního melanomu. Vznik kožního melanomu se také často v médiích používá jako odstrašující příklad důsledků dlouhodobého vystavování kůže slunečnímu záření. Vědecký náhled na vznik kožního melanomu je však mnohem složitější. Různé epidemiologické studie z posledních let přinesly důkazy, že pro vznik melanomu jsou důležitější genetické faktory, než faktory okolního prostředí. Jako příklad je možné uvést práci z australského Brisbane, kde se autoři zaměřili na rizikové faktory u mladé populace (15–19 let) pacientů s kožním melanomem [35]. Tento výzkum byl založen na myšlence, že nejdůležitější rizikové faktory pro vznik melanomu se uplatní v mladším věku než faktory méně důležité. Autoři srovnávali údaje 201 pacienta s kontrolní skupinou skládající se ze 196 zdravých osob srovnatelného stáří, pohlaví a bydliště. Zdaleka nejdůležitějším rizikovým faktorem pro vznik melanomu byl počet menších a větších melanocytárních névů. Mnohem méně se uplatňovaly jiné faktory: velmi světlá kůže (která se vždy spálí), pihy, zrzavé vlasy a přítomnost melanomu v rodinné anamnéze. Autorům článku se v této mladé populaci nepodařilo prokázat žádnou souvislost mezi vznikem melanomu a kumulativní dávkou slunečního záření. Přítomnost většího počtu pigmentových névů jako důležitého a nezávislého rizikového faktoru pro vznik melanomu bylo popsáno i později [3, 10].
VROZENÉ NÉVOCELULÁRNÍ NÉVY
Zhruba jedno procento dětí se narodí s jedním či více pigmetovými névy [33]. V některých případech se névus stane viditelným až během dvou let po narození dítěte. Tyto kongenitální névy, někdy nazývané retardované, jsou obvykle menší a mají pravidelnější okraje. Dermatoskopicky se tyto dvě formy nedaří od sebe odlišit [30]. Kongenitální névy jsou v principu hamartomy, které se mohou vyskytnout u všech dětí s různou barvou kůže; ukazuje se však, že o něco častější je výskyt u dětí s fototypem I, nebo dětí, jejichž rodiče mají tento fototyp. U některých dětí mohou kongenitální névy postupně blednout. Toto blednutí obvykle trvá 2–3 roky. Kongenitální névy na hlavě jsou prakticky vždy světlejší. Možnost maligní degenerace je u kongenitálních névů silně závislá na jejich velikosti. V malých, solitárních, kongenitálních névech je riziko vzniku melanomu velice malé. Lékařský přístup k malým (< 1,5 cm) a středně velkým (1,5 – 20 cm) névům je čistě individuální a závisí na různých faktorech, jako je lokalizace, kožní typ pacienta a přítomnost jiných rizikových faktorů, jako je familiární melanom [17]. Větší riziko maligního zvrhnutí existuje u velkých kongenitálních névů (> 20 cm). Takovéto velké névy se nacházejí zhruba u jednoho z 20 000 narozených dětí, a tzv. naevus giganteus se vyskytuje přibližně u jednoho z 500 000 novorozenců. Možnost vývinu melanomu z takového gigantického névu se pohybuje mezi 4 a 24 procenty [13]. Nebezpečí vzniku melanomu v těchto velikých névech je největší do deseti let věku dětí. To je také jeden z důvodů, proč se lékaři snaží včas (chirurgicky) větší névy odstranit. To však není často možné, a proto se odstaňují jenom „podezřelé“ části velkého névu. Poměrně kosmeticky přijatelných výsledků bývá dosaženo při použití kyretáže. Tato metoda však musí být použita během prvních týdnů po narození, protože struktura kůže se postupně zpevňuje a provedení kyretáže se znesnadňuje. Podle belgických autorů [22] mohou být funkční a kosmetické výsledky kyretáže lepší, než jaké jsou po chirurgické léčbě. Není ještě jasné, zda tato metoda skutečně snižuje riziko vzniku melanomu. U malých kongenitálních névů se celoživotní riziko vzniku melanomu pohybuje v rozmezí 0–5 % a tyto melanomy se skoro vždy vyvíjejí až v dospělosti. Na profylaktické odstranění těchto menších névů se tedy nemusí tolik spěchat. Je však důležité, aby rodiče pacientů byli informováni o charakteru pozorovatelných změn, které by mohly vést k nádorové přeměně névu.
Přítomnost velkých kongenitálních névů je ve více než 25 % spojena s jinými vývojovými anomáliemi, jako je intrakraniální proliferace névových buněk (syndrom neurokutánní melanózy). Tato vývojová porucha nese s sebou zvýšené riziko vzniku intrakraniálního melanomu či jiných nádorů [16]. Při bolestech hlavy je zapotřebí dítě řádně neurologicky vyšetřit. Je prokázáno spojení mezi velikostí kongenitálního névu a patologickým nálezem MRI [12]. MRI vyšetření by mělo být provedeno do 4 měsíců věku dítěte [17].
Někteří autoři počítají k vrozeným névům také nevus spilus. Tento névus se vyskytuje u 1–2 % lidí a je zpravidla přítomen již při narození. Makroskopicky je tento névus charakterizován světle hnědou makulou připomínající skvrnu café-au-lait, na níž jsou roztroušené malé tmavší makuly či papuly. Rozměry tohoto névu jsou silně variabilní, někdy mohou pokrývat celé segmenty kůže. Maligní transformace tohoto névu je sice v literatuře popsaná, je však velmi vzácná. Melanom vzniká z tmavých skvrn a při podezření se tyto skvrny musí excidovat pro histologické vyšetření.
ZÍSKANÉ NÉVOCELULÁRNÍ NÉVY
Pravděpodobnost vzniku běžných pigmentových névů je závislá na stavu kožní pigmentace. Nejčastěji vznikají pigmentové névy u dětí se světlou barvou kůže [9]. U dětí s tmavší kůží (asijský typ) se névy vytvářejí v mnohem menším množství a u jedinců s velmi tmavou kůží se prakticky nevyskytují. Melanocytární névy se začnou objevovat na kůži již v prvních měsících života a postupně jich přibývá. Maximální počet névů je přítomen na kůži kolem 30. roku života a potom jejich počet pomalu klesá [15]. Scope a spoluautoři se nedávno zaměřili na věkovou skupinu 11–14 let. Podle těchto autorů [27] se zejména v období raného dospívání objevují změny v počtu pigmentových névů, tj. jejich přibývání a ubývání a pozvolné odbarvování. Příbývání névů však převažuje. U zhruba jedné třetiny dětí v této věkové skupině alespoň jeden pigmentový névus zmizel. Takováto involuce névů je však známým jevem u dospělých, a to zejména u vyšších věkových skupin.
Involuce névů je připisována různým buněčným pochodům, jako je apoptóza névových buněk, jejich stárnutí (senescence) krácením telomerové části DNA, či přeměna v buňky podobné buňkám nervovým. U involuce névů spojené s tvorbou depigmentace (halo névus) se předpokládá aktivní účast T-lymfocytů. Zajímavá jsou pozorování, že pacienti s atopickým ekzémem mají signifikantně snížený počet pigmentových névů [4, 31]. Příčiny se hledají v involuci névových buněk díky přítomnosti chronického zánětlivého procesu.
Dospělé osoby ve střední Evropě mají v průměru 20–30 névocytárních névů o velikosti dvou či více milimetrů. To, že vznik těchto névů je pod genetickou kontrolou, se prokázalo ve studiích s dvojčaty. Obrázek 1 ukazuje výsledky z jedné ze studií, která se zabývala srovnáním počtu vzniklých pigmentových névů u jednovaječných a dvouvaječných dvojčat [6]. Na základě těchto a podobných výsledků dosažených u jiných skupin dvojčat se badatelé domnívají, že za vznik pigmentových névů jsou zhruba ze dvou třetin zodpovědny genetické faktory. Za zbytek jsou pak zodpovědny faktory okolí, a to zejména sluneční záření.
![Srovnání počtu melanocytárních névů (> 3 mm) u dospělých dvojvaječných (A) a jednovaječných (B) dvojčat (podle Easton et al. [6])](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/a88fc217d651784643a23d1209e69290.jpeg)
Při vzniku névových buněk se chování kožních melanocytů mění. Nejdůležitějšími pozorovatelnými změnami je tendence ke shlukování a omezený kontakt s keratinocyty, a tudíž i omezená možnost zbavovat se potenciálně škodlivých melanozomů. Vzhledem k změněným vlastnostem není správné považovat tyto buňky za identické s normálními melanocyty. To platí zvláště o névových buňkách klinicky atypických névů. Jak bude později uvedeno, během našeho výzkumu jsme nalezli v melanomových buňkách metabolické změny, která byly již přítomny v dysplastických névových buňkách, ale nevyskytovaly se v normálních melanocytech či v buňkách benigních (dermálních) névů.
VLIV SLUNEČNÍHO ZÁŘENÍ A POUŽÍVÁNÍ OCHRANNÝCH KRÉMŮ NA VZNIK NÉVOCELULÁRNÍCH NÉVŮ
Z celé řady studií je známo, že sluneční expozice v mladém věku podporuje vznik melanocytárních névů. U australských dětí vyrůstajících v oblasti s vyšší intenzitou slunečního záření se vytvářely pigmentové névy dříve a ve větším počtu [11]. Rozsáhlý klinický výzkum v sousedním Německu tato pozorování potvrdil a navíc potvrdil, že se více melanocytárních névů tvoří pod vlivem slunečního záření, zejména u dětí se světlejším fototypem (II–III) [2]. Zdálo by se logické, že pravidelné používání ochranných krémů na opalování bude tvorbu pigmentových névů brzdit. Toto se však dosud nepodařilo prokázat. Naopak, některé studie došly k závěru, že pravidelné používání ochranných krémů je spojeno se zvýšeným počtem melanocytárních névů [1, 32]. Možným vysvětlením je, že používání ochranných krémů lidem často umožnňuje dlouhodobou sluneční expozici, přičemž je zapotřebí si uvědomit, že ochranné krémy na opalování nechrání kůži v celém rozsahu UV spektra. Prakticky všechny prodávané krémy nebrání dostatečně průniku dlouhovlnného UVA záření (cca 360–400 nm), a tak lidé mohou při dlouhodobém pobytu na slunci obdržet vysokou dávku tohoto záření. Lepší ochranu poskytuje ochranné oblečení. Podle výsledků zmíněné mezinárodní studie [1] používání ochranného oděvu nevedlo ke vzniku zvýšeného počtu melanocytárních névů.
PIGMENTOVÉ NÉVY U LIDÍ S FAMILIÁRNÍM VÝSKYTEM MELANOMU
Zvýšený výskyt pigmentových névů je častým jevem u rodin s familiárním melanomem. Familiární výskyt melanomu se podílí na celkovém výskytu melanomu zhruba deseti procenty. Výzkum osob s familiárním melanomem vedl k odkrytí důležitých vrozených genových změn, které výskyt těchto melanomů doprovázejí. Nejdůležitější takovou vrozenou mutací DNA u familiárního melanomu je mutace genu CDKN2A, který kóduje dvě různé bílkoviny: p16INK4 a p14ARF. Obě tyto bílkoviny se podílejí na regulaci (inhibici) buněčného dělení a patří tedy mezi tzv. nádorové supresory. Jejich mutace pak zvyšují možnost nekontrolovaného buněčného dělení. Nedávná nizozemská studie potvrdila již známý poznatek, že u pacientů s mutací genu CDKN2A melanomy vznikají ve výrazně nižším věku a riziko vzniku mnohočetných melanomů je u těchto pacientů signifikantně vyšší [23]. Ve zmíněné studii se u pacientů s mutací vytvořil prvním melanom o 15 let dříve než u pacientů bez mutace. Pacienti s touto vrozenou mutací měli také dvakrát větší pravděpodobnost vytvoření druhého melanomu, jestliže se první melanom u nich objevil před jejich 40. narozeninami. Autoři také zaznamenali, že se u pacientů s CDKN2A mutací vytvářely ve výrazně vyšším procentu superficiálně se šířící melanomy. Lentiginózní a nodulární melanomy byly u těchto pacientů vzácné. Autoři soudí, že jejich nálezy jsou v souladu s tzv. névovou cestou vzniku melanomu, která je charakterizovaná (zvýšeným) výskytem pigmentových névů, střídavou sluneční expozicí, mladším věkem a lokalizací na trupu.
Přítomnost mutací genu CDKN2A však nedokáže plně vysvětlit zvýšenou tvorbu pigmentových névů a vznik melanomu [20]. Představa, že by existoval jediný gen, jehož změna by byla zodpovědná za vznik tohoto kožního nádoru, je již opuštěna. Na vzniku melanomu se evidentně podílí celá řada faktorů. Pátrání po nových genech (melanoma susceptibility genes) pokračuje s narůstající intenzitou. Řada prací se zabývá možnou rolí tzv. mutací NRAS a BRAF, které mají za následek stimulaci buněčného růstu (pigmentových) buněk. Zatímco mutace NRAS byly nalézány u více než poloviny kongenitálních névů, BRAF mutace se objevují u velké většiny získaných pigmentových névů [25]. Tyto mutace však nejsou dostačující k iniciaci vzniku melanomu. Ukazuje se také, že tyto mutace nejsou spojeny s chronickou sluneční expozicí, ale že vznikají patrně druhotně, možná jako důsledek produkce reaktivních kyslíkových sloučenin. Nedávno byl také popsán polymorfismus ve dvou genech, nazývaných POLN a PRKDC, které se podílejí na opravě poškozené DNA. Tento polymorfismus byl spojený se zvýšeným rizikem vzniku melanomu u rodin s familiárním melanomem [14]. Byl popsán i nový syndrom s autosomálně dominantním přenosem, u něhož byla zjištěna vrozená mutace genu BAP1. Tento gen se uplatňuje při buněčné reakci na poškození DNA, ale také při regulaci buněčného cyklu, apoptózy a buněčného stárnutí [34]. U pacientů s tímto novým syndromem se postupně vytvářely zhruba půl centimetru velké polokulovité papuly, které byly někdy i stopkaté a měly červenohnědou barvu či barvu kůže. Histopatologicky byly charakterizovány velkými epiteloidními névovými buňkami a atypickou proliferaci melanocytů, která vykazovala některé známky melanomu. U některých z těchto osob se vytvořily kožní či oční melanomy.
ZVLÁŠTNÍ FORMY PIGMENTOVÝCH NÉVŮ
U některých získaných névocelulárních névů se může postupně vytvořit kulatá či oválná depigmentace v přímém okolí névu. Tak vzniká tzv. halo névus, také nazývaný Suttonův névus. Névus samotný se při vzniku depigmentace obvykle zmenšuje a může zcela vymizet. Někteří pacienti mají celou řadu takových névů. Změny kolem névu se často považují za podobné změnám u vitiliga a u těchto pacientů se také halo névy častěji vyskytují. U halo névu je nutné zvážit možnost diagnózy melanomu se spontánní regresí. Maligní změny halo névů však nejsou v odborné literatuře hlášené.
Poměrně vzácné jsou také névocelulární névy, které se jeví jako modrošedá či modročerná papula či nodulus. Vzácněji se vyskytují ve skupinách. U těchto tzv. modrých névů jsou névové buňky uloženy hluboko v kůži mezi kolageními vlákny koria a buňky samé mají vřetenovitě protažený tvar. Maligní transformace je u modrých névů velmi vzácná, a proto se tyto névy nemusí odstraňovat. Pouze snad velké modré névy na hlavě si vyžadují pravidelnou pozornost.
U dětí a dospívajících se pravidlně vyskytují relativně rychle rostoucí hladké polokulovité, světle hnědé či načervenalé nebo černé papuly. Nejčastěji se objevují v obličeji. Protože histologicky připomínají melanom, používal se dříve název juvenilní melanom. Tento název způsoboval řadu nedorozumění a zejména nyní, v době internetu, je to název, který u rodičů může způsobovat zděšení. Vžitý název, který se i v mezinárodní literatuře běžně používá, je Spitz névus (v češtine névus Spitzové) po Američance Sophii Spitzové, která v roce 1948 tento névus poprvé popsala. Tento névus se vyskytuje v několika formách. U takzvaného atypického névu Spitzové je histologické odlišení od melanomu zvlášť obtížné. Důležitou formou névu Spitzové je takzvaný Reedův pigmentový spinocelulární tumor, který se vyskytuje zejména u mladých žen na stehnech. Makroskopicky se jeví jako černé papuly či noduly s mírným olupováním a hyperkeratózou. Vzhledem k obtížnému odlišení névů Spitzové od melanomu se tyto léze většinou excidují do zdravé tkáně. Při neúplné excizi je indikována opakovaná excize, neboť tento névus může recidivovat. Při nejasné diagnostice by se mělo s névem Spitzové zacházet jako s melanomem.
DYSPLASTICKÉ NÉVY A RIZIKO VZNIKU MELANOMU
U poměrně vysokého procenta lidí se světlou kůží se mohou vytvořit pigmentové névy s nápadně odlišným makroskopickým projevem (obr. 2A a 2B). Tyto tzv. klinicky atypické, či dysplastické névy jsou obvykle větší než 5 mm v průměru, asymetrické, mají nerovnoměrnou pigmentaci, jsou nepřesně ohraničené a jejich vzhled se může pomalu měnit [7]. Alespoň tři z těchto právě jmenovaných kritérií jsou zapotřebí k tomu, aby se névus mohl nazývat dysplastický. Většina odborníků považuje rozměr atypického névu (v průměru > 0,5 cm) za obligátní pro stanovení diagnózy. U lidí s velkým počtem získaných melanocytárních névů je větší pravděpodobnost, že se u nich vyvinou také dysplastické névy. Tyto névy se objevují také na netypických místech těla, jako je kštice, plosky nohou a dlaně. Tato místa je zapotřebí vždy prohlédnout. Stejně jako u normálních névů je výskyt dysplastických névů závislý na kožní pigmentaci. V Japonsku je výskyt těchto névů velmi nízký a u lidí s velmi tmavou kůží (fototyp VI) se nevyskytují. Při vzniku mnohočetných dysplastických névů se hovoří o syndromu dysplastických névů. Tento syndrom může být sporadický či familiární.
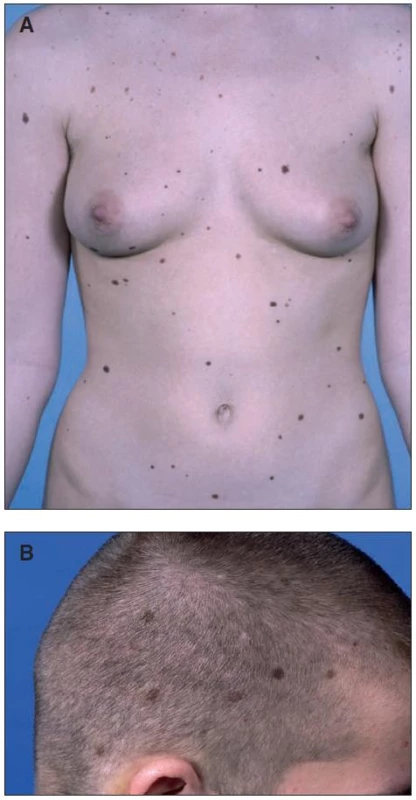
Dysplastické névy byly poprvé popsány v 70. letech minulého století jako velké atypické pigmentové névy v rodinách se zvýšeným výskytem melanomu [5]. V posledních letech se jim věnuje velká pozornost nejenom proto, že představují zvýšené riziko vzniku melanomu, ale také proto, že dysplastické névové buňky jsou považovány za mezistupeň během maligní přeměny normálních melanocytů. Během histopatologického vyšetření excidovaných melanomů se ve vysokém procentu (65 %) může najít zbytek původního névu [26].
Nedávná práce z Rakouska ukázala také na souvislost mezi přítomností kožních dysplastických névů a očního melanomu. Podle tohoto výzkumu mělo 35,3 % pacientů s očním melanomem více než 5 dysplastických névů, zatímco u kontrolní populace to bylo pouhých 1, 2 % [24].
Souhrnně lze tedy řící, že výzkum posledních třiceti let přinesl jasné důkazy o souvislosti mezi přítomností pigmentový névů a rizikem vzniku melanomu [7]. Nejjasnější souvislost byla opakovaně nalezena mezi přítomností dysplastických névů a vznikem melanomu. Metaanalýza 46 výzkumných prací publikovaných do září 2002 ukázala, že např. přítomnost 101–120 benigních névů u jednoho člověka (ve srovnání s méně než 15 névy u jiného) byla spojena s relativním rizikem 6,89 (95% CI 4,63, 10,25) pro vznik melanomu [10]. U pacientů s dysplastickými névy bylo zhruba stejného rizika dosaženo již při přítomnosti pěti dysplastických névů (proti žádnému). Také velké rozdíly ve výskytu dysplastických névů u normální populace a u pacientů s melanomem podtrhávají význam těchto névů jako rizikového faktoru. Zatímco u normální populace se světlou kůží jsou dysplastické névy nalézány u méně než deseti procent, u pacientů s melanomem je výskyt mnohem častější (34–59 %) [8].
DYSPLASTICKÉ NÉVY, PORUCHA TVORBY PIGMENTU A OXIDATIVNÍ STRES
V každé pigmentové buňce se nacházejí dva typy melaninu: tmavší eumelanin a světlejší feomelanin. Každý z těchto typů melaninů je polymerem a oba se tvoří společně v melanozomech pigmentových buněk. Syntéza obou polymerů vychází z aminokyseliny tyrozinu (obr. 3). Tyrozin se v melanozomech enzymaticky mění na řadu reaktivních fenolových a indolových sloučenin, které se na sebe váží a vytváří polymer. Pro tvorbu feomelaninu je ještě zapotřebí aminokyselina cystein. Tato aminokyselina se tedy při syntéze feomelaninu v pigmentových buňkách spotřebovává a tím přivádí buňky do choulostivé situace, neboť se nemohou dostatečně bránit proti oxidačním reakcím. Cystein je totiž součástí glutathionu, velmi důležité antioxidační sloučeniny (tripeptidu) v cytoplazmě buněk. Syntéza feomelaninu je tedy pro pigmentové buňky nevýhodná. Navíc tento pigment nedovede dosti dobře absorbovat ultrafialové záření a během této absorbce se mohou tvořit reaktivní formy kyslíku, které tuto již oslabenou buňku mohou dále poškodit. Tvorba eumelaninu je pro pigmentovou buňku výhodnější a eumelanin je schopen lépe absorbovat UV záření. Světlá lidská kůže obsahuje málo melaninu s relativně velkým množstvím feomelaninu. Naproti tomu tmavá kůže je lépe chráněná proti slunečnímu záření, neboť obsahuje více melaninu a relativně více eumelaninu. Toto bylo potvrzeno i experimentálně, kdy stimulace tvorby melaninu vedla u buněk pocházejících ze světlé kůže převážně ke zvýšené tvorbě feomelaninu a u buněk z tmavé kůže zejména ke zvýšené tvorbě eumelaninu [18, 28].
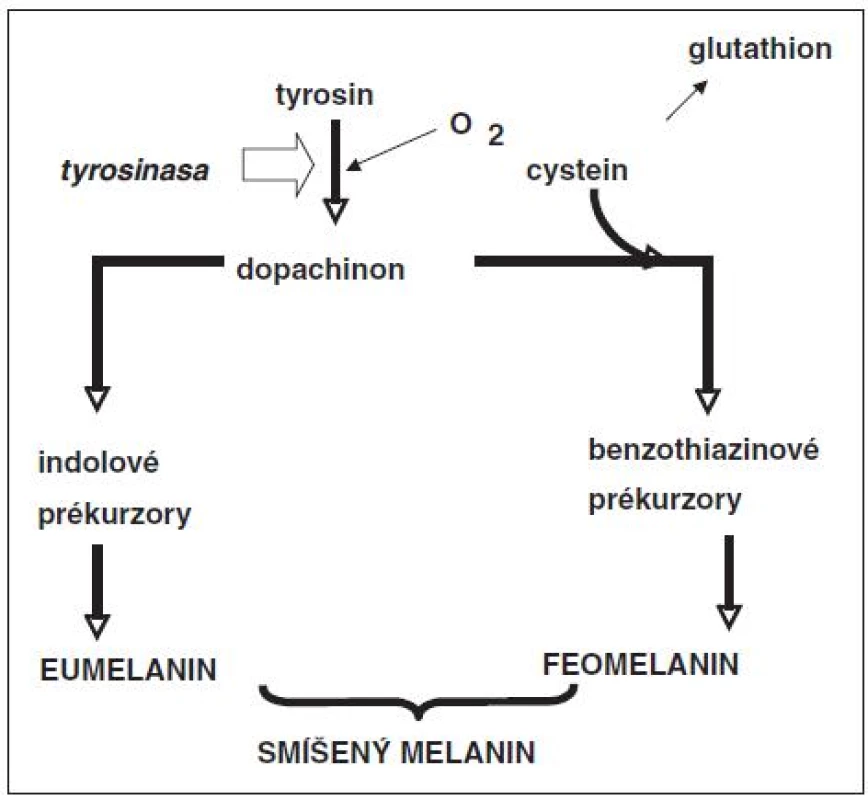
Naše výzkumy z posledních let ukázaly, že tvorba melaninu v névových buňkách se může lišit od tvorby melaninu v normálních melanocytech u stejných osob. V řadě experimentů se podařilo prokázat, že dysplastické névové buňky syntetizují výrazně větší množství feomelaninu než normální pigmentové buňky kůže u stejné osoby [19]. Stejný nález byl také učiněn u buněk melanomových, ale ne u normálních melanocytů a buněk benigních (dermálních) nevů. Kromě toho obsahovaly pouze melanomové a névové buňky větši množství volného železa než normální melanocyty. Tyto nálezy svědčí pro existenci metabolických změn, ktere ve svých důsledcích vedou k chronické produkci reaktivních forem kyslíku. To je pro buňky značně nepříjemná situace, neboť může mít za následek oxidativní poškození různých molekul včetně DNA. Melanozomy jsou patrně hlavním zdrojem těchto změn. Za normálních okolností se pigmentové buňky svých melanozomů zbavují tím, že je předávají keratinocytům, a tím snižují riziko chronického oxidativního stresu. Névové buňky však tuto možnost většinou nemají. Jejich kontakt s keratinocyty je omezen a melanozomy se v nich hromadí. Produkce feomelaninu a s tím související oxidativní stres [29] pak mohou být zodpovědné za oxidativní poškození různých buněčných struktur včetně mitochondrií a jaderné DNA. Tyto výsledky výzkumu nás vedly k návrhu, že dysplastické névové buňky patří mezi tzv. mutátorové buňky, tj. buňky s relativně vysokou mutační frekvencí, a tato vlastnost může urychlit jejich přeměnu v buňky nádorové, tedy v tomto případě melanomové [21].
HISTOLOGIE MELANOCYTÁRNÍCH PROJEVŮ
Histopatologické hodnocení pigmentových kožních projevů, a to zvláště melanocytárních, patří mezi nejkomplikovanější hodnocení v dermatopatologii. Při odlišení névocelulárních névů a dalších benigních melanocytárních lézí od melanomu se používají určitá kritéria. Problémem je, že žádné kritérium není zcela specifické a určité změny se najdou jak u benigních lézí, tak u melanomu. Nálezy je proto třeba hodnotit jako určitý celek a navzájem porovnávat jejich váhu.
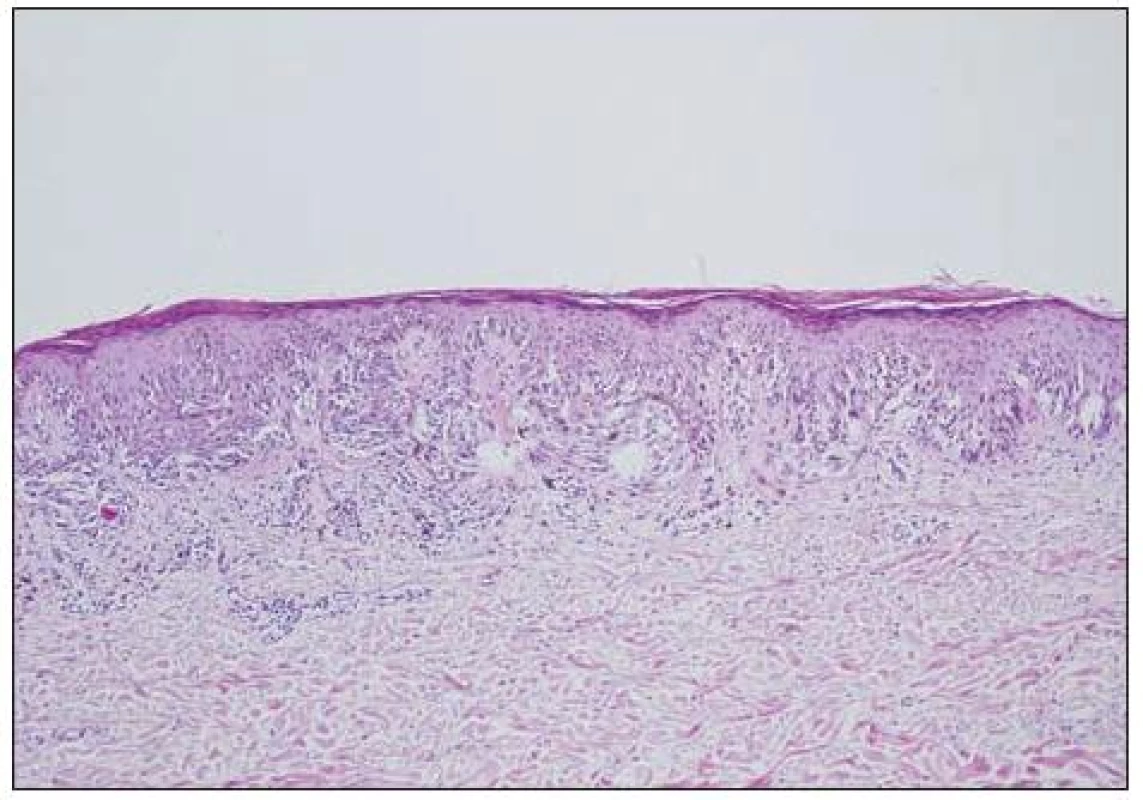
Obecně se melanocytární léze posuzují podle architektury nálezu (tj. symetrie, ohraničení, charakteru hnízd atd.) a podle cytologie vlastních melanocytů (např. mitózy, velikost jader aj.). K základní diagnostice obvykle postačují běžné techniky barvení (hematoxylin-eozin, barvení podle Massona, barvení na elastiku). Histochemické techniky (S-100, melan A, HMB-45) slouží pouze k odlišení melanocytární léze od jiné nemelanocytární, takže nám nepomohou při odlišení benigního névu od melanomu. Na obrázku 4 je ukázka atypického junkčního névu s různě velikými melanocyty, splýváním hnízd a fibrotizací vaziva kolem epidermálních čepů. Odlišný charakter mají změny melanocytů odpovídající obrazu melanoma in situ (obr. 5). Obtížnější pak je hodnocení nálezů, kdy se najde současně obraz benigní léze spolu s melanomem (obr. 6, 7).
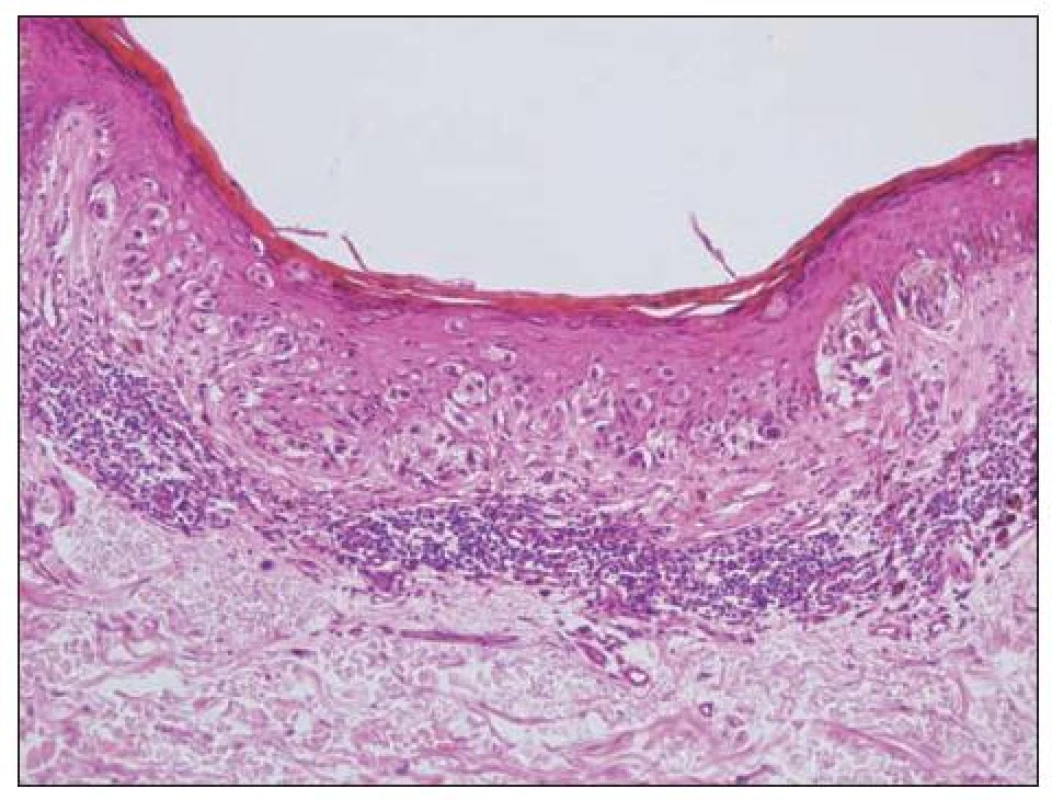
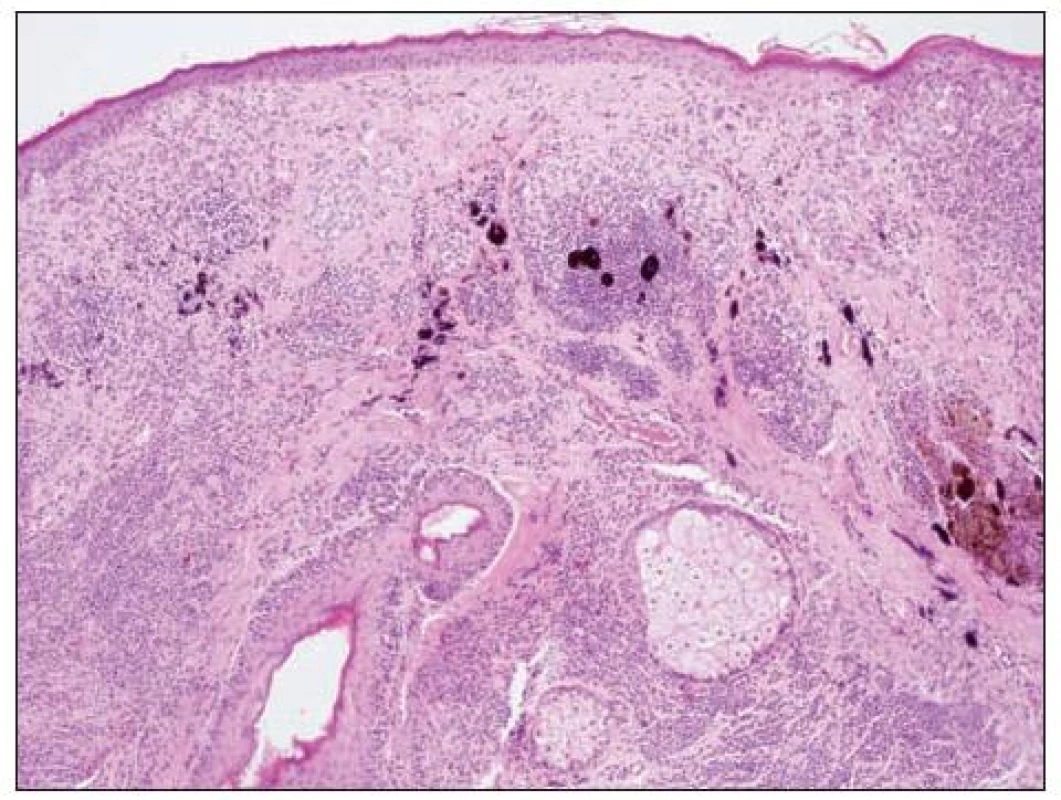
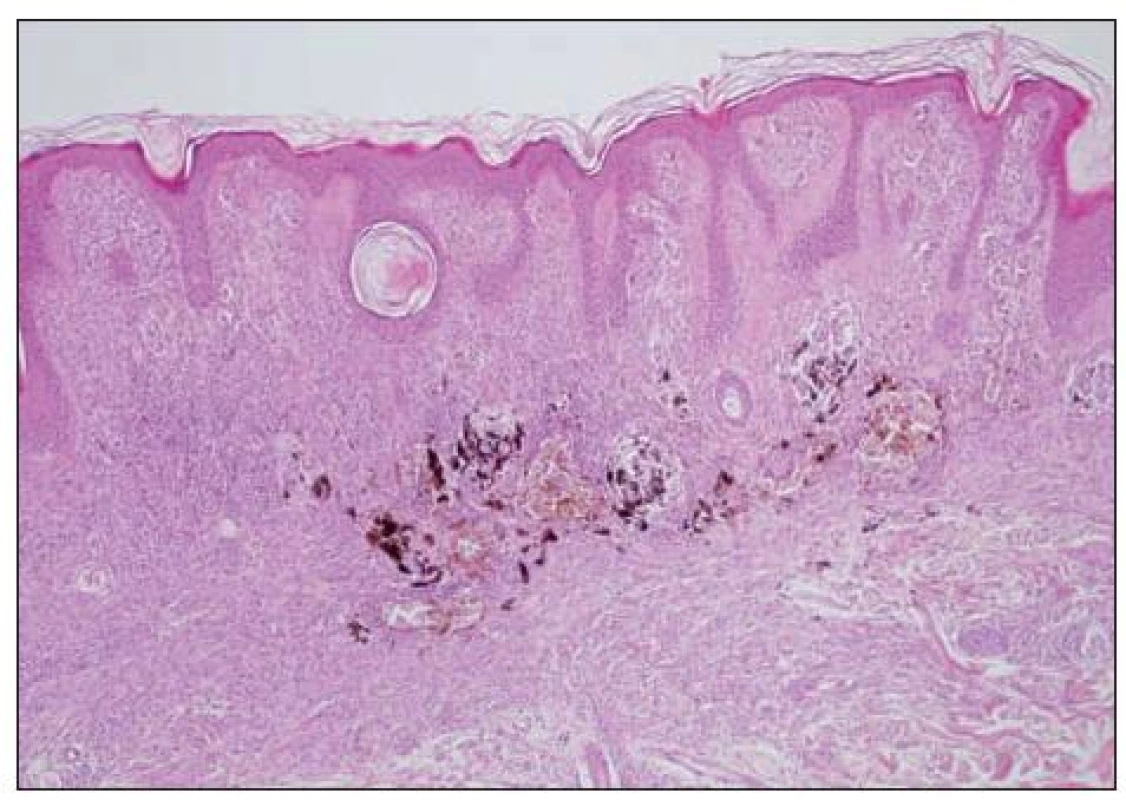
Při konečném rozhodnutí je vždy nutné vzít v úvahu i veškeré klinické informace o hodnoceném projevu. Ty by měly zahrnovat věk nemocného, přesnou lokalizaci excidovaného projevu (zvláště na končetinách musí být místo uvedeno přesně, zcela nedostatečný je např. údaj „noha“, „ruka“ apod.). Významnou informací je doba trvání projevu (kdy si pacient poprvé všiml névu, kdy začaly jeho změny). Projev by měl být precizně popsán (přesná velikost, změny barvy, povrch aj.), případně doplněny informace o dermatoskopickém nálezu. Optimální je přiložení klinické fotografie.
PACIENTI SE ZVÝŠENÝM RIZIKEM VZNIKU MELANOMU – VČASNÁ DETEKCE
Pacienti se zvýšeným rizikem vzniku melanomu mohou být identifikováni na základě klinických údajů. Mezi ně patří počet névocelulárních névů, přítomnost dysplastických névů a výskyt melanomu. Zejména následující skupiny pacientů vyžadují pravidelné a pečlivé kontroly u kožních lékařů:
- pacienti s velkým počtem (> 100) pigmentových névů,
- pacienti s velkým počtem normálních (> 50) a atypických (> 5) névů,
- pacienti s velkými kongenitálními névy,
- pacienti s rodinným výskytem melanomu,
- pacienti, kteří již měli melanom.
Všichni tito pacienti by měli obdržet písemné instrukce o kontrole kůže, kterou si mohou provádět doma. Každá výraznější makroskopická změna névu, která trvá více než měsíc, by měla u těchto lidí být důvodem navštívít kožního lékaře. Frekvence plánovaných kontrol u kožního lékaře se pohybuje mezi 1–4krát za rok, v závislosti na anamnéze a klinickém obrazu každého pacienta. Například pacient z rodiny s familiárním melanomem, který má mnoho pigmentových névů a sám melanom prodělal, by měl být vyšetřován 4krát do roka. Anamnestické údaje by se měly týkat podchycení rodinného výskytu melanomu. Pakliže je to možné, pacienti s familiárním melanomem by měli projít genetickou kontrolou. V minulosti vedl výzkum familiárního melanomu k identifikaci několika důležitých genů. Časná detekce melanomu vyžaduje, aby se každý kožní lékař seznámil s dermatoskopií a tuto techniku také běžně používal. Prevence, která by měla začít již v raném dětském věku, by se měla týkat ochrany před spálením a v případě dlouhodobého pobytu na slunci by se kůže měla chránit vhodným oblečením.
Do redakce došlo dne 1. 11. 2011.
Kontaktní adresa:
Doc.MUDr Stanislav Pavel, CSc., PhD.
Karlovarská 1698/1
16300 Praha 6
e-mail: stanpavel@hotmail.com
Sources
1. AUTIER, P., DORÉ, J. F., CATTARUZZA, M. S. et al. Sunscreen use, wearing clothes, and number of nevi in 6 - to 7-year old European children. J. Nat. Cancer Inst., 1998, 90, p. 1873–1880.
2. BAUER J., BÜTTNER, P., WIECKER, TS. et al. Risk factors of incident melanocytic naevi: a longitudinal study in a cohort of 1232 young German children. Int. J. Cancer, 2005, 115, p. 121–126.
3. BAUER, J., GARBE, C. Acquired melanocytic nevi as risk factor for melanoma development. A comprehensive review of epidemiological data. Pigment Cell Res., 2003, 16, p. 297–306.
4. BROBERG, A., AUGUSTSSON, A. Atopic dermatitis and melanocytic naevi. Br. J. Dermatol., 2009, 142, p. 306–309.
5. CLARK, W. H, JR., REIEMER, R. R., GREENE, M. H. et al. Origin of familial melanomas from heritable melanocytic lesions. “The B-K mole syndrome”. Arch. Dermatol., 1978, 114, p. 732–738.
6. EASTON, D. F., COX, G. M., MACDONALD, A. M. et al. Genetic susceptibility to naevi – a twin study. Br. J. Cancer, 1991, 64, p. 1164–1167.
7. ELDER, D. E. Dysplastic naevi: an update. Histopathology, 2010, 56, p. 112–120.
8. FRIEDMAN, R. J., FARBER, M. J., WARYCHA, M. A. et al. The “dysplastic” nevus. Clin. Dermatol., 2009, 27, p.103–115.
9. GALLAGHER, R. P., MCLEAN, D. I., YANG, P. et al. Suntan, sunburn and pigmentation factors and the frequency of acquired melanocytic nevi in children. Arch. Dermatol., 1990, 126, p. 770–778.
10. GANDINI, S., SERA, F., CATARUZZA, M. S. et al. Meta-analysis of risk factors for cutaneous melanoma: I. Common and atypical naevi. Eur. J. Cancer, 2005, 41, p. 28–44.
11. HARRISON, S. L., MACLENNAN, R., SPEARE, R. et al. Sun exposure and melanocytic naevi in young Australian children. Lancet, 1994, 344, p. 1529–1532.
12. KINSLEY, V. A., CHONG, W. K., AYLETT, S. E. et al. Complications of congenital melanocytic naevi in children: analysis of 16 years‘ experience and clinical practice. Br. J. Dermatol., 2008, 159, p. 907–914.
13. LEECH, S. N., BELL, H., LEONARD, N. et al. Neonatal giant congenital naevi with proliferative nodules. Arch. Dermatol., 2004, 144, p. 83–88.
14. LIANG, X. S., PFEIFFER, R. M., WHEELER, W. et al. Genetic variants in DNA repair genes and the risk of cutaneous malignant melanoma in melanoma-prone families with/without CDKN2A mutations. Int. J. Cancer, 2011, v tisku.
15. MACKIE, R. M., ENGLISH, J., AITCHINSON, T. C. et al. The number and distribution of benign pigmented moles (melanocytic naevi) in a healthy British population. Br. J. Dermatol., 1985, 113, p. 167–174.
16. MAKKAR, H. S., FRIEDEN, I. J. Congenital melanocytic naevi: an update for the pediatrician. Curr. Opin. Pediatr., 2002, 14, p. 397–403.
17. MARGHOOB, A. A., BORREGO, J. P., HALPERN, A. C. Congenital melanocytic nevi: Treatment modalities and management options. Semin. Cutan. Med. Surg., 2007, 26, p. 231–240.
18. NIEUWPOORT van, F., SMIT, N. P. M., KOLB, A. M. et al. Tyrosine-induced melanogenesis shows differences in morphologic and melanogenic preferences of melanosomes from light and dark skin types. J. Invest. Dermatol., 2004, 122, p. 1251–1255.
19. PAVEL, S., NIEUWPOORT van, F., MEULEN VAN DER, J. et al. Disturbed melanin synthesis and chronic oxidative stress in melanoma precursor lesions. Eur. J. Cancer, 2004, 40, p. 1423–1430.
20. PAVEL, S., SMIT, N. P. M., MEULEN van der, J. et al. Homozygous germline mutation of the CDKN2A/p16 gene and G-6-PD deficiency in a multiple melanoma case. Melanoma Res., 2003, 13, p. 171–178.
21. PAVEL, S., SMIT, N. P. M., PIZINGER, K. Dysplastic nevi as precursor melanoma lesions. In J. Borovanský, P. A. Riley, editors. Melanins and Melanosomes: Biosynthesis, Biogenesis, Physiological, and Pathological Functions. First edition. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2011, pp. 383–393.
22. RAEVE de, L. E., ROSEEUW, D. I. Curretage of giant congenital melanocytic nevi in neonates. Arch. Dermatol., 2002, 138, p. 943–948.
23. RHEE van der, J. I., KRIJNEN, P., GRUIS, N. A. et al. Clinical and histologic characteristics of malignant melanoma in families with a germline mutation in CDKN2A. J. Am. Acad. Dermatol., 2011, 65, p. 281–288.
24. RICHTING, E., LANGMANN, G., MULLNER, K. et al. Ocular melanoma: epidemiology, clinical presentation and relationship with dysplastic naevi. Ophthalmologica, 2004, 218, p. 111–114.
25. ROSS, A. L., SANCHEZ, M. L., GRINCHNIK, J. M. Molecular nevogenesis. Dermatology Research and Practice, 2011, v tisku.
26. SAGEBIEL, R. W. Melanocytic nevi in histologic association with primary cutaneous melanoma of superficial spreading and nodular types: effect of tumor thickness. J. Invest. Dermatol., 1993, 100, p. 322S–325S.
27. SCOPE, A., DUSZA, S. W., MARGHOOB, A. A. et al. Clinical and dermoscopic stability and volatility of melanocytic nevi in a population-based cohort of children in Framingham School System. J. Invest. Dermatol., 2011, 131, p. 1615–1621.
28. SMIT, N. P. M., KOLB, A. M., LENTJES, E. G. W. M. et al. Variations in melanin formation by cultured melanocytes from different skin types. Arch. Dermatol. Res., 1998, 290, p. 342–349.
29. SMIT, N. P. M., NIEUWPOORT van, F. A., MARROT, L. et al. Increased melanogenesis is a risk factor for oxidative DNA damage. Study on cultured melanocytes and atypical nevus cells. Photochem. Photobiol., 2008, 84, p. 550–555.
30. STINGO, G., ARGENZIANO, G., FAVOT, F. et al. Absence of clinical and dermoscopic differences between congenital and non-congenital melanocytic nevi in a cohort of two-year-old children. Br. J. Dermatol., 2011, v tisku.
31. SYNNERSTAD, I., NILSSON, L., FREDRIKSON, M. et al. Fewer melanocytic nevi found in children with active atopic dermatitis than in children without dermatitis. Arch. Dermatol., 2004, 140, p. 1471–1475.
32. WACHSMUTH, R. C., TURNER, F., BARRETT, J. H. et al. The effect of sun exposure in determining nevus density in UK adolescent twins. J. Invest. Dermatol., 2005, 124, p. 56–62.
33. WILLIAMS, M. L., PENNELLA, R. Melanoma, melanocytic nevi, and other melanoma risk factors in children. J. Pediatr., 1994, 104, p. 833–845.
34. WIESNER, T., OBENAUF, A. C., MURALI, R. et al. Germline mutations in BAP1 predispose to melanocytic tumors. Nature Gen., 2011, v tisku.
35. YOUL, P., AITKEN, J., HAYWARD, N. et al. Melanoma in adolescents: a case-control study of risk factors in Queensland, Australia. Int. J. Cancer, 2002, 98, p. 92–98.
Labels
Dermatology & STDs Paediatric dermatology & STDsArticle was published in
Czech-Slovak Dermatology

2011 Issue 6
Most read in this issue
- Pigmentové névy a jejich vztah ke vzniku kožního melanomu
- Erythema elevatum diutinum
- Vlastní zkušenosti s nestandardním dávkovacím režimem etanerceptu a jeho výhody
