Porokeratózy
Porokeratoses
Porokeratoses represent a heterogeneous group of diseases which have in common the same histopathologic feature – the presence of cornoid lamela. Currently, there are seven the most frequent clinical variants. The etiology of porokeratoses has not been fully elucidated yet. Combination of genetic predisposition and enviromental factors are playing role in the occurence of porokeratosis. Guidelines for the treatment of porokeratosis have not been drawn up yet as the efficacy of the individual drugs or their combinations have been reported only in individual cases or small case series and controlled clinical studies are lacking. The authors give an overview of the current knowledge on porokeratosis.
Key words:
porokeratosis – cornoid lamella
:
J. Fialová; M. Kojanová
:
Dermatovenerologická klinika 1. LF UK a VFN, Praha, přednosta prof. MUDr. J. Štork, CSc.
:
Čes-slov Derm, 91, 2016, No. 4, p. 155-164
:
Reviews (Continuing Medical Education)
Porokeratózy představují heterogenní skupinu onemocnění, jejichž společným rysem je shodný histopatologický obraz charakterizovaný přítomností tzv. kornoidní lamely. V současnosti je známo 7 nejčastějších klinických variant. Etiologie porokeratóz dosud úplně objasněna nebyla. Kromě genetické predispozice se na vzniku PK zřejmě podílí í zevní faktory. Doporučené léčebné postupy pro léčbu PK dosud nebyly vypracovány, neboť účinnost jednotlivých přípravků či jejich kombinací byla popsána pouze na jednotlivých pacientech, či malých souborech, a kontrolované klinické studie chybí. Autorky poskytují přehled současných znalostí o těchto onemocněních.
Klíčová slova:
porokeratóza – kornoidní lamela
ÚVOD
Porokeratózy (PK) představují heterogenní skupinu onemocnění, jejichž společným rysem je shodný histopatologický nález charakterizovaný přítomností tzv. kornoidní lamely. Termín PK poprvé použil italský dermatolog Vittorio Mibelli, který v roce 1893 popsal nové onemocnění a pojmenoval ho složením z řeckého poros (vývod potní žlázy) a keratos (rohovění), porokeratosis Mibelli [63]. Až později se ukázalo, že porokeratóza není spojena nutně s potní žlázou, ale „nesprávný“ název již zůstal [80]. Následně se v literatuře objevovaly popisy případů různých variant onemocnění s familiárním výskytem či získaných, s odlišným klinickým obrazem i průběhem. V současnosti je známo 7 nejčastějších klinických variant PK. Přibývají další, i když vymezení některých jednotek není vždy jednoznačné. Podle distribuce ložisek můžeme PK rozdělit na lokalizované a diseminované formy. Lokalizované formy zahrnují porokeratosis Mibelli (PM), porokeratosis linearis (LP), porokeratosis punctata palmaris et plantaris (PPPP) a porokeratosis ptychotrophica (PPT), diseminované formy pak porokeratosis superficialis actinica disseminata (DSAP), porokeratosis superficialis disseminata (DSP) a porokeratosis palmaris et plantaris disseminata (PPPD). Etiologie PK dosud úplně objasněna nebyla [42]. Primární eflorescencí PK je plochá papula, která se centrifugálně šíří, v jejím centru postupně dochází k atrofii. Okraj je tvořen mírně vyvýšenou rohovou lištou nazývanou též periferní vláskový lem. Výsledné léze jsou ostře ohraničené, různé velikosti od několika milimetrů až po několik centimetrů a dosahují obvykle anulárního či lineárního tvaru. Projevy jsou většinou asymptomatické, některé klinické varianty ale mohou být provázeny svěděním či palpační bolestivostí. V ložiscích PK se může objevit spinocelulární karcinom nebo morbus Bowen [104]. Diferenciální diagnóza zahrnuje aktinické keratózy, seboroické keratózy, psoriázu, Darierovu chorobu, lichen planus, lichen nitidus, acrokeratosis verruciformis Hopf, elastosis perforans serpiginosa, epidermální névy, syndrom bazocelulárního névu, hereditární palmoplantární keratodermie, acrodermatitis enteropathica, či nekrolytický migrující erytém [87].
ETIOPATOGENEZE
K vytvoření kornoidní lamely spojené s přítomností lokalizovaných dysplastických znaků dochází fokální expanzí abnormálních keratinocytů. Tato expanze je pravděpodobně způsobena chybným vyzráváním keratinocytů nebo urychlením epidermopoezy. Změny keratinocytů v oblasti pod kornoidní lamelou jsou podmíněny poškozenou expresí lorikrinu, která způsobuje poruchu regulace terminální diferenciace [90].
Genetika
Genetická predispozice PK se začala zvažovat, když se objevil familiární výskyt PK. U PM, PPPP, PPPD, DSP a DSAP byl pak prokázán autozomálně dominantní typ dědičnosti s variabilní penetrancí [4, 31, 88, 93 ]. Postupně byli stanoveny 4 lokusy související s DSAP na chromozomu 12, 15, 1, 16 a byli označeny DSAP1, DSAP2, DSAP3 a DSAP4 [53, 55, 109, 110]. Byla zastižena mutace genu mevalonát kinázy (MVK) u 33 % a 16 % pacientů s familiární, respektive sporadickou DSAP, která je pravděpodobně specifická pro DSAP, protože u pacientů s jinými PK zastižena nebyla. Předpokládá se, že MVK chrání keratinocyty před apoptózou indukovanou ultrafialovým zářením A (UVA) [113]. Lokus pro PPPD identifikoval Wei et al. v čínské rodině na 12. chromozomu (12q24.1--24.2) a překrývá se s lokusem DSAP1 [107]. U pacientů s PM byla zastižena duplikace genu EMILIN2 (elastin microfibril interfacer 2), která se zdá být odpovědná za abnormální apoptózu epidermálních keratinocytů vyúsťující v poruchu keratinizace u PM [76]. Pro DSP byl analýzou vazby popsán lokus na 18. chromozomu (18p11.3) [106, 108]. Další analýza 12 genů v tomto regionu přinesla sice negativní výsledek, ale poukázala na překrývání této oblasti s lokusem psoriázy na 18. chromozomu (18p11.23). Podobný profil genové exprese PK a psoriázy ukázaly i další nezávislé genetické studie [6, 36, 114]. Hivnor et al. dále identifikovali nové markery v porokeratotických keratinocytech u PM, a to keratin 16, S-100 A8 a A9, či konexin 26. Tyto molekuly hrají významnou roli při tvorbě cytoskeletu keratinocytů, epidermální hyperproliferaci a intercelulární komunikaci [36, 68]. V roce 2012 Cao et al. lokalizovali druhý lokus pro DSP, a to DSP2 na 12. chromozomu (12q21.2–24.21) [13]. Už jedna defektní alela v genomu heterozygotního jedince stačí k expresi onemocnění. Všechny buňky jsou postiženy, proto je onemocnění diseminované. K oddálené expresi onemocnění v dospělosti pravděpodobně dochází v důsledku aktivace zevními faktory. Lokalizované formy manifestující se v dětství (PM, LP) mají pravděpodobně odlišný genetický základ. Tam se abnormální klon buněk v kůži aktivuje během embryonálního vývoje na základě somatické mutace, projev bývá lokalizován v Blaschkových liniích. A mosaicismus může vysvětlovat, proč PK má někdy lokální či lineární distribuci [33]. Mnohočetné genové studie zatím tedy ukázaly několik různých typů mutací v proliferaci a diferenciaci keratinocytů, které vedou různou cestou vždy ke stejnému výsledku, a to porokeratóze. Klinický obraz jednotlivých typů PK potom odpovídá charakteru mutace. Avšak úplné objasnění molekulární genetiky u jednotlivých typů PK nás v budoucnu teprve čeká [68].
Zevní faktory
Kromě genetické predispozice se na vyvolání PK zřejmě podílí í zevní faktory. K manifestaci či zhoršení DSAP dochází obvykle po předchozí expozici slunečnímu záření. Fototerapie ultrafialovým zářením A (UVA) či ultrafialovým zářením B (UVB), samostatně či v kombinaci s lokálním oxsoralenem (lokální PUVA) nebo s dithranolem vyvolala v několika popsaných případech DSAP [3, 14]. Stejně tak radioterapie u pacienta s lymfomem byla zřejmě významným etiologickým faktorem u segmentální PK v oblasti genitálu [40].
Na druhou stranu studie in vitro na keratinocytech a fibroblastech nepotvrdily senzitivitu pacientů s PK k UVB a rentgenovému (RTG) záření. Stejně tak je zajímavé, že postižení obličeje, který je nejvíce slunečnímu záření exponován, je u DSAP pouze u 15 % pacientů [42]. A dokonce PUVA byla úspěšně použita v léčbě DSP [76]. Významný počet pacientů byl v době manifestace PK imunosuprimován [9, 50]. Jednalo se zejména o pacienty s imunosupresí po orgánové transplantaci [58]. PK se objevila u pacientů s autoimunitními onemocněními, onemocněním jater či s diabetem [21, 67, 71, 97, 103]. Několik případů PK se objevilo u pacientů se syndromem získané ztráty imunity (AIDS) [44, 82], několik se léčilo s hepatitidou C [64, 65, 78]. Významnou roli v manifestaci PK hrají zřejmě i léky. Kromě léků s imunosupresivním účinkem, jako jsou lokální a systémové kortikosteroidy, hydroxyurea či antagonisté tumor nekrotizujícího faktoru alfa (certolizumab pegol, adalimumab, etanercept), byl případ DSP zaznamenám i u pacienta léčeného furosemidem [8, 11, 27, 29, 43, 49, 94, 111]. Také chronická expozice karcinogenu benzenu byla zvažována v etiologii porokeratózy 70letého muže v oblasti genitální, tříselné a perianální [98]. K výsevu PM současně s DSP došlo také náhle u ženy v 35. týdnu gravidity a po porodu projevy spontánně vymizely [102]. Z důvodu výskytu lézí PK v místě popálení kůže, či v místě podávání hemodialýzy je zvažována i přítomnost společného rysu s psoriázou, a to Koebnerova fenoménu [42].
PK a transplantace
Incidence PK u pacientů po transplantacích se liší od 0,34 % do 3,4 %. Vyšší incidenci – 10,7 % – popsali britští autoři v prospektivní studii u pacientů po transplantaci ledvin. Průměrná doba od transplantace k manifestaci PK byla 4,5 roku. DSAP je nejčastější forma PK, která se vyskytla u pacientů po transplantaci, následována PM [42]. Byly popsány případy PK nejen po transplantaci solidních orgánů, ale i po transplantaci kostní dřeně [1].
PK a maligní transformace
LP má ze všech typů PK nejvyšší riziko maligní transformace. Z 281 publikovaných případů PK v letech 1964 až 1994 byl výskyt karcinomu v terénu PK zaznamenán u 21 pacientů, a to u 19 % pacientů s LP a 7,6 % s PM. Jednalo se převážně o spinocelulární karcinom či morbus Bowen a pouze o 2 bazocelulární karcinomy [68, 86, 92].
DIAGNOSTIKA
Histopatologie
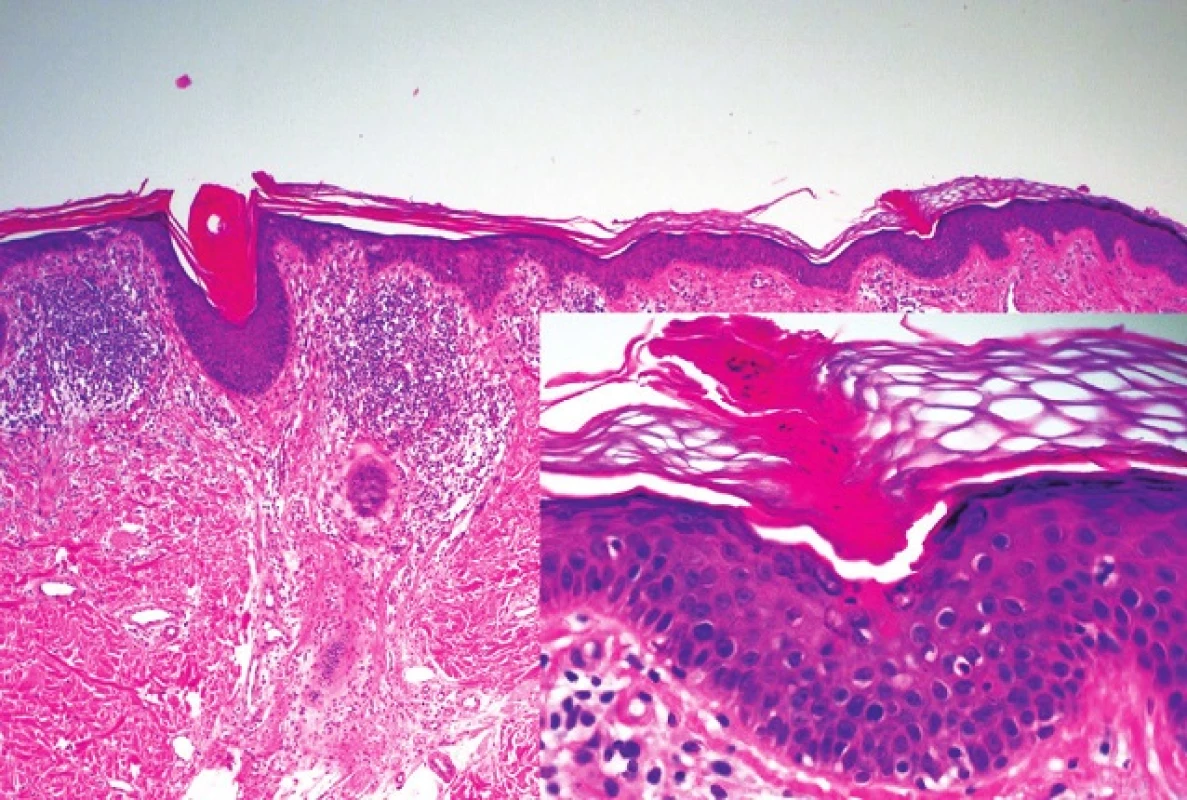
V histopatologickém obraze PK dominuje tzv. kornoidní lamela, tvořená úzkým vertikálně orientovaným sloupcem parakeratotických korneocytů. Epidermis pod lamelou je vkleslá, stratum granulosum je ztenčené nebo zcela chybí. Keratinocyty ve stratum spinosum jsou dyskeratotické nebo vykazují vakuolární degeneraci, stejně tak jako keratinocyty stratum basale. Kornoidní lamela může být přítomna i v ústí vlasového folikulu nebo potní žlázy. V horní dermis nacházíme zánětlivý infitrát, převážně tvořený CD4+ lymfocyty, které mohou místy pronikat do stratum basale. V papilární dermis jsou pak eozinofily, koloidní tělíska nebo depozita amyloidu epidermálního původu (obr. 1). Abychom získali tento charakteristický histopatologický obraz PK, provádíme excizi z okraje projevu. Pokud odebereme vzorek z centrální části porokeratotického projevu, pak kornoidní lamelu nezachytíme. Můžeme vidět jen mírnou hyperkeratózu, atrofické stratum spinosum a v dermis pak dilatované kapiláry obklopené lymfocytárním infiltrátem. Charakteristický histopatologický obraz je nejlépe vyjádřen u PM, zatímco u jiných forem, obzvláště těch, které jsou spojeny s imunosupresí, nemusí být tak výrazný. Kornoidní lamela není vázána striktně k PK. Její přítomnost zjišťujeme i u seboroické a aktinické keratózy, bazocelulárního karcinomu a vulgární veruky [41, 42].
DERMATOSKOPIE
V případě PK představuje dermatoskopie jednoduchou, rychlou a neinvazivní metodou k upřesnění klinické diagnózy. Kornoidní lamela se v dermatoskopickém obraze zobrazuje jako bělavě-žlutavá až hnědavá anulární struktura, někdy zdvojená. V centru můžeme zachytit bílou homogenní oblast, představující atrofické centrum léze [18]. Někdy jsou patrné červené tečky, globule a linie korespondující s dilatovanými kapilárami [112]. Kornoidní lamelu, ale i folikuly a vývody potních žláz s keratinovými zátkami lze zvýraznit použitím inkoustu. [99].
Konfokální mikroskopie (CM) a optická koherenční tomografie (OCT)
Techniky s vyšší zobrazovací schopností jako CM a OCT poskytují neinvazivní morfologické vyšetření kůže a zobrazí v případě PK kornoidní lamelu. OCT díky průniku hlouběji proti CM se zdá být přesnější v diagnostice PK, nicméně CM byl úspěšně použit v diferenciální diagnóze DSAP a aktnické keratózy [66, 100, 101].
Klinické varianty
Sedm nejčastejších klinických variant PK nepostihuje celou škálu PK. Další varianty se vyskytují vzácně a ne vždy jsou jednoznačně vymezené od již definovaných 7 forem. Jednotlivé typy PK se u pacientů vyskytují převážně samostatně, ale mohou se objevit i současně [10, 30, 57, 61].
Porokeratosis Mibelli (PM)
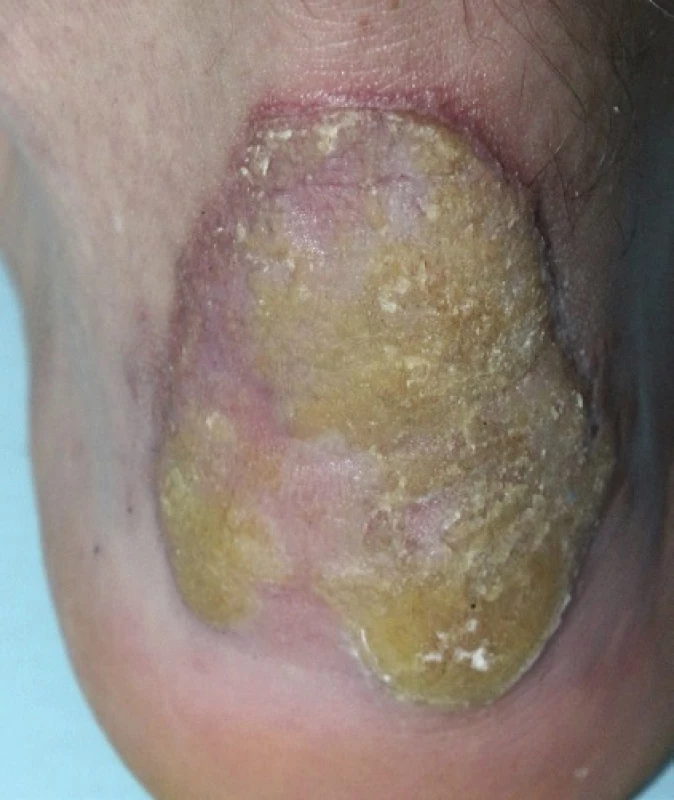
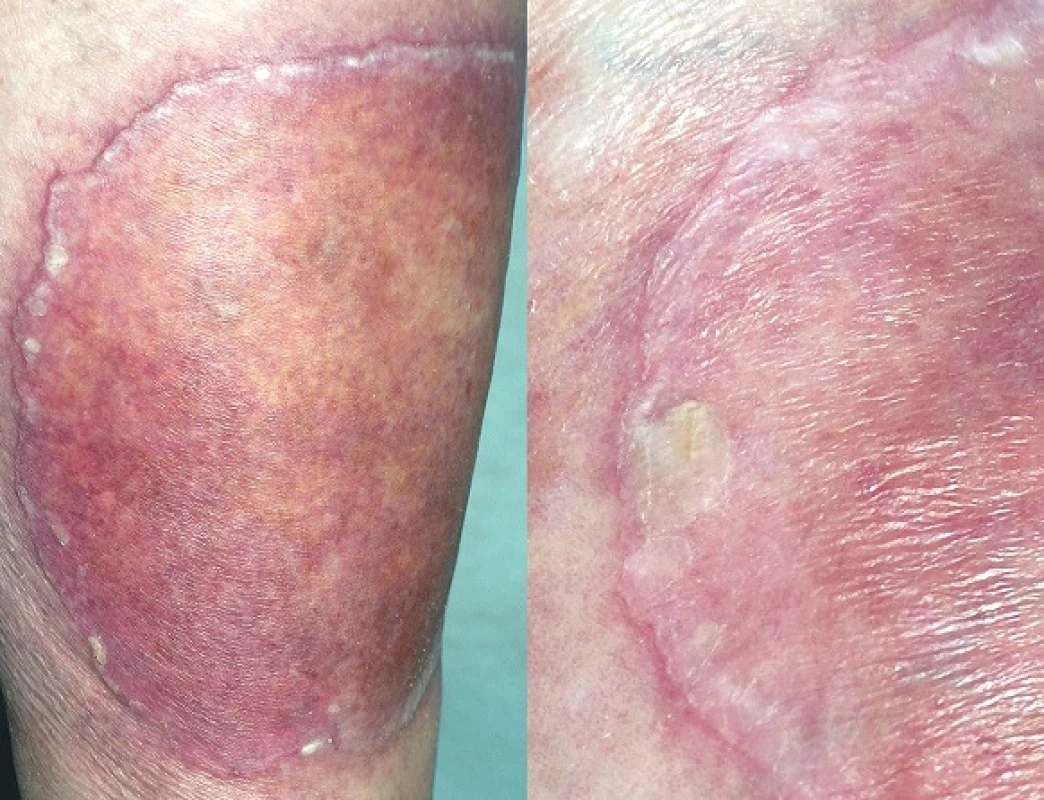
PM, první popsaná PK, patří k druhé nejčastější formě s vyšším výskytem v mužské populaci [87]. Často se objevuje již v dětském věku. Začíná jako asymptomatická nebo mírně svědivá eflorescence, která se pomalu v průběhu let zvětšuje. Centrum bývá hypopigmentované nebo hyperpigmentované, atrofické, mírně se šupící, bez přítomnosti ochlupení (obr. 2). Někdy léze dosahují velikosti až 20 cm a tato forma je pak označována jako PM gigantea (obr. 3, 4). Některými autory je PM gigantea dokonce považována za samostatnou formu PK [41]. A může se vyskytnout současně s psoriázou [20]. PM je obvykle lokalizovaná unilaterálně na končetinách, někdy i na dlaních a ploskách, ve kštici, na genitálu či na rtu nebo na sliznici dutiny ústní. Při lokalizaci na prstu může projev zasahovat i nehtový aparát a způsobit pterygium [47, 62].
Porokeratosis linearis (LP)
LP je obvykle kongenitální, méně častá forma PK. Může se objevit i v dospělosti, častější je u žen. Projevy jsou unilaterální, červenavá či hnědavá vyvýšená ložiska nebo lineárně uspořádané papuly, někdy splývají a jsou lokalizované podél Blaschkových linií. Postižení prstů může být provázeno postižením nehtů (pterygium, podélné rýhování) nebo dokonce i postižením kostního aparátu. Byly popsány i zosteriformní, segmentální či generalizované formy [87]. Lineární porokeratóza byla dosud prezentována jako samostatná forma PK, ačkoli dnes existují přesvědčivé důkazy, že tato dermatóza představuje segmentální typ 2 mosaicismu DSAP [33, 34].
Porokeratosis punctata palmaris et plantaris (PPPP)
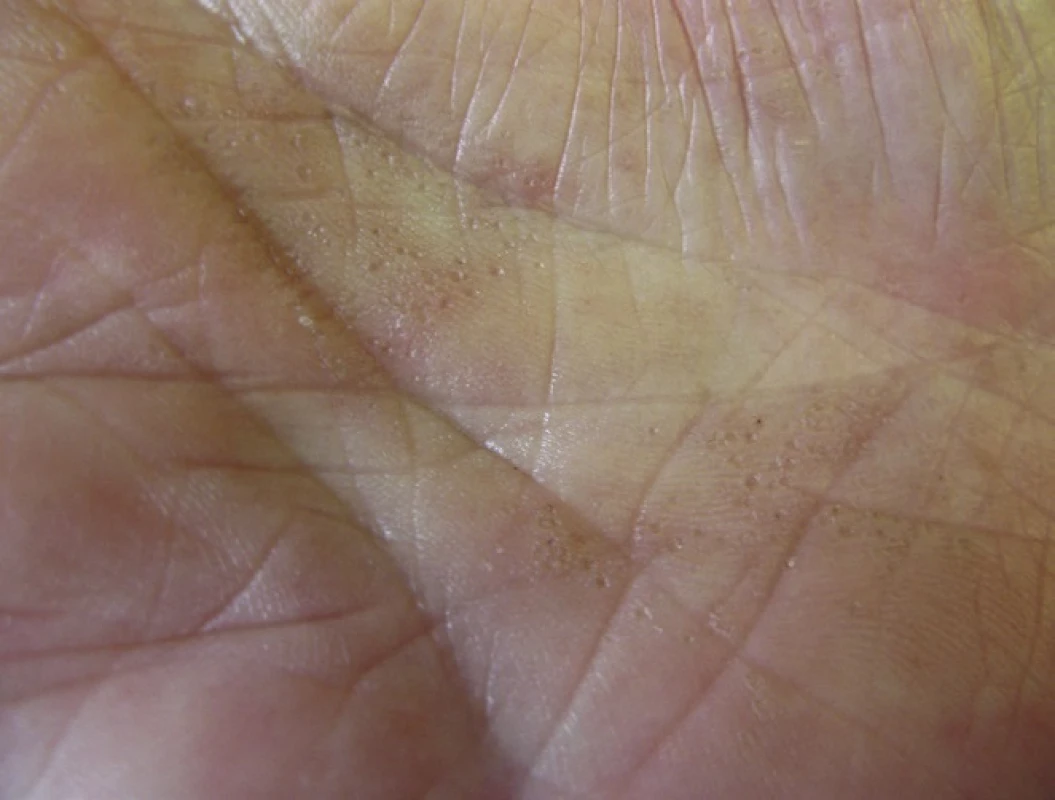
PPPP je velmi vzácná forma PK, kterou poprvé popsal Brown v roce 1971 [12]. Označuje se také jako palmoplantární keratodermie, punktátní typ II (PPKP2) [93]. Objevuje se obvykle po pubertě a v dospělosti. Projevy dosahují velikosti pouze 1–4 mm, jsou mnohočetné a lokalizované na dlaních a chodidlech. Jednotlivé eflorescence mají charakter papul s tenkým, vyvýšeným okrajem nebo jamek (obr. 5). Toto onemocnění je obvykle asymptomatické a kromě estetických problémů nečiní pacientům jiné obtíže [85].
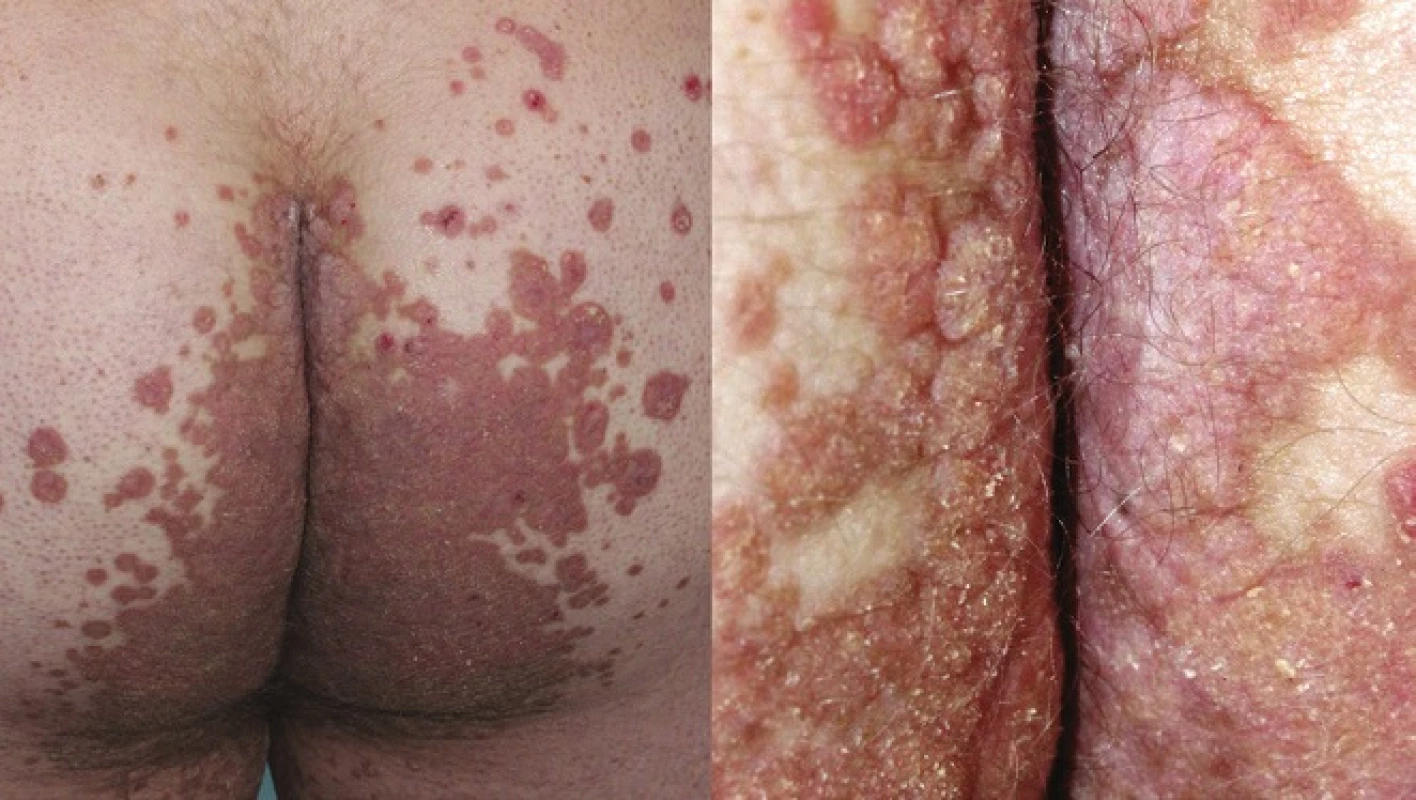
Porokeratosis ptychotropica (PPT)
PPT popsal poprvé v roce 1995 Lucker et al. Označení vychází z řeckého ptyché (záhyb) a tropé (obrat), čímž zdůrazňuje flexurální lokalizaci lézí. Onemocnění připomínající inverzní psoriázu je charakterizováno mnohočetnými asymetrickými vyvýšenými ložisky červenohnědé barvy, která jsou ostře ohraničená, se šupinami na povrchu. Objevují se v gluteální rýze a mohou se šířit na hýždě a genitál (obr. 6, 7). Někdy ložiska dosahují až verukózního charakteru, proto najdeme i označení porokeratosis verrucosa, někdy jsou přítomny i eroze [56, 61].
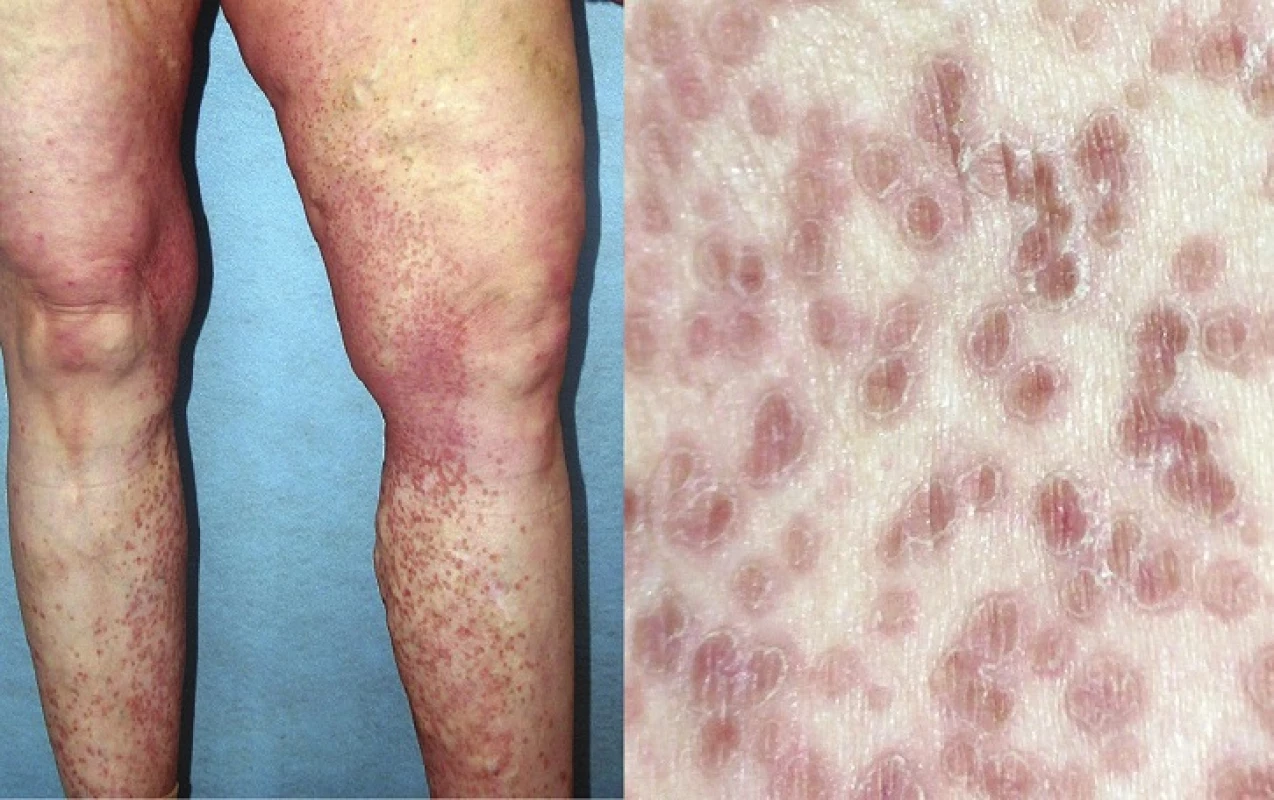
Porokeratosis superficialis disseminata (DSP)
V roce 1937 Andrew popsal novou klinickou variantu PK, provázenou mnohočetnými eflorescencemi lokalizovanými na trupu, genitálu, dlaních a na ploskách, kterou nazval DSP [5]. Tato forma PK je charakterizována drobnými červenými či hnědavými papulami s centrální atrofií objevujícími se obvykle kolem 5.–10. roku věku, ale i později, prakticky kdekoliv na těle a může být provázena svěděním (obr. 8) [95]. Léze se mohou vyskytovat i na sliznici dutiny ústní [83]. DSP se častěji vyskytuje u transplatnovaných, HIV pozitivních, či jinak imunosuprimovaných pacientů [87].
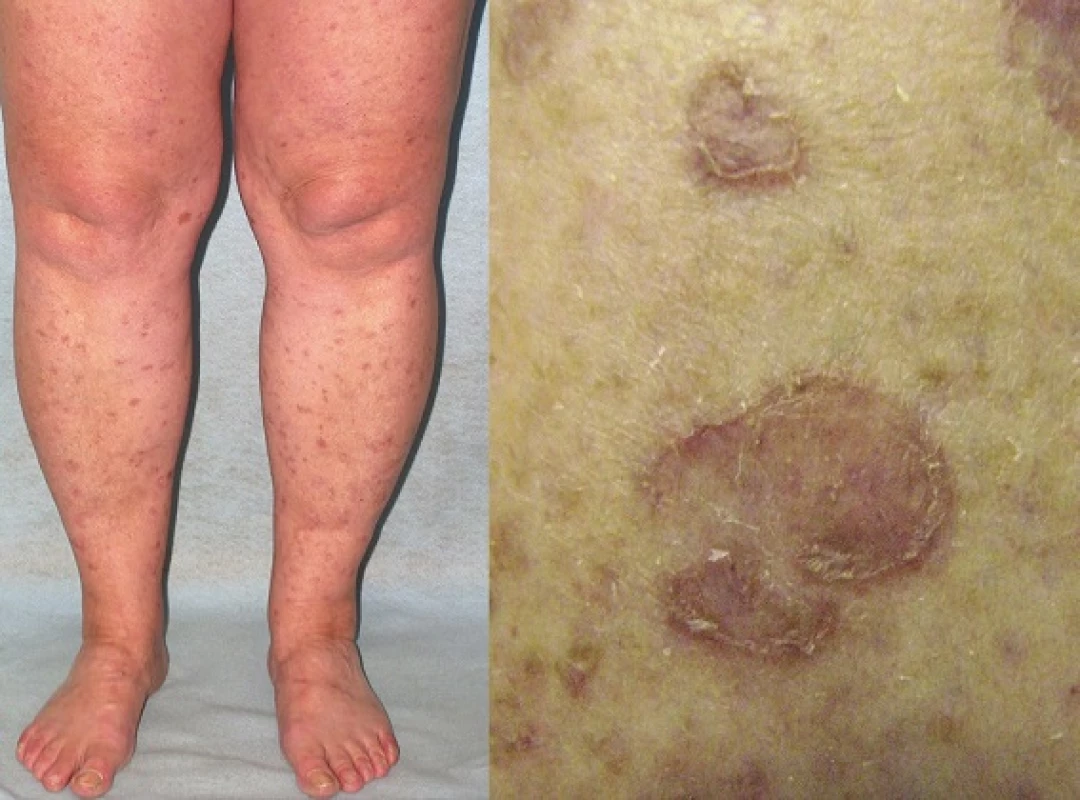
Porokeratosis superficialis actinica disseminata (DSAP)
V roce 1967 Chernosky a Freeman popsali u 31 pacientů DSAP, onemocnění klinicky odlišné od dosud známého PM, ale se shodným histopatologickým obrazem [38]. DSAP je klinicky podobná DSP. Objevuje se však později, obvykle kolem 30.–40. roku, častěji u žen a na místech exponovaných slunečnímu záření, tedy na obličeji, ale i nad extenzory horních končetin, ramenou a na zádech. Pacienti udávají zhoršení onemocnění během letních měsíců, či v přímé návaznosti na oslunění nebo na expozici UVA i UVB záření. Projevy u DSAP stejně jako u DSP mohou být spojené se svěděním. [15, 35, 75 ].
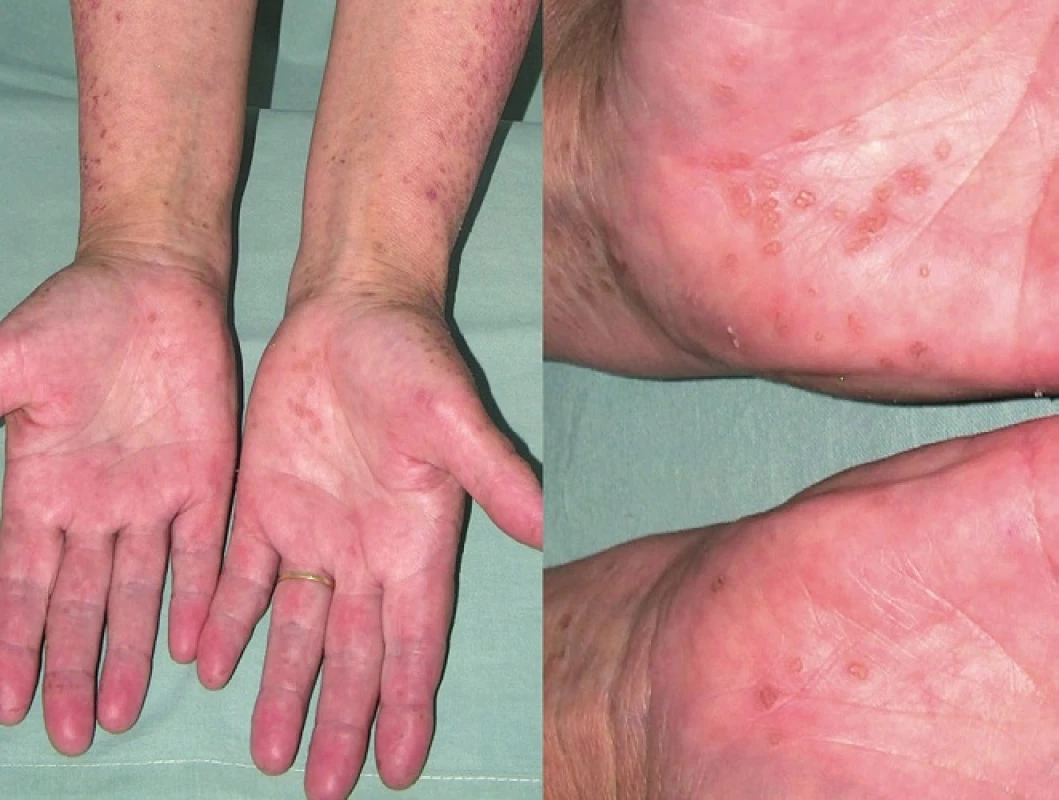
Porokeratosis palmaris et plantaris disseminata (PPPD)
PPPD je vzácná varianta PK, kterou poprvé popsal Guss v roce 1971 [31]. PPPD se častěji vyskytuje u mužů a obvykle se objevuje kolem 20. roku věku. Onemocnění je provázeno bilaterálně se vyskytujícími růžovo-hnědými keratotickými papulami na dlaních a ploskách. Později dochází k výsevu často svědivých projevů na končetiny a trup, kde klinický obraz může připomínat DSP či DSAP (obr. 13, 14) [39]. Vzácně může postižení trupu předcházet postižení dlaní a plosek. PPPD bývá provázena i postižením sliznice dutiny ústní, kde nacházíme anulární projevy. Postižení dlaní a plosek bývá spojeno s bolestivostí při chůzi [74].
Ostatní typy
Kromě těchto výše uvedených nejčastějších PK byly popsány i další ojedinělé klinicko-patologické varianty s odlišnými rysy. U některých je jejich samostatné postavení ve skupině PK diskutabilní, a jsou některými autory považovány za dosud popsané formy. Porokeratosis follicularis (PF) s přítomností kornoidní lamely výlučně folikulárně, se projevuje asymptomatickými červenavo-hnědavými eflorescencemi, velikosti do 1 cm, které se objevují ve středním věku [115]. Porokeratosis genitalis (GP) se objevuje téměř výhradně u mužů kolem 30. roku věku v oblasti penisu a skrota. Může být provázena svěděním [37]. Gu et al. zahrnují do této formy i perianální léze a rozdělují ji na 5 podtypů včetně PM, PPT [28]. Další formou PK je porokeratom. Tento název použili poprvé Walsh et al. v roce 2007. Jedná se o hyperkeratotickou papulu, někdy i verukózního charakteru, solitárně se vyskytující nejčastěji v oblasti končetin, ale i na hýždích, v intergluteální rýze, na hlavě, s histopatologicky přítomnou akantózou, verukózní hyperplazií a mnohočetnými kornoidními lamelami [105]. U 2 pacientů se porokeratom vyskytoval současně s ankylozující spondylartritidou [7, 45]. Porokeratotický névus adnexálních ústí (PAON), zahrnující porokeratotický névus ekrinních ústí a dermálních vývodů (PEODDN) a porokeratotický névus ekrinních a vlasových folikulů (PEHFN), je kongenitální dermatóza s kornoidní lamelou v histopatologickém obraze, která se obvykle vyskytuje již u novorozenců. Unilaterálně v oblasti dlaní či plosek s propagací na proximální části končetin, trup, krk i hlavu se tvoří keratotické papuly podobné komedonům v lineárním uspořádání v průběhu Blaschkových linií. Onemocnění může postihovat i nehtový aparát a eflorescence mohou být i erozivního charakteru. U 2 popsaných případů se vyskytla současně ipsilaterální hypoplazie prsu, u jednoho pacienta se vyvinul morbus Bowen a u 2 pacientů dokonce invazivní spinocelulární karcinom [26]. Výskyt porokeratózy v rámci syndromu CAP (kraniosynostóza, anální anomálie, porokeratóza) popsal Flanagan et al. v roce 1998 [23]. Shoimer et al. navrhují používat termín eruptivní diseminovaná porokeratóza pro náhle vzniklé formy PK a rozdělit je na 4 podtypy podle asociovaných stavů, a to na paraneoplastické, imunosupresivní, inflamatorní a jiné [91].
Dále byly popsány jednotlivé kazuistiky PK vzhledu benigní lichenoidní keratózy, formy ulcerativní, bulózní či verukózní [46, 87].
LÉČBA PK
Terapeutické postupy pro léčbu PK dosud nebyly vypracovány, neboť účinnost jednotlivých přípravků či jejich kombinací byla popsána pouze na jednotlivých pacientech, či malých souborech, a kontrolované klinické studie chybí. Zásadní v terapii PK je ochrana před slunečním zářením, používání emoliencií a pravidelné vyšetřování pacientů s PK z hlediska prevence malignit. Lokální léčba keratolytiky může zlepšit projevy během jejich aplikace, ale nevede ke zhojení. Podobné je to s aplikací lokálních kortikosteroidů, které během aplikace uleví od symptomů. Je však třeba je používat s opatrností, neboť mohou zvýšit imunosupresi kůže a usnadnit maligní transformaci [87]. Omezené jsou zkušenosti se zevními přípravky s deriváty vitaminu D. Jejich příznivý efekt byl popsán u několika případů DSAP, ale až při dlouhodobém použití (6 týdnů až 19 měsíců), a to jak samostatně, či v kombinaci s kryoterapií, s betametazonem nebo s lokálním 5% imiquimoidem [42]. Efekt u DSAP měla kombinovaná léčba kalcipotriolu a lokálního retinoidu adapalenu [72]. Ale i samostatná léčba lokálními retinoidy byla u některých pacientů hodnocena pozitivně, např. použití tazarotenu u DSAP ve kštici či 0,05% tretinoinu v krému jedenkrát denně 4 týdny a následně dvakrát týdně u generalizované LP [19, 70]. 5-fluoruracil v krému v koncentraci 0,5–5% aplikovaný jedenkrát i dvakrát denně zlepšil projevy u PM, DSAP, LP a DSP [60, 79, 89]. V některých případech k usnadnění penetrace účinné látky byl aplikován v okluzi nebo v kombinaci se 70% kyselinou glykolovou nebo 17% kyselinou salicylovou [17, 96]. Kombinovaná 3týdenní aplikace 5-fluoruracilu a 1 sezení fotodynamické léčby vedly ke zhojení projevu PM u pacienta s AIDS [51]. Dokonce i systémově podaný 5-fluoruracil u pacientky s metastazujícím karcinomem prsu vedl k zánětlivé reakci PK a k následnému zhojení [69]. Lokálním 5% imiquimoidem v krému byli úspěšně léčení pacienti s PM, DSAP, LP a PPPD při aplikaci 1krát denně po dobu 3–7 dnů v týdnu, a to 4–24 týdnů, kdy aplikace v okluzi zlepšovala účinek. Léčba byla provázena někdy zánětlivou reakcí a reziduálním jizvením a hypopigmentací [42]. 3% diklofenak v gelu měl dobré účinky na projevy u DSAP [58]. Nadějné v terapii PM se jeví použití ingenol-mebutátu [48]. Postupně přibývá i pacientů, kteří užívali retinoidy systémově (etretinát, acitretin i isotretinoin). Výhodou systémových retinoidů je jejich protektivní potenciál u nemelanomových kožních nádorů. Na druhou stranu je jejich použití limitováno nežádoucími účinky, jako je teratogenita, hepatotoxicita a elevace sérových lipidů. Často po jejich vysazení došlo opět k postupnému zhoršení a jeden pacient zaznamenal relaps již při léčbě etretinátem [87]. Příznivé účinky u jednoho pacienta s DSAP měla kombinace acitretinu s fotodynamickou léčbou (PDT). Samostatné PDT s použitím 5 aminolevuové kyseliny bylo účinné u PM a LP, ale již méně u DSAP [14, 16, 22, 24, 25, 32, 73]. Z dalších terapeutických možností s použitím záření byl popsán případ bulózní PK, kde Buckyho záření vedlo ke zlepšení a ústupu svědění [81]. Invazivní metody (kryoterapie, elektrodestrukce, exkochleace, dermabraze, chirugická excize, vaporizace CO2 nebo erbiovým laserem) jsou vhodnější pro jednotlivé projevy nebo tam, kde máme podezření na maligní zvrat. V případě kompletního odstranění projevu nedochází k rekurenci [87]. Kromě vaporizačních laserů bylo popsáno efektivní použití laseru barvivového 585 nm u LP, Nd:YAG u DSP, Q-switched rubínového laseru u hyperpigmentovaných lézí DSAP, či frakčního laseru 1927 nm u stejného typu PK [2, 52, 54, 84].
Do redakce došlo dne 3. 5. 2016.
Adresa pro korespondenci:
MUDr. Jorga Fialová
Dermatovenerologická klinika 1. LF UK a VFN
U Nemocnice 499/2
128 00 Praha 2
e-mail: fialova.jorga@seznam.cz
Sources
1. ALEXIS, A. F., BUSAM, K., MYSKOWSKI, P. L. Porokeratosis of Mibelli following bone marrow transplantation. Int. J. Dermatol., 2006, 45, 4, p. 361–365.
2. ALSTER, T. S., NANNI, C. A. Successful treatment of porokeratosis with 585 nm pulsed dye laser irradiation. Cutis, 1999, 63, 5, p. 265–266.
3. ALLEN, A. L., GLASER, D. A. Disseminated superficial actinic porokeratosis associated with topical PUVA. J. Am. Acad. Dermatol., 2000, 43, p. 720–722.
4. ANDERSON, D. E., CHERNOSKY, M. E. Disseminated superficial actinic porokeratosis. Genetic aspects. Arch. Dermatol., 1969, 99, p. 408–412.
5. ANDREW, G. C. Porokeratosis (Mibelli) disseminated and superficial type. Arch. Dermatol. Syphilol., 1937, 36, p. 1111–1114.
6. ASUMALAHTI, K., LAITINEN, T., LAHERMO, P. et al. Psoriasis susceptibility locus on 18p revealed by genome scan in Finnish families not associated with PSORS1. J. Invest. Dermatol., 2003, 121, p. 735–740.
7. BATALLA, A., ROSÓN, E., DE LA TORRE, C. Porokeratoma: a different entity or a variant of verrucous (hyperkeratotic) porokeratosis? Indian. J. Dermatol., 2013, 58, 2, p. 158.
8. BEDNAREK, R., EZRA, N., TOUBIN, Y. et al. Eruptive disseminated porokeratosis associated with corticosteroid-induced immunosuppression. Clin. Exp. Dermatol., 2015, 40, 7, p. 753–756.
9. BENCINI, P. L., CROSTI, C., SALA, F. Porokeratosis: immunosuppression and exposure to sunlight. Br. J. Dermatol., 1987, 116, 1, p. 113–116.
10. BHASKAR, S., JAISWAL, A. K., RAJ, N. Porokeratosis – Head to toe: An unusual presentation. Indian Dermatol. Online J., 2015, 6, 2, p. 101–104.
11. BRAUER, J. A., MANDAL, R., WALTERS, R. et al. Disseminated superficial porokeratosis. Dermatol. Online J., 2010, 15, 16, p. 20.
12. BROWN, P. C. Punctate keratoderma. Arch. Dermatol., 1971, 104, p. 682–683.
13. CAO, H. M., WANG, Z. Y., ZHANG, G. W. et al. Identification of a locus (DSP2) for disseminated superficial porokeratosis at chromosome 12q21.2–24.21. Clin. Exp. Dermatol., 2012, 37, p. 672–676.
14. CAVICCHINI, S., TOURLAKI, A. Successful treatment of disseminated superficial actinic porokeratosis with methyl aminolevulinatephotodynamic therapy. J. Dermatol. Treat., 2006, 17, p. 190–191.
15. COCKERELL, C. J. Induction of disseminated superficial actinic porokeratosis by phototherapy for psoriasis. J. Am. Acad. Dermatol., 1991, 24, p. 301–302.
16. CURKOVA, A. K., HEGYI, J., KOZUB, P. et al. A case of linear porokeratosis treated with photodynamic therapy with confocal microscopy surveillance. Dermatol. Ther., 2014, 27, 3, p. 144–147.
17. DANBY, W. Treatment of porokeratosis with fluorouracil and salicylic acid under occlusion. Dermatol. Online J., 2003, 9, p. 33.
18. DELFINO, M., ARGENZIANO, G., NINO, M. Dermoscopy for the diagnosis of porokeratosis. J. Eur. Acad. Dermatol. Venereol., 2004, 18, 2, p. 194–195.
19. DERVIS, E., DEMIRKESEN, C. Generalized linear porokeratosis. Int. J. Dermatol., 2006, 45, 9, p. 1077–1079.
20. DE SIMONE, C., PARADISI, A., MASSI, G. et al. Giant verrucous porokeratosis of Mibelli mimicking psoriasis in a patient with psoriasis J. Am. Acad. Dermatol., 2007, 57, 4, p. 665–668.
21. DIPPEL, E., HAAS, N., CZARNETZKI, B. M. Porokeratosis of Mibelli associated with active chronic hepatitis and vitiligo. Acta Derm. Venereol., 1994, 74, 6, p. 463–464.
22. FERNÁNDEZ-GUARINO, M., HARTO, A., PÉREZ-GARCIA, B. et al. Photodynamic therapy in disseminated superficial actinic porokeratosis. J. Eur. Acad. Dermatol. Venereol., 2009, 23, p. 176–177.
23. FLANAGAN, N., BOYADJIEV, S. A., HARPER, J. et al. Familial craniosynostosis, anal anomalies, and porokeratosis: CAP syndrome. J. Med. Genet., 1998, 35, 9, p. 763–736.
24. GARCIA-NAVARRO, X., GARCÉS, J. R., BASELGA, E. et al. Linear porokeratosis. Excellent response to photodynamic therapy. Arch Dermatol., 2009, 145, p. 526–527.
25. GIULIODORI, K., CAMPAATI, A., GANZETTI, G. et al. The successful offlabel use of photodynamic therapy for classic porokeratosis of Mibelli: case report. Dermatol. Ther., 2011, 24, p. 501–504.
26. GODDARD, D. S., ROGERS, M., FRIEDEN, I. J. et al. Widespread porokeratotic adnexal ostial nevus: clinical features and proposal of a new name unifying porokeratotic eccrine ostial and dermal duct nevus and porokeratotic eccrine and hair follicle nevus. J. Am. Acad. Dermatol., 2009, 61, p. 1060.
27. GOULDING, J., TEOH, J., CARR, R. et al. Eruptive disseminated superficial porokeratosis with rapid resolution: a drug induced phenomenon? Clin. Exp. Dermatol., 2009, 34, p. 895–897.
28. GU, C. Y., ZHANG, C. F., CHEN, L. J. et al. Clinical analysis and etiology of porokeratosis. Exp. Ther. Med., 2014, 8, 3, p. 737–741.
29. GUARNERI, C., CANNAVO, S., LENTINI, M. et al. Adalimumab induced disseminated superficial porokeratosis. Ann. Pharmacother., 2011, 45, 2, p. 280–281.
30. GUO, H., GAO, X. H., CHEN, H. D. Coexistence of multiple variants of porokeratosis. Indian J. Dermatol. Venereol. Leprol., 2015, 81, 4, p. 402–403.
31. GUSS, S. B., OSBOURN, R. A., LUTZNER, M. A. Porokeratosis plantaris, palmaris, et disseminata. A third type of porokeratosis. Arch Dermatol., 1971, 104, p. 366–373.
32. GUTIÉRREZ PAREDES, E., BELLA NAVARRO, R., MONTESINOS VILLAESCUSA. E. et al. Porokeratosis of Mibelli: A new indication for photodynamic therapy? Actas Dermosifilogr., 2013, 104, p. 259–261.
33. HAPPLE, R. Dohi Memorial Lecture. New aspects of cutaneous mosaicism. J. Dermatol., 2002, 29, 11, p. 681–692.
34. HAPPLE, R. Mibelli revisited: a case of type 2 segmental porokeratosis from 1893. J. Am. Acad. Dermatol., 2010, 62, 1, p. 136–138.
35. HILL, M. P., BALME, B., GHO, A., PERROT, H. Superficial disseminated porokeratosis with dermal amyloidosis. Ann. Dermatol. Venereol., 1992, 119, p. 651–654.
36. HIVNOR, C., WILLIAMS, N., SINGH, F. et al. Gene expression profiling of porokeratosis demonstrates similarities with psoriasis. J. Cutan. Pathol., 2004, 31, p. 657–664.
37. CHEN, T. J., CHOU Y. C., CHEN C. H. et al. Genital porokeratosis: a series of 10 patients and review of the literature. Br. J. Dermatol., 2006, 155, 2, p. 325–329.
38. CHERNOSKY, M. E., FREEMAN, R. G. Disseminated superficial actinic porokeratosis (DSAP). Arch. Dermatol., 1967, 96, p. 611–624.
39. IRISAWA, R., YAMAZAKI, M., YAMAMOTO, T. et al. A case of porokeratosis plantaris palmaris et disseminata and literature review. Dermatol. Online J., 2012, 18, p. 5.
40. JAMES, A. J., CLARKE, L. E., ELENITSAS, R. et al. Segmental porokeratosis after radiation therapy for follicular lymphoma. J. Am. Acad. Dermatol., 2008, 58, 2, p. 49–50.
41. KAFKOVÁ, H., ŠTORK, J., VOSMÍK, F. et al. Porokeratosis gigantea. Čes.-slov. Derm., 2005, 80, 1, p. 23–25.
42. KANITAKIS, J. Porokeratoses: an update of clinical, aetiopathogenic and therapeutic features. Eur. J. Dermatol., 2014, 24, p. 533–544.
43. KANITAKIS, J., ARBONA-VIDAL, E., FAURE, M. Porokeratosis in patients with polycythemia rubra vera: a new side-effect of hydroxyurea? J. Eur. Acad. Dermatol. Venereol., 2012, 26, p. 1040–1041.
44. KANITAKIS, J., MISERY, L., NICOLAS, J. F. et al. Disseminated superficial porokeratosis in a patient with AIDS. Br. J. Dermatol., 1994, 131, 2, p. 284–289.
45. KANITAKIS, J., RIVAL-TRINGALI, A. L., CHOUVET, B. et al. J. Cutan. Pathol., 2009, 36, 7, p. 804–807.
46. KIM, M. S., HA, J. M., CHO, E. B. et al. Porokeratosis presenting with a benign lichenoid keratosis-like appearance. Ann. Dermatol., 2015, 27, 6, p. 778–779.
47. KIM, D. S., ROH, M. R., LEE, J. H. et al. Pterygium unguis formation in porokeratosis of Mibelli. Br. J. Dermatol., 2007, 156, p. 1384–1385.
48. KINDEM, S., SERRA-GUILLÉN, C., SORNI, G. et al. Treatment of porokeratosis of Mibelli with ingenol mebutate: a possible new therapeutic option. JAMA Dermatol., 2015, 151, 1, p. 85–86.
49. KROISS, M., STOLZ, W., HOHENLEUTNER, U. et al. Disseminated superficial porokeratosis induced by furosemide. Acta Derm. Venereol., 2000, 80, p. 52–53.
50. LEDERMAN, J. S., SOBER, A. J., LEDERMAN, G. S. Immunosuppression: a cause of porokeratosis? J. Am. Acad. Dermatol., 1985, 13, 1, p. 75–79.
51. LEVITT, J., EMER, J. J., EMANUEL, P. O. Treatment of porokeratosis of Mibelli with combined use of photodynamic therapy and fluorouracil cream. Arch. Dermatol., 2010, 146, p. 371–373.
52. LIU, H. T. Treatment of lichen amyloidosis (LA) and disseminated superficial porokeratosis (DSP) with frequency-doubled Q-switched Nd: YAG laser. Dermatol. Surg., 2000, 26, 10, p. 958–962.
53. LIU, P., ZHANG, S., YAO, Q. et al. Identification of a genetic locus for autosomal dominant disseminated superficial actinic porokeratosis on chromosome 1p31.3 - p31.1. Hum. Genet., 2008, 123, p. 507–513.
54. LOLIS, M. S., MARMUR, E. S. Treatment of disseminated superficial actinic porokeratosis (DSAP) with the Q-switched ruby laser. J. Cosmet. Laser Ther., 2008, 10, 2, p. 124–127.
55. LUAN, J., NIU, Z., ZHANG, J. et al. A novel locus for disseminated superficial actinic porokeratosis maps to chromosome 16q24.1-24.3. Hum. Genet., 2011, 129, p. 329–334.
56. LUCKER, G. P., HAPPLE, R., STEIJLEN, P. M. An unusual case of porokeratosis involving the natal cleft: porokeratosis ptychotropica? Br. J. Dermatol., 1995, 132, 1, p. 150–151.
57. MA, Y., LI, C., WU, J. Coexistence of porokeratosis ptychotropica with porokeratosis of Mibelli in a Chinese man. Postepy Dermatol. Alergol., 2015, 32, 4, p. 307–309.
58. MARKS, S., VARMA, R., CANTRELL, W. et al. Diclofenac sodium 3% gel as a potential treatment for disseminated superficial actinic porokeratosis. J. Eur. Acad. Dermatol. Venereol., 2009, 23, 1, p. 42–45.
59. MACMILLAN, A. L., ROBERTS, S. O. Porokeratosis of Mibelli after renal transplantation. Br. J. Dermatol., 1974, 90, 1, p. 45–51.
60. MCDONALD, S. G., PETERKA, E. S. Porokeratosis (Mibelli): treatment with topical 5 -fluorouracil. J. Am. Acad. Dermatol., 1983, 8, p. 107–110.
61. MCGUIGAN, K., SHURMAN, D., CAMPANRLLI, C. et al. Porokeratosis ptychotropica: A clinically distinct variant of porokeratosis. J. Am. Acad. Dermatol., 2008, 60, 3, p. 501–503.
62. MEHREGAN, A., KHALILI, H., FAZEL, Z. Mibelli’s porokeratosis of the face. A report of seven cases. J. Am. Acad. Dermatol., 1980, 3, p. 394–396.
63. MIBELLI, V. Contribute allo studio della ipercheratosi dei canali sudoriferi (porocheratosis). G. Ital. Mal. Ven., 1893, 28, p. 313–355.
64. MIZUKAWA, Y., SHIOHARA, T. Porokeratosis in patients with hepatitis C virus infection: does hepatitis C virus infection provide a link between porokeratosis and immunosuppression? Br. J. Dermatol., 1999, 141, 1, p. 163–164.
65. MIZUKAWA, Y., SHIOHARA, T. Virus-induced immune dysregulation as a triggering factor for the development of drug rashes and autoimmune diseases: With emphasis on EB virus, human herpesvirus 6 and hepatitis C virus. J. Dermatol. Sci., 2000, 22, 3, p. 169–180.
66. MOSCARELLA, E., LONGO, C., ZALAUDEK, I. et al. Dermoscopy and confocal microscopy clues in the diagnosis of psoriasis and porokeratosis. J. Am. Acad. Dermatol., 2013, 69, p. 231–233.
67. MUNDI, J. P., CERULLO, L., COTLIAR, J. Porokeratosis in a patient with hepatitis of unclear etiology. J. Drugs Dermatol., 2010, 9, 3, p. 258–260.
68. MURASE, J., GILLIAM, A. Disseminated superficial actinic porokeratosis co-existing with linear and verrucous porokeratosis in an elderly woman: update on the genetics and clinical expression of porokeratosis. J. Am. Acad. Dermatol., 2010, 63, p. 886–891.
69. NAHM, W. K., DONOHUE, K. G., DANAHY, J. F. et al. Systemic 5 -fluorouracil producing an inflammatory response in porokeratosis. J. Eur. Acad. Dermatol. Venereol., 2003, 17, 2, p. 190–192.
70. NAINENI, K. K., HOHLE, R., LUCKE, T. Disseminated superficial actinic porokeratosis of the scalp. Clin. Exp. Dermatol., 2007, 32, 2, p. 222–223.
71. NAKAMURA, M., FUKAMACHI, S., TOKURA, Y. Acute onset disseminated superficial porokeratosis associated with exacerbation of diabetes mellitus due to development of anti-insulin antibodies. Dermatoendocrinol., 2010, 2, 1, p. 17–18.
72. NAKAMURA, Y., YAMAGUCHI, M., NAKAMURA, A. et al. Calcipotriol and adapalene therapy for disseminated superficial actinic porokeratosis. Indian J. Dermatol. Venereol. Leprol., 2014, 80, 4, p. 373–374.
73. NAYEEMUDDIN, F. A., WONG, M., YELL, J. et al. Topical photodynamic therapy in disseminated superficial actinic porokeratosis. Clin. Exp. Dermatol., 2002, 27, p. 703–706.
74. NEUMANN, R. A., KNOBLER, R. M., GEBHART, W. Unusual presentation of porokeratosis palmaris, plantaris et disseminata. J. Am. Acad. Dermatol., 1989, 21, 5, p. 1131–1133.
75. NEUMANN, R. A., KNOBLER, R. M., JURECKA, W. et al. Disseminated superficial actinic porokeratosis: experimental induction and exacerbation of skin lesions. J. Am. Acad. Dermatol., 1989, 21, p. 1182–1188.
76. NEUMANN, R., KNOBLER, R., METZE, D., JURECKA, W., GEBHART, W. Disseminated superficial actinic porokeratosis: experimental induction and exacerbation of skin lesions. J. Am. Acad. Dermatol., 1989, 21, p. 1182–1188.
77. OCCELLA, C., BLEIDL, D., NOZZA, P. Identification of an interstitial 18p11.32-p11.31 duplication including the EMILIN2 gene in a family with porokeratosis of Mibelli. PLoS One, 2013, 10, 8, 4, e61311.
78. PAREKH, V., KABIHTING, F. D., JUNKINS-HOPKINS, J. M. Hyperkeratotic variant of porokeratosis in a patient with Hepatitis C virus infection and a concomitant immunosuppressed state. Dermatol. Online J., 2015, 18, 21, p. 11.
79. RAHMAN, M., ANSARI, N., HADIUZZAMAN, M. A giant porokeratosis of Mibelli: successful treatment with topical 5 percent fluorouracil. Egypt Dermatol. Online J., 2011, 7, p. 7.
80. REED, R. J., LEONE, P. Porokeratosis-a mutant clonal keratosis of the epidermis. I. Histogenesis. Arch Dermatol., 1970, 101, p. 340–347.
81. RICCI, C., ROSSET, A., PANIZZON, R. Bullous and pruritic variant of disseminated superficial actinic porokeratosis: successful treatment with grenz rays. Dermatology, 1999, 199, p. 328–331.
82. RODRÍGUEZ, E. A., JAKUBOWICZ, S., CHINCHILLA, D. A. et al. Porokeratosis of Mibelli and HIV-infection. Int. J. Dermatol., 1996, 35, 6, p. 402–404.
83. ROSON, E., GARCIA-DOVAL, I., DE LA TORRE, C. et al. Disseminated superficial porokeratosis with mucosal involvement. Acta Derm. Venereol., 2001, 81, p. 64–65.
84. ROSS, N. A., ROSENBAUM, L. E., SAEDI, N. et al. Disseminated superficial actinic porokeratosis improved with fractional 1927-nm laser treatments. J. Cosmet. Laser Ther., 2016, 28, p. 1–3.
85. SAKAS, E. L., GENTRY, R. H. Porokeratosis punctata palmaris et plantaris (punctate porokeratosis): case report and literature review. J. Am. Acad. Dermatol., 1985, 13, p. 908–912.
86. SASSON, M., KRAIN, A. D. Porokeratosis and cutaneous malignancy. A review. Dermatol. Surg., 1996, 22, 4, p. 339–342.
87. SERTZNIG, P., VON FELBERT, V., MEGAHED, M. Porokeratosis: present concepts. J. Eur. Acad. Dermatol. Venereol., 2012, 26, p. 404–412.
88. SEHGAL, V. N., DUBE, B. Porokeratosis (Mibelli) in a family. Dermatologica, 1967, 134, p. 219–224.
89. SHELLEY, W. B., SHELLEY, E. D. Disseminated superficial porokeratosis: rapid therapeutic response to 5 - fluorouracil. Cutis, 1983, 32, p. 139–140.
90. SHEN, C. S., TABATA, K., MATSUKI, M. et al. Premature apoptosis of keratinocytes and the dysregulation of keratinization in porokeratosis. Br. J. Dermatol., 2002, 147, p. 498–502.
91. SHOIMER, I., ROBERTSON L., H., STORWICK, G., HABER. M., R. Eruptive disseminated porokeratosis: A new classification system. J. A. Acad. Dermatol., 2014, 71, 2, p. 398–400.
92. SILVER, S., CRAWFORD, R. Fatal squamous cell carcinoma arisingfrom transplant-associated porokeratosis. J. Am. Acad. Dermatol., 2003, 49, p. 931–933.
93. STEVENS, H. P., KELSELL, D. P., BRYANT, S. P. et al. Linkage of an American pedigree with palmoplantar keratoderma and malignancy (palmoplantar ectodermal dysplasia type III) to 17q24: literature survey and proposed updated classification of the keratodermas. Arch. Derm., 1996, 132, p. 640–651.
94. STEWART, L., HOWAT, A., COULSON, I. Disseminated superficial porokeratosis secondary to immunosuppression induced by etanercept for extensive psoriasis. Arch Dermatol., 2010, 46, p. 1193–1194.
95. STORK, J., KODETOVA, D. Disseminated superficial porokeratosis: an eruptive pruritic papular variant. Dermatology, 1997, 195, 3, p. 304–305.
96. TEIXEIRA, S., NASCIMENTO, M., BAGATIN, E. et al. The use of fluor-hydroxy pulse peel in actinic porokeratosis. Dermatol. Surg., 2005, 31, p. 1145–1148.
97. TERRANOVA, M., AMATO, L., MASSI, D. et al. Disseminated superficial actinic porokeratosis in a patient with Sjögren syndrome. Skinmed., 2003, 2, 6, p. 390–391.
98. TRCKA, J., PETTKE-RANK, C. V., BROCKER, E. B. et al. Genitoanocrural porokeratosis following chronic exposure to benzene. Clin. Exp. Dermatol., 1998, 23, p. 28–31.
99. UHARA, H., KAMIJO, F., OKUYAMA, R. et al. Open pores with plugs in porokeratosis clearly visualized with the dermoscopic furrow ink test: report of 3 cases. Arch. Dermatol., 2011, 147, 7, p. 866–868.
100. ULRICH, M., FORSCHNER, T., RÖWERT-HÜBER, J., et al. Differentiation between actinic keratoses and disseminated superficial actinic porokeratoses with reflectance confocal micrscopy. Br. J. Dermatol., 2007, 156, 3, p. 47–52.
101. VON FELBERT, V., NEIS, M., MEGAHED, M. et al. Imaging of actinic porokeratosis by optical coherence tomography. Hautarzt, 2008, 59, p. 877–879.
102. VASUDEVAN, B., CHATTERJEE, M., GREWAL, R. A case of disseminated superficial porokeratosis associated with giant porokeratosis in pregnancy. Indian J. Dermatol., 2014, 59, 5, p. 492–494.
103.VENECIE, P. Y., VEROLA, O., PUISSANT, A. Porokeratosis in primary biliary cirrhosis during plasmapheresis. J. Am. Acad. Dermatol., 1986, 15, 4, p. 709–710.
104. VOSMÍK, F. Porokeratosis. In Štork, J. et al. Dermatovenerologie. Praha: Galén, 2008, p. 360–362.
105. WALSH, S. N., HURT, M. A., SANTA CRUZ, D. J. Porokeratoma (porokeratotic acanthoma): immunohistological study of a new case. Am. J. Surg. Pathol., 2007, 31, 12, p. 1897–1901.
106. WEI, S., YANG, S., LIN, D. et al. A novel locus for disseminated superficial porokeratosis maps to chromosome 18p11.3. J. Invest. Dermatol., 2004, 123, p. 872–875.
107. WEI, S. C., YANG, S., LI, M. et al. Identification of a locus for porokeratosis palmaris et plantaris disseminata to a 6.9 - cM region at chromosome 12q24.1 - -24.2. Br. J. Dermatol., 2003,149, 2, p. 261–267.
108. WEI, S., ZHANG, T. D., ZHOU, Y. et al. Fine mapping of the disseminated superficial porokeratosis locus to a 2.7 Mb region at 18p11.3. Clin. Exp. Dermatol., 2010, 35, p. 664–667.
109. XIA, J. H., YANG, Y. F., DENG, H. et al. Identification of a locus for disseminated superficial actinic porokeratosis at chromosome 12q23.2-24.1. J. Invest. Dermatol., 2000,114, p. 1071–1074.
110. XIA, K., DENG, H., XIA, J. H. et al. A novel locus (DSAP2) for disseminated superficial actinic porokeratosis maps to chromosome 15q25.1-26.1. Br. J. Dermatol., 2002, 147, p. 650–654.
111. YAZAKAN, F., TURK, B. G., DERELI, T. et al. Porokeratosis of Mibelli induced by topical corticosteroid. J. Cutan. Pathol., 2006, 33, p. 516–518.
112. ZABALLOS, P., PUIG, S., MALVEHY, J. Dermoscopy of disseminated superficial actinic porokeratosis. Arch. Dermatol., 2004, 40, 11, p. 1410.
113. ZHANG, S. Q., JIANG, T., LI, M. et al. Exome sequencing identifies MVK mutations in disseminated superficial actinic porokeratosis. Nat. Genet., 2012, 44, p. 1156–1160.
114. ZHANG, Z. H., WANG, Z. M., CROSBY, M. E. et al. Gene expression profiling of porokeratosis. J. Cutan. Pathol., 2008, 35, p. 1058–1062.
115. ZHAO, M., SANUSI, T., ZHAO, Y. et al. Porokeratosis with follicular involvement: report of three cases and review of literatures. Int. J. Clin. Exp. Pathol., 2015, 1, 8, 4, p. 4248–4252.
Labels
Dermatology & STDs Paediatric dermatology & STDsArticle was published in
Czech-Slovak Dermatology

2016 Issue 4
Most read in this issue
- Porokeratoses
- Granuloma annulare at the Site of Healed Herpes Zoster: Wolf’s Isotopic Response
- Musculosceletal Ultrasonography in Patients with Psoriasis and Psoriatic Arthritis