Rázštepy nervovej trubice – súčasné pohľady na etiopatogenézu a možnosti prevencie kyselinou listovou
Neural Tube Defects – Current Opinion on Etiopathogenesis and Prevention Potencial of Folic Acid
Neural tube defects belong to the most serious birth defects. Comparing to the past – thanks to the possibilities of modern neurosurgery – the number of surviving children significantly increases – although frequent morbidity and variable degree of permanent deficiency (sensomotoric, autonomous or mental) are present in majority of patients.
Authors discuss present knowledge about etiopathogenesis of these multifactorial birth defects (genetic factors – polymorfisms of genes regulating folat and homocystein metabolism, transcription factors and signalling proteins, as well as environmental factors) with the emphasis on existing possibilities of prevention – sufficient daily intake of folat in all women in childbearing age and elimination of risk moments.
Key words:
neural tube defects, etiopathogenesis, gene polymorphisms, MTHFR, folat, homocystein, prevention
:
J. Behúnová; Ľ. Podracká
:
I. Klinika detí a dorastu LF UPJŠ a DFN, Košice
prednostka prof. MUDr. Ľ. Podracká, CSc.
:
Čes-slov Pediat 2008; 63 (1): 38-46.
:
Review
Rázštepy nervovej trubice patria k najzávažnejším vrodeným vývojovým chybám. Vďaka včasným neurochirurgickým výkonom v porovnaní s minulosťou výrazne vzrástol počet prežívajúcich detí, avšak častá morbidita a rôzny stupeň trvalého deficitu (senzomotorického, autonómneho či mentálneho) sú realitou u väčšiny pacientov.
Autori upriamili svoju pozornosť na súčasné poznatky o etiopatogenéze týchto multifaktoriálne podmienených defektov (genetické faktory – polymorfizmy génov regulujúcich metabolizmus folátu a homocysteínu, transkripčné faktory a signálne proteíny, ako aj vonkajšie faktory) s dôrazom na existujúce možnosti prevencie – dostatočný príjem folátu u všetkých žien vo fertilnom veku a elimináciu rizikových momentov.
Kľúčové slová:
rázštepy nervovej trubice, etiopatogenéza, génové polymorfizmy, MTHFR, folát, homocysteín, prevencia
Úvod
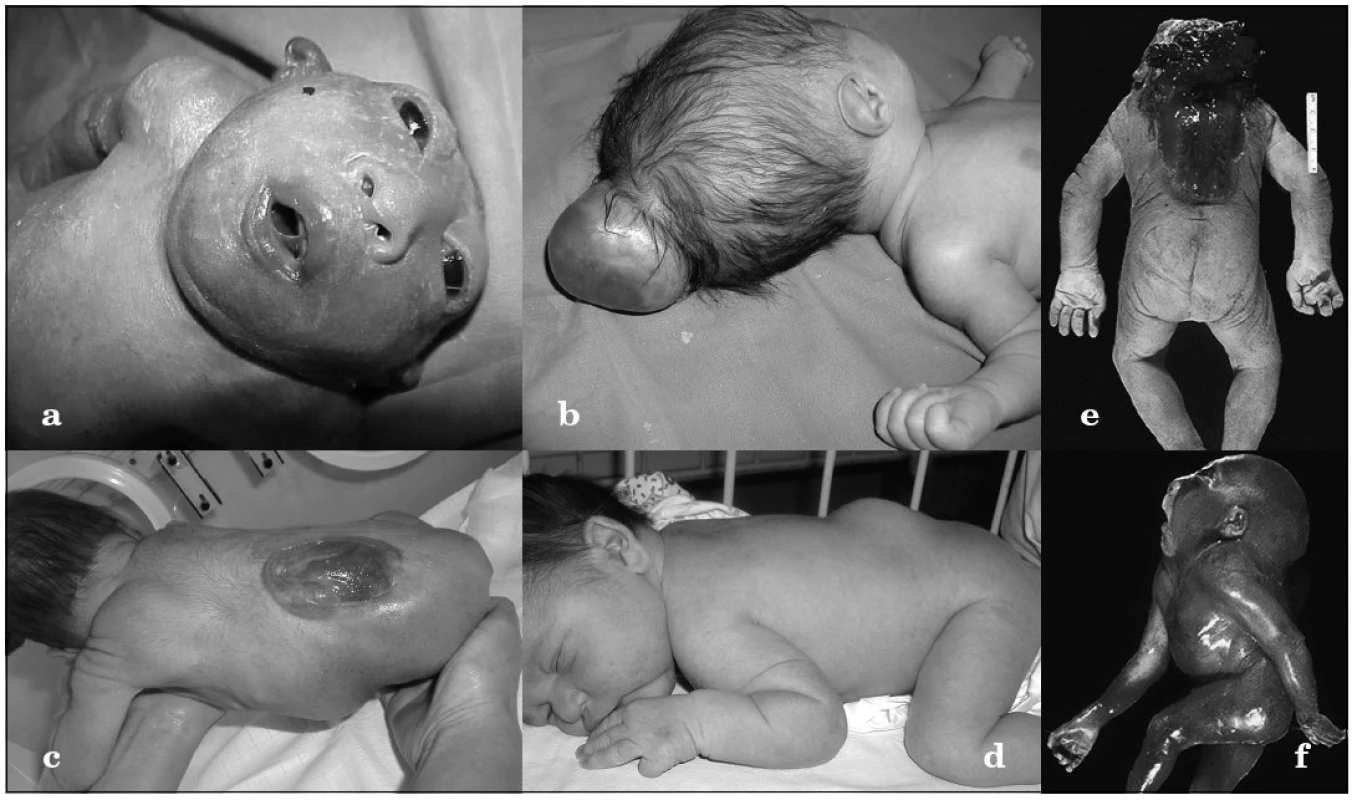
Rázštepy nervovej trubice (NTD – Neural Tube Defects) sú v drvivej časti multifaktoriálne vrodené vývojové chyby manifestujúce sa ako 3 samostatné jednotky – anencefalus, encefalokéla a meningomyelokéla (obr. 1a–d). K menej známym vzácne sa vyskytujúcim formám patrí craniorhachischisis (anencefália s otvoreným kostným defektom chrbtice a expozíciou mozgu a miechy navonok) a iniencephalus (dysrafizmus v okcipitálnej oblasti s retroflexiou krku a trupu) (obr. 1e–f). Tieto bizarné anomálie sa 10-násobne častejšie vyskytujú v oblastiach s vysokou incidenciou NTD [1]. Kým plody s anencefalom sú zvyčajne mŕtvorodené alebo umierajú krátko po narodení, deti s meningomyelokélou, ak sa im dostane adekvátna medicínska starostlivost, prežívajú, no často ostávajú inkontinentné, s parézou dolných končatín, poruchami kožnej citlivosti a hydrocefalom [2]. Navyše, až u tretiny z nich sa vyvinie mentálny deficit, ktorý varíruje od ľahkého po ťažký stupeň [3]. Vzácnejšie sú rázštepy nervovej trubice spojené s výskytom ďalších orgánových anomálií či dysmorfií. Vtedy môžu byť súčasťou monogénových syndrómov (napr. Meckelovho-Gruberovho syndrómu), alebo VATER sekvencie, či chromozómových aberácií.
Výskyt NTD – geografické, rasové a pohlavné rozdiely, riziká rekurencie
Incidencia rázštepov nervovej trubice značne varíruje. Celosvetový priemer sa pohybuje okolo 1–2 gravidít s NTD na 1000 pôrodov, no v Írsku bol v 60. rokoch ich výskyt až 8/1000. Vysoký výskyt sa zaznamenal aj v oblasti severnej Číny, Mexika, Veľkej Británie a časti Kanady (tab. 1) [4]. Na Slovensku sa počet hlásených prípadov NTD (podľa Ústavu zdravotníckych informácií a štatistiky) pohybuje v rozmedzí 0,52–0,59 NTD gravidít na 1000 živorodených – vrátane umelo prerušených gravidít po prenatálne diagnostikovanom rázštepe neurálnej trubice; je však možné, že toto číslo je podhodnotené pre nekompletné hlásenia abortovaných prípadov. Výskyt živorodených detí s NTD je priemerne 0,28/1000 (tab. 1).
![Výskyt rázštepov nervovej trubice – svet a Slovensko – upravené podľa [4].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/79beac09055c437e6088f859588ac20b.png)
Incidencia NTD je ovplyvnená pohlavím a etnickými rozdielmi. Častejšie sú postihnuté ženy, čo sa pripisuje vyššej viabilite plodov ženského pohlavia. O tom, či sú etnické rozdiely viac determinované genetickými variáciami alebo životosprávou sa diskutuje. Zistené rozdiely po migrácii obyvateľstva sa pripisujú skôr environmentálnym ako genetickým faktorom (napr. zmena výživy), kedže „genetický shift“ v priebehu jednej či dvoch generácií je len málo pravdepodobný [5]. Oproti tomu, na dôležitú úlohu genetických faktorov poukazujú výsledky americkej štúdie, ktorá zistila, že perikoncepčne podávaná kyselina listová redukovala výskyt NTD u kaukazskej populácie o 40 %, no riziko NTD gravidity u hispánskych žien neznížila!
Až v 95 % sa NTD objaví ako „prvovýskyt“ v rodine, čiže dieťa postihnuté rázštepom nervovej trubice má negatívnu rodinnú anamnézu. Ženy, ktoré už porodili dieťa s NTD, majú riziko rekurencie u ďalšieho potomka 3,5 až 4 % – t.j. niekoľkonásobne vyššie ako v bežnej populácii, no u vzdialenejších ako prvostupňových príbuzných toto riziko prudko klesá. V súlade s modelom multifaktoriálne podmienených chorôb platí, že čím viac je postihnutých jedincov v príbuzenstve, tým je väčšia pravdepodobnosť opätovného výskytu tejto anomálie.
Etiopatogenéza multifaktoriálnych NTD – genetické faktory
Nervová trubica sa uzatvára medzi 3. a 4. gestačným týždňom zrastaním medulárnej rúry v budúcej krčnej oblasti embrya a pokračuje v 4. týždni kaudálnym aj kraniálnym smerom. Novšie sa predpokladá, že medulárna rúra sa uzatvára na viacerých miestach súčasne („multisite closure“ – viacmiestny“ model uzatvárania) [6]. Tento zdanlivo jednoduchý proces je v skutočnosti veľmi zložitý. Zúčastňujú sa na ňom početné transkripčné faktory (HOX-A, B, C, PAX) a tiež dôležité signálne proteíny – morfogény (sonic hedgehog – SHH, bone morphogenic proteins – BMP a i.), ktoré sprostredkúvajú vzájomnú interakciu medzi bunkami a tým ovplyvňujú génovú expresiu [7, 8]. Rovnako ako pri ďalších multifaktoriálne podmienených VVCH aj tu je prítomný typický prahový efekt – po prekročení určitej pomyselnej hranice vzniká trvalý defekt.
Presný etiopatomechanizmus defektu uzatvárania nervovej trubice nie je známy. Avšak už v 80. rokoch prenikli na odbornú verejnosť prvé správy o preventívnom vplyve perikoncepčného užívania kyseliny listovej na rekurenciu a neskôr i na prvovýskyt NTD [9, 10, 11, 12]. Niektoré štúdie následne potvrdili signifikantne nižšie koncentrácie folátu či zvýšený homocysteín v súboroch pacientov s NTD a/alebo ich matiek v porovnaní s kontrolnou populáciou [13, 14, 15]. Logickým vyústením týchto objavných skutočností je veľký záujem lekárskej verejnosti o geneticky determinované odchýlky v metabolizme folátu a homocysteínu a ich aditívny vplyv na vznik rázštepových chýb nervovej trubice.
Pre komplexný obraz danej problematiky stručne pripomenieme metabolické cesty folátu a homocysteínu (obr. 2). Aktívna forma folátu – tetrahydrofolát – je zložkou enzymatickej sústavy, ktorá katalyzuje prenos jednouhlíkatých zvyškov a spolu s vitamínom B12 sa zúčastňuje premeny homocysteínu na metionín. Túto metabolickú reakciu katalyzuje enzým metionín syntáza; jeho obnove napomáha metionín syntáza reduktáza. Metionín sa v ďalších biochemických pochodoch podieľa na metylácii proteínov a DNA, čo je osobitne dôležité v embryonálnom období, keď sa rozhoduje o čase, mieste a intenzite expresie génov. Okrem toho je folát aj donorom metylovej skupiny pri syntéze tymidínových nukleotidov (enzým tymidylát syntáza). Pri výraznom folátovom deficite dochádza k misinkorporácii (chybnému zabudovaniu) uracilu namiesto tymínu do DNA, čo má za následok zvýšený výskyt chromozomálnych zlomov a instabilitu DNA [16, 17]. Dôležitým enzýmom v metabolizme kyseliny listovej a homocysteínu je metylén tetrahydrofolát reduktáza (MTHFR), ktorá redukuje 5,10-metylén tetrahydrofolát na jeho aktívnu formu 5-metyl tetrahydrofolát. Znížená funkcia MTHFR vedie k nižšej koncentrácii aktívnej formy folátu a k spomaleniu remetylácie homocysteínu na metionín.
![Metabolizmus kyseliny listovej.
THF – tetrahydrofolát – aktívna forma kyseliny listovej [4]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/eae192cc9b9b6d1643318cfb1c042100.jpeg)
Najčastejšou príčinou mierneho deficitu funkcie MTHFR je génový polymorfizmus, ktorý má za následok termolabilitu enzýmu a zníženie jeho aktivity na 35 až 50 %, s následnou ľahkou hyperhomocysteinémiou. Tento „termolabilný“ polymorfizmus bol prvýkrát opísaný v súvislosti so zvýšeným výskytom srdcovocievnych príhod [18], ale jeho molekulová podstata bola odhalená až neskôr [19]. Z biochemického hľadiska ide o zámenu jedinej bázy cytozínu za tymín na pozícii 677 v reťazci DNA (C677T) a v štruktúre proteínu zámenu aminokyseliny alanínu za valín. Keďže výskyt T alely bol v niektorých prácach asociovaný so vznikom NTD, mnoho autorov ho považuje za rizikový faktor susceptibility pre malformácie nervovej trubice [20, 21]. V prípadoch, keď sú TT homozygotmi matka aj plod, sa riziko zvyšuje. Takisto deplécia kyseliny listovej u matiek – nosičiek T alely v perikoncepčnom období potencuje negatívny vplyv polymorfizmu, a naopak, suplementácia folátu významne redukuje vznik NTD u plodu s rizikovým genotypom [22].
V súvislosti s metabolizmom folátu, homocysteínu a rizikom NTD sa dnes študujú i génové polymorfizmy iných enzýmov/proteínov – napr. varianta A1298C MTHFR a iné [4]. V českej populácii sú veľmi dobre zmapované génové frekvencie variánt folátového metabolizmu a ich vplyv na folátový status zdravej populácie. Publikovaná bola aj genetická analýza súboru pacientov s hyperhomocysteinémiou po kardio/ cerebro-vaskulárnej príhode so signifikantne vyšším zastúpením C677T varianty MTHFR [23, 24].
Etiopatogenéza multifaktoriálnych NTD – biochemické a experimentálne aspekty
Teoretický model patomechanizmu vzniku NTD na podklade deplécie folátov vychádza z dôsledkov nedostatku folátu v organizme. Ide o deficit tymidínových nukleotidov pre replikáciu DNA na jednej strane a nadbytok homocysteínu s nedostatkom metionínu v deliacich sa tkanivách na strane druhej. Tymidínové nukleotidy sú esenciálne pre všetky biologické tkanivá rýchlo rastúceho niekoľkotýždňového embrya, a tak ich deficit per se nevysvetľuje, prečo táto anomália postihuje predilekčne práve nervové tkanivo. Tieto úvahy iniciovali sériu experimentálnych prác, ktoré študovali potenciálny vplyv hyperhomocysteinémie na vznik NTD. Rosenquist et al. demonštrovali priamy teratogénny vplyv homocysteínu na vznik defektov spojených s uzatváraním NT a s niektorými vrodenými srdcovými chybami (aortopulmonálne defekty) a uvádza, že možnosť jeho negatívneho vplyvu na nervové tkanivá môže byť sprostredkovaná inhibíciou funkcie receptorov pre N-metyl-D-aspartát [25]. Avšak Vanaerts upozorňuje, že potenciálne toxické koncentrácie homocysteínu indukujúce vznik NTD sú až 100-násobne vyššie oproti fyziologickej norme, čo je v praxi málo pravdepodobné a za reálny patomechanizmus pri folát-senzitívnych NTD považuje nedostatok metionínu [26]. Aj Mills uzatvára, že pre vznik folát-senzitívnych NTD je kritický metabolizmus homocysteínu (zistil signifikantne vyššie koncentrácie homocysteínu u žien s NTD graviditou oproti kontrolám). Za zásadný krok považuje konverziu homocysteínu na metionín a vyzdvihuje význam enzýmov metionín syntázy, cystationín beta-syntázy a metyléntetrahydrofolát reduktázy v metabolizme homocysteínu [13]. Naviac sa v naväzujúcich prácach potvrdilo, že kyselina listová má potenciál limitovať aj nepriaznivý vplyv iných teratogénov na vznik NTD [27].
Etiopatogenéza multifaktoriálnych NTD – vonkajšie faktory
1. Nedostatok folátu
Z vyššie uvedených poznatkov vyplýva, že pre vznik multifaktoriálne podmienených NTD je z vonkajších rizikových faktorov kritický predovšetkým nedostatok kyseliny listovej. Ba čo viac, deficit folátu sa môže spolupodieľať aj na vývoji iných vrodených chýb, ako sú napr. orofaciálne rázštepy, rázštepy prednej brušnej steny, niektoré vrodené srdcové chyby či Downov syndróm (ovplyvnenie nondisjunkcie pri meióze vajíčka) [28, 29, 25, 30].
Závery kontrolovaných klinických štúdií nespochybniteľne potvrdzujú preventabilný účinok perikoncepčného podávania kyseliny listovej na prvovýskyt NTD [11, 12], ako aj na rekurenciu NTD [9, 10]. Opierajú sa najmä o údaje doteraz najväčšieho kontrolného súboru zahrňujúceho až 247 831 žien plánujúcich graviditu, ktorý sa uskutočnil v severnej a južnej Číne, t.j. v oblastiach s najvyšším výskytom NTD [12]. Autori podávali polovici žien 400 μg kyseliny listovej od poslednej menštruácie až po koniec prvého trimestra ťarchavosti. Porovnaním klinických výsledkov zistili dramatické rozdiely vo výskyte NTD u nesuplementovaných a suplementovaných žien (4,8 vs. 1,0/1000 gravidít v severnej Číne (redukcia rizika 79 % !) a 1,0 vs. 0,6/1000 gravidít v oblasti južnej Číny (redukcia rizika 40 %). Dnes sa verí, že užívanie kyseliny listovej má reálny 50 - až 70% preventabilný účinok na vznik NDT [31].
2. Antikonvulzíva a ďalší antagonisti kyseliny listovej
Vychádzajúc z mechanizmu účinku liekov patriacich do skupiny antagonistov kyseliny listovej (antikonvulzíva – karbamazepín, fenobarbital, valproát a iné; niektoré protinádorové lieky, trimetoprim, triamteren atď.) sa skúmalo, či môžu tieto farmaká zvyšovať riziko vzniku NDT. Skutočne sa zistilo, že ženy užívajúce tieto lieky počas prvých 6 týždňov gravidity majú až 2,8-krát vyššiu pravdepodobnosť porodenia dieťaťa s NDT. Najvyššie riziko spomedzi antikonvulzív predstavuje valproát: 1–2 % a karbamazepín: 0,5–1 % riziko NTD v exponovaných graviditách [32]. Avšak najdôležitejší bol poznatok, že toto riziko sa významne znížilo u gravidných žien, ktoré súčasne brali aj kyselinu listovú [33].
3. Hypertermia
Teratogénny efekt hypertermie na nervový systém počas kritického embryonálneho vývoja sa dokázal v experimente na zvieratách. Podanie kyseliny listovej myšiam exponovaným hypertermii malo podľa očakávaní signifikantný protektívny účinok. Aj v populačných štúdiách sa ukázalo, že ženy vystavené vysokým teplotám v prvom trimestri gravidity (horúci kúpeľ, sauna, horúčka nad 38 °C) mali 2-krát vyššie riziko NTD pre plod [34].
4. Obezita a diabetes mellitus
Obezita a cukrovka tiež môžu zvyšovať susceptibilitu pre narodenie dieťaťa s defektom neurálnej trubice. Kým spojenie maternálneho diabetu so vznikom diabetickej embryopatie, súčasťou ktorej môže byť aj NTD, je dobre známe, vzťah medzi samotnou obezitou a NTD sa začal skúmať len v 90. rokoch. Shaw a spol. uvádzajú 1,9-krát vyššie riziko pre NTD, a to najmä pre spina bifida u matiek s BMI (body mass index) vyšším ako 29 kg/m2 [35]. K podobným záverom dospela aj Werlerová, keď zistila, že novorodenci žien s pregravidnou hmotnosťou 80–89 kg majú takmer dvojnásobný a rodičky s hmotnosťou nad 100 kg dokonca až 4-krát vyšší výskyt NDT. Týmto alarmujúcim údajom je potrebné venovať patričnú pozornosť, a to najmä so zreteľom na celosvetový „epidemický“ nárast obezity u mladých ľudí zaznamenaný v ostatných rokoch.
5. Iné
Je potrebné spomenúť i vzácnejšie exogénne faktory uplatňujúce sa najmä pri „folátrezistentných“ NTD, ako sú deficit inozitolu, prebytok olova alebo deplécia zinku. Vysvetlenie patomechanizmu spoluúčasti stopových prvkov pri vzniku NDT nie je jednoznačné; zvažuje sa priamy neurotoxický vplyv olova na rýchlo sa vyvíjajúce nervové tkanivo a najmä sekundárny nedostatok kyseliny listovej z deficitu zinku spôsobeného nadbytkom olova. Zinok je významným faktorom pri vstrebávaní folátu – kyselina listová sa totiž nachádza v strave najmä vo forme polyglutamátov, ktoré sa pred vstrebaním v čreve musia hydrolyzovať na monoglutamát za účasti zinok-dependentnej folát konjugázy [36, 37]. A konečne, pod nedostatok folátu sa môže podpísať aj socio-ekonomická deprivácia [5, 36].
Možnosti prevencie, odporúčania
V celosvetovom meradle, a to najmä vo vyspelých štátoch, panuje klesajúci trend výskytu NTD. Tieto priaznivé demografické dáta sa dávajú do súvislosti so zlepšovaním socioekonomických podmienok obyvateľstva, ale najmä so zvýšenou konzumáciou multivitamínov s obsahom kyseliny listovej v perikoncepčnom období, so zavedením fortifikácie múky kyselinou listovou v niektorých krajinách, ako aj s cielenou prevenciou rekurencie NDT vysokými dávkami folátu [38].
Veľká dvojito slepá kontrolovaná štúdia (MRC study) z rokov 1983–1991 potvrdila 72%-ný protektívny efekt u žien s predchádzajúcimi NTD graviditami a zníženie rizika rekurencie z 3,5 na 1 % [10]. Podľa inej štúdie užívanie multivitamínu s obsahom 0,36 mg kyseliny listovej ženám s predchádzajúcou NTD graviditou znížilo rekurenciu tejto anomálie na 0,7 % v porovnaní so 4,7 % u nesuplementovaných žien! Ak sa sledovaný súbor rozdelil na matky s jednou predchádzajúcou NTD graviditou a s dvoma či viacerými NTD graviditami, preventabilný účinok kyseliny listovej sa dokonca ešte znásobil (0,5 %, resp. 2,3 % v suplementovanej skupine v porovnaní so 4,2 %, resp. 9,6 % v nesuplementovanej skupine) [9].
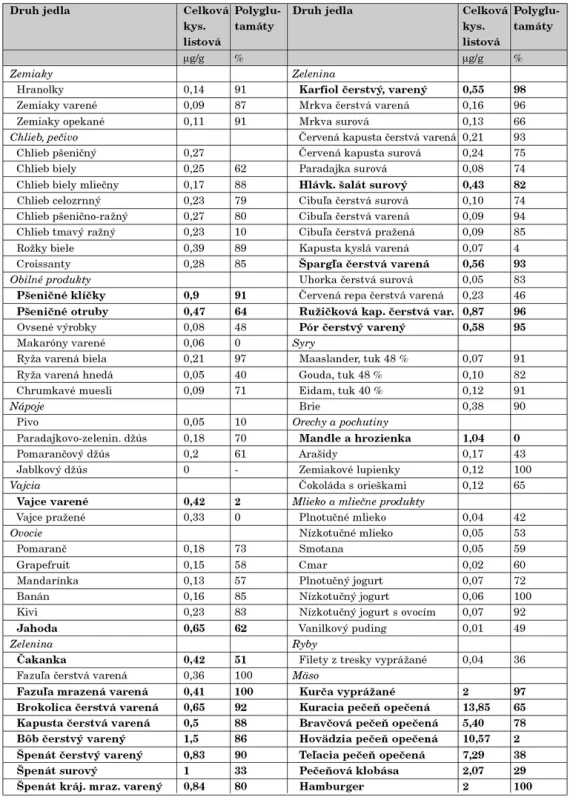
Ako teda správne postupovať v prevencii prvovýskytu či rekurencie rázštepov nervovej trubice? Viaceré skupiny zdravotníckych expertov (American Academy of Pediatrics – Committee on Genetics, The Expert Advisory Group in the United Kingdom, Society of Obstetricians and Gynaecologists of Canada, World Alliance of Organizations for Birth Defect Prevention) odporúčajú minimálny denný príjem kyseliny listovej 400 μg celoplošne pre všetky ženy vo fertilnom veku bez ohľadu na to, či aktuálne plánujú alebo neplánujú tehotenstvo [39]. Argumentuje sa praktickou skúsenosťou, že väčšina žien začne užívať prenatálne multivitamíny s obsahom folátu až po definitívnom potvrdení ťarchavosti, a to často až v 5.–6. gestačnom týždni. Keďže nervová trubica sa uzatvára včasnejšie, medzi 21. až 28. dňom po oplodnení, v mnohých prípadoch je na prevenciu NTD už neskoro. Aby sa dosiahol plnohodnotný protektívny efekt kyseliny listovej, so suplementáciou treba začať minimálne mesiac pred koncepciou. To je však nereálne v populácii, kde je podľa štatistík aspoň polovica gravidít neplánovaná (údaj z USA a Veľkej Británie) [40]. Argumentáciu podporujú aj ďalšie skutočnosti. Prirodzený príjem folátov je často nedostatočný a navyše foláty majú v strave obmedzenú biologickú dostupnosť a menšiu stabilitu [41]. Pre úplnú informáciu uvádzame prehľad obsahu kyseliny listovej v najbežnejších čerstvých i spracovaných potravinách (tab. 2). Podľa súčasných odporúčaní má dostatočný preventabilný efekt denná dávka kyseliny listovej 400 μg, podávaná vo forme vitamínového doplnku k vyváženej strave. Dôležité je ešte zdôrazniť, že pri plánovaní ďalšieho tehotenstva u matiek, ktoré už porodili dieťa s NTD, sa odporúča až 10-násobne vyššia denná dávka kyseliny listovej, t.j. 4000 μg – 4 mg, čo sa dá zabezpečiť len podávaním syntetického folátu.
V ostatných rokoch sa dosiahol veľký pokrok v edukovaní zdravotníkov i laickej verejnosti o antiteratogénnom efekte kyseliny listovej. V USA prebiehajú celonárodné vzdelávacie a propagačné projekty zamerané na cieľové skupiny žien s rozpočtami desiatok miliónov dolárov. Avšak ukázalo sa, že len samotné mediálne kampane proklamujúce význam kyseliny listovej nepostačujú na to, aby zmenili životný štýl mladých žien v širších populačných rozmeroch. Preto sa ako vhodné riešenie zaviedla fortifikácia múky a obilných výrobkov kyselinou listovou. V USA je povinná fortifikácia s obsahom folátu 140 μg/100 gramov produktu od januára 1998. To zaistí navŕšenie denného príjmu kyseliny listovej približne o 100 μg [42]. K rovnakým opatreniam pristúpili aj v Kanade, kde začali fortifikáciu 150 μg/100 g v novembri 1998, a v Chile. O tom, že išlo o správnu investíciu, presvedčivo dokumentujú demografické údaje o signifikantnom poklese incidencie NTD „po fortifikácií“ [43]. Vo Veľkej Británii je prístup zatiaľ menej striktný a fortifikácia v objeme 240 μg folátu/100 g je dobrovoľná, avšak práve prebiehajú rokovania o jej povinnom zavedení [44]. V protiklade k tomu sú krajiny, kde je fortifikácia dokonca zakázaná. Túto reštrikciu zdôvodňujú najmä obavami z „predávkovania“ kyselinou listovou, čo by mohlo najmä v populácii starších ľudí „maskovať“ príznaky anémie z nedostatku vitamínu B12 a zhoršovať jej neurologické prejavy.
Odvolávajúc sa na pozitívny vplyv folátu na delenie buniek boli tiež vyslovené názory o jeho možnej spoluúčasti na rozvoji onkologických procesov. Tieto úvahy sú zatiaľ iba špekulatívne a v praxi sa doteraz nepotvrdili, naopak, viaceré retrospektívne štúdie poukázali na ochranný vplyv folátu na vznik niektorých druhov rakoviny [45, 46]. V tejto súvislosti bol stanovený i maximálny odporučený denný príjem kyseliny listovej zo suplementov na 1000 ∝g, respektive 1 mg/deň. Na relevantné závery prebiehajúcich štúdií o úlohe kyseliny listovej pri onkologických ochoreniach treba ešte počkať, no neodškriepiteľným faktom zostáva, že v USA po zavedení povinnej fortifikácie múky signifikantne poklesol výskyt NTD aj srdcovocievnych chorôb.
Záver
V medicínskej praxi sa len ťažko nájde preventabilný prostriedok, ktorý by svojou účinnosťou a bezpečnosťou prevýšil kyselinu listovú – jej dennou suplementačnou dávkou v množstve 400 μg sa dosiahne ochrana v 50 až 70 %. Vysoký cost benefit, nízka cena a dostupnosť robia z folátu unikátny antiteratogénny liek. Kvalitu života pacientov s NTD môže zvýšiť komplexná zdravotná starostlivosť, ako aj občianske združenia rodičov, pacientov a odborníkov – konkrétne na Slovensku je to SBAH (Slovenská spoločnosť pre spina bifida a/alebo hydrocefalus – www.sbah.sk).
V každom prípade však platí, že prevencia je lepšia ako liečba. Je aj na nás pediatroch, aby sme aktívne upozorňovali na antiteratogénny účinok kyseliny listovej a najmä, aby sme prispievali k jeho dôslednému uplatňovaniu v bežnej klinickej praxi. Len tak sa podarí eliminovať tieto ťažko invalidizujúce vrodené vývojové chyby na minimum.
Tento príspevok je súčasťou práce na grante APVT č. 2005/1-DFNKE-01 a VEGA č. 1/3362/06.
Došlo: 28. 8. 2007
Přijato: 17. 10. 2007
MUDr. Jana Behunová
I. Klinika detí a dorastu LF UPJŠ a DFN Košice
Tr. SNP 1
040 66 Košice
Slovenská republika
e-mail: barbjane1@yahoo.com
Sources
1. Moore CA, Li S, Li Z, et al. Elevated rates of severe neural tube defects in a high-prevalence area in Northern China. Am. J. Med. Genet. 1997;73 : 113–118.
2. Horn F. Spina bifida – kaudálne defekty neurálnej rúry. Prešov: Vyd. Michala Vaška, 2005. 96 s.
3. Northrup H, Volcik KA. Spina bifida and other neural tube defects. Curr. Probl. Pediatr. 2000;30(10): 313–332.
4. Behunová J. Polymorfizmy génu pre metyléntetrahydrofolát reduktázu (MTHFR) vo vzťahu k etiopatogenéze rázštepov nervovej trubice a iným patologickým stavom (písomná práca k dizertačnej skúške). Košice: 2004. 106 s.
5. Suarez L, Hendricks A, Cooper SP, et al. Neural tube defects among Mexican Americans living on the US-Mexico border: effects of folic acid and dietary folate. Am. J. Epidemiol. 2000;152 : 1017–1023.
6. Van Der Put NMJ, Van Straaten HWM, Trijbels FJM, Blom HJ. Folate, homocysteine and neural tube defects: An Overview. Exp. Biol. Med. 2001;226(4): 243–270.
7. Lumsden A, Graham A. Neural patterning: A forward role for hedgehog. Curr. Biol. 1995;5(12): 1347–1350.
8. Muenke M, Beachy PA. Genetics of ventral forebrain development and holoprosencephaly. Curr. Opin. Genet. Dev. 2000;10(3): 262–269.
9. Smithells RW, Seller MJ, Harris R, et al. Further experience of vitamin supplementation for prevention of neural tube defects recurrences. Lancet 1983;7(May): 1027–1031.
10. MRC Vitamin Study Research Group – Wald N, Sneddon J, Densem J, et al. Prevention of neural tube defects: results of the medical research council vitamin study. Lancet 1991;338 : 131–137.
11. Czeizel AE, Dudás I. Prevention of the first occurrence of neural tube defects by periconceptional vitamin supplementation. N. Engl. J. Med. 1992;327 : 1832–1835.
12. Berry RJ, Li Z, Erickson J, et al. Prevention of neural-tube defects with folic acid in China. N. Engl. J. Med. 1999;341(20): 1485–1490.
13. Mills JL, McPartlin JM, Kirke PN, et al. Homocysteine metabolism in pregnancies complicated by neural-tube defects. Lancet 1995;345 : 149–151.
14. Martinez de Villarreal LE, Delgado-Enciso I, et al. Folate levels and N(5), N(10)-methylenetetrahydrofolate reductase genotype (MTHFR) in mothers of offspring with neural tube defects: a case-control study. Arch. Med. Res. 2001;32(4): 277–282.
15. Grandone E, Corrao AM, Colaizzo D, et al. Homocysteine metabolism in families from southern Italy with neural tube defects: role of genetic and nutritional determinants. Prenat. Diagn. 2006;26(1): 1–5.
16. Crott JW, Mashiyama ST, Ames BN, et al. The effect of folic acid deficiency and MTHFR C677T polymorphism on chromosome damage in human lymphocytes in vitro. Cancer Epidemiol. Biomarkers Prev. 2001;Oct.10 : 1089–1096.
17. Blount BC, Mack MM, Wehr CM, et al. Folate deficiency causes uracil misincorporation into human DNA and chromosomal breakage: implications for cancer and neuronal damage. Proc. Natl. Acad. Sci. 1997;Apr.94 : 3290–3295.
18. Kang SS, Wong PWK, Zhou J, et al. Thermolabile methylentetrahydrofolate reductase in patients with coronary artery disease. Metabolism 1988;37 : 611–613.
19. Frosst P, Blom HJ, Milos R, et al. A candidate genetic risk factor for vascular disease: a common mutation in methylenetetrahydrofolate reductase. Nat. Genet. 1995;10 : 111–113.
20. Rampersaud E, Melvin EC, Siegel D, NTD Collaborative Group, et al. Updated investigations of the role of methylenetetrahydrofolate reductase in human neural tube defects. Clin. Genet. 2003;63(3): 210–214.
21. Richter B, Stegmann K, Roper B, et al. Interaction of folate and homocysteine pathway genotypes evaluated in susceptibility to neural tube defects (NTD) in a German population. J. Hum. Genet. 2001;46(3): 105–109.
22. Johanning GL, Wenstrom KD, Tamura T. Changes in frequencies of heterozygous thermolabile 5,10-methylenetetrahydrofolate reductase gene in fetuses with neural tube defects. J. Med. Genet. 2002;39 : 366–367.
23. Veselá K, Pavlíková M, Janošíková B, et al. Genetic determinants of folate status in Central Bohemia. Physiol. Res. 2005;54 : 295–303.
24. Matalon R, Rady S, Szucs K, et al. Polymorphism of MTHFR and MTRR in Czech patients with cardiovascular diseases and stroke. Čes.-slov. Pediat. 2003;58(7): 418–420.
25. Rosenquist TH, Ratashak A, Selhub J. Homocysteine induces congenital defects of the heart and neural tube: effect of folic acid. Proc. Natl. Acad. Sci. USA 1996;93 : 15227–15232.
26. Vanaerts LA. Investigation, using rat embryo culture, of the role of methionine supply in folic acid-mediated prevention of neural tube defects. Toxicology in Vitro 1995;9(5): 677–684.
27. Sadler TW, Bulman M, Wang P. Folic acid ameliorates toxicant induced growth retardation and birth defects: including fumonisin and hyperthermia. Faseb. J. 2000;16(4): A354.
28. Mills JL, Druschel CM, Pangilinan F, et al. Folate-related genes and omphalocele. Am. J. Med. Genet. A. 2005;136(1):8–11.
29. Botto LD, Khoury MJ, Mulinare J, et al. Periconceptional multivitamin use and the occurrence of conotruncal heart defects: results from a population-based, case-control study. Pediatrics 1996;98(5): 911–917.
30. Rosenblatt DS. Folate and homocysteine metabolism and gene polymorphisms in the etiology of Down syndrome. Am. J. Clin. Nutr. 1999;70 : 429–430.
31. Kadir R, Economides D. Neural tube defects and periconceptional folic acid. CMAJ 2002;167(3): 255–256.
32. Dolk H, McElhatton P. Assessing epidemiological evidence for the teratogenic effects of anticonvulsant medications. J. Med. Genet. 2002;39 : 243–245.
33. Hernandez-Díaz S, Werler MM, Walker AM, et al. Folic acid antagonists during pregnancy and the risk of birth defects. N. Engl. J. Med. 2000;343 : 1608–1614.
34. Milunsky A, Ulcickas M, Rothman KJ, et al. Maternal heat exposure and neural tube defects. JAMA 1992;268 : 882–885.
35. Shaw GM, Velie EM, Schaffer D. Risk of neural tube defect-affected pregnancies among obese women. JAMA 1996;275(14): 1093–1096.
36. Bound JP, Harvey PW, Francis BJ, et al. Involvement of deprivation and environmental lead in neural tube defects: a matched case-control study. Arch. Dis. Child. 1997;76 : 107–112.
37. Akar N. Neural tube defects and zinc. Arch. Dis. Child. 1998;78 : 288.
38. Behunová J, Podracká Ľ. Kyselina listová ako ju (možno) nepoznáme. Ambulantná Terapia 2006;3(1): 3–4.
39. Behunová J, Podracká Ľ. Rázštepy nervovej trubice – preventabilné vrodené chyby? Lekársky Obzor 2005;54(3): 110–113.
40. McNulty H, Cuskelly GJ, Ward M. Response of blood cell folate to intervention: implications for folate recommendations for the prevention of neural tube defects. Am. J. Clin. Nutr. 2000;71(Suppl): 1308S–1311S.
41. Prinz-Langenohl R, Brőnstrup A, Thorand B, et al. Availability of food folate in humans. J. Nutr. 1999;129 : 913–916.
42. Cuskelly G, McNulty H, Scott JM. Fortification with low amounts of folic acid makes a significant difference in folate status in young women: implications for the prevention of neural tube defects. Am. J. Clin. Nutr. 1999;70 : 234–239.
43. Persad VL, Van den Hof MC, Dubé JM, et al. Incidence of open neural tube defects in Nova Scotia after folic acid fortification. CMAJ 2002;167(3): 241–245.
44. Elliott V. Folic acid in bread to cut birth defects. The Times 2006;April 5 : 1–3.
45. Giovanucci EL, Stampfer MJ, Colditz GA, et al. Multivitamin use, folate, and colon cancer in women in the nurses’ health study. Ann. Intern. Med. 1998;129 : 517–524.
46. Zhang S, Hunter DJ, Hankinson SE, et al. A prospective study of folate intake and the risk of breast cancer. JAMA 1999;281(17): 1632–1637.
Labels
Neonatology Paediatrics General practitioner for children and adolescentsArticle was published in
Czech-Slovak Pediatrics

2008 Issue 1
- What Effect Can Be Expected from Limosilactobacillus reuteri in Mucositis and Peri-Implantitis?
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Transcutaneous Bilirubinometry in Preterm Newborns
- Early Diagnostics of Asperger Syndrome and Specific Aspects
- Aspirated Foreign Bodies in Children
- Juvenile Myelomonocytic Leukemia Associated with Neurofibromatosis and Complicated by Hemophagocytic Syndrome
- Acute Renal Failure in Newborn Period – Initial Symptom of Inborn Error of Metabolism of Purines
- Neural Tube Defects – Current Opinion on Etiopathogenesis and Prevention Potencial of Folic Acid
- PROTEIN HYDROLYSATES IN PREVENTION AND THERAPY
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Aspirated Foreign Bodies in Children
- Early Diagnostics of Asperger Syndrome and Specific Aspects
- Neural Tube Defects – Current Opinion on Etiopathogenesis and Prevention Potencial of Folic Acid
- Transcutaneous Bilirubinometry in Preterm Newborns
