Diabetes mellitus vázaný na cystickou fibrózu: diagnostika a terapie
Cystic Fibrosis Related Diabetes Mellitus: Diagnostics and Therapy
Cystic fibrosis related diabetes (CFRD) is associated with higher morbidity and 6 times higher mortality. In females, it occurs 5 years earlier compared to males. After 18 years of age, prevalence of CFRD increases and ranges between 12 and 34%, after 30 years it affects 35–50% of all patients. Prospective studies demonstrated deterioration of nutritional status and pulmonary functions 2–4 years prior diabetes onset; therefore, an early recognition of CFRD is a prerequisite for a successful management of CF patients. Insulin therapy of CFRD may delay progression of pulmonary changes. Pulmonary functions do not deteriorate within 5 years after onset of insulin therapy, in parallel with improved nutritional status.
Screening of CFRD is based on oral glucose tolerance test (OGTT) after 10 years of age (golden standard). An additional intravenous glucose tolerance test (IVGTT) is provided in subjects with impaired glucose tolerance or diabetes mellitus to detect insulinopenia and to start individualised therapy. Regarding the prevalent finding of insulinopenia, an early insulin therapy is started as early as possible if necessary to prevent serious consequences of developing clinical diabetes on nutritional status and pulmonary functions.
Special nutritional team takes care of diabetic diet in CFRD. In these subjects, diet is based on different principles in comparison to other diabetes subtypes. The food energy content has to be substantially increased and carbohydrates only moderately regulated.
Any unexplained deterioration of nutritional status or pulmonary functions in CF patients should be suspected of CFRD.
Key words:
cystic fibrosis related diabetes, screening, therapy, insulin, OGTT, IVGTT
:
S. Koloušková; D. Zemková; Z. Šumník; M. Šnajderová; V. Skalická; J. Bartošová; J. Brázová
:
Pediatrická klinika UK 2. LF a FN Motol, Praha
přednosta prof. MUDr. J. Lebl, CSc.
:
Čes-slov Pediat 2008; 63 (2): 90-95.
Diabetes mellitus vázaný na cystickou fibrózu (cystic fibrosis related diabetes; CFRD) je spojen s vyšší morbiditou a 6krát vyšší mortalitou. U žen se objevuje v průměru o 5 let dříve v porovnání s muži. Po 18. roce věku výskyt CFRD stoupá a pohybuje se mezi 12–34 %, po 30. roce se vyskytuje u 35–50 % nemocných. Prospektivní studie prokázaly, že 2–4 roky před manifestací diabetes mellitus dochází ke zhoršování stavu výživy a funkce plic, proto včasná diagnostika CFRD je nezbytným předpokladem úspěšné léčby pacientů s CF. Inzulin může při CFRD zpomalit progresi plicních změn. Funkce plic 5 let po zahájení léčby inzulinem se nezhoršují a zároveň dochází ke zlepšení stavu výživy.
Screening CFRD se provádí pomocí orálního glukózového tolerančního testu (OGTT) po 10. roce věku (zlatý standard). U pacientů s porušenou glukózovou tolerancí nebo s diabetes mellitus bez hyperglykémie nalačno autoři doplňují intravenózní orální glukózový toleranční test (IVGTT), který včas detekuje inzulinopenii a umožní tak diferencovat léčbu. Vzhledem k častému nálezu inzulinopenie zahajují v indikovaných případech léčbu inzulinem co nejdříve, aby předešli neblahým následkům pozvolna se rozvíjejícího klinického diabetu na stav výživy a plicní funkce.
Dieta u pacientů s CFRD patří do rukou specializovaného nutričního týmu. U těchto pacientů nelze uplatňovat stejné zásady jako u jiného typu diabetu, naopak energetický příjem musí být podstatně vyšší, než je běžný pro vrstevníky. Sacharidy jsou omezovány pouze rámcově.
Na CFRD musíme myslet vždy, když u pacienta s CF dochází k nevysvětlitelnému zhoršování stavu výživy nebo k nevysvětlitelnému zhoršování funkce plic.
Klíčová slova:
diabetes mellitus vázaný na cystickou fibrózu (cystic fibrosis related diabetes), screening, léčba, inzulin, OGTT, IVGTT
Úvod
Cystická fibróza (CF) je závažné autozomálně recesivně dědičné onemocnění, které výrazně zkracuje délku života. Do roku 1957 byl medián přežití nemocných 5 let; v dalších desetiletích se vlivem nových léčebných strategií postupně prodlužoval a dnes dosahuje ve vyspělých zemích 32 let [10].
S prodlužováním střední délky života se však začínají objevovat i některé komplikace dříve neznámé nebo vzácné. První zmínky o výskytu diabetu u CF byly publikovány roku 1938 [5]. Asociace diabetu a CF se však potvrdila až mnohem později, v roce 1969 [12].
Diabetes mellitus nese u pacientů s CF rysy jak diabetu prvního typu – inzulinopenii, tak diabetu druhého typu. Také proto je používán specifický název cystic fibrosis related diabetes (CFRD).
CFRD je spojen s vyšší morbiditou a mortalitou. U pacientů s CFRD se zhoršuje stav výživy a progreduje postižení plic [18]. Mortalita je 6krát vyšší než u stejně starých pacientů s CF s normální glukózovou tolerancí [11]. U žen se objevuje diabetes v průměru o 5 let dříve v porovnání s muži.
Výskyt CFRD
Výskyt CFRD je uváděn v jednotlivých populacích ve velkém rozptylu. Údaje o prevalenci závisejí hlavně na úrovni péče o nemocné a na používaných metodách screeningu CFRD [7, 8, 22].
Výskyt CFRD ovlivňuje hlavně věk, pankreatická insuficience, četnost infekcí, terapie kortikoidy a pohlaví. Do 10 let věku se diabetes u nemocných s CF objevuje raritně, maximálně u 1 % pacientů. Naopak po 18. roce věku četnost CFRD stoupá k hodnotám 12–34 %, po 30. roce se objevuje porucha glukózové tolerance nebo CFRD téměř u 50 % nemocných.
Patofyziologie CFRD
Patofyziologie CFRD není dodnes jasná. Podle histologických preparátů je patrné, že v počátečních stadiích dochází k dilataci pankreatických duktů a k fibróze acinů. Postupně se pankreas fibroticky přestavuje, což vede k atrofii acinů. V důsledku toho zřejmě dochází k redukci počtu ostrůvků a tím ke snížení počtu funkčních beta buněk. Jiní autoři předpokládají, že fibrózní vazivo izoluje ostrůvky a zároveň jimi prorůstá. Může tedy jít spíše o izolaci než o redukci počtu ostrůvků [1, 23]. Důsledkem je v každém případě nedostatečné uvolňování inzulinu, postupný rozvoj porušené glukózové tolerance a následně CFRD. Kromě snížené sekrece inzulinu (inzulinopenie) je snížena i sekrece glukagonu a pankreatického polypeptidu [19]. Zároveň je však zvýšena sekrece somatostatinu – inhibitoru inzulinové sekrece, což ještě prohloubí inzulinopenii [24].
Dlouho diskutovanou otázkou je inzulinová rezistence. Výsledky studií jsou kontroverzní, nepochybně však závisejí na fázi nemoci, ve které pacienty vyšetřujeme. Studie potvrzují, že zpočátku je u CF pacientů senzitivita k inzulinu zvýšena oproti zdravé populaci [2, 6, 7, 31]. Později se začínají objevovat hyperglykémie, vedoucí k rozvoji periferní inzulinové rezistence, kterou dále potencují interkurentní infekty a často podávaná léčba kortikoidy [26]. Negativní vliv na glukózovou toleranci u pacientů s CF má i zvýšená hepatální inzulinová rezistence. K dalšímu zhoršování glycidového metabolismu přispívá zvýšená hepatální produkce glukózy a zvýšená clearance inzulinu, tzn. že nedostatečná produkce inzulinu je ještě potencována jeho rychlejším odbouráváním [14, 15].
Screening CFRD
O způsobu provádění screeningu CFRD dosud nebylo dosaženo konsensu [3, 21, 27]. Časté vyšetřování zatěžuje pacienta, ale zároveň je prokázáno, že pozdě diagnostikovaný CFRD negativně ovlivňuje životní prognózu pacientů. Pravidelný a efektivní screening glukózové tolerance, včasná diagnóza CFRD ještě před zhoršováním klinického stavu a funkcí plic a následná adekvátní léčba jsou nezbytné. V řadě případů může screening efektivně zlepšit životní prognózu CF pacientů.
Glykosylovaný hemoglobin je cenným ukazatelem kvality kompenzace již léčeného diabetu, nelze jej však použít ke screeningu CFRD [9].
Vyšetřování glykémie nalačno [4] či náhodné glykémie v průběhu dne je schopno detekovat pouze část pacientů s rozvíjejícím se CFRD, většinu pacientů však nezachytí. V našem souboru měla převaha pacientů glykémii nalačno v normálním pásmu, i když orální glukózový toleranční test (OGTT) již ukázal diabetickou křivku.
Na rozdíl od praxe ve Spojených státech považuje řada evropských autorů za zlatý standard diagnostiky CFRD vyšetření glukózové tolerance pomocí OGTT. Protože před 10. rokem je výskyt diabetu raritní (kolem 1 %), zahájit systematický screening CFRD se doporučuje až po dosažení tohoto věku. Stále se diskutuje o tom, zda je nutné vyšetřovat pacienty v dobrém klinickém stavu. V našem centru začínáme vzhledem k závažnosti CFRD vyšetřovat všechny pacienty starší 10 let.
OGTT může odhalit poruchu glukózové tolerance či diabetes mellitus, nepomáhá ale posoudit produkci inzulinu. Jednoznačně se prokázalo, že u CF pacientů se na rozvoji CFRD významně podílí inzulinopenie. Rutinní vyšetření sekrece inzulinu pomocí intravenózního glukózového tolerančního testu (IVGTT) se v rámci screeningu neprovádí, zatím jde pouze o výzkumnou metodu.
Doporučený algoritmus vyšetřování pacientů s CF znázorňuje obrázek 1.
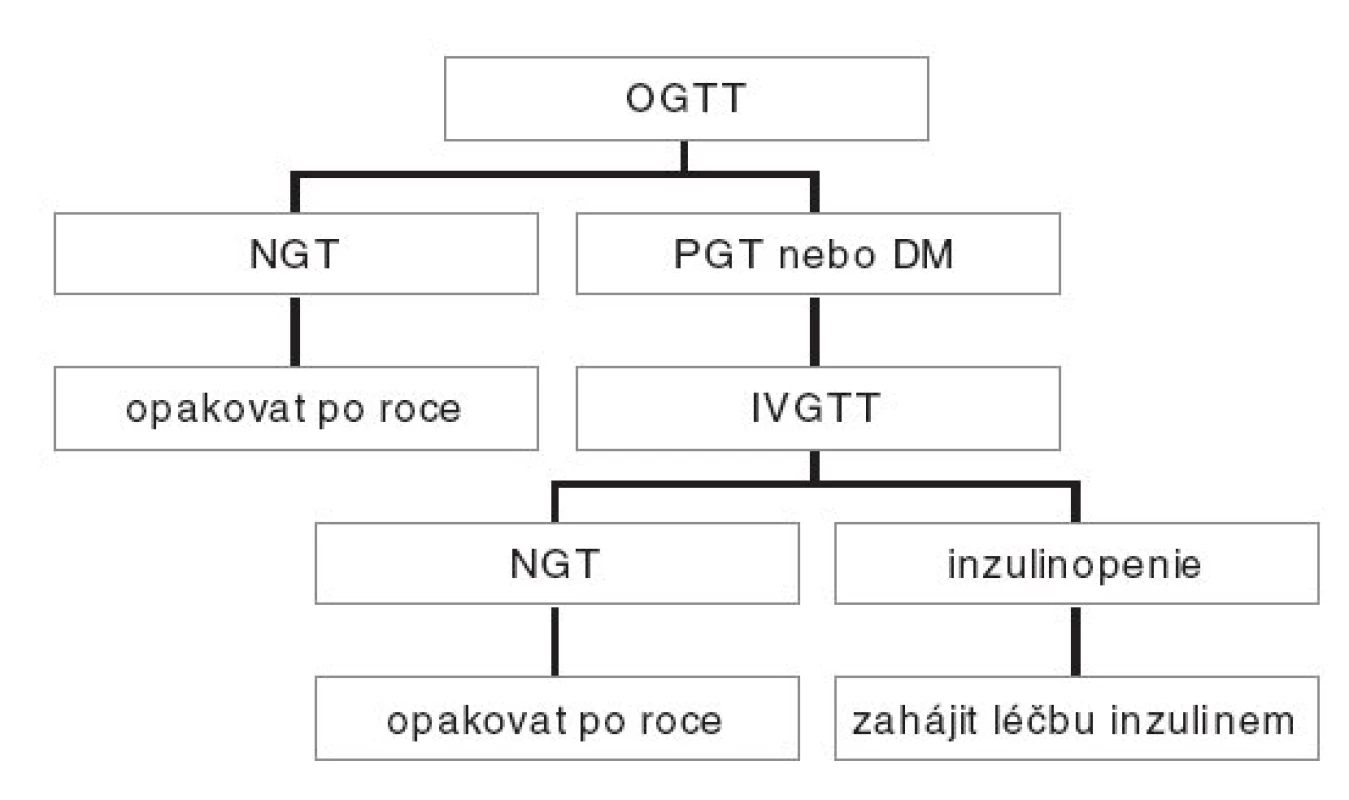
Vyšetřování glukózové tolerance u pacientů s CF
Včasná diagnostika CFRD je založena na laboratorních vyšetřeních, nikoliv na příznacích klinicky rozvinutého diabetu. Typická diabetická ketoacidóza u pacientů s CF je vzácná, protože kromě snížené inzulinové sekrece je snížena i sekrece glukagonu. Diabetes se u CF pacientů většinou manifestuje plíživě. Podezření na CFRD budí hlavně zhoršování stavu výživy i při intenzivní nutriční podpoře a při nevelkých zánětlivých komplikacích, zhoršující se růstová rychlost ještě před projevy tělesného strádání neodpovídající věku a stupni puberty, výrazně opožděná puberta. Velmi záhy, současně s diskrétními projevy tělesného strádání, navazuje nevysvětlitelné zhoršování funkce plic, a to 2–4 roky před manifestací diabetu [27] (tab. 1).

Při těchto klinických příznacích je vždy nutné pátrat cíleně po možné poruše glukózové tolerance. Je-li porušená glukózová tolerance zjištěna, je potřebné pomocí IVGTT ozřejmit vliv inzulinopenie na výše uvedené klinické projevy. Naše pozorování potvrdilo skutečnost, že i pacienti s porušenou glukózovou tolerancí při OGTT mohou mít výraznou inzulinopenii [16]. V našem souboru 144 CF pacientů starších 10 let má 59 % normální glukózovou toleranci. U 28 % jsme zjistili porušenou glukózovou toleranci (PGT), z toho 25 % pacientů má při PGT již výraznou inzulinopenii, tzn. že pouze 3 % pacientů s PGT mají ještě normální produkci inzulinu. CFRD má 13 % pacientů, z toho 5 % má CFRD s hyperglykémií nalačno [16] (graf 1).

Výše uvedené důvody vedly na řadě pracovišť k rozhodnutí pravidelně vyšetřovat glukózovou toleranci u dětí s CF od 10. roku věku, ideálně pomocí OGTT.
Laboratorní kritéria pro diagnostiku CFRD
Z laboratorních kritérií se pro diagnostiku CFRD používá buď glykémie nalačno, nebo glykémie zachycená ve 120. minutě OGTT.
CFRD potvrzuje glykémie nalačno nad 7 mmol/l zjištěná opakovaně, případně glykémie nad 11,1 mmol/l z náhodného odběru v průběhu dne, stejně jako glykémie nad 11,1 mmol/l ve 120. minutě OGTT. K významně ohroženým pacientům patří i ti, u kterých byla zachycena porušená glukózová tolerance, tj. glykémie ve 120. minutě OGTT mezi 7,8–11,1 mmol/l (tab. 2).

Podle výsledku OGTT dělíme pacienty s CF do 4 skupin:
- normální glukózová tolerance
- porušená glukózová tolerance
- diabetes mellitus bez hyperglykémie nalačno
- diabetes mellitus s hyperglykémií nalačno (tab. 3).

Monitorování glykémií
I když pro počáteční stadia CFRD jsou typické vcelku stabilní glykémie, je nutné vybavit pacienty s PGT a prokázanou inzulinopenií či CFRD bez lačné hyperglykémie glukometrem k včasnému záchytu postprandiálních hyperglykémií.
Postačuje monitorovat glykémie jednou za 7–10 dní, a to vždy před jídlem a za 1 hodinu po jídle. Jakmile se začnou objevovat postprandiální hyperglykémie, později i hyperglykémie nalačno, pak se monitorování glykémií významněji neliší od monitorování pacientů s klasickým diabetes mellitus 1. typu, tak jak to známe u našich diabetických dětí.
Principy terapie CFRD
Léčbu CFRD volíme podle typu a závažnosti poruchy. Efektivně vedená léčba má za úkol stabilizovat či zlepšit funkce plic, udržet či zlepšit stav výživy a umožnit fyziologický růst a rozvoj puberty.
Během léčby je proto nezbytné udržet glykémie blízko fyziologických hodnot nejenom preprandiálně, ale i postprandiálně. Léčba musí být dostatečně flexibilní a pro pacienta na dané období co možná nejjednodušší proto, aby mu umožnila běžný život bez zbytečných omezení.
Terapie perorálními antidiabetiky
Některá pracoviště se pokoušejí využít u pacientů s diabetem bez hyperglykémie nalačno léčbu perorálními antidiabetiky ve snaze ovlivnit zejména inzulinovou rezistenci. Efekt je však pouze přechodný, přechod na terapii inzulinem je u většiny pacientů pouze otázkou krátké doby.
Terapie inzulinem
Inzulin patří k anabolickým hormonům. Působí nejen na metabolismus glukózy, ale ovlivňuje i metabolismus tuků a bílkovin. Nedostatečná inzulinová sekrece, inzulinová rezistence a zvýšená clearance inzulinu přispívají ke katabolismu proteinů [13, 15, 27]. Proto jsou CF pacienti s CFRD výrazně ohroženi chronickým proteinovým katabolismem. Dlouhodobý proteinový katabolismus přispívá ke zhoršování stavu výživy a pravděpodobně následně i ke zhoršení funkce plic. Je tedy zřejmé, že inzulinopenie je daleko významnějším faktorem, než se původně myslelo. Prospektivní studie prokázaly, že 2–4 roky před manifestací CFRD dochází právě ke zhoršování výše uvedených parametrů.
Naopak při včas zahájené léčbě inzulinem se během 1–2 let může zpomalit progrese plicních změn, zároveň dochází ke zlepšení stavu výživy [17, 20, 25, 28] a proteinový katabolismus je odvrácen.
Reisman a spolupracovníci [29] zjistili, že funkce plic 5 let po zahájení léčby inzulinem se nezhoršují, na rozdíl od kontrolní skupiny, kde dochází k postupnému zhoršování funkce plic. Otevírá se tedy otázka, jaká jsou optimální kritéria pro zahájení léčby inzulinem.
Léčba inzulinem u CFRD je vysoce individuální, závisí na stadiu onemocnění. Zpočátku lze s výhodou využít buď intermediární NPH inzulin (Humulin N nebo Insulatard HM) v jedné ranní injekci, později při postprandiálních hyperglykémiích využíváme směsi inzulinu – nejčastěji Mixtard 30/70 jednou či dvakrát denně (ráno a večer). U plně rozvinutého CFRD se léčba neliší od klasického diabetes mellitus 1. typu, využívají se vícečetné injekce inzulinu. Vzhledem k tomu, že energetický příjem u pacientů s CF musí být vyšší než u jejich vrstevníků, s výhodnou lze rovněž využít inzulinové pumpy pro větší flexibilitu a možnost většího množství jídla při svačinách či druhých večeřích.
Dieta u CFRD
Dieta u pacientů s CFRD patří do rukou specializovaného nutričního týmu, nikoliv pouze do rukou běžného diabetologa.
Pacientům s CFRD nikdy neomezujeme sacharidy a energetický příjem tak, jak je to obvyklé při léčbě jiného typu diabetu. Doporučený energetický příjem je v průměru 120–150 % obvyklého denního množství ve vztahu k věku. V některých případech volíme na přechodnou dobu až 200 % obvyklé dodávky energie. Dieta u CFRD musí být bohatá na tuky i bílkoviny. Vzhledem k problémům s resorpcí tuků doporučujeme zvýšit přísun tuků na 40 % celkového množství energie. Nedoporučujeme restrikci žádného typu tuků, je tedy dovolena konzumace i nasycených tuků. Bílkoviny ve stravě neomezujeme, renální selhání u CFRD jako projev komplikace diabetu je vzhledem k době trvání CFRD jen ojedinělé.
Samostatnou kapitolu tvoří sacharidy. Na rozdíl od tuků a bílkovin pacienti s CF velmi dobře vstřebávají sacharidy. Ty tvoří důležitou složku energetického příjmu. Doporučované množství sacharidů, které je vhodné pro ostatní diabetické pacienty, je u pacientů s CFRD absolutně nedostatečné. Nasazení takové diety by naopak vedlo ke ztrátě hmotnosti a k následnému celkovému zhoršení klinického stavu.
Doporučujeme proto během dne opakovaný a dostatečný příjem sacharidů. U počátečních stadií diabetu dokonce vůbec neomezujeme například menší množství sacharózy nebo fruktózy opakovaně několikrát během dne. Doporučujeme je konzumovat spolu s tuky, které zpomalují resorpci sacharidů a tím je vzestup glykémie menší (čokolády, používání šlehačky apod.). Jediné omezení je u sladkých nápojů, které zásadně nedoporučujeme.
Na rozdíl od ostatních diabetických nemocných je vyšší podíl vlákniny ve stravě při CFRD nežádoucí. Vláknina budí pocit přesycenosti a tím dochází ke snížení energetického příjmu. Výsledkem mohou být také poruchy trávení a úbytek hmotnosti [27] (tab. 4).

Závěr
Včasná diagnostika a léčba diabetes mellitus vázaného na cystickou fibrózu patří do rukou specializovaného týmu, který je seznámen se specifiky tohoto onemocnění. Strategie léčby a doporučovaná dieta se odlišuje od pacientů s diabetem jiné etiologie. Neomezujeme energetický příjem ani příjem tuků. Konzumace sacharidů je omezena pouze rámcově a významně se liší od běžných doporučení pro jiné typy diabetu.
Pouze týmová spolupráce může vést k úspěšné léčbě CFRD a tím zlepšit životní prognózu našich CF pacientů.
Problematika je řešena s podporou VZ FN Motol 64203.
MUDr. Stanislava Koloušková, CSc.
Pediatrická klinika UK 2. LF
Fakultní nemocnice Motol
V Úvalu 84
150 06 Praha 5
e-mail: stanislava.kolouskova@lfmotol.cuni.cz
Sources
1. Abdul-Karim FW, Dahms BB, Velasca ME, et al. Islet of Langerhans in adolescents and adults with cystic fibrosis. Arch. Pathol. Lab. Med. 1986;110 : 602–606.
2. Ahmad T, Melson R, Taylor R. Insulin sensitivity and metabolic clearance rate of insulin in cystic fibrosis. Metabolism 1994;43 : 163–167.
3. Allen HF, Gay EC, Klingensmith GJ, Hamman RF. Identification and treatment of cystic fibrosis-related diabetes. Current Opinion in Endocrinology, Diabetes and Obesity1998;21 : 943–948.
4. American Diabetes Association Clinical Practice Recommendations. Diabetes Care 1998; S1.
5. Andersen DH. Cystic fibrosis in the pancreas and its relationship to celiac disease. Am. J. Dis. Child. 1938;56 : 344–399.
6. Cucinotta D, Nibali SC, Attigo T, et al. Beta cell function, peripheral sensitivity to insulin and islet cell autoimmunity in cystic fibrosis patients with normal glucose tolerance. Horm. Res. 1990; 34 : 33–38.
7. Cuccinotta D, De Luca F, Scoglio R, et al. Factor affecting diabetes mellitus onset in cystic fibrosis: evidence from a 10-yaers follow-up study. Acta Pediatr. 1999;88 : 389–393.
8. Cystic Fibrosis Foundation Patient Registry 1997. Annual data report. Bethesda, MD: Cystic Fibrosis Foundation, 1998.
9. Schepper J, Dab I, Derde MP, Loeb H. Oral glucose tolerance testing in cystic fibrosis: Correlations with clinical parameters and glycosylated haemoglobin determinations. Eur. J. Pediatr. 1991;150 : 403–406.
10. Doershuk CF (ed). Cystic Fibrosis in the 20th Century. People, Events and Progress. Cleveland, Ohio: AM Publishing Ltd., 2001, XII.
11. Finkelstein SM, Wielinski CL, Elliot GR, et al. Diabetes mellitus associated with cystic fibrosis. J. Pediatr. 1988;112 : 373–377.
12. Handwerger S, Roth J, Gorden P, et al. Glucose intolerance in cystic fibrosis. N. Engl. J. Med. 1969;281 : 451–461.
13. Hardin DS, LeBlanc A, Lukenbaugh S, et al. Proteolysis associated with insulin resistance in cystic fibrosis. Pediatrics 1998;101 : 433–437.
14. Hardin DS, LeBlanc A, Para L, Seilheimer DK. Hepatic insulin resistance and defects in substrate utilization in cystic fibrosis. Diabetes 1999;49 : 1082–1087.
15. Hardin DS, LeBlanc A, Marschall G, Seilheimer DK. Mechanism of insulin resistance in cystic fibrosis. Am. J. Physiol. Endocrinol. Metab. 2001;281 : 1022–1028.
16. Koloušková S, Zemková D, Bartošová J, Šumník Z, Vávrová V. Vývoj porušené glukózové tolerance a diabetu u pacientů s cystickou fibrózou. Čes.-slov. Pediat. 2003;58 : 270–273.
17. Koloušková S, Zemková D, Bartošová J, Šumník Z, Vávrová V. Early insulin treatment in insulinopenic CF patients improves body composition and stabilizes pulmonary function. J. Cystic Fibrosis 2003;2: S78.
18. Lanng S, Thorsteinsson B, Nerup J. Koch C. Influence of the development of diabetes mellitus on clinical status in patients with cystic fibrosis. Eur. J. Pediatr. 1992;151 : 684–697.
19. Lanng S, Thorsteinsson B, Roder ME, et al. Pancreas and gut hormone responses to oral glucose and intravenous glucagon in cystic patients with normal, impaired and diabetic glucose tolerance. Acta Endocrinol. 1993;128 : 207–214.
20. Lanng S, Thorsteinsson B, Nerup J, Koch C. Diabetes mellitus in cystic fibrosis: effect of insulin therapy on lung function and infections. Acta Pediatr.1994;83 : 849–853.
21. Lanng S, Hahnsen A, Thorsteinsson B, Nerup J, Koch C. Glucose tolerance in patients with cystic fibrosis: five year prospective study. Brit. Med. J. 1995;311 : 655–659.
22. Lanng S, Thorsteinnson B, Nerup J, et al. Diabetes mellitus in cystic fibrosis: a ten-year prospective study. Diabetologia 2000;43 : 107A.
23. Lohr M, Goerchen P, Nizze H, et al. CF associated islet changes may provide a basis for diabetes: a immunocytological and morphometrical study. Virchows Ach. f. pathol. Anat. u. Physiol. 1989;414 : 179–185.
24. Meacham LR, McKean LP, Buchanan CN, et al. Selective preservation of somatostatin secretion in CF patients with diabetes. Pediatr. Pulmonol. 1991;Suppl 6 : 333A.
25. Milla CE, Warwick WJ, Moran A. Trends in pulmonary function in patients with cystic fibrosis correlate with the degree of glucose intolerance at base. Am. J. Respir. Crit. Care Med. 2000;162 : 891–895
26. Moran A, Doherty L, Wang X, et al. Abnormal glucose metabolism in cystic fibrosis. J. Pediatr. 1998;133 : 10–17.
27. Moran A, Hardin D, Rodman D, et al. Diagnosis, screening and management of cystic fibrosis related diabetes mellitus. A consensus conference report. Diabetes Research and Clinical Practice 1999;45 : 61–73.
28. Nousia-Arvanitakis S, Galli-Tsinopoulou A, Karamouzis M. Insulin improves clinical status of patients with cystic fibrosis related diabetes mellitus. Acta Pediatr. 2001;90 : 515–519.
29. Reisman J, Corey M, Canny G, Levison H. Diabetes mellitus in patients with cystic fibrosis effect on survival. Pediatrics 1990;86 : 374–377.
30. Report of the Expert Committee on the Diagnosis and Classification of Diabetes Mellitus. Diabetes Care 1997;20 : 1183–1197.
31. Wilmhurst EG, Soeldner JS, Holsclaw DS, et al. Endogenous and exogenous insulin response in patients with cystic fibrosis. Pediatrics 1975;55 : 75–82.
Labels
Neonatology Paediatrics General practitioner for children and adolescentsArticle was published in
Czech-Slovak Pediatrics

2008 Issue 2
- What Effect Can Be Expected from Limosilactobacillus reuteri in Mucositis and Peri-Implantitis?
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Associate Professor Věra Vávrová and History of Cystic Fibrosis
- Current Diagnostic Strategies and Overview of Preimplantation, Prenatal and Postnatal DNA Diagnostics of Cystic Fibrosis in the Czech Republic
- Modern Management of Cystic Fibrosis and Its Influence upon General Health and Survival of Czech Patients
- Role of Novel Microbiological Diagnostics in the Care for Patients with Cystic Fibrosis
- Cystic Fibrosis Related Diabetes Mellitus: Diagnostics and Therapy
- Newborn Screening in the Czech Republic and in Europe
- Present International Projects in the Area of Diagnostics and Therapy of Cystic Fibrosis: Participation of Specialists from the Czech Republic into the Problem Solving
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Newborn Screening in the Czech Republic and in Europe
- Current Diagnostic Strategies and Overview of Preimplantation, Prenatal and Postnatal DNA Diagnostics of Cystic Fibrosis in the Czech Republic
- Associate Professor Věra Vávrová and History of Cystic Fibrosis
- Cystic Fibrosis Related Diabetes Mellitus: Diagnostics and Therapy
