Tromboembolické příhody u dívek a mladých žen užívajících hormonální antikoncepci
Thromboembolic Events in Girls and Young Women Taking Hormonal Contraception
The authors describe their 15 years of experience in the changes of total cholesterol levels in plasma of girls with familial hypercholesterolemia (FH) during menarche. In half of them, regardless of the findings of LDL-receptors mutations, cholesterol level decreases to normal values and does not require medication. Moreover, the authors describe the negative effect of combined hormonal contraception on cholesterolemia during medication treatment, since combined hormonal contraception increases cholesterol level by 1.5–2.5 nmol/l in almost half of the girls, whereas the effects of the levels of HDL cholesterol and triacylglycerols are not so significant.
The authors selected fatal or life-threatening case reports of pulmonary embolism, thromboembolism, brain events, thromboses and phlebothromboses, which occurred in connection with the findings of hereditary thromboembolic mutations (Leiden mutation FV, Prothrombin II, MTHFR), combined with hyperhomocysteinemia, deficit of holotranscobalamin, high Lp(a) and other external risk factors from the group of patients (adolescent girls and young women up to 30 years of age) who attended the lipid outpatient over the last 5 years. All of these patients took combined hormonal contraception for a short or long period of time without being sufficiently advised or examined by the physician.
In conclusion, the authors strongly require a carefully taken anamnesis and at least basic laboratory examination of APCR before combined hormonal contraception medication. Moreover, they draw attention to astounding lack of knowledge of possible unfavorable consequences of combined hormonal contraception in the adolescent girls themselves and, especially, in their mothers, influenced by positive advertisements only.
The bad experience of the authors indicates that the diagnosis if FH is not taken into account when the combined hormonal contraception is indicated; in the selected sad case reports, thrombophilic anamnesis has never been examined in the family and the physicians have not offered sufficient information about the unfavorable effects of combined hormonal contraception, nor were absolute or relative contraindications considered there.
Key words:
familial hypercholesterolemia – therapy, menarche, hyperhomocysteinemia, combined hormonal contraception – complications, thromboembolism, thromboembolic disease, cerebrovascular accident, thrombosis, phlebothrombosis in adolescent girls
Authors:
J. Hyánek; V. Maťoška; L. Dubská; H. Pejznochová; S. Vaingátová; F. Pehal; V. Martiníková; J. Privarová
Authors‘ workplace:
Lipidová ambulance a Oddělení klinické biochemie, hematologie a imunologie, Nemocnice na Homolce, Praha
prim. MUDr. L. Táborský
Published in:
Čes-slov Pediat 2010; 65 (6): 369-383.
Category:
Original Papers
Overview
Autoři popisují své 15leté zkušenosti se změnami hladin celkového cholesterolu v plazmě u dívek s familiární hypercholesterolémií (FH) v průběhu menarché. U poloviny z nich, bez ohledu na nález mutací LDL-receptorů, se hladina cholesterolu snižuje k normálním hodnotám a nevyžaduje medikamentózní léčbu. Dále popisují negativní vliv podání kombinované hormonální antikoncepce (KHA) na cholesterolémii během medikamentózní léčby, protože KHA hladinu cholesterolémie téměř u poloviny dívek zvyšuje o 1,5–2,5 mmol/l, zatímco ovlivnění hladin HDL cholesterolu a triacylglycerolů už není tak významné.
Ze souboru pacientek (adolescentky a mladé ženy do 30 let), které navštívily lipidovou ambulanci za posledních 5 let, pak autoři vybrali kazuistiky smrtelných nebo život ohrožujících plicních embolií, tromboembolií, mozkových příhod, trombóz a flebotrombóz, které se vyskytly ve spojitosti s nálezem dědičných tromboembolických mutací (Leidenská mutace FV, protrombin II, MTHFR), kombinovaných s hyperhomocysteinemií, deficitem holotranskobalaminu, vysokým Lp(a) a dalších zevních rizikových faktorů. Všechny tyto pacientky krátkodobě nebo dlouhodobě užívaly KHA, před jejímž nasazením nebyly lékařem dostatečně poučeny ani vyšetřeny.
V závěru autoři důrazně požadují před nasazením KHA respektovat pečlivě odebranou anamnézu a alespoň základní laboratorní vyšetření APCR. Dále konstatují zarážející neznalost o možných nepříznivých účincích KHA, a to jak u samotných adolescentek, tak především u jejich matek – jen pozitivní reklamou ovlivněných. Podle dosud špatných zkušeností autorů při indikaci KHA není diagnóza FH vůbec respektována; u vybraných smutných kazuistik nebyla vyšetřena trombofilická anamnéza v rodině, nebyla poskytnuta dostatečná informace lékařem o nežádoucích účincích KHA, ani nebyly respektovány absolutní či relativní kontraindikace.
Klíčová slova:
familiární hypercholesterolémie – léčba, menarché, hyperhomocysteinemie, kombinovaná hormonální antikoncepce – komplikace, tromboembolie, tromboembolická nemoc, plicní embolie, mozková příhoda, trombóza, flebotrombóza u adolescentek
Úvod
Během rutinní práce v lipidové ambulanci jsme mohli registrovat specifické případy kumulace dědičných genetických faktorů, špatného životního stylu a nepříznivého vlivu environmentálních faktorů v populaci adolescentek často s vysokým kardiovaskulárním rizikem. Sledovali jsme pomocí dostupných vyšetření tyto nejčastější rizikové faktory a můžeme tak prezentovat klinickou studii, která je současně upozorněním na závažné nedostatky ve zdravotní péči o adolescentky.
Povinný selektivní screening na poruchy metabolismu tuků v ČR u dětí a adolescentů prováděný pečlivými pediatry od roku 1994 (novelizace 1997) [1] dovolil detekovat za posledních 15 let nejenom všechny dosud známé lipidové poruchy i u dětí a adolescentů, ale také odhalit celou řadu zajímavých kazuistik u adolescentních pacientek z naší lipidové ambulance. Tyto nepříjemné a varující kazuistiky za posledních 5 let nás nutí k jejich prezentaci a varování širší odborné veřejnosti.
Estrogenní vlivy na hladiny lipidů
Bylo opakovaně prokázáno, že aterosklerotické změny vyvolané zvýšeným cholesterolem jsou více akcentovány u mužů, u nichž je stupeň postižení odlišný než u žen. Menší vnímavost žen v reprodukčním věku k ischemické chorobě je vysvětlována ochranným účinkem estrogenů [2]. Každým rokem, o který se menopauza oddálí, se snižuje mortalita žen na kardiovaskulární onemocnění (KVO) o 2 %. Dalším dokladem jsou u mužů výraznější změny nalézané u postižení koronárních tepen než aorty, zatímco u žen je naopak postižení koronárních tepen menší než aorty [3, 4, 5].
Androgeny, především testosteron, zvyšují celkový cholesterol (CCh) a tedy i LDL-cholesterol (LDL-Ch) a snižují HDL-Ch, zatímco estrogeny svým indukčním účinkem na zvyšování počtu LDL-receptorů v játrech hladinu CCh snižují a v pokusech na zvířeti odstraňují endoteliální dysfunkce vyvolané toxickou dávkou homocysteinu [6]; dále estrogeny zvyšují HDL tlumením účinku endoteliální lipázy, ale současně zvyšují dosud neznámým způsobem hladiny triacylglycerolů (TAG). Ostatní změny lipidového spektra jsou nevýrazné [3]. Na cévní stěnu estrogeny také účinkují tím, že inhibují buněčnou proliferaci, snižují ve stěně kumulaci cholesterolu, podporují syntézu vazodilatačních molekul jako NO, prostacyklinu, cAMP a inhibují syntézu vazokonstrikčních metabolitů (endotelin, angiotenzin II, renin, angiotenzin-konvertující enzym, katecholaminy). Dále inhibují mitogeny navozenou proliferaci hladkých svalů cévní stěny, srdečních fibroblastů a glomerulárních mezangiálních buněk [2]. Významný je účinek vazodilatační a antioxidační. Glukokortikoidy v léčebném podání také vyvolávají dyslipidemické změny u 10–50 % pacientů. Menopauza se zvýšenou tvorbou FSH i LH je naopak provázena zvýšeným CCh a poklesem HDL a také vzestupem TAG.
Tyto změny nastupují už několik let před začátkem samotné menopauzy a s věkem se zvýrazňují. Na ateroskleroticky změněné cévy u starších pacientek však působí estrogeny nepříznivě především stimulujícím účinkem na metaloproteinázy, jejichž vlivem se destabilizuje sklerotický plát s možností jeho ruptury, estrogeny zvyšují prokoagulační účinek koagulačních faktorů, především FVII a fibrinogenu, dále se podílejí na zvýšení CRP, amyloidu A a interleukinu 6, čímž nutně vyvolávají zvýšení rizika trombóz. Jejich účinkem se mění složení LDL cholesterolových frakcí ve smyslu přibývání malých denzních LDL-Ch částic, které jsou výrazem stoupajícího rizika KVO [ 4]. Poklesu estradiolu v menopauze se přičítá významné snížení antioxidační aktivity [7]. Všechny změny vyvolané estrogeny jsou však závislé na genotypu nositelky (polymorfismu genů pro LDL-R, apolipoproteinových frakcí, především apo(a), apo E4, polymorfismu pro myeloperoxidázy aj.). Dále závisí na věku nositelky těchto genů, aby se mohly pozitivně nebo už negativně manifestovat. Transdermální podání estrogenů obchází jejich metabolismus v játrech a nedochází např. ke zvýšení prokoagulačních a zánětlivých faktorů – proto se tento způsob podávání považuje za výhodnější [8].
Kombinovaná hormonální antikoncepce (KHA)
Hormonální antikonceptiva užívaná od 60. let minulého století mají za cíl tlumit thalamo-hypofýzo-ovariální aktivitu, aby nestimulovala vaječníky k ovulaci a tím zabránit otěhotnění – hormonální antikoncepce (HAK). „Moje tělo ovládané hormony si myslí, že jsem těhotná.“ Užívá se kombinace estrogenů a progestagenů s cílem zabránit jen ovulaci bez interakce na další tělesné funkce ženy s efektivitou až 98 %. Klinické využití je nejvíce efektivní u endometriózy, dysmenorhey, poruch menstruačního cyklu a syndromu polycystických ovarií [8, 9]. Existuje několik druhů HAK, u mladistvých a nulipar se preferuje shora uvedená kombinace v perorálním či transdermálním podání, se kterými se v naší ambulanci nejčastěji setkáváme; proto v dalším pojednání se omezujeme jenom na KHA.
Dlouhá řada dosud provedených studií o hormonální antikoncepci nedokázala však stále spolehlivě vysvětlit všechny vedlejší interakce a mechanismy, které KHA vyvolává. Proto má celou řadu kontraindikací, z nichž podle doporučení SZO mezi ty absolutní – nejzávažnější – patří tromboembolické příhody v rodinné anamnéze uživatelky, tj. hluboká žilní trombóza (HŽT), plicní embolie (PE), tromboembolie (TE), cévní mozková příhoda (CMP), infakrt myokardu (IM). Mezi další kontraindikace patří epilepsie, migréna, jaterní selhání a další KVO, diabetes mellitus a hypertenze [WHO]. Před podáním KHA se dále doporučuje omezit kouření, zkontrolovat krevní srážlivost, krevní tlak a vyšetřit lipidové spektrum [10, 11, 12].
Ačkoliv doporučení SZO snižující riziko KHA jsou už téměř 10 let známá, denní praxe z naší lipidové ambulance, kam přichází rizikové adolescentky i starší pacientky s KHA, nás opakovaně přesvědčují, že se při její indikaci tak neděje. Tyto pacientky nebyly před podáním KHA ani anamnesticky konzultovány, ani laboratorně dostatečně vyšetřeny. Musíme si přiznat, že naše znalosti o vlivu pohlavních hormonů a jejich derivátů obsažených v KHA jak na etiologii aterosklerózy, tak na začátek koagulační kaskády jsou stále nedostatečné, představují spíše „Pandořinu skříňku“ a pro indikující lékaře zůstávají zřejmě příliš složité! Exponenciální nárůst tromboembolických komplikací v posledním desetiletí je toho dokladem [10, 13, 14, 15, 16].
Fyziologické a patofyziologické účinky KHA precizně popsali Fait, Fanta [8, 9, 12], v jejichž pracích zájemce najde všechno potřebné. Jen pro základní informaci je třeba sdělit, že dosud existují 3 generace vyráběných KHA. Prvá generace z 60. let obsahovala 50 µg estrogenu ve formě ethinyl estradiolu a 50 µg progesterolu. Pro vysoký výskyt PE, IM i CMP byla dávka estrogenu u 2. generace snížena na 30 µg a byly použity novější progestogeny (levonorgestrel nebo norethindron) a incidence IM se snížila. Ve 3. generaci je obsah estrogenů ještě nižší a byly použity novější progestogeny s nižším androgenním účinkem. Další očekávané snížení vedlejších účinků se však nevyplnilo, jen se snížil výskyt IM [16]; výsledky rozsáhlých studií jsou stále rozporné [17, 18, 19, 20] a komise odborníků při SZO zřejmě pod tlakem výrobců musela velice opatrně a filosoficky formulovat „problematické nižší“ riziko 3. generace před generací druhou, ale jednomyslně se pouze shodli, že se KHA nesmí podávat ženám s trombotickou anamnézou v rodině [10, 14].
Dědičné tromboembolické mutace (DTEM)
DTEM jsou známy více než 20 let, ale jejich hrozivá manifestace vyvstává až v posledním desetiletí, kdy miliony žen užívajících denně KHA už poskytly aktuální studijní materiál, na kterém se ověřil jak počet a incidence hemokoagulačních poruch bez používání HAK, tak jejich indukce v prvém a dalším roce užívání HAK. Dříve se soudilo, že jsou jen velice vzácné (1 na 0,5–1 milion) nebo jen v neobvyklých dědičných, lékových či jiných metabolických interakcích. Akcentace jejich výskytu vydatným kouřením, obezitou a špatným životním stylem („Western Living Style“) je obecně uznávaná [8, 13, 14].
Podrobnou fyziologii a patologii o DTEM najdeme v recentních hematologických a genetických učebnicích [22, 23]. Zde zjednodušujeme a komentujeme pro snazší pochopení kazuistik jen to nejdůležitější. Výskyt DTEM ve zdravé bělošské populaci se významně liší podle toho, zda pacientky prodělaly už nějakou tromboembolickou příhodu nebo nikoliv. Např. deficit proteinu S, proteinu C a antitrombinu III nedosahuje ve zdravé populaci ani 1 %, zatímco u pacientek, které trombózu absolvovaly, dosahuje už 3 % nebo 7 %. Nejčastější ze všech DTEM je však tzv. Leidenská mutace koagulačního faktoru V (G1691A) (LMFV). Je to bodová mutace v genu kódujícím koagulační faktor V, při které se pro záměnu argininu za glutamin tento stane rezistentní k účinku aktivovaného proteinu C (APC rezistence – APCR); molekula faktoru V se nerozštěpí a tím se nesnižuje množství generovaného trombinu. Ve zdravé populaci se vyskytuje jen ve 3–7 %, ale u pacientek po prodělané trombóze je LMFV nalézána už ve 25 % (při opakované trombóze dokonce v 50 %!). Riziko výskytu tromboembolie pro heterozygotku je 5–10krát vyšší než pro zdravou ženu bez KHA, zatímco pro homozygotku riziko exponenciálně narůstá až na 80násobek. Výskyt homozygotů v naší populaci je 1 : 5000, což dokazuje nejvyšší výskyt právě v evropské populaci; v asijské a africké populaci je výskyt mnohem nižší [23]. Nebezpečná je však interakce vnějších vlivů s touto anomálií, především hyperhomocysteinemie, KHA, antifosfolipidové protilátky, deficit kritických vitaminů, léková interakce aj., které několikanásobně zvyšují riziko trombofilie (až na 35násobek) [22, 24, 25, 26]. Stejný exponenciální nárůst rizika vzniká i při kombinaci s jinými přítomnými DTEM.
U genové mutace pro bílkovinu protrombinu II (G2021A) má její přítomnost za následek zhoršení koagulace pro vyšší koncentraci inaktivní molekuly protrombinu a tím častější trombózy – vyskytuje se u 10 % postižených s žilní trombózou. Zvýšené hladiny koagulačního faktoru VIII jsou rovněž příčinou zvýšeného výskytu HŽT, zatím bez známého mechanismu vysvětlení účinku. Mutace genové v trombolytickém systému, jako např. polymorfismus genu PAI-1 4G/4G, jsou další v pořadí výskytu DTEM s častým nálezem flebitid nebo HŽT. Deficit nebo dysfunkce Hagemanova faktoru XII se v koagulaci příliš neuplatňuje, ten je spíše významný pro aktivaci fibrinolýzy pomocí kalikreinu – jeho nedostatek vede k potlačení fibrinolýzy; manifestuje se pouze u 8 % nositelů. Deficity proteinu C (PC), proteinu S (PS) jsou vzácné, ovšem, spolu s deficitem AT III, patří mezi nejsilnější trombofilní rizika. Deficity PC a PS jsou pouze v heterozygotní formě, homozygotní formy jsou letální nebo vedou k obrazu novorozenecké purpury fulminans. Dysfibrinogenemie z dědičného polymorfismu pro gen fibrinogenu vede vlivem mutací také k trombofilii nejčastěji poruchou vazby deficitního fibrinu na trombin nebo neschopností stimulovat t-PA a tím i fibrinolýzu.
Polymorfismus enzymového systému methylentetrahydrofolát reduktazy (MTHFR) C677T a A1298C je v naší evropské populaci dosti častý s výskytem v 10–12 %. Homozygotky (677 T>T) jsou více než heterozygotky (C>T) znevýhodněny proti zdravým nízkou hladinou aktivního 5-methyltetrahydrofolátu. Ta je pak důvodem zvýšení hladiny toxického homocysteinu v krvi, který při vysokých koncentracích (>30 µmol/l) už tromboembolické pochody výrazně akcentuje [28, 29].
O DTEM se hovoří častěji v posledních 10 letech díky rutinní dostupnosti jejich laboratorního stanovení metodikou PCR v molekulárně genetických laboratořích i proto, že představují téměř 90 % všech nejčastěji nacházených tromboembolických komplikací po aplikaci KHA u mladých žen [20, 23, 30].
Získané tromboembolické dispozice
Získané tromboembolické dispozice jsou pro svou metabolickou složitost v diferenciální diagnostice tromboembolií velmi důležité především proto, že jsou často opomíjeny a přitom celá řada metabolických závislostí není dostatečně známa. Z těch dostatečně vysvětlených sem patří především:
A.
Antifosfolipidový syndrom (Acquired Antiphospholipoid Antibody Syndrome) (APS) je provázen zvýšením antikardiolipinových protilátek (ACLA), protilátek typu lupus antikoagulans, anti-beta-2-glykoproteinu I a event. dalších antifosfolipidových protilátek z tříd IgA, IgG a IgM globulinů. Jsou dokumentované zvýšeným výskytem arteriálních i venózních trombotických příhod, nevysvětlitelnou trombocytopenií, vaskulopatií v těhotenství z placentární insuficience s opakovanými aborty [26]. Pokud je známo, tak v konečné fázi APS způsobuje různě intenzivní inhibici proteinu C, event. změněné vlastnosti trombocytů, monocytů, makrofágů, deciduálních endometriálních buněk a dalších buněk po navázání fosfolipidových autoprotilátek na jejich povrch. Ty všechny spolu s dalšími metabolity se mohou podílet na indukci tkáňového faktoru, který dosud jen málo známým způsobem spouští koagulační kaskádu [22, 27].
B.
Výrazně zvýšená hladina celkového homocysteinu (tHcy) (>30 µmol/l) zůstává rizikovým faktorem zvyšujícím žilní a především arteriální trombózu, i když racionální vysvětlení stále chybí a snížení hladiny samotného tHcy tromboembolické komplikaci nezabrání. Zvýšení tHcy je akcentováno především polymorfismem MTHFR 677 T>T, méně i 1298C>C, které působí sníženou enzymatickou aktivitou zvýšení tHcy z deficitu aktivního folátu v plazmě a erytrocytech. Suplementace folátem tento handicap dostatečně odstraňuje, problematická je pouze u urémie a u pacientů léčených hydantoináty [28].
C.
Prakticky však nejčastější příčinou zvýšení tHcy je kromě chronického ledvinného selhání (tHcy je jeden z aktivních uremických toxinů) relativně častý deficit vitaminu B12, jeho aktivní formy – holotranskobalaminu (HTC). Deficit HTC je vyvolaný u adolescentů většinou vegetariánskou stravou, u starších pacientů pak deficitem transportních bílkovin a mechanismů, které se uplatňují při složitém vstřebávání vitaminu B12 v zažívacím traktu a které jsou zranitelné nadměrným podáváním např. antacid nebo jim podobných léků. tHcy je nebezpečný tím, že indukuje expresi tkáňového faktoru na monocytech a makrofázích a tím zvyšuje trombofilii v žilním i arteriálním řečišti. Na endotelu indukuje expresi trombomodulinu a tím i aktivaci proteinu C; dále zvyšuje aktivitu i FXII a FV [25, 27].
D.
Zvláště nebezpečná je interakce vlivem zvýšeného tHcy se zvýšenou hladinou lipoproteinu(a), Lp(a) >1000 mg/l, který má proaterogenní a antifibrinolytické vlastnosti. Zjednodušené schéma jeho předpokládaného účinku je uvedeno na obrázku 1 (podle Chapmana) [31, 32, 33].
![Interakce hyperhomocysteinemie a vysokého Lp(a), které působí inhibici trombolytického systému PAI-1 podle Chapmana (podrobnosti v textu) [33].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/352922def45ddeac2326f49adc0c4b32.jpg)
Interakce je způsobena podobností vedlejších řetězců, „cringlů“ Lp(a) a PAI-1. Zvýšený tHcy (nad 20 µmol/l) dále modifikuje cringl Lp(a) v takovém rozsahu, že ten vytěsní PAI-1 z vazby, který se stane neúčinným a efektivní trombolýza se zastaví.
E.
Chronické jaterní postižení nebo jaterní selhání z různých příčin mohou vést k deficitu syntézy koagulačních proteinů a tromboembolie může sehrát konečnou fázi jaterního selhání.
F.
Další prokázané, ale metabolicky zatím dostatečně nevysvětlené zevní faktory, provokující tromboembolie, jsou kouření, obezita, dlouhodobá imobilizace a hypotrofie, při kterých se HAK také nedoporučuje [9, 10, 20].
Nález homozygotní mutace LMFV, proteinů C, S, protrombinu II a antitrombinu by měl být považován za absolutní a nález heterozygotní formy LMFV, proteinů C, S, protrombinu II, vysokého Lp(a), tHcy a antifosfolipidových protilátek pak za relativní kontraindikaci KHA [34].
Soubor a metodika
Naší lipidovou ambulancí ročně prochází od devadesátých let kolem 400 dětských a adolescentních pacientů (6–18 let) s dyslipidemií a dvakrát tolik dospělých – nejbližších příbuzných, kteří jsou odesíláni k bližší diferenciaci lipidové poruchy. Chlapci mírně převažují (60 %) nad dívkami (40 %). Obézních dětí evidujeme <5 %, ověřených vegetariánů <2 promile, ale jejich léčbu nezajišťujeme. Z deficitních LDL-receptorů typických pro FH nejčastěji evidujeme mutace: pG571E, pD245E, pR395 W, pC188Y, c1272_1273ins96, ostatní typy byly vzácnější.
Adolescentky odesílané pediatry do lipidové ambulance k diferencování zjištěné lipidové poruchy z oblasti Čech i Moravy většinou pocházejí z rizikových rodin s vysokým rizikem pro KVO (hodnoty SCORE u jejich rodičů nebo prarodičů vždy >10 %). Mají proto před nasazením účinné medikamentózní léčby vyšetřeny všechny hlavní parametry lipidového spektra, tj. CCh, LDL-Ch, HDL-Ch, Apo-B, Apo-A1, sdLDL a Lp(a); s grantovou podporou vyšetřujeme ještě metabolity syntézy a absorpce necholesterolových sterolů (lathosterolu, desmosterolu, kampesterolu a sitosterolu) a pohlavní hormony. Graficky registrujeme a monitorujeme růstovou křivku a pohlavní zrání.
Smutné zkušenosti s nálezem tromboembolických komplikací při zavádění KHA z posledních 10 let nás donutily vyšetřovat u těchto rizikových pacientek alespoň základní dědičné tromboembolické mutace, tj. Leidenskou mutaci FV (LMFV), protrombin II, MTHFR 677C>T a 1298 A>C, dále hladinu celkového homocysteinu, folátu, holotranskobalaminu, přítomnost antifosfolipidových protilátek, koagulační faktory FV, FVII, FVIII. Podmínky medikamentózní léčby jsou podrobně uvedeny v jiných pracích [35, 36]. Uvedené kazuistiky pochází ze souboru pacientek z let 2005–2009, vyšetřovaných podrobně bohužel až po tromboembolické příhodě.
Stanovení rutinní biochemie a rutinních lipidových markerů (HDL a LDL přímé metody) bylo prováděno na přístroji Synchron LX20 Beckman Coulter; speciální lipidové markery (Apo-A1, Apo-B, Lp(a) nefelometricky na Immage Beckman Coulter; vitaminy na HPLC nebo na Immulite (DPC), pohlavní hormony RIA metodikou; necholesterolové steroly GC/MS; genové mutace LDL-receptorů včetně Apo-E polymorfismu byly prováděny v molekulárně genetických laboratořích MedPed Brno (MUDr. T. Freiberger, CSc.). Rutinní hematologie a hemokoagulace: na analyzátoru Advia 2120 (Bayer). Tromboembolické mutace FV Leiden, protrombin II a MTHFR C677T a A1298 C byly stanoveny PCR technikou. Necholesterolové steroly na GC/MS. Monitorování růstu a hmotnosti počítačovým programem ”Růst“ – Krásničanová a Lesný, 1998; pohlavní zralost byla testována podle Tannera a spol., 1974. Kožní řasa měřena kaliperem Best. Ztluštění intimy karotideálních arterií (IMT) měřeno sonograficky na VigmedSound. Pro spolehlivou diagnostiku vegetariánství používáme stanovení aktivního vitaminu B12 – holotranskobalaminu – na analyzátoru AxSym-Abbot enzymoimunostanovení. Pro evidenci abúzu alkoholu stanovujeme hladinu „Carbohydrate Deficient Transferinu“ (CDT) na HPLC s fotometrickou detekcí.
Výsledky
Medikamentózní léčbu familiární hypercholesterolémie začínáme u děvčat až po menarché, protože teprve poté může dojít k výrazným změnám v toleranci cholesterolu. Z typických vybraných monitorovacích grafů hladin cholesterolu (n = 10) (graf 1) ve statusech u adolescentních pacientek nacházíme individuálně rozdílný vliv tohoto „hormonálního přívalu“ na hladinu CCh.

U poloviny pacientek s hypercholesterolémií detekovanou před menarché se sníží CCh tak výrazně, že nevyžaduje léčbu a v dalším období už se neobjevuje, nebo stačí jen nízkocholesterolová dieta. Zhruba druhá polovina pacientek si zvýšenou hladinu CCh v různé intenzitě podrží už z předmenarchálního období a tedy nutně vyžaduje medikamentózní léčbu [35]. Nemusí to být vždy jen nositelky s molekulárně geneticky prokázaným deficitem LDL-receptorů. Aktivita PCSK9, která rozhoduje o regulaci LDL-receptorů, během puberty kolísá a dosahuje maxima teprve ve 13 letech věku [37]. Hormonální vyzrávání dívek probíhá podle individuálních závislostí a my je musíme respektovat a podle spektra dostupných diagnostických metabolitů medikamentózní léčbu individuálně zajišťovat [35].
Situaci v ambulanci nám v posledním desetiletí výrazně komplikuje široké nasazení kombinované perorální antikoncepce (KHA), se kterou pacientky nedostatečně vyšetřené už přicházejí, a nebo kterou ony nebo hlavně jejich matky „pouze pozitivní reklamou z médií zpracované“ bezstarostně požadují!
U 50 % pacientek s prokázanou mutací LDL-receptorů nacházíme totiž po zavedení KHA zvýšení CCh o 1,5–2,5 mmol/l. Stejně reagují i adolescentky se závažnou rodinnou anamnézou a vysokým SCORE pro KVO, kde zatím dostupnou molekulárně genetickou metodikou nebyly mutace pro deficit LDL-R prokázány. Pro vyhodnocení byl použit soubor 35 adolescentek (15–21 let) s nejlepší compliancí. Nevíme, jaké průměrné zvýšení CCh nastává ve zdravé nerizikové populaci adolescentek, ale pochybujeme, že bude jiné. Publikované studie – většinou firemní – platí jen pro dospělé a souvislé populační studie a objektivní zkušenosti na toto téma neexistují doma ani v zahraničí, nebo se o nich mlčí.
Některé adolescentky, které nemají dostatečně vysokou hladinu HDL, se tak dostávají do kritických hodnot CCh vyžadujících medikamentózní léčbu. Často pozorujeme, že před zavedením KHA často stačívala jen vydatná pohybová výchova či nízkocholesterolová pestrá strava k udržení normální cholesterolémie, po zavedení KHA už nikoliv.
Náš přístup při léčbě je zcela individuální podle očekávaného rizika a nálezu spektra monitorovacích metabolitů. Pokud KHA nevyvolává zvýšení CCh, není co řešit, pokud nastává mírné zvýšení ověřené i mírnou hodnotou syntetického markeru – lathosterolu, pak asi budeme KHA tolerovat a léčit [3, 35]. Pokud však KHA vyvolá výrazné zvýšení CCh o více než 2,0 mmol/l, a to u adolescentky z rizikové rodiny – s prokázanou mutací LDL-receptorů, pak nám nezbývá než podávání KHA odmítnout. V případě negativního postoje matky, která právně adolescentku zastupuje, si necháváme alespoň podepsat prohlášení o zjištění vysokého rizika KVO či rizika tromboembolie. U pacientek, kde je KHA léčebně gynekologem indikována, se snažíme jeho požadavek respektovat a FH léčit. Léčebný efekt KHA u akné je některými autory posuzován skepticky, i když indukuje tvorbu SHBG, IGFBP v játrech a tím nepřímo snižuje tvorbu volného testosteronu [38].
Grafy 2–4 monitorující cholesterolémii u pacientek s FH ověřenou prokázanou mutací LDL-receptorů ukazují různě obdobné změny hypercholesterolémie vyvolané podáváním KHA, změnou medikamentózní léčby či vysazením nebo změnou používané KHA. Hladiny HDL-Ch či TAG nejsou tak výrazně jako CCh ovlivňovány.

Např. u 27leté pacientky s mutací LDL-R S156L (nové označení p.Ser177Leu) nebyla dlouhou dobu hladina CCh výrazně vysoká a terapeutickou hladinu udržovala vydatná sportovní aktivita spolu s dietou a denní konzumací Flory Plus. Podání KHA působí její výrazný vzestup a po vysazení výrazný pokles. Po změně HAK, tj. zavedením medikovaného nitroděložního tělíska uvolňujícího jen levonorgestrel, dochází k mírnému poklesu CCh a spolu se statinem cholesterolémii na dlouhou dobu normalizuje.
U 17leté adolescentky s mutací LDL-R G571E (p.Gly592Glu), která už přišla do ambulance s KHA spolu s nasazenou statinovou léčbou, stačilo pouhé vysvětlení, následovalo vysazení, aby bylo možné snížit i dávky statinu k dostatečné normalizaci hypercholesterolémie (graf 3).

U 16leté neukázněné a obézní adolescentky (BMI 30) s relativně mírnou mutací LDL-R D245E (p.Asp266Glu) podávaná KHA výrazně zvýšila CCh i při jinak efektivní statinové léčbě; po vysazení KHA se snadno udržuje léčebná hladina CCh při statinové léčbě; po návratu k lépe vyhovujícímu stejnému druhu KHA došlo k ještě výraznějšímu zvýšení CCh; pacientka však odmítá vysazení KHA a naši ambulanci opouští (graf 4).

Vybrané kazuistiky
Kazuistika I (obr. 2)
Smrtelnou příhodu následkem embolie a. pulmonalis po příletu do Austrálie u 18leté studentky, která zde nastoupila jako „au pair“ a pro nekvalitní lékařskou péči do 10 dnů zemřela za příznaků stupňující se dušnosti, osvětlila až soudní pitva, jejíž výsledek jsem si vyžádal a kterou mi koroner doložil nálezem homozygotní Leidenské mutace FV. U nás v laboratoři poté byla vyšetřena celá její rodina a výsledky doplnily naše očekávání: LMFV přítomna v heterozygotní formě u matky i babičky, dále homozygotní mutace MTHFR 677 T>T a vysoký homocystein (>50 µmol/), nízké hodnoty HTC <10 pmol/l, MMA zvýšená nad 500 nmol/l. Trestuhodné bylo jednání gynekoložky, která KHA této adolescentce podala, žádné anamnestické ani laboratorní šetření neprovedla a na pozdější stížnost babičky klidně odvětila, že si to měla pacientka přečíst na příbalovém letáku, kde jsou všechny komplikace dostatečně uvedeny.
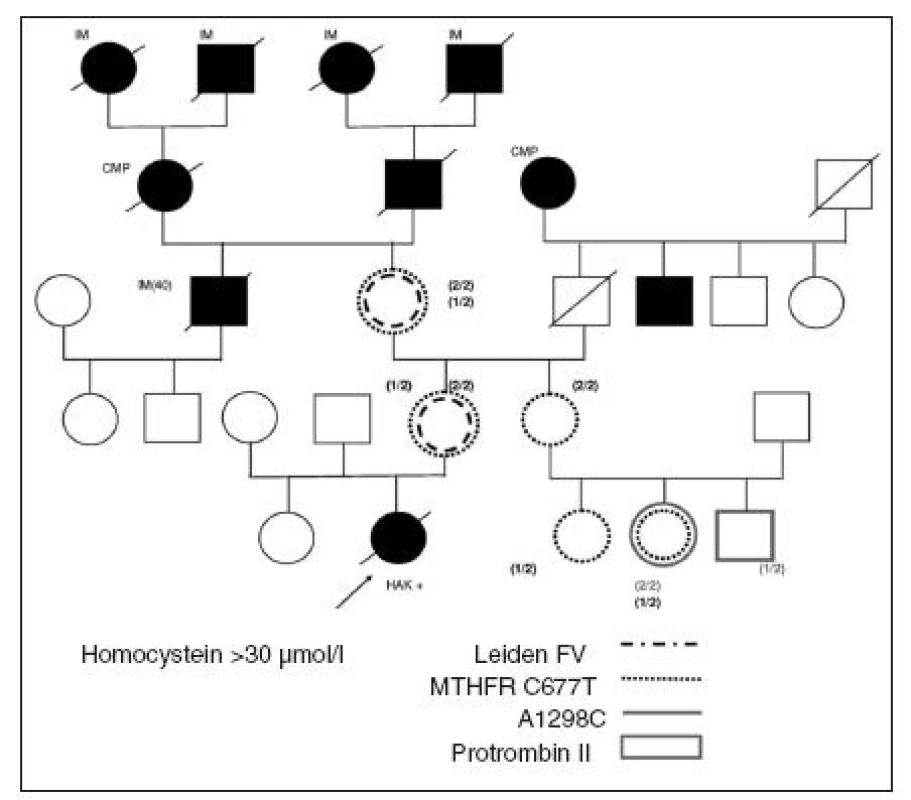
Jak je patrné z rodokmenu na obrázku 2, pocházela tato dívka z velice rizikové rodiny, kde ve 3 generacích skoro všichni muži zemřeli na KVO komplikace. Matka ani babička však HAK nikdy neužívaly, brzy po problémovém porodu ještě relativně mladé pro opakované metrorrhagie podstoupily včasnou hysterektomii. Červené maso se v rodině nejedlo pro obavu z „kravské nemoci“. U nevlastní sestry probandky nebyla LMV prokázána, nebyl zvýšený ani tHcy. U naší adolescentky se zřetelně kumulovaly nepříznivé dědičné i zevní rizikové faktory a přidala se i trombotická indispozice z dlouhého letu a nedostatečná lékařská péče na místě. Včasná vyšetření před podáním antikoncepce odpovědným gynekologem v takto rizikové rodině mohla smrtelné příhodě jistě zabránit!
Kazuistika II (obr. 3)
Tento případ neskončil smrtelně, ale pouze trvalým mozkovým poškozením. LMFV se vyskytovala u této 16leté studentky pouze v heterozygotní formě, stejně MTHFR mutace 677C>T, tHcy 62 µmol/l a HTC měla neměřitelný – protože byla vegetariánka, což matka poctivě sice uváděla, ale trestuhodné bylo sebevědomé prohlášení matky na dotaz lékařů z JIP ARO, kteří dceru právě resuscitovali, že KHA u dcery nepřichází v úvahu, protože dcera je dobře nábožensky vychovaná… Matce to posléze přece jen nedalo, šla do školy za spolužačkami a v dceřině školní skříňce našly ještě otevřenou krabičku od používané KHA. Prodloužila se tak kritická doba pro správnou diagnózu tromboembolické příhody – opět masivní embolie plicnice a následná mozková hypoxie zanechaly trvalé poškození. Ani v tomto případě gynekolog žádné vyšetření neprovedl, ani se nevyptával na situaci v rodině, která byla typicky riziková, jen se zeptal, „jaký přípravek bude slečně vyhovovat, aby netloustla a bylo to laciné?“. Se souhlasem matky uvádím část jejího dopisu, který uveřejnila na internetu pro varování ostatních matek, protože dcera sama už psát nemůže:
„Když si moje velká dcera našla přítele, sehnala si sama hormonální antikoncepci, kterou již většina jejích spolužaček samozřejmě užívala. Vzpomínám si, že zdravotnické letáčky, nabízející studentkám hormonální antikoncepci, se povalovaly v šatně gymnázia, když jsem se tam přezouvala na rodičovskou třídní schůzku. Doufala jsem, že až to na moji dceru „také přijde“, tak se o tom snad dozvím, abychom si mohly o tak důležité věci spolu popovídat. Nestalo se tak. O tom, že dcera brala už několik měsíců hormonální antikoncepci, jsem se dozvěděla až od ošetřující lékařky Jednotky intenzivní péče jedné dobré nemocnice, kam mne zavolali, když dcera ležela v bezvědomí napojena na různé přístroje různými hadičkami a kde jí nakonec zachránili život. Neúprosná diagnóza zněla: rozsáhlá plicní embolie, trombóza břišních tepen, omezená srdeční činnost, možnost poškození psychosomatických funkcí mozku atd. Ani jsem to všechno nestačila sledovat, co všechno se v mé „holčičce“ porouchalo. Jen závěr paní doktorky si pamatuji: A to je všechno důsledek kouření, užívání antikoncepce, která je pro ni zcela nevhodná, ohrožuje ji na životě, protože má dědičnou poruchu srážlivosti krve. Věděla jsem, že porucha srážlivosti je v naší rodině dědičná. A tak se chci zeptat rodičů dospívajících dcer: „Víte, co Vaše dcery polykají za prášky a vědí ony něco o dědičných nemocech, které se dosud neprojevily a mohou je postihnout?“
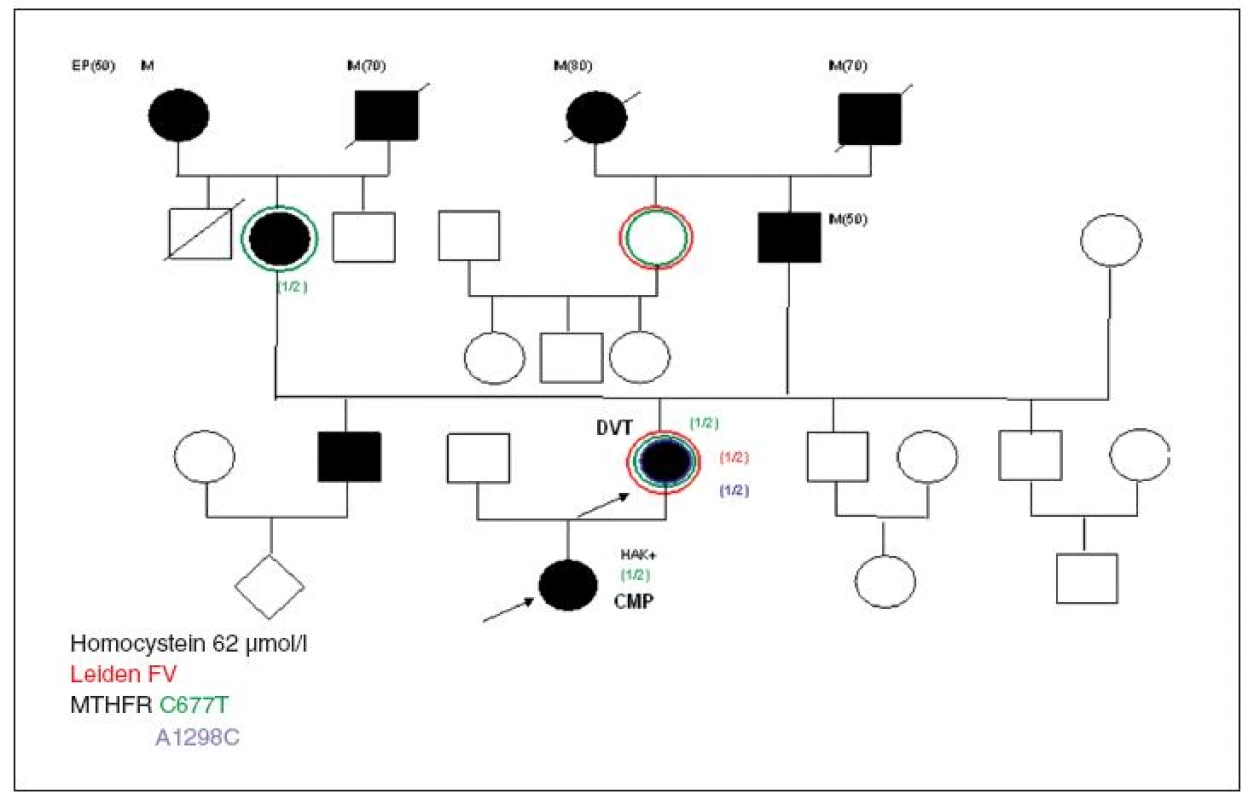
Ze stejné skupiny pozitivních heterozygotních nálezů LMFV ještě můžeme doložit další dvě hypercholesterolemické pacientky s HŽT po sportovním úrazu a po gynekologickém zákroku. Další dvě starší adolescentní pacientky – z rizikových rodin pro KVO, přesvědčené vegetariánky s hyperhomocysteinemií, kterým KHA nebyla doporučena, ochotně podepsaly prohlášení o zvýšeném riziku tromboembolie a naši ambulanci opustily.
Kazuistika III (obr. 4)
17letá obézní pacientka (BMI 35), prodavačka s vysokým rizikem KVO v rodině z obou stran rodičů, kterou vychovávala babička. Dívka byla přijata na kardiologickou JIP s podezřením na embolii plicnice, která se potvrdila, trombus z levé větve na kardiochirurgii operačně odstraněn a po symptomatické léčbě se dívka rychle zotavila. U nás i při velké chylositě séra potvrzena smíšená dyslipidemie (CCh 6,5 mmol/l, TAG 13,0 mmol/l; Apo-B 1,8 g/l, Lp(a) 625 mg/l). Ostatní biochemické parametry (měřitelné až po použití Lipoclearu) byly nalezeny v normě, CDT opakovaně >4 %!; žádné DTEM nebyly nalezeny, také vyšetření hemokoagulačních faktorů v normě.
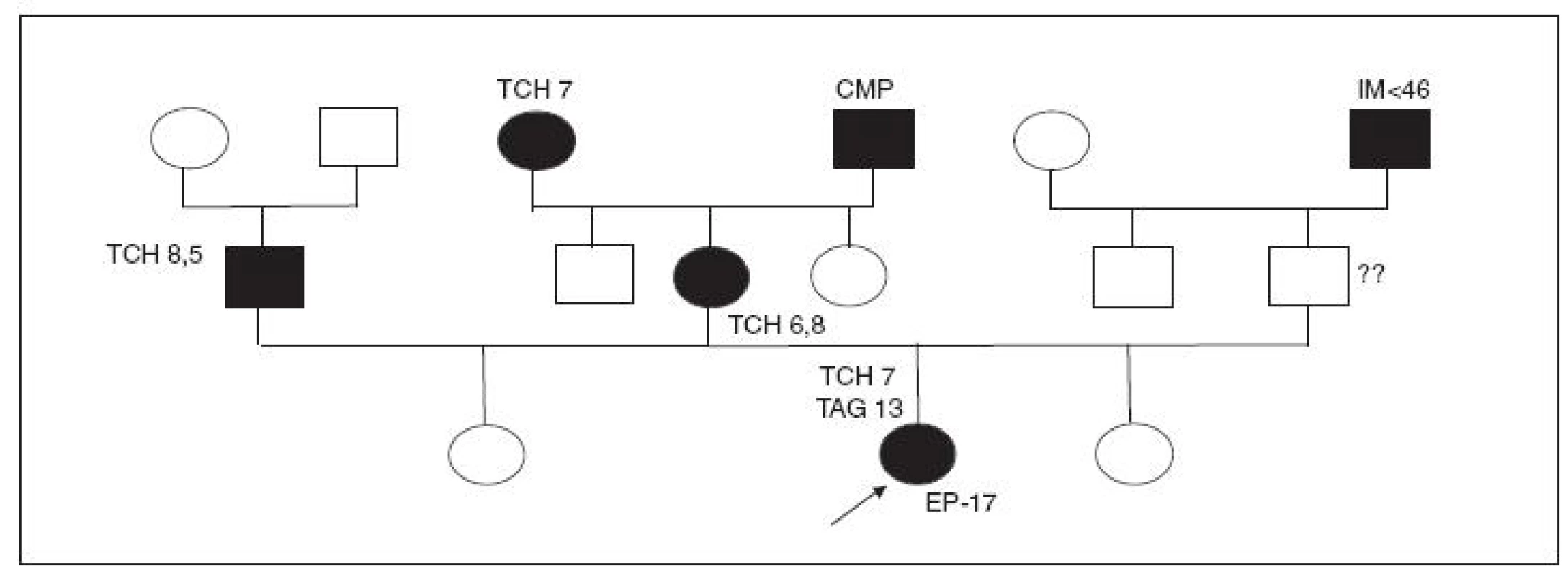
V ambulanci byla nejprve zahájena usilovná dietní terapie a snaha o nápravu špatného stravovacího stereotypu a později nasazena i medikamentózní léčba, ale pro malou compliance s mizivým efektem. KHA bere probandka od 13 let a nehodlá ji nadlouho vysadit, zůstává náruživá kuřačka, konzumentka alkoholu, životní styl a pohybový stereotyp velice špatný a nenapravitelný. Po částečném odléčení do metabolické ambulance přestala docházet.
Kazuistika IV (obr. 5)
27letá zdravá inženýrka byla z plného zdraví přijata na neurologickou JIP s akutní mozkovou příhodou; při symptomatické léčbě se rozsáhlá mozková ischémie postupně upravuje a parézy s výjimkou DK částečně mizí. V našem laboratorním nálezu zůstává zvýšený tHcy 49 µmol/l, neměřitelný HTC a vysoká MMA (755 nmol/l). MCV a KO i plazmat. železo jsou v normě. Homozygotka pro T>T mutaci MTHFR 677. Vyšetření všech koagulačních faktorů v normě, LMFV negativní; KHA užívala od 15 let.
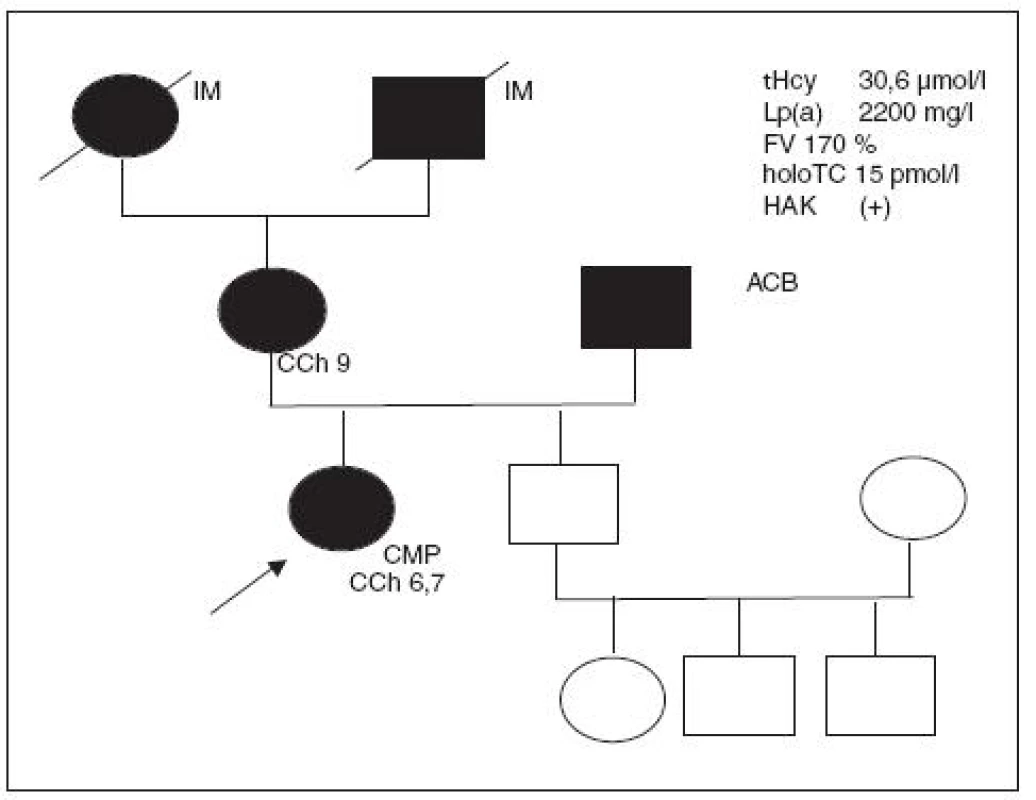
Nyní suplementována vitaminem B12 (Milgama, Neuromax) a folátem; je stabilizovaná, ale pohyblivá jen na vozíku.
Kazuistika V (obr. 6)
40letá pacientka s familiární hypercholesterolémií (8,5 mmol/l), Lp(a) >1500 mg/ml a s vysokým rizikem KVO v rodině; v 15 letech prodělala na náročném zájezdu autobusem flebotrombózu; po prvém těhotenství absolvovala další HŽT a přesto dál dlouhodobě užívala KHA; při vyšetření v ambulanci uvádí, že nyní užívá náhradní hormonální terapii; nalezena náhodně se zvýšeným tHcy 39 µmol/l v rámci prevence; hladina HTC jen 8 pmol/l a MMA 560 nmol/l; heterozygotka pro MTHFR A1289C a homozygotka pro genový polymorfismus protrombinu II (G20210A), hladina fibrinogenu 3,3 g/l. Pozitivní protilátky proti vnitřnímu faktoru a proti parietálním buňkám, fibroskopický nález žaludku v normě.
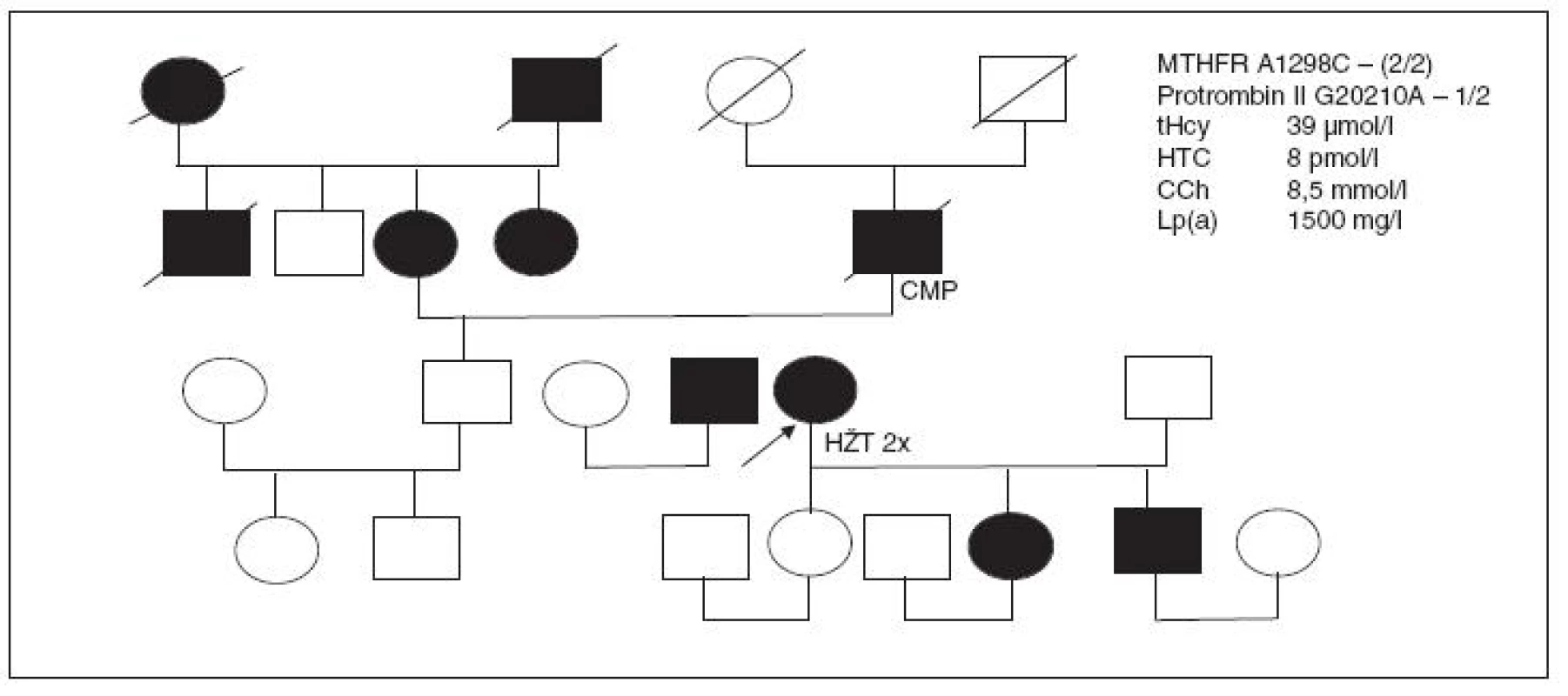
NHT vysazena, pacientka je u nás suplementována vitaminem B12 a pravidelně navštěvuje Trombotické centrum pro kontrolu koagulačního spektra. Stejné mutace genu pro MTHFR a protrombinu II byly nalezeny u její dcery a syna.
Kazuistika VI (obr. 7)
39letá úřednice po opakované flebotrombóze DK (v pubertě a po porodu) dlouhodobě užívala KHA. Po hysterektomii dostává náhradní hormonální terapii a přichází do ambulance s vysokým tHcy (55 µmol/l), nízkým HTC (8 pmol/l), vysokou MMA (>500 nmol/l). Heterozygotka pro obě mutace MTHFR; z koagulačních faktorů zvýšený FVIII na 189 %. Při dalším vyšetření nalézáme i vysoký CCh 8,5 mmol/l a velmi vysoký Lp(a) >1500 mg/l.
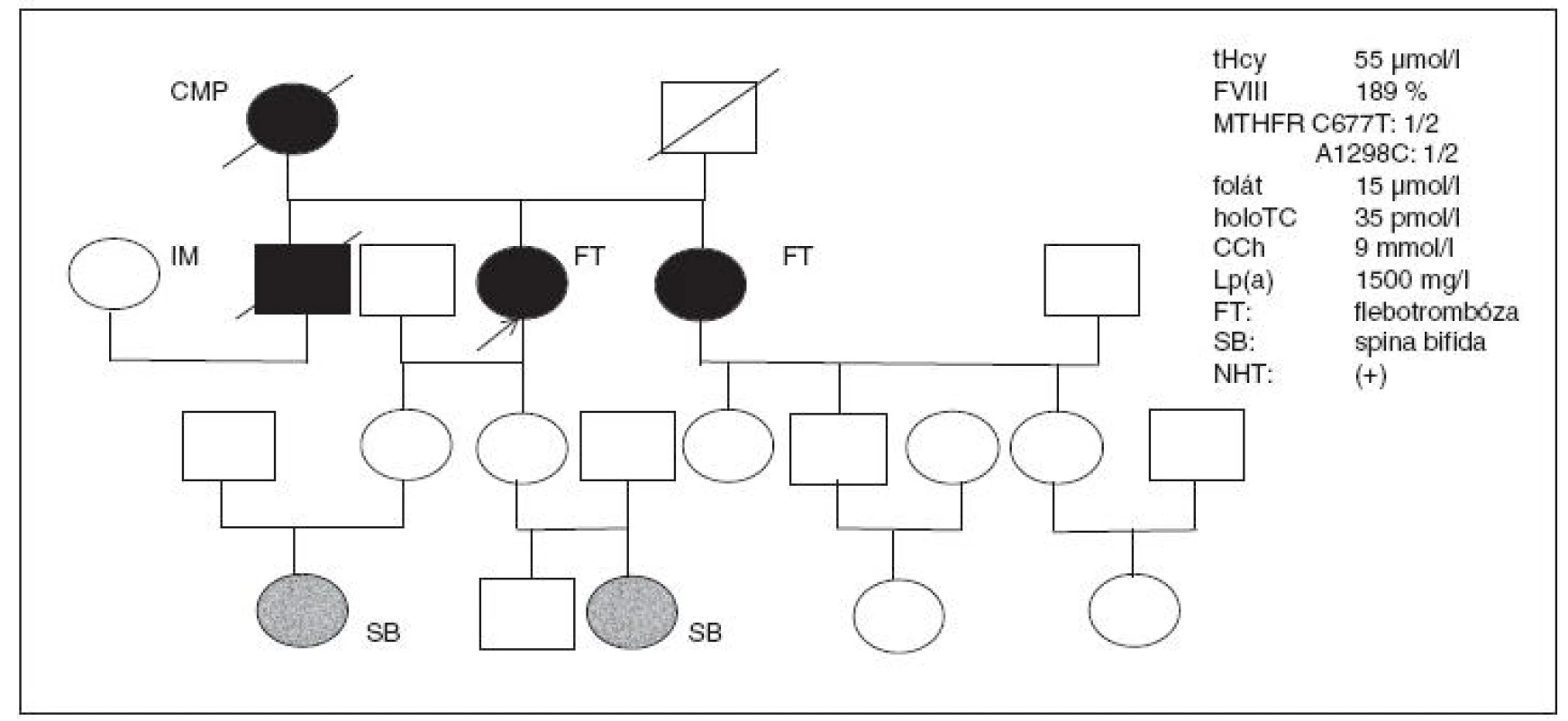
U obou vnuček s homozygotní mutací MTHFR 677T>T nalezena spina bifida. Podobný laboratorní nález také u její mladší sestry, se stejným výskytem flebotrombózy, i když zatím NHT nepoužila, její koagulační FVIII je rovněž zvýšený na 165 %, tHcy 44 µmol/l a přítomny obě mutace pro MTHFR v heterozygotní formě.
Kazuistika VII
27letá žena po odléčeném levostranném iktu odeslána z neurologie k vyšetření do metabolické ambulance pro enormně vysokou hladinu tHcy >100 µmol/l, folát <5 nmol/l; HTC 5 pmol/l, MMA >750 nmol/l; homozygotka T<T pro MTHFR 677; LMFV nenalezena, všechna ostatní koagulační vyšetření v normě; od 15 let užívala střídavě různé druhy KHA. Nyní suplementována perorálně kyanokobalaminem a její hemiplegie je stabilizovaná.
Za uplynulých 10 let evidujeme z neurologické JIP více než 10 tzv. „mladých iktů“ u žen do 40 let věku, bez nálezu kritické mutace LMFV, ale jsou to homozygotky nebo heterozygotky pro MTHFR C677 T se středně zvýšeným tHCy, bez dalších DTEM; všechny pochází z rizikových rodin pro KVO, dlouhodobě užívaly KHA a byly v kritické době silné kuřačky.
Diskuse
Z výše uvedených kazuistik je zřejmé, že tromboembolické komplikace jsou mezi rizikovými pacientkami v rutinní praxi lipidové ambulance relativně časté. Trombóza (častěji v žilním systému) nebo tromboembolie (častěji v arteriálním systému) je velmi komplexní příhoda odvislá od dědičných dispozic, aktuální situace cévního endotelu, vydatné funkce fibrinolytického a koagulačního systému, od humorálních účinků, lokálních průtokových poměrů a event. zánětlivých změn. Dostatečně víme, jak probíhá konec koagulační kaskády, ale málo víme o její inicializaci přes spouštěcí tkáňový faktor uvolňovaný z makrofágů, monocytů, endotelií a dalších tkáňových buněk, o expresi různých genetických a exogenních vlivů na složité enzymatické pochody koagulačních procesů. Interakce vnějšího prostředí představovaného léky, vitaminy, potravou či metabolity KHA a reaktanty vnitřního prostředí z právě probíhajících metabolických reakcí dosud podrobně nezvládáme, protože je dostatečně neznáme.
Nedostatečně odborně zajištěná exploze podávání KHA v posledních 10 letech mladým adolescentkám je nebezpečná, protože se dívkám a jejich matkám pouze zdůrazňuje zlepšení životního stylu a nikdo nechce vysvětlovat a přiznávat i ty negativní, skoro nečitelným malým písmem uváděné komplikace na příbalovém letáku. Je zarážející a až trestuhodné pozorovat v ambulanci, jak matky vyžadují KHA pro své 12–15leté dcery, aby ony samy byly bez starostí o jejich možné otěhotnění, aniž si uvědomují, že reagují pod vlivem falešné a jen pozitivní reklamy z tisku a televize tvrdící, že KHA žádná nebezpečí s sebou nepřináší!
Relativní riziko tromboembolického postižení u uživatelek KHA je v literatuře uváděno 2–4 %, i když pouze 1–2 % komplikací končí fatálně [22, 23]. Celopopulační screening na přítomnost LMFV před podáním KHA se nedoporučuje, i když by byl metodicky dostupný. Považuje se za drahý a zatím „prý“ stačí jen jeho vyšetřování v rizikové populaci žen, kde se HŽT už jednou vyskytla. V severoamerické populaci žen bylo spočítáno, že dokonaná smrtelná „příhoda“ se vyskytne u jedné z 0,5 milionu uživatelek KHA [39]. Jiný autor ze stejné populace vypočítal, že by muselo být detekováno a z KHA vyloučeno 92 000 nositelek LF, aby se zabránilo vzniku jedné smrtelné komplikace, což by stálo 320 milionů dolarů! [40, 41]. Tyto úvahy starší deseti let, ani některé novější přesto nerespektují narůstající výskyt tromboembolických příhod nalézaný u stoupajícího počtu žen užívajících KHA a plošný screening nedoporučují (45).
Nechybí varovné kazuistiky ani z naší populace – Hadačová nebo Šmírová a spol., stejně i Chroustová a spol. dokumentují znepokojivý nárůst tromboembolických komplikaci a plicní embolizace u adolescentek užívajících KHA proti ostatním vrstevnicím KHA neužívajícím [42, 43, 44].
Dosud není soustavně dostatečně poznán a akceptován vliv nízkomolekulárních látek vstupujících a ovlivňujících iniciální fázi koagulační kaskády. Zatím je pouze znám rušivý vliv tHcy (hlavně jeho derivátu Hcy-laktonu) a jeho možná interakce s koagulačními bílkovinami ve zvýšených koncentracích; přitom se u nás tHcy jen málo vyšetřuje! Nejsou dále vyhodnoceny metabolické reaktanty, jako např. vliv interleukinů, chemokinů, reaginů, chemotaktických, růstových a destičkových faktorů. A nevyšetřeny jsou i vlivy léků a jejich možné interakce. Podle našich zkušeností se vnitřní i vnější rizikové faktory pro vznik tromboembolických příhod (koagulační, metabolické, zánětlivé, environmentální) u rizikových pacientek z lipidové ambulance zřejmě kumulují nebo přímo násobí a teprve v kombinaci s metabolity KHA způsobí nežádoucí spuštění koagulační kaskády, či dosud neznámým způsobem indukují koagulační interakce vedoucí k HŽT, TE, EP nebo CMP podle zdravotního stavu, věku a genetické výbavy nositelky [19, 20].
Pacientky s nálezem DTEM a podezřením na koagulopatii proto vždy odesíláme do Trombotického centra VFN (Prof. MUDr. J. Kvasnička, DrSc.) k podrobnému vyšetření všech, i těch vzácných koagulačních faktorů a genových mutací. Zde také při pozitivním nálezu jsou schopni zajistit potřebnou antikoagulační léčbu a její dlouhodobé monitorování.
Je pochopitelné, že v době, kdy na celém světě užívá skoro 1,5 miliardy žen HAK, nezastavíme tento trend, ale musíme se snažit zajistit všechna možná preventivní vyšetření, abychom koagulační příhodě zabránili, jak jsem to matkám postižených pacientek slíbil! Stačilo by jen dodržovat doporučení SZO o absolutních kontraindikacích, což se u všech našich pacientek z kazuistik nestalo – rozuměj pečlivá anamnéza a vyjasnění všech dostupných tromboembolických příhod v rodině. Vyšetřením alespoň APCR se zachytí 80–90 % rizika a upozorní na další potřebná vyšetření.
Naše doporučení
Co tedy doporučujeme podle našich zkušeností testovat u nastávajících prokazatelně rizikových žadatelek o KHA v pořadí důležitosti a největšího efektivního záchytu?
1. APCR, 2. LMFV, 3. protrombin II, 4. FVIII, 5. tHcy, 6. antifosfolipidové protilátky. Dohromady činí cena těchto vyšetření kolem 5000 Kč. Pokud mladistvé uživatelky KHA chtějí mít „zlepšenou kvalitu života“, jak hlásají všechny mediálně používané informace o HAK, ať si potřebná vyšetření ony nebo jejich partneři zaplatí, protože si samy patofyziologické prostředí vytváří (i když některé pojišťovny sice hradí HAK, už ale nehradí drahá potřebná vyšetření pro jejich bezpečné používání).
Zopakujme alespoň minimální požadavek pro každou adolescentku před prvým použitím KHA:
vyšetření pečlivé tromboembolické anamnézy v rodině a vyšetření alespoň APCR, které stojí max. 500 Kč – to je to minimum, které se musí dodržovat, abychom nemuseli psát tak smutné kazuistiky, které jsem slíbil matkám postižených dcer uveřejnit alespoň pro poučení lékařů.
Použité zkratky:
- ACB – aortokoronární bypass
- APCR – rezistence proti aktivovanému proteinu C
- APS – antifosfolipidový syndrom
- CCh – celkový cholesterol
- CDT – carbohydrate deficient transferrin (test na dlouhodobé požívání alkoholu)
- CMP – cévní mozková příhoda
- EP – embolie plicnice
- DTEM – dědičné tromboembolické mutace
- HAK – hormonální antikoncepce
- HDL – high density lipoprotein cholesterol
- HTC – holotranskobalamin – aktivní vitamin B12
- HŽT – hluboká žilní trombóza
- IGFBP – insulin growth factor binding protein
- IM – infarkt myokardu
- KHA – kombinovaná perorální antikoncepce
- KVO – kardiovaskulární onemocnění
- LA – lupus anticoagulans
- LDL – low density lipoprotein cholesterol
- LDL-R – receptor pro LDL-cholesterol v jaterní buňce
- LMFV – leidenská mutace faktoru V
- MMA – methylmalonová kyselina (marker nedostatku vitaminu B12)
- MTHFR – methylentetrahydrofolát reduktáza
- NHT – náhradní hormonální terapie
- PAI-1 – plazminogen aktivátor inhibitor 1
- PCSK9 – proprotein convertase subtisilisin/kexin type 9 (rizikový marker)
- PE – plicní embolie
- sdLDL – small density LDL
- SCORE – tabelární systém k výpočtu rizika kardiovaskulární příhody
- SHBG – sex hormone binding globulin
- SZO – Světová zdravotnická organizace
- t-PA – tkáňový aktivátor plazminogenu
- TE – tromboembolie
Děkuji doc. MUDr. J. Hamanové, CSc., za cenné rady a připomínky k rukopisu sestavenému pod emočním tlakem opakovaných nepříznivých kazuistik.
Výsledky částečně podpořeny grantem IGA MZ ČR NA 7452-3.
Prof. MUDr. Josef Hyánek, DrSc.
Metabolická
ambulance
Oddělení
klinické biochemie, hematologie a imunologie
Nemocnice Na Homolce
Roentgenova
2
150
30 Praha 5 - Motol
e-mail:
josef.hyanek@homolka.cz
Sources
1. Nařízení Vlády ČR č. 149/1994 Sb. Zdravotní řád. Věstník MZČR 1994, část 7, par. 4, odst. 2, písm. c.
2. Marek J, Hána V, Kršek M. Jak ovlivňují kortikoidy, růstový hormon a estrogeny lipidy a aterosklerózu. Vnitř. Lék. 2007;; 53 : 386–390.
3. Češka R. Cholesterol a ateroskleróza, léčba dyslipidemií. Praha: Triton, 2005.
4. Campos H, Sacks FM, Walsh BW, Schiff I. Differential effects of estrogen on low-density lipoprotein subclasses in healthy menopausa women. Metabolism 1993;; 42 : 1153–1158.
5. Giri S, Thompson P-D, Taxel P, et al. Oral estrogen improves serum lipids, homocysteine and fibrinolysis in eldery men. Atherosclerosis 1998;; 137 : 359–665.
6. Spenser TA, Chai H, Fu W, et al. Estrogen bloc homocysteine-induced endothelial dysfunction in porcine coronary arteries. J. Surg. Res. 2004;; 118 : 83–90.
7. Sack MN, Rader DJ, Cannon RO. Estrogen and inhibition of low-density lipoproteins in postmenopauzal women. Lancet 1994;; 343 : 269–270.
8. Fait T. Antikoncepce. Praha: Jesenius Maxdorf, 2008.
9. Fanta M. Kontraceptiva v gynekologické praxi. Klin. farm. Farmakol. 2008;; 22 : 149–151.
10. WHO Collaborative Study of Cardiovascular Disease and Steroid Hormone Contraception: Acute myocardial infarction and combined oral contraceptives: Results of an international multicentre case-control study. Lancet 1997;; 349 : 102–109.
11. Improving access to quality care in family planning. Medical eligibility criteria for contraceptives. WHO 2000. http://www.who.int/reproduction-health/publications/index.html.
12. Čepický P, Cibula D, Dvořák K, et al. Doporučení k předpisu kombinované hormonální kontracepce. Čs. Gynekol. 2005;; 70 : 320–324.
13. Plu-Bureau G, Horellou MH, Gompel A, Conard J. Hormonal contraception and risk of venous thromboembolism: When to ask for an assessment of hemostasis? Which parameters? Gynecol. Obst. Fertilité 2008 : 448–454.
14. Van Lunsen RHW, Unzeitig V, Creatsas G. Contraceptive choises and realities. New York, London: The Parthenon Publ. Group, 2000 : 79–82.
15. Inman WHW, Vessey MP, Westerholm B. Thromboembolic disease and the steroidal content of oral contraceptives: A report to the Committee on Safety of Drugs. BMJ 1970;;2 : 203–289.
16. Meade TW. Risks and mechanisms of cardiovascular events in users of oral contraceptives. Am. J. Obstet. Gynecol. 1988;;158 : 1646–1652.
17. Ramakrishnan G, Rana A, Das Ch, Chandra NC. Study of low-density lipoprotein regulation by oral (steroid) contraceptives: desogestrel, levonorgestrel and ethinyl estradiol in JEG-03 cell line and placenta tissue. Contraception 2007;;76 : 297–305.
18. Cushman M, Kuller LH, Prentice R, et al. Estrogen plus progestin and risk of venous thrombosis. JAMA 2004;;295 : 1573–1580.
19. Mammen EF. Oral contraceptive pills and hormonal replacement therapy and thromboembolic disease. Hematologic Probleme in Obstetrics, Pregnancy, Gynecol. 2000;; 14 : 1045–1059.
20. Pernod G, Biron-Aadreani C, Morange PE, et al. Reccommendations on testing for thrombophilia in venous thromboembolic diseases: a French consensus guideline. J. Malad. Vasc. 2009; 34 : 156–203.
21. Fruzzetti F, Giannessi D, Ricci C, et al. Platelet-vessel wall interactions with third-generation oral contraceptives: no evidence of detrimental effects. Thromb. Haemost. 1999; 82 : 1164–1170.
22. Kvasnička J. Tromboembolie a tromboembolické stavy v klinické praxi. Praha: Grada Avicenum, 2003 : 37–65.
23. Roušová E, Hadačová I, Macek M. Hereditární trombofilie – jeden z modelů molekulární medicíny. Klin. Biochem. Metab. 2005; 13 : 68–76.
24. Blickstein I. Thrombophilia and women´s health. An overview. Obstet. Gynecol. Clin. N. Am. 2006; 33 : 347–356.
25. Khajuria A, Houston DS. Induction of monocyte tissue factor expression by homocysteine: a possible mechanism for thrombosis. Hemostasis, Tromb. Vasc. Biol. 2000; 96 : 966–972.
26. Greaves M. Antiphospholipid antibodies and thrombosis. Lancet 1999; 353 : 1348–1353.
27. Galajda P, Mokáň M. Nový model homeostázy a problematika aterosklerózy. Ateroskleróza 2001;;5 : 143–151.
28. Durand P, Prost M, Blanche D. Folic acid deficienty enhances oral contraceptive-induced platelet hyperacidity. Atheroscler. Thromb. Vasc. Biol. 1997; 17 : 1939–1946.
29. Guba SC, Fonseca V, Fink LM. Hyperhomocysteinemia and thrombosis. Semin. Thromb. Hemost. 1999; 25 : 291–310.
30. Dulíček P, Kalousek P, Malý J. Hormonální antikoncepce a trombofilická nemoc – jak je to ve skutečnosti? Intern. Med. 2002; 4 : 4–8.
31. Dardik R, Varon D, Tamarin A, et al. Homocysteine and oxidized LDL lipoproteid enhance platelet adhesion to endothelial cells under flow conditions: distinct mechanisms of thrombogenic modulation. Thromb. Hemost. 2000; 83 : 338–344.
32. Caplice NM, Panetta C, Peterson T, et al. Lipoprotein(a) binds and inactivates tissue factor pathway inhibitor: a novel link between lipoproteins and thrombosis. Blood 1989; 98 : 2980–2987.
33. Chapman JM, Huly T, Migon JE, et al. Lipoprotein(a): implication in atherosclerosis. Atherosclerosis 1994; 110 : 69–75.
34. Blickstein D. Screening for thrombophilia. Obstet. Gynecol. Clin. N. Am. 2006; 33 : 389–395.
35. Hyánek J, Martiníková V, Matoška V, et al. Desetileté zkušenosti s medikamentózní léčbou familiární hypercholesterolémie u dětí a adolescentů. Čes.-slov. Pediat. 2002; 57 : 404–412.
36. McCrindle BW, Urbina EM, Dennison BA, et al. Drug therapy of high-risk lipid abnormalities in children and adolescents: A scientific statement from the AHA atherosclerosis, hypertension, and obesity in youth committee, council of cardiovacular disease in the young, with the council on cardiovascular nursing. Circulation 2007; 115 : 1948–1967.
37. Baass A, Dubrec G, Tremblay M, et al. Plasma PCSK9 is associated with age, sex and multiple metabolic markers in a population based sample of children and adolescents. Clin. Chem. 2009; 55 : 1637–1645.
38. Odlind V, Misoma I, Persson I, et al. Can change in sex hormones binding globulin predict the risk of venous thromboembolism with combined oral contraception pills? Acta Obstet. Gynecol. Scand. 2002; 81 : 482–490
39. Rozendal FR. Oral contraceptives and screening for Factor V Leiden. Thromb. Haemost. 1996; 75 : 524–525.
40. Creinin M-D, Lisman R, Strickler RC. Screening for factor V Leiden mutation before prescribing combination oral contraceptives. Fertil. Steril. 1996; 72 : 646–651.
41. Dietrich JE, Yee DL. Thrombophilic conditions in the adolescent: the gynecologic impact. Obstet. Gynecol. Clin. N. Am. 2009; 36 : 163–175.
42. Chroustová D, Krátká K, Palyzová D, Patr R. Výskyt plicní embolizace u mladých dívek ve věku 15–25 let z hlediska používání hormonální perorální antikoncepce. Výsledky 5leté studie. Prakt. Lék. 2009; 89 : 439–443.
43. Hadačová I. Žilní trombóza a hormonální antikoncepce. Čes.-slov. Pediat. 2008; 63 : 383.
44. Šmirová S, Chochola M, Vařejka P, Ascherman M. Tromboembolické komplikace užívání orální estrogen-gestagenní antikoncepce. Vnitř. Lék. 2001; 47 : 460–464.
45. Wu O, et al. Screening for thrombophilia in high risk situations: a metaanalysis and cost effectiveness. Br. J. Haematol. 2005; 131 : 82–90.
Labels
Neonatology Paediatrics General practitioner for children and adolescentsArticle was published in
Czech-Slovak Pediatrics

2010 Issue 6
- What Effect Can Be Expected from Limosilactobacillus reuteri in Mucositis and Peri-Implantitis?
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Hydroa vacciniforme
- Rizika hormonálních kontraceptiv u adolescentních dívek
- Tromboembolické příhody u dívek a mladých žen užívajících hormonální antikoncepci
- Rychle progredující komplikace chřipky typu A u dětí
- Metotrexát u dětí s juvenilní idiopatickou artritidou
- Tělesná teplota a termoregulace u novorozence
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Tělesná teplota a termoregulace u novorozence
- Rychle progredující komplikace chřipky typu A u dětí
- Metotrexát u dětí s juvenilní idiopatickou artritidou
- Tromboembolické příhody u dívek a mladých žen užívajících hormonální antikoncepci
