Změny elektrické kožní vodivosti v důsledku bolestivého stimulu u novorozenců různých gestačních kategorií a srovnání se změnami vybraných fyziologických parametrů
Changes in electrical conductivity of the skin due to painful stimuli in newborns of different gestational categories and comparison with changes in selected physiological parameters
Pain in neonates is globally regarded as a highly undesirable phenomenon. Many studies have been confirmed that the pain feels as mature newborns and premature babies born. So far, however, there is no objective method of assessing pain in these patients who cannot yet verbalize their pain. One of the objectives of this study was to explore the use of measuring changes in electrical skin conductance as an objective criterion for evaluating the perception of pain in neonates. Given the experience of pain affects the physiological functions of the organism, the next objective was to ascertain the relationship between changes in skin conductance and changes in selected physiological parameters.
Patients:
The study included a total of 57 babies born in KNTB in Zlín in the first half of 2010. Infants were divided according to gestational age in the following 3 groups: group A: 41+6–36+0 (19 neonates), group B: 35+6–32+0 (25 neonates), group C: 31+6–25+0 (13 newborns).
Results:
As the most sensitive parameter for changes in skin conductance rating of pain seems to be the peak per second (PPS), other parameters of skin conductance and selected physiological parameters measured do not correlate with each other. The results could not determine basal skin conductance levels. A comparison of gestational age and parameters of skin conductance weren´t also demonstrate significant correlation. Gestational age also doesn´t affect the electrical parameters of skin conductance changes.
Conclusion:
We can conclude that the evaluation of pain in both mature and premature newborns requires individual assessment. Changes in skin conductance are probably influenced by other factors, not just the emergence of painful stimulus. The present study suggests, that pain assessment in neonates only measured by changes in electrical skin conductivity cannot replace the full range of established practices and vice versa is necessary to take into account the complexity of the perception of pain using a combination of several methods.
Key words:
electrical conductivity of the skin, infants, Prechtl, saturation, heart rate, gestational age
:
J. Macko 1; P. Humpolíček 2; D. Moravčíková 3; L. Kantor 4; M. Kotíková 1
:
Novorozenecké oddělení, Krajská nemocnice Tomáše Bati, Zlín
primář MUDr. J. Macko
1; Institut zdravotnických studií, Univerzita Tomáše Bati, Zlín
vedoucí Mgr. M. Cichá, Ph. D.
2; Ústav porodní asistence, Institut zdravotnických studií, Univerzita Tomáše Bati, Zlín
vedoucí Mgr. L. Reslerová, Ph. D.
3; Novorozenecké oddělení, Fakultní nemocnice, Olomouc
primář MUDr. L. Kantor
4
:
Čes-slov Pediat 2011; 66 (6): 363-371.
:
Original Papers
Bolest u novorozenců je globálně chápána jako velmi nežádoucí jev. Mnohými výzkumy bylo potvrzeno, že bolest cítí jak zralí novorozenci, tak i novorozenci předčasně narození. Doposud však neexistuje objektivní metoda hodnocení bolesti právě u těchto pacientů, kteří prozatím nemohou svou bolest verbalizovat. Jedním z cílů této studie bylo posoudit možnost využití měření změn elektrické kožní vodivosti jako objektivní hodnotící kritérium vnímání bolesti u novorozenců. Vzhledem k tomu, že prožívání bolesti ovlivňuje i fyziologické funkce organismu, bylo dalším cílem zjistit vztah mezi změnami kožní vodivosti a změnami vybraných fyziologických parametrů.
Soubor pacientů:
Do studie bylo zahrnuto celkem 57 novorozenců, narozených v Krajské nemocnici Tomaše Bati ve Zlíně v první polovině roku 2010. Novorozenci byli podle gestačního stáří rozděleni do 3 následujících skupin: skupina A: 41 + 6 – 36 + 0 (19 novorozenců), skupina B: 35 + 6 – 32 + 0 (25 novorozenců), skupina C: 31 + 6 – 25 + 0 (13 novorozenců).
Výsledky:
Jako nejcitlivější parametr změn kožní vodivosti pro hodnocení bolesti se zdá být peak za sekundu (PpS), další parametry kožní vodivosti či měřené vybrané fyziologické parametry vzájemně nekorelují. Z výsledků nebylo možno stanovit bazální hladinu kožní vodivosti. Při porovnání gestačního stáří a parametrů kožní vodivosti nebyly rovněž prokázány významné korelace. Gestační stáří tedy také nemá vliv na parametry elektrických změn kožní vodivosti.
Závěr:
Lze konstatovat, že při hodnocení percepce bolesti u novorozenců zralých i předčasně narozených je nutno dbát na individuální posouzení. Změny v kožní vodivosti jsou pravděpodobně ovlivněny i dalšími faktory, nejen vznikem bolestivého stimulu. Z předkládané studie vyplývá, že hodnocení bolesti u novorozenců pouze metodou měření změn v elektrické kožní vodivosti nemůže v plné šíři nahradit zavedené postupy a naopak je nutno zohlednit komplexnost vnímání bolesti pomocí kombinace více metod.
Klíčová slova:
elektrická kožní vodivost, novorozenci, Prechtl, saturace, frekvence srdeční činnosti, gestační stáří
ÚVOD
Mezinárodní asociace pro hodnocení bolesti (International Association of Study of Pain – IASP) definuje bolest jako nepříjemnou senzorickou či emocionální zkušenost, spojenou s okamžitým či potencionálním poškozením tkání. Společná komise pro akreditace zdravotnických zařízení (Joint Commission on Accreditation of Healthcare Organizations – JCAHO) v roce 2001 stanovila bolest jako pátý vitální znak [1]. Bolest u novorozenců je velmi nežádoucí nejen z etických a humánních důvodů, ale také proto, že zejména prolongovaná bolest může vést k inhibici růstu a vývoje dítěte a může být spojována se zvýšenou morbiditou a mortalitou novorozenců [1, 2].
V uplynulých 25 letech bylo publikováno více než 40 skórovacích schémat a hodnotících škál bolesti [16]. Jen některé z nich byly obecně uznány jako validní, jejich obecnou charakteristikou je implementace behaviorálních a fyziologických parametrů, některá schémata zařazují navíc biologické a konceptuální faktory. Exaktní měření bolesti u neverbálních pacientů je stále nedokonalé. Bolest a agitovanost či stres nejsou někdy optimálně rozlišitelné. Stále chybí validní měření prolongované či chronické bolesti.
IASP považuje za validní pro hodnocení bolesti tyto škály: NIPS (Neonatal Infant Pain Scale), PIPP (Premature Infant Pain Profile), CRIES (Crying, Requires O2, Increase vital signs, Expression, Sleepless) a NFCS (Neonatal Facial Coding System). NIPS a PIPP hodnotí akutní procedurální bolest, CRIES pak postoperační bolest. Pro hodnocení pokračující či přetrvávající bolesti je doporučována škála EDIN (Échelle Douleur Inconfort Nouveau-Né). NFCS se jeví jako spolehlivá škála pro posouzení akutní i krátce trvající bolesti podle výrazu obličeje, která vyjadřuje vysokou specificitu již pro novorozence od 30. gestačního týdne [26], její realizace je ovšem obtížná, a proto je méně využívána. Problémem všech skórovacích schémat je, že nediferencují mezi jednotlivými gestačními kategoriemi dětí, tudíž nelze mnohá schémata univerzálně aplikovat na děti všech gestačních stáří.
V současné době tedy neexistuje zlatý standard pro měření a hodnocení bolesti u těchto pacientů [3]. Neschopnost či nemožnost verbalizovat bolest ovšem neznamená, že jedinec bolest necítí či nevnímá.
Jako vhodná objektivní metoda pro měření a hodnocení bolesti u novorozenců se jeví metoda měření změn elektrické kožní vodivosti (Skin Conductivity Algesimetry – SCA) [4, 5]. Tato metoda se ukázala využitelnou pro individuální posouzení vhodné dávky anestetických preparátů [9]. Metoda poskytla téměř 90% senzitivitu a specificitu pro dospělé pacienty v celkové anestezii [8]. Principem této metody jsou reakce sympatického nervového systému [4, 6, 7] vzniklé v důsledku bolestivých změn. Tyto změny způsobují uvolnění acetylcholinu, který působí na muskarinové receptory a nejsou tedy ovlivněny nervosvalovými blokátory či aktivátory adrenergních receptorů či hemodynamickou variabilitou [3, 6, 7, 10]. Následkem toho dochází k plnění potních žláz (s maximem hustoty na palmární straně ruky a plantární straně nohy), což má za následek zvýšení kožní vodivosti v této oblasti [3, 4]. Měřitelným projevem je snížení odporu kůže až do okamžiku reabsorpce potu [3, 4, 7]. Tento proces je zaznamenán jako vrchol (peak) vodivosti. Jeho velikost (amplituda) závisí na intenzitě aktivace sympatiku. Změny v elektrické kožní vodivosti probíhají téměř okamžitě v reakci na bolestivý stimul, tedy do 0,7–2 sekund po impulzu [14]. Nejsou ovlivněny hemodynamickou variabilitou či neuromuskulární blokádou [1]. Specifičnost této metody je založena na stimulu, který vyvolává bolestivou reakci novorozence a spouští aktivitu sympatického nervového systému [4]. Měření kožní vodivosti (skin conductivity – SC) je obecně uznávanou metodou hodnocení emocionálního stavu novorozence a je úzce spojováno s chováním a pláčem novorozence [12] – viz níže Prechtlova škála hodnocení bdělosti a chování novorozence [11].
Cílem této studie bylo stanovit, zda změny elektrické kožní vodivosti mohou být považovány za objektivní metodu pro měření a hodnocení bolesti u novorozenců různého gestačního stáří v závislosti na bolestivém stimulu a porovnat tyto změny se změnami vybraných fyziologických parametrů v průběhu bolestivého stimulu.
MATERIÁL A METODIKA
Princip
Vlastní provedení metody spočívá v měření bolestivé odpovědi hodnocením jednotlivých parametrů SC pomocí algesimetru (přístroj k měření odpovědi na bolestivý podnět změnou vodivosti kůže). V prezentované studii byl použit přístroj MedStorm algesimetr, pracující na principu měření intenzity bolesti a jejího trvání pomocí změn vodivosti kůže, a to v reálném čase jako odpověď na bolestivý stimul. K měření se standardně využívá tří samolepicích AgCL elektrod: C – current (žlutá), R – reference (modrá) a M – measure (černá), které jsou umísťovány na kůži do míst s maximální hustotou potních žláz, to znamená na dlaň ruky u větších dětí a dospělých nebo plosku nohy u novorozenců.
Pro měření je rozhodující plocha kůže pod měřicí elektrodou M, neboť hodnota vodivosti reflektuje množství a aktivitu potních žláz pod touto elektrodou (obr. 1).
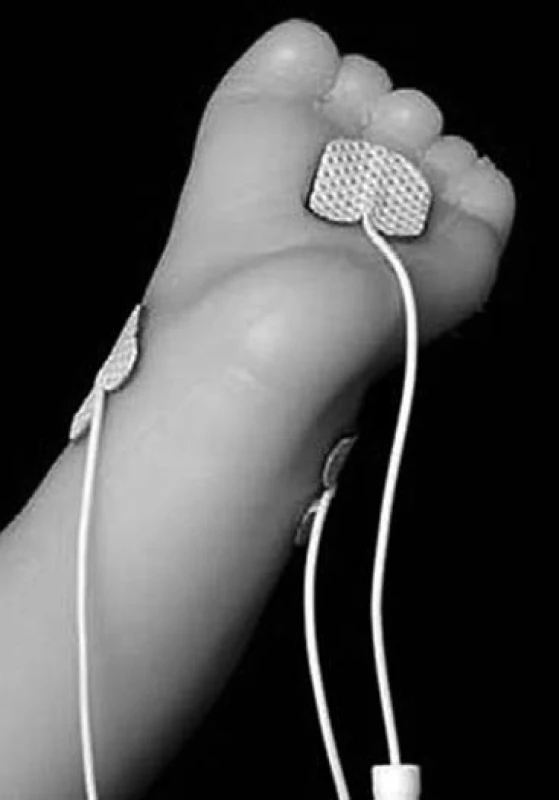
Příslušný software je možné využít u čtyř aplikačních skupin: k měření a objektivizaci bolesti a škodlivých podnětů zralých a nezralých novorozenců, pro pacienty v průběhu anestezie, pro měření a objektivizaci pooperační bolesti a škodlivých podnětů u pacientů na jednotkách intenzivní péče a v neposlední řadě pro vědecké účely. Přístroj umožňuje měření v modu pro novorozence, tzv. „preterm“ modus, který vyhodnocuje následující parametry: Peaks per second – Hz (PpS), Area under curve – ∝S/sec a Area small peaks – ∝S/sec (ASP). Jednotkou vodivosti je udáván jeden mikrosiemens (∝S/sec). Měřenou periodou je nejčastěji doba 15 sekund a aktualizace hodnot probíhá každou vteřinu. Je nutno vědět, že měřené parametry se mění s behaviorálním stavem dítěte. Bolestivý podnět vede k okamžitému zvýšení vodivosti kůže a zvýšení hodnoty PpS. Pokud bolestivý stimul ustoupí, okamžitě dochází ke snížení kožní vodivosti a poklesu PpS. Ostatní mody u novorozenců prozatím nebyly zkoumány.
Fyzikální princip
Měřicí jednotka zpracovává údaje z elektrod C a R a využívá zpětnovazebný mechanismus tak, aby na základě získaných údajů bylo zajištěno dodání konstantního a přesného střídavého napětí mezi elektrody M a R. Tento zpětný proud z měřicí elektrody je zaznamenáván a jeho hodnoty představují přímou informaci o vodivosti kůže. Software má schopnost odfiltrovat artefakty a šum ze zaznamenaných hodnot střídavého napětí tak, aby byly zaznamenány co nejpřesnější informace o vodivosti kůže. Systém je schopen měřit hodnoty vodivosti v rozsahu 1–200 µS s úrovní šumu pod 0,002 µS. Současně má měřicí jednotka schopnost zaznamenávat chyby v měření, jako jsou odlepení elektrody, interference s jinými elektrickými přístroji, případně použití elektrokoagulace. Přístroj je schválen Evropskou komisí pro vyhlášení shody (Declaration of conformity). O registraci FDA bylo zažádáno.
EXPERIMENTÁLNÍ USPOŘÁDÁNÍ
Studie se zaměřila na novorozence jednotky intenzivní péče (JIP), intermediární péče (IMP) a novorozence z oddělení rooming-in (RI) z novorozeneckého oddělení KNTB ve Zlíně. Všechny děti se narodily v první polovině roku 2010 na výše zmíněném pracovišti a před jejich zařazením do studie byl od rodičů získán informovaný souhlas s provedením měření. Měření bylo realizováno za různě dlouhou dobu po porodu. U novorozenců byly hodnoceny fyziologické a konceptuální parametry. Mezi hodnocené fyziologické parametry byla zařazena srdeční akce (AS), saturace hemoglobinu kyslíkem (SatO2) a krevní tlak (TK) měřený invazivní či neinvazivní metodou. Za konceptuální parametry považujeme v této studii gestační týden v době narození novorozence a charakteristiku bdělosti podle Prechtla. Podle gestačního týdne byli novorozenci rozděleni do následujících skupin: skupina A: 41 + 6 – 36 + 0 (19 novorozenců), skupina B: 35 + 6 – 32 + 0 (25 novorozenců), skupina C: 31 + 6 – 25 + 0 (13 novorozenců).
Podle Prechtla rozdělujeme novorozence do kategorií 1–5. Do 1. kategorie jsou zařazeny děti, které mají zavřené oči, pravidelně dýchají a nevyskytují se u nich pohyby, do 2. kategorie spadají děti, které mají rovněž zavřené oči, ale nepravidelně dýchají a jsou u nich patrné drobné pohyby. Do 3. kategorie patří děti s otevřenýma očima, ale bez pohybů, do 4. kategorie zařazujeme děti s otevřenýma očima a velkými pohyby a do poslední 5. kategorie spadají křičící, neklidné děti s otevřenýma očima. Abychom předešli zkreslení výsledků, byly pro účely této studie vybrány děti spadající pouze do 1. nebo 2. kategorie podle Prechtla v klidové fázi před zahájením měření.
Podstatou studie bylo měření bolestivé odpovědi hodnocením jednotlivých parametrů kožní vodivosti v modu „preterm“, tj. PpS, Area Under Curve a ASP. Bolestivým podnětem bylo porušení kožní integrity při venózním či kapilárním krevním odběru nebo při zavádění cévní linky. U pacientů na umělé plicní ventilaci nebyl hodnocen žádný jiný bolestivý parametr. Souběžně s měřením SC probíhalo měření fyziologických a konceptuálních parametrů (viz výše). Doba hodnocení SC po narození nehraje zásadní roli, avšak zvláště u nezralých novorozenců bylo měření realizováno až ve věku několika dnů, optimálně tehdy, kdy byly děti tlakově i cirkulačně stabilní.
Vlastní pokus probíhal ve třech následujících fázích:
Přípravná fáze:
Nejprve byla provedena identifikace pacienta. Po identifikaci pacienta následovalo jeho zařazení do příslušné skupiny podle výše uvedených konceptuálních parametrů (podle gestačního stáří a Prechtlovy škály hodnocení bdělosti). V průběhu přípravné fáze došlo k vyloučení škodlivých vlivů, které by mohly zkreslit výsledky měření, např. zpocení dítěte či aplikace některých léčiv. Následovala instalace elektrod na plosku nohy dítěte do definovaných oblastí. Elektrody i ploska nohy byly předem očištěny fyziologickým roztokem. Další příprava pacienta spočívala v instalaci saturačního čidla a manžety pro měření TK. Nakonec byly do softwarového programu MedStorm vloženy základní údaje o pacientovi – iniciály, datum měření, GT, věk po narození a skóre podle Prechtla. Přípravná fáze trvala zhruba 5 minut před bolestivým stimulem.
Klidová – předbolestivá fáze:
Další fáze trvá 5 minut před vlastním bolestivým podnětem. V této fázi probíhá první měření změn elektrické kožní vodivosti. Záznam MedStorm se natáčel po dobu 2 minut a po této době byl nakrátko přerušen. Paralelně se záznamem SC byly měřeny i parametry SatO2, AS, TK a byly zaznamenány případné změny skóre podle Prechtla. Zařazeny byly pouze děti s hodnocením Prechtl 1 či 2. AS i SatO2 byly zaznamenávány po dobu 2 minut. Na konci předbolestivé fáze, zhruba 2 minuty před vlastním bolestivým stimulem, byl pacientovi podán 25% roztok sacharózy v objemu 0,1–0,5 ml per os na dudlík nebo štětičku přesně v souladu s protokolem prevence bolesti na novorozeneckém oddělení KNTB. Přesný objem byl stanoven podle gestačního věku pacienta, a to 0,1 ml novorozencům gestačně nejmladším a 0,5 ml zralým donošeným novorozencům.
Bolestivá fáze:
Navazuje bezprostředně na fázi předcházející. Jedná se o fázi, ve které probíhá vlastní bolestivý podnět, jímž je krevní odběr či inzerce katétru. Současně se zahájením bolestivého stimulu je spuštěno i zaznamenávání změn SC pomocí MedStorm algesimetru. Měření SatO2 a AS jsou zaznamenávány ještě celou minutu po skončení odběru. V této fázi je rovněž zaznamenán TK: neinvazivní krevní tlak oscilometricky je hodnocen 1 minutu po skončení odběru, invazivní je pak zaznamenáván od počátku odběru až do doby 1 minuty po skončení odběru. Vyhodnocování Prechtlovy škály bdělosti probíhá na počátku odběru, v okamžiku skončení odběru a v čase za 1 minutu po skončení odběru. V době 1 minuty po skončení odběru jsou ukončena veškerá měření a je vypnut přístroj MedStorm. Následuje 3–5minutový interval po bolestivém stimulu, kdy dochází k uklidnění dítěte.
Klidová – pobolestivá fáze:
Fáze začíná v době 10 minut po bolestivém stimulu. Opět bylo na dobu 1 minuty spuštěno zaznamenávání změn SC. Současně s přístrojem MedStorm byly měřeny fyziologické parametry SatO2, AS a IBP. Jednorázově pak byla změřena hodnota krevního tlaku oscilometricky. Vždy je třeba vyhodnocovat Prechtlovu stupnici chování, neboť při změně chování či stavu dítěte se mění hodnoty PpS.
Matematicko-statistické vyhodnocení
Pomocí Q testu byly ze statistického šetření vyloučeni novorozenci, u nichž byl některý ze stanovených parametrů odchýlen. Grafy a základní statistické parametry byly stanoveny pomocí programu STATISTICA. Ve stejném programu byly vypočteny také hodnoty Spearmanova korelačního koeficientu. Ke stanovení vlivu jednotlivých parametrů na hodnotu ASP a PpS byl použit smíšený lineární model (Mixed Linear Model) v programu SAS pro Windows verze 9.1.2. Jako pevné efekty byly použity: gestační týden a interakce mezi fází pokusu a hodnotou Prechtlovy škály. Jako náhodný efekt byl použit vliv jedince.
VÝSLEDKY
Studie měla dva hlavní cíle. Prvním cílem bylo posouzení možnosti využít měření parametrů kožní vodivosti jako objektivní hodnotící kritérium vnímání bolesti u novorozenců. Druhým cílem pak bylo stanovení vztahu změn kožní vodivosti se změnami vybraných fyziologických parametrů. Do studie bylo zahrnuto celkem 57 novorozenců z novorozeneckého oddělení KNTB ve Zlíně, narozených v první polovině roku 2010. Jedním ze sledovaných parametrů byl vliv gestačního stáří, a proto byli novorozenci rozděleni do tří skupin A, B a C. Skupinu A tvořili novorozenci narození v období od 41 + 6 do 36 + 0 t.g., což představovalo celkem 19 dětí, skupinu B tvořili novorozenci narození v rozmezí od 35 + 6 do 32 + 0 t.g., jichž bylo 25, a skupinu C tvořili novorozenci narození v období od 31 + 6 do 25 + 0 t.g., celkem 13 dětí.
Ačkoliv existuje celá řada postupů pro hodnocení bolesti [16], jsou tyto metody pro non-verbální pacienty nepoužitelné. To se odráží i ve stanovisku International Association of Study of Pain – IASP, která za validní uznala jen některé z nich. Jedná se o metody, které implementují jak behaviorální, tak fyziologické parametry (NIPS, PIPP, CRIES, NFCS) a některé navíc zařazují i biologické a konceptuální faktory.
S ohledem na dříve publikované práce jsme pro účely této studie zvolili metodu hodnocení bolesti založené na měření změn elektrické kožní vodivosti v závislosti na bolestivém stimulu [9]. Principem metody je aktivace sympatického nervového systému, který se projeví zvýšením kožní vodivosti a je zaznamenáván jako peak, jehož amplituda vyjadřuje míru intenzity aktivovaného sympatiku [4, 6, 7]. Tato metoda hodnocení bolesti je uznávanou metodou pro hodnocení emocionálního stavu novorozence, se kterou úzce souvisí i Prechtlova škála pro hodnocení bdělosti a chování novorozence [11, 12].
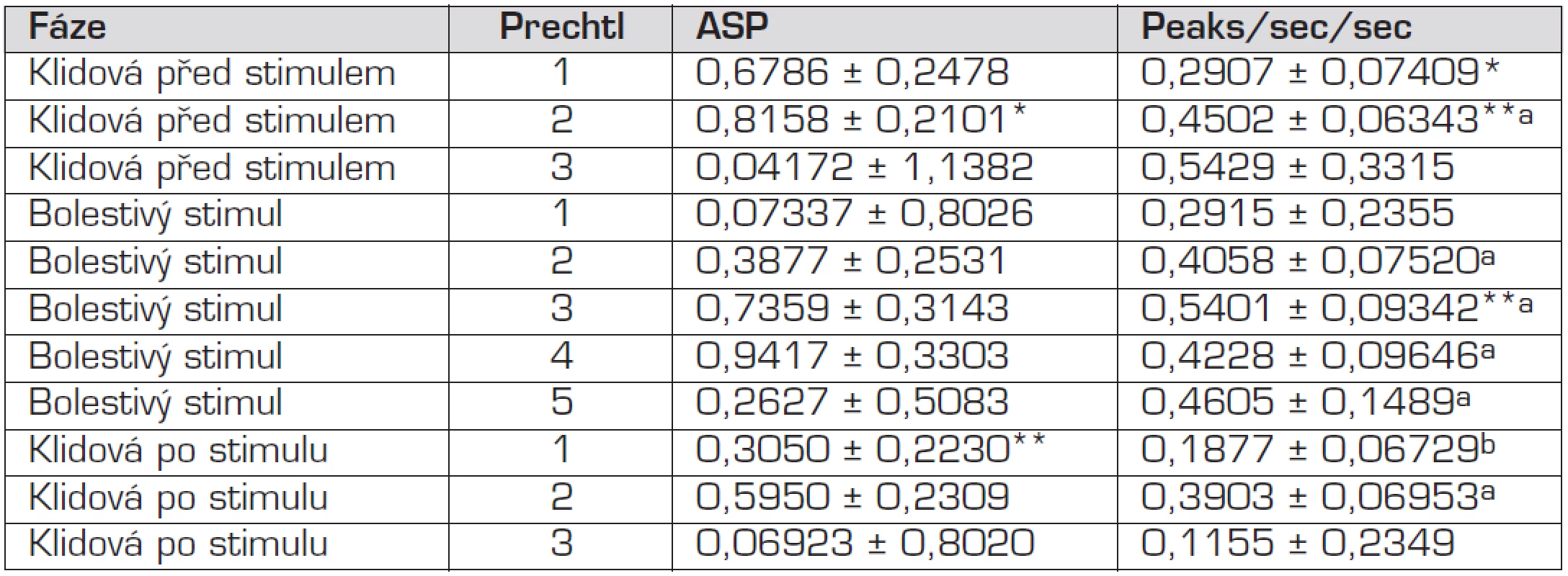
Výsledky popisující hodnoty Area Small Peaks (ASP) a Peaky za sekundu (PpS) vzhledem k jednotlivým fázím pokusu a fázi Prechla vyjadřuje tabulka 4 a grafy 1, 2. V klidové fázi před bolestivým stimulem (+ Prechtl 1) byly naměřeny průměrné hodnoty ASP 0,6786 a PpS 0,2907, zatímco pokud byl novorozenec před zahájením pokusu hodnocen stupněm Prechtl 2, byla průměrná naměřená hodnota ASP 0,8158 a PpS 0,4502. Stejná fáze pokusu v kombinaci s hodnocením Prechtl 3 však měla průměrné hodnoty ASP 0,04172, ale její směrodatná odchylka činila 1,1382. Tento vysoký rozdíl poukazuje na vysokou variabilitu získaných hodnot ASP mezi novorozenci. Průměrná hodnota PpS byla 0,5429. V druhé fázi pokusu, ve které probíhal bolestivý stimul a dítě bylo hodnoceno stupněm Prechtl 1, byla naměřena průměrná hodnota ASP 0,07337 a PpS 0,2915. Směrodatná odchylka u ASP zde činila 0,8026, což opět poukazuje na vysokou variabilitu v získaných hodnotách ASP mezi novorozenci. V kombinaci bolestivé fáze pokusu a stupně Prechtl 2 byly naměřeny průměrné hodnoty ASP 0,3877 a PpS 0,4058, zatímco u stupně Prechtl 3 činilo ASP 0,7359 a PpS 0,5401 a u stupně Prechtl 4 byly hodnoty ASP 0,9417 a PpS 0,4228. Při Prechtl 5 byla průměrná hodnota ASP nejnižší, a to 0,2627, a hodnota PpS 0,4605. Ve třetí fázi pokusu v kombinaci se stupněm Prechtl 1 byly naměřeny průměrné hodnoty ASP 0,5950 a PpS 0,1877, kdežto při stupni Prechtl 2 byla průměrná hodnota ASP 0,5950 a PpS 0,3903. Ve spojení klidové pobolestivé fáze a stupně Prechtl 3 byly získány průměrné hodnoty ASP 0,06923 a PpS 0,1155. Směrodatná odchylka u ASP, která činí 0,8020, znovu poukazuje na vysokou variabilitu v dílčích hodnotách ASP. Statisticky blížící se průkaznosti byly však pouze rozdíly mezi klidovou fází před stimulem při Prechtl 2 a klidovou fází po stimulu při Prechtl 1 u ASP, což svědčí o nízké vypovídací hodnotě tohoto ukazatele s ohledem na fázi a hodnotu Prechtla. O něco vyšší vypovídací hodnotu má s ohledem na výsledky prezentované v tabulce 4 PpS oproti ASP. Zde se vyskytují rozdíly blížící se statistické průkaznosti (p ≤0,1), a to u hodnot PpS mezi klidovou fází před stimulem a současné hodnotě Prechtl 1 a Prechtl 2 a také mezi klidovou fází před stimulem při hodnotě Prechtl 1 a bolestivou fází při hodnotě Prechtl 3. Za statisticky průkazné (p ≤0,05) můžeme považovat rozdíly mezi klidovou fází po bolestivém stimulu při současné hodnotě Prechtl 1 a následujícími: klidová fáze před stimulem (1. fáze) a Prechtl 2, bolestivá fáze (2. fáze) při hodnotě Prechtl 2, 3, 4 a 5 a klidovou fází po stimulu (3. fází) při hodnotě Prechtl 2. Z výsledků je tak patrné, že není možné stanovit bazální hodnotu kožní vodivosti.


DISKUSE
V písemnictví existuje řada prací, zaměřujících se na problematiku percepce bolesti u dětí. Storm v roce 2000 publikuje práci, provedenou na dvaceti předčasně narozených novorozencích (gestační týden 29–35) [3]. Autorka zkoumala parametry kožní vodivosti v závislosti na vzniku bolestivého stimulu, jímž byl odběr krve z paty novorozence. Měření probíhalo v rozmezí 1. a 25. dne po porodu. Stejně jako v předkládané studii, i studie provedená Storm a kol. prokazuje zvyšující se frekvenci PpS během bolestivého stimulu. Před bolestivým stimulem a po něm se PpS nevyskytovaly. To odpovídá našim výsledkům prezentovaným v grafu 1. Storm ve své studii stejně jako my nedokázala stanovit bazální hodnotu SC, pouze popsala zvýšení bazální linie v průběhu bolestivého stimulu, která přetrvávala i v klidové fázi po stimulu. Tyto výsledky Storm popisuje i v jedné z jejích dalších prací z roku 2008 [8]. Stejné závěry ve své práci uvádí i autoři Harrison, Boyce, Loughnan et al. [27], kteří kvůli velké variabilitě ve změnách kožní vodivosti doporučují další studie. Na variabilitu poukazuje i další studie autorů Hellerud a Storm [28], kteří porovnávali změnu kožní vodivosti i chování novorozenců předčasně narozených i rozených v termínu. Ve své práci popisují vliv bolestivé i taktilní stimulace na změny v kožní vodivosti. Ve výsledcích své práce rovněž potvrzují zvýšení kožní vodivosti v průběhu bolestivého stimulu.
Sledovaným konceptuálním parametrem v této studii byl i gestační věk. Nezralí novorozenci jsou také schopni vnímat bolest [20]. Vedení bolestivých podnětů je velmi dobře vyvinuto jak u zralých, tak i nezralých novorozenců. U nezralých novorozenců však nejsou zcela vyvinuty modulační mechanismy, díky kterým se novorozenec vyrovnává s bolestivými stimuly [21, 22]. Bolestivé stimuly u nezralých novorozenců vedou ve svém důsledku k hyperalgeziím či allodyniím [23, 24, 25]. Pouze minimum hodnotících škál bolesti se ovšem specifikuje na bolest předčasně narozených dětí [19].
Tabulka 1 popisuje vliv gestačního stáří na reakci na bolestivý stimul. Zde jsou opět popisovány parametry ASP a PpS. Ve skupině A byla naměřena průměrná hodnota ASP 0,5310 a PpS 0,4378, kdežto ve skupině B tvořila průměrná hodnota ASP 0,5512 a PpS 0,3583 a ve skupině C činila průměrná hodnota ASP 0,2160 a PpS 0,3117. V uvedených výsledcích se nevyskytl žádný statisticky průkazný rozdíl, z čehož vyplývá, že gestační věk nemá vliv na hodnoty ASP a PpS. Autorka Storm se ve své studii z roku 2000 rovněž zaměřuje na vliv gestačního stáří. Ve studii popisuje pozitivní signifikantní asociace mezi parametry gestačního stáří a počtem a amplitudou peaků. V souladu s naší studií však tvrdí, že neexistuje významný efekt mezi gestačním stářím a PpS v průběhu bolestivého stimulu. Stejně tak gestační stáří podle Storm nepůsobí ani na bazální úroveň kožní vodivosti a ani neovlivňuje behaviorální stav novorozence v průběhu bolestivého stimulu.

Při klasifikaci bolesti je vhodné využívat i některé fyziologické parametry [19]. Nejvíce užívanými fyziologickými parametry jsou hodnoty akce srdeční, krevního tlaku, kyslíkové saturace, srdeční frekvence, palmárního pocení, svalového napětí, nitrolebního tlaku a stav spánku a bdění [29, 30, 31].
Srovnání parametrů elektrické kožní vodivosti (SC) s vybranými fyziologickými parametry nebylo dosud studováno. Z výsledků je patrné, že nebyly nalezeny korelace mezi hodnotami fyziologických parametrů a hodnotami SC, a to ani u posunu parametrů kožní vodivosti mezi jednotlivým fázemi (tab. 2), ani mezi fázemi samotnými (tab. 3). Za statisticky významné můžeme označit pouze korelace mezi hodnotami ASP a PpS, nikoliv však vůči fyziologickým parametrům. Ve fází 2 – 1 činí vzájemná korelace mezi ASP a PpS 0,51, ve fázi 2 – 3 byla změřena korelace 0,46 a ve fázi 1 – 3 činila tato korelace hodnotu 0,62.
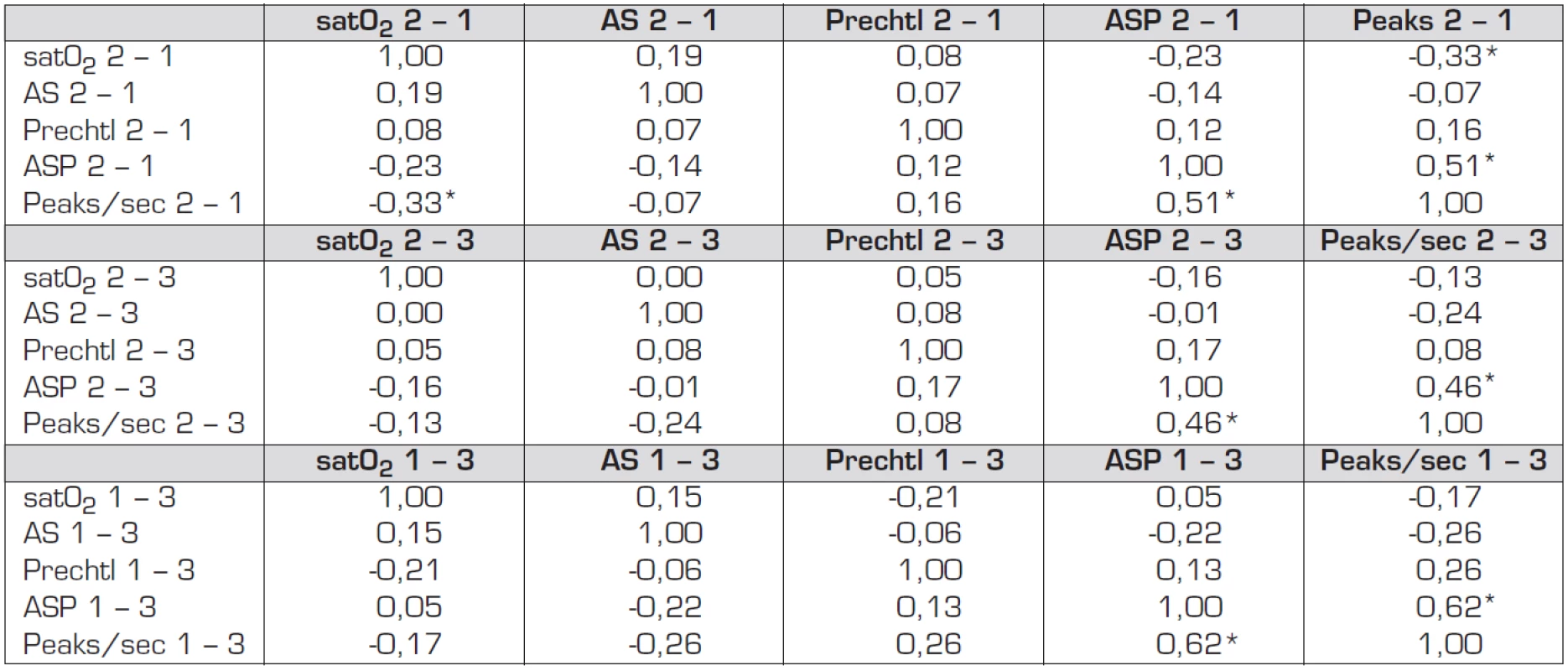
Jako statisticky významnou můžeme označit zápornou hodnotu korelace mezi parametry SatO2 a PpS, jejíž hodnota je -0,33 na hladině průkaznosti 0,05, avšak pouze v posunu mezi fázemi 2 a 1 (tab. 2).
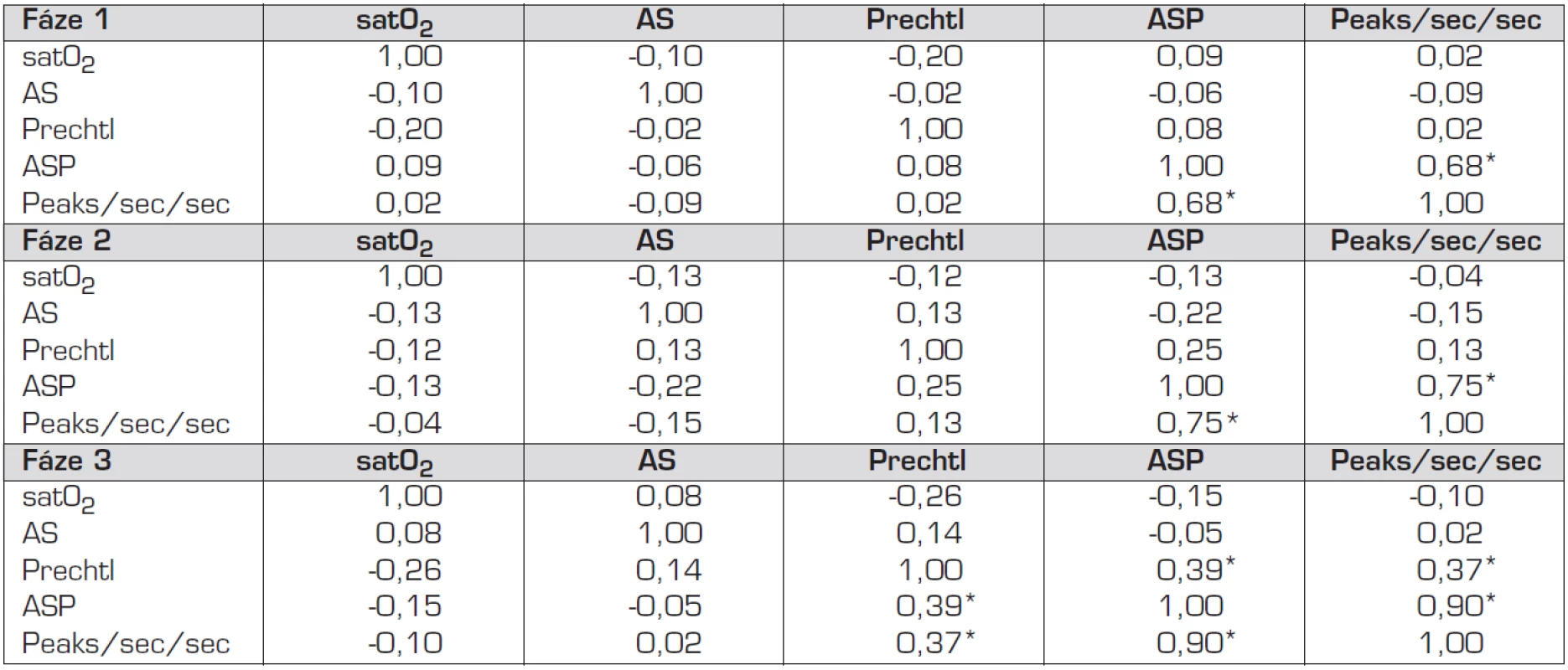
Statisticky průkazné korelace se vyskytly pouze mezi hodnotami SC vzájemně, tedy mezi parametry ASP a PpS. Při posunu těchto parametrů mezi jednotlivými fázemi (tab. 2) byla vzájemná korelace ve fázi 2 – 1 0,51, ve fázi 2 – 3 představovala hodnotu 0,46 a ve fázi 1 – 3 činila vzájemná korelace hodnotu 0,62. Vzhledem k jednotlivým fázím pokusu, které popisuje tabulka 3, se vyskytly statisticky významné korelace opět pouze mezi parametry SC vzájemně. Ve fázi 1 činila korelace mezi ASP a PpS 0,68, ve druhé fázi představovala hodnotu 0,75 a ve třetí fázi hodnotu 0,90. Ve třetí fázi existuje statisticky významná korelace i mezi parametry SC a hodnotami škály podle Prechtla. Statisticky významná korelace na hladině průkaznosti 0,05000 mezi parametry PsP a Prechtl představovala hodnotu 0,37 a mezi parametry ASP a Prechtl činila 0,39.
Storm ve své studii tvrdí (2000), že behaviorální stav novorozence zrcadlí zvyšující se počet PpS v průběhu bolestivého stimulu.
ZÁVĚR
Studie se zabývá objektivizací hodnocení bolestivého stimulu u novorozenců a nově také vztahem kožní vodivosti a vybraných fyziologických parametrů. Výsledky naznačují, že při hodnocení bolesti u novorozenců je nutno dbát na individuální posouzení, protože ani objektivní hodnota kožní vodivosti neumožňuje obecně platné stanovení bazální hodnoty. Vyšší vypovídací hodnotu má parametr PpS než ASP. Z výsledků dále vyplývá, že kožní vodivost není ovlivněna fázemi pokusu ani gestačním stářím novorozence.
V průběhu pokusu rovněž nebylo možno stanovit bazální hodnoty kožní vodivosti, neboť ani v klidové fázi před bolestivým stimulem nevykazovaly hodnoty nulovou hladinu. Získaná data byla validní pouze u jednotlivých novorozenců. Změny v kožní vodivosti jsou tedy pravděpodobně ovlivněny dalšími faktory, nejen bolestivým podnětem.
Z předkládané studie vyplývá, že hodnocení bolesti u novorozenců pouze metodou měření změn v elektrické kožní propustnosti nemůže v plné šíři nahradit zavedené postupy a naopak je nutno zohlednit komplexnost vnímání bolesti kombinací více metod. Vztah mezi fyziologickými parametry a parametry kožní vodivosti nebyl ve studii prokázán a není tedy možné využívat je jako korelující faktor. Na základě získaných výsledků bude studie rozšířena o další metodu hodnocení bolesti podle výrazu obličeje – mimiky a faciálních změn – podle škály NFCS. Tato kombinace se v současnosti jeví jako nejcitlivější indikátor pro posouzení bolesti.
Došlo: 5. 4. 2011
Přijato 17. 8. 2011
Prim. MUDr. Jozef Macko
Novorozenecké oddělení
Krajská nemocnice Tomáše Bati, a.s.
Havlíčkovo nábř. 600
762 75 Zlín
e-mail: macko@bnzlin.cz
Sources
1. Storm H. Changes in skin conductance as a tool to monitor nociceptive stimulation and pain. Curr Opin Anaesth 2008; 21 : 796–804.
2. Hulletee B, Chambers N, Preuss J, et al. Monitoring electrical skin conductance: A tool for the assessment of postoperative pain in children. Anestesiology 2009; 3 : 513–517.
3. Storm H. Skin conductance and the stress response from heel stisk in preterm infants. Arch Dis Child Fetal Neonatal Ed 2000; 83: F143–F147.
4. Gjerstad AN, Wagner K, Henrichsen T, Storm H. Skin conductance versus the modified comfort sedation score as a measure of discomfort in artificially ventilated children. Pediatrics 2008; 122: e848–e853.
5. Edelberg R. Electrical properities of the skin. In: Brown CC, ed. Methods in Psychophysiology. Baltimore, MD: Williams&Wilkins, 1967 : 1–53.
6. Hagbarth KE, Halin RG, Hongell A, et. al. General characteristics of sympatethic activity in human skin nerves. Acta Physiol Scand 1972; 84(2): 164–176.
7. Wallin BG, Sundlöf G, Delius W. The effect of karotid sinus nerve stimulations on muscle and skin nerve sympathetic activity in man. Pflugers Arch 1975; 358(2): 101–110.
8. Storm H, Shafiei M, Myre K, Raeder J. Palmar skin conductance compared to a developed stress score and to noxious and awakeness stimuli on patiens in anaesthesia to study the sensitivity and specificity of skin conductance. Acta Anaesth Scand 2005; 49 : 798–804.
9. Storm H, Skorpen F, Klepstad P, et. al. Genetic variations influence the skin conductance response to nociceptive pain in anesthetized patients. Abstract accepted ISAP, Orlando; 2008.
10. Gjerstad AC, Storm H, Wallin G. Evaluation of the skin conductance method by using microneurographi [abstract]. Chicago: ISAP; 2006.
11. Prechtl HFR. The behavioural states of the newborn infant (a review). Brain Res 1974 August; 76(2): 185–212.
12. Gladman G, Chiswick ML. Skin conductance and arousal in the newborn infant. Arch Dis Child 1990; 65 : 1063–1066.
13. Macefield VG, Wallin BG. The change in behavior of single sympathetic outflow in normotensive human sweat glands. J Auton Nerv Syst 1996; 14 : 277–286.
14. Lindberg L, Wallin G. Sympathetic skin nerve discharges in relation to amplitude of skin resistence response. Psychophys 1981; 18(3): 268–270.
15. Kim EJ, Buschmann MBT. Reliability and validity of the faces pain scale with older adults. Intern J Nurs Stud 2006; 43 : 456–477.
16. Porter FL, Wolf CM, Miller JP. The effect of handling and immobilization on the response to acute pain in newborn infants. Pediatrics 1998 Dezember; 102(6): 1383–1389.
17. Thompson DG. Utilizing an oral sucrose solution to minimize neonatal pain. J Spec Pediat Nurs 2005; 10(1): 3–10.
18. Mc Kechnie L, Levene M. Procedural pain guidelines for the newborn i the United Kingdom. J Perinatol 2008; 28 : 107–111.
19. Macko J. Procedurální bolest novorozence – možnosti prevence a tišení. Čes-slov Pediat 2010; 65(10): 584–591.
20. Grunau RE, Oberlander TF, Whitfield MF, Fitzgerald C, Lee SK. Demographis and therapeutic determinantns of pain reactivity in very low birth weight neonates at 32 weeks postconceptional age. Pediatrics 2001; 107 : 105–112.
21. Holsti L, Grunau RE, Whitfield MF. Behavioural responsiveness to pain are heightened after clustered care in preterm infants born between 30 and 32 weeks gestational age. Clin J Pain 2006; 22(9): 757–764.
22. Morison SJ, Grunau RE, Tim F, Oberlander MF. Whitfield-relations between behavoural and cardiac autonomic reactivity to acute pain in preterm infants. Clin J Pain 2001 December; 17(4): 350–358.
23. O´ Rourke D. The measurement of pain in infants, children and adolescents: from policy to practice. Phys Ther 2004 Jun; 84(6): 560–570.
24. Lindh V, Wicklund U, Hakansson S. Heel lancing in term newborn infants: an evaluation of pain by frequency domain analysis of heart rate variability. Pain 1999; 80 : 143–148.
25. Hummel P, van Dijk M. Pain assessment, current status and challenges. Semin Foetal Neonatal Med 2006; 11 : 237–245.
26. Stevens B, Gibbins S, Franck LS. Treatment of pain in the neonatal intensive care unit. Pediatr Clin North Am 2000 Jun; 47(3): 633–650.
27. Harrison D, Boyce S, Loughnan P, Dargaville P, Storm H, Johnston L. Skin conductance as a measure of pain and stress in hospitalised infants. Early Hum Dev 2006; 82(9): 603–608.
28. Hellerud BC, Storm H. Skin condutance and behaviour during sensory stimulation of preterm and term infants. Early Hum Dev 2002; 70(1–2): 35–46.
29. Bellieni C. Pain definitions revised : newborns not only feel pain, they also suffer. Eth and Med Spring 2005; 21(1): 5–9.
30. Ranger M, Johnston CC, Anand KJS. Current controversie regarding pain in neonates. Semin Perinatol 2007; Sep 07. pp 283-28.
31. Stevens BJ, Johnston CC. Physiological responses of premature infantns to a painful stimulus. Nurs Res 1994; 43(4): 226–231.
Labels
Neonatology Paediatrics General practitioner for children and adolescentsArticle was published in
Czech-Slovak Pediatrics

2011 Issue 6
- What Effect Can Be Expected from Limosilactobacillus reuteri in Mucositis and Peri-Implantitis?
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- The development of neonatal care and evaluation of the first five years experience in surgery of cleft lip in the neonatal period
- Changes in electrical conductivity of the skin due to painful stimuli in newborns of different gestational categories and comparison with changes in selected physiological parameters
- Necrotizing enterocolitis in full-term neonates. Case report and review of the literature
- Off-label prescribing in pediatrics
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Necrotizing enterocolitis in full-term neonates. Case report and review of the literature
- Off-label prescribing in pediatrics
- Changes in electrical conductivity of the skin due to painful stimuli in newborns of different gestational categories and comparison with changes in selected physiological parameters
- The development of neonatal care and evaluation of the first five years experience in surgery of cleft lip in the neonatal period
