Rizikové faktory ovlivňující výsledek léčby novorozenců s hypoxicko-ischemickou encefalopatií léčených řízenou hypotermií
Risk factors affecting the outcome of newborns undergoing therapeutic hypothermia for hypoxic-ischemic encephalopathy
Aim of the study:
To evaluate the role of potential risk factors and biochemical parameters in the outcome, at 24 months of age, of newborns treated by therapeutic hypothermia for stage II and III hypoxic-ischemic encephalopathy.
Material and methods:
This prospective study comprised 51 newborns, of gestation age from 36–41 weeks, who were undergoing hypothermia treatment for stage II and III hypoxic-ischemic encephalopathy. Various risk factors were noted and monitored including birthplace, time hypothermia treatment was initiated, birth weight, Apgar score at 5 and 10 minutes of life, occurrence of seizures, serum lactate values, and lactate dehydrogenase. At 24 months, the patients were assessed and consequently divided into two groups. Patients placed in one group exhibited normal psychomotor development and were therefore judged to have positive treatment outcomes; the other group comprised those who displayed severely compromised motor coordination or sensory impairment, or even died. In each group specific risk factors were subsequently evaluated to determine their influence on treatment outcome.
Results:
Seven infants died during the course of the study. Of the remaining 44 examined at 2 years old, 34 exhibited positive psychomotor development, with adverse findings in 10 cases. The risk factors associated with adverse treatment outcome were noted to be low Apgar score at 5 and 10 minutes, seizures resistant to treatment, initial pH values, base excess, and lactate and lactate dehydrogenase in arterial blood at the time of admission. While both patient groups saw a significant reduction in lactate values over the course of hypothermia treatment, it was nevertheless clear that there were significant statistical differences in observed values.
Conclusion:
Elevated serum lactate values, lactate dehydrogenase early in the period post-asphyxia, and seizure activity resistant to pharmacotherapy are indicative of adverse outcomes in newborns receiving therapeutic hypothermia for stage II and III hypoxic-ischemic encephalopathy.
Keywords:
lactate – hypoxic-ischemic encephalopathy – therapeutic hypothermia – outcome – seizures
Authors:
R. Poláčková 1; J. Kučová 2,3; Z. Švagera 4,5; L. Kantor 6; D. Šalounová 7
Authors‘ workplace:
Katedra dětského lékařství a neonatologie, Lékařská fakulta Ostravské univerzity, Ostrava
1; Oddělení neonatologie, Fakultní nemocnice Ostrava
2; Ústav ošetřovatelství a porodní asistence, Lékařská fakulta Ostravské univerzity, Ostrava
3; Ústav laboratorní diagnostiky, Fakultní nemocnice Ostrava
4; Katedra biomedicínských oborů, Lékařská fakulta Ostravské univerzity, Ostrava
5; Novorozenecké oddělení, Fakultní nemocnice a Lékařská fakulta Univerzity Palackého, Olomouc
6; Katedra matematických metod v ekonomice, Vysoká škola báňská – Technická univerzita, Ostrava
7
Published in:
Čes-slov Pediat 2019; 74 (1): 30-40.
Category:
Original Papers
Overview
Cíl studie:
Vyhodnotit vliv možných rizikových faktorů a biochemických parametrů na outcome novorozenců s hypoxicko-ischemickou encefalopatií II.–III. stupně (léčených řízenou hypotermií) ve 24 měsících věku.
Metodika:
V prospektivní studii byly u 51 novorozenců (gestační stáří 36 až 41) s hypoxicko-ischemickou encefalopatií II.–III. stupně, léčených řízenou hypotermií, sledovány rizikové faktory (místo narození, čas zahájení řízené hypotermie, porodní hmotnost, skóre podle Apgarové v 5. a 10. minutě života, výskyt křečí, sérová hodnota laktátu a laktátdehydrogenázy aj.). Ve 24 měsících věku byli pacienti rozděleni do 2 skupin podle výsledku léčby – outcome příznivý (adekvátní neurologický vývoj) a nepříznivý (závažné motorické nebo smyslové postižení, event. úmrtí). Poté byla v jednotlivých skupinách vyhodnocena závislost výsledku léčby na sledovaných rizikových parametrech.
Výsledky:
Sedm dětí v průběhu studie zemřelo. U přeživších 44 dětí byl ve věku dvou let shledán příznivý vývoj ve 34 případech, v 10 případech byl nález nepříznivý. Za rizikové faktory s nepříznivým vlivem na výsledek léčby byly označeny nízké Apgar skóre v 5. a 10. minutě, křeče rezistentní na léčbu, vstupní hodnoty pH, base excess, laktátu i laktátdehydrogenázy v arteriální krvi při příjmu pacienta. U novorozenců v průběhu řízené hypotermie sice nastal významný pokles hodnot laktátu v obou skupinách, nicméně mezi skupinami byl zřejmý, statisticky významný rozdíl v jeho aktuálně naměřených hodnotách.
Závěr:
Vyšší sérová hodnota laktátu, laktátdehydrogenázy v časném postasfyktickém období a křečová aktivita rezistentní na farmakoterapii u novorozenců s hypoxicko-ischemickou encefalopatií II.–III. stupně léčených řízenou hypotermií jsou spjaty s nepříznivým outcome.
Klíčová slova:
hypoxicko-ischemická encefalopatie – řízená hypotermie – outcome – laktát – křeče
ÚVOD
Porod je proces, při kterém plod prochází porodním kanálem ven z těla matky. Přestože během této „cesty“ urazí sotva několik desítek centimetrů, pro kvalitu jeho dalšího života je to jeden z nejnebezpečnějších úseků, kterými musí za celou dobu své existence projít. Přes velké pokroky v perinatologii a neonatologii v posledních desetiletích zůstává asfyxie závažným problémem, který má nezanedbatelný vliv na novorozeneckou mortalitu. Svými důsledky přesahuje novorozenecké období a výrazně navyšuje závažnou dětskou morbiditu.
V roce 2000 většina zemí světa ratifikovala Rozvojové cíle tisíciletí (MDGs), ve kterých zaměřila svou pozornost mimo jiné i na redukci mortality u dětí. Od té doby došlo k nejvýznamnějšímu snížení úmrtnosti u dětí ve věku 1–4 roky díky pokroku v léčbě infekčních onemocnění. Podíl úmrtí v novorozeneckém věku (do 28. dne života) činil v této době 37 % dětí mladších pěti let [1]. V roce 2013 zemřelo na celém světě 6,3 milionu dětí do 5 let věku, přičemž 2,761 milionu (44 %) z nich zemřelo právě v novorozeneckém období. Za druhou nejčastější příčinu úmrtí (hned po nezralosti) byla označena perinatální asfyxie (PA), která se na úmrtnosti podílela 10,5 %, což v přepočtu na jedince činilo 662 000 dětí. Každou hodinu tak v důsledku PA zemřelo na světě cca 75 dětí [2].
V České republice se ročně narodí přibližně 100 000 dětí, z nichž 0,5–2 % může být zasaženo perinatální asfyxií a přibližně u 0,7 ‰ se vyvine středně závažná nebo těžká hypoxicko-ischemická encefalopatie (HIE). Incidence HIE za posledních 20 let se téměř nezměnila a výsledky léčby zůstávaly dlouhodobě neuspokojivé. Dříve byla péče o asfyktické novorozence omezena pouze na symptomatickou a podpůrnou terapii, v roce 2010 však byly publikovány dvě metaanalýzy multicentrických studií, které statisticky jednoznačně potvrdily pozitivní neuroprotektivní efekt řízené hypotermie (TH), při které je novorozenec řízeně podchlazen na cílovou teplotu
33,5 ± 0,5 °C na dobu 72 hodin. Důležitým prognostickým faktorem pro výsledek léčby HIE je aktuální klinický stav novorozence, hodnocený podle Sarnat à Sarnat skóre, na jehož podkladě lze rozlišit tři stupně HIE – I. stupeň (mírná), II. stupeň (středně závažná) a III. stupeň (těžká) [3]. Mírná HIE vzhledem ke své příznivé prognóze není indikována k TH. HIE II.–III. stupně může být po splnění indikačních kritérií indikována k léčbě TH, v ČR byla tato léčba poprvé poskytnuta v roce 2007. Její implementace a postupné rozšíření do všech perinatologických center (PC) v ČR se úspěšně odráží ve výsledcích léčby HIE, kdy od roku 2000 do roku 2016 došlo postupně k poklesu mortality v důsledku HIE II.–III. stupně z 31 % na 17 % [4].
Metaanalýza publikovaná v Cochrane Library z roku 2013 vyhodnotila 11 randomizovaných kontrolovaných studií zahrnujících 1505 donošených a lehce nedonošených novorozenců s HIE II. a III. stupně, kteří byli randomizováni do skupiny normotermické nebo hypotermické. Hypotermie byla spojena s prokazatelným snížením úmrtí nebo incidence (středně závažného nebo závažného) psychomotorického defektu ve věku 18 měsíců (RR 0,75; 95% CI 0,68 až 0,83; NNT 7/5 až 10/; 1344 novorozenců v 8 studiích). Léčba TH byla spojena s redukovanou mortalitou (RR 0,75; 95% CI 0,64 až 0,88, z 1468 novorozenců v 11 studiích) a snížila riziko neurovývojového handicapu ve skupině přeživších (RR 0,77, 95% CI 0,63 až 0,94; 917 novorozenců v 8 studiích). Z této metaanalýzy vyplynulo, že TH je pro novorozence s diagnózou HIE II. až III. stupně přínosná [5]. Pokud je však u dítěte ještě v době hospitalizace odhalen abnormální neurologický nález, je jeho prognóza zpravidla nepříznivá [6]. Mezi nejčastější nepříznivé důsledky HIE patří dětská mozková obrna, vývojová retardace, epileptický syndrom nebo postižení smyslových orgánů (zrak, sluch), které se každoročně celostátně vyhodnocují v rámci pozdní morbidity.
HIE svými důsledky celoživotně ovlivňuje funkci dítěte nejen v rodině, škole a zaměstnání, jedinec mnohdy trvale vyžaduje nezanedbatelnou podporu zdravotního i sociálního systému celé společnosti. TH je doposud jediným prokazatelným pokrokem v léčbě HIE za posledních 20 let.
SOUBOR A METODIKA
Soubor této prospektivní studie zahrnuje všechny hospitalizované novorozence s diagnózou HIE II.–III. stupně (celkem 51 dětí), léčených v období 7/2008–7/2014 v PC Ostrava metodou TH. Cílem studie bylo objasnit vliv sledovaných rizikových faktorů a biochemických parametrů na výsledek léčby HIE metodou řízené hypotermie.
Padesát novorozenců prodělalo peripartální asfyxii, jedno dítě utrpělo časnou postpartální asfyxii. U 35 (68,6 %) dětí byla diagnostikována středně závažná HIE (II. stupeň) a u 16 (31,4 %) dětí těžká HIE (III. stupeň). Z tohoto souboru bylo 33,3 % narozeno přímo v PC, 66,6 % bylo převezeno z regionálních nemocnic Moravskoslezského regionu (Ostrava - Fifejdy, Ostrava - Vítkovice, Opava, Krnov, Havířov, Karviná, Třinec, Frýdek, Nový Jičín), popř. z jiného PC, nedisponujícího přístrojovým vybavením pro TH. Pacienti byli k TH indikováni v souladu s doporučeným postupem České neonatologické společnosti (ČNeoS) ČLS JEP [7]. K vyhodnocení amplitudového EEG (aEEG) byl používán monitor CFM 6000 Olympic (jehlové elektrody), TH byla poskytována ochlazovacím zařízením Gaymar Medi-Term III, cílovou byla teplota tělesného jádra 33,5 ± 0,5 °C.
Novorozenci byli narozeni mezi 36.–41. gestačním týdnem, s porodní hmotností od 1810 do 3995 gramů, 52,9 % dětí bylo porozeno vaginálně, 47,1 % císařským řezem. Všichni novorozenci splnili indikační kritéria pro léčbu řízenou hypotermií, která byla realizována po dobu 72 hodin. V rámci studie byla od přijetí pacienta do PC pravidelně monitorována acidobazická rovnováha, laktát, glykémie vždy při příjmu pacienta a následně ve 3., 6., 12., 24. a 36. hodině života (± 30 minut) a laktátdehydrogenáza pouze při příjmu pacienta do PC. Vzorky krve (objem 100 μl) byly odebírány z arterie (pupeční nebo končetinové) a vyšetřovány na totožném bed-side analyzátoru Radiometer ABL800 flex bezprostředně po odběru, pouze laktátdehydrogenáza byla měřena spektrofotometricky podle pokynů výrobce na přístroji AU 5810 analyzer (Beckman Coulter, Inc., Brea, CA), variační koeficient metody nepřesáhl 3,6 %. Horní hranice laktátu byla empiricky stanovena na 4 mmol/l. Po celou dobu TH byly u novorozenců sledovány základní životní funkce a bylo trvale monitorováno aEEG, které umožňovalo zachytit i subklinicky probíhající křeče.
V průběhu studie 7 novorozenců zemřelo, přeživších 44 pacientů bylo po propuštění sledováno do dvou let věku, kdy byl vyhodnocen jejich zdravotní stav. Nozologické jednotky u níže uvedených sledovaných postižení byly validovány příslušným lékařem – specialistou (neurolog, ORL, oftalmolog, neonatolog apod.):
- DMO – trvalé neprogredující postižení pohybu nebo držení těla vzniklé poškozením mozku v perinatálním období.
- Těžké poškození zraku – těžká slabozrakost, zbytky zraku, praktická slepota, slepota.
- Senzorineurální hluchota – definována jako ztráta sluchu 40 dB a více při jakékoliv frekvenci v pásmu 0,5–4 kHz na lepším uchu.
- Těžká porucha růstu – tělesná výška 2 SD od průměru populace.
- Epileptický syndrom – záchvatovité onemocnění obtížně korigovatelné nebo nekorigovatelné příslušnou terapií, vzniklé v neonatálním nebo raném dětském věku v souvislosti s perinatálním poškozením CNS.
- Těžká retardace vývoje – vývojový kvocient 2 SD od průměru populace. Nejvíce rozšířenou metodikou je škála dle Bayleyové (Bayley scale infant and toddlers development, BSID), která vyhodnocuje mentální (MDI) a psychomotorický (PDI) vývojový index, přičemž za závažnou abnormitu je považována hodnota pod 70 bodů. Vzhledem k tehdejší nedostupnosti erudovaného psychologa v BSID byla vývojová retardace dítěte hodnocena dětským neurologem.
K hodnocení hrubé motoriky byl použit systém GMFCS (Gross Motor Function Classification System), který zahrnuje pět stupňů klasifikace hrubé motoriky, pro dětskou mozkovou obrnu (DMO) spočívá v hodnocení samostatné hybnosti s důrazem na sed, přesun a lokomoci. Rozlišení mezi jednotlivými stupni je dané mírou funkčního omezení, potřebou lokomočních prostředků (např. chodítka), zásadně neřeší kvalitu pohybu [8]. Děti byly ve dvou letech věku rozděleny do dvou skupin. Skupina s nepříznivým outcome zahrnovala pacienty, kteří zemřeli nebo přežili s handicapem (GMFCS level II–V, těžká mentální retardace, porucha sluchu, porucha zraku, epilepsie, porucha růstu). Příznivý outcome vykazovalo 66,7 % léčených pacientů, u 33,3 % byl outcome hodnocen jako nepříznivý. Tabulka 1 zobrazuje popisné charakteristiky souboru v těchto skupinách pacientů. Následně byla statisticky hodnocena závislost výsledku léčby na vybraných sledovaných charakteristikách a zvolených biochemických parametrech.
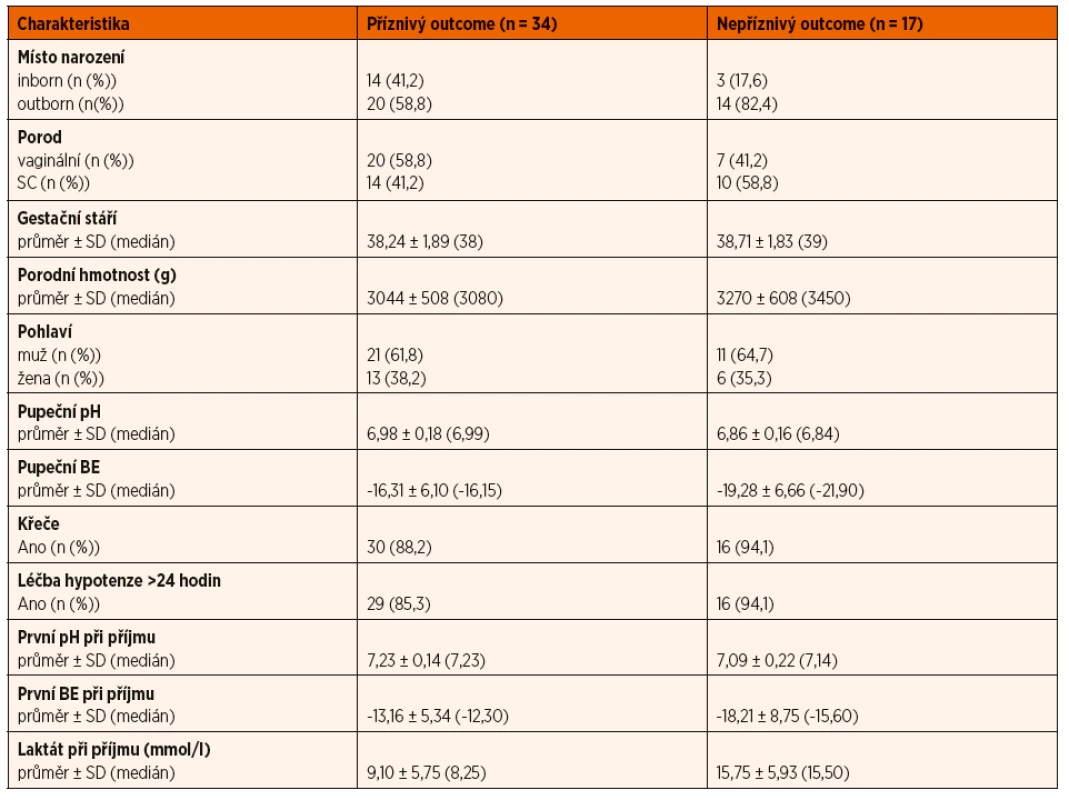
K vyhodnocení byly použity testy: χ-kvadrát, mediánový test, t-test, Fisherův exaktní test a Mannův-Whitneyův test. Data byla zpracována statistikem pomocí softwaru IBM SPSS, verze 24. Statistické testy byly provedeny na hladině významnosti 0,05.
VÝSLEDKY
Místo narození, zahájení řízené hypotermie
V souboru dat bylo z celkového počtu 51 dětí 17 (33,3 %) porozeno v PC, ostatních 34 (66,7 %) novorozenců bylo dovezeno z regionu. Příznivý outcome ve 2 letech věku vykazovalo 14 dětí (82,4 %) porozených v PC a 20 dětí (58,8 %) dovezených z periferních nemocnic. Léčba TH byla zahajována u novorozenců porozených v PC průměrně ve stáří 2 hodiny 29 minut (maximální interval: 0–4 hodiny života), zatímco u novorozenců dovezených z regionu byla TH započata průměrně ve věku 4 hodiny 20 minut (maximální interval: 2–6 hodin).
Data byla vyhodnocena pomocí χ-kvadrát testu (p = 0,093), takže nebyla shledána závislost mezi místem narození a výsledkem léčby.
Porodní hmotnost
Porodní hmotnost novorozenců ve sledovaném souboru se pohybovala od 1810 g do 3995 g. Obě skupiny, tj. skupina s příznivým i nepříznivým výsledkem léčby, byly vyhodnoceny mediánovým testem (p = 0,060). Mediánem ve skupině s příznivým výsledkem byla porodní hmotnost 3080 g oproti 3450 g ve skupině, kde byl výsledek hodnocen jako nepříznivý. V souboru daného rozsahu nebyla shledána závislost outcome na porodní hmotnosti zařazených pacientů.
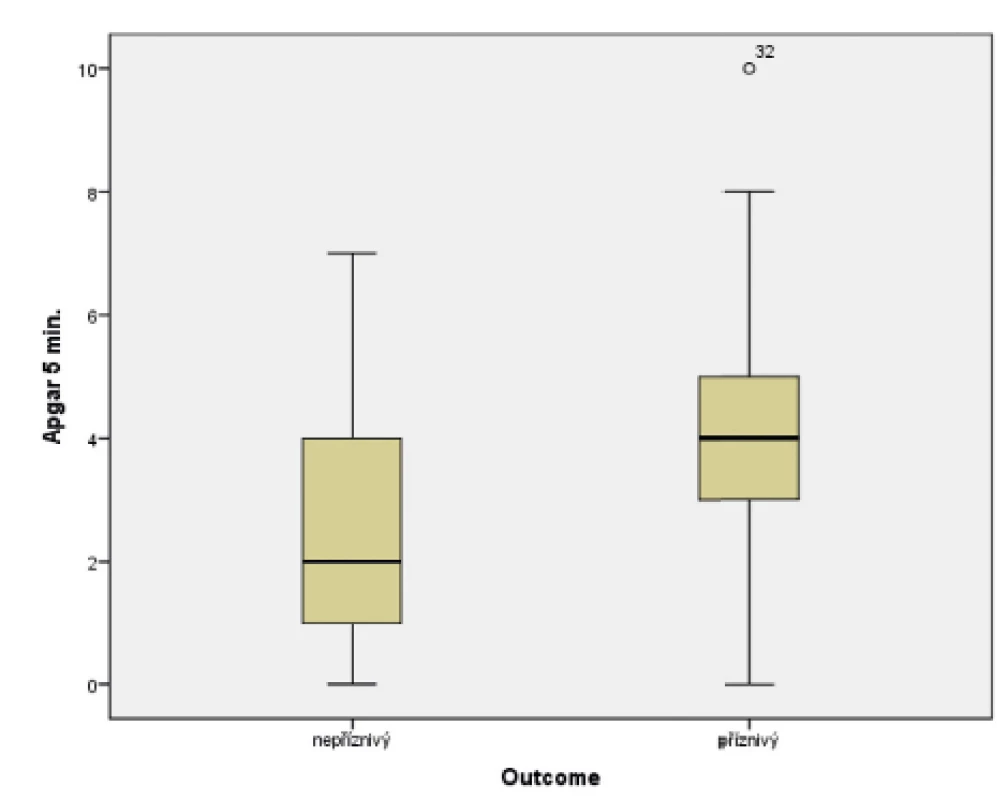
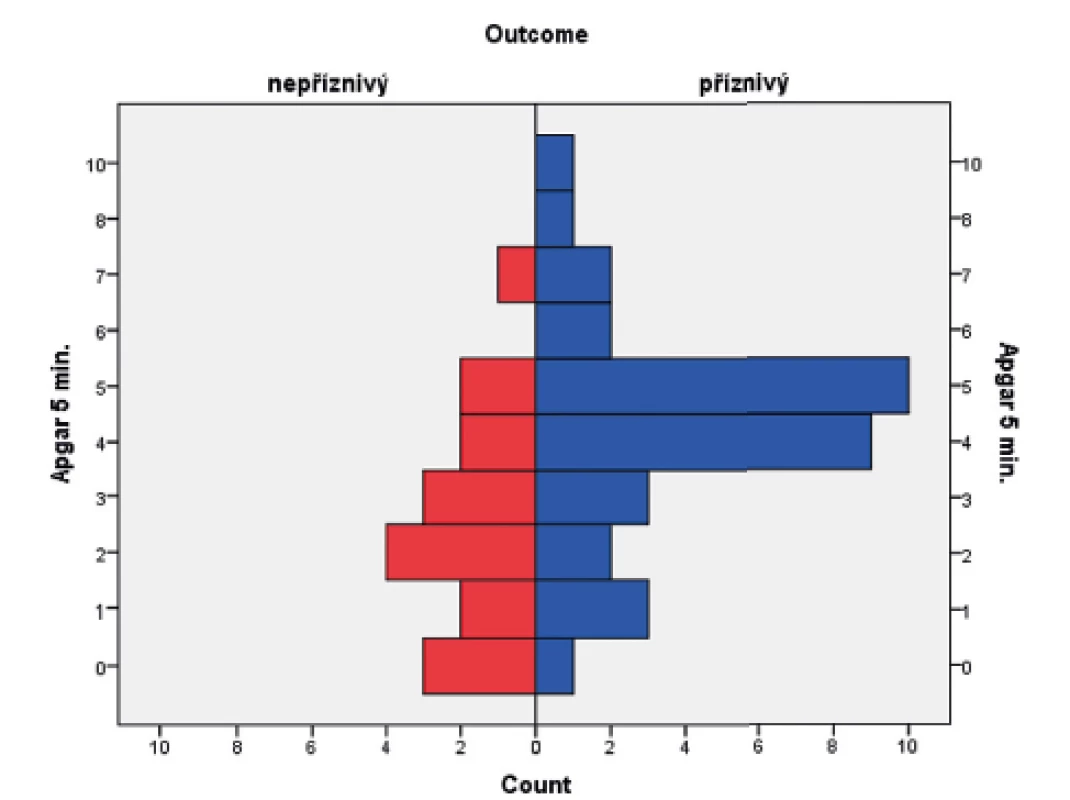
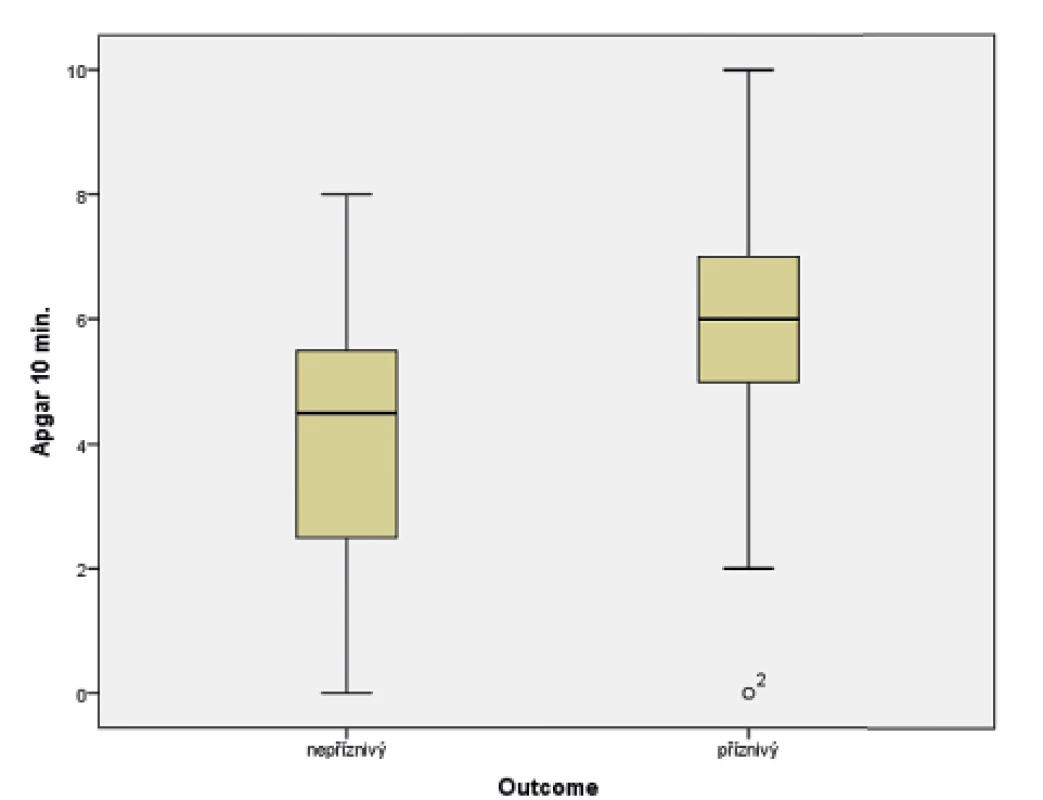
Skóre podle Apgarové
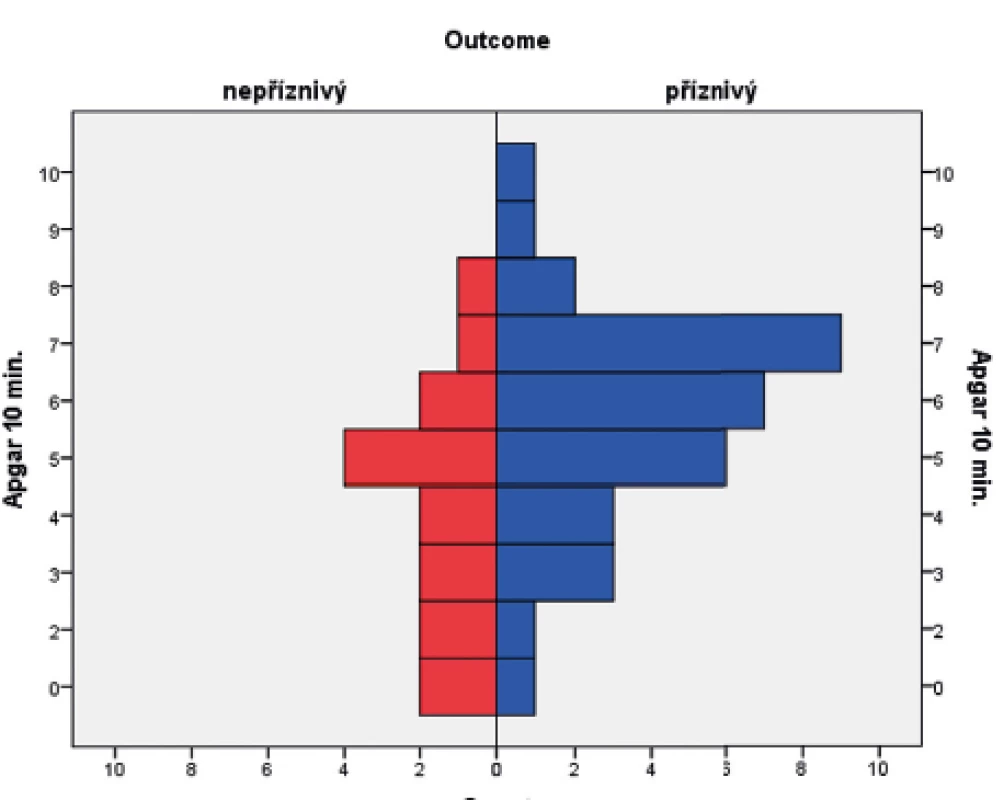
V souboru byl pomocí Mannova-Whitneyova testu vyhodnocen vztah AS v 5. a 10. minutě k výsledku léčby u dětí ve 24 měsících věku, přičemž byla shledána závislost výsledného outcome na hodnotě AS v 5. i 10. minutě života. Získaná data jsou graficky znázorněna krabicovými grafy a histogramy na obrázcích 1–4.
(Mannův-Whitneyův test; p = 0,006)
(t-test; p = 0,015)
pH pupečníkové krve
Pupečníkové pH nebo časné pH do 60 minut života s hodnotou <7,0 je jedním z indikačních kritérií k TH [7]. Průměrné pupeční pH ve skupině dětí s příznivým neurologickým vývojem bylo 6,98, u dětí s nepříznivým vývojem byla průměrná hodnota 6,86. Data byla zpracována pomocí t-testu (p = 0,136), nebyla shledána závislost.
Sledované biochemické parametry v době příjmu pacienta do perinatologického centra
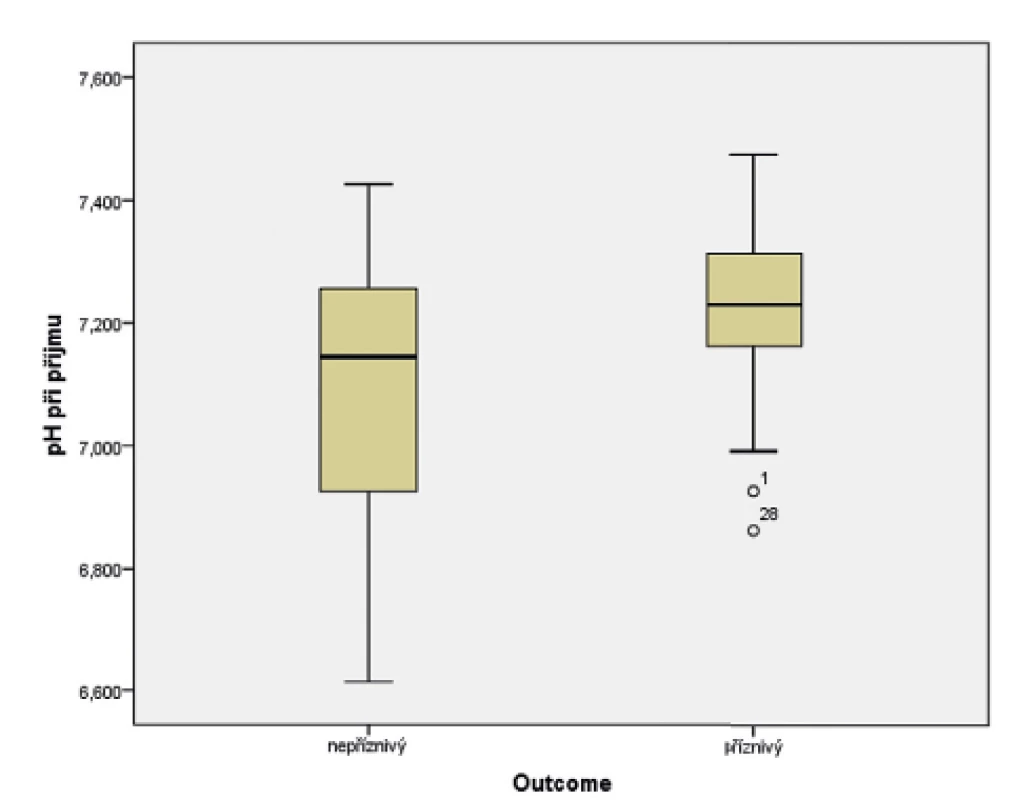
U novorozenců ve skupině s příznivým vývojem bylo průměrné pH při příjmu 7,23, kdežto u novorozenců s nepříznivým výsledkem léčby byla hodnota průměrného pH 7,09 (obr. 5). Data byla vyhodnocena pomocí t-testu (p = 0,029). Byla shledána závislost mezi vstupním pH a výsledkem léčby HIE.
Průměrná hodnota BE byla ve skupině s nepříznivým vývojem signifikantně nižší (-18,21) než ve skupině s příznivým outcome ve 2 letech věku (-13,16). Soubor byl analyzován t-testem (p <0,0005).
Hodnota vstupního laktátu u dětí s příznivým výsledkem se pohybovala v intervalu 1,6–20 mmol/l, přičemž u 21 (62 %) pacientů byla naměřena hodnota pod hranicí 10 mmol/l. Laktát při příjmu do PC u novorozenců s nepříznivým vývojem kolísal v rozmezí 7,1–26,0 mmol/l, ale pouze u 2 (11,2 %) z nich byla zachycena vstupní hodnota laktátu nižší než 10 mmol/l. Při vyhodnocení mediánovým testem byl outcome ve 24 měsících věku vyhodnocen jako závislý na iniciální hodnotě laktátu (p = 0,002).
V našem souboru byla časná hypoglykémie zachycena pouze u tří pacientů, a to ve 3. hodině života. Z tohoto důvodu nebyl tento údaj statisticky zpracováván.
Laktátdehydrogenáza ve stáří 0–6 hodin života
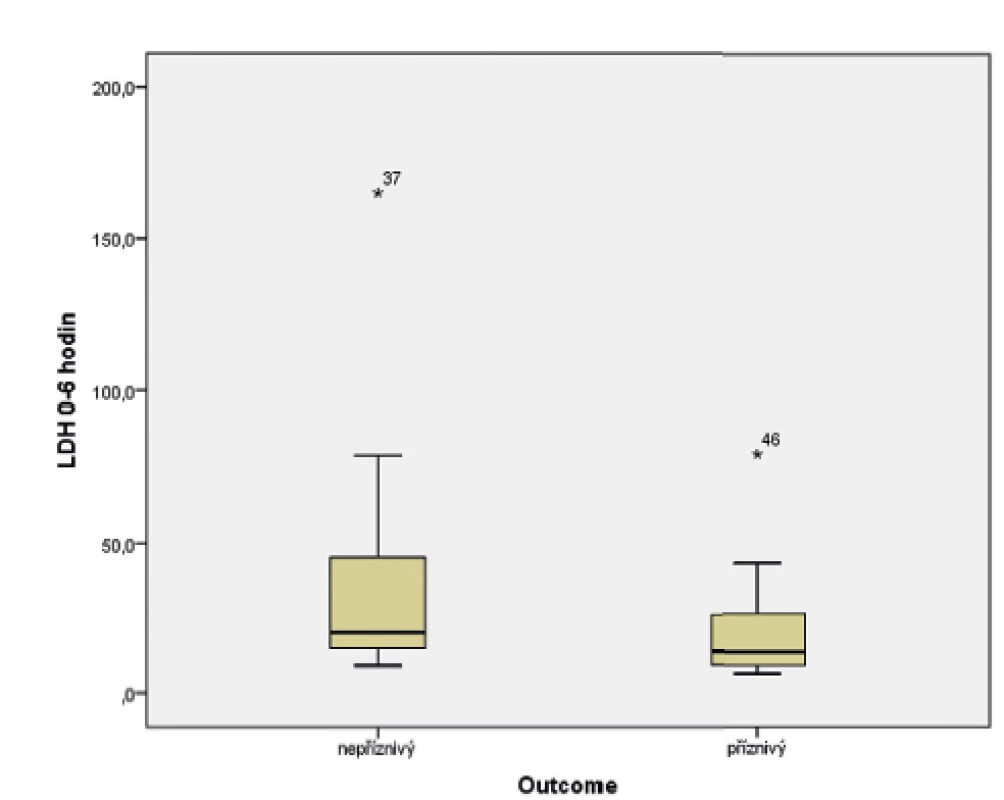
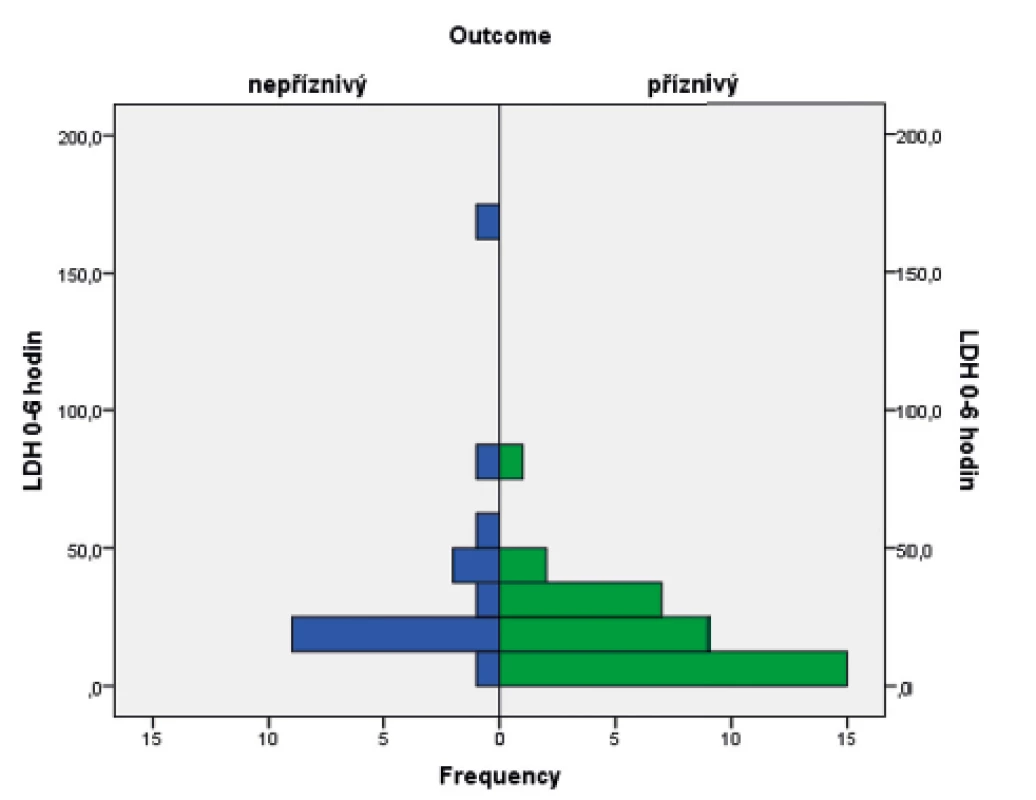
Ve sledovaném souboru byl pomocí Mannova-Whitneyova testu hodnocen vztah hodnoty LDH ve stáří 0–6 hodin života s výsledným outcome, přičemž byla shledána závislost výsledku léčby HIE na vstupní hodnotě LDH (p = 0,017). Závislost je graficky znázorněna pomocí boxplotu (obr. 6) a histogramu (obr. 7).
Křeče a jejich terapie
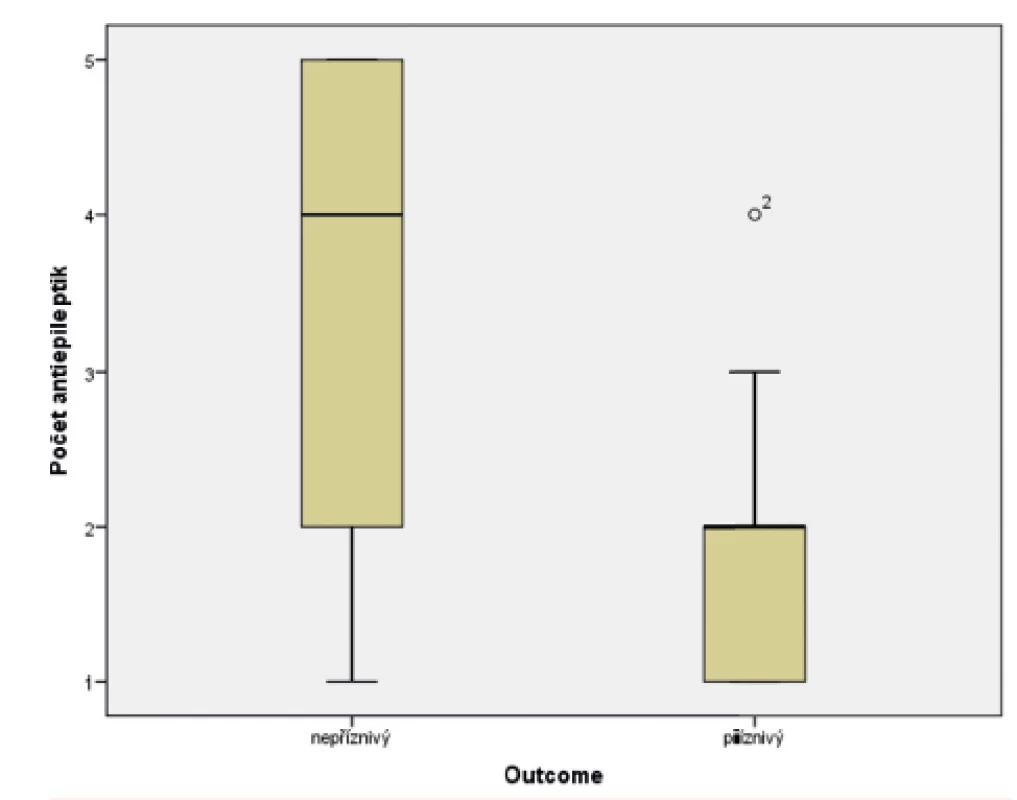
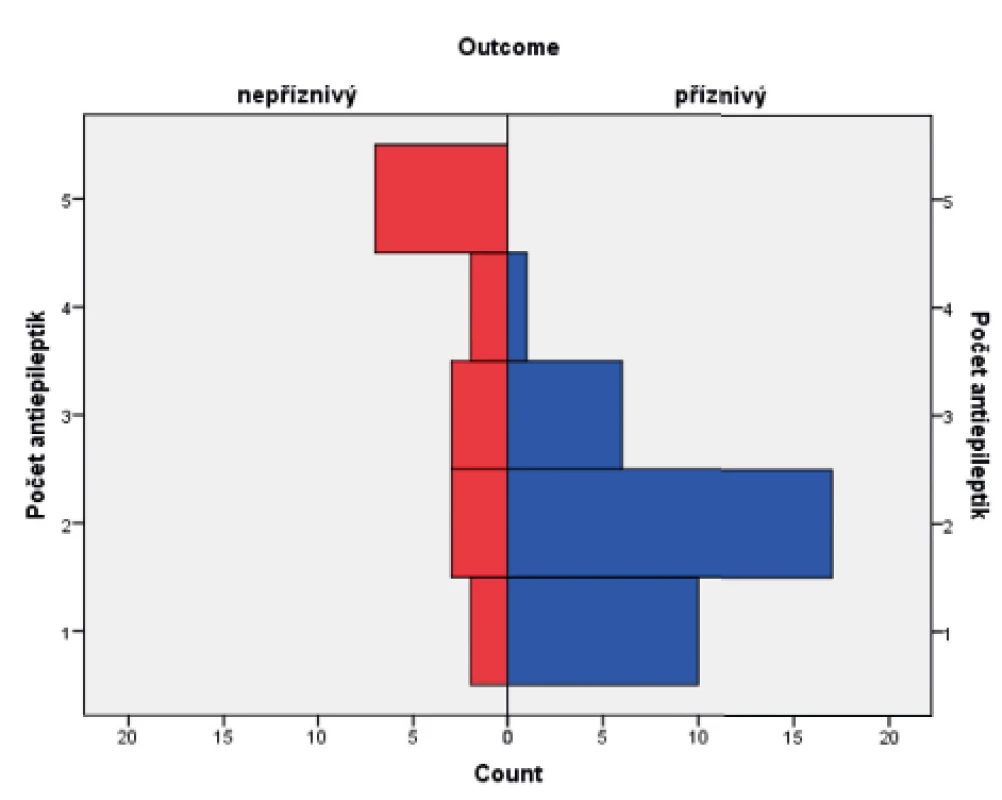
Ve skupině dětí s příznivým osudem se křeče vyskytly u 88,8 % pacientů, u dětí s nepříznivým outcome mělo křeče 94,1 % pacientů. Soubor byl hodnocen Fisherovým exaktním testem (p = 0,654), bylo tedy konstatováno, že outcome pacientů nezávisí na samotné přítomnosti konvulzí. Statisticky významný vliv na výsledek léčby však měly křeče, rezistentní na standardně podávaná antiepileptika, kdy narůstající kombinace antiepileptik (tj. rezistence křečových projevů na léčbu) u pacienta jednoznačně predikovala jeho nepříznivý outcome. Ke zpracování dat byl použit Mannův-Whitneyův test (p = 0,0005). Výsledky jsou graficky zobrazeny v krabicovém grafu (obr. 8) a histogramu (obr. 9).
(Mannův-Whitneyův test; p <0,0005)
Dynamika laktátu v průběhu léčby HIE
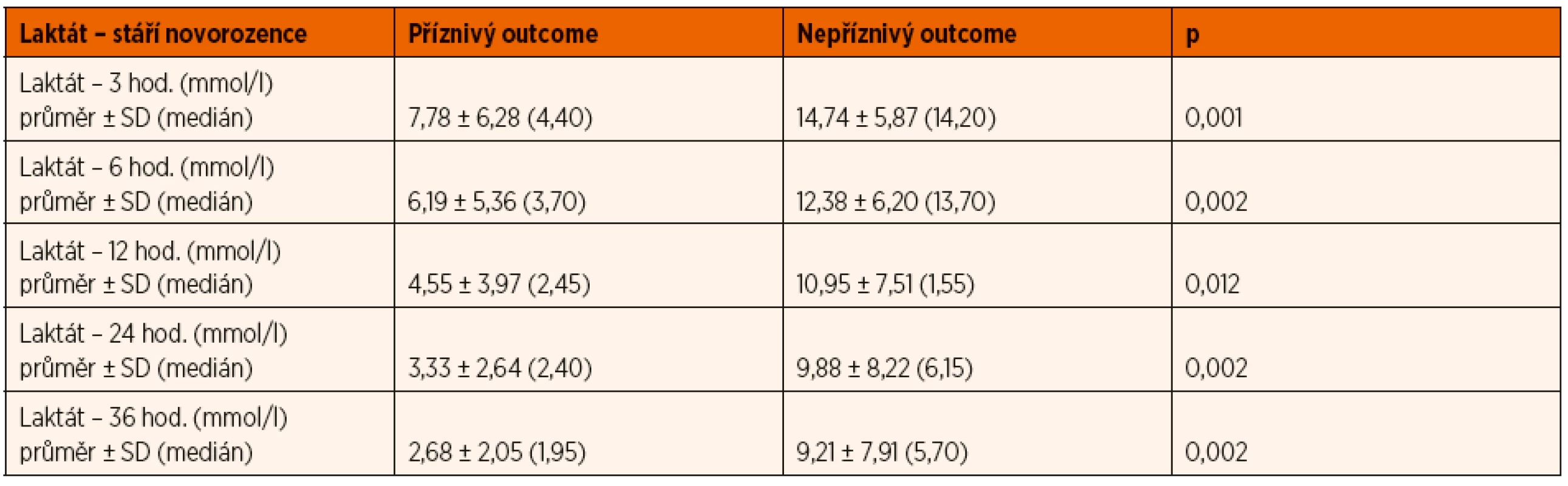
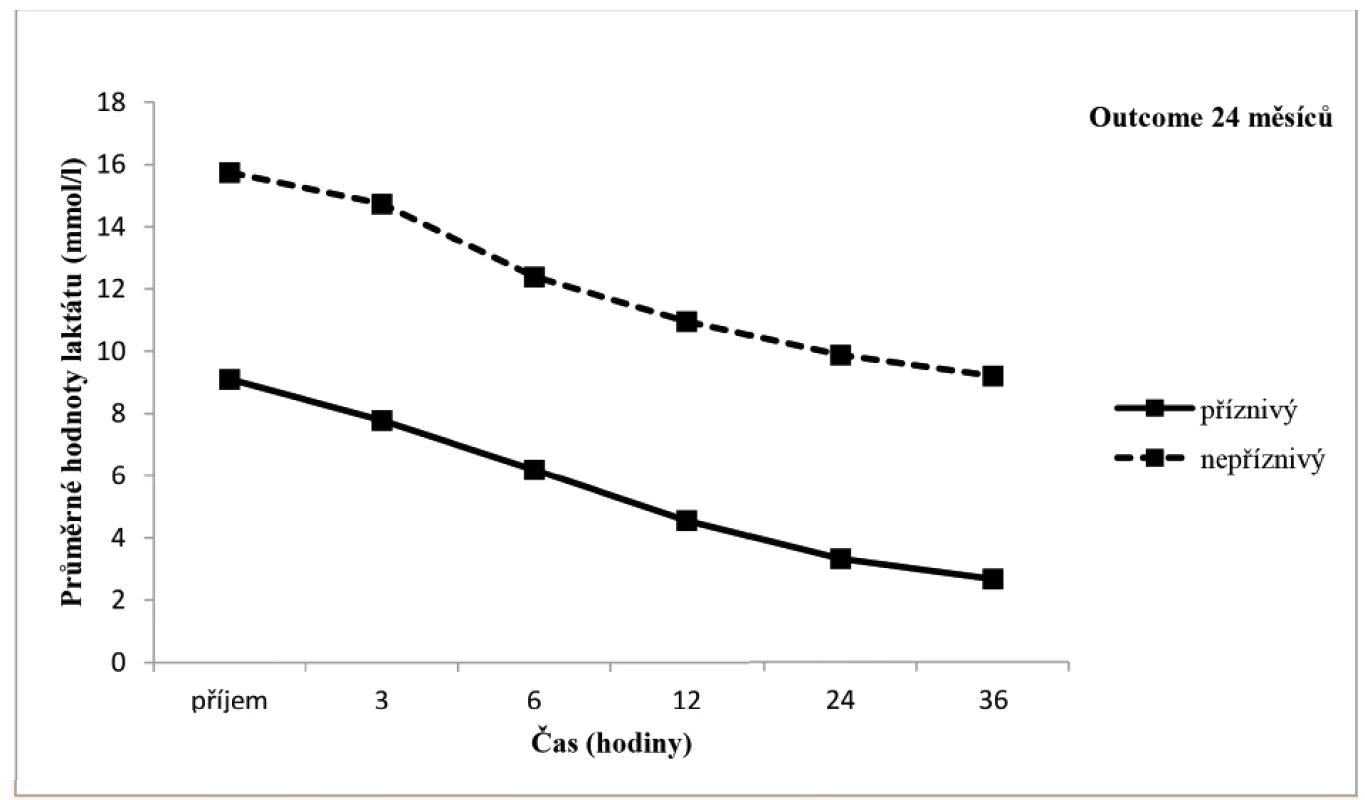
Arteriální laktát byl monitorován u všech zařazených pacientů při příjmu do PC a následně ve 3., 6., 12., 24. a 36. hodině života (± 30 minut), byla sledována závislost výsledku léčby HIE na jeho dynamice v průběhu TH. Tento vztah byl v jednotlivých časových úsecích hodnocen mediánovým testem a výsledky byly zpracovány do tabulky a grafu (tab. 2, obr. 10). V obou porovnávaných skupinách pacientů měl laktát tendenci k poklesu v čase, nicméně pro příznivý outcome pacienta byla klíčová i jeho absolutní hodnota v krvi.
DISKUSE
Místo narození, zahájení řízené hypotermie
Thoresen a kol. v příznačně nazvané publikaci „Time is brain“ zdůrazňují, že časnější zahájení léčebné hypotermie je spjato s lepším výsledkem léčby HIE [9]. V našem souboru byl za počátek hypotermie označován čas zahájení „aktivní“ hypotermie, tj. přístrojem řízeného ochlazování. Z tohoto důvodu se (v případě indikované TH) mohlo místo narození mimo PC jevit jako znevýhodňující faktor pro výsledný efekt TH, protože jakýkoliv nutný transport oddaloval nástup zahájení „aktivní“ TH. Náš soubor však neprokázal závislost outcome na čase zahájení ochlazování. Při p = 0,093 však vyvstává otázka, jak by dopadlo vyhodnocení dat v případě většího souboru. Nelze opomenout ani fakt, že jsou-li u novorozence po asfyxii splněna indikační kritéria k transportu do PC (k vyhodnocení aEEG a event. k léčbě TH), doporučuje se od roku 2010 zahájit „pasivní“ ochlazování okamžitě. Realizace „pasivního“ ochlazování (směřujícího k teplotě 33,5 °C) spočívá ve vypnutí vyhřívaného lůžka, pravidelném monitoringu rektální teploty à 15 minut a regulaci teploty přikládáním/odnímáním přikrývky [7, 10]. Vzhledem k tomu, že v předkládané prospektivní studii byla data sbírána v období 7/2008–7/2014, „pasivní“ ochlazování bylo poskytnuto jen části zařazených pacientů. Jejich rektální teplota tak mohla dosáhnout cílové teploty pro TH (33,5 ± 0,5 °C) mnohem dříve, než byla iniciována „aktivní“ TH. U 14 (27,4 %) novorozenců byla při příjmu do PC naměřena dokonce nižší rektální teplota než 33 °C, jedno z dětí mělo dokonce vstupní teplotu 30,3 °C (hluboká hypotermie). Zavedení „pasivního“ ochlazování v době probíhající studie tak mohlo významně ovlivnit výsledek statistického zpracování dat v našem souboru.
Kendall a kol. označili „pasivní“ ochlazování za jednoduchou a efektivní metodu, která umožňuje zahájení hypotermie už v období před přijetím do PC, upozornili však na nutnost pravidelného monitoringu rektální teploty z důvodu prevence hluboké hypotermie [11]. Cavallaro a kol. publikovali, že hluboká hypotermie pod 33 °C způsobuje výraznější pokles krevního tlaku vlivem inhibice aktivity endogenních katecholaminů a prudší nástup sinusové bradykardie. Negativní dopad hluboké hypotermie na outcome nebyl dosud jednoznačně prokázán, přesto v léčbě HIE není standardně doporučována [12].
Vzhledem k tomu, že některé experimentální studie naznačovaly, že hypotermie pod 33,5 °C nebo hypotermie trvající déle než 72 hodin by mohla poskytnout větší neuroprotekci, Shankaran a kol. provedli srovnávací studii na novorozencích, které stratifikovali do 4 skupin podle cílové teploty (32 °C nebo 33,5 °C) a podle délky poskytované hypotermie (72 nebo 120 hodin). Studie byla ukončena z důvodu bezpečnosti pacientů. Neprokázala benefit hlubší nebo delší hypotermie, mortalita se v jednotlivých skupinách signifikantně nelišila. Delší hypotermie však byla spjata s četnějším výskytem arytmií, s anurií a prodlouženou hospitalizací, zatímco užití hlubší hypotermie vykazovalo vyšší potřebu léčby oxidem dusnatým, extrakorporální membránovou oxygenací, delší potřebu oxygenoterapie a častější výskyt bradykardie [13].
Porodní hmotnost
Porodní hmotnost novorozence je již prenatálně ovlivněna řadou chorobných stavů a rizikových faktorů matky i samotného plodu. Odráží funkci fetoplacentární jednotky v době těhotenství, která zajišťuje plodu dodávku kyslíku i energetických substrátů. Perinatální asfyxie může mít závažné důsledky i pro zdravě vyvíjející se plod, u novorozence s nitroděložním zaostáváním růstu však mohou být důsledky asfyxie fatální z důvodů omezených energetických rezerv. I když v souboru nebyla potvrzena závislost výsledku léčby HIE na porodní hmotnosti, vzhledem k hodnotě p = 0,060 je otázkou, jak by dopadlo vyhodnocení souboru s větším počtem zařazených pacientů. Z medicínského hlediska je málo pravděpodobné, že by blízké váhové kategorie (medián porodní hmotnosti 3080 g ve skupině dětí s příznivým outcome versus 3450 g ve skupině s nepříznivým vývojem) samy o sobě předurčovaly dramaticky rozdílný outcome.
Wyatt a kol. v souboru novorozenců léčených TH porovnávali účinnost léčby u dvou váhových podskupin (porodní hmotnost ≤25. percentil versus porodní hmotnost >25. percentil) a shledali, že z TH jednoznačně lépe profitovali těžší novorozenci, tedy děti s porodní hmotností nad 25. percentilem [14].
Skóre podle Apgarové
Samotné nízké Apgar skóre (AS) nelze považovat za jednoznačný důkaz ani důsledek asfyxie. Hodnota Apgar skóre ve výši 0–3 bodů v 1. minutě nemá žádnou výpovědní hodnotu pro vývoj dítěte v budoucnu. Stejné bodové hodnocení v 5. minutě života však již může předpovídat vyšší novorozeneckou úmrtnost a zvýšené riziko vzniku DMO [15, 16]. Statistická analýza předkládaného souboru potvrzuje dostupné literární údaje.
pH pupečníkové krve
Nebyla shledána závislost výsledku léčby HIE na pupečníkovém pH. Nutno podotknout, že v celkovém souboru 51 dětí nebyla dostupná hodnota pupečního ABR u 11 (21,6 %) novorozenců, což snižuje validitu hodnocení.
pH, BE, laktát a glykémie při příjmu pacienta do perinatologického centra
U všech uvedených biochemických parametrů se vždy jedná o první vyšetřený vzorek u pacienta ihned po přijetí do PC. Vzhledem k nezbytnému transportu 2/3 novorozenců z regionálních nemocnic jde o vzorky vyšetřené v časné fázi HIE (ve stáří dítěte 0–5 hodin). Ve shodě s publikovanými údaji Hayakawy a kol. v roce 2014 bylo pH i BE při příjmu signifikantně nižší u novorozenců s nepříznivým outcome, zatímco laktát byl u těchto dětí prokazatelně vyšší než ve skupině s příznivým výsledkem léčby [16]. Hodnota pH arteriální krve při příjmu pacienta poukazuje na závažnost tíže asfyktického inzultu. V případě narození dítěte mimo PC zároveň odráží i účinnost poskytnuté resuscitační péče po narození a během nezbytného transportu. Je výsledkem aktuálního metabolického i respiračního stavu dítěte.
Hypoglykémie (zejména časná) je považována za významný rizikový faktor nepříznivého outcome u asfyktických pacientů [17]. Glykémie je u asfyktických novorozenců přísně sledovaným biochemickým parametrem. Existuje dostatek důkazů, že hypoglykémie (zejména časná, od narození do 6 hodin života) jednoznačně zhoršuje outcome těchto dětí. Vzhledem k velmi ojedinělému záchytu hypoglykémie v tomto časovém rozmezí (pouze u 5,9 % novorozenců) nebylo statistické zpracovávání dat prováděno. Zjištěná skutečnost potvrzuje, že regionální nemocnice v Moravskoslezském regionu i novorozenecká transportní služba pečlivě dodržují zásady doporučeného postupu ČNeoS pro léčbu HIE, kde je na prevenci hypoglykémie kladen důraz [7].
Laktátdehydrogenáza ve stáří 0–6 hodin
Laktátdehydrogenáza (LDH) je cytoplazmatický enzym, vyskytující se ve všech buňkách lidského organismu, který se při tkáňovém poškození uvolňuje do oběhu. V analyzovaném souboru byla zjištěna závislost výsledku léčby HIE na časné hodnotě laktátdehydrogenázy. Tato informace je v souladu s literárními zdroji, v nichž se uvádí, že novorozenci s HIE a signifikantně zvýšenou hladinou laktátdehydrogenázy v časném postasfyktickém období mají zpravidla nepříznivý outcome [16, 18].
Křeče a jejich terapie
Křečová aktivita je klinickým projevem sekundárního energetického selhání neuronů při HIE. Klinické křeče i subklinickou konvulzivní aktivitu (zachycenou na aEEG) je nutno včas a účinně léčit. Lékem volby je fenobarbital, při výskytu torpidních křečí jsou postupně přidávána další antiepileptika (fenytoin, diazepam, midazolam). V případě nezvládnutelného status epilepticus je pacient uveden do thiopentalového kómatu.
HIE je jednou z nejčastějších příčin křečových záchvatů v novorozeneckém období. Záchvaty obvykle začínají první den po porodu, mohou ovlivnit udržování ventilace, úroveň okysličení i krevní tlak. Záchvaty, včetně asymptomatických EEG záchvatů, mohou přispívat k poškození mozku a zvyšovat riziko následné epilepsie [19]. Neexistuje žádné univerzální doporučení pro management křečí u neonatální HIE. Status epilepticus a časté křeče by měly být vždy intenzivně léčeny. Srinivasakumar a kol. publikovali, že důsledná léčba záchvatů (detekovaných EEG/aEEG) vedla u novorozenců s HIE k významnému snížení křečové aktivity, která jinak byla spjata se závažnějším nálezem na magnetické rezonanci (MRI) mozku a s výrazně nižším výkonnostním skóre ve všech parametrech standardizovaného vyšetření psychomotorického vývoje, objektivizovaného metodou Bayley Scale Infant and Toddlers Development (BSID III) [20].
Současná terapie novorozeneckých záchvatů při HIE má však limitovanou účinnost. Fenobarbital je lékem první volby, nicméně jeho účinnost je uváděna pouze ve 29–50 % případů [21–23]. Dalšími nejpoužívanějšími léky jsou fenytoin (s účinností cca 15 %) a benzodiazepiny. Neexistují žádné důkazy podporující profylaktické používání antikonvulziv po perinatální asfyxii. Antikonvulziva jsou obvykle vyžadována pouze v prvním týdnu života, protože záchvaty jsou „akutními symptomy“ a vymizí s časem. U některých těžce postižených jedinců je však nutná dlouhodobější léčba [24].
Dynamika laktátu v průběhu léčby HIE
Laktát vzniká v organismu při hypoxii v důsledku anaerobní glykolýzy. V minulosti byl považován za pouhý výsledný produkt anaerobního metabolismu, za „odpad“, který se v těle hromadí při nedostatečném okysličování metabolicky aktivních tkání. Dnes je všeobecně známo, že spolu s dalšími ketolátkami může být laktát zdrojem energie pro srdce i mozek. V poslední době je navíc laktátu přisuzována role důležitého informátora aktuálního metabolického stavu organismu. Jako významný mediátor dokáže ovlivňovat metabolismus buněk daleko od místa svého vzniku, ovlivňuje jejich energetický obrat a podílí se nepřímo i na regulaci krevního průtoku [25].
V novorozenecké populaci byla zvýšená sérová hladina laktátu po narození dosud popisována jako riziko možného vzniku a vývoje těžké postpartální asfyxie [26]. Byl potvrzen vztah mezi postpartální hyperlaktatémií a vyšší frekvencí neurologické morbidity a úmrtí novorozence v prvních dnech života [27–29]. Dřívější studie (před érou TH), využívající protonovou magnetickou rezonanční spektroskopii (1H MRS) k vyšetření mozku, prokázaly, že přetrvávající zvýšený obsah laktátu v mozkové tkáni časně po asfyktickém inzultu je spjat s nepříznivým neurologickým vývojem dítěte ve 12 měsících věku, přičemž u těžké HIE s nepříznivým outcome byl laktát v mozku zvýšen ještě po jednom měsíci věku [30–32].
Dynamika laktátu v organismu a jeho prognostický význam byl dosud intenzivně sledován pouze u kriticky nemocných dospělých pacientů. U septických a traumatických dospělých bylo prokázáno, že přetrvávání vysokých hodnot laktátu v průběhu léčby je spjato s vyšší mortalitou i morbiditou [33]. Také veterinární medicína označila přetrvávající zvýšené hodnoty laktátu za spolehlivý nezávislý biomarker, předpovídající mortalitu u kriticky nemocných novorozených hříbat [34, 35]. Dynamika laktátu jako možného prediktora dlouhodobého outcome u asfyktických novorozenců léčených řízenou hypotermií dosud uspokojivě studována nebyla. Li a kol. publikovali v roce 2013 v souboru 21 dětí s HIE léčených TH signifikantně vyšší hladiny laktátu s pomalejším poklesem u novorozenců s nepříznivým outcome než ve skupině s příznivým výsledkem léčby [36].
V roce 2015 byl prezentován soubor 12 asfyktických novorozenců léčených TH, který poukazoval na skutečnost, že zvýšená sérová hladina laktátu může být asociována s nepříznivým vývojem ve věku 24 měsíců [37]. Podle získaných výsledků v našem souboru je zřejmé, že vstupní hodnota laktátu jednoznačně koreluje s tíží hypoxického inzultu. Po iniciálním nárůstu zpravidla postupně klesá k normálu. Zpomalený pokles byl u zvířecích modelů vysvětlován sníženou jaterní clearance a zvýšenou produkcí laktátu při stimulaci glykolýzy a sympatoadrenálního systému, popř. průvodní křečovou aktivitou [38]. Nutno zmínit, že sekundární zvýšení hladiny laktátu v průběhu prvních 4 dnů života může být u termínových asfyktických novorozenců léčených TH markerem suboptimálního hemodynamického stavu [39].
Stejně tak nelze opomenout, že hodnota laktátu může být v organismu ovlivněna řadou příčin. Tkáňová hypoxie během HIE je stěžejním faktorem, který zvyšuje u novorozence množství laktátu v organismu. Přesto existuje řada dalších vlivů, které však bylo možno u našich zařazených pacientů vyloučit: závažná sepse, diabetické koma, otrava (oxid uhelnatý, alkohol, metanol nebo kyanid), methemoglobinémie, toxická hepatopatie, mitochondriální myopatie a některé metabolické choroby. Na produkci laktátu se však může podílet i aktuální teplota těla spolu se stavem perfuze kůže a splanchniku. Hodnoty laktátu, naměřené v našem souboru ve 3. a 6. hodině života, tak mohou teoreticky být značně ovlivněny významným rozptylem aktuálních teplot u sledovaných subjektů. Po vyhodnocení souboru lze konstatovat, že v obou sledovaných skupinách laktát postupně klesal, nicméně pro příznivý outcome pacienta měla stěžejní význam i jeho absolutní hodnota v krvi. Vzhledem k získaným výsledkům by mohl být laktát považován za jeden z pomocných (byť nespecifických) prediktorů následného outcome u novorozenců s HIE II. a III. stupně [40].
Ze současných znalostí o významu a metabolismu laktátu lze jen stěží říci, zda je laktát příčinou či následkem samotného průběhu HIE, jeho aktuální množství v organismu však zcela nepochybně ovlivňuje metabolismus klíčových energetických procesů v mozku. Stejně tak nelze zhodnotit, zda hyperlaktatémie vzniká nadměrnou produkcí laktátu nebo jeho nedostatečným odbouráváním či kombinací obou pochodů. Jak ale vyplývá z výsledku zkoumání, nadbytek laktátu v časné fázi HIE lze dát do souvislosti s nepříznivým outcome asfyktických novorozenců.
Za limitující v naší studii může být považována skutečnost, že u zařazených pacientů nebylo provedeno standardizované vyšetření BSID III ve 2 letech věku, které by značně upřesnilo jejich úroveň mentálního a psychomotorického vývoje. V době zahájení studie na našem pracovišti nebyl dostupný klinický psycholog, erudovaný v problematice BSID. Pokud by BSID bylo považováno za nezbytnou podmínku pro vyhodnocení studie, soubor pacientů by se významně snížil. Použitá škála GMFCS spolu s hodnocením úrovně smyslového vnímání a psychomotorického vývoje se pro hodnocení klinického stavu přeživších pacientů jeví jako dostatečná. Dalším limitujícím faktorem je skutečnost, že i dvouleté děti bez zjevného neurologického a smyslového deficitu se mohou ve školním věku potýkat se značnými kognitivními a paměťovými problémy, proto by bylo správnější sledovat tyto pacienty minimálně do předškolního věku.
ZÁVĚR
HIE je jednou z nejzávažnějších diagnóz, se kterou jsou léčeni donošení a lehce nezralí novorozenci v perinatologickém centru III. typu. V současné době je za nejspolehlivější prediktor příznivého vývoje u HIE II.–III. stupně považována absence patologického nálezu na MRI mozku po ukončení TH a úprava záznamu integrované amplitudy EEG během 48.–72. hodiny života při poskytované TH [41–43]. Přesto je zapotřebí hledat další možné rizikové faktory a biochemické parametry, které by dokázaly předpověď výsledku léčby ještě více upřesnit. Jedním z důvodů je samotná detekce vhodné cílové skupiny k indikaci/kontraindikaci k (toho času intenzivně zkoumané) adjuvantní neuroprotektivní léčbě a také snaha co nejdříve a nejpřesněji informovat zákonné zástupce o prognóze jejich dítěte. Podle předkládaných výsledků by za pomocné prediktory následného vývoje v průběhu TH mohly být považovány např. dynamika laktátu či rezistence konvulzí na antiepiletika.
Autorka děkuje prof. MUDr. Jindřichu Mourkovi, DrSc., z Fyziologického ústavu 1. lékařské fakulty Univerzity Karlovy v Praze za cenné rady v problematice metabolických pochodů u asfyktických novorozenců.
Poznámka: Pátý autor této práce byl podpořen ESF projektem CZ.1.07/2.3.00/20.0296.
Došlo: 13. 2. 2018
Přijato: 12. 6. 2018
MUDr. Renáta Poláčková, Ph.D.
Katedra dětského lékařství a neonatologie
Lékařská fakulta Ostravské univerzity
Syllabova 19
703 00 Ostrava - Zábřeh
e-mail: rekol@seznam.cz
Sources
- Lawn JE, Bahl R, Bergstrom S, et al. Setting research priorities to reduce almost one million deaths from birth asphyxia by 2015. PLoS Med 2011; 8 (1): e1000389. https://doi.org/10.1371/journal.pmed.1000389
- Liu L, Oza S, Hogan D, et al. Global, regional, and national causes of child mortality in 2000–13, with projections to inform post-2015 priorities: an updated systematic analysis. Lancet 2014 Sep. doi: https://doi.org/10.1016/S0140-6736(14)61698-6.
- Sarnat HB, Sarnat MS. Neonatal encephalopathy following fetal distress. A clinical and electroencephalographic study. Arch Neurol 1976; 33 (10): 696–705.
- Plavka R, a kol. Neonatální mortalita a morbidita, Česká republika 2016. Výsledky perinatální péče v ČR za rok 2016. In: XXXIV. celostátní konference perinatologie a fetomaternální medicíny s mezinárodní účastí. Karlovy Vary, 2017. Dostupné online: http://www.neonatology.cz/upload/www.neonatology.cz/morbidita/nu-2016-pro-www.pdf.
- Jacobs SE, Berg M, Hunt R, et al. Cooling for newborns with hypoxic ischaemic encephalopathy. Cochrane Database of Systematic Reviews 2013; (1), CD003311.
- Murray DM, Bala P, O´Connor C, et al. The predictive value of early neurological examination in neonatal hypoxic-ischaemic encephalopathy and neurodevelopmental outcome at 24 months. Dev Med Child Neurol 2010; 52 (2): e55–59.
- Kolářová R, Hálek J, Kantor L, et al. Řízená hypotermie v léčbě hypoxicko-ischemické encefalopatie – doporučený postup. Neonatologické listy 2011; 17 (2): 19–27. Dostupné z: http://www.neonatology.cz/upload/
- /www.neonatology.cz/Legislativa/Postupy/hypotermie.pdf.
- Palisano R, Rosenbaum P, Walter S, et al. Development and reliability of a system to classify gross motor function in children with cerebral palsy. Dev Med Child Neurol 1997; 39 (4): 214–223.
- Thoresen M, Tooley J, Liu X, et al. Time is brain: starting therapeutic hypothermia within three hours after birth improves motor outcome in asphyxiated newborns. Neonatology 2013; 104 (3): 228–233.
- UK TOBY Cooling Register Clinician’s Handbook. Available online: https://www.npeu.ox.ac.uk/downloads/files/tobyregister/Register-Clinicans-Handbook1-v4-07-06-10.pdf.
- Kendall GS, Kapetanakis A, Ratnavel N, et al. Passive cooling for initiation of therapeutic hypothermia in neonatal encephalopathy. Arch Dis Child Fetal Neonatal Ed 2010; 95 (6): F408–F412.
- Cavallaro G, Filippi L, Raffaeli G, et al. Heart rate and arterial pressure changes during whole-body deep hypothermia. ISRN Pediatr 2013; 2013 : 140213. doi: 10.1155/2013/140213.
- Shankaran S, Laptook AR, Pappas A, et al. National Institute of Child Health and Human Development Neonatal. Effect of depth and duration of cooling on deaths in the NICU among neonates with hypoxic ischemic encephalopathy: a randomized clinical trial. JAMA 2014; 312 (24): 2629–2639.
- Wyatt JS, Gluckman PD, Liu PY, et al. Determinants of outcomes after head cooling for neonatal encephalopathy. Pediatrics 2007; 119 (5): 91–921.
- Li F, Wu T, Lei X, et al. The apgar score and infant mortality. PLoS One 2013; 8 (7): e69072.
- Hayakawa M, Ito Y, Saito S, et al. Incidence and prediction of outcome in hypoxic-ischemic encephalopathy in Japan. Pediatr Int 2014; 56 (2): 215–221.
- Nadeem M, Murray DM, Boylan GB, et al. Early blood glucose profile and neurodevelopmental outcome at two years in neonatal hypoxic-ischaemic encephalopathy. BMC Pediatr 2011; 11 (10).
- Thoresen M, Liu X, Jary S, et al. Lactate dehydrogenase in hypothermia-treated newborn infants with hypoxic-ischaemic encephalopathy. Acta Paediatr 2012; 101 (10): 1038–1044.
- Miller SP, Weiss J, Barnwell A, et al. Seizure-associated brain injury in term newborns with perinatal asphyxia. Neurology 2002; 58 (4): 542–548.
- Srinivasakumar P, Zempel J, Trivedi S, et al. Treating EEG seizures in hypoxic ischemic encephalopathy: A randomized controlled trial. Pediatrics 2015; 136 (5): e1302–e1309.
- Painter MJ, Scher MS, Stein AD, et al. Phenobarbital compared with phenytoin for the treatment of neonatal seizures. N Engl J Med 1999; 341 (7): 485–489.
- Hellström-Westas L, Boylan G, Agren J. Systematic review of neonatal seizure management strategies provides guidance on anti-epileptic treatment. Acta Paediatr 2015; 104 (2): 123–129.
- Boylan GB,Rennie JM, Pressler RM, et al. Phenobarbitone, neonatal seizures, and video-EEG. Arch Dis Child Fetal Neonatal Ed 2002; 86 (3): F165–F170.
- Martinello K, Hart AR, Yap S, et al. Management and investigation of neonatal encephalopathy: 2017 update. Arch Dis Child Fetal Neonatal Ed 2017; 102 (4): F346–F358.
- Bergersen LH, Giedde A. Is lactate a volume transmitter of metabolic states of the brain? Front Neuroenergetics 2012; 4 : 5. doi: 10.3389/fnene.2012.00005.
- Varkilova L. Blood lactate measurement as a diagnostic and prognostic marker tool after birth asphyxia in newborn infants with gestational age > or = 34 gestational weeks. Akush Ginekol 2013; 52 (3): 36–43.
- Fernandez HG, Vieira AA, Barbosa AD. The correlation between plasma lactate concentrations and early neonatal mortality. Rev Bras Ter Intensiva 2012; 24 (2): 184–187.
- Shah S, Tracy M, Smyth J. Postnatal lactate as an early predictor of short-term outcome after intrapartum asphyxia. J Perinatol 2004; 24 (1): 16–20.
- Silva SD, Hennebert N, Denis R, et al. Clinical value of single postnatal lactate measurement after intrapartum asphyxia. Acta Paediatr 2000; 89 (3): 320–323.
- Hanrahan JD, Cox IJ, Edwards AD, et al. Persistent increases in cerebral lactate concentration after birth asphyxia. Pediatr Res 1998; 44 (3): 304–311.
- Hanrahan JD, Cox IJ, Azzopardi D, et al. Relation between proton magnetic resonance spectroscopy within 18 hours of birth asphyxia and neurodevelopment at 1 year of age. Dev Med Child Neurol 1999; 41 (2): 76–82.
- Amess PN, Penrice J, Wylezinska M, et al. Early brain proton magnetic resonance spectroscopy and neonatal neurology related to neurodevelopmental outcome at 1 year in term infants after presumed hypoxic-ischaemic brain injury. Dev Med Child Neurol 1999; 41 (7): 436–445.
- Bakker J, Nijsten MW, Jansen TC. Clinical use of lactate monitoring in critically ill patients. Annals of Intensive Care 2013; 3 : 12. Available from: http://www.annalsofintensivecare.com/content/3/1/12.
- Castagnetti C, Pirrone A, Mariella J, et al. Venous blood lactate evalution in equine neonatalintensive care. Theriogenology 2010; 73 (3): 343–357.
- Borchers A, Wilkins PA, Marsh PM, et al. Sequental L-lactate concentration in hospitalised equine neonates: A prospective multicentre study. Equine Vet J Suppl 2013; (45): 2–7.
- Li J, Funato M, Tamai H, et al. Predictors of neurological outcome in cooled neonates. Pediatr Int 2013; 55 (2): 169–176. doi: 10.1111/ped.12008.
- Chiang MC, Lien R, Chu SM, et al. Serum lactate, brain magnetic resonance imaging and outcome of neonatal hypoxic ischemic encephalopathy after therapeutic hypothermia. Pediatr Neonatol 2016; 57 (1): 35–40.
- Murray DM, Boylan GB, Fitzgerald AP, et al. Persistent lactit acidosis in neonatal hypoxic-ischaemic encephalopathy correlates with EEG grade and electrographic seizure burden. Arch Dis Child Fetal Neonatal Ed 2008; 93 (3): F183–186.
- Balushi AA, Guibault MP, Wintermark P. Secondary increase of lactate levels in asphyxiated newborns during hypothermia treatment: Reflect of suboptimal hemodynamics (a case series and review of the literature). AJP Rep 2016; 6 (1): e48–58.
- Polackova R, Salounova D, Kantor L. Lactate as an early predictor of psychomotor development in neonates with asphyxia receiving therapeutic hypothermia. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2017 Dec 4. doi: 10.5507/bp.2017.052. [Epub ahead of print].
- Del Rio R, Ochoa C, Alarcon A, et al. Amplitude integrated electroencephalogram as a prognostic tool in neonates with hypoxic-ischemic encephalopathy: A systematic review. PLoS ONE 2016; 11 (11): e0165744.
- Lukášková J. Kontinuální monitorování elektrické mozkové aktivity u novorozenců. Ces-slov Pediat 2007; 62 (2): 91–97.
- Bakaj Zbrožková L, Hálek J, Michálková K, a kol. Radiologické nálezy u donošených novorozenců s hypoxicko-ischemickou encefalopatií. Cesk Slov Neurol N 2017; 80/113 (3): 291–299.
Labels
Neonatology Paediatrics General practitioner for children and adolescentsArticle was published in
Czech-Slovak Pediatrics

2019 Issue 1
- What Effect Can Be Expected from Limosilactobacillus reuteri in Mucositis and Peri-Implantitis?
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Editorial: Česko-slovenská pediatrie v roce 2019
- Editorial: Dětský diabetes na prahu nové éry
- Poděkování spolupracovníkům za rok 2018
- 20. dny dětské endokrinologie Ostrov u Tisé, Ústecký kraj 25.–26. 1. 2019
- Moderní technologie v terapii diabetu 1. typu v dětském věku
- Etiologie a léčba novorozeneckého diabetu
- Monogenně podmíněný diabetes MODY v dětském věku: retrospektivní studie pacientů diagnostikovaných na Dětské klinice FN Plzeň v letech 2000–2017
- Depresívne a úzkostné symptómy vo vzťahu k spánku u detí a adolescentov s diabetes mellitus 1. typu
- Rizikové faktory ovlivňující výsledek léčby novorozenců s hypoxicko-ischemickou encefalopatií léčených řízenou hypotermií
- Možnosti antibiotické léčby akutní sinusitidy
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Možnosti antibiotické léčby akutní sinusitidy
- Etiologie a léčba novorozeneckého diabetu
- Moderní technologie v terapii diabetu 1. typu v dětském věku
- Rizikové faktory ovlivňující výsledek léčby novorozenců s hypoxicko-ischemickou encefalopatií léčených řízenou hypotermií
