Vitamin D u dětí s nespecifickým střevním zánětem
Vitamin D in children with inflammatory bowel disease
The relationship between inflammatory bowel disease and vitamin D is intensively studied, not only in connection with bone metabolism, but also in relation to immunopathological response in the gastrointestinal tract, intestinal microbiota and therapy of underlying disease. Although it is clear that these patients suffer from vitamin D deficiency, it is not yet fully understood, whether vitamin D replacement leads to an improvement in the clinical condition or prognosis of these patients.
Keywords:
inflammatory bowel disease – Ulcerative colitis – Crohn’s disease – vitamin D – children
Authors:
Geryk Miloš; Karásková Eva
Authors‘ workplace:
Dětská klinika, Lékařská fakulta, Univerzita Palackého v Olomouci a FN Olomouc
Published in:
Čes-slov Pediat 2024; 79 (2): 85-88.
Category:
doi:
https://doi.org/10.55095/CSPediatrie2024/011
Overview
Práce byla podpořena grantem IGA_LF_2023_037 a MZ ČR – RVO (FNOl, 00098892).
Vztah nespecifických střevních zánětů a vitaminu D je intenzivně studován nejen v souvislosti s kostním metabolismem, ale rovněž ve vztahu k imunopatologickým dějům v gastrointestinálním taktu, k střevní mikrobiotě a také efektivitě léčby zánětlivých střevních onemocnění. Ačkoliv je zřejmé, že nemocní s nespecifickým střevním zánětem často trpí deficitem vitaminu D, není dosud plně objasněno, zda jeho substituce vede ke zlepšení klinického stavu či prognózy těchto jedinců.
Klíčová slova:
deti – ulcerózní kolitida – vitamín D – Crohnova choroba – nespecifický střevní zánět
Nespecifické střevní záněty
Nespecifické střevní záněty (inflammatory bowel diseases, IBDs) jsou celoživotní chronická zánětlivá střevní onemocnění. Řadíme mezi ně Crohnovu chorobu (Crohnʼs disease, CD), ulcerózní kolitidu (ulcerative colitis, UC) a neklasifikovatelný nespecifický střevní zánět (inflammatory bowel disease unclassified, IBD-U).(1) Incidence IBD u dětí se celosvětově zvyšuje, a to platí i pro Českou republiku.(2) Patogeneze IBD není dosud plně objasněna, předpokládá se podíl genetické predispozice, vlivu střevní mikrobioty a faktorů zevního prostředí.(3) I přes pokroky v terapii IBD dosáhne dlouhodobé remise méně než polovina pacientů.(4) Jsou hledány biomarkery, které by napomohly odlišit pacienty, kteří budou vyžadovat intenzifikovanou terapii již od počátku onemocnění. Dosud nebyl zjištěn žádný konkrétní ukazatel, který by v této souvislosti mohl být použit. Výzkum směřuje k vyhledávání většího počtu biomarkerů a tvorbě prediktivních modelů sestávajících z kombinace těchto ukazatelů. Mezi studovanými molekulami je i vitamin D.
Vitamin D je v tucích rozpustný steroidní hormon, jehož zdroje jsou rostlinné (vitamin D2, ergokalciferol) nebo živočišné (vitamin D3, cholekalciferol) potraviny. Kromě kostního metabolismu zasahuje vitamin D do širokého spektra biologických reakcí včetně modulace systémové imunitní odpovědi, slizničních imunitních procesů v gastrointestinálním traktu a udržení střevní bariérové funkce.(5) V klinické praxi je standardně doporučeno měřit sérový 25(OH)D, který dobře odráží stav zásob v organismu.(6)
Potenciální role nedostatku vitaminu D v patogenezi IBD
Nedostatek vitaminu D (hladina 25(OH)D < 50 nmol/l) je u pacientů s IBD běžný. Jeho výskyt se uvádí mezi 16 až 95 %.(7) Nicméně příčinný vztah mezi deficitem vitaminu D a rozvojem IBD zatím nebyl jednoznačně prokázán a může existovat i vztah opačný, kdy IBD vede k nízkým hladinám vitaminu D. Mnohdy tedy nelze určit, zda deficit vitaminu D je příčinou, nebo následkem IBD.(8,9) Nicméně lze předpokládat, že jeho přítomnost má na průběh, závažnost a terapeutickou odpověď IBD vliv.(7)
Řadu let byl vitamin D spojován především s metabolismem vápníku, fosforu a správnou funkcí kostní tkáně. Zhruba od 80. let, kdy byly objeveny receptory pro vitamin D (VDR) na periferních mononukleárech,(10,11) byla též zvažována jeho role při diferenciaci a maturaci leukocytů. Později byly VDR identifikovány v různých hematopoetických buňkách a potenciální zapojení vitaminu D do imunitní regulace bylo také podpořeno prokázáním lokální produkce aktivního metabolitu vitaminu D – 1,25(OH)2D v makrofázích a dendritických buňkách.(12,13) Vitamin D se může podílet na diferenciaci makrofágů v monocyty, ovlivňuje prezentaci povrchových antigenů a také produkci reaktivních kyslíkových metabolitů a lysosomálních enzymů.(14) V monocytech reguluje expresi Toll-like receptoru, což vede ke snížené imunitní odpovědi na lipopolysacharid (LPS) a potlačení LPS indukované produkce tumor nekrotizujícího faktoru alfa (TNF-α).(15) Vitamin D ovlivňuje také proliferaci a diferen-
ciaci lymfocytů. Zasahuje do diferenciace a maturace dendritických buněk, což vede k potlačení aktivace alloreaktivních T lymfocytů, a naopak podporuje produkci regulačních T lymfocytů.(16–18) Vitamin D stimuluje tvorbu protizánětlivého interleukinu (IL-10) a inhibuje syntézu řady prozánětlivých cytokinů.(7,15,18–20) Jeho působení tak vede různými mechanismy k potlačení reaktivity imunitního systému a nedostatek vitaminu D je spojován s řadou autoimunitních onemocnění včetně IBD.(5,8,9,21)
In vitro studie a studie na zvířatech ukázaly, že signalizace vitaminu D kromě ovlivnění vrozené i získané imunitní odpovědi hraje klíčovou roli v regulaci slizničního imunitního systému. Zlepšuje integritu epiteliální bariéry expresí řady junkčních proteinů, defensinů a mucinů, moduluje zánětlivou odpověď a ovlivňuje složení střevní mikrobioty.(5,9,21)
Vitamin D stimuluje specializované epiteliální Panethovy buňky střeva a buňky lamina propria sliznice (B lymfocyty a plazmatické buňky), což vede k omezení přechodu střevních mikroorganismů a jejich produktů do intersticia. V případě bakteriální invaze do lamina propria imunitní buňky (makrofágy, dendritické buňky a T lymfocyty) eliminují patogeny z postižené tkáně. I v této fázi může vitamin D uplatnit své imunoregulační vlastnosti – inhibuje pomocné Th1 lymfocyty, aktivuje T regulační buňky a obnovuje střevní homeostázu. V epitelu se kromě exprese junkčních proteinů vitamin D podílí také na regulaci autofagie a apoptózy, což přispívá k zajištění správné funkce epiteliální bariéry.(9,22)
Mikrobiota a vitamin D
V poslední době přitahuje velký zájem výzkumných pracovníků střevní mikrobiota. Vitamin D se spolupodílí na modulaci střevní mikroflóry a udržování mikrobiální rovnováhy v gastrointestinálním traktu.(22) Studie, která sledovala možnou souvislost mezi sezónní hladinou vitaminu D v séru a mikrobiálním složením střeva, zjistila u pacientů s IBD sníženou diverzitu střevní mikroflóry. Složení mikrobioty korelovalo se sérovou hladinou vitaminu D, která přímo souvisela se sezónní variabilitou slunečního svitu. V období léto/podzim bylo pozorováno snížení počtu bakteriálních rodů typických pro záněty (Eggerthella lenta, Fusobacterium spp., Bacteroides spp., Collinsella aerofaciens, Helicobacter spp., Rhodococcus spp., Faecalibacterium prausnitzii) a zvýšené množství Pediococcus spp., Clostridium spp. a Escherichia/Shigella spp.(23) Další studie ukázala, že suplementace vitaminem D u pacientů s IBD byla spojena se zvýšenými hladinami prospěšných bakteriálních druhů (Roseburia, Alistipes, Parabacteroides, Faecalibacterium) a nižšími hladinami patogenních bakterií ve srovnání se zdravými jedinci. Účinek suplementace vitaminu D byl však přechodný.(24)
Vztah vitaminu D k aktivitě IBD
Vzájemná vazba mezi hladinami vitaminu D a klinickými ukazateli IBD není dosud jednoznačně objasněna. Studie přinášejí rozporuplné výsledky. Některé práce poukazují na možný protektivní efekt vyšších hladin vitaminu D snižujících riziko rozvoje IBD.(25) Ovšem jiné práce tento efekt nepotvrzují.(26) V nedávné metaanalýze bylo zjištěno, že suplementace vitaminem D může redukovat riziko vzniku relapsu IBD, zejména u dospělých pacientů s CD.(27) Také v souboru pacientů s UC bylo dokumentováno, že sérové hladiny 25(OH)D < 35 ng/ml byly asociovány se zvýšeným rizikem relapsu onemocnění během 1 roku sledování.(28)
Další práce hodnotily efekt podávání vitaminu D na průběh IBD. Ve studii Lina a kol. zjistili u dospělých pacientů s CD substituovaných vitaminem D signifikantně nižší hladiny C-reaktivního proteinu, nižší index aktivity onemocnění (CDAI skóre) i endoskopickou aktivitu (SES-CD skóre) oproti těm bez suplementace.(29) V randomizované placebem kontrolované studii de Bruyn a kol. však nebylo potvrzeno, že by podání vysokých dávek vitaminu D (25 000 IU týdně) působilo preventivně proti rozvoji pooperační rekurence CD po předchozí ileocekální resekci.(30) V další práci, která hodnotila efekt a bezpečnost podání vysoké dávky cholekalciferolu (perorální podání 50 000 IU každý 4.–5. týden nebo 100 000 IU každý 6.–8. týden po dobu 1 roku) u dětí a mladých dospělých s IBD, byla zjištěna bezpečnost i dobrá tolerance podávaných dávek vitaminu D, nicméně i přes uvedenou substituci vysokými dávkami celých 63 % pacientů nedosáhlo během ročního sledování sérové hladiny 25(OH)D > 30 ng/ml. Autoři se domnívají, že pacienti s IBD budou zřejmě vyžadovat vyšší dávkování vitaminem D než běžná populace.(31) S přibývajícími studiemi zabývajícími se efektem substituce vitaminu D na průběh IBD množství odlišných závěrů bohužel narůstá. Loňská velká metaanalýza hodnotící 22 randomizovaných klinických studií, která zahrnula 1874 jedinců, neprokázala, že by substituce vitaminem D ovlivňovala klinickou odpověď pacientů na léčbu IBD nebo riziko relapsu onemocnění. Závěrem autoři uvádějí, že budou nutné další především prospektivní studie hodnotící tuto problematiku.(32)
Vitamin D a biologická léčba
Biologická léčba patří k základním pilířům terapie IBD. V pediatrické populaci jsou nejdéle využívány protilátky proti TNF-α (anti-TNF terapie). Jejich efektivita byla zkoumána i ve vztahu k vitaminu D.
V roce 2021 byla publikována práce amerických autorů hodnotící dopady deficitu vitaminu D (25(OH)D ˂ 30 ng/ml) na efekt anti-TNF léčby u dětských pacientů s CD a UC. Byla zjištěna asociace (nikoliv kauzalita) mezi deficitem vitaminu D a časným selháním anti-TNF léčby.(33) Dánská práce ukázala, že podávání vysoké dávky vitaminu D (5mg bolus následovaný sedmitýdenní aplikací v dávce 0,5 mg/den) oproti podání placeba u dospělých pacientů s CD statisticky významně redukovalo potřebu eskalace dávky infliximabu. Tito pacienti měli signifikantně nižší hladiny kalprotektinu ve stolici v týdnu 15 a týdnu 23.(34) Naproti tomu recentní rozsáhlá studie britských autorů nepotvrdila u dospělých ani pediatrických pacientů s CD efekt předchozího podání vitaminu D pro terapeutický efekt anti-TNF léčby v týdnu 14 ani v týdnu 54.(35) Studován byl rovněž vliv hladin vitaminu D při léčbě vedolizumabem (monoklonální protilátkou proti α4β7 integrinu). Práce Gubatana a kol. ukázala, že hladina vitaminu D před zahájením léčby vedolizumabem může sloužit jako prediktor terapeutické odpovědi na léčbu. Zejména hladiny 25(OH)D ˂ 25 ng/ml byly asociovány s vyšší pravděpodobností primární neefektivity léčby a také jejím selháním rok po zahájení.(36)
Ačkoliv přibývají práce popisující vztah hladin vitaminu D k efektu biologické léčby, není v současné době ani tuto problematiku možné uzavřít a budou třeba další studie ke zpřesnění tohoto vztahu.
Metabolická kostní nemoc u dětí s IBD a vitamin D
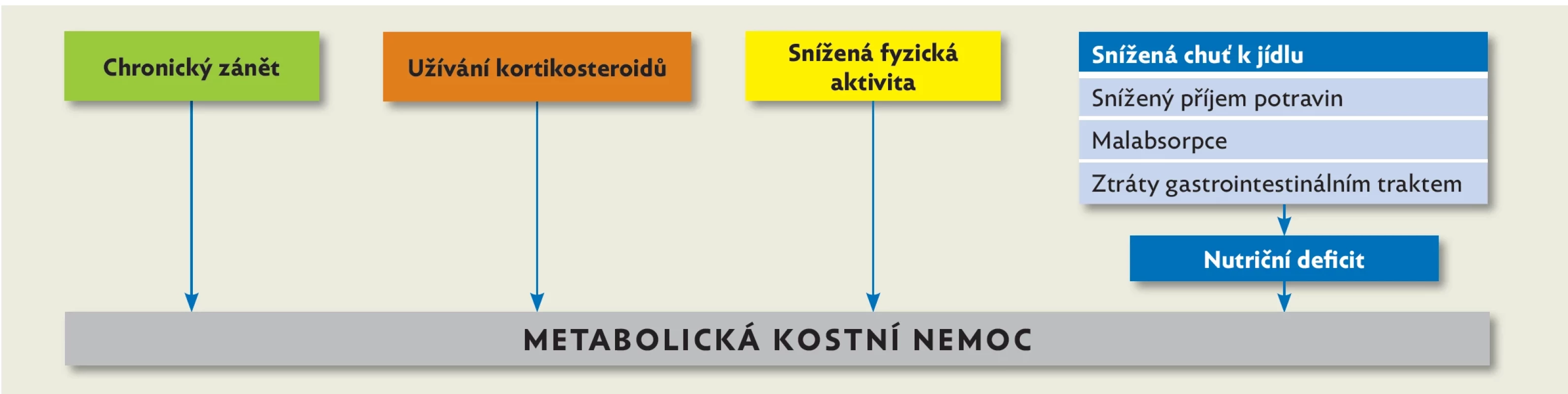
Vitamin D hraje nezastupitelnou roli v regulaci kalcium-fosfátového metabolismu. Dětství je důležité období pro tvorbu a mineralizaci kostí, přičemž pacienti s IBD jsou ohroženi ztrátou kostní hmoty. Etiologie je multifaktoriální, zahrnuje malabsorpci, sníženou fyzickou aktivitu, nesprávnou životosprávu nebo terapii kortikosteroidy (obr. 1).(37) Patofyziologie tohoto procesu je komplexní, je inhibován růst i remodelace kostí.(38) Prevalence výskytu snížené kostní denzity u pacientů s IBD se liší podle užité metodologie od 5 % do 21 %.(39–41) Oproti zdravé populaci bylo zjištěno vyšší riziko kostních fraktur u dospělých pacientů s IBD. U dětí s IBD toto riziko zjištěno nebylo.(42,43) Substituce vitaminem D se v české studii z roku 2017 ukázala jako efektivní a došlo při ní ke zlepšení parametrů kostní denzity.(44)
Doporučení substituce vitaminem D u dětí s IBD
Evropská pracovní skupina pro IBD u dětí doporučuje hladiny vitaminu D pravidelně monitorovat a v případě prokázaného deficitu (při 25(OH)D ˂ 50 nmol/l) má být zahájena substituce. Dosud není k dispozici standardní dávkování u dětí podle jejich hmotnosti. Odborníci se přiklánějí k dávkování 2000 IU (0,05 mg) denně nebo 50 000 IU (1,25 mg) jednou týdně.(45) Z možných schémat podání je u dětí nad 6 let volena nejčastěji dlouhodobá terapie 2000 IU cholekalciferolu denně.(46)
Závěr
Je pravděpodobné, že vitamin D kromě ovlivnění systémové imunitní odpovědi hraje důležitou roli v regulaci slizničního imunitního systému, zlepšuje integritu epiteliální bariéry a má vliv i na složení střevní mikrobioty. Ačkoliv je k dispozici velké množství studií sledujících souvislost mezi hladinou vitaminu D a rizikem vzniku IBD, rizikem relapsu či odpovědí na léčbu, nelze aktuálně toto téma uzavřít jednoznačným doporučením o vhodnosti či nevhodnosti substituční léčby. Přesto je v klinické praxi v případě prokázaného deficitu vitaminu D u pacientů s IBD substituce podávána. V rámci ČR je nejčastěji používána dávka 2000 IU cholekalciferolu denně.
Sources
1. Levine A, Koletzko S, Turner D, et al. European Society of Pediatric Gastroenterology, Hepatology, and Nutrition. ESPGHAN revised porto criteria for the diagnosis of inflammatory bowel disease in children and adolescents. J Pediatr Gastroenterol Nutr 2014; 58(6): 795–806.
2. Jabandziev P, Pinkasova T, Kunovsky L, et al. Regional incidence of inflammatory bowel disease in a Czech pediatric population: 16 years of experience (2002-2017). J Pediatr Gastroenterol Nutr 2020; 70(5): 586–592.
3. Karlinger K, Györke T, Makö E, et al. The epidemiology and the pathogenesis of inflammatory bowel disease. Eur J Radiol 2000; 35(3): 154–67.
4. Bamias G, Rivera-Nieves J. Vitamin D levels may predict response to vedolizumab. J Crohns Colitis 2021; 15(12): 1978–1979.
5. Vernia F, Valvano M, Longo S, et al. Vitamin D in inflammatory bowel diseases. Mechanisms of action and therapeutic implications. Nutrients 2022; 14(2): 269.
6. Berger MM, Shenkin A, Schweinlin A, et al. ESPEN micronutrient guideline. Clin Nutr 2022; 41(6): 1357–1424.
7. Nielsen OH, Rejnmark L, Moss AC. Role of vitamin D in the natural history of inflammatory bowel disease. J Crohns Colitis 2018; 12(6): 742–752.
8. Limketkai BN, Bechtold ML, Nguyen DL. Vitamin D and the pathogenesis of inflammatory bowel disease. Curr Gastroenterol Rep 2016; 18(10): 52.
9. Triantos C, Aggeletopoulou I, Mantzaris GJ, et al. Molecular basis of vitamin D action in inflammatory bowel disease. Autoimmun Rev 2022; 21(8): 103136.
10. Provvedini DM, Tsoukas CD, Deftos LJ, et al. 1,25-dihydroxyvitamin D3 receptors in human leukocytes. Science 1983; 221(4616): 1181–3.
11. Bhalla AK, Amento EP, Clemens TL, et al. Specific high-affinity receptors for 1,25-dihydroxyvitamin D3 in human peripheral blood mononuclear cells: presence in monocytes and induction in T lymphocytes following activation. J Clin Endocrinol Metab 1983; 57(6): 1308–10.
12. Reichel H, Koeffler HP, Norman AW. Synthesis in vitro of 1,25-dihydroxyvitamin D3 and 24,25-dihydroxyvitamin D3 by interferon-gamma-stimulated normal human bone marrow and alveolar macrophages. J Biol Chem 1987; 262(23): 10931–7.
13. Fritsche J, Mondal K, Ehrnsperger A, et al. Regulation of 25-hydroxyvitamin D3-1 alpha-hydroxylase and production of 1 alpha,25-dihydroxyvitamin D3 by human dendritic cells. Blood 2003; 102(9): 3314–6.
14. Kreutz M, Andreesen R, Krause SW, et al. 1,25-dihydroxyvitamin D3 production and vitamin D3 receptor expression are developmentally regulated during differentiation of human monocytes into macrophages. Blood 1993; 82(4): 1300–7.
15. Sadeghi K, Wessner B, Laggner U, et al. Vitamin D3 down-regulates monocyte TLR expression and triggers hyporesponsiveness to pathogen-associated molecular patterns. Eur J Immunol 2006; 36(2): 361–70.
16. Penna G, Adorini L. 1 Alpha,25-dihydroxyvitamin D3 inhibits differentiation, maturation, activation, and survival of dendritic cells leading to impaired alloreactive T cell activation. J Immunol 2000; 164(5): 2405–11.
17. Jeffery LE, Burke F, Mura M, et al. 1,25-dihydroxyvitamin D3 and IL-2 combine to inhibit T cell production of inflammatory cytokines and promote development of regulatory T cells expressing CTLA-4 and FoxP3. J Immunol 2009; 183(9): 5458–67.
18. Daniel C, Sartory NA, Zahn N, et al. Immune modulatory treatment of trinitrobenzene sulfonic acid colitis with calcitriol is associated with a change of a T helper (Th) 1/Th17 to a Th2 and regulatory T cell profile. J Pharmacol Exp Ther 2008; 324(1): 23–33.
19. Palmer MT, Lee YK, Maynard CL, et al. Lineage-specific effects of 1,25-dihydroxyvitamin D(3) on the development of effector CD4 T cells. J Biol Chem 2011; 286(2): 997–1004.
20. Bhalla AK, Amento EP, Krane SM. Differential effects of 1,25-dihydroxyvitamin D3 on human lymphocytes and monocyte/macrophages: inhibition of interleukin-2 and augmentation of interleukin-1 production. Cell Immunol 1986; 98(2): 311–22.
21. Fletcher J, Cooper SC, Ghosh S, et al. The Role of vitamin D in inflammatory bowel disease: mechanism to management. Nutrients 2019; 11(5): 1019.
22. Aggeletopoulou I, Marangos M, Assimakopoulos SF, et al. Vitamin D and microbiome: molecular interaction in inflammatory bowel disease pathogenesis. Am J Pathol 2023; 193(6): 656–668.
23. Soltys K, Stuchlikova M, Hlavaty T, et al. Seasonal changes of circulating 25-hydroxyvitamin D correlate with the lower gut microbiome composition in inflammatory bowel disease patients. Sci Rep 2020; 10(1): 6024.
24. Schäffler H, Herlemann DP, Klinitzke P, et al. Vitamin D administration leads to a shift of the intestinal bacterial composition in Crohn’s disease patients, but not in healthy controls. J Dig Dis 2018; 19(4): 225–234.
25. Ananthakrishnan AN, Khalili H, Higuchi LM, et al. Higher predicted vitamin D status is associated with reduced risk of Crohn’s disease. Gastroenterology 2012; 142(3): 482–9.
26. Hassan V, Hassan S, Seyed-Javad P, et al. Association between serum 25 (OH) vitamin D concentrations and inflammatory bowel diseases (IBDs) activity. Med J Malaysia 2013; 68(1): 34–8.
27. Valvano M, Magistroni M, Cesaro N, et al. Effectiveness of vitamin D supplementation on disease course in inflammatory bowel disease patients: systematic review with meta-analysis. Inflamm Bowel Dis 2022: izac253.
28. Gubatan J, Mitsuhashi S, Zenlea T, et al. Low serum vitamin D during remission increases risk of clinical relapse in patients with ulcerative colitis. Clin Gastroenterol Hepatol 2017; 15(2): 240–246.e1.
29. Lin X, Wu X, Zhang Y, et al. Effect of vitamin D supplementation on clinical course and T helper 17/ T-regulatory balance in peripheral blood of patients with Crohn’s disease. Turk J Gastroenterol 2023; 34(5): 463–471.
30. de Bruyn JR, Bossuyt P, Ferrante M, et al. Dutch-Belgian The Effect of Vitamin D3 to Prevent Postoperative Relapse of Crohn’s Disease: A Placebo-controlled Randomized Trial Study Group. High-dose vitamin D does not prevent postoperative recurrence of Crohn’s disease in a randomized placebo-controlled trial. Clin Gastroenterol Hepatol 2021; 19(8): 1573–1582.e5.
31. Gordon RJ, Wells R, Johansen C, et al. Efficacy and safety of high-dose cholecalciferol in patients with inflammatory bowel disease receiving infliximab. J Pediatr Gastroenterol Nutr 2022; 74(4): 476–483.
32. Wallace C, Gordon M, Sinopoulou V, et al. Vitamin D for the treatment of inflammatory bowel disease. Cochrane Database Syst Rev 2023; 10(10): CD011806.
33. Hizarcioglu-Gulsen H, Kaplan JL, Moran CJ, et al. The impact of vitamin D on response to anti-tumor necrosis factor-α therapy in children with inflammatory bowel disease. J Pediatr Gastroenterol Nutr 2021; 72(5): e125–e131.
34. Bendix M, Dige A, Jørgensen SP, et al. Seven weeks of high-dose vitamin D treatment reduces the need for infliximab dose-escalation and decreases inflammatory markers in Crohn’s disease during one-year follow-up. Nutrients 2021; 13(4): 1083.
35. Chanchlani N, Lin S, Smith R, t al. Pretreatment vitamin D concentrations do not predict therapeutic outcome to anti-TNF therapies in biologic-naïve patients with active luminal Crohn’s disease. Crohns Colitis 360 2023; 5(3): otad026.
36. Gubatan J, Rubin SJS, Bai L, et al. Vitamin D is associated with α4β7+ immunophenotypes and predicts vedolizumab therapy failure in patients with inflammatory bowel disease. J Crohns Colitis 2021; 15(12): 1980–1990.
37. Olczyk M, Czkwianianc E, Socha-Banasiak A. Metabolic bone disorders in children with inflammatory bowel diseases. Life (Basel) 2022; 12(3): 423.
38. Sylvester FA, Wyzga N, Hyams JS, et al. Natural history of bone metabolism and bone mineral density in children with inflammatory bowel disease. Inflamm Bowel Dis 2007; 13(1): 42–50.
39. Jin HY, Lim JS, Lee Y, et al. Growth, puberty, and bone health in children and adolescents with inflammatory bowel disease. BMC Pediatr 2021; 21(1): 35.
40. Masip E, Donat E, Polo Miquel B, et al. Bone mineral density in spanish children at the diagnosis of inflammatory bowel disease. Arch Osteoporos 2021; 16(1): 96.
41. Kärnsund S, Lo B, Bendtsen F, et al. Systematic review of the prevalence and development of osteoporosis or low bone mineral density and its risk factors in patients with inflammatory bowel disease. World J Gastroenterol 2020; 26(35): 5362–5374.
42. Kappelman MD, Galanko JA, Porter CQ, et al. Risk of diagnosed fractures in children with inflammatory bowel diseases. Inflamm Bowel Dis 2011; 17(5): 1125–30.
43. Bernstein CN, Blanchard JF, Leslie W, et al. The incidence of fracture among patients with inflammatory bowel disease. A population-based cohort study. Ann Intern Med 2000; 133(10): 795–9.
44. Hradsky O, Soucek O, Maratova K, et al. Supplementation with 2000 IU of cholecalciferol is associated with improvement of trabecular bone mineral density and muscle power in pediatric patients with IBD. Inflamm Bowel Dis 2017; 23(4): 514–523.
45. Miele E, Shamir R, Aloi M, et al. Nutrition in pediatric inflammatory bowel disease: a position paper on behalf of the Porto Inflammatory Bowel Disease Group of the European Society of Pediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr 2018; 66(4): 687–708.
46. Maratová K, Hradský O, Souček O, et al. Vitamin D a jeho suplementace u dětských pacientů se zánětlivým střevním onemocněním. Pediatr praxi 2018; 19(4): 190–194.
Labels
Neonatology Paediatrics General practitioner for children and adolescentsArticle was published in
Czech-Slovak Pediatrics

2024 Issue 2
- What Effect Can Be Expected from Limosilactobacillus reuteri in Mucositis and Peri-Implantitis?
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Vitamin D in enteral and parenteral nutrition
- Vitamin D and immunity
- The role of vitamin D in children with chronic kidney disease
- Vitamin D in children with inflammatory bowel disease
- Vitamin/hormone D in pediatric rheumatology – minireview and summary for clinical practice
- Pathophysiology in paediatrics: What laboratory parameters are suitable for nutrition status assessment?
- Impact of celiac disease on adolescent’s quality of life
- Bartter syndrome in children: a series of eight cases from the Czech Republic and Slovakia
- Cardiovascular and metabolic complications of childhood obesity
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Pathophysiology in paediatrics: What laboratory parameters are suitable for nutrition status assessment?
- Vitamin D and immunity
- Cardiovascular and metabolic complications of childhood obesity
