PROGNOSTICKÝ VÝZNAM EXPRESE p53, Ki-67 VE TKÁNI UROTELIÁLNÍHO KARCINOMU A NENÁDOROVÉ SLIZNICI MOČOVÉHO MĚCHÝŘE
PROGNOSTIC VALUE OF p53, Ki-67 EXPRESSION IN THE UROTHELIAL CARCINOMA TISSUE AND URINARY BLADDER NONTUMOR MUCOSA
Aim:
The aim of the prospective study was to assess the prognostic value of p53, Ki-67 expression level in the urothelial carcinoma tissue and in the samples of urinary bladder non-tumor mucosa.
Material and methods:
Forty eight patients with first history of Ta, T1 urinary bladder carcinoma were enrolled into the study. They were all followed for 31,3 month at average. Primary antibodies (Imunotech/ DAKO) were used to detect p53 and Ki-67 positivity. The expression was evaluated semi quantitatively and expressed as HSCORE, where HSCORE = Σpi (i + 1), in which I is one of the four positivity grades, Pi stands for the positive nuclei percentage. All patients were included into the follow-up program. The results were evaluated in the statistical system SAS (Cary, USA).
Results:
The tumor recurrence was detected in 21 patients, and tumor progression in four patients. The average p53 expression value in the tumor samples was 139.3, in the samples of non-tumor mucosa was 118.2. The average Ki-67 values were 126.2 in the tumor samples and 107.6 in the non tumor mucosa. P53 positivity in the tumor and non-tumor mucosa correlated significantly (p = 0.0019), nevertheless, not the same relation was found for Ki-67. The level of expression Ki-67 in non tumor musoca correlated significantly with recurrence-free interval (p = 0.023), the cut-off level was calculated 127.66. Ki-67 and p53 expression in the tumor tissue were significantly related to the tumor grade (p = 0.003 and p = 0.004, resp.). The level of Ki-67 expression in non-tumor mucosa and tumor multiplicity had independent prognostic value in the relation to the cancer recurrence.
Conclusion:
The level of p53, Ki-67 expression in tumor tissue correlated with those levels in non-tumor mucosa. The level of Ki-67 expression in nontumor mucosa brings independent prognostic information in relation to the cancer recurrence and could be the cause of urinary bladder urothelial carcinoma multiplicity. Further research has to be done for the final assessment.
Key words:
urinary bladder urothelial carcinoma, nontumor mucosa, p53, Ki-67.
:
Viktor Soukup 1; Marko Babjuk 1; Jaroslava Dušková 2; Michael Pešl 1; Monika Szakácsová 1; Libor Zámečník 1; Jan Dvořáček 1; Ctibor Povýšil 2
:
Katedra urologie IPVZ, Urologická klinika 1. LF UK a VFN, Praha
1; Patologický ústav 1. LF UK a VFN, Praha
2
:
Ces Urol 2009; 13(2): 161-167
:
Original article
Cíl:
Cílem prospektivní studie bylo posoudit prognostický význam exprese p53, Ki-67 ve tkáni uroteliálního karcinomu a ve vzorcích z nenárodové sliznice močového měchýře.
Materiál a metoda:
Do studie bylo zařazeno 48 pacientů s primozáchytem Ta, T1 uroteliálního karcinomu močového měchýře, kteří byli sledováni průměrně 31,3 měsíce. K imunohistochemické detekci p53 a Ki-67 byly použity primární protilátky (Immunotech/DAKO). Míra exprese byla hodnocena semikvantitativně a vyjádřena pomocí tzv. HSCORE, přičemž platí, že HSCORE = ΣPi (i + 1), kde i je jeden ze čtyř stupňů pozitivity, Pi je procento pozitivních jader. Pacienti byli sledováni dle obvyklých schémat.
Výsledky:
Byly hodnoceny pomocí statistického systému SAS (Cary, USA). K recidivě tumoru došlo u 21 pacientů, k progresi u 4 pacientů. Průměrná hodnota exprese p53 hodnocená jako H-SCORE ve vzorcích z tumoru byla 139,3, ve vzorcích z nenádorové sliznice 118,2. Pro Ki-67 byly hodnoty 126,2 v tumoru a 107,6 v nenádorové sliznici. Míra exprese p53 v tumoru a v nenádorové sliznici spolu signifikantně souvisely (p = 0,0019), stejný vztah nebyl zjištěn pro Ki-67. S intervalem bez recidivy onemocnění z vyšetřovaných parametrů souvisela pouze míra exprese Ki-67 v nenádorové sliznici (p = 0,023), hraniční hodnota HSCORE byla vypočítána na 127,66. Exprese p53, Ki-67 ve tkáni tumoru signifikantně souvisela s nádorovým grade (p = 0,003 a p = 0,004). V multivariantní analýze pouze míra exprese Ki-67 v nenádorové sliznici a multifokalita měly nezávislou předpovědní hodnotu ve vztahu k recidivě onemocnění.
Závěr:
U pacientů s uroteliálním karcinomem močového měchýře exprese p53 a Ki-67 v tumoru a v nenádorové sliznici spolu navzájem souvisí. Exprese Ki-67 v nenádorové sliznici přináší nezávislou prognostickou informaci ve vztahu k riziku recidivy tumoru, a může tak mít souvislost s výskytem metachronní multiplicity uroteliálního karcinomu močového měchýře. Definitivní hodnocení bude možné po provedení rozsáhlejších studií.
Klíčová slova:
uroteliální karcinom močového měchýře, nenádorová sliznice, p53, Ki-67.
ÚVOD
Uroteliální karcinom močového měchýře (KMM) patří mezi druhou nejčastější malignitu urogenitálního traktu. V době diagnózy je u 70–80 % pacientů zjištěn nádor, který je lokalizován pouze ve sliznici či podslizničním vazivu a lze jej kompletně odstranit transuretrální resekcí. Víme, že u více než 80 % těchto pacientů dojde v průběhu dlouhodobého sledování k recidivě tumoru, z toho v 10 až 15 % případů se jedná o formu invazivního tumoru močového měchýře (1, 2). Pro léčbu nemocných s nádorem močového měchýře má zcela zásadní význam odhad budoucího chování malignity. K určení prognózy se již běžně používají klinické prognostické faktory, mezi které patří hloubka nádorové invaze, míra histologické diferenciace, velikost nádoru, počet nádorů, počet předchozích recidiv a přítomnost carcinoma in situ. Výše vyjmenované prognostické faktory umožní zařazení pacienta do příslušné rizikové skupiny, což určuje další způsob léčby a sledování. I přesto, že je na jejich základě předpovědět průběh onemocnění daného pacienta, pokračuje výzkum na poli molekulárně prognostických markerů.
Jednou z nejvýznamnějších charakteristik karcinomu močového měchýře je četný výskyt synchronní a metachronní multifokality. Bylo prokázáno, že nemocní s mnohočetným tumorem mají vyšší riziko recidivy (2, 3). Mechanismus vzniku synchronní a metachronní mutifokality uroteliálního KMM však zůstává nejasný. Doposud byly publikovány dvě základní hypotézy. Podle první je příčinou multifokality migrace nádorových buněk z primárního tumoru do nenádorového urotelu. Tuto teorii podporuje analýza multifokálních a recidivujících tumorů, podle které tyto tumory mají identický klonální původ (4–6). Druhá základní teorie je teorie plošného defektu, která je založena na předpokladu, že do vytváření tumorů je zavzata sliznice jako celek a karcinom močového měchýře může být považován za slizniční onemocnění. Podle této teorie dochází působením karcinogení události k tvorbě mnoha částečně transformovaných buněčných klonů, přičemž pokud v těchto buňkách dojde k dalšímu genetickému poškození, vznikne oligoklonální tumor (7–10). Názor na příčinu multifokality KMM není tedy doposud jednoznačný a měl by být předmětem dalšího zkoumání.
Mutace genu TP53 patří mezi časté genetické abnormality u většiny papilárních i invazivních uroteliálních karcinomů močového měchýře. U těchto nádorů lze imunohistochemicky zjistit zvýšenou expresi proteinu p53 v buněčném jádře. Jaderný antigen Ki-67, marker buněčné proliferace, koreluje s mírou růstu řady lidských nádorů včetně uroteliálního karcinomu. Díky pravidelnosti, s jakou je u karcinomu močového měchýře přítomna zvýšená exprese p53 a zvýšená proliferační aktivita Ki-67, lze tyto použít jako markery uroteliálních buněk s významným genetickým poškozením (11).
MATERIÁL A METODA
V rámci prospektivní studie byly vyšetřeny vzorky tkáně tumoru a nenádorové sliznice u 48 nemocných s primozáchytem povrchového uroteliálního karcinomu močového měchýře. Biopsie z nenádorové sliznice byla provedena v době transuretrální resekce tumoru měchýře z místa vzdáleného alespoň 3 cm od okraje tumoru. To, že se jednalo o povrchový nádor a nenádorovou sliznici, bylo potvrzeno histologicky.
K detekci proteinu p53 byla použita protilátka BP53-12-1. Řezy byly odparafinovány a zavodněny. Antigen byl demaskován varem v tlakovém hrnci v citrátovém pufru pH 6 po dobu 5 minut, po oplachu destilovanou vodou a vystavení neimunnímu séru a bez oplachu se preparát inkuboval po dobu 70 minut s primární protilátkou p53 (užita od fy Immunotech) při pokojové teplotě. Následoval oplach v PBS pufru pH 7,4–7,6 třikrát po dobu 5 minut, následně inkubace se spojovací biotinizovanou protilátkou 10 minut při pokojové teplotě, opět oplach v PBS pufru pH 7,4–7,6 třikrát po dobu 5 minut, po té působení streptavidin – peroxidázovového komplexu 10 minut při pokojové teplotě, oplach v PBS pufru pH 7,4–7,6 třikrát po dobu 5 minut. Následovalo vyvolání peroxidázové reakce v DAB 10–20 minut, oplach destilovanou vodou třikrát. Pro zesílení barevné intenzity bylo použito moření 3–5% roztokem CuSO4 a dobarvení jader hematoxylinem po dobu 30 sekund.
Postup při detekci Ki-67 byl obdobný, byla použita primární protilátka MIB-1 1 : 50, inkubace 70 minut při pokojové teplotě, po oplachu v PBS pufru pH 7,4–7,6 třikrát po dobu 5 minut následovala inkubace Histofine 30 minut a po dalším oplachu v PBS pufru pH 7,4–7,6 třikrát po dobu 5 minut vyvolání peroxidázové reakce v DAB po dobu 5 minut. Jádra byla dobarvena Harrisovým hematoxylinem.
Za pozitivní zbarvení byla použita pouze jaderná imunoreaktivita. Hodnoceno bylo vždy minimálně 200 jader v několika reprezentativních polích. K interpretaci nálezů byla použita metoda McCartyho v modifikaci dle Bacusové. Tento postup usiluje o vyšší stupeň objektivity využitím počítačové techniky. Jde o semikvantitativní metodu, která bere v úvahu nejen procento pozitivních nádorových buněk, ale rovněž intenzitu pozitivity kvantifikovanou do čtyř stupňů: 0 – negativní, 1 – slabě pozitivní, 2 – pozitivní distinktně, 3 – pozitivní silně. Vyčísluje se tzv. HSCORE, přičemž HSCORE = ΣPi (i + 1), kde i je některý ze 4 výše uvedených stupňů a Pi kolísá od 0 do 100 %. Výsledkem je číselný údaj dosahující hodnot od 100 do 400. Zcela negativní nález má hodnotu HS 100, nejvyšší možnou hodnotou je pak HS 400. Zpracované preparáty byly zobrazeny v obrazově analytickém systému LUCIA na obrazovce a pomocí speciálního soft waru bylo zařazeno do příslušné skupiny minimálně 200 jader v několika reprezentativních polích (obr. 1, 2).
Všichni pacienti byli následně sledováni dle obvyklých schémat zahrnujících pravidelné cystoskopické a cytologické kontroly. Intravezikální chemoterapie nebo imunoterapie byly indikovány dle obvyklých kritérií.
STATISTICKÉ HODNOCENÍ
Veškerá statistická analýza byla vypracována pomocí systému SAS (Statistical Analysis Systém, SAS version 8.2, SAS Inc., Cary, NC, USA). Funkce přežití bez návratu choroby a časy do progrese byly porovnány pomocí Log-Rank testu a Wilcoxonova zobecněného testu. Metoda dle Kaplana-Meiera (zvaná též product limit method) byla užita pro odhad funkcí přežití. Porovnání středních poloh dvou distribucí bylo provedeno pomocí ANOVA testu nebo dle Wilcoxonova nepárového testu. Souvislost mezi nominálními parametry byla testována χ-kvadrát testem. Všechny testované hypotézy byly oboustranné a předem byla zvolena hladina významnosti α = 0,05. Všechny testované hypotézy H0 vs. H1 byly formulovány před sběrem dat a nebyla užita žádná z metod adjustace pro mnohonásobná porovnávání.
VÝSLEDKY
Do studie bylo zařazeno celkem 48 pacientů s primozáchytem TaT1 uroteliálního karcinomu močového měchýře. Průměrný věk pacientů v době diagnózy byl 67,1 let. Jednalo se o 40 mužů a 8 žen. K recidivě tumoru během sledování došlo u 21 pacientů, k progresi do invazivního tumoru u 4 pacientů. Průměrná doba sledování byla 31,3 měsíce (tab. 1).
Vztah mezi expresí p53, Ki-67 v tumoru a nenádorové sliznici
Průměrná hodnota exprese p53 hodnocená jako H-SCORE ve vzorcích z tumoru byla 139,29, ve vzorcích z nenádorové sliznice 118,24. Vyšší exprese p53 v tumoru signifikantně souvisela se zvýšenou hodnotou p53 v nenádorové sliznici (p = 0,0019, korelační koeficient -0,437). Stejně i míra exprese Ki-67 v nádorové tkáni byla vyšší (126,62) ve srovnání s mírou exprese ve vzorcích z nenádorové sliznice (107,76), vzájemná souvislost mezi těmito parametry však nebyla statisticky významná (p = 0,2887).
Vztah mezi expresí sledovaných parametrů a rizikem recidivy a progrese tumoru
Míra exprese p53 v nádorové tkáni a nenádorové sliznici nesouvisela s přežíváním bez recidivy onemocnění (p = 0,39 a p = 0,32). Stejně i míra exprese Ki-67 ve tkáni nádoru neměla souvislost dobou do recidivy onemocnění (p = 0,55). Statisticky významná souvislost mezi dobou do vzniku recidivy onemocnění byla zjištěna pro míru exprese Ki-67 ve vzorcích z nenádorové sliznice (p = 0,0232). Pomocí Coxova modelu proporcionálních rizik byl stanoven cutoff míry exprese Ki-67 na hodnotu 127,66. Pacienti s touto hodnotou měli 3,8× vyšší riziko recidivy onemocnění než pacienti s hodnotou pod 127,66. Viz Kaplan-Maierovy křivky (obr. 3).
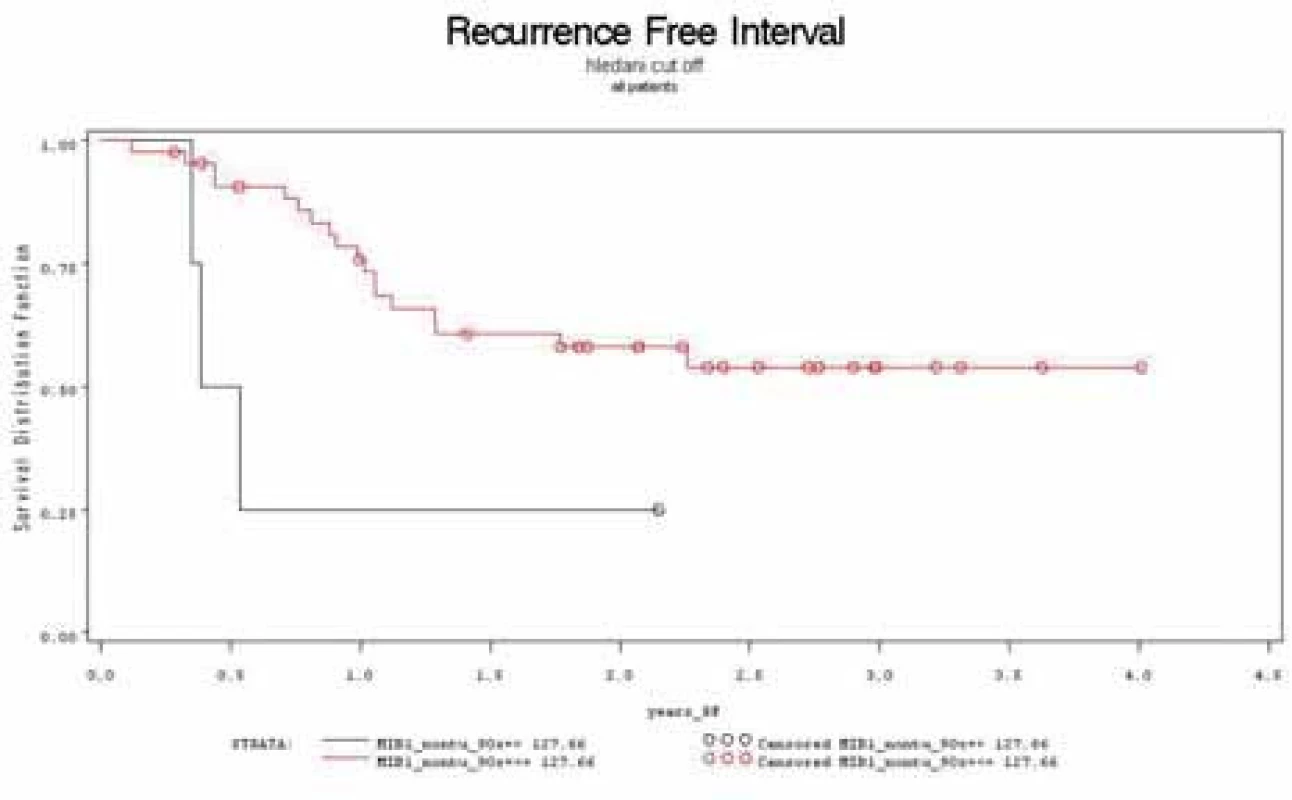
V našem souboru došlo k progresi pouze u čtyř pacientů. Takto malý počet nelze validně statisticky analyzovat.
Vyslovení, zda existuje nějaká souvislost mezi mírou exprese p53 a Ki-67 v tumoru a nenádorové sliznici a ostatními sledovanými parametry
Byla hodnocena souvislost mezi mírou exprese p53, MIB1 ve tkáni tumoru a hloubkou nádorové invaze, nádorovým gradem, přítomností TIS, multifokalitou a velikostí tumoru. Ze všech sledovaných parametrů se ukázala statisticky významná pouze souvislost mezi mírou exprese p53 v tumoru a mírou histologické diferenciace (p = 0,003), dále mezi mírou exprese Ki-67 v tumoru a mírou histologické diferenciace (p = -0,004).
Pro míru exprese p53 a Ki-67 ve vzorcích z nenádorové sliznice byla ze sledovaných parametrů významná pouze souvislost mezi expresí p53 a mírou histologické diferenciace tumoru (p = 0,0392), pro Ki-67 tento vztah nebyl potvrzen.
Multivariační analýza
Ve vztahu k recidivě onemocnění byly do multivariačního Coxova regresního modelu zařazeny tyto proměnné: hodnota exprese p53 a Ki-67 v tumoru a nenádorové sliznici, hloubka nádorové invaze, nádorový grade, nález TIS, velikost tumoru a multifokalita.
Nezávislými prediktory recidivy byly multifokalita (p = 0,0273) a míra exprese Ki-67 v nenádorové sliznici (p = 0,0358). Pacienti s mnohočetným tumorem měli téměř 3,6× vyšší riziko recidivy onemocněni než pacienti se solitárním tumorem. Pacienti s Ki-67 v nenádorové sliznici vyšším než 127,66 měli 6× vyšší riziko recidivy než pacienti s hodnotou nižší než 127,66. Multifokalita a míra exprese Ki-67 byly na sobě vzájemně nezávislé, jejich korelační koeficient byl 0,064 (tab. 2).

DISKUSE
Pro stanovení účinné léčby karcinomu močového měchýře je zásadní určit, zda se jedná o onemocněním celého urotelu nebo zda je příčinou multifokality a recidiv KMM intraepiteliální migrace nádorových buněk a vznik intraepiteliálních implantačních metastáz.
Nález genetických změn v nádorových a současně i nenádorových buňkách urotelu v době diagnózy uroteliálního karcinomu podporuje teorii plošného genetického defektu.
Srovnávání míry imunohistochemické exprese p53 v tumoru a ve vzorcích z nenádorové sliznice provedl A. Pycha, který detekoval zvýšenou expresi p53 jak ve vzorcích z tumoru, tak i ve vzorcích z nenádorové sliznice, přičemž míra exprese v karcinomu byla 3,5× vyšší než ve vzorcích z nenádorové sliznice (12). Podstatný byl nález zvýšené exprese právě i v nenádorové sliznici, který nebyl v dříve publikovaných pracích uváděn (13–15). V našem souboru jsme rovněž potvrdili vyšší než nulovou míru exprese p53 a Ki-67 ve vzorcích z nenádorového urotelu.
V dřívější práci jsme na jiném souboru nemocných zjistili statisticky významnou souvislost mezi mírou exprese p53 v nenádorovém urotelu a rizikem recidivy onemocnění (16). Na tomto souboru byl tento vztah rovněž patrný, nebyl však statisticky významný. Zásadní odlišnosti obou souborů jsou následující: v prvním byli pacienti s primozáchyty i recidivujícími tumory, zatímco do druhého byli zařazeni pouze nemocní s primozáchytem nádoru. Určitým limitem obou prací je nízký počet pacientů.
Rovněž počet nemocných s progresí nádoru byl v našem souboru malý, prognostický význam exprese sledovaných parametrů z toho důvodu nebylo možno hodnotit. Prokázána byla však souvislost mezi mírou exprese p53 v nenádorovém urotelu a mírou exprese p53 v tumoru, stejně i mírou histologické diferenciace tumoru. Z tohoto úhlu pohledu je možné očekávat určitý prognostický význam exprese p53 v nenádorovém urotelu i ve vztahu k riziku budoucí progrese tumoru, což by mělo být předmětem dalšího zkoumání.
Do studie byli zařazeni pouze pacienti s primozáchytem nádoru měchýře. Na základě našich výsledků lze kostatovat, že již v době diagnózy lze v nenádorové sliznici objevit genetické změny. Studená biopsie z nenádorové sliznice byla odebírána před zahájením transuretrální resekce, vznik implantačních metastáz v důsledku uvolnění nádorových buněk při tranuretrální resekci je málo pravděpodobný.
Pro hodnocení prognostického významu změn v nenádorové sliznici je imunohistochemická detekce exprese p53 a Ki-67 výhodná. Právě imunohistochemie umožní posouzení bioptického vzorku patologem a určení, zda se skutečně jedná o nenádorový urotel. Zvýšená exprese Ki-67 ve vzorcích sliznice, které se jeví při běžném histologickém vyšetření jako normální, nám dává informaci o zvýšené proliferační aktivitě v nenádorové sliznici. Signifikantní souvislost s dobou do recidivy je toho důkazem. Průkaz stejné souvislosti na větším souboru pacientů by znamenal možnost použití dalšího molekulárního prognostického faktoru pro odhad rizika recidivy uroteliálního karcinomu močového měchýře.
ZÁVĚR
U pacientů s uroteliálním karcinomem močového měchýře exprese p53 v tumoru a v nenádorové sliznice spolu navzájem souvisí. Exprese MIB1 v nenádorové sliznici přináší nezávislou prognostickou informaci ve vztahu k riziku recidivy tumoru a může se spolupodílet na vzniku metachronní multiplicity uroteliálního karcinomu močového měchýře. Definitivní hodnocení bude možné po provedení rozsáhlejších studií.
Práce byla podpořena grantem IGA MZ NR 8934-3/2006.
Došlo: 11. 11. 2008.
Přijato: 3. 12. 2008.
Kontaktní adresa
MUDr. Viktor Soukup, Ph.D, FEBU
Urologická klinika 1. LF UK a VFN,
Katedra urologie IPVZ Ke Karlovu 6,
128 00 Praha 2
e-mail: viktor.soukup@centrum.cz
Sources
1. Lamm DL. Long-term results of intravesical therapy for superficial bladder cancer. Urol Clin North Am 1992; 19 : 573–580.
2. Heney NM, Ahmed S, Flanaghan MJ, Frable W, Corder MP, Hafermann MD, Hawkins IR. Superficial bladder cancer: Progression and recurrence. J Urol 1983; 130 : 1083–1086.
3. Holmang S, Hedelin H, Anderström C, et al. Recurrence and progression in low grade papillary urothelial tumors. J Urol 1999; 162 : 702–707.
4. Sidransky D, Frost P, Von Eschenbach A, et al. Clonal origin bladder cancer. N Engl J Med 1992; 326, 737–740.
5. Takahashi T, Habuchi T, Kakehi Y, et al. Clonal and chronological genetic analysis of multifocal cancers of the bladder and upper urinary tract. Cancer Res 1998; 58 : 5835–5841.
6. Fadl-Elmula I, Gorunova L, Mandahl N, et al. Cytogenetic monoclonality in multifocal uroepithelial carcinomas: evidence of intraluminal tumor seeding. Br J Cancer 1999; 81 : 6–12.
7. Heney NM, Daly J, Prout GR, et al. Biopsy of apparently normal urothelium in patients with bladder carcinoma. J Urol 1978; 120 : 559–560.
8. Igawa M, Urakami S, Shirakawa H, et al. A mapping of histology and cell proliferation in human bladder cancer: an immunohistochemical study. Hiroshima J Med Sci 1995; 44 : 93–97.
9. Koss LG. Mapping of the urinary bladder: its impact on the concepts of bladder cancer. Hum Pathol 1979; 10 : 533–548.
10. Stoehr R, Zietz S, Burger M, et al. Deletions of chromosomes 9 and 8p in histologically normal urothelium of patients with bladder cancer. Eur Urol 2005; 47 : 58–63.
11. Sun W, Zhang PL, Herrera AG. p53 Protein and Ki–67 overexpression in urothelial dysplasia of bladder. Appl Immunohistochem Mol Morphol 2002; 10(4): 327–331.
12. Pycha A, Mian C, Hofbauer J, et al. Multifocality of transitional cell carcinoma results from genetic instability of entire transitional epithelium. Urology 1999; 53 : 92–97.
13. Spruck CH III, Ohneseit PF, Gonzales-Zulueta M, et al. Two molecular pathways to transitional cell carcinoma of the bladder. Cancer Res 1994; 54 : 784–788.
14. Sidransky D, Von Eschenbach A, Tsai YC, et al. Identification of p53 gene mutations in bladder cancers and urine samples. Science 1991; 252 : 706–709.
15. Dalbaghi G, Presti JC, Reuter VE, et al. Molecular genetic alterations of chromosome 17 and p53 nuclear overexpression in human bladder cancer. Diagn Mol Pathol 1993; 2 : 4–13.
16. Soukup V, Babjuk M, Dušková J, Pešl M, Szakázcová M, Zámečník L, Dvořáček J. P53 pozitivita v nenádorové sliznici u pacientů s povrchovým uroteliálním karcinomem močového měchýře. Čas Lék čes 2007; 146 : 63–67.
Labels
Paediatric urologist Nephrology UrologyArticle was published in
Czech Urology

2009 Issue 2
-
All articles in this issue
- DEVELOPMENT AND CLINICAL EVALUATION OF NEW DRUGS
- INTERDISCIPLINARY COMMUNICATION BETWEEN UROLOGIST AND ONCOLOGIST AND ITS IMPLEMENTATION IN HORMONE REFRACTORY PROSTATE CANCER
- PROGNOSTIC VALUE OF p53, Ki-67 EXPRESSION IN THE UROTHELIAL CARCINOMA TISSUE AND URINARY BLADDER NONTUMOR MUCOSA
- OUR EARLY EXPERIENCE WITH ROBOTIC-ASSISTED LAPAROSCOPIC RADICAL PROSTATECTOMY - FIRST 153 CASES
- ATYPICAL TORSION OF THE TESTICULAR APPENDIX
- Czech Urology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- ATYPICAL TORSION OF THE TESTICULAR APPENDIX
- PROGNOSTIC VALUE OF p53, Ki-67 EXPRESSION IN THE UROTHELIAL CARCINOMA TISSUE AND URINARY BLADDER NONTUMOR MUCOSA
- DEVELOPMENT AND CLINICAL EVALUATION OF NEW DRUGS
- OUR EARLY EXPERIENCE WITH ROBOTIC-ASSISTED LAPAROSCOPIC RADICAL PROSTATECTOMY - FIRST 153 CASES
