LYMFOMY UROGENITÁLNÍHO TRAKTU
UROGENITAL LYMPHOMA
Aim:
The aim of this report is to describe the issue of lymphomas of urological organs through the analysis of our own patients.
Methods:
At the Departement of Urology in Pilsen the diagnosis of malignant lymphoma occured in ten patients in the period 2010 till 2015. We performed a retrospective analysis of the diagnostic process, disease course and outcome. Histology for confirmation of the diagnosis was obtained by surgical operation or targeted biopsy. The patients were thereafter treated by immunochemotherapy R-CHOP (rituximab, cyklophoshamid, vincristine, adriamycin/doxorubicin, prednisone) or R-COP (without doxorubicin).
Results:
Most frequent were testicular lymphomas in seven patients, one case of right adrenal lymphoma, one lymphoma of peripelvic tissue of left kidney and one patient with lymphoma of the small pelvis in close contact to the urinary bladder. Six patients with testicular lymphoma and the patient with lymphoma of peripelvic tissue achieved complete remission. In one patient with testicular lymphoma and the patient with lymphoma of the small pelvis the therapy was ongoing and regression of findings were documented at the time of publication. The patient with adrenal lymphoma achieved partial remission.
Conlusion:
Primary or secondary urogenital lymphomas are rare urological malignancies. Nevertheless this illness should be contemplated in the differential diagnosis. The role of urologist is to provide surgical treatment and histological verification of the disease, followed by haematooncologal therapy. Early diagnosis and prompt treatment is fundamental for inducing complete remission and for long-term survival of patients with this disease.
Key words:
Malignant lymphoma, urogenital lymphoma, testicular lymphoma, immunochemotherapy.
Authors:
Daniela Kovářová 1; Samuel Vokurka 2; Olga Dolejšová 1; Milan Hora 1; Jana Kuntscherová 3; Boris Kreuzberg 4; Zdeněk Chudáček 5
Authors‘ workplace:
Urologická klinika LF UK a FN Plzeň
1; Hematologicko-onkologické oddělení LF UK a FN Plzeň
2; Šiklův ústav patologie LF UK a FN Plzeň
3; Klinika zobrazovacích metod LF UK a FN Plzeň
4; Radiodiagnostické oddělení LF UK a FN Plzeň
5
Published in:
Ces Urol 2015; 19(3): 201-209
Category:
Original Articles
Overview
Cíl:
Cílem našeho sdělení je přiblížit problematiku lymfomů urologických orgánů prostřednictvím analýzy vlastního souboru pacientů.
Metoda:
Na Urologické klinice FN Plzeň se za období 2010 až 2015 diagnóza lymfomu vyskytla u deseti pacientů. Provedly jsme retrospektivní analýzu diagnostického procesu, průběhu onemocnění a výsledků léčby. Histologie k potvrzení diagnózy maligního lymfomu byla získaná při chirurgickém výkonu nebo cílenou biopsií. Poté následovala časná imunochemoterapie v režimu R-CHOP (rituximab, cyklofosfamid, vincristin, adriamycin/doxorubicin, prednison), R-COP (bez doxorubicinu).
Výsledky:
Dominovaly lymfomy varlete u celkem sedmi pacientů, dále se jednalo o lymfom pravé nadledviny, lymfom peripelvické tkáně levé ledviny a lymfom malé pánve v těsném kontaktu s močovým měchýřem. U šesti pacientů s lymfomem varlat a u pacientky s lymfomem peripelvické tkáně levé ledviny bylo dosaženo kompletní remise. U jednoho pacienta s lymfomem varlete a u pacienta s lymfomem pánve v době sepsání práce léčba ještě probíhala a nález regredoval. V případě lymfomu nadledviny bylo dosaženo parciální remise onemocnění.
Závěr:
Primární nebo sekundární lymfomy urogenitálního traktu se v rámci urologických malignit vyskytují vzácně. Přesto by se na toto onemocnění mělo v diferenciálně diagnostické rozvaze pomýšlet. Role urologa je v zajištění histologické verifikace onemocnění a případně i v chirurgické léčbě, po které následuje terapie vedená hematoonkologem. Časná diagnostika a neodkladná onkologická léčba má zásadní význam v navození kompletní remise a dlouhodobém přežívání nemocných s touto diagnózou.
Klíčová slova:
Maligní lymfom, lymfom urogenitálního traktu, lymfom varlete, imunochemoterapie.
ÚVOD
Maligní lymfomy jsou nádory lymfatické tkáně (lymfatických uzlin a mimouzlinové lymfatické tkáně). O primárně extranodálním lymfomu se hovoří v případě primárního postižení mimouzlinové oblasti s převažující masou nádoru v této lokalizaci. Základem diagnostiky je histopatologické vyšetření reprezentativního vzorku tkáně, který je doplněn stážovacím vyšetřením ke zjištění rozsahu onemocnění. V terapii jsou voleny specifické léčebné postupy v souvislosti s histologickým nálezem a orgánovou lokalizací.
METODA
Na Urologické klinice FN Plzeň se za období 2010 až 2015 diagnóza lymfomu vyskytla u deseti pacientů, u kterých jsme provedli retrospektivní analýzu diagnostického procesu, průběhu onemocnění a výsledků léčby. Lymfomy postihovaly močopohlavní trakt primárně nebo se vyskytovaly v jeho bezprostředním kontaktu a byly řešeny v rámci diferenciální diagnostiky. Dominovaly lymfomy varlete celkem v sedmi případech, dále se jednalo o lymfom pravé nadledviny, lymfom peripelvické tkáně levé ledviny a lymfom malé pánve. U pacientů s postižením varlete a pravé nadledviny byla histologie získána provedením radikální orchiektomie a adrenaleketomie. V případě expanze v okolí levé ledvinné pánvičky byla diagnóza potvrzena biopsií CORE jehlou pod CT. Pacient s expanzí malé pánve, která byla v těsném kontaktu s močovým měchýřem, podstoupil explorativní laparotomii s odběrem tkáně k histologickému vyšetření pro inoperabilitu.
ANALÝZA SOUBORU A VÝSLEDKY
Lymfomy varlat
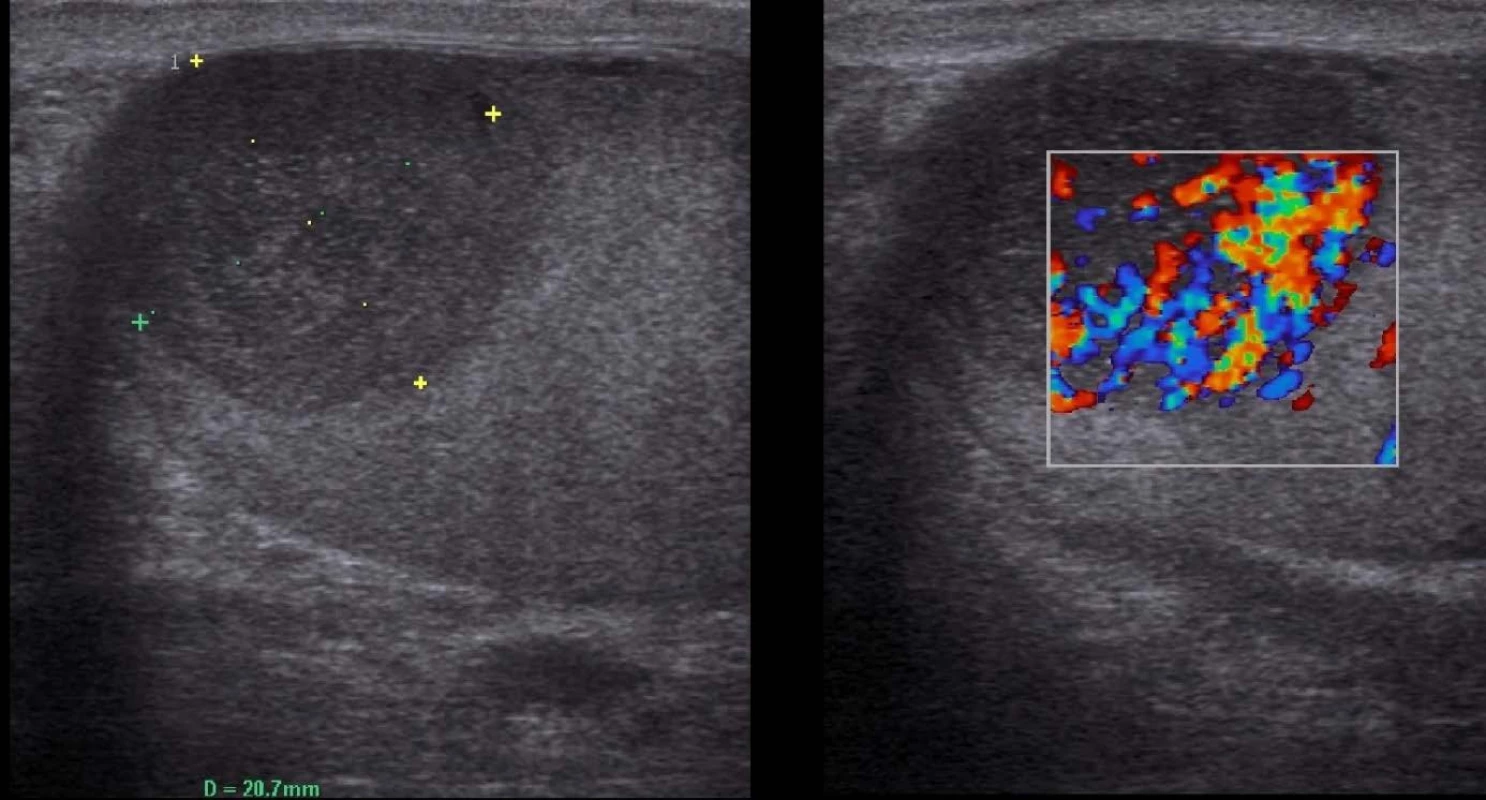
V období od roku 2010 až 2015 bylo ošetřeno celkem sedm pacientů s lymfomem varlete. Nejmladší muž měl v době diagnózy 43 let, nejstarší 74 let, medián 62,6 let. V šesti případech se jednalo o testikulární difuzní velkobuněčný B-lymfom (DLBCL). V jednom případě byly postiženy sekundárně obě varlata v rámci recidivy původně chronické lymfatické leukemie transformované na akutní lymfatickou leukemii. Všichni pacienti podstoupili urologické vyšetření pro hmatnou rezistenci v oblasti varlat. Na základě fyzikálního nálezu a sonografického vyšetření (Obr. 1) byli indikováni k radikální orchiektomii. Nádorové markery charakteristické pro germinální tumory varlat (LDH, AFP, HCG) nevykazovaly odchylku od normy. Po histologické verifikaci byli pacienti předáni do péče hematoonkologa. Po provedení stagingu onemocnění byla v pěti případech podávána R-CHOP imunochemoterapie, z toho ve třech případech byla tato léčba doplněna o intratékální aplikaci chemoterapie a u jednoho pacienta v rámci zajištění profylaxe CNS byla podána vysokodávková chemoterapie. V jednom případě byla podána kombinace R-COP. Žádný z pacientů nepodstoupil radioterapii kontralaterálního varlete. Specifická intenzivní léčba probíhala u pacienta se sekundárním postižením varlat. Všichni pacienti s primárním testikulárním lymfomem byli po léčbě v remisi, v jednom případě v době sepsání práce léčba ještě probíhala.
Lymfom nadledviny
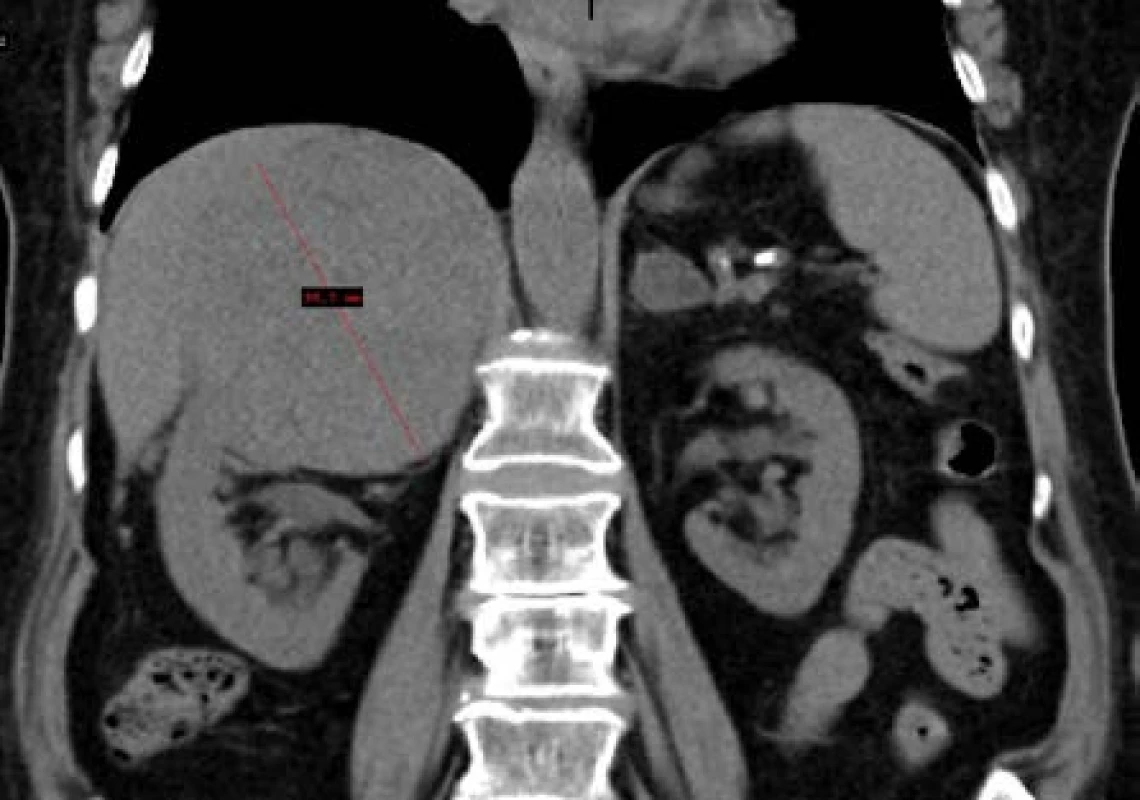
Žena, 75 let, byla sledována endokrinologem pro adenom nadledvin bilaterálně s intermitentním hyperkorticizmem v rámci subklinického hyperkorticizmu, bez vyšších metanefrinů dle funkčního vyšetření. Pro rychle progredující expanzi v pravé nadledvině až na 115 mm suspektní z karcinomu (Obr. 2) byla indikována k adrenalektomii vpravo. Histologicky potvrzen difuzní velkobuněčný B-lymfom s následnou velmi časnou recidivou v oblasti portální žíly subhepatálně. Další léčba probíhala na hematoonkologickém oddělení, kde pacientka podstoupila imunochemoterapii R-CHOP a byla dosažená parciální remise onemocnění.
Lymfom peripelvické tkáně ledviny
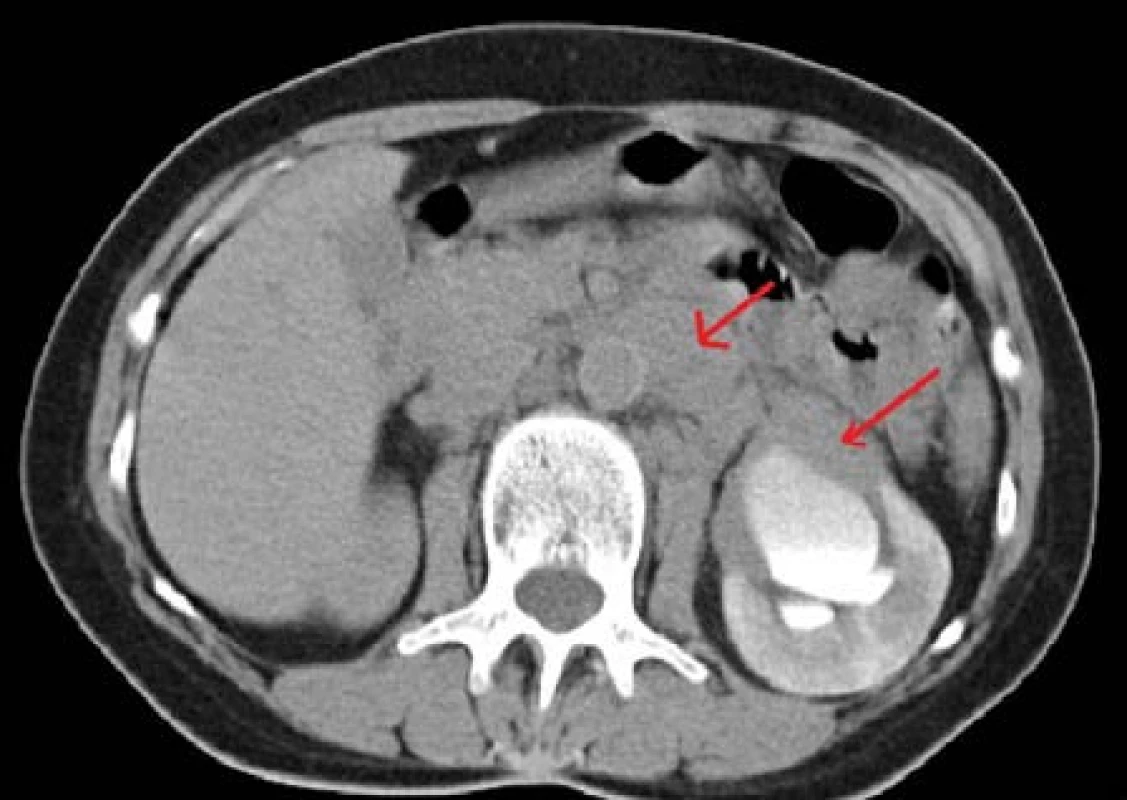
Žena, 59 let, byla vyšetřena urologem pro 14 dní trvající bolesti levého mezogastria, subfebrilie, nechutenství, bez mikčních potíží. Sonograficky zjištěn megaureter vlevo. Doplněna CT-vylučovací urografie s nálezem expanzivně se chovající masy cirkulárně obklopující ledvinnou pánvičku a proximální močovod, další masa paraaortálně v levém retroperitoneu (Obr. 3). Již z CT vyšetření vysloveno podezření na možný lymfom. Pacientka byla indikována k zajištění derivace horních močových cest vlevo stentem a k odběru biopsie z expanze pod CT kontrolou. Po potvrzení diagnózy folikulárního lymfomu byla předána do péče hematoonkologa, kde absolvovala R-CHOP imunochemoterapii, s následnou kompletní remisí onemocnění a derivace ureterálním stentem již nebyla nutná.
Lymfom pánve
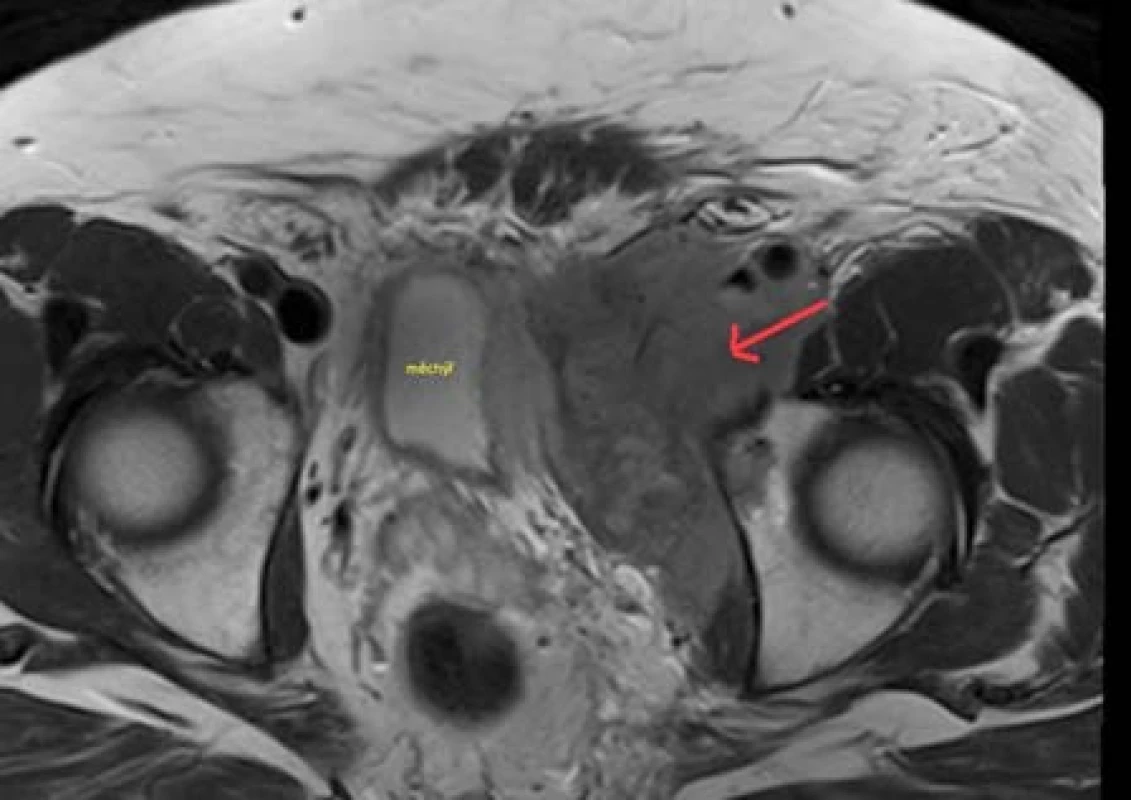
Nemocný, 63 let, s progredujícím lymfedémem levé dolní končetiny, byl odeslán k urologickému vyšetření pro nejasný nález expanze malé pánve v místě močového měchýře při sonografickém vyšetření břicha. V rámci urologického vyšetření proveden screening na tumor penisu, varlat a prostaty, který byl negativní. Pro anamnesticky udávanou alergii na jodové kontrastní látky bylo doplněno vyšetření pánve magnetickou rezonancí (Obr. 4) s nejistým závěrem angiofolikulární uzlinovou hyperplazií – Castlemanova choroba, diferenciálně diagnosticky pomalu rostoucí sarkom či dle anamnézy a klinického obrazu fibrotizovaný hematom. Pacient indikován k explorativní laparotomii, nález peroperačně hodnocen za inoperabilní a odebrána histologie. Potvrzen non-Hodgkinský B-lymfom, velmi pravděpodobně difuzní malobuněčný B-lymfom typu CLL/SLL s neobvyklou pozitivitou CD10. Byla zahájena hematoonkologická léčba R-COP, která v době sepsání práce probíhala a pokračovala regrese nálezu.
DISKUZE
Lymfomy patří mezi nádorová onemocnění se stoupající incidencí. V České republice je každoročně diagnostikováno kolem 15 nových pacientů na 100 000 obyvatel a tento počet se každoročně zvyšuje o 3–4 %. Nárůst jde téměř všechen na vrub nehodgkinských lymfomů (NHL), protože incidence Hodgkinova lymfomu (HL) je stabilní a pohybuje se kolem tří nových pacientů na 100 000 obyvatel ročně. NHL jsou onemocněním zejména staršího věku (medián 55–65 let), zatímco HL se vyskytují převážně mezi 20. a 40. rokem.
Klasifikace maligních lymfomů vychází ze dvou hlavních buněčných linií T a B-buněk. Dnes obecně platnou klasifikací je klasifikace WHO aktualizována v roce 2008 (WHO Classification of tumours of haematopoietic and lymphoid tissues, 4th edition). Zahrnuje velké množství jednotek, definovaných na základě kombinace morfologických, imunologických, molekulárně biologických a klinických znaků. Podle té jsou rozlišovány: 1. B-buněčné neoplazie, 2. Neoplazie T-buněk a Natural-Killer (NK)-buněk, 3. Hodgkinovy lymfomy, 4. Lymfoproliferační posttransplantační onemocnění. Neoplazie T - a B-buněk se dále rozdělují na neoplazie z prekurzorů a neoplazie zralých T - a B-buněk. Neoplazie zralých T - a B-buněk se dále dělí na leukémie, primárně extranodální a nodální onemocnění. Stranou tohoto dělení zůstává Hodgkinův lymfom, přestože se jedná o lymfom z B-buněk germinálního centra, vyznačuje se jak vlastními genetickými a klinickými charakteristikami, tak i léčebnými postupy. V ČR je v rámci NHL nejčastěji zastoupen difuzní velkobuněčný B-lymfom (DLBCL) a folikulární lymfom (FL). DLBCL představuje agresivní formu lymfomů tj. potenciálně vyléčitelných, ale při selhání léčby mající špatnou prognózu. FL patří mezi indolentní lymfomy s pomalou progresí, které lze někdy léčit i s odstupem od diagnózy a i při relapsu zůstává prognóza relativně dobrá. T-lymfomy se většinou chovají agresivně (1).
Etiologické mechanizmy vzniku lymfomu jsou komplexní, avšak primárně vedou k deregulaci kontroly buněčného cyklu a k nádorové proliferaci. Jedná se o několikastupňový proces s přibývajícími molekulárně genetickými změnami. U některých lymfomů jsou známé chromozomální aberace v oblasti protoonkogenů (např. bcl1, bcl2, c-myc) či tumor supresorových genů (např. p53, p16). NHL se často vyskytují v asociaci s chronickými zánětlivými chorobami (např. MALT lymfom žaludku a infekce Helicobacter pylori, EB virus a Burkittův lymfom, Borrelia burgdorferi a lymfomy kůže). Imunosupresivní léčba a HIV infekce také zvyšují riziko maligního lymfomu.
Základem diagnostiky je histopatologické vyšetření reprezentativního vzorku včetně imunohistochemie a analýz genových mutací a expresí. Obvykle je vyžadováno tzv. druhé čtení, což je konziliární zhodnocení biopsie na specializovaném hematopatologickém pracovišti s vyspělým laboratorním zázemím. Anamnéza se opírá o tzv. „B“ symptomy – noční poty, teploty neinfekčního původu a váhový úbytek. Zjišťování rozsahu onemocnění tzv. konvenční staging zahrnuje vyšetření fyzikální, vyšetření krevního obrazu, vyšetření kostní dřeně (trepanobiopsie) a biochemický screening. Při podezření na lymfom je zásadní vyšetření laktátdehydrogenázy, jejíž hodnota je nezbytná k určení prognózy. V rámci zobrazovacích vyšetření se provádí celotělové CT, i když v současné době je ke stagingu onemocnění používáno častěji FDG-PET/ CT vyšetření. V případě lymfomu varlete je nutné také pečlivé vyšetření (sonografie) kontralaterálního varlete pro častost bilaterálního postižení.
V terapii jsou voleny specifické léčebné postupy v souvislosti s histologickým nálezem a orgánovou lokalizací. Vlastní léčebný přístup se také odvíjí dle klinického stadia onemocnění, dle čtyř stupňové Ann-Arbor klasifikace (Tab. 1). Základem léčby prakticky všech B-lymfomů (s možnou výjimkou lymfomu lymfoblastového a lymfomů dětského věku) je chemoterapie, a to nejčastěji režim CHOP (cyklofosfamid, vincristin, adriamycin/doxorubicin, prednison) nebo COP (bez doxorubicinu), který je doplněn anti-CD20 protilátkou rituximabem tj. R-CHOP (imunochemoterapie) (1, 2).

Více než jedna třetina nových lymfomů vzniká v jiných lokalizacích než v lymfatických uzlinách, a to dokonce v místech, kde se přirozeně žádná lymfatická tkáň nevyskytuje. Etiologie těchto lymfomů je multifaktoriální. Histologické spektrum extranodálních lymfomů je nesmírně široké. Klinicky nejčastější jsou lymfomy ORL oblasti, lymfomy varlete, primární lymfomy kostí a lymfomy CNS (3).
Primární testikulární lymfom (PTL) patří s incidencí 9–26 : 10 000 000 mezi vzácné a agresivní formy malignit nejen obecně, ale také v rámci skupiny non-hodgkinských lymfomů. Představuje přibližně 5 % testikulárních malignit a 1–2 % všech NHL. Na druhé straně je tento lymfom nejčastější testikulární malignitou s bilaterálním výskytem a ve skupině mužů ve věku nad 60 let – medián výskytu je 66 až 68 let věku a incidence bilaterálního postižení se udává do 20 % případů (2, 4, 5, 6). Výskyt lymfomového postižení v dalších oblastech urogenitálního traktu je zřetelně vzácnější.
V rámci analýzy registru České lymfomové kooperativní skupiny bylo lymfomové postižení varlete v době diagnózy evidováno u 40 (1,6 %) nemocných a jako primární testikulární lymfom bylo onemocnění označeno u 33 nemocných (1,3 %) (7). Rozlišení mezi PTL a případným uzlinovým lymfomem se sekundárním postižením varlat není histopatologicky možné a jde o rozlišení prakticky arbitrární, které vyžaduje komplexní klinické posouzení lokalizací, velikostí a vývoje nádorových mas. Do skupiny PTL tak v praxi bývají většinou řazeny případy s postižením varlete a regionálních uzlin (klinická stadia I až II dle Ann-Arbor klasifikace), přičemž stadia pokročilá s postižením uzlin na obou stranách bránice nebo difuzním postižením velkých orgánů (stádia III až IV) jsou naopak spíše a ve zřetelně menší četnosti řazeny do skupiny generalizovaných nodálních lymfomů (7, 8, 9).
Zhruba 90 % všech PTL odpovídá histologicky difuznímu velkobuněčnému B-lymfomu, zbytek případů pak např. perifernímu T-lymfomu, Mantle cell lymfomu a jiným. Makroskopicky je varle difuzně infiltrované nebo jsou na řezu patrné bělavé uzly solidního vzhledu, obvykle bez nekróz a hemoragií. Často je patrná i infiltrace nadvarlete, funiklu a obalů varlete (2). Diferenciálně diagnosticky je nutno odlišit germinální nádory varlete, xantogranulomatózní orchitis, ale může se jednat také o leukemické infiltráty, které se mohou vyskytovat v jednom nebo obou varlatech jako první příznak nebo relaps leukémie – typicky u akutní lymfoblastické leukémie (2). Základem diagnostiky je histopatologické vyšetření včetně imunohistochemie a analýz genových mutací a expresí. Na základě DNA microarray analýz je pak naprostá většina PTL s histologií DLBCL řazena do kategorie původu z tzv. ABC buněk (activated B-cell-like), přičemž tato predominance se nejspíše také částečně podílí na horších léčebných výsledcích při využívání pouze konvenční chemoterapie (8, 6).
Typickým klinickým projevem nemoci je tuhá nebolestivá masa nádoru varlete, neoddělitelná, s mediánem velikosti v době diagnózy 6 cm a s přítomností hydrokély u přibližně 40 % případů (11, 12). Přítomnost celkových příznaků (úbytek hmotnosti, teploty, noční pocení, únava) ukazuje na spíše pokročilé onemocnění. Při USG vyšetření jsou charakteristické nálezy ložiskové nebo difuzní hypoechogenní hypervaskularizované oblasti zvětšeného varlete, v případě MR pak v T2 váženém obraze hypointenzivní a gadoliniem heterogenně se silně sytící oblasti (13, 14, 15).
Při podezření na PTL je pak inguinální orchiektomie metodou volby základního chirurgického řešení, kdy je současně získán adekvátní materiál na histologické vyšetření. Vždy je nutné pečlivé dovyšetření kontraleterálního varlete. Určení dalších oblastí lymfomového postižení (tzv. stážování, staging) ideálně s využitím PET-CT, doplnění lumbální punkce s vyšetřením likvoru na přítomnost patologické infiltrace (cytologie, FACS), MR mozku a jako součást vyšetřovacího plánu pacientů bývá doporučováno také vyšetření sérologie HIV (7, 8, 16, 19). Etiologicky významný faktor přispívající k vývoji PTL nebyl jasně definován, ale histologicky agresivnější formy lymfomu u mladých pacientů mohou mít případnou souvislost s probíhající HIV infekcí (5, 8, 17).
Léčebná doporučení a zkušenosti vychází z řady retrospektivních analýz, nerandomizovaných studií a několika málo studií prospektivních. Aktuálně je za referenční postup považován protokol studie IELSG-10 založený na aplikaci šesti až osmi cyklů kombinované standardní chemoterapie R-CHOP-21 (rituximab, cyklofosfamid, doxorubicin, vincristin, prednison), dále čtyř dávek metotrexátu intratékálně, zajištění radioterapie kontralaterálního varlete (dávka 30 Gy) a doplnění regionální radioterapie (30–36 Gy) při uzlinovém postižení stadia nemoci II. Zde bývá dosahováno kompletní remise u 98 % pacientů (stadia I-II), přežití pět let bez progrese a celkové přežití 74 % a 85 %, incidence CNS a testikulárních relapsů do pěti let je 6 % a 0 % (18). Standardní léčba dle doporučení České KLS (19) zahrnuje rovněž opakovanou aplikaci režimu R-CHOP, nutnost CNS profylaxe intratékální aplikací nebo systémovou chemoterapií s vysokodávkovaným metotrexátem. V případě přítomnosti paraaortální masy lymfatických uzlin je potřeba zvážit doplnění radioterapie involved-field (30–35 Gy v případě kompletní remise, nebo 35–45 Gy v případě jejího nedosažení) a je také indikována radioterapie kontralaterálního varlete k prevenci relapsu.
Výsledky pacientů léčených pouze orchiektomií a/nebo radioterapií samostatně jsou špatné a takový postup je rezervován pro pacienty neúnosné k systémové léčbě (9). S ohledem na fakt, že většina CNS relapsů je hlavně parenchymálních, jsou snahy využívat v profylaxi systémovou chemoterapii s vysokodávkovaným metotrexátem, spíše než intratékální aplikace cytostatika. Do budoucna se jako možnosti zlepšení výsledků léčby uvažuje o lenalidomidu a ibrutinibu – tedy molekul účinných v případě ABC buněčných subtypů lymfomu DLBCL (8).
Prognostické odhady pravděpodobnosti léčebné odpovědi včetně délky jejího trvání zatím nadále uplatňují systém IPI skóre (International prognostic index), který je dán kombinací stadia, věku, počtu extranodálních postižení, hladiny LDH a performance statutu (PS). Nicméně pro naprostou většinu pacientů s PTL a prakticky lokalizovaným postižením bývá skóre IPI nízké (< 2 body) a tedy s teoreticky dobrou prognózou, což je v rozporu s praxí. Využití tohoto systému je proto sporné a definování nezávislých risk faktorů nadále probíhá v rámci řady sledování (7, 18, 21). Základní prognostickou charakteristikou PTL je nicméně dlouhodobé, i více než 15 let trvající riziko relapsů, které často zahrnují konralaterální varle, CNS a další extranodální oblasti a orgány (7, 20, 21). Riziko CNS postižení dle IELSG sledování u 381 pacientů historického souboru bylo 19 % a 34 % za pět a deset let, přičemž dvě třetiny případů měly charakter intraparenchymatózního a zbytek pak leptomeningeálního postižení (21). Vyšší riziko relapsů souvisí i s nedostatečně intenzivní léčbou v úvodu. Prognóza u pokročilých stadií PTL je krajně nepříznivá (7, 18).
Primární adrenální lymfomy se vyskytují vzácně a to zejména ve vyšším věku a více u mužů (28). Tvoří 3 % všech extranodálních NHL. Často se jedná o objemnou expanzi v oblasti nadledviny. Vzhledem k nepřítomnosti lymfoidní nebo krvetvorné tkáně v nadledvinách se jejich vznik předpokládá v terénu autoimunitní adrenalitis. Tato hypotéza by vysvětlovala jejich častý bilaterální výskyt (až v 70 %) a přítomnost adrenální insuficience (až v 60–70 %) (29). Primární adrenální lymfomy jsou dále charakteristické svojí agresivitou, B-symptomy (váhový úbytek, febrilie, noční pocení) a elevace LDH. Histologicky je nejvíce zastoupen DLBCL. Přes možnosti onkologické léčby, a to imunochemoterapie s případnou kombinací s radioterapií, je dlouhodobá prognóza onemocnění ve většině případů nepříznivá (22, 23).
Primární lymfom ledviny se vyskytuje velice vzácně. Jedna z teorií předpokládá, že lymfatická tkáň pouzdra ledviny může být zdrojem lymfomu, který následně invaduje parenchym ledviny. Dalším vysvětlením může být chronický zánětlivý proces, který kumuluje lymfatické buňky v ledvině, jehož důsledkem je vznik lymfomu. Typicky se vyskytuje u starších pacientů nezávisle na pohlaví. Nejvíce je zastoupen DLBCL. Mezi časté nespecifické klinické projevy patří bolest v bedru, hematurie a B-symptomy. V případech neobvyklých renálních nebo perirenálních expanzí spojených s adenopatií, by v rámci diferenciální diagnostiky karcinomu ledviny, uroteliálního karcinomu nebo benigních lézích (adenom, onkocytom, hematom) mělo být pomýšleno i na možné lymfoproliferativní onemocnění (24, 25, 26).
Primární lymfom močového měchýře je velice vzácné onemocnění s výskytem 0,2 % všech extranodálních NHL u starších nemocných. Převažují (80 %) low grade neoplazie nejčastěji MALT lymfomy, kde zpravidla postačuje transuretrální resekce tumoru měchýře (TURB). U high grade neoplazií dominuje DLBCL a základem léčby je chemoterapie či její kombinace s radioterapií nebo TURB (27).
SEZNAM POUŽITÝCH ZKRATEK
- AFP – alfafetoprotein
- CLL – chronická lymfatická leukemie
- CNS – centrální nervový systém
- DLBCL – difuzní velkobuněčný B-lymfom
- FACS – Florescence-Activated Cell Sorter
- FDG-PET/CT – 2-[18F]-fluoro-2-deoxy-D-glukóza pozitronová emisní tomografie/CT vyšetření
- FL – folikulární lymfom
- HCG – choriogonadotropin
- HL – Hodgkinův lymfom
- KLS – Kooperativní lymfomová skupina
- LDH – laktátdehydrogenáza
- MR – magnetická rezonance
- NHL – nehodgkinských lymfom
- PTL – primární testikulární lymfom
- R-CHOP – rituximab, cyklofosfamid, vincristin, adriamycin/doxorubicin, prednison
- R-COP – rituximab, cyklofosfamid, vincristin, prednison
- SLL – lymfom z malých lymfocytů
- TURB – transuretrální resekce tumoru močového měchýře
- USG – ultrasonografie
Došlo: 14. 7. 2015
Přijato: 5. 9. 2015
Střet zájmů: žádný
Prohlášení o podpoře: Podpořeno MZ ČR – RVO (Fakultní nemocnice Plzeň – FNPI, 00669806).
Kontaktní adresa:
MUDr. Daniela Kovářová
Urologická klinika LF UK a FN Plzeň
Edvarda Beneše 1128/13, 305 99 Plzeň-Bory
e-mail: kovarovad@fnplzen.cz
Sources
1. Pytlík R, Berková A, Ptáčník V. Moderní diagnostika a léčba nehodgkinských lymfomů. Interní Med. 2013; 15(3–4): 105–109.
2. Toufarová P, et al. Lymfomy varlat. Urol. praxi. 2004; 3 : 125–126.
3. Adam Z, Krejčí M, Vorlíček J, et al. Hematologie. Přehled maligních hematologických onemocnění. 2., doplněné a zcela přepracované vydání. Grada 2008; 163–164.
4. Møller MB, d’Amore F, Christensen BE. Testicular lymphoma: a population-based study of incidence, clinicopathological correlations and prognosis. The Danish Lymphoma Study Group, LYFO. Eur J Cancer 1994; 30A(12): 1760–1764.
5. Vitolo U, Ferreri AJ, Zucca E. Primary testicular lymphoma. Crit Rev Oncol Hematol 2008; 65(2): 183–189.
6. Hasselblom S, Ridell B, Wedel H, et al. Testicular lymphoma-a retrospective, population-based, clinical and immunohistochemical study. Acta Oncol 2004; 43(8): 758–765.
7. Vášová I, et al. Primární testikulární lymfom, klinickopatologická multicentrická retrospektivní studie a data registru Kooperativní lymfomové skupiny (KLS). Klinická onkologie. 2007; 20(4): 302–306.
8. Cheah ChY, Wirth A, Seymour JF. Primary testicular lymphoma. Blood 2014; 123(4): 486–493.
9. Gundrum JD, Mathiason MA, Moore DB, Go RS. Primary testicular diffuse large B-cell lymphoma: a population-based study on the incidence, natural history, and survival comparison with primary nodal counterpart before and after the introduction of rituximab. J Clin Oncol 2009; 27(31): 5227–5232.
10. Swerdlow SH, Campo E, Harris NL, et al. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues, Fourth Edition, World Health Organization; 2008.
11. Horne MJ, Adeniran AJ. Primary diffuse large B-cell lymphoma of the testis. Arch Pathol Lab Med 2011; 135(10): 1363–1367.
12. Shahab N, Doll DC. Testicular lymphoma. Semin Oncol 1999; 26(3): 259–269.
13. Moorjani V, Mashankar A, Goel S, et al. Sonographic appearance of primary testicular lymphoma. AJR Am J Roentgenol 1991; 157(6): 1225–1226.
14. Srisuwan T, Muttarak M, Kitirattrakarn P, Ya-in C. Clinics in diagnostic imaging (134). Testicular lymphoma. Singapore Med J 2011; 52(3): 204–208.
15. Tsili AC, Argyropoulou MI, Giannakis D, et al. Primary diffuse large B-cell testicular lymphoma: magnetic resonance imaging findings. Andrologia 2012; 44(Suppl 1): 845–847.
16. Ponti G, Ponzoni M, Ferreri AJ, et al. The impact of histopathologic diagnosis on the proper management of testis neoplasms. Nat Clin Pract Oncol 2008; 5(10): 619–622.
17. Verma N, Chaudhary UB, Costa LJ, et al. Primary testicular lymphoma and AIDS. Ann Clin Lab Sci 2010; 40(1): 75–79.
18. Vitolo U, Chiappella A, Ferreri AJ, et al. First-line treatment for primary testicular diffuse large B-cell lymphoma with rituximab-CHOP, CNS prophylaxis, and contralateral testis irradiation: final results of an international phase II trial. J Clin Oncol 2011; 29(20): 2766–2772.
19. Belada D, Trněný M, Kooperativní lymfomová skupina. Diagnostické a léčebné postupy u nemocných s maligními lymfomy, VIII. edice, CREDIT s.r.o., Hradec Králové; 2014, 89–89.
20. Fonseca R, Habermann TM, Colgan JP, et al. Testicular lymphoma is associated with a high incidence of extranodal recurrence. Cancer 2000; 88(1): 154–161.
21. Zucca E, Conconi A, Mughal TI, et al. International Extranodal Lymphoma Study Group. Patterns of outcome and prognostic factors in primary large-cell lymphoma of the testis in a survey by the International Extranodal Lymphoma Study Group. J Clin Oncol 2003; 21(1): 20–27.
22. Rashidi A, Fisher SI. Primary adrenal lymphoma: a systematic review. Ann Hematol. 2013 Dec; 92(12): 1583–1593.
23. Kasaliwal R, et al. Primary Adrenal Lymphoma: A Single Center Experience. Endocr Pract. 2015 Feb 25 : 1–18.
24. Dedekam E, Graham J, Strenge K, Mosier AD. Primary renal lymphoma Mimicking a subcapsular hematoma: A case report. Radiology Case. 2013 Aug; 7(8): 18–26.
25. Hart S, et al. A case of primary renal lymphoma. UROLOGY 2012 Oct; 80(4): 763–765.
26. Chen L, et al. Lymphomas and lymphoproliferative disorders clinically presenting as renal carcinoma: a clinicopathological study of 14 cases. Pathology. 2013 Dec; 45(7): 657–663.
27. Simpson WG, Lopez A, Babbar P, Payne LF. Primary bladder lymphoma, diffuse large B-cell type: Case report and literature review of 26 cases. Urol Ann. 2015 Apr-Jun; 7(2): 268–272.
28. Hartmann I, et al. Laparoskopická adrenalektomie ve FN Olomouc. Patnáctileté zkušenosti. Ces Urol 2013; 17(4): 246–253
29. Simpson WG, Babbar P, Payne LF. Bilateral primary adrenal non-Hodgkin‘s lymphoma without adrenal insufficiency. Urol Ann. 2015 Apr-Jun; 7(2): 259–261.
Labels
Paediatric urologist Nephrology UrologyArticle was published in
Czech Urology
2015 Issue 3
-
All articles in this issue
- EXTRA-ANATOMICKÉ STENTY JAKO ALTERNATIVA NEFROSTOMIE
- LAPAROSKOPICKÁ CYSTEKTOMIE – PRVNÍ ZKUŠENOSTI
- LYMFOMY UROGENITÁLNÍHO TRAKTU
- SROVNÁNÍ CHARAKTERISTIKY SEMINOMŮ A NONSEMINOMŮ U SOUBORU PACIENTŮ, KTEŘÍ PODSTOUPILI RADIKÁLNÍ ORCHIEKTOMII PRO TUMOR VARLETE
- IATROGENNÍ LÉZE MOČOVODU DIAGNOSTIKOVÁNA PO MĚSÍCI
- ANOMÁLIE URACHU – VZÁCNÁ PŘÍČINA BOLESTÍ BŘICHA A HOREČNATÝCH STAVŮ
- ASYNCHRONNÍ NÁDOROVÁ KVADRUPLICITA (TRIPLICITA UROLOGICKÝCH MALIGNIT)
- PAGE KIDNEY – POZDNÍ PREZENTACE SUBKAPSULÁRNÍHO HEMATOMU LEDVINY U MLADÉHO CHLAPCE
- FOTOSELEKTIVNÍ VAPORIZACE PROSTATY (PVP) S LAPAROSKOPICKOU DIVERTIKULEKTOMIÍ (LD) MOČOVÉHO MĚCHÝŘE
- Czech Urology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- ANOMÁLIE URACHU – VZÁCNÁ PŘÍČINA BOLESTÍ BŘICHA A HOREČNATÝCH STAVŮ
- EXTRA-ANATOMICKÉ STENTY JAKO ALTERNATIVA NEFROSTOMIE
- IATROGENNÍ LÉZE MOČOVODU DIAGNOSTIKOVÁNA PO MĚSÍCI
- LAPAROSKOPICKÁ CYSTEKTOMIE – PRVNÍ ZKUŠENOSTI
