Postradiační hemoragická cystitida – terapeutické možnosti se zaměřením na hyperbarickou oxygenoterapii
Radiation‑induced hemorrhagic cystitis – hyperbaric oxygen therapy
Šurík M, Pokorný J, Študent V Jr., Vidlář A, Študent V, Hájek M. Radiation-induced hemorrhagic cystitis – hyperbaric oxygen therapy
The authors present a case of a radiation-induced hemorrhagic cystitis. A serious late complication of pelvic radiotherapy for prostate cancer and hyperbaric oxygen therapy as a treatment with good response.
Keywords:
Radiation-induced hemorrhagic cystitis – late toxicity of radiotherapy – prostate cancer – hyperbaric oxygen therapy
Authors:
Michal Šurík 1; Jan Pokorný 1; Vladimír Študent Jr 2; Aleš Vidlář 2; Vladimír Študent 2; Michal Hájek 3,4
Authors‘ workplace:
Urologické oddělení, Karlovarská krajská nemocnice a. s., Karlovy Vary
1; Urologická klinika, Lékařská fakulta Univerzity Palackého, Fakultní nemocnice Olomouc
2; Centrum hyperbarické medicíny, Městská nemocnice Ostrava
3; Katedra biomedicínských oborů, Lékařská fakulta Ostravské univerzity, Ostrava
4
Published in:
Ces Urol 2020; 24(4): 295-302
Category:
Case reports
Overview
Šurík M, Pokorný J, Študent V Jr, Vidlář A, Študent V, Hájek M. Postradiační hemoragická cystitida – terapeutické možnosti se zaměřením na hyperbarickou oxygenoterapii.
Autoři v kazuistice prezentují případ pacienta s postradiační hemoragickou cystitidou. Závažnou pozdní komplikací předchozí radioterapie na oblast malé pánve pro karcinom prostaty a zajímavou možnost kauzálního řešení hyperbarickou oxygenoterapií s velmi dobrým výsledkem.
Klíčová slova:
Postradiační hemoragická cystitida – komplikace radioterapie – karcinom prostaty – hyperbarická oxygenoterapie
ÚVOD
Radioterapie (RT) je jednou ze základních léčebných modalit maligního onemocnění. Každá z nich, zevní ozařování a brachyterapii nevyjímaje, má své nežádoucí účinky (NÚ) a komplikace. V roce 2014 přibližně 60 % všech onkologických pacientů a 22 % onkologických pacientek absolvovalo v minulosti některou z léčebných modalit pro maligní onemocnění v oblasti malé pánve (1). Jednotlivé typy onkologické léčby zdroj neuvádí, můžeme tedy pouze odvozovat, kolik těchto pacientů bylo léčeno některým ze způsobů RT. Z urologických malignit je RT nejčastěji indikována u pacientů s karcinomem prostaty. Je alternativou radikální prostatektomie (RP). Radioterapie může operační výkon následovat v druhé době v případě pozitivních chirurgických okrajů, u lokálně pokročilého nálezu v resekátu po RP nebo v případě infiltrace spádových uzlin karcinomem. S delším časovým odstupem jako záchranná (salvage) radioterapie při biochemickém relapsu lokální recidivy. Radioterapie na oblast malé pánve je také indikována jako modalita u svalovinu infiltrujícího karcinomu močového měchýře (pacienti nevhodní k radikální cystektomii a/nebo v rámci multimodálního přístupu) (2), k zástavě krvácení z tumoru močového měchýře (2), u malignit gynekologických a kolorektálních (3).
Principem kurativní RT obecně je aplikace vysokých dávek ionizujícího záření do cílového orgánu a nádorem postižených tkání vedoucí k eradikaci nádorových buněk (2). Při plánování tzv. cílových objemů musí být přihlédnuto k radiosenzitivitě okolních zdravých tkání a orgánů (tzv. kritické orgány). V maximální možné míře musí být zajištěna prevence jejich poškození (4). Pro jednotlivé kritické orgány jsou stanoveny limity dávek, které mají procento závažných komplikací udržet na nízké úrovni (5, 6).
Přes nové ozařovací techniky a postupy je RT na oblast malé pánve stále doprovázena nezanedbatelnou urinární a gastrointestinální toxicitou. Nežádoucí účinky (NÚ) dělíme na akutní a chronické (pozdní). Především ty pozdní významně omezují kvalitu života našich pacientů. Vzhledem k vysoké morbiditě a mortalitě patří mezi nejzávážnější komplikace postradiační hemoragická cystitida (RIHC) (7).
Nejčastěji používaná stupnice hodnocení radiační toxicity pro různé orgány je RTOG/EORTC (Radiation Therapy Oncology Group/European Organization for Research and Treatment of Cancer) (8). Tabulky č. 1 a č. 2 zobrazují urinární a gastrointestinální toxicitu RT na oblast malé pánve.
Tab. 1. RTOG/EORTC acute radiation morbidity scoring system
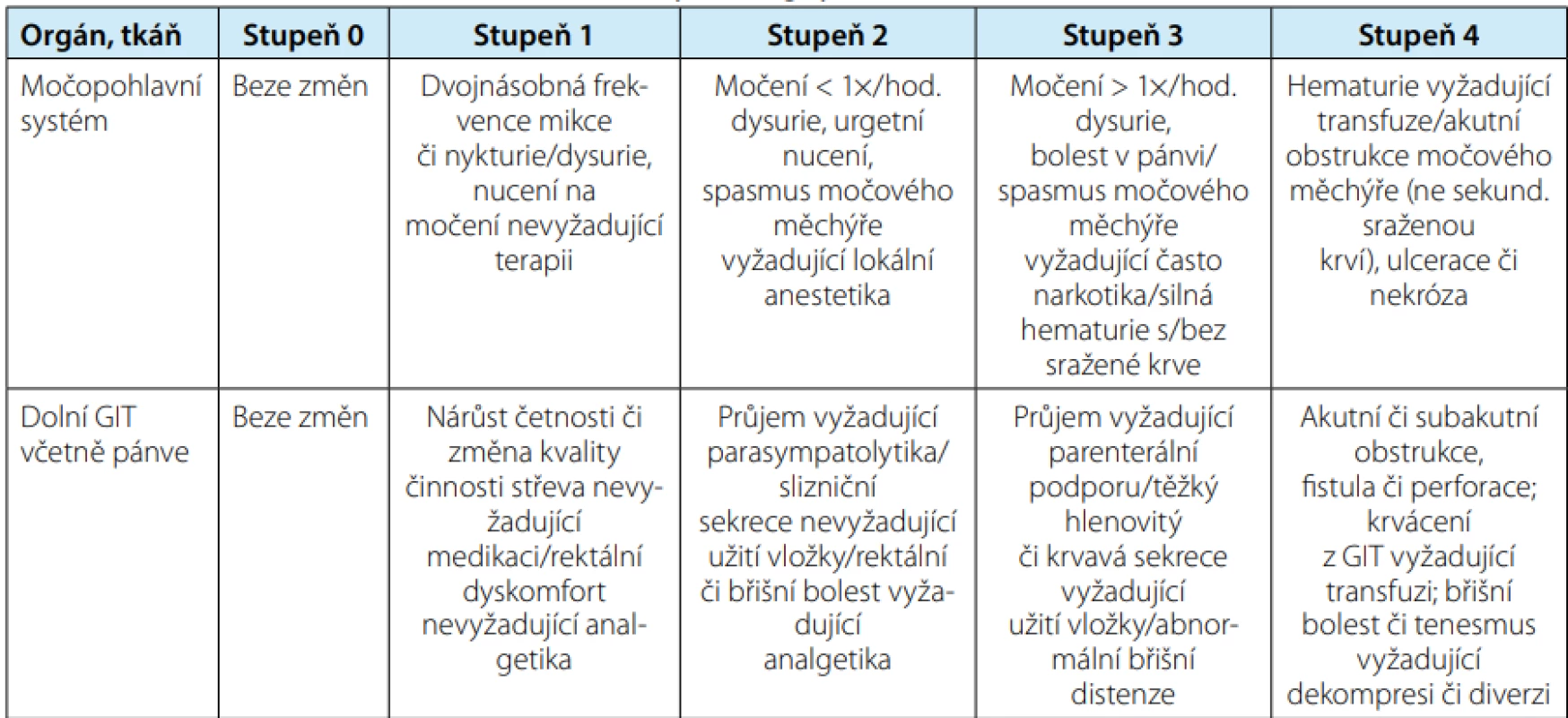
Tab. 2. RTOG/EORTC late radiation morbidity scoring system
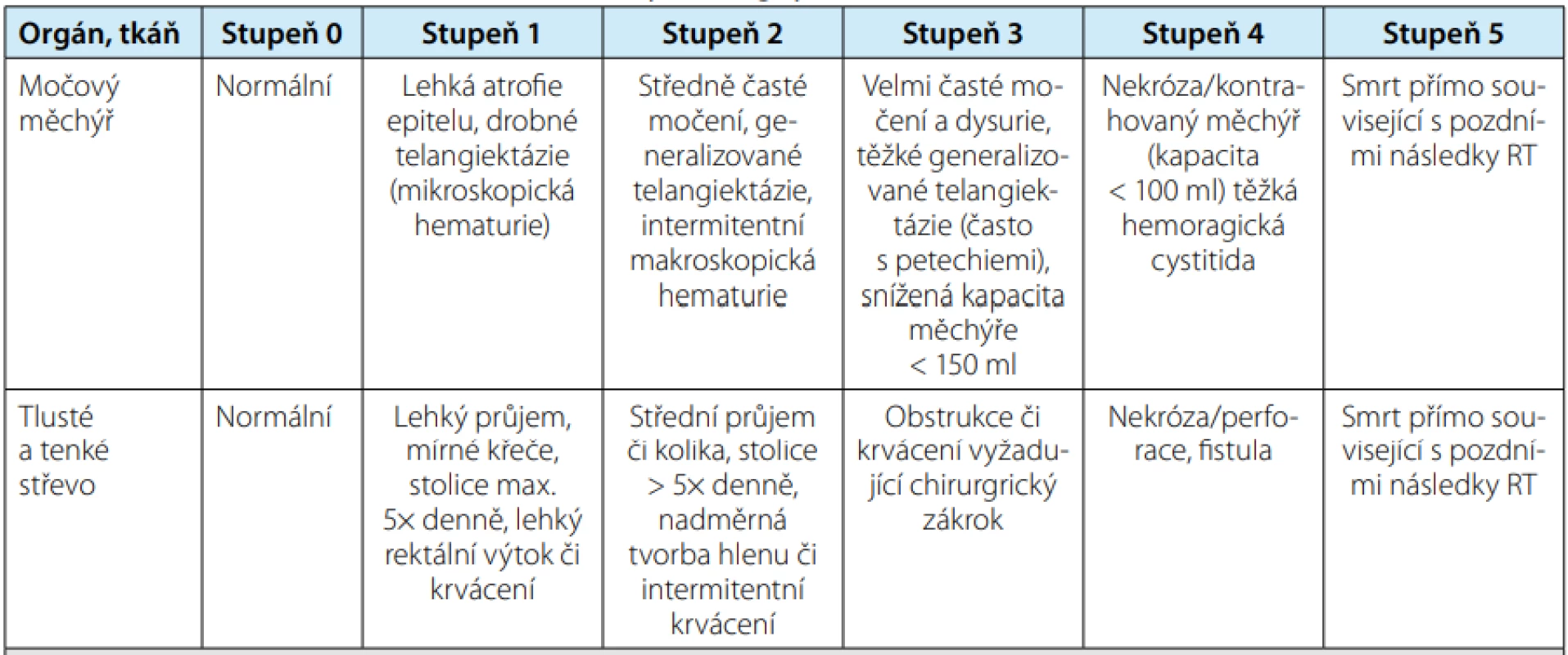
VLASTNÍ KAZUISTIKA
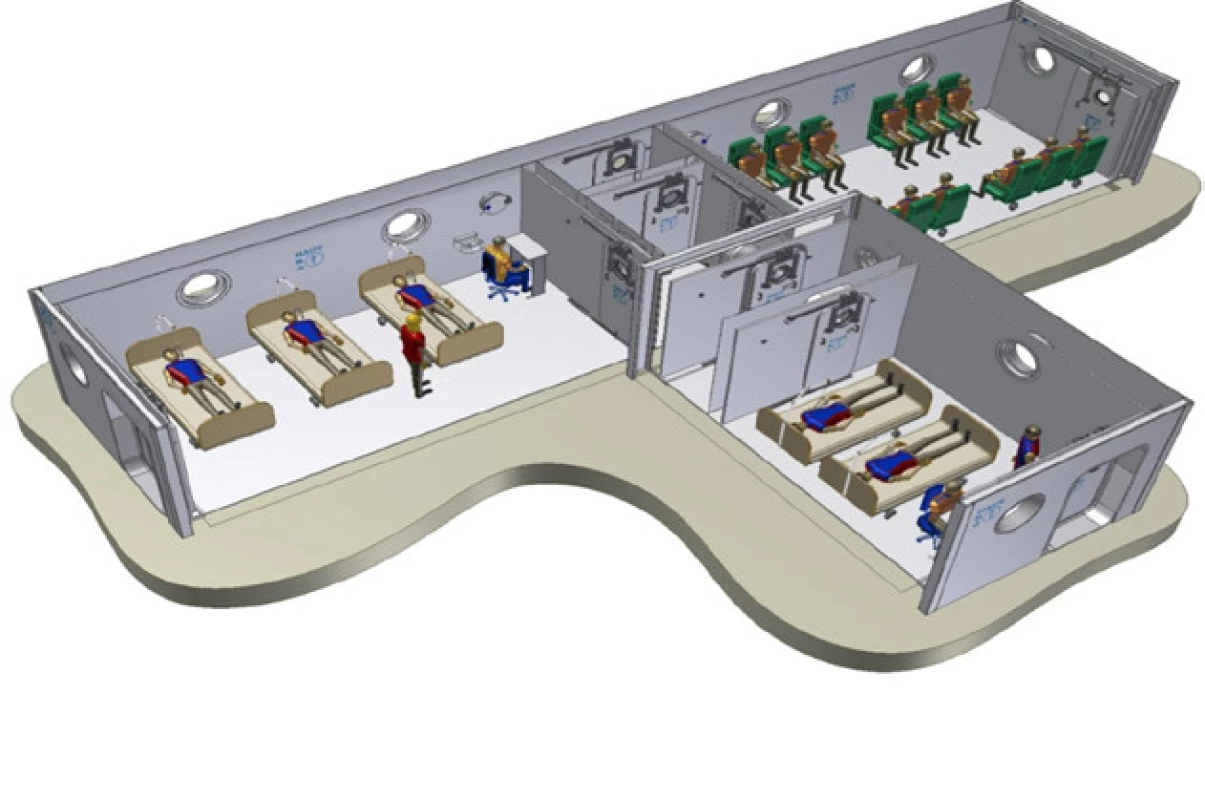
Padesátiletý pacient byl v březnu r. 2010 odeslán praktickým lékařem pro elevaci PSA 8,3 do urologické ambulance. Vyšetření per rectum bylo nesuspektní stran malignity. Při transrektálním ultrasonografickém vyšetření byl celkový objem homogenní prostatické žlázy dvacet mililitrů. Následovala punkční biopsie prostaty, která histologicky potvrdila ve dvou vzorcích zprava adenokarcinom T1c Nx Mx, GS 6 (3+3). Pacient po kompletní edukaci o všech aktuálních možnostech léčby preferoval a rozhodl se podstoupit roboticky asistovanou radikální prostatektomii (RaRP) v květnu r. 2010. Histologické vyšetření resekátu verifikovalo adenokarcinom prostaty pT2c Nx, Mx, R0 GS 7 (3+4). Po výkonu pacient močil bez potíží, byl plně kontinentní, pro erektilní dysfunkci přechodně užíval PDE5-I. Kontrolní hodnota PSA < 0,01. S odstupem dvou let od RaRP došlo u pacienta k biochemické recidivě onemocnění, kdy hodnota PSA vzrostla na 0,23. Doplněná zobrazovací vyšetření byla negativní ve smyslu generalizace maligního onemocnění a pacient byl indikován k salvage radioterapii. Plánovanou RT s celkovou dávkou 70 Gy pacient podstoupil koncem roku 2014 s dobrou odezvou PSA < 0,01. Remise onemocnění trvala až do 11/2016, kdy byl pacient akutně vyšetřen pro frekventní mikci, nykturie a urgence. Provedené ultrasonografické vyšetření zobrazuje difuzní zesílení stěny močového měchýře bez nálezu jiné patologie. Aktuální hodnota PSA < 0,01. Pacient byl při negativním kultivačním vyšetření moči směřován k cystoskopickému dovyšetření. Před jeho realizací proběhla další akutní ambulantní ošetření pacienta pro makroskopickou hematurii komplikovanou hemotamponádou močového měchýře. Infekční etiologie byla opakovaně vyloučena. Konzervativní postup s katetrizací močového měchýře postupně selhával. Pro progredující anemizaci byl pacient hospitalizován na urologickém oddělení. Za hospitalizace jsme postupovali dále konzervativně kontinuální irigací močového měchýře, hemosubstitucí, infuzní rehydratací, podáváním hemostyptik. Po odeznění akutní fáze makroskopické hematurie byla doplněna cystoskopie s nálezem kontaktně krvácejících difuzních teleangiektázií sliznice na spodině, zadní a levé boční stěně močového měchýře. Odebrali jsme biopsii a provedli plošnou elektrokoagulaci popisovaných změn. Po výkonu byl pacient bez známek hematurie a po extrakci močové cévky dimitován. Histologické výsledky z biopsie potvrdily diagnózu chronických postradiačních zánětlivých změn. S odstupem čtyř týdnů byl pacient pro identické potíže hospitalizován znova. Po zvážení našich předchozích zkušeností u pacientů s RIHC, kteří pro stále častější a závažnější recidivy podobných potíží postupně dospěli k řešení buď selektivní embolizací nebo dokonce cystektomií, jsme v literatuře hledali méně invazivní a pro pacienta přijatelnější cestu. Po konzervativně zvládnuté akutní fázi relapsu hemoragické cystitidy byl pacient přeložen do Městské nemocnice Ostrava k provedení terapie hyperbarickým kyslíkem (HBO) (Obr. 1). Pacient absolvoval v hyperbarické komoře léčbu HBO 2,4 ATA (absolutní atmosféra). Celkem 14 expozic, 1× denně. Během této doby symptomy makroskopické hematurie odezněly. Po extrakci močového katétru s dvoutýdenním odstupem a rozmočení byl pacient bez další recidivy makroskopické hematurie ve dvouročním sledovaném období.
Fig. 1. Schema of hyperbaric
chamber University Hospital Lille, France. A similar one will arise
as a part of the reconstruction in
Centrum hyperbaric medicine,
Ostrava City Hospital (15)
DISKUZE
Hemoragická postradiační cystitida je vzácnou pozdní urologickou komplikací RT, ale jednou z nejnepříznivějších a kvalitu života pacientů nejvíce omezujících. Incidence je cca 5 % pacientů, kteří podstoupili RT na oblast malé pánve (9). Latence od proběhlé RT do vzniku symptomů je půl roku až dvacet let. V dnešní době tedy stále „sklízíme plody“ starších technik ozařování. Pro úplnost dodávám, že shodný klinický obraz jako RIHC se všemi konsekvencemi a také podobné možnosti léčby má i chemoterapií indukovaná hemoragická cystitida (CHIHC) (1). Mechanismem vzniku RIHC je nespecifická zánětlivá reakce probíhající ve stěně močového měchýře jako důsledek poškození ionizujícím zářením (negativní efekt vzniklých kyslíkových radikálů, poškození jaderné DNA), nerovnováhou mezi zánětlivou reakcí a reparačními pochody (1). Postupně dochází k poškození buněk přechodního epitelu, endotelových a hladkých svalových buněk. Z časového hlediska má tento proces tři na sebe navazující fáze. První je krátká akutní fáze, která může vzniknout již v průběhu ozařování, trvá několik týdnů po ukončení RT a odpovídá klinickému projevu akutní radiační cystitidy způsobené poškozením urotelu. Následuje asymptomatická fáze trvající řadu měsíců až několik let, kdy postupně dochází k přestavbě stěny močového měchýře především vrstvy lamina propria mucosae a tunica muscularis. Tyto změny nakonec vyústí ke vzniku vředovitých slizničních lézí, odlučování nekrotických tkání až možnému vzniku píštělí s okolními orgány, rozvoji endarteritis obliterans, telangiektázií a k projevům signifikantní hematurie (3).
V současnosti není pro RIHC dostupná žádná definitivní léčba a neexistují žádné platné doporučené léčebné postupy na podkladě medicíny založená na důkazech (Evidence‑Based Medicine, EBM). V první době je nutné vyloučit jiné onemocnění, které se projevuje stejnými nespecifickými příznaky: především infekční etiologie potíží, urolitiáza či neoplazie urotraktu. Spektrum terapeutických modalit je široké. Pokud to klinický stav pacienta umožňuje, měli bychom začínat konzervativní léčbou a až při neefeku přidávat na invazivitě, která je samozřejmě přímo úměrná i morbiditě. Na to je třeba myslet při zvažování radikálnějších postupů. S ohledem na hematurii je u RIHC stupně 2 a výše nutné zahájit terapii zajištěním derivace močového měchýře proplachovou cévkou, rehydratací pacienta, hrazením eventuálních krevních ztrát, farmakoterapií spasmoanalgetiky, hemostyptiky. V případě takto neřešitelné hemotamponády močového měchýře nebo protrahovaného krvácení pacienta indikujeme k cystoskopii s intervencí směřující k zástavě krvácení. Kalium‑titanyl‑fosfát (KTP) laser se vzhledem ke specifickému zaměření cévních struktur zdá ideální volbou (10). Po zvládnutí aktivního krvácení ze stěny močového měchýře se otevírá prostor položit si otázku: Jak dále? Čekat na další recidivu a pak postupovat opět maximálně konzervativně? Při další recidivě zkusit některou ze starších variant intravezikální instilace roztoků (IVI) např.: solemi stříbra, hliníku, formaldehydu? Jsou při selhání konzervativních postupů nyní na řadě intervence typu selektivní arteriální embolizace, chirurgické podvazy vnitřní ilické arterie, derivační chirurgické výkony včetně cystektomie? Je nutné si uvědomit, že výše jmenované spektrum je vždy léčbou symptomatickou. Dle mého názoru je v této fázi ideální prostor přistoupit k některé z méně známých, v praxi méně využívaných, ale především méně invazivních možností kauzální terapie. S přihlédnutím k reálným podmínkám současného zdravotního systému v České republice se plošná péče tohoto druhu prakticky zužuje na intravezikální instilaci kyseliny hyaluronové (3) a námi diskutovanou hyperbaroxii. V současnosti okrajové a spíše experimentální postupy kauzální léčby RIHC jsou intravezikální instilace prostaglandinů (1, 3), botulotoxinu (1), kyseliny aminokapronové (1), lipozomálního roztoku imunosupresiva tacrolimu (3), lokální použití vaskulárního endotelového růstového faktoru (VEGF) (11), kmenových buněk (3) nebo intravenózního podání 10% roztoku tetrachlorodekaoxidu Cl4H2O11 (Macrokine®, Immunokine) WF10 (12). Tyto modality čeká dlouhá cesta s nejistým výsledkem před eventuálním uvedením do běžné denní praxe.
Hyperbarická oxygenoterapie (hyperbaroxie) je léčebná metoda, která by vzhledem k mechanismu účinku mohla být vhodným kauzálním způsobem léčby RIHC. Princip spočívá v inhalačním podávání kyslíku za podmínek zvýšeného atmosférického tlaku. Vdechovaná koncentrace kyslíku se blíží 100 %, pracovní tlak v hyperbarické komoře je 2,5–3,0 ATA (1). Dochází k plnému dosycení hemoglobinu kyslíkem, mnohonásobnému zvýšení parciálního tlaku kyslíku a jeho fyzikálnímu rozpuštění v krevní plazmě. Cévní systém pak zprostředkovaně přispívá k mnohonásobnému zvýšení parciálního tlaku kyslíku ve tkáních, kde se až čtyřnásobně prodlužuje jeho difuzní dráha. Všechny tyto děje vedou ke zvýšené dodávce kyslíku i ve tkáních postižených ischemií a hypoxií (jako je tomu ve stěně močového měchýře při RIHC) (13).
Hyperbarická oxygenoterapie ale neznamená pouze přísun „většího množství kyslíkového substrátu“, má více jedinečných efektů včetně signálního efektu vůči DNA (transkripci) s ovlivněním množství buněčných procesů (exprese hormonů, enzymů, faktorů up‑regulace receptorů). Bylo prokázáno, že během 24 hodin po aplikaci HBO jsou aktivovány geny antioxidační, protizánětlivé, prorůstové, reparační faktory a hormony. Naopak deaktivovány jsou geny pro tvorbu prozánětlivých cytokinů a geny zodpovědné za apoptózu. Výsledným efektem je stimulace neovaskularizace, fibroblastové proliferace, tkáňové reparace, produkce kolagenu, urychlení demarkace mezi nekrotickou a vitální tkání (14).
Vlastní pobyt v hyberbarické komoře při léčbě RIHC je obvykle v délce 60–90 minut. Za účelem snížení rizika toxicity vdechovaného kyslíku je možné v 20–30minutových intervalech provádět přestávky s dýcháním vzduchu (3). Pacienti hyperbaroxii absolvují 1–2× denně do celkového počtu 20–40 expozic dle průběžného efektu (1, 3).
Léčba hyperbarickým kyslíkem je obecně považována za bezpečnou léčebnou proceduru s velmi nízkým rizikem NÚ. Nejčastější komplikací je soubor tzv. dysbarických poranění (barotraumat): středoušní dutiny, dutiny v obličejové části lebky, zubní dutiny a zažívacího traktu. Barotrauma plic je nejzávažnější poranění, jedná se o velice raritní, nicméně život ohrožující komplikaci. Dále může být HBO komplikována hypoglykemií a reverzibilní myopií (13). Dlouhodobá inhalace kyslíku může být potenciálně toxická pro plíce a CNS. Toxicitu mohou také ovlivnit medikace kortikosteroidů, inzulinu, adrenalinu, noradrenalinu, užívání vysokých dávek kyseliny acetylsalicylové a vitaminu C (3), deficit vitaminu E, retence oxidu uhličitého či horečka nejasné etiologie. V některých starších pracích bylo uvedeno, že HBO zvýšenou dodávkou kyslíku stimuluje růst tumorů a aktivitu metastáz. Toto tvrzení bylo později opakovaně vyvráceno (13).
Kontraindikace HBO jsou neošetřený pneumotorax (někdy uváděný jako jediná absolutní kontraindikace), dlouhodobá léčba kardiotoxickými cytostatiky (doxomycin, doxorubicin), cis‑platinou, medikace disulfiramu (Antabus®), bleomycinu, akutní infekt horních cest dýchacích, akutní sinusitida, neprůchodnost paranasálních dutin či Eustachovy trubice, těžké ušní afekce či operace v anamnéze, otoskleróza, těžké astma bronchiale, chronická obstrukční choroba s emfyzémem a vyšším parciálním tlakem oxidu uhličitého v arteriální krvi (> 60 mmHg) (3), klaustrofobie, křečové onemocnění v anamnéze. Relativními kontraindikacemi jsou prodělaný spontánní pneumotorax, resekční výkony na plicích v anamnéze pacienta, těhotenství, některé druhy kardiostimulátorů a kardiostimulátor‑defibrilátorů (13).
Efektivita HBO při léčbě RIHC je velmi variabilní, příznivou odpověď na tuto léčbu udávají autoři ve svých pracích v rozmezí 27–92 %, rekurence je popisována v rozmezí 8–63 % (1, 3). Tato variabilita může být zapříčiněna různými kritérii jednotlivých protokolů v těchto studiích. Je nutné si uvědomit, že jde o soubory čítající maximálně několik desítek pacientů a většina z nich nepodstoupila HBO jako první metodu volby, ale až po selhání jiných modalit. Otázkou je délka sledování a trvání příznivého efektu HBO v čase.
Největší soubor pacientů v rámci jedné studie publikovali Ribeiro de Oliveira et al. v r. 2015. Jde o retrospektivní nerandomizovanou studii, která zahrnuje soubor 176 pacientů s RIHC (111 žen, 65 mužů) ve věku 15–85 let, kteří podstoupili HBO v Portuguese Navy Center for Underwater and Hyperbaric Medicine v průběhu 15 let. Nejčastěji zastoupená indikace RT na oblast malé pánve byla pro karcinom děložního čípku (50,6 %) a karcinom prostaty (31,8 %), střední celková obdržená dávka byla 56 Gy. Přibližně čtvrtina pacientů měla postradiační postižení dalšího kritického orgánu mimo močový měchýř (proktitida, enteritida), u 19,3 % pacientů si závažnost stavu vyžádala před zahájením vlastní HBO krevní transfuze a všichni pacienti podstoupili bez efektu minimálně jednu jinou konzervativní léčebnou modalitu pro RIHC. Průměrná doba od vzniku hematurie do začátku HBO byla 13,69 měsíců. Každý z pacientů podstoupil 20 devadesátiminutových cyklů, po kterých se dle klinického stavu pacienta a dosavadního efektu léčby přidalo dalších 10 nebo 20 cyklů. Celkem byl průměr na jednoho pacienta 37 cyklů HBO. Z nežádoucích účinků se u tří pacientů projevilo barotrauma středouší. Efektivita HBO v tomto souboru pacientů byla následující: u 89,8 % pacientů došlo k ústupu hematurických projevů (u 67 % zcela bez projevů makroskopické hematurie, u 22,7 % došlo k redukci frekventurie a stupně závažnosti hematurických projevů). Pouze u 9,1 % pacientů nedošlo k žádné změně a u dvou pacientů došlo ke zhoršení příznaků. K rekurenci projevů RIHC došlo v rámci dvanáctiměsíčního sledování u celkem 24 pacientů (15,2 %) (7).
Přínosem této práce bylo také potvrzení dobrého efektu HBO u pacientů s konkomitantním postra ‑ diačním poškozením dalšího orgánu mimo močový měchýř s doporučením autorů uvažovat o HBO jako o léčbě první linie u této skupiny pacientů. Statisticky významnou korelaci autoři udávají mezi vymizením hematurie po HBO a nutnosti podání krevních transfuzí před léčbou a počtem cyklů HBO. Důležité je správné načasování směřování pacienta k HBO. Z dosavadních prací je také zřejmé, že časné zahájení HBO od vzniku prvních příznaků RIHC má lepší výsledky (7).
Naše zkušenost s HBO byla s dobrým výsledkem. Je na místě ale poukázat, že se jedná pouze o kazuistiku jediného pacienta a krotit přehnanou euforii. Pouze čas a další nasbírané zkušenosti s touto léčbou ukážou, zda bude standardně aplikovatelná s dobrým a trvalým efektem. U našeho konkrétního pacienta se výsledek dostavil i přes pouhých 14 expozic, tedy výrazně méně než je spodní hranice u zmiňované práce Ribeiro de Oliveira et al. Otázkou samozřejmě je, zda-li bude efekt léčby trvalý. Již nyní ale HBO nelze upřít několik benefitů. V porovnání s ostatními možnostmi jde o přístup neinvazivní, tedy je předpoklad dobré tolerance a spolupráce pacienta. Po zvládnutí akutního krvácení bez nutnosti hospitalizace je možné následující HBO absolvovat ambulantní cestou. To může být jistě i zajímavý argument pro poskytovatele zdravotní péče jako přístup ekonomicky výhodnější. Náklady u chronických indikací jsou cca 1700 Kč za jednu expozici (13). Dlouhodobý efekt HBO nebyl zatím prokázán žádnou prospektivní randomizovanou studií. Při selhání HBO se dle mého soudu lze ale vždy vrátit zpět k některému ze symptomatických a více invazivních postupů.
ZÁVĚR
Vzhledem k vzrůstajícímu počtu pacientů indikovaných k radioterapii na oblast malé pánve budeme my urologové muset ve své praxi stále častěji čelit komplikacím tohoto léčebného postupu. A to včetně postradiační hemoragické cystitidy. Tato pozdní komplikace RT je s ohledem na kvalitu života pacientů jedna z nejúpornějších. Může se objevit s odstupem až dvaceti let a v extrémním případě vést až k život ohrožujícímu krvácení z močového měchýře. Přes veškeré možnosti současné medicíny není pro RIHC žádná definitivní kauzální léčba a neexistují žádné platné doporučené léčebné postupy. Většina v současnosti používaných léčebných postupů je symptomatických a invazivních. Množí se ale kazuistiky a studie, které poukazují na nespornou efektivitu poněkud neotřelé kauzální léčby u pacientů s RIMC – hyperbarickou oxygenoterapii. Tato léčebná modalita se zdá slibnou i z důvodů prokázané efektivity u všech stadií RIHC.
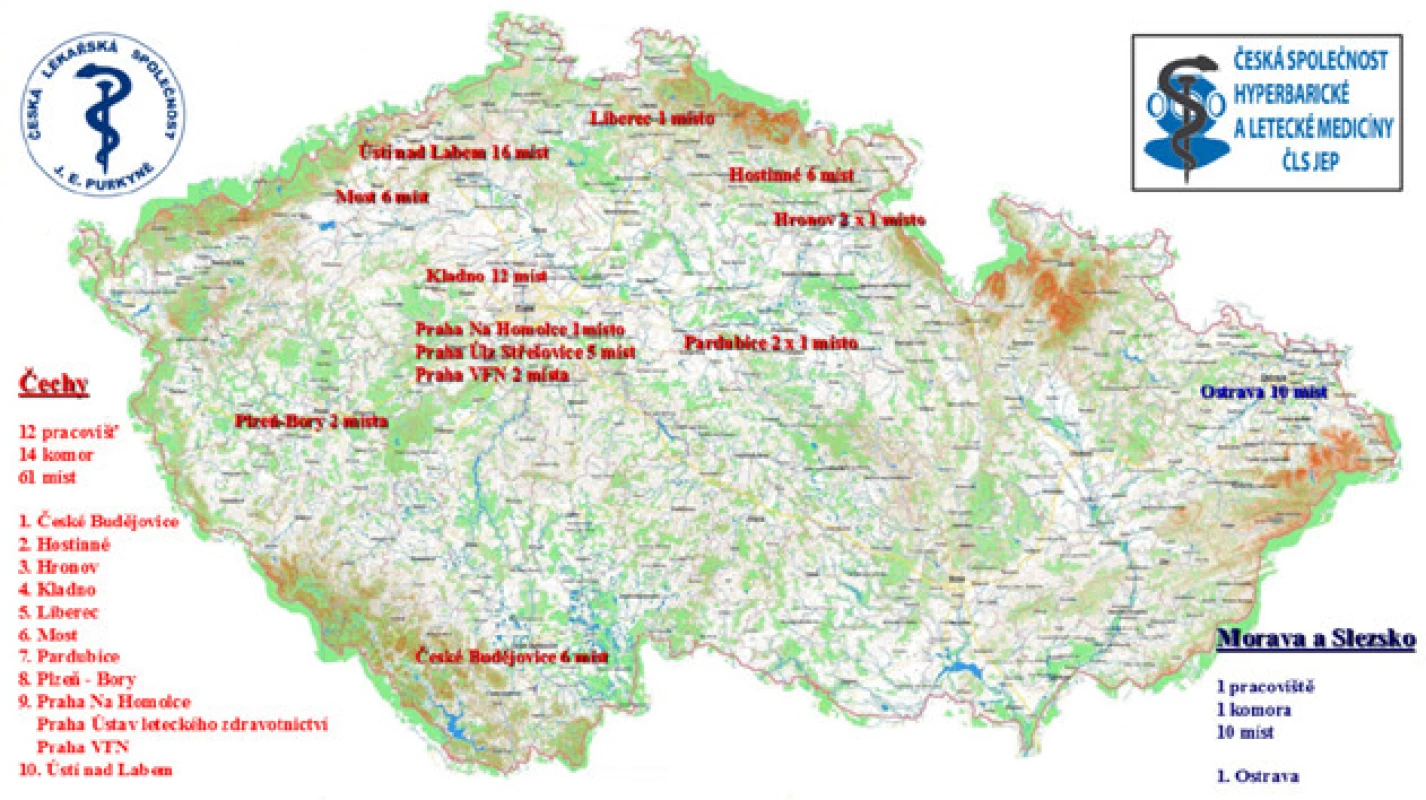
Jako vždy je nutné primárně pacienta informovat o všech dostupných možnostech léčby se všemi pozitivy i negativy. Hyperbaroxie určitě stojí za diskuzi a zahrnutí do našich léčebných algoritmů i vzhledem k slušné síti hyperbarických komor v ČR (obr. č. 2) a možnosti ambulantní léčby.
Fig. 2. Hyperbaric chambers
in the Czech Republic, actual situation (16)
Přes dobré výsledky dosavadních prací nutno ale kriticky poukázat na poměrně velkou variabilitu jednotlivých souborů, stále relativně malý celkový počet pacientů a fakt, že jde pouze o retrospektivní nerandomizované studie. I toto je jistě objektivní příčinou, proč se nepodařilo do současnosti prosadit efektivitu HBO v léčbě RIHC jako všeobecně uznávaný trend.
Střet zájmů: Žádný.
Prohlášení o podpoře: Autor prohlašuje, že zpracování tohoto článku nebylo podpořeno žádnou společností.
Došlo: 25. 7. 2020
Přijato: 15. 10. 2020
Kontaktní adresa:
MUDr. Michal Šurík, FEBU
Urologické oddělení
Karlovarská krajská nemocnice a. s.
Bezručova 1190/19,
360 01 Karlovy Vary
e-mail: michal.surik@kkn.cz
Sources
1. Zwaans BMM, Nicolai HG, Chancellor MB, Lamb LE. Challenges and Opportunities in Radiation‑induced Hemorrhagic Cystitis. Reviews in Urology 2016; 18(2): 57–65.
2. Witjes JA, Compérat E, Cowan NN, et al. EAU Guidelines on Muscle‑invasive and Metastatic Bladder. In: European Association of Urology Guidelines 2017 edition. Arnhem 2017 : 33–34.
3. Rajaganapathy BR, Jayabalan N, Tyagi P, Kaufman J, Chancellor MB. Advances in Therapeutic Deve ‑ lopment for Radiation Cystitis. LUTS 2014; 6(1): 1–10.
4. Šlampa P, Burkoň P, Čoupek P, et al. Radiační onkologie v praxi. 4 aktualizované vydání. Brno: MOÚ 2014 : 353 s.
5. Odrážka K, Vaculíková M, Doležel M, et al. Chronická toxicita trojrozměrné konformní radioterapie (3D‑CRT) karcinomu prostaty. Klin Onkol 2006; 19(4): 222–227.
6. Šlampa P, Petera J, Abrahámová J, et al. Radiační onkologie. Praha: Galén 2007 : 287–297.
7. Ribeiro de Oliveira TM, Carmelo Romao AJ, Gamito Guerreiro FM, Matos Lopes TM. Hyperbaric oxygen therapy for refractory radiation‑induces hemorrhagic cystitis. International Journal of Urology 2015; 22 : 962–966.
8. Čoupková I, Čoupek P, Krupa P, Šlampa P. Komplikace spojené s radioterapií karcinomu prostaty, jejich prevence a léčba. Urol. praxi 2011; 12(5): 292–294.
9. Smit SG, Heyns CF. Management of radiation cystitis. Nat Rev Urol 2010; 7 : 206–214.
10. Zhu J, Xue B, Shan Y, Yang D, Zang Y. Transurethral coagulation for radiation‑induced hemorrhagic cystitis using GreenlightTM potassium‑titanyl‑phosphate laser. Photomed Laser Surg 2013; 31 : 78–81.
11. Soler R, Vianello A, Fullhase C, et al. Vascular therapy for radiation cystitis. Neurourol Urodyn 2011; 30 : 428–434.
12. Veerasarn V, Khorprasert C, Lorvidhaya V, et al. Reduced recurrence of late hemorrhagic radiation cystitis by WF10 therapy in cervical cancer patients: a multicenter, randomized, two‑arm, open‑label trial. Radiother Oncol J Eur Soc Ther Radiol. Oncology 2004; 73 : 179–185.
13. Hájek M. Centrum hyperbarické medicíny. Městská nemocnice Ostrava [online]. 2017. Dostupný na www: http://www.mnof.cz/klinicka‑oddeleni/centrum‑hyperbaricke‑mediciny/co‑je‑hyperbaricka ‑ ‑oxygenoterapie/.
14. Hájek M, Růžička J, Racek J, et al. Hyperbarická medicína. Praha: Mladá fronta 2017 : 453 s.
15. Spol. HAUX Life Support GmbH, Karlsbad-Ittersbach, Německo.
16. Centrum hyperbarické medicíny. Městská nemocnice Ostrava, Česká republika.
Labels
Paediatric urologist Nephrology UrologyArticle was published in
Czech Urology
2020 Issue 4
-
All articles in this issue
- Editorial
- Pravostranná robotická reimplantace močovodu s Boariho lalokovou plastikou
- Možnosti využití ligandů prostatického specifického membránového antigenu (PSMA) v diagnostice a léčbě karcinomu prostaty
- Úvod do problematiky urogenitálních píštělí: incidence, etiologie, klasifikace, symptomatologie a diagnostika
- Výskyt a výsledky operačního řešení lokálních recidiv zhoubných nádorů ledvin
- Atypická hladkosvalová neoplazie prostaty nejistého maligního potenciálu – leiomyom/leiomyosarkom prostaty
- Raritní případ gigantických kondylomat (Buschke-Löwenstein) v urologické prax
- Postradiační hemoragická cystitida – terapeutické možnosti se zaměřením na hyperbarickou oxygenoterapii
- Fraktura penisu – diagnostika a léčba
- Komentář k práci Schraml J, Broul M, Hlavička M, Bočan M. Šetření hrdla močového měchýře při RARP
- Vzpomínka na doc. MUDr. et MgA. Ivana Kawaciuka, CSc.
- Ohlédnutí za 66. výroční konferencí České urologickém společnosti
- Zpráva o proběhlé akci 8. český video‑seminář, Tipy a triky v urologické operativě 2020
- Výsledky soutěže ČUS o nejlepší vědeckou publikaci za rok 2019
- Czech Urology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Fraktura penisu – diagnostika a léčba
- Úvod do problematiky urogenitálních píštělí: incidence, etiologie, klasifikace, symptomatologie a diagnostika
- Postradiační hemoragická cystitida – terapeutické možnosti se zaměřením na hyperbarickou oxygenoterapii
- Pravostranná robotická reimplantace močovodu s Boariho lalokovou plastikou
