Antibiotická profylaxe u transrektální fúzní biopsie prostaty
Antibiotic prophylaxis in multiparametric magnetic resonance imaging-guided transrectal prostate biopsy
Řezáč J, Čapoun O, Sobotka R, Kupidlovská L, Lambert L, Hanuš P, Macová I, Černý V, Hanuš T. Antibiotic prophylaxis in multiparametric magnetic resonance imaging-guided transrectal prostate biopsy.
Introduction: Antibiotic prophylaxis is, according to international recommendations, an integral part of transrectal prostate biopsy. The most used antibiotics are ciprofloxacin and cotrimoxazole. However, the incidence of resistance to both substances has an upward trend. The aim of our work was to evaluate the microbial profile from a rectal swab and to determine the sensitivity of bacterial strains in patients indicated for multiparametric magnetic resonance imaging-guided prostate biopsy.
Material and methods: In the period from 03/2019 to 05/2020, we examined a total of 192 patients. Prophylactically, cotrimoxazole 960 mg p. o. every 12 hours in a total of three doses starting in the morning on the day of the biopsy was most administered. In case of allergy, we recommended ciprofloxacin 750 mg p. o. in the same regime. We performed a rectal swab just before the procedure. Bacterial strains were cultured on common soils, sensitivity was determined qualitatively by the diffusion disk method. We recorded a maximum of three strains and, in the case of resistance, all evaluated antibiotics. We prospectively monitored the occurrence of a septic reaction, characterized by a general alteration of the condition, a temperature above 38 °C and a painful per rectum finding requiring hospitalization within seven days after the procedure.
Results: A total of 266 bacterial strains were found in a total of 170 (88.5 %) patients. The most frequently cultured strain was Escherichia coli with sensitivity to all antibiotics (45.8 % of all patients). Most often, we described Escherichia coli resistance to potentiated aminopenicillin (22 % of strains). Resistance to cotrimoxazole and ciprofloxacin, respectively, was observed in 19 % and 22 % strains, respectively. Resistance to three or more antibiotics has been described in 27 strains. Septic complication occurred in a total of three (1.6 %) patients, we present those in short case reports.
Conclusion: Our results show a similar incidence of pathogens resistant to both commonly used antibiotics. Despite the relatively high incidence of resistance, the number of clinical complications remains low.
Keywords:
antibiotics – Biopsy – Prophylaxis – prostate cancer
Authors:
Jakub Řezáč 1; Otakar Čapoun 1; Roman Sobotka 1; Lenka Kupidlovská 2; Lukáš Lambert 3
; Petr Hanuš 3; Iva Macová 3; Vladimír Černý 3; Tomáš Hanuš 1
Authors‘ workplace:
Urologická klinika VFN a 1. LF UK v Praze
1; Ústav lékařské biochemie a laboratorní diagnostiky VFN, Klinická mikrobiologie a ATB centrum, Praha
2; Radiodiagnostická klinika VFN a 1. LF UK v Praze
3
Published in:
Ces Urol 2021; 25(2): 106-111
Category:
Original Articles
Overview
Řezáč J, Čapoun O, Sobotka R, Kupidlovská L, Lambert L, Hanuš P, Macová I, Černý V, Hanuš T. Antibiotická profylaxe u transrektální fúzní biopsie prostaty.
Úvod: Antibiotická profylaxe představuje dle mezinárodních doporučení nedílnou součást transrektální biopsie prostaty. Nejčastěji užívanými antibiotiky jsou ciprofloxacin a kotrimoxazol. Výskyt rezistence na oba preparáty má však vzestupný trend. Cílem naší práce je zhodnocení mikrobiálního profilu z rektálního stěru a určení citlivosti bakteriálních kmenů u pacientů indikovaných k fúzní biopsii prostaty (FBP).
Materiál a metody: V období od 03/2019 do 05/2020 jsme vyšetřili celkem 192 pacientů. Profylakticky byl nejčastěji podán kotrimoxazol 960 mg p. o. po 12 hodinách v celkem třech dávkách počínaje ránem v den biopsie. Při alergii jsme doporučili ciprofloxacin 750 mg p. o. ve stejném režimu. Rektální stěr jsme provedli těsně před výkonem. Bakteriální kmeny byly kultivovány na běžných půdách, citlivost jsme stanovili kvalitativně difuzní diskovou metodou. Zaznamenali jsme nejvýše tři kmeny a v případě rezistence pak všechna hodnocená antibiotika. Prospektivně jsme sledovali výskyt septické reakce, charakterizované celkovou alterací stavu, teplotou nad 38 °C a bolestivým nálezem per rektum s nutností hospitalizace do sedmi dnů po provedení FBP.
Výsledky: U 170 (88,5 %) pacientů jsme zjistili celkem 266 bakteriálních kmenů. Nejčastěji kultivovaným kmenem byla Escherichia coli s citlivostí na všechna antibiotika (45,8 % pacientů). Rezistence Escherichia coli na potencované aminopeniciliny byla zjištěna u 22 % kmenů. Zvlášť sledovanou rezistenci na kotrimoxazol, respektive ciprofloxacin jsme zaznamenali celkově u 19 %, respektive 22 % kmenů. Vícečetná rezistence (na tři a více antibiotik) byla popsána u 27 kmenů. Septická komplikace nastala celkem u tří (1,6 %) pacientů, které prezentujeme v krátkých kazuistikách.
Závěr: Naše výsledky ukazují obdobný výskyt patogenů rezistentních na obě běžně užívaná antibiotika. I přes relativně vysoký výskyt rezistence zůstává počet klinických komplikací nízký.
Klíčová slova:
antibiotiká – Biopsie – profylaxe – karcinom prostaty
ÚVOD
Antibiotická (ATB) profylaxe představuje nedílnou součást transrektální biopsie prostaty (BP). Evropská urologická asociace (EAU) jí ve svých Guidelines přiřadila velmi vysokou úroveň důkazu Ib (1). Nejčastějšími v praxi užívanými antibiotiky jsou ciprofloxacin a kotrimoxazol. Výskyt rezistence na oba tyto preparáty má však vzestupný trend (2, 3). Profylaxi nejčastěji podáváme perorální formou, jednodenní profylaxe se zdá být z hlediska komplikací srovnatelnou s třídenním režimem (4). V roce 2019 zveřejnila Evropská agentura pro léčivé přípravky (EMA) doporučení omezující indikace k užívání fluorochinolonů vzhledem k jejich závažným nežádoucím účinkům (5). Mezi rizikové faktory vzniku antibiotické rezistence řadíme užívání antibiotik v předchozích 3–6 měsících předchozí biopsie, přítomnost permanentního močového katétru a uroinfekce v předchozích šesti měsících, hospitalizace a komorbidity jako například diabetes mellitus a metabolický syndrom (2). K minimalizování závažného rizika v případě polyrezistentní rektální flóry se doporučuje provedení rektálního stěru, cílená antibiotická profylaxe, případně dezinfekce rekta jodovaným povidonem (6). Mezi nejčastější komplikace BP řadíme nejčastěji hemospermii (až 37 %) a hematurii (14 %). Infekční komplikace představuje: horečka nad 38,5 °C (0,8 %), epididymitida (0,7 %) či prostatitida (1 %) (1). Alternativou, se kterou se setkáváme i na tuzemských pracovištích, může být transperineální BP. U té je doporučován cefazolin nebo cefuroxim v jedné dávce (7, 8, 9). Cílem naší práce bylo zhodnocení mikrobiálního profilu z rektálního stěru a určení citlivosti bakteriálních kmenů na nejčastěji užívaná antibiotika u pacientů indikovaných k fúzní biopsii prostaty (FBP).
MATERIÁL A METODY
V období od 03/2019 do 05/2020 jsme na našem pracovišti provedli FBP celkem u 192 pacientů. Vyšetření provádíme v poloze na levém boku v lokálním znecitlivění 10 ml 1% trimecainu periprostaticky. K multiparametrické magnetické rezonanci (mpMR) využíváme přístroj Siemens SKYRA 3 Tesla, Německo. Aplikujeme 15 ml kontrastní látky gadoteridolu. Odebíráme 10–12 vzorků dle velikosti prostaty. Na základě mpMR označujeme maximálně dvě léze podle Prostate Imaging-Reporting and Data System (PI-RADS) verze 2.1 (10). Z lézí PI-RADS ≥ 3 odebíráme vždy maximálně tři vzorky. Střední počet vzorků při FBP dosahuje 12 (12–16 vzorků).
Vyšetření provádíme vždy v ATB profylaxi. U všech pacientů vyžadujeme buď negativní kultivaci moče nebo negativní močový sediment. Nejčastěji podáváme kotrimoxazol 960 mg p. o. po 12 hodinách v celkem čtyřech dávkách počínaje ránem nejméně dvě hodiny před biopsií. Při alergii využíváme ciprofloxacin 750 mg p. o. ve stejném režimu. U každého pacienta jsme provedli rektální stěr těsně před výkonem odběrovým tamponem zanořeným do transportní půdy.
Po příjmu do bakteriologické laboratoře je stěr nanesen na pevné kultivační půdy: krevní agar, Uriselect 4 a deoxycholát-citrátový (DC) agar, poté je tampon vytřepán do selenitového bujónu. Naočkované půdy se inkubují v termostatu při teplotě 35–37 °C po dobu 18–24 hodin. Po předepsané době kultivace se hodnotí přímá kultivace (primokultivace) a zároveň se očkuje tekutá bujónová půda na pevná kultivační media – krevní agar, Uriselect 4 a DC agar. Definitivní hodnocení se provádí za 48 hodin. U všech gramnegativních bakterií je stanovena citlivost na antibiotika difuzní diskovou metodou. Každý kmen je zároveň testován na produkci širokospektré betalaktamázy. Ertapenem pak slouží jako skríningové antibiotikum pro záchyt kmenů s možnou produkcí karbapenemáz.
V souboru pacientů jsme sledovali výskyt septické reakce, charakterizované celkovou alterací stavu, teplotou nad 38 °C, či bolestivým nálezem per rektum, s nutností hospitalizace či další ATB léčby do sedmi dnů po provedení FBP.
VÝSLEDKY
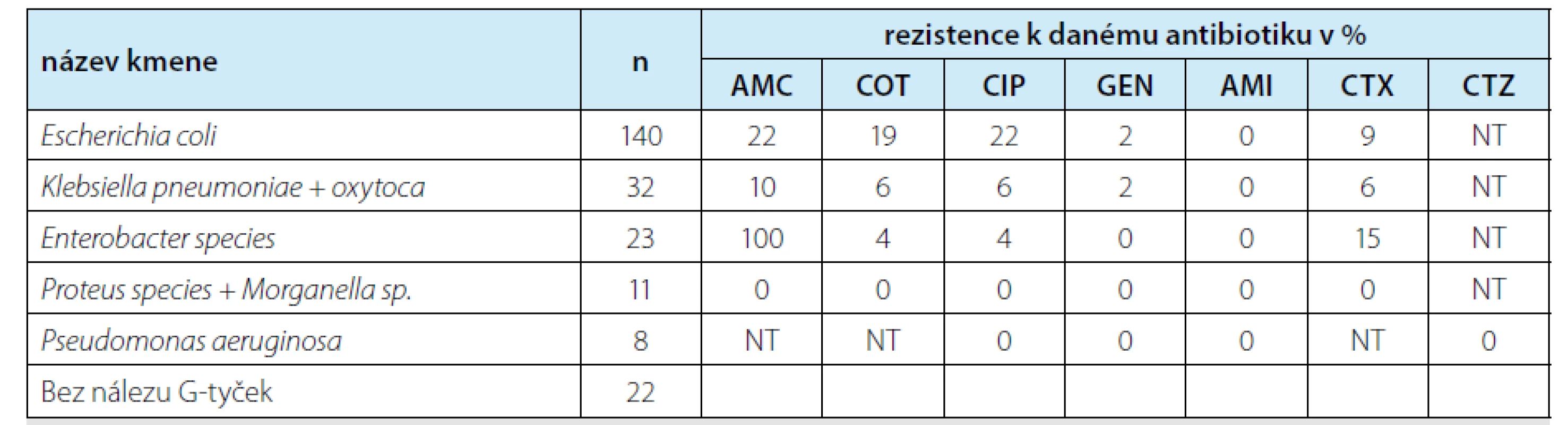
U 170 (88,5 %) pacientů jsme zjistili celkem 266 bakteriálních kmenů (1–3 kmeny bakterií v rektálním stěru). U 11,5 % pacientů byla popsána pouze běžná rektální flóra, případně zcela negativní nález. Nejčastěji kultivovaný kmen představovala Escherichia coli s citlivostí na všechna antibiotika (45,8 % všech pacientů). Rezistence Escherichia coli na potencované aminopeniciliny byla zjištěna u 22 % kmenů. Zvlášť sledovanou rezistenci na kotrimoxazol, respektive ciprofloxacin jsme zaznamenali u 19 %, respektive 22 % kmenů. Rezistenci ke třem a více skupinám antibiotik jsme zjistili u 10 % kmenů. Septická komplikace nastala u tří (1,6 %) pacientů, které prezentujeme v krátkých kazuistikách. U jednoho pacienta jsme kultivovali kmen Escherichia coli rezistentní na kotrimoxazol i ciprofloxacin, u dalšího pak kmen Klebsiella pneumoniae rezistentní na kotrimoxazol, třetí pacient měl kmen Escherichia coli rezistentní ke kotrimoxazolu a potencovanému aminopenicilinu.
Dalšími kultivovanými kmeny z rektálního stěru byly: Klebsiella pneumoniae, Enterobacter cloacae, Pseudomonas aeruginosa, Citrobacter freundii, Proteus mirabilis, Proteus vulgaris a Morganella morganii. U všech kmenů byla stanovena citlivost k těmto antibiotikům: amoxicilin/klavulanát, kotrimoxazol, ciprofloxacin, gentamicin, amikacin, cefotaxim a ertapenem, u Pseudomonas aeruginosa: gentamicin, amikacin, ceftazidim a ciprofloxacin.
Přehled rezistence bakterií k testovaným antibiotikům je shrnut v tabulce č. 1.
Tab. 1. Cultured bacterial strains and numbers of resistances
KAZUISTIKA 1
Sedmdesátiletý muž bez závažnějších komorbidit podstoupil první BP (deset vzorků) s negativním nálezem před dvěma lety mimo naše pracoviště. Při dalším nárůstu hladiny PSA na 6,84 ng/ml jsme provedli mpMR prostaty s nálezem jedné léze PI-RADS 3 v tranzitorní zóně vlevo ve střední části prostaty. Sonografické i per rektum vyšetření bylo v normě, při FBP jsme odebrali celkem 12 vzorků opět s negativním výsledkem. Pacient užíval profylakticky ciprofloxacin ve výše popsaném režimu. Kultivace rektálního stěru identifikovala Escherichia coli, Klebsiella oxytoca širokospektrá betalaktamáza negativní (ESBL-), Enterobacter cloacae s produkcí širokospektré betalaktamázy a ojediněle kvasinky. Rezistenci na profylakticky podaný ciprofloxacin vykázal pouze kmen Escherichia coli, ostatní bakterie byly citlivé na podané antibiotikum. Pacient přichází třetí den po biopsii s horečkou 38 °C, třesavkou a bolestí v podbřišku. Popsali jsme palpačně citlivou prostatu, sonograficky byla patrná močová retence. Ambulantně jsme doplnili kultivaci moči. S přihlédnutím k výsledkům rektálního stěru jsme zahájili i. v. podávání Amoksiklavu 1,2 g po osmi hodinách, jednorázově jsme aplikovali amikacin 1 g i. m. a zavedli permanentní močový katétr (PMK). V kultivaci moči jsme potvrdili infekci Escherichia coli rezistentní na chinolony a citlivou na podávaný Amoksiklav. Na celkem deset dní dlouhé terapii symptomy odezněly a bylo možné PMK extrahovat.
KAZUISTIKA 2
Před dvěma lety podstoupil 68letý pacient s kompenzovanou hypertenzí standardní BP s odběrem deseti vzorků a negativním nálezem. Při hodnotě PSA 7,29 ng/ml jsme provedli FBP, z jedné léze dle mpMR (PI-RADS 3, tranzitorní zóna vpravo ve střední části prostaty) jsme odebrali tři vzorky a dále deset vzorků z periferní zóny. Sonografický, per rektum i histologický nález byly negativní. Pacient užíval jako profylaxi kotrimoxazol ve výše popsaném režimu. Čtvrtý den po vyšetření přichází pro makroskopickou hematurii a febrilie až 38,5 °C. V rektálním stěru jsme zachytili Escherichia coli s produkcí širokospektré betalaktamázy, Leuconostoc lactis a Klebsiella pneumoniae ESBL. Rezistenci na podaný kotrimoxazol vykázala Klebsiella pneumoniae, proto byl pacientovi předepsán ciprofloxacin v dávce 500 mg p. o. po 12 hodinách celkem na deset dní. Kultivace moči nezjistila signifikantní infekci. V den vyšetření byl pacient afebrilní, rektální vyšetření v normě a hematurie minimální. Hospitalizaci jsme neindikovali, na zvolené medikaci došlo do dvou dnů k ústupu obtíží.
KAZUISTIKA 3
Interně zdravý 71letý muž s hyperplazií prostaty byl odeslán k FBP pro elevaci PSA na 10,8 ng/ml po předchozí negativní primobiopsii. Na mpMR jsme popsali jedno ložisko PI-RADS 5 o velikosti 17 mm v anteriorní zóně prostaty. Per rektum nález byl v normě, naopak sonograficky bylo patrné ložisko v obou lalocích prostaty. Odebrali jsme celkem 13 vzorků v ATB krytí kotrimoxazolem ve výše popsaném režimu. Všechny tři cílené vzorky zachytily signifikantní karcinom prostaty (Gleason grade group 3). V rektálním stěru jsme zjistili Escherichia coli ESBL-, rezistentní na kotrimoxazol a dále citlivé kmeny Enterobacter cloacae a Morganella morganii. Den po biopsii byl pacient akutně vyšetřen pro několik hodin trvající febrilie až 40 °C, na ambulanci udával, že zaměnil léky a předepsaná antibiotika již po biopsii neužil. Indikovali jsme hospitalizaci a nasadili ATB terapii: nejprve empiricky amoksiklav 1,2 g i. v. po osmi hodinách a gentamicin 320 mg i. v. 1x denně. Dle kultivace moče s nálezem Escherichia coli rezistentní na podávaný amoksiklav jsme změnili terapii na ertapenem 1 g i. v. po 24 hodinách celkem na pět dní. Léčba měla dobrý efekt, po hospitalizaci pacient ještě užíval dle konzultace ATB centra deset dní nitrofurantoin 100 mg p. o. každých osm hodin.
DISKUZE
Přestože existují jasná doporučení EAU ohledně ATB profylaxe při BP, v praxi se názory na ni výrazně liší. Často totiž závisí na zkušenosti a zvyklostech jednotlivých pracovišť. Zdroje uvádějí, že až 50 % urologů nerespektuje evropská doporučení stran ATB profylaxe u běžných výkonů, například schématu antibiotické profylaxe u transuretrální resekce prostaty (11). Obecně je preferována perorální profylaxe, ideálně v jednodenním režimu, který se zdá být srovnatelný s tří a vícedenním podáním. Specifickou skupinu představují pacienti rizikovější pro vznik komplikací, např. s imunodeficitem či arteficiální srdeční chlopní. Postupně se zvyšující výskyt rezistence na běžně užívaný kotrimoxazol a ciprofloxacin je spojován s nárůstem závažných postbioptických infekcí (3).
Podle dat norského registru je zvýšený výskyt rezistence na oba tyto preparáty spojen se zvýšením 30denní mortality po BP (12). Mezi rizikové faktory vzniku rezistence řadíme předchozí biopsie, přítomnost PMK nebo uroinfekci a užívání antibiotik v předchozích šesti měsících. Dle doporučení EMA z roku 2019 byly pozměněny indikace k terapii chinolony vzhledem k závažným nežádoucím účinkům (5). Na našem pracovišti nyní ve shodě s tímto doporučením využíváme k profylaxi kotrimoxazol ve výše zmíněném režimu. Ciprofloxacin indikujeme pak pouze u alergiků, či při jiné závažné kontraindikaci kotrimoxazolu. Abychom minimalizovali riziko, které souvisí s polyrezistentní rektální florou, je možné před BP provést stěr z rekta a ATB profylaxi upravit podle výsledku kultivace (1).
Mezi nejzávažnější komplikace po BP řadíme výskyt sepse, se kterou se můžeme setkat přibližně v 1 % případů, jak jsme ukázali i na třech kazuistikách z našeho pracoviště. Po sérii několika septických komplikací vzniklých po nově zavedené metodě FBP v roce 2018 jsme na našem pracovišti přistoupili ke kontrole kultivačních nálezů rektální flóry. Mimo statistické účely nám napomáhá k časné cílené léčbě případné sepse. Domníváme se rovněž, že při déle trvajícím vyšetření rektální sondou, které je při FBP nutné pro fúzi mpMR a sonografického obrazu, dochází k větší traumatizaci sliznice než při standardní BP. Další rizikový faktor představuje nejspíše také odběr většího počtu vzorků a jejich lokalizace, často v lézích uložených hluboko v prostatě. S výše doporučovanou dezinfekcí rekta jodovaným povidonem nemáme na našem pracovišti zkušenost.
Alternativou, se kterou se již setkáváme na tuzemských pracovištích (9), je transperineální BP. Jiný přístup v odběru vzorků totiž eliminuje riziko přenosu bakterií rektální flóry do prostatické tkáně, a tak snižuje pravděpodobnost septických komplikací. Při této formě biopsie můžeme podat i. v. cefazolin v jedné dávce (7, 8). Dle systematického přehledu z roku 2017 (13) nebyl nalezen signifikantní rozdíl počtu infekcí mezi transrektální a transperineální BP. Novější metaanalýza sedmi srovnávacích studií však ukázala poloviční riziko u pacientů po transperineální BP (14).
Cílená ATB léčba na základě kultivace stěru z rekta před BP, případně upravená podle výsledků kultivace moče po biopsii, obvykle vede k rychlému uzdravení pacientů, jak jsme ukázali na kazuistikách.
U skandinávské populace se zvýšila rezistence Escherichia coli v moči na kotrimoxazol z 35 % na více než 60 % mezi lety 2013 a 2015. U ciprofloxacinu pak ve stejném období z 15 % na 45 % (12). Antibiotické centrum Ústavu lékařské biochemie a laboratorní diagnostiky VFN pravidelně sleduje změny ATB profilů patogenů na jednotlivých klinikách. Na našem pracovišti se v letech 2017–2020 rezistence Escherichia coli k aminopenicilinům pohybovala mezi 25–30 %, zatímco např. u fosfomycinu nedosáhla ani 5 %. U chinolonů byla rezistence hlášena v 15–25 %, ale v druhé polovině roku 2020 již klesla k 7 %.
Naopak u Klebsiella pneumoniae dosahuje rezistence na fosfomycin dlouhodobě až 75 %. Ze zvlášť sledovaných ATB je rezistence na florochinolony hlášena téměř u 40 %. Podobně jako u Escherichia coli se rezistence významně snížila až v druhé polovině roku 2020, data nepublikována.
ZÁVĚR
Naše výsledky ukazují obdobný výskyt patogenů rezistentních na obě běžně užívaná antibiotika. I přes relativně vysoký výskyt rezistence zůstává počet klinických komplikací relativně nízký. Vzhledem k postupnému růstu rezistencí se do popředí dostává technicky náročnější biopsie transperineální, při které je riziko infekce střevními patogeny minimální.
Došlo: 10. 3. 2021
Přijato: 22. 4. 2021
Kontaktní adresa:
MUDr. Jakub Řezáč
Urologická klinika VFN a 1. LF UK
Ke Karlovu 6, 120 00 Praha 2
e-mail: jakub.rezac@vfn.cz
Prohlášení o podpoře: Práce byla podpořena
projektem MZ ČR RVO–VFN64165.
Střet zájmů: Žádný.
Sources
1. EAU Guidelines Prostate Cancer [cit. 27.2.2021]. Dostupné z: https://uroweb.org/guideline/prostate-cancer.
2. Kandil H, Cramp E, Vaghela T. Trends in Antibiotic Resistance in Urologic Practice. Eur Urol Focus 2016; 2 : 363–373.
3. Cai T, De Nunzio C, Andrea Salonia A, et al. Urological infections due to multidrug-resistant bacteria: what we need to know? Urologia 2016; 83(1): 21–26.
4. Elshal AM, Atwa AM, El-Nahas AR, et al. Chemoprophylaxis during transrectal prostate needle biopsy: critical analysis through randomized clinical trial. World J Urol 2018; 36(11): 1845–1852.
5. European Medicines Agency [cit. 27.2.2021]. Dostupné z: https://www.ema.europa.eu/en/medicines/ human/referrals/quinolone-fluoroquinolone-containing-medicinal-products.
6. Roberts MJ, Bennett HY, Harris PN, et al. Prostate Biopsy-related Infection: A Systematic Review of Risk Factors, Prevention Strategies, and Management Approaches. Urology 2017; 104 : 11–21.
7. Pepe P, Aragona F. Morbidity after transperineal prostate biopsy in 3000 patients undergoing 12 vs 18 vs more than 24 needle cores. Urology 2013; 81(6): 1142–1146.
8. Pepdjonovic L, Tan GH, Huang S, et al. Zero hospital admissions for infection after 577 transperineal prostate biopsies using single-dose cephazolin prophylaxis. World J Urol 2017; 35(8): 1199–1203.
9. Ryšánková K, Hanzlíková P, Vrtková A, Albínová T, Krhut J. Transperineálně prováděné fúzní US/MRI navigované biopsie prostaty. Ces Urol 2021; 25(1): 17–26.
10. Pernický J, Tupý R, Cibulková J, Ferda J. Změny v hodnocení nálezů v prostatě pomocí klasifikace PI-RADS 2.1. Ces Radiol 2020; 74(1): 47–54.
11. Köves B, Tenke P, Tandogdu Z, et al. Transurethral resection of the prostate: are we following the guidelines? Outcomes from the global prevalence of infections in urology (GPIU) study. J Chemotherapy 2019; 31(1): 15–22.
12. Johansen TEB, Zahl PH, Baco E, et al. Antibiotic resistance, hospitalizations, and mortality related to prostate biopsy: first report from the Norwegian Patient Registry. World J Urol 2020; 38(1): 17–26.
13. Xue J, Qin Z, Cai H, et al. Comparison between transrectal and transperineal prostate biopsy for detection of prostate cancer: a meta-analysis and trial sequential analysis. Oncotarget 2017; 4; 8(14): 23322–23336.
14. Xiang J, Yan H, Li J, et al. Transperineal versus transrectal prostate biopsy in the diagnosis of prostate cancer: a systematic review and meta-analysis. World J Surg Oncol 2019; 17(1): 31.
Labels
Paediatric urologist Nephrology UrologyArticle was published in
Czech Urology
2021 Issue 2
-
All articles in this issue
- EDITORIAL
- Inferior vena cava lesion as a complication of laparoscopic radical nephroureterectomy with retroperitoneal lymphadenectomy
- Transperineal prostate biopsy in the diagnosis of prostate cancer
- Antibiotic prophylaxis in multiparametric magnetic resonance imaging-guided transrectal prostate biopsy
- Ultrasound versus fluoroscopic localisation during extracorporeal shockwave lithotripsy
- Laparoscopic partial nephrectomy of solitary kidneys
- Posterior urethral valve with late manifestation in a 14-year-old boy
- Posterior pubic symphyseal protuberance as an obstacle to radical prostatectomy
- Rare case of acquired herniation of the kidney in the chest
- Bilateral inguinal hernia solved with mash during extraperitoneal robot assisted radical prostatectomy
- Životné jubileum prof. MUDr. Jána Klimenta, CSc.
- Jubileum profesora Tomáše Hanuše
- Profesor Babjuk slaví šedesátiny
- Ohlédnutí za JEUS 2021
- Czech Urology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Transperineal prostate biopsy in the diagnosis of prostate cancer
- Antibiotic prophylaxis in multiparametric magnetic resonance imaging-guided transrectal prostate biopsy
- Posterior urethral valve with late manifestation in a 14-year-old boy
- Laparoscopic partial nephrectomy of solitary kidneys
