Transperineální biopsie v diagnostice karcinomu prostaty
Transperineal prostate biopsy in the diagnosis of prostate cancer
Stejskal J, Hanáček V, Adamcová V, Zachoval R. Transperineal prostate biopsy in the diagnosis of prostate cancer.
Despite advances in imaging methods and the use of novel biomarkers, prostate biopsy still plays a vital part in prostate cancer diagnostics. Along with the widespread use of MRI/TRUS fusion guided biopsies we are recently witnessing a resurgence of transperineal approach in prostate biopsy.
Transperineal prostate biopsy (TPBxP) offers to avoid infectious complications by omitting the transrectal approach. Furthermore, TPBxP offers to improve the detection rate in the, sometimes undersampled, anterior part of the gland in patients after previous negative transrectal biopsies or with anterior prostate lesions visible on MRI.
As TPBxP is not yet widely used in clinical practice, in this text we aim to offer a review of literature concerning TPBxP available in the PubMed database.
According to the available data, TPBxP is easy to perform under general or local anaesthesia and is well tolerated by patients. Detection rate of prostate cancer is similar to that of the transrectal approach, except in the anterior parts of the prostate where TPBxP detects more cancer. TPBxP also seems to have less infectious complications and cases of rectal bleeding after biopsy. The incidence of other prostate biopsy complications is similar between transrectal and transperineal approach.
Keywords:
transperineal prostate biopsy – prostate biopsy under local anaesthesia – prostate biopsy complications – prostate cancer – clinically significant prostate cancer
Authors:
Jiří Stejskal; Vítězslav Hanáček; Vanda Adamcová; Roman Zachoval
Authors‘ workplace:
Urologická klinika 3. lékařské fakulty a Fakultní Thomayerovy nemocnice v Praze
Published in:
Ces Urol 2021; 25(2): 94-105
Category:
Review article
Overview
Stejskal J, Hanáček V, Adamcová V, Zachoval R. Transperineální biopsie v diagnostice karcinomu prostaty.
Přes pokroky ve využití nových biomarkerů a zobrazovacích technikách hraje biopsie v diagnostice karcinomu prostaty (PCa) stále stěžejní úlohu. V poslední době jsme, kromě stále většího využití MRI/TRUS navigace odběru vzorků, svědky i tendence návratu k transperineálnímu přístupu při biopsii prostaty.
Transperineální biopsie prostaty (TPBxP) slibuje vyhnout se komplikacím spojeným s transrektálním odběrem vzorků, zejména riziku infekce. Dále TPBxP nabízí lepší přístup k anteriorním částem prostaty, což je výhodné pro zde uložená ložiska popsaná na MRI či u pacientů po předchozích opakovaných transrektálních biopsiích, u kterých dosud převažoval odběr z dorzální části prostaty, která je při transrektální biopsii (TRBxP) přístupnější.
Jelikož se jedná o dosud málo prováděný zákrok, nabízíme v následujícím textu přehled literatury pojednávající o TPBxP dostupné v databázi PubMed.
Dle nalezené literatury je TPBxP metodou, která je dobře proveditelná v celkové i lokální anestezii a je pacienty dobře tolerována. Záchyt karcinomu prostaty je srovnatelný s transrektální biopsií, TPBxP nicméně dosahuje vyššího záchytu karcinomu v anteriorní části prostaty. Po TPBxP dochází dle mnohých analýz k nižšímu výskytu infekčních komplikací a krvácení z rekta, výskyt ostatních komplikací je obdobný jako u transrektální biopsie prostaty.
Klíčová slova:
transperineální biopsie prostaty – lokální anestezie při biopsii prostaty – komplikace biopsie prostaty – karcinom prostaty – klinicky signifikantní karcinom prostaty
ÚVOD
První biopsie prostaty byly prováděny začátkem 20. století a jako první byl, kvůli anatomické přístupnosti prostaty bez nutnosti porušit sliznici rekta, využíván transperineální přístup, při kterém byla excidována tkáň prostaty. Tento postup byl později z většiny nahrazen punkční biopsií prostaty, neboť tato je méně invazivní. Využíván byl transrektální přístup s vedením jehly po prstu zavedeném v konečníku. V kombinaci s ultrazvukovou navigací se potom transrektální biopsie prostaty (TRBxP) stala standardem odběru bioptických vzorků (1). Poslední výraznou změnou v technice odběru biopsií bylo využití magnetické rezonance (MRI) prostaty k indikaci a navádění biopsií (2), tato takzvaná cílená biopsie se v posledních letech stala součástí doporučených postupů Evropské urologické asociace (3).
Přes mnoho úprav v metodice odběru vzorků a přípravy pacienta je biopsie prostaty stále zatížena rizikem infekčních komplikací, včetně život ohrožujících septických stavů (3, 4) a nízkým záchytem karcinomu prostaty jak u prvních (30–50 %), tak i v případě opakovaných (10–35 %) či saturačních (13–46 %) biopsií (5, 6, 7). Rizika infekčních komplikací a nízký záchyt karcinomu prostaty jsou příčinou současného trendu návratu k transperineálním biopsiím prostaty (TPBxP), která slibuje jak snížení rizika infekčních komplikací sterilním prováděním biopsií, tak vyšší záchyt klinicky signifikantního karcinomu prostaty (csPCa) v anteriorní části prostaty, která je transrektálně (zejména u větších prostat) špatně dosažitelná.
V následujícím článku pojednáváme o indikacích, provedení, výsledcích a komplikacích TPBxP na základě dat publikovaných v posledních deseti letech. Databázi PubMed jsme prohledali pomocí fráze „transperineal“ + „prostate“ + „biopsy“. Z nalezených 644 výsledků v anglickém jazyce (v databázi jsme nenalezli žádné české práce) jsme po postupném prohledání názvů, abstrakt a nakonec plných znění vybrali 45 relevantních publikací, z nichž vycházíme v následujícím textu. Do textu jsme zahrnuli i jedinou publikaci na téma TPBxP nalezenou v českém periodiku.
INDIKACE TRANSPERINEÁLNÍ BIOPSIE PROSTATY
Přesto, že TPBx prostaty nabírá na popularitě, není prováděna rutinně. Dostupná jsou data z Němec ka, kde TPBxP provádí pouze 1,6 % pracovišť (8). V České republice je dle povědomí autorů situace obdobná. Pro vyšší technickou náročnost byla TPBxP dosud často používána pouze jako alternativa TRBxP indikovaná u pacientů s vyšším rizikem infekce (9), či po negativních předchozích biopsiích, u kterých přetrvává podezření na přítomnost PCa. U těchto pacientů se lze domnívat, že anteriorní oblasti prostaty nebyly dostatečně biopticky zhodnoceny pro špatnou dosažitelnost z posteriorního přístupu. Toto riziko je markantní zejména u větších prostat, neboť obvyklá délka vzorku je u 18G jehel 17–22 mm a nad touto linií by bylo třeba odebrat vzorky ve dvou různých hloubkách.
V poslední době stále více pracovišť indikuje TPBxP i u prvních biopsií. Kromě narůstající resistence na ATB může být zvyšující riziko septických komplikací příčinou častější indikace TPBxP i rutinní použití MRI prostaty vedoucí k identifikaci anteriorně uložených ložisek, pro která jsou TPBxP přístupnější (10, 11, 12, 13). Indikace TPBxP zatím ale nejsou v rámci doporučených postupů specifikovány (3) a jsou proto závislé na provádějícím pracovišti.
PŘÍPRAVA PACIENTA
TPBxP nevyžaduje speciální přípravu. Potřebná je pouze příprava k eventuální celkové anestezii a jako u každého invazivního zákroku je vhodná kontrola koagulačních parametrů a případná úprava antitrombotické medikace. Význam kontrolní kultivace moči před biopsií prostaty stále není objasněn (14) a v recentním německém průzkumu ji provádí pouze cca polovina lékařů (8). Studie hodnotící přínos kultivace moči specificky pro TPBxP nejsou k disposici, lze však očekávat obdobný efekt jako u TRBxP. TPBxP je prováděna sterilně, proto hraje antibiotická profylaxe menší úlohu než u TRBxP. Dle doporučení EAU stačí jedna dávka cefalosporinu (3, 10, 15). Na některých pracovištích jsou ale podávány fluorochinolony, jinak obvykle užívané před TRBxP (8, 16, 17, 18).
PROVEDENÍ TRANSPERINEÁLNÍ BIOPSIE PROSTATY
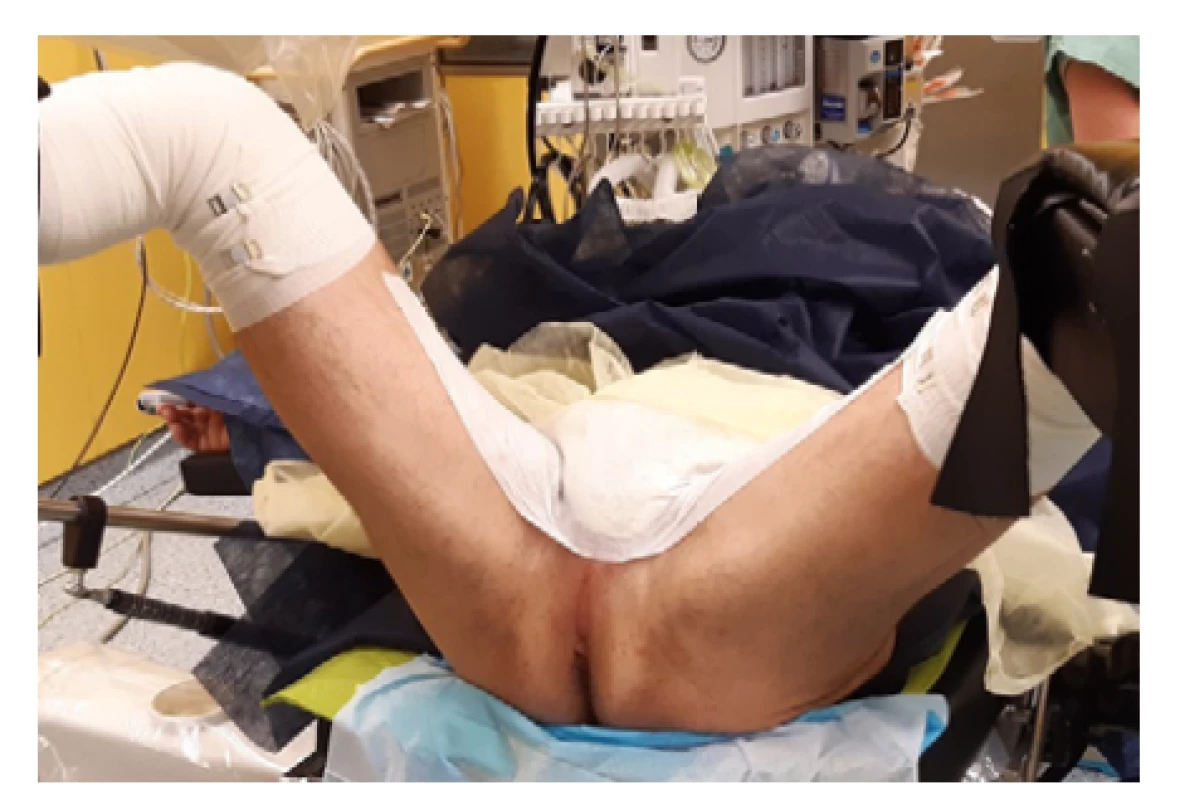
Principem transperineální biopsie prostaty je odběr punkčních vzorků prostaty skrze kůži v oblasti hráze. Pacient je v litotomické poloze, kůže perinea je oholena a dezinfikována. Skrotum je odsunuto kraniálně, aby byla oblast perinea lépe přístupná a nehrozilo poranění varlat, která mohou být v podkoží pohyblivá až k perineu (Obr. 1).
Fig. 1. Patient position during TPBxP (author’s archive)
Do konečníku pacienta zavádíme ultrazvukovou sondu k sonografické kontrole a cílení odběru vzorků. Obvykle využíváme obrazu v sagitální rovině (Obr. 2), či biplanární zobrazení prostaty v sagitální a transverzální rovině zároveň, umožňuje - li to vybavení. Ultrazvuková sonda je fixována v pohyblivém rameni stepperu (Obr. 3 a 4), nebo ji drží vyšetřující urolog v ruce a ovládá ji přímo, což je označováno pojmem freehand technika.
Fig. 2. Sagital view of the prostate during TRUS
(author’s archive)
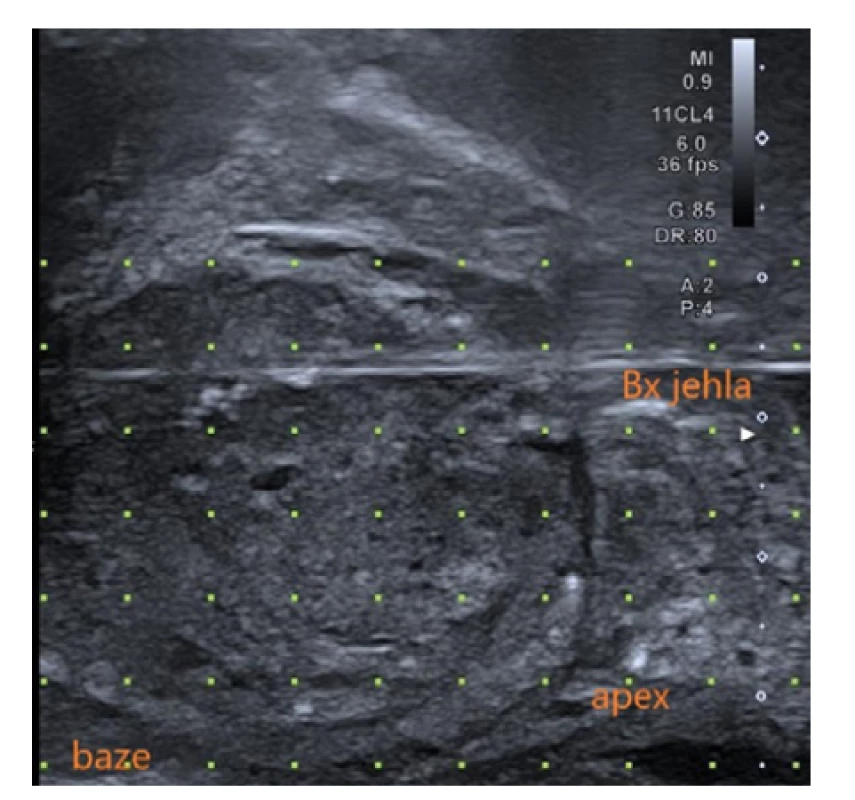
Fig. 3. Stepper arm with an attached transrectal
ultrasound probe (author’s archive)

Fig. 4. Usage of stepper arm during transperineal
prostaty biopsy (https://radiologykey.com/template-
-mapping-biopsies-an-overview-of-technique-and-
-results)
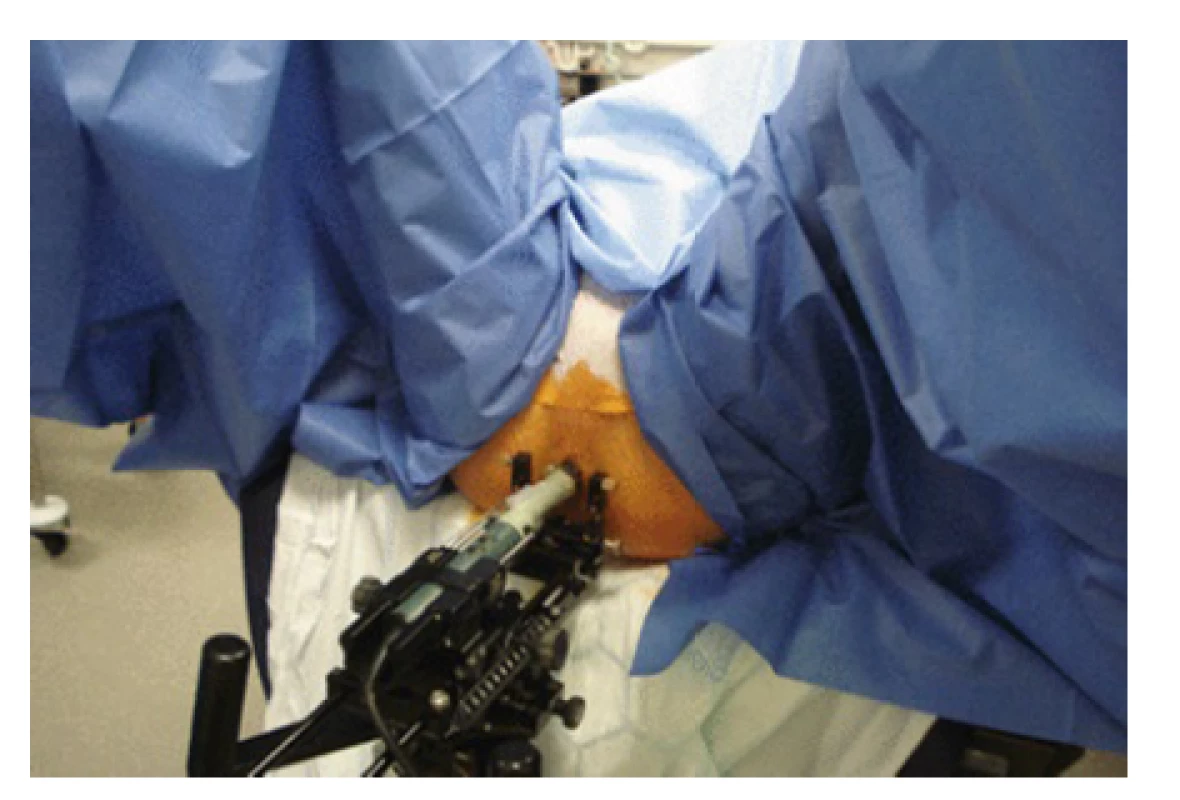
Stepper je zařízení, jehož hlavní částí je pohyblivé rameno, které lze fixovat k operačnímu stolu, či je součástí ultrazvukového přístroje. Na konci tohoto ramene je upevněna ultrazvuková sonda, jejíž pohyb ve všech osách je pomocí stepperu ovládán. Sonda je tak velmi stabilní a není třeba ji po dobu vyšetření držet v ruce. Lékař se tak může lépe věnovat navigaci a samotnému oděru vzorků. Vyšetření je proto z hlediska vyšetřujícího jednodušší a vyžaduje méně zkušeností. Nevýhodou využití stepperu jsou vyšší pořizovací náklady. Stepper musí být kompatibilní jak s ultrazvukovou sondou, tak se stolem či ultrazvukovým přístrojem, což může limitovat jeho využití. V případě potřeby použití s více ultrazvukovými přístroji či stoly je mezi vyšetřeními třeba stepper vždy odinstalovat a uskladnit či transportovat. Instalace a dezinfekce stepperu společně s nutností fixace ultrazvukové sondy dále bioptický zákrok prodlužuje.
Limitace stepperu může eliminovat freehand technika, která v poslední době nabírá na popularitě. Při této technice není ultrazvuková sonda fixována ve stepperu a vyšetřující ji ovládá rukou. Odpadá tedy jakákoli manipulace a péče o nákladné rameno stepperu. Vyšetření lze provést pouze s použitím ultrazvukového přístroje, vodiče jehly a bioptické pistole. Tímto je freehand technika flexibilní na použití a oproti stepperu výrazně levnější. Nevýhodou freehand techniky je potřeba po celou dobu vyšetření držet ultrazvukovou sondu v ruce. Sonda je navíc méně stabilní, což může komplikovat navigaci, zejména při oděru MRI/TRUS fúzí cílených vzorků. Biopsie freehand technikou je tedy náročnější na vyšetřujícího kvůli snížené stabilitě obrazu a nutnosti obsluhovat ultrazvuk (ukládat snímky, synchronizovat obraz fúze atd.) a odebírat biopsie jednou rukou.
Bioptická jehla je v případě použití stepperu i freehand techniky naváděna pomocí bioptické mřížky či navigačního nástavce s otvory v jedné vertikální linii. Laterální posun je potom prováděn rotací sondy s tímto nástavcem podél její dlouhé osy (Obr. 5). Některé systémy využívají takzvanou koaxiální techniku, při které jehla prochází zavaděčem, který umožnuje měnit úhel vpichu jehly do prostaty a biopsii lze potom provést z jednoho kožního vstupu s rozmístěním vzorků vějířovitě skrze celou prostatu (19–21). Použití koaxiálního přístupu může snižovat bolestivost zákroku, signifikantní rozdíl v komplikacích však prokázán nebyl (20).
Fig. 5. Transperineal prostate biopsy using the freehand
technique and a vertical needle guide (author’s
archive)
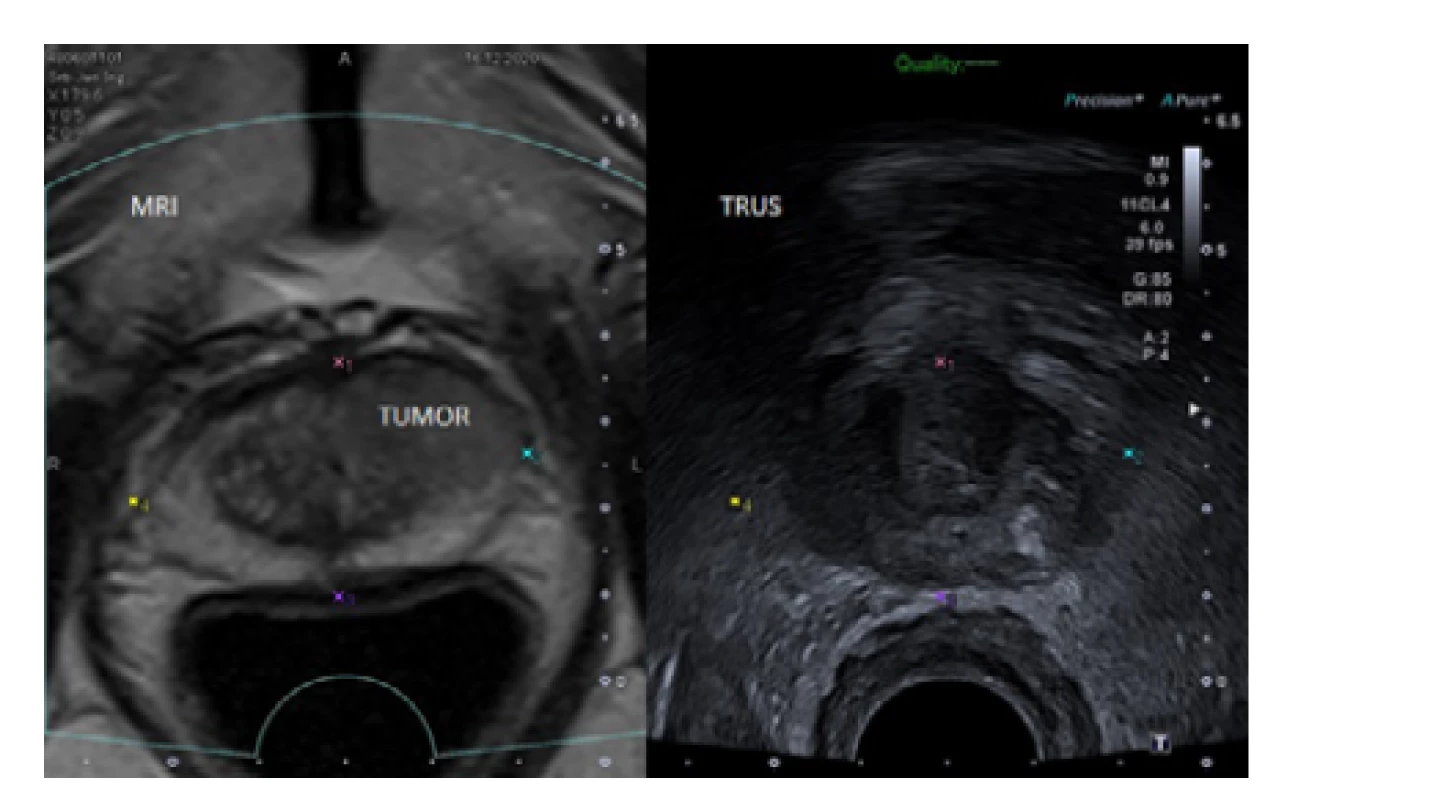
Stejně jako u TRBxP, je při standardní biopsii odebíráno 10–12 systematických vzorků a při saturační biopsii 20 a více vzorků (3). Běžnou součástí diagnostiky PCa je nyní i MRI/TRUS fúzí cílená biopsie prostaty (3). Tuto lze při TPBxP velmi dobře provádět pomocí stepperu i freehand techniky, a to jak s využitím kognitivního, tak i softwarového (2) navádění (Obr. 6). Publikace se často liší v počtu odebíraných MRI/TRUS fúzí cílených vzorků, jako dostatečné je obecně hodnoceno odebrání 2–4 cílených vzorků na každé ložisko (3, 22, 23).
Fig. 6. MRI/TRUS fusion images of the prostate with
a PIRADS 5 lesion in the anterior part of the left lobe
sutable for TPBxP (author’s archive)
LOKÁLNÍ ANESTEZIE PŘI TRANSPERINEÁLNÍ BIOPSII PROSTATY
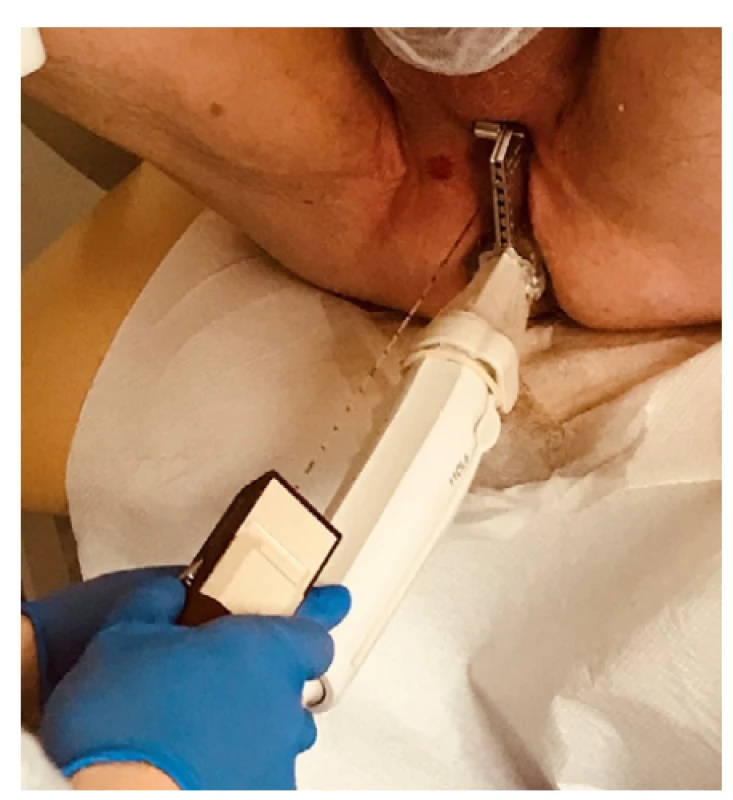
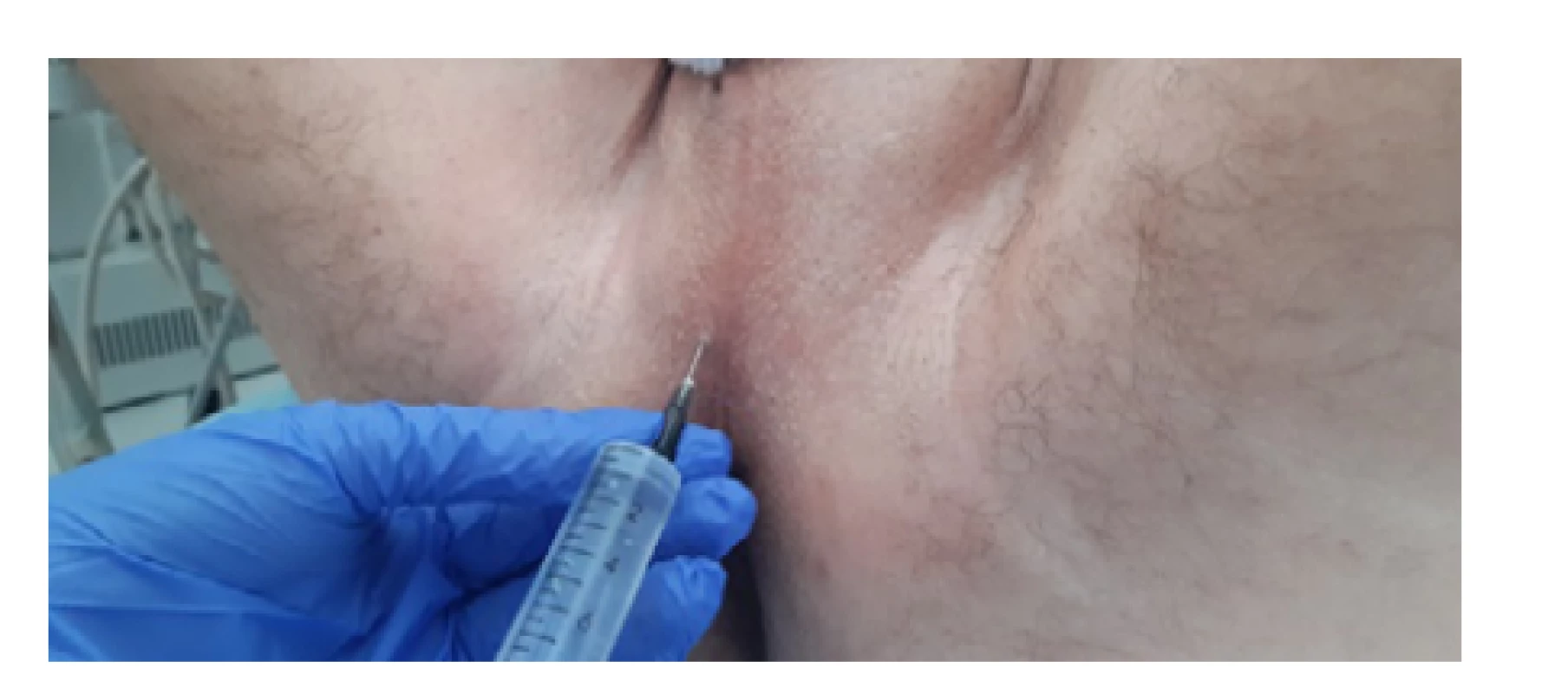
TPBxP byla dříve obvykle prováděna v celkové anestezii, postupně však přibývá pracovišť, kde je zákrok prováděn v lokální anestezii (10, 24, 25). Při této je třeba zajistit nejprve anestezii kůže a podkoží oblasti hráze a následně anestezii vlastní prostaty. Používaná jsou obvyklá lokální anestetika, jako je mesocain, lidocain či bupivacain. Infiltrace podkoží oblasti hráze je provedena postupnou subkutánní aplikací anestetika v potřebném rozsahu jako při jiné lokální anestezii kůže (Obr. 7). Při anestezii vlastní prostaty anestetikum aplikujeme zpravidla bilaterálně k oblasti apexu, který je při TPBx nejlépe přístupný a zároveň nejvíce citlivý (16), nebo oblasti odstupu semenných váčků. Alternativou může být provedení pudendálního bloku místo lokální infiltrace oblasti hráze. Tato technika je náročnější na provedení, ale dle práce z roku 2010 zároveň efektivnější ve snížení bolestivosti vyšetření (16). Kromě lokální anestezie lze paralelně použít i perorální či intravenózní nesteroidní antirevmatikum. Úzkostlivější pacienty, kteří mohou vnímat bolest silněji (17), je dále možno premedikovat intramuskulárně podaným opiátem. Při ambulantním provedení biopsie to však vyžaduje delší následnou observaci pacienta a nutnost jej předem informo ‑ vat například o zákazu řízení automobilu 24 hodin po podání opiátů.
Fig. 7. Local anesthesia of the perineum (author’s
archive)
TPBxP v lokální anestezii pacienti obvykle dobře snáší (16, 21, 24). Práce, které hodnotí bolestivost lokální anestezie a vlastní biopsie zvlášť, udávají, že aplikace lokální anestezie je pacienty vnímána bolestivěji, než samotná biopsie (10, 25). Některé publikace udávají vyšší bolestivost TPBxP v porovnání s TRBxP (11, 26). Při indikaci TPBxP je proto vždy vhodné zvážit provedení výkonu v celkové anestezii, zejména u anxiózních pacientů, či při nižších zkušenostech vyšetřujících s aplikací lokální anestezie v oblasti hráze a prostaty.
VÝSLEDKY TRANSPERINEÁLNÍ BIOPSIE PROSTATY
Publikované práce na téma TPBxP se velmi liší metodikou, zejména z hlediska indikací k biopsii a použitého vybavení (stepperu, freehand techniky, mřížky či koaxiálního vodiče). Studie srovnávající dvě nebo více metod TPBxP proti sobě jsou vzácné, častější je srovnání TPBxP s TRBxP. Dle dostupné literatury nicméně nejsou v záchytu PCa či csPCa mezi freehand technikou a použitím stepperu signifikantní rozdíly (27). Vybavení použité k odběru vzorků při TPBxP tedy příliš neovlivňuje záchyt PCa a jeho volba je spíše závislá na preferencích a možnostech jednotlivých pracovišť. Obecně je TPBxP hodnocena jako dobře proveditelná v celkové i lokální anestezii s délkou zákroku mezi 10 a 20 minutami (10, 25). Vzhledem k heterogenitě publikovaných studií zabývajících se TPBxP jsou k posouzení jejího přínosu vhodné zejména metaanalýzy, které minimalizují vliv rozdílné metodiky jednotlivých studií.
VÝSLEDKY SYSTEMATICKÉ TRANSPERINEÁLNÍ BIOPSIE PROSTATY
Z prací, hodnotících záchyt PCa csPCa při TPBxP, uvádíme například větší studii z roku 2019, ve které Stefanova a kolektiv (10) analyzovali rozsáhlý soubor 1 287 pacientů, kteří podstoupili TPBxP v lokální anestezii mezi lety 2016 a 2018. Odebíráno bylo minimálně deset vzorků na pacienta, byla použita freehand technika. Autoři neuvádějí, zda-li se jedná o první či opakované biopsie. PCa byl zachycen u 49,8 % pacientů, csPCa u 29,93 %. Důležitý údaj je, že u 52,7 % pacientů s PCa se tento mimo jiné vyskytoval i v anteriorní části prostaty, u 9,7 % pacientů byl potom karcinom zjištěn pouze v anteriorní části prostaty.
Záchyt PCa pomocí TPBxP v případě prvních biopsií potom nabízí multicentrická studie hodnotící celkem 402 pacientů podstupující první biopsii prostaty v celkové či lokální anestezii z roku 2016. PCa byl zachycen u 61 % pacientů, csPCa potom u 47 % (9). Vyas a kolektiv udávají při primobiopsii záchyt PCa 54 %, z toho 9,6 % pouze v anteriorní části prostaty. U pacientů po předchozí negativní biopsii potom ve stejné studii TPBxP zachytila PCa v 36 %, z toho 17 % pouze v anterioní části prostaty (18).
SROVNÁNÍ TRANSPERINEÁLNÍ A TRANSREKTÁLNÍ SYSTEMATICKÉ BIOPSIE
TPBxP tedy nabízí celkem vysoký záchyt PCa i csPCa, k posouzení jejího přínosu stran diagnostiky PCa je ale potřeba její výsledky srovnat s TRBxP, jako dosud standardní metodou odběru vzorků prostaty. Takovéto srovnání nabízí například Abdollah a kolektiv v analýze saturačních (vždy 24 vzorků) TPBxP a TRBxP na souboru 472 pacientů po předchozí negativní biopsii prostaty. Záchyt karcinomu prostaty byl 31,4 % při TRBxP a 25,7 % při TPBxP. Rozdíl ale nebyl statisticky signifikantní (28). Stejný záchyt PCa pomocí TPBxP a TRBxP popisuje i studie Di Franca a kolektivu, TPBxP nicméně v jejich souboru zachytila o něco více nádorů u pacientů podstupujících první biopsii (29). Ve dvou studiích hodnotících shodu TPBxP a TRBxP s preparátem radikální prostatektomie dosahují obě metody též srovnatelných výsledků (30, 31).
V roce 2011 provedl Shen a kolektiv (32) metaanalýzu studií popisujících výsledky TPBxP a TRBxP. Celkem bylo hodnoceno sedm studií. Separovaně byly hodnoceny sextantové biopsie (2 studie, 509 pacientů), rozšířené biopsie (4 studie, 1 429 pacientů) a jedna studie porovnávající saturační biopsie (280 pacientů). Statisticky signifikantních rozdílů v záchytu karcinomu prostaty mezi TPBxP a TRBxP nebylo dosaženo v žádné ze skupin. Rozdíly nebyly nalezeny ani v zaznamenaných komplikacích. V metaanalýze z roku 2013 hodnotil Nelson a kolektiv záchyt karcinomu prostaty u pacientů po předchozí negativní biopsii. Hodnoceny byly separovaně transperineální, transrektální a fúzní biopsie (bez ohledu na přístup a metodu fúze). Záchyt PCa byl pro systematickou transperineální biopsii 36,8 %, pro systematickou transrektální 30,0 % a pro fúzní biopsii 37,6 %. Rozdíl v záchytu PCa (včetně csPCa) mezi metodami nebyl statisticky signifikantní (33). Novější metaanalýza z roku 2019 nabízí hodnocení celkem 11 studií (11). Celkem bylo hodnoceno 2 569 pacientů, kteří podstoupili TPBxP či TRBxP. Záchyt PCa při použití obou bioptických metod byl v této
metaanalýze srovnatelný. TPBxP vykazovala nižší riziko febrilií (RR 0,26) a krvácení z rekta (RR 0,02), byla však dle hodnocení pacientů bolestivější.
VÝSLEDKY FÚZNÍ TRANSPERINEÁLNÍ BIOPSIE PROSTATY
Nedílnou součástí diagnostiky PCa je v poslední době MRI/TRUS fúzí cílená biopsie prostaty, která je transperineálně dobře proveditelná. Porovnání fúzní a systematické TPBxP potom nabízí například Zhang a kolektiv, kteří hodnotili záchyt karcinomu prostaty při MRI/TRUS fúzí cílené TPBxP versus systematické TPBxP provedené u stejného pacienta (34). U všech 224 pacientů byla použita freehand technika. Cílená TPBxP zachytila signifikantně více PCa (42,2 % vs. 34,8 %) i csPCa (33,5 % vs. 21,9 %) než systematická biopsie. V roce 2020 publikoval výsledky MRI/TRUS fúzní TPBxP v lokální anestezii Marra a kolektiv (25). Ve skupině 459 pacientů bylo provedeno 279 fúzních (4 vzorky na ložisko) + systematických TPBxP, a 180 pouze systematických (12vzorků) TPBxP. Ve skupině fúzní + systematické biopsie byl csPCa zachycen u 53,8 % pacientů, u pouze systematické biopsie potom u 45 %. Ve prospěch fúzní TPBxP svědčí i podobná multicentrická studie z roku 2020 hodnotící 640 pacientů, kteří podstoupili první, či opakovanou biopsii. TPBxP vykazovala vyšší záchyt csPCa a nižší záchyt klinicky nesignifikantního karcinomu prostaty (nsPCa) (35).
V recentně publikované české práci (26) byl hodnocen soubor 208 pacientů, kteří podstoupili fúzní a systematickou TPBxP. Záchyt karcinomu prostaty byl v případě prvních biopsií 52,9 % (17,6 % csPCa) a u opakovaných biopsií 53,6 % (15 % csPCa). U dvou pacientů se po zákroku objevily dysurické obtíže, bakteriální infekce ale prokázaná nebyla. Biopsie byly prováděny v lokální anestezii, dle autorů byla tato ale tolerována hůře než při obvyklých TRBxP.
V roce 2020 byla publikována práce s cílem stanovit vhodné množství vzorků odebíraných z každého ložiska při MRI/TRUS fúzní TPBxP. Celkem bylo hodnoceno 101 pacientů s celkem 161 MRI ložisky minimální hodnoty 3 dle systému PIRADS v2. Frekvence detekce csPCa pro 1, 2, 3 a 4 a více odebíraných fúzních vzorků na ložisko byla 27,3 %, 32,9 %, 37,3 % a 39,1 % respektive. Mezi záchytem csPCa při 3 a 4 čí více vzorcích na ložisko byl dle matematické analýzy minimální rozdíl. Odběr tří vzorků na ložisko byl proto při MRI/TRUS fúzí cílené TPBxP hodnocen jako dostačují (23).
Stejně jako fúzní TRBxP tedy fúzní TPBxP dosahuje vyššího záchytu csPCa než systematická biopsie prostaty, nejlepších výsledků je, stejně jako v případě TRBxP, dosaženo kombinací fúzní a systematické biopsie (23, 33, 34, 35, 36). Rozdíly v záchytu csPCa mezi systematickou a fúzní biopsií prostaty jsou markantní zejména ve vyšších PIRADS kategoriích (37, 38).
SROVNÁNÍ TRANSPERINEÁLNÍ A TRANSREKTÁLNÍ FÚZNÍ BIOPSIE
TPBxP se jeví jako diagnosticky efektivnější než TRBxP v metaanalýze zaměřené na MRI/TRUS fúzí cílené biopsie provedené Tu a kolektivem, ve které bylo hodnoceno 328 pacientů, kteří podstoupili fúzní TPBxP a 315 pacientů podstoupivších fúzní TRBxP. Záchyt csPCa byl lepší v případě TPBxP (62,2 %) než v případě TRBxP (41,3 %). Lepších výsledků dosahovala TPBxP zejména v případě anteriorně uložených ložisek (12). Na výsledky fúzní TPBxP a TRBxP byla zaměřena též metaanalýza z roku 2020. V souboru celkem 2 002 pacientů nebyly mezi TPBxP a TRBxP rozdíly v senzitivitě a specificitě, AUC křivky byly též bez signifikantních rozdílů (39). V novější, obdobně zaměřené, metaanalýze sedmi studií dosahovala fúzní TPBxP vyššího záchytu PCa než TRBxP, záchyt csPCa byl stejný s výjimkou anteriorní části prostaty, kde TPBxP zachytila více csPCa (13).
Studie i metaanalýzy se tedy shodují, že stejně jako v případě systematických biopsií, dosahuje fúzní TPBxP stejných výsledků jako fúzní TRBxP. Metodika fúze (kognitivní vs. softwarová) nemá dle recentní multicentrické studie na záchyt csPCa signifikantní vliv (40).
Kromě diagnostiky PCa je biopsie důležitá i v aktivním sledování již diagnostikovaných nsPCa. Při této docházelo v recentní studii při použití TPBxP k častějšímu upgradingu histologie než při TRBxP (OR 1,49), což může mít výrazný vliv na včasné zahájení kurativní léčby (41).
Z výše uvedeného vyplývá, že TPBxP má celkové stejný záchyt PCa a csPCa jako TRBxP v případě systematických (11, 32, 42, 43), i fúzních biopsií (12, 13, 25). Vyššího záchytu PCa potom TPBxP dosahuje v oblasti apexu a anteriorní části prostaty (10, 11, 12, 13, 41), což je vzhledem k její lepší dostupnosti z perineálního přístupu pochopitelné. V případě opakovaných biopsií potom může k vyššímu záchytu PCa anteriorně přispívat i fakt, že dorzální polovina prostaty byla již minimálně jednou bioptována a případné dosud nediagnostikované tumory budou s větší pravděpodobností aneriorně (18, 44).
KOMPLIKACE TRANSPERINEÁLNÍ BIOPSIE PROSTATY
Mezi komplikace punkční biopsie prostaty patří zejména krvácení (rektoragie, hematurie či hemospermie), infekce a močová retence (3, 4). Přesto, že krvácení a močová retence jsou pro pacienty nepříjemné, velmi zřídka představují skutečné ohrožení jejich života. Infekční komplikace mohou naproti tomu poměrně rychle vyústit v život ohrožující septický stav, a proto je snížení jejich výskytu jednou z hnacích sil úpravy metodiky biopsií prostaty. TPBxP slibuje snížit riziko infekčních komplikací vyhnutím se nesterilnímu prostředí rekta. Práce zabývající se komplikacemi TPBxP uvádíme níže.
Ve prospěch TPBxP hovoří multicentrické studie z roku 2014 (245 pacientů) (45), 2016 (402 pacientů) (9) a 2020 (1 008 pacientů) (17) s nulovým výskytem sepse po TPBxP. Velmi nízký počet septických stavů (0,03 %) po TPBxP uvádí též práce hodnotící přes 3 000 pacientů, kteří podstoupili biopsii prostaty v období deseti let (46). V práci z roku 2014 hodnotili Togo a kolektiv infekční komplikace po biopsii prostaty v rozsáhlém souboru 5 895 pacientů. Mezi TPBxP a TRBxP nebyl signifikantní rozdíl ve výskytu infekcí (0,57 % vs. 0,83 %), po TPBxP bylo ale zaznamenáno výrazně méně febrilních stavů (0,16 % vs. 0,71 %) (47). Dle britské národní studie (48) hodnotící více než 73 tisíc biopsií včetně 13 723 TPBxP, byla tato zatížena nižším rizikem sepse než TRBxP (1,0 % vs. 1,4 %), pacienti ale v porovnání s TRBxP trpěli častější močovou retencí (1,9 % vs. 1,0 %). Ve výskytu hematurie nebyly nalezeny rozdíly.
Signifikantní rozdíl ve výskytu septických komplikací mezi TRBxP a TPBxP nepotvrdila systematická analýza čtyř prací z roku 2017 (42). V metaanalýze z roku 2016 (49) byl sice popsán nižší výskyt sepse (0,8 % vs. 0,1 %) i nutnosti hospitalizace (1,1 % vs. 0,9 %) po TPBxP než po TRBxP, přes zjevný trend ale nebyly rozdíly statisticky signifikantní, dle autorů je toto způsobeno heterogenitou porovnávaných prací. V pozdější metaanalýze 11 studií z roku 2019 (11) Xiang a kolektiv popsali při TPBxP výrazné snížení rizika febrilií (RR 0.26) a rektálního krvácení (RR 0,02). Podobně v metaanalýze zaměřené na prevenci infekčních komplikací hodnotí Pradere a kolektiv transperineální přístup jako nejefektivnější ve snížení infekcí po biopsiích prostaty (50).
Dle některých autorů (4, 51, 52) je TPBxP zatížena vyšším rizikem močové retence. Jako možné příčiny jsou uváděny provedení TPBxP v celkové anestezii či častější odběr většího množství bioptických vzorků. Vyšší výskyt močové retence po TPBxP potom vyvracejí například práce Xiang et al., 2019 a Marra et al., 2020 (11, 25).
V práci z roku 2016 hodnotil Pepe a kolektiv vliv TPBxP na erekci v souboru 1 050 pacientů, kteří podstoupili rozšířenou (18 vzorků) a saturační (28 vzorků) a saturační + MRI cílenou (32 vzorků) TPBxP. Malá část pacientů (4,2 % u rozšířené, 6,4 % u saturační biopsie a 7 % u saturační a fúzní biopsie) udávala po biopsii lehkou erektilní dysfunkci, která do tří měsíců odezněla (53). Obdobné výsledky nabízí i analýza z roku 2019 (54).
Při stejném záchytu PCa jako při TRBxP spočívá hlavní přínos TPBxP ve snížení rizika infekčních komplikací biopsie prostaty, což je klíčové zejména pro polymorbidní či imunosuprimované pacienty. Výhodu může TPBxP představovat též u pacientů s chronickými zánětlivými onemocněními střeva jako například Crohnovou chorobou. Specifickou komplikací TPBxP může být hematom podkoží perinea, nejedná se však o závažnou komplikaci a v hodnocených studiích obvykle není zmiňována.
ZÁVĚR
Transperineální technika biopsie prostaty je známá již řadu let, po dlouhém období jednoznačné dominance transrektálního odběru biopsií prostaty nyní TPBxP zažívá pozvolný návrat mezi standardní vyšetření. Metoda je pacienty dobře tolerovaná v celkové i lokální anestezii, snižuje výskyt infekčních komplikací a zvyšuje záchyt karcinomu v anteriorní části prostaty. Výhodná je zejména u pacientů s vyšším rizikem infekcí, pacientů po předchozích negativních biopsiích či anteriorních lezích popsaných na MRI prostaty.
V tuto chvíli je nepravděpodobné, že by transperineální přístup zcela nahradil transrektální odběr biopsií, lze ale očekávat, že trend k jejímu častějšímu provádění bude následovat zprvu též málo zastoupenou fúzní biopsii prostaty a TPBxP se stane se běžnou součástí algoritmu diagnostiky karcinomu prostaty.
Došlo: 23. 3. 2021
Přijato: 21. 4. 2021
Kontaktní adresa:
MUDr. Jiří Stejskal
Urologická klinika 3. lékařské fakulty a Fakultní Thomayerovy nemocnice Vídeňská 800, 140 59 Praha 4
email: jiri.stejskal@ftn.cz
Prohlášení o podpoře: Autoři prohlašují, že zpracování tohoto článku nebylo podpořeno žádnou společností.
Střet zájmů: Žádný.
Hlavní stanovisko práce: Dle dostupné literatury dosahuje transperineální biopsie prostaty v porovnání s transrektálním přístupem vyššího záchytu karcinomu prostaty v anteriorní části prostaty a je zatížena nižším rizikem infekčních komplikací.
Major statement: According to the available literature, transperineal prostate biopsy offers higher cancer detection rate in the anterior parts of the prostate and carries a lower risk of infectious complications than the transrectal approach.
Sources
1. Yeo L, Patel D, Bach C, et al. The Development of the Modern Prostate Biopsy. In: Bissada NK, editor. Prostate Biopsy [Internet]. InTech; 2011 [cited 2018 Nov 2]. Available from: http://www.intechopen.com/ books/prostate-biopsy/the-development-of-the-modern-prostate-biopsy.
2. Stejskal J, Jaskova V, Pavlicko A, et al. Diagnostika karcinomu prostaty pomoci fúzní biopsie. Ces Urol 2018; 22(2): 87–98.
3. Mottet N, van den Bergh RCN, Briers E, et al. EAU-EANM-ESTRO-ESUR-SIOG Guidelines on Prostate Cancer – 2020 Update. Part 1: Screening, Diagnosis, and Local Treatment with Curative Intent. Eur Urol 2021; 79(2): 243–62.
4. Loeb S, Vellekoop A, Ahmed HU, et al. Systematic review of complications of prostate biopsy. Eur Urol 2013; 64(6): 876–892.
5. Záleský M, Stejskal J, Minárik I, et al. Porovnání detekce signifikantního a nesignifikantního karcinomu pomocí systematické a cílené fúzní MRI/TRUS biopsie prostaty. Ces Urol 2018; 22(2): 115–121.
6. Shariat SF, Roehrborn CG. Using biopsy to detect prostate cancer. Rev Urol 2008; 10(4): 262–280.
7. Čapoun O, Sobotka R, Macek P, Hanuš T. Predictive factors for prostate cancer detection using saturation prostate biopsy. Ces Urol 2012; 16(3): 163–170.
8. Boehm K, Siegel FP, Schneidewind L, et al. Antibiotic Prophylaxis in Prostate Biopsies: Contemporary Practice Patterns in Germany. Front Surg [Internet]. 2018 Jan 24 [cited 2021 Jan 23]; 5. Available from: https:// www.ncbi.nlm.nih.gov/pmc/articles/PMC5787537/.
9. Eldred-Evans D, Kasivisvanathan V, Khan F, et al. The Use of Transperineal Sector Biopsy as A First-Line Biopsy Strategy: A Multi-Institutional Analysis of Clinical Outcomes and Complications. Urol J 2016; 13(5): 2849–2855.
10. Stefanova V, Buckley R, Flax S, et al. Transperineal Prostate Biopsies Using Local Anesthesia: Experience with 1,287 Patients. Prostate Cancer Detection Rate, Complications and Patient Tolerability. J Urol 2019; 201(6): 1121–1126.
11. Xiang J, Yan H, Li J, et al. Transperineal versus transrectal prostate biopsy in the diagnosis of prostate cancer: a systematic review and meta-analysis. World J Surg Oncol. 2019; 17(1): 31.
12. Tu X, Liu Z, Chang T, et al. Transperineal Magnetic Resonance Imaging-Targeted Biopsy May Perform Better Than Transrectal Route in the Detection of Clinically Significant Prostate Cancer: Systematic Review and Meta-analysis. Clin Genitourin Cancer 2019; 17(5): e860–870.
13. Rai BP, Mayerhofer C, Somani BK, et al. Magnetic Resonance Imaging/Ultrasound Fusion-guided Transperineal Versus Magnetic Resonance Imaging/Ultrasound Fusion-guided Transrectal Prostate Biopsy ‑ A Systematic Review. Eur Urol Oncol. 2021 Jan 18.
14. Bruyère F, d’Arcier BF, Boutin J-M, Haillot O. Is urine culture routinely necessary before prostate biopsy? Prostate Cancer Prostatic Dis. 2010; 13(3): 260–262.
15. Baba K, Sekine Y, Miyazawa Y, et al. Assessment of antimicrobiral prophylaxis in transperineal prostate biopsy: A single-center retrospective study of 485 cases. J Infect Chemother Off J Jpn Soc Chemother. 2018; 24(8): 637–640.
16. Iremashvili VV, Chepurov AK, Kobaladze KM, Gamidov SI. Periprostatic Local Anesthesia With Pudendal Block for Transperineal Ultrasound-guided Prostate Biopsy: A Randomized Trial. Urology 2010; 75(5): 1023–1027.
17. Marra G, Zhuang J, Marquis A, et al. Pain in Men Undergoing Transperineal Free-Hand Multiparametric Magnetic Resonance Imaging Fusion Targeted Biopsies under Local Anesthesia: Outcomes and Predictors from a Multicenter Study of 1,008 Patients. J Urol 2020; 204(6): 1209–1215.
18. Vyas L, Acher P, Kinsella J, et al. Indications, results and safety profile of transperineal sector biopsies (TPSB) of the prostate: a single centre experience of 634 cases. BJU Int 2014; 114(1): 32–37.
19. Thurtle D, Starling L, Leonard K, et al. Improving the safety and tolerability of local anaesthetic outpatient transperineal prostate biopsies: A pilot study of the CAMbridge PROstate Biopsy (CAMPROBE) method. J Clin Urol 2018; 11 : 205141581876268.
20. Babaei Jandaghi A, Habibzadeh H, Falahatkar S, Heidarzadeh A, Pourghorban R. Transperineal Prostate Core Needle Biopsy: A Comparison of Coaxial Versus Noncoaxial Method in a Randomised Trial. Cardiovasc Intervent Radiol 2016; 39(12): 1736–1742.
21. Lopez JF, Campbell A, Omer A, et al. Local Anaesthetic Transperineal Prostate (LATP) biopsy using a probe-mounted transperineal access system: a multi-centre prospective outcome analysis. BJU Int. 2021 Jan 15.
22. Leyh-Bannurah S-R, Kachanov M, Beyersdorff D, et al. Minimum Magnetic Resonance Imaging-Ultrasound Fusion Targeted Biopsy Cores Needed for Prostate Cancer Detection: Multivariable Retrospective, Lesion Based Analyses of Patients Treated with Radical Prostatectomy. J Urol 2020; 203(2): 299–303.
23. Song G, Ruan M, Wang H, et al. How Many Targeted Biopsy Cores are Needed for Clinically Significant Prostate Cancer Detection during Transperineal Magnetic Resonance Imaging Ultrasound Fusion Biopsy? J Urol 2020; 204(6): 1202–1208.
24. Bass EJ, Donaldson IA, Freeman A, et al. Magnetic resonance imaging targeted transperineal prostate biopsy: a local anaesthetic approach. Prostate Cancer Prostatic Dis 2017; 20(3): 311–317.
25. Marra G, Marquis A, Tappero S, et al. Transperineal Free-hand mpMRI Fusion-targeted Biopsies Under Local Anesthesia: Technique and Feasibility From a Single-center Prospective Study. Urology 2020; 140 : 122–31.
26. Ryšánková K, Hanzlíková P, Vrtková A, et al. Transperineálně prováděné fúzní US/MRI navigované biopsie prostaty. 2021; Jan 22 [cited 2021 Feb 25]; Available from: http://czechurol.cz/doi/10.nnnn/cur.2021.001.html.
27. He B-M, Chen R, Shi Z-K, et al. Trans-Perineal Template-Guided Mapping Biopsy vs. Freehand Trans ‑ -Perineal Biopsy in Chinese Patients With PSA < 20 ng/ml: Similar Cancer Detection Rate but Different Lesion Detection Rate. Front Oncol 2019; 9 : 758.
28. Abdollah F, Novara G, Briganti A, et al. Trans-rectal Versus Trans-Perineal Saturation Rebiopsy of the Prostate: Is There a Difference in Cancer Detection Rate? Urology 2011; 77(4): 921–925.
29. Di Franco CA, Jallous H, Porru D, et al. A retrospective comparison between transrectal and transperineal prostate biopsy in the detection of prostate cancer. Arch Ital Urol Androl Organo Uff Soc Ital Ecogr Urol E Nefrol 2017; 89(1): 55–59.
30. Marra G, Eldred-Evans D, Challacombe B, et al. Pathological Concordance between Prostate Biopsies and Radical Prostatectomy Using Transperineal Sector Mapping Biopsies: Validation and Comparison with Transrectal Biopsies. Urol Int 2017; 99(2): 168–176.
31. Scott S, Samaratunga H, Chabert C, Breckenridge M, Gianduzzo T. Is transperineal prostate biopsy more accurate than transrectal biopsy in determining final Gleason score and clinical risk category? A comparative analysis. BJU Int 2015; 116(Suppl 3): 26–30.
32. Shen P-F, Zhu Y-C, Wei W-R, et al. The results of transperineal versus transrectal prostate biopsy: a systematic review and meta-analysis. Asian J Androl 2012; 14(2): 310–315.
33. Nelson AW, Harvey RC, Parker RA, et al. Repeat prostate biopsy strategies after initial negative biopsy: meta-regression comparing cancer detection of transperineal, transrectal saturation and MRI guided biopsy. PLoS One 2013; 8(2): e57480.
34. Zhang Q, Wang W, Zhang B, et al. Comparison of free-hand transperineal mpMRI/TRUS fusion-guided biopsy with transperineal 12-core systematic biopsy for the diagnosis of prostate cancer: a single-center prospective study in China. Int Urol Nephrol [Internet]. 2016 Dec 22. Available from: http://dx.doi.org/10.1007/ s11255-016-1484-8.
35. Miah S, Hosking-Jervis F, Connor MJ, et al. A Multicentre Analysis of the Detection of Clinically Significant Prostate Cancer Following Transperineal Image-fusion Targeted and Nontargeted Systematic Prostate Biopsy in Men at Risk. Eur Urol Oncol 2020; 3(3): 262–269.
36. Radtke JP, Kuru TH, Boxler S, et al. Comparative analysis of transperineal template saturation prostate biopsy versus magnetic resonance imaging targeted biopsy with magnetic resonance imaging-ultrasound fusion guidance. J Urol 2015; 193(1): 87–94.
37. Hansen NL, Kesch C, Barrett T, et al. Multicentre evaluation of targeted and systematic biopsies using magnetic resonance and ultrasound image-fusion guided transperineal prostate biopsy in patients with a previous negative biopsy. BJU Int [Internet]. 2016 Nov 10. Available from: http://dx.doi.org/10.1111/bju.13711
38. Borkowetz A, Hadaschik B, Platzek I, et al. Prospective comparison of transperineal magnetic resonance imaging/ultrasonography fusion biopsy and transrectal systematic biopsy in biopsy-naïve patients. BJU Int 2018; 121(1): 53–60.
39. Loy LM, Lim GH, Leow JJ, et al. A systematic review and meta-analysis of magnetic resonance imaging and ultrasound guided fusion biopsy of prostate for cancer detection – comparing transrectal with transperineal approaches. Urol Oncol 2020; 38(8): 650–660.
40. Khoo CC, Eldred-Evans D, Peters M, et al. A Comparison of Prostate Cancer Detection between Visual Estimation (Cognitive Registration) and Image Fusion (Software Registration) Targeted Transperineal Prostate Biopsy. J Urol 2020; Nov 18; 101097JU0000000000001476.
41. Meyer AR, Mamawala M, Winoker JS, et al. Transperineal Prostate Biopsy Improves the Detection of Clinically Significant Prostate Cancer among Men on Active Surveillance. J Urol 2020; Dec 1;101097JU0000000000001523.
42. Xue J, Qin Z, Cai H, et al. Comparison between transrectal and transperineal prostate biopsy for detection of prostate cancer: a meta-analysis and trial sequential analysis. Oncotarget 2017; 8(14): 23322–23336.
43. Guo L-H, Wu R, Xu H-X, et al. Comparison between Ultrasound Guided Transperineal and Transrectal Prostate Biopsy: A Prospective, Randomized and Controlled Trial. Sci Rep 2015; 5(1): 16089.
44. Bittner N, Merrick G, Taira A, et al. Location and Grade of Prostate Cancer Diagnosed by Transperineal Template-guided Mapping Biopsy After Negative Transrectal Ultrasound-guided Biopsy. Am J Clin Oncol 2018; 41(8): 723–729.
45. Grummet JP, Weerakoon M, Huang S, et al. Sepsis and ‘superbugs’: should we favour the transperineal over the transrectal approach for prostate biopsy? BJU Int 2014; 114(3): 384–388.
46. Mai Z, Yan W, Zhou Y, et al. Transperineal template-guided prostate biopsy: 10 years of experience. BJU Int 2016; 117(3): 424–429.
47. Togo Y, Kubo T, Taoka R, et al. Occurrence of infection following prostate biopsy procedures in Japan: Japanese Research Group for Urinary Tract Infection (JRGU) – a multi-center retrospective study. J Infect Chemother Off J Jpn Soc Chemother 2014; 20(4): 232–237.
48. Berry B, Parry MG, Sujenthiran A, et al. Comparison of complications after transrectal and transperineal prostate biopsy: a national population – based study. BJU Int 2020; 126(1): 97–103.
49. Bennett HY, Roberts MJ, Doi SR, Gardiner RA. The global burden of major infectious complications following prostate biopsy. Epidemiol Infect 2016; 144(8): 1784–1791.
50. Pradere B, Veeratterapillay R, Dimitropoulos K, et al. Nonantibiotic Strategies for the Prevention of Infectious Complications following Prostate Biopsy: A Systematic Review and Meta-Analysis. J Urol 2021; 205(3): 653–663.
51. Moran BJ, Braccioforte MH, Conterato DJ. Re-biopsy of the prostate using a stereotactic transperineal technique. J Urol 2006; 176(4 Pt 1): 1376–1381; discussion 1381.
52. Borghesi M, Ahmed H, Nam R, et al. Complications After Systematic, Random, and Image-guided Prostate Biopsy. Eur Urol 2017; 71(3): 353–365.
53. Pepe P, Pennisi M. Erectile dysfunction in 1 050 men following extended (18 cores) vs saturation (28 cores) vs saturation plus MRI-targeted prostate biopsy (32 cores). Int J Impot Res. 2016; 28(1): 1–3.
54. García Rojo E, García Gómez B, González Padilla DA, et al. Assessment of the influence of transrectal and transperineal prostate biopsies on erectile function: A prospective observational single-center study. Int J Urol Off J Jpn Urol Assoc 2019; 26(11): 1054–1058.
Labels
Paediatric urologist Nephrology UrologyArticle was published in
Czech Urology
2021 Issue 2
-
All articles in this issue
- EDITORIAL
- Inferior vena cava lesion as a complication of laparoscopic radical nephroureterectomy with retroperitoneal lymphadenectomy
- Transperineal prostate biopsy in the diagnosis of prostate cancer
- Antibiotic prophylaxis in multiparametric magnetic resonance imaging-guided transrectal prostate biopsy
- Ultrasound versus fluoroscopic localisation during extracorporeal shockwave lithotripsy
- Laparoscopic partial nephrectomy of solitary kidneys
- Posterior urethral valve with late manifestation in a 14-year-old boy
- Posterior pubic symphyseal protuberance as an obstacle to radical prostatectomy
- Rare case of acquired herniation of the kidney in the chest
- Bilateral inguinal hernia solved with mash during extraperitoneal robot assisted radical prostatectomy
- Životné jubileum prof. MUDr. Jána Klimenta, CSc.
- Jubileum profesora Tomáše Hanuše
- Profesor Babjuk slaví šedesátiny
- Ohlédnutí za JEUS 2021
- Czech Urology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Transperineal prostate biopsy in the diagnosis of prostate cancer
- Antibiotic prophylaxis in multiparametric magnetic resonance imaging-guided transrectal prostate biopsy
- Posterior urethral valve with late manifestation in a 14-year-old boy
- Laparoscopic partial nephrectomy of solitary kidneys
