Co je nového v patologii štítné žlázy
What is New in Pathology of the Thyroid Gland?
Current view on certain lesions of the thyroid gland has dramatically changed during last several decades, namely due to definition of some new entities and inclusion of molecular genetic methods into diagnostic process. This results in change or more precise definition of diagnostic criteria of certain entities. In the article are discussed namely the following topics: follicular variant of papillary carcinoma, tumors of uncertain malignant potential, papillary microcarcinoma, oncocytic tumors and poorly differentiated carcinoma.
Key words:
thyroid gland – papillary carcinoma – follicular variant – tumors of uncertain malignant potential – oncocytic tumors – poorly differentiated carcinoma – molecular genetics
:
A. Ryška
:
Fingerlandův ústav patologie, LF UK a FN, Hradec Králové
:
Čes.-slov. Patol., 44, 2008, No. 4, p. 90-95
:
Reviews Article
Pohled na některé léze štítné žlázy se za posledních několik desetiletí zásadně proměnil, zejména v důsledku zavedení nových jednotek; díky zahrnutí molekulárně genetických metod do diagnostiky dochází ke změnám či zpřesnění klasifikačních kritérií u některých lézí. V textu je věnována pozornost pěti oblastem, kde jsou změny zvláště markantní - problematice folikulární varianty papilokarcinomu, folikulárním nádorům s hraniční morfologií, papilárnímu mikrokarcinomu a otázce jeho biologického potenciálu, onkocytárním nádorům a málo diferencovanému karcinomu.
Klíčová slova:
štítná žláza – papilární karcinom – folikulární varianta – nádory s nejistým maligním potenciálem – onkocytární nádory – málo diferencovaný karcinom – molekulární genetika
Přes rozvoj různých molekulárně biologických metod zůstává patologická diagnostika nádorů do dnešní doby závislá na mikroskopickém vyšetření a klasických histologických metodách, které se nezměnily po mnoho desetiletí. Neznamená to však, že se patologie jako obor nevyvíjí, či snad že se patologická diagnostika nemění. Opak je pravdou a histopatologie štítné žlázy je toho vynikající ilustrací.
Pohled na některé léze štítné žlázy se za posledních několik desetiletí proměnil naprosto dramaticky. Zavedením nových jednotek, jako např. folikulární varianty papilokarcinomu, nebo naopak zrušením jednotek jiných, jako např. papilárního adenomu, se zcela změnilo spektrum nádorů, které jsou ve štítné žláze diagnostikovány (3). V posledních asi 10 letech dochází k další podobné revoluci, a to zejména v důsledku zahrnutí molekulárně genetických metod do diagnostiky.
V následujícím textu bude věnována pozornost pěti oblastem, kde je, dle autorova názoru, posun v patologii štítné žlázy největší. Těmito oblastmi jsou:
- folikulární varianta papilokarcinomu, možnosti její diagnostiky a diferenciální diagnostiky,
- folikulární nádory s hraniční morfologií, jejich diferenciální diagnostika a klasifikace,
- časná stadia papilokarcinomu - problematika papilárního mikrokarcinomu a jeho biologického potenciálu,
- onkocytární nádory štítné žlázy,
- málo diferencovaný karcinom štítné žlázy – definice této kategorie a její diagnostická kritéria.
Folikulární varianta papilokarcinomu štítné žlázy
Folikulární varianta papilárního karcinomu (FVPC), ačkoli byla poprvé popsána před více než 30 lety (11), zůstává i přes rozvoj imunohistochemických a molekulárně genetických vyšetření v současnosti pravděpodobně vůbec nejkontroverznější oblastí onkopatologie štítné žlázy.
Diagnóza FVPC se opírá o dvě základní morfologická kritéria – přítomnost charakteristických jader (tzv. matnicová jádra – nepravidelného tvaru, se světlým chromatinem, hyperchromazií jaderné membrány, intranukleárními rýhami a pseudoinkluzemi) a folikulární úpravu nádorové léze (45).
Prvním kontroverzním tématem u FVPC je vlastní oblast diagnostiky – tedy rozhodnutí, zda se jedná o FVPC či nikoli. Takřka nikdy nejsou typické jaderné charakteristiky vyjádřeny u všech nádorových buněk, ale pouze u větší či menší části z nich (45). Vzhledem k tomu je obtížné u folikulárně uspořádaných nádorů s fokálním projasněním jader rozhodnout, zda jde o FVPC, či zda se jedná o pseudomaligní změny v benigní folikulární lézi (adenomu) (5). Interpretace těchto lézí je velice subjektivní a vede, jak bylo opakovaně popsáno, k velmi vysoké interindividuální diagnostické variabilitě (29) a časté falešně pozitivní diagnóze malignity (40). Někteří autoři navrhují v těchto případech využití imunohistochemické detekce určitých specifických markerů – např. HBME1, galectinu-3, cytokeratinu 19 apod. Výsledky jednotlivých studií jsou však kontroverzní a neexistuje žádný marker s dostatečně vysokou senzitivitou a současně i specificitou (6, 26, 46). Z tohoto důvodu se jako nejpřínosnější jeví využití panelu několika markerů současně – nejlepší výsledky byly popsány za současného použití HBME-1, galectinu-3 a CK19 (6, 34). Senzitivita tohoto panelu pro stanovení diagnózy FVPC dosahuje 87 % při zachování specificity 89 % (34). Je však třeba upozornit na nutnost opatrné interpretace výsledků imunohistochemie v těch případech, kdy je v uzlech přítomna chronická zánětlivá infiltrace – ať již z důvodu chronické lymfocytární tyreoiditidy nebo u nádorů, kde byla v předoperační diagnostice provedena tenkojehlová aspirační cytologie uzlu. V těchto případech může být imunohistochemické vyšetření v místě chronického zánětu falešně pozitivní (6).
Druhou oblastí je predikce biologického chování FVPC. Na rozdíl od prvotních publikací, které udávaly relativně příznivější prognózu FVPC ve srovnání s ostatními papilokarcinomy, je v současnosti zřejmé, že se jedná o značně heterogenní skupinu lézí, z nichž některé mohou mít i velmi agresivní průběh (19, 28).
Z molekulárně genetického hlediska lze vedle přítomnosti mutací typických pro papilokarcinom (přestavba RET/PTC nebo mutace BRAF genu – která je u FVPC relativně vzácná) u určité části těchto nádorů prokázat také mutace RAS genů (u zhruba 10–20 % FVPC) či přestavbu PAX8-PPARgamma, které jsou jinak charakteristickým a poměrně častým nálezem u folikulárních tumorů (adenomů i karcinomů) (10, 14, 18, 25, 56, 61). To koreluje s biologickým chováním FVPC, kdy některé nádory s mutací RAS vykazují agresivnější chování (20) a mohou metastazovat nikoli do uzlin, ale do kostí (1, 4, 5). Zdá se, že diagnostická kategorie FVPC zahrnuje ve skutečnosti tři skupiny nádorů – relativně nízce maligní opouzdřené FVPC, neopouzdřené FVPC s intermediární prognózou a vysoce agresivní, široce invazivní, často multicentrické či difúzní FVPC (16, 24).
Folikulární nádory s hraniční morfologií
Zvláštní kategorii lézí štítné žlázy představují nově zavedené skupiny nádorů s hraničním fenotypem.
Je to jednak skupina nádorů, které mají folikulární úpravu, nerostou invazivně, ale vykazují ložiskově některé rysy FVPC. U těchto nádorů je obtížné až nemožné rozhodnout, zda se jedná o folikulární adenom s fokálními jadernými změnami imitujícími FVPC (prosvětlení jader, intranukleární rýhy), či zda jde o případ skutečného, extrémně dobře diferencovaného FVPC, kde jaderné charakteristiky jsou pouze minimálně vyjádřeny. U těchto nádorů bylo doposud rozhodnutí o biologické povaze lézí víceméně arbitrární záležitostí a jako takové tedy výrazně subjektivní (či „expert-dependentní“). Proto byla navržena (a v nové WHO klasifikaci již i ustanovena) jednotka označovaná jako dobře diferencovaný tumor nejistého maligního potenciálu (well differentiated tumor of uncertain malignant potential) (16, 43, 60). Tyto nádory mají v naprosté většině případů vynikající prognózu a nedochází u nich k metastazování.
Druhou skupinou jsou nádory s folikulární úpravou, nevykazující jaderné charakteristické rysy papilokarcinomu, ale s ložiskovou přítomností nádorové invaze do pouzdra (nikoli však skrze jeho celou tloušťku) (obr. 1), případně ne zcela jednoznačnou invazi do kapsulárních cév. Pro tyto nádory, morfologicky (a velmi pravděpodobně tedy i biologicky) ležící na pomezí mezi folikulárním adenomem a minimálně invazivním folikulárním karcinomem, byla vytvořena kategorie folikulárních tumorů nejistého maligního potenciálu (follicular tumor of uncertain malignant potential) (16, 54). U těchto nádorů byla prokázána ložisková, různě intenzivní exprese markerů používaných v diferenciální diagnostice benigních a maligních nádorů z folikulárních buněk (viz výše), jako jsou HBME-1 či galectin-3 (38), což ilustruje fakt, že se zřejmě jedná o velmi heterogenní skupinu lézí, jejichž prognóza je nicméně prakticky vždy příznivá, a proto je v jeho léčbě doporučován konzervativní postup.
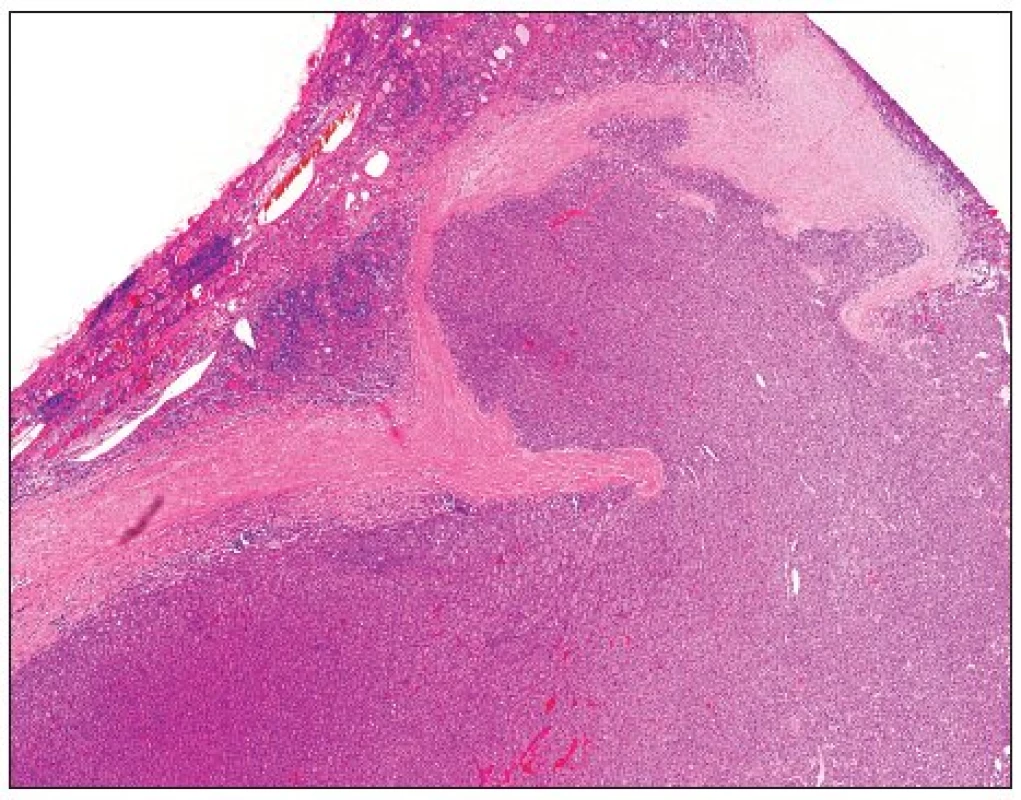
Na tomto místě je třeba zmínit několik důležitých skutečností. Prognóza folikulárního karcinomu je přímo úměrná stupni jeho invazivity (13). Obecně je akceptováno, že biologické chování minimálně invazivních folikulárních karcinomů bez angioinvaze je velmi příznivé a jejich metastazování je naprostou vzácností (22, 55). U minimálně invazivních folikulárních karcinomů s angioinvazí by léčba měla být obdobná jako u případů široce invazivních folikulárních karcinomů (16). U folikulárních karcinomů s nepochybnou angioinvazí pak velmi pravděpodobně prognóza úzce koreluje s rozsahem této invaze; zejména u karcinomů s přestavbou PAX8-PPARgamma nebo mutací RAS dochází ve zvýšené míře k invazi kapsulárních cév a tyto nádory mají tendenci k agresivnímu průběhu a časnému a četnějšímu výskytu hematogenních metastáz (13, 36, 37).
Třetí skupinou jsou nepochybné dobře diferencované karcinomy, u kterých však nelze spolehlivě rozhodnout, zda mají folikulární či papilární fenotyp. U nádorů tohoto typu byl navrhován název hybridní karcinom (9) či dobře diferencovaný karcinom, blíže neurčený (well differentiated carcinoma, not otherwise specified) (16). Tato kategorie je podstatně méně kontroverzní, neboť nemá zásadní vliv na volbu terapeutického přístupu – v obou případech (ať už jde o folikulární či papilární karcinom) je po radikálním chirurgickém zákroku pacientům podáván radiojód 131I.
Časná stadia papilokarcinomu
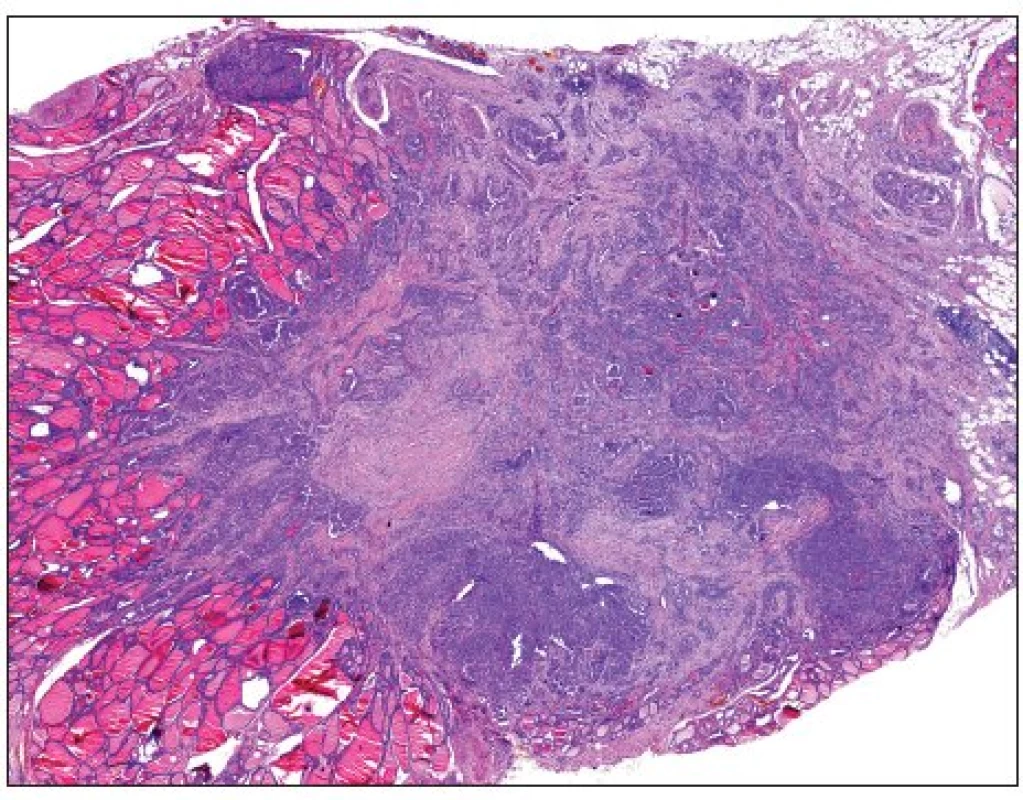
Zatím neexistuje jednoznačný přístup k hodnocení papilárních mikrokarcinomů. Dle definice WHO jsou takto označovány všechny papilokarcinomy menší než 10 mm v maximálním rozměru. S nárůstem extenzivity při histologickém vyšetřování resekátů štítné žlázy dochází v posledních letech k výraznému nárůstu záchytu těchto miniaturních papilárních lézí. Naprostá většina těchto nádorů představuje náhodný záchyt klinicky okultních lézí odstraněných a diagnostikovaných při vyšetření štítné žlázy z jiného důvodu. V některých systematických pitevních studiích se četnost výskytu okultních papilárních mikrokarcinomů pohybuje mezi 30–40 %. Při zohlednění faktu, že sebepečlivější histologické vyšetření zákonitě nepokryje celý objem parenchymu, lze dospět ke zjištění, že při kompletním zpracování celého objemu žlázy by byl papilární mikrokarcinom identifikován prakticky u 100 % vyšetřených pacientů. Přestože výskyt klinicky relevantního papilokarcinomu je asi desetkrát častější u žen (13), byly papilární mikrokarcinomy prokázány stejně často u mužů jako u žen (12) či dokonce s mírnou převahou výskytu u mužů (17, 21). Tyto nádory mají v naprosté většině případů nulový maligní potenciál; zdá se, že k jejich progresi do klinicky manifestního stadia je zapotřebí další molekulární mechanismus, který však zatím není znám.
Často se jedná o nádory, jejichž velikost nepřesahuje 5 mm, nezřídka jde i o ložiska o průměru menším než 1 mm (obr. 2, 3). Protože diagnóza malignity může u takových lézí vést k neadekvátně radikálnímu terapeutickému postupu, bylo navrženo, aby nádory, u kterých nebyly prokázány žádné zjevné morfologické známky potenciálně agresivního chování (musí jít o solitární náhodně zachycený papilární nádor bez známek prorůstání do pouzdra štítné žlázy či lymfangioinvaze, bez lymfadenopatie, při současném ultrasonografickém nálezu homogenního parenchymu bez ložiskových změn v druhém laloku), byly označovány nikoli jako mikrokarcinomy, ale jako papilární mikrotumory, což by umožnilo volbu méně agresivního terapeutického přístupu (44). Je perličkou, že návrh z roku 2003 (44) není prvním, který navrhuje zrušení termínu „karcinom“ u malých papilárních tumorů – s obdobným návrhem přišli již o 18 let dříve Harach a spol. (21); jak je ale zřejmé, jejich tehdejší návrh nebyl široce akceptován.
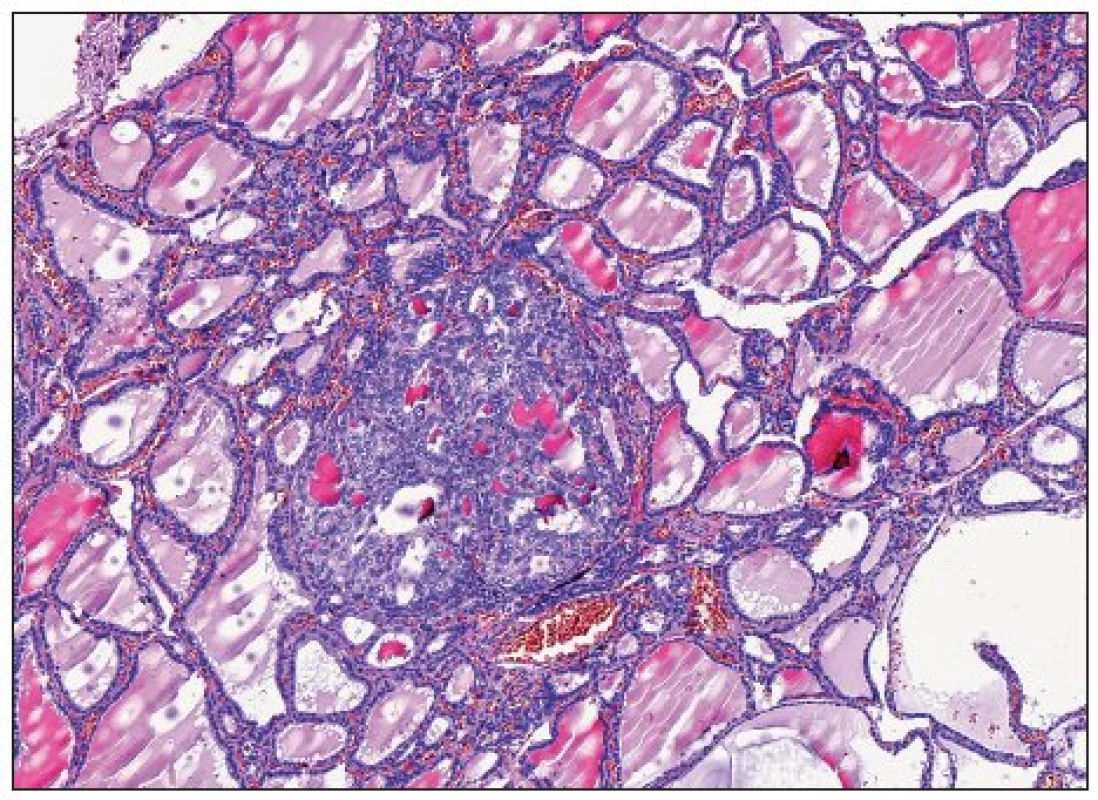
Onkocytární nádory štítné žlázy
Onkocytární nádory štítné žlázy představují kategorii lézí, která byla z WHO klasifikace zcela vypuštěna (13). Současné poznatky ukazují, že onkocytární nádory se chovají obdobně jako jejich neonkocytární protějšky – tedy onkocytární adenom jako folikulární adenom, onkocytární karcinom jako folikulární karcinom a onkocytární papilokarcinom jako klasický papilokarcinom. Onkocytární diferenciace (tj. přítomnost buněk s objemnou, jemně zrnitou cytoplazmou, která obsahuje masivně zmnožené mitochondrie) může být patrná difuzně v celém nádoru (tzv. primární oxyfilie), nebo pouze v části nádorových buněk (tzv. sekundární oxyfilie). V prvním případě došlo k mutaci mitochondriální mtDNA před mutací jaderné DNA vedoucí ke vzniku nádoru, ve druhém případě došlo k poruše mitochondriální DNA až po vzniku vlastního nádoru (31–33, 52).
Rozdílem oproti jejich „neonkocytárním“ protějškům je však nižší senzitivita onkocytárních nádorů na terapii radiojódem, proto je i nadále vhodné onkocytární fenotyp zmínit ve výsledku bioptického vyšetření (13, 52).
Málo diferencovaný karcinom štítné žlázy
Málo diferencovaný karcinom (poorly differentiated carcinoma – PDC) je nádor, který svým biologickým chováním leží na pomezí mezi dobře diferencovanými karcinomy (papilárním a folikulárním) na jedné straně a nediferencovaným (anaplastickým) karcinomem na straně druhé. Existence nádorů tohoto typu byla poprvé popsána již v 70. letech 20. století, jako samostatná jednotka však byl PDC navržen až v roce 1983 (48), resp. 1984 (8) nezávisle dvěma autorskými týmy. Kritéria definovaná v obou pracích se však značně lišila (důraz na architektonické uspořádání – solidní, trabekulární nebo scirhotický růst v práci Sakamoto et al. (48) versus striktní kritéria – insulární růst, hyperchromní jádra, mitotická aktivita a přítomnost nekróz v prácí Carcangiu et al. (8). V průběhu času začaly být mezi PDC řazeny i některé klinicky agresivnější varianty papilokarcinomu, jako např. papilokarcinom z vysokých (tall-cell) či z kolumnárních buněk (columnar cell) (53). PDC byl tedy značně heterogenní a velmi vágně definovanou kategorií, která zahrnovala celé spektrum lézí s rozličným biologickým potenciálem (2, 42, 47).
Teprve rozsáhlá studie italských autorů z roku 2004 popisující 183 případů PDC definovala jednoznačná kritéria pro stanovení diagnózy PDC (59); tato kritéria byla následně ověřena i v mezinárodní studii zahrnující patology z Evropy, USA a Japonska (58). Jako PDC lze označit pouze nádor, který vychází z folikulárních buněk a splňuje následující kritéria: 1. nádor vykazuje solidní/inzulární/trabekulární uspořádání, 2. nádorové buňky nevykazují charakteristické znaky papilokarcinomu (s výjimkou případného rezidua dobře diferencovaného papilokarcinomu, který může být někdy součástí PDC) a 3. přítomnost alespoň jednoho ze tří kritérií – nekróza, modelovaná hyperchromní jádra, mitotická aktivita přesahující 3 mitózy na 10 HPF (58) (obr. 4). Onkocytární nádory, které splňují výše popsaná kritéria, nebyly doposud do skupiny PDC zahrnuty, velmi pravděpodobně však jejich biologické chování bude obdobné jako u klasických PDC (39,58). Molekulární mechanismy, které vedou k dediferenciaci papilárního či folikulárního karcinomu a vzniku PDC, nejsou ještě zcela přesně známy, nepochybně se však na tomto procesu podílí mutace genu p53 (15, 30, 51). Dále se na procesu dediferenciace podílí ztráta exprese E-cadherinu, zodpovědná za poruchu kohezivity nádorových buněk a jejich zvýšenou invazivitu (41). U části nádorů hraje úlohu také bodová mutace ras onkogenu, zejména genu N-ras v kodonu 61 (7, 57). Naopak přestavba RET/PTC nemá pravděpodobně na dediferenciaci a zhoršenou prognózu vliv (50).
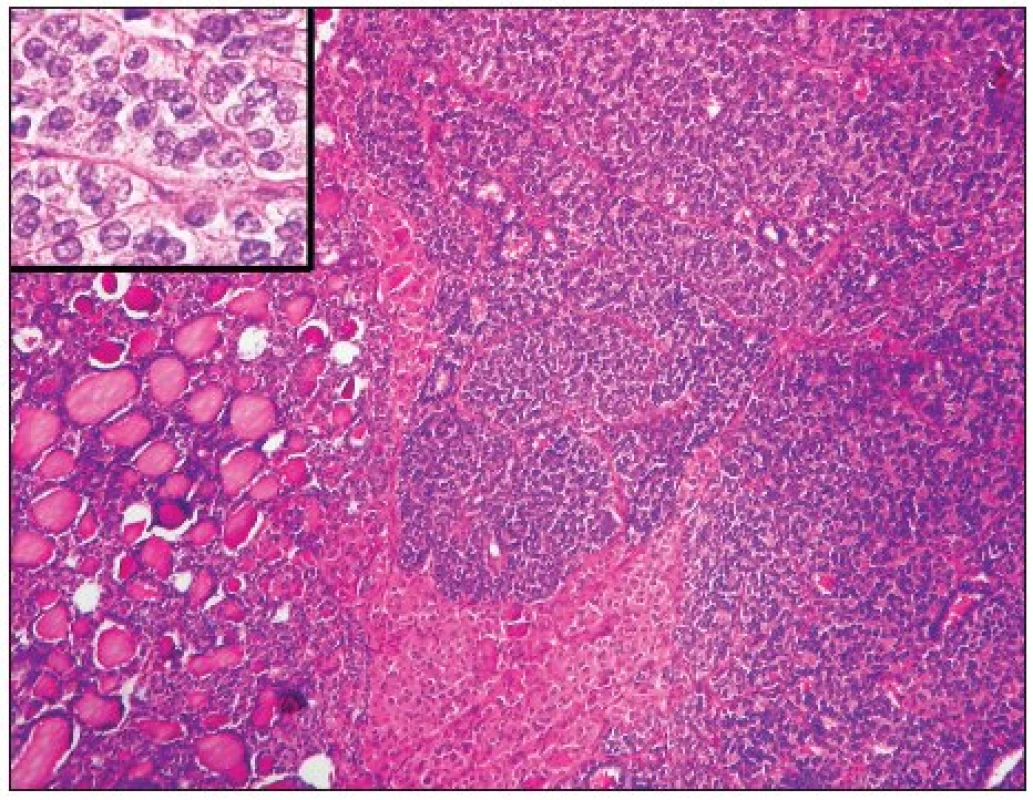
Diferenciálně diagnosticky je nutno odlišit zejména solidní variantu papilokarcinomu (obr. 5), který může vykazovat obdobné architektonické uspořádání a zvýšenou mitotickou aktivitu, jeho prognóza je však vzhledem k vyšší akumulaci radiojódu 131I zřetelně lepší než u PDC (35). Pro solidní variantu papilokarcinomu je charakteristická přítomnost typických matnicových jader, obdobných jako v ostatních variantách papilokarcinomu (13, 35).
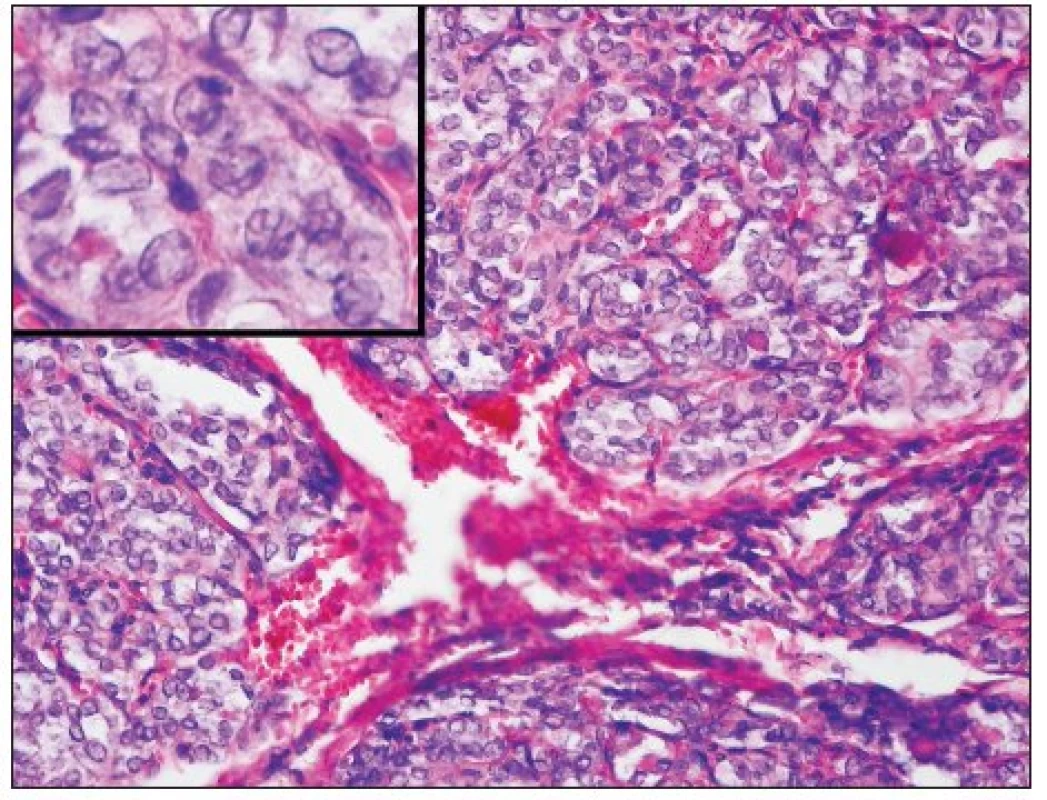
Z prognostického hlediska hraje zásadní roli zejména přítomnost nekróz a proliferační aktivita nádoru, které výrazně zhoršují jeho biologické chování (23, 58, 59). Data o možnostech léčby PDC jsou značně kontroverzní, v současnosti je však doporučováno kromě podávání radiojódu 131I (27) také zevní ozáření (49).
Práce byla podpořena Výzkumným záměrem MZO 00179906 a grantem IGA NR/9165-3.
Prof. MUDr. Aleš Ryška, Ph.D.
Fingerlandův ústav patologie LF UK a FN
Fakultní nemocnice
500 05 Hradec Králové
e-mail: ryskaale@fnhk.cz
Sources
1. Adeniran, A. J., Zhu, Z., Gandhi, M., Steward, D. L., Fidler, J. P., Giordano, T. J., Biddinger, P. W., Nikiforov, Y. E.: Correlation between genetic alterations and microscopic features, clinical manifestations, and prognostic characteristics of thyroid papillary carcinomas. Am J Surg Pathol, 2006, 30 : 216-22
2. Albores-Saavedra, J., Carrick, K.: Where to set the threshold between well differentiated and poorly differentiated follicular carcinomas of the thyroid. Endocr Pathol, 2004, 15 : 297-305
3. Albores-Saavedra, J., Henson, D. E. , Glazer, E., Schwartz, A. M.: Changing patterns in the incidence and survival of thyroid cancer with follicular phenotype—papillary, follicular, and anaplastic: a morphological and epidemiological study. Endocr Pathol, 2007, 18 : 1-7
4. Baloch, Z. W., LiVolsi, V. A.: Encapsulated follicular variant of papillary thyroid carcinoma with bone metastases. Mod Pathol, 2000, 13 : 861-5
5. Baloch, Z. W., Livolsi, V. A.: Follicular-patterned lesions of the thyroid: the bane of the pathologist. Am J Clin Pathol, 2002, 117 : 143-50
6. Barroeta, J. E., Baloch, Z. W., Lal, P., Pasha, T. L., Zhang, P. J., LiVolsi, V. A.: Diagnostic value of differential expression of CK19, Galectin-3, HBME-1, ERK, RET, and p16 in benign and malignant follicular-derived lesions of the thyroid: an immunohistochemical tissue microarray analysis. Endocr Pathol, 2006, 17 : 225-34
7. Basolo, F., Pisaturo, F., Pollina, L. E., Fontanini, G., Elisei, R., Molinaro, E., Iacconi, P., Miccoli, P., Pacini, F.: N-ras mutation in poorly differentiated thyroid carcinomas: correlation with bone metastases and inverse correlation to thyroglobulin expression. Thyroid, 2000, 10 : 19-23
8. Carcangiu, M. L., Zampi, G., Rosai, J.: Poorly differentiated (“insular”) thyroid carcinoma. A reinterpretation of Langhans’ “wuchernde Struma”. Am J Surg Pathol, 1984, 8 : 655-68
9. Castro, P., Fonseca, E., Magalhaes, J., Sobrinho-Simoes, M.: Follicular, papillary, and “hybrid” carcinomas of the thyroid. Endocr Pathol, 2002, 13 : 313-20
10. Castro, P., Rebocho, A. P., Soares, R. J., Magalhaes, J., Roque, L., Trovisco, V., Vieira de Castro, I., Cardoso-de-Oliveira, M., Fonseca, E., Soares, P., Sobrinho-Simoes, M.: PAX8-PPARgamma rearrangement is frequently detected in the follicular variant of papillary thyroid carcinoma. J Clin Endocrinol Metab, 2006, 91 : 213-20
11. Chem, K. T., Rosai, J.: Follicular variant of thyroid papillary carcinoma: a clinicopathologic study of six cases. Am J Surg Pathol, 1977, 1 : 123-30
12. de Matos, P. S., Ferreira, A. P., Ward, L. S.: Prevalence of papillary microcarcinoma of the thyroid in Brazilian autopsy and surgical series. Endocr Pathol, 2006, 17 : 165-73
13. DeLellis, R. A., Lloyd, R. V., and Heitz, P. U.: Tumors of the thyroid and parathyroid. In: Tumours of endocrine organs. World Health Organization Classification of Tumours. 2004. Lyon, France, IARC Press.
14. Di Cristofaro, J., Marcy, M., Vasko, V., Sebag, F., Fakhry, N., Wynford-Thomas, D., De Micco, C.: Molecular genetic study comparing follicular variant versus classic papillary thyroid carcinomas: association of N-ras mutation in codon 61 with follicular variant. Hum Pathol, 2006, 37 : 824-30
15. Donghi, R., Longoni, A., Pilotti, S., Michieli, P., Della Porta, G., Pierotti, M. A.: Gene p53 mutations are restricted to poorly differentiated and undifferentiated carcinomas of the thyroid gland. J Clin Invest, 1993, 91 : 1753-60
16. Fonseca, E., Soares, P., Cardoso-Oliveira, M., Sobrinho-Simoes, M.: Diagnostic criteria in well-differentiated thyroid carcinomas. Endocr Pathol, 2006, 17 : 109-17
17. Franssila, K. O., Harach, H. R.: Occult papillary carcinoma of the thyroid in children and young adults. A systemic autopsy study in Finland. Cancer, 1986, 58 : 715-9
18. Giordano, T. J., Kuick, R., Thomas, D. G., Misek, D. E., Vinco, M., Sanders, D., Zhu, Z., Ciampi, R., Roh, M., Shedden, K., Gauger, P., Doherty, G., Thompson, N. W., Hanash, S., Koenig, R. J., Nikiforov, Y. E.: Molecular classification of papillary thyroid carcinoma: distinct BRAF, RAS, and RET/PTC mutation-specific gene expression profiles discovered by DNA microarray analysis. Oncogene, 2005, 24 : 6646-56
19. Hagag, P., Hod, N., Kummer, E., Cohenpour, M., Horne, T., Weiss, M.: Follicular variant of papillary thyroid carcinoma: clinical-pathological characterization and long-term follow-up. Cancer J, 2006, 12 : 275-82
20. Hara, H., Fulton, N., Yashiro, T., Ito, K., DeGroot, L. J., Kaplan, E. L.: N-ras mutation: an independent prognostic factor for aggressiveness of papillary thyroid carcinoma. Surgery, 1994, 116 : 1010-6
21. Harach, H. R., Franssila, K. O., Wasenius, V. M.: Occult papillary carcinoma of the thyroid. A “normal” finding in Finland. A systematic autopsy study. Cancer, 1985, 56 : 531-8
22. Heffess, C. S., Thompson, L. D.: Minimally invasive follicular thyroid carcinoma. Endocr Pathol, 2001, 12 : 417-22
23. Hiltzik, D., Carlson, D. L., Tuttle, R. M., Chuai, S., Ishill, N., Shaha, A., Shah, J. P., Singh, B., Ghossein, R. A.: Poorly differentiated thyroid carcinomas defined on the basis of mitosis and necrosis: a clinicopathologic study of 58 patients. Cancer, 2006, 106 : 1286-95
24. Ivanova, R., Soares, P., Castro, P., Sobrinho-Simoes, M.: Diffuse (or multinodular) follicular variant of papillary thyroid carcinoma: a clinicopathologic and immunohistochemical analysis of ten cases of an aggressive form of differentiated thyroid carcinoma. Virchows Arch, 2002, 440 : 418-24
25. Kimura, E. T., Nikiforova, M. N., Zhu, Z., Knauf, J. A., Nikiforov, Y. E., Fagin, J. A.: High prevalence of BRAF mutations in thyroid cancer: genetic evidence for constitutive activation of the RET/PTC-RAS-BRAF signaling pathway in papillary thyroid carcinoma. Cancer Res, 2003, 63 : 1454-7
26. Laco, J., Ryška, A.: Využití imunohistochemie v diferenciální diagnostice nádorů štítné žlázy s folikulárními rysy. Čes-slov Patol, 2006, 42 : 120-4
27. Lin, J. D., Chao, T. C., Hsueh, C.: Clinical characteristics of poorly differentiated thyroid carcinomas compared with those of classical papillary thyroid carcinomas. Clin Endocrinol (Oxf), 2007, 66 : 224-8
28. Liu, J., Singh, B., Tallini, G., Carlson, D. L., Katabi, N., Shaha, A., Tuttle, R. M., Ghossein, R. A.: Follicular variant of papillary thyroid carcinoma: a clinicopathologic study of a problematic entity. Cancer, 2006, 107 : 1255-64
29. Lloyd, R. V., Erickson, L. A., Casey, M. B., Lam, K. Y., Lohse, C. M., Asa, S. L., Chan, J. K., DeLellis, R. A., Harach, H. R., Kakudo, K., LiVolsi, V. A., Rosai, J., Sebo, T. J., Sobrinho-Simoes, M., Wenig, B. M., Lae, M. E.: Observer variation in the diagnosis of follicular variant of papillary thyroid carcinoma. Am J Surg Pathol, 2004, 28 : 1336-40
30. Matias-Guiu, X., Villanueva, A., Cuatrecasas, M., Capella, G., De Leiva, A., Prat, J.: p53 in a thyroid follicular carcinoma with foci of poorly differentiated and anaplastic carcinoma. Pathol Res Pract, 1996, 192 : 1242-9; discussion 1250-1
31. Maximo, V., Soares, P., Lima, J., Cameselle-Teijeiro, J., Sobrinho-Simoes, M.: Mitochondrial DNA somatic mutations (point mutations and large deletions) and mitochondrial DNA variants in human thyroid pathology: a study with emphasis on Hurthle cell tumors. Am J Pathol, 2002, 160 : 1857-65
32. Maximo, V., Sobrinho-Simoes, M.: Hurthle cell tumours of the thyroid. A review with emphasis on mitochondrial abnormalities with clinical relevance. Virchows Arch, 2000, 437 : 107-15
33. Maximo, V., Sobrinho-Simoes, M.: Mitochondrial DNA ‘common’ deletion in Hurthle cell lesions of the thyroid. J Pathol, 2000, 192 : 561-2
34. Nakamura, N., Erickson, L. A., Jin, L., Kajita, S., Zhang, H., Qian, X., Rumilla, K., Lloyd, R. V.: Immunohistochemical separation of follicular variant of papillary thyroid carcinoma from follicular adenoma. Endocr Pathol, 2006, 17 : 213-23
35. Nikiforov, Y. E., Erickson, L. A., Nikiforova, M. N., Caudill, C. M., Lloyd, R. V.: Solid variant of papillary thyroid carcinoma: incidence, clinical-pathologic characteristics, molecular analysis, and biologic behavior. Am J Surg Pathol, 2001, 25 : 1478-84
36. Nikiforova, M. N., Lynch, R. A., Biddinger, P. W., Alexander, E. K., Dorn, G. W. 2nd, Tallini, G., Kroll, T. G., Nikiforov, Y. E.: RAS point mutations and PAX8-PPAR gamma rearrangement in thyroid tumors: evidence for distinct molecular pathways in thyroid follicular carcinoma. J Clin Endocrinol Metab, 2003, 88 : 2318-26
37. Nikiforova, M. N., Nikiforov, Y. E.: Molecular genetics of thyroid cancer: implications for diagnosis, treatment and prognosis. Expert Rev Mol Diagn, 2008, 8 : 83-95
38. Papotti, M., Rodriguez, J., De Pompa, R., Bartolazzi, A., Rosai, J.: Galectin-3 and HBME-1 expression in well-differentiated thyroid tumors with follicular architecture of uncertain malignant potential. Mod Pathol, 2005, 18 : 541-6
39. Papotti, M., Torchio, B., Grassi, L., Favero, A., Bussolati, G.: Poorly differentiated oxyphilic (Hurthle cell) carcinomas of the thyroid. Am J Surg Pathol, 1996, 20 : 686-94
40. Renshaw, A. A., Gould, E. W.: Why there is the tendency to “overdiagnose” the follicular variant of papillary thyroid carcinoma. Am J Clin Pathol, 2002, 117 : 19-21
41. Rocha, A. S., Soares, P., Fonseca, E., Cameselle-Teijeiro, J., Oliveira, M. C., Sobrinho-Simoes, M.: E-cadherin loss rather than beta-catenin alterations is a common feature of poorly differentiated thyroid carcinomas. Histopathology, 2003, 42 : 580-7
42. Rosai, J.: Poorly differentiated thyroid carcinoma: introduction to the issue, its landmarks, and clinical impact. Endocr Pathol, 2004, 15 : 293-6
43. Rosai, J.: Handling of thyroid follicular patterned lesions. Endocr Pathol, 2005, 16 : 279-83
44. Rosai, J., LiVolsi, V. A., Sobrinho-Simoes, M., Williams, E. D.: Renaming papillary microcarcinoma of the thyroid gland: the Porto proposal. Int J Surg Pathol, 2003, 11 : 249-51
45. Rosai, J., Zampi, G., Carcangiu, M. L.: Papillary carcinoma of the thyroid. A discussion of its several morphologic expressions, with particular emphasis on the follicular variant. Am J Surg Pathol, 1983, 7 : 809-17
46. Sahoo, S., Hoda, S. A., Rosai, J., DeLellis, R. A.: Cytokeratin 19 immunoreactivity in the diagnosis of papillary thyroid carcinoma: a note of caution. Am J Clin Pathol, 2001, 116 : 696-702
47. Sakamoto, A.: Definition of poorly differentiated carcinoma of the thyroid: the Japanese experience. Endocr Pathol , 2004, 15 : 307-11
48. Sakamoto, A., Kasai, N., Sugano, H.: Poorly differentiated carcinoma of the thyroid. A clinicopathologic entity for a high-risk group of papillary and follicular carcinomas. Cancer, 1983, 52 : 1849-55
49. Sanders, E. M. Jr, LiVolsi, V. A., Brierley, J., Shin, J., Randolph, G. W.: An evidence-based review of poorly differentiated thyroid cancer. World J Surg, 2007, 31 : 934-45
50. Santoro, M., Papotti, M., Chiappetta, G., Garcia-Rostan, G., Volante, M., Johnson, C., Camp, R. L., Pentimalli, F., Monaco, C., Herrero, A., Carcangiu, M. L., Fusco, A., Tallini, G.: RET activation and clinicopathologic features in poorly differentiated thyroid tumors. J Clin Endocrinol Metab, 2002, 87 : 370-9
51. Soares, P., Cameselle-Teijeiro, J. , Sobrinho-Simoes, M.: Immunohistochemical detection of p53 in differentiated, poorly differentiated and undifferentiated carcinomas of the thyroid. Histopathology, 1994, 24 : 205-10
52. Sobrinho-Simoes, M., Maximo, V., Castro, I. V., Fonseca, E., Soares, P., Garcia-Rostan, G., Oliveira, M. C.: Hurthle (oncocytic) cell tumors of thyroid: etiopathogenesis, diagnosis and clinical significance. Int J Surg Pathol, 2005, 13 : 29-35
53. Sobrinho-Simoes, M., Nesland, J. M., Johannessen, J. V.: Columnar-cell carcinoma. Another variant of poorly differentiated carcinoma of the thyroid. Am J Clin Pathol, 1988, 89 : 264-7
54. Sobrinho-Simoes, M., Preto, A., Rocha, A. S., Castro, P., Maximo, V., Fonseca, E., Soares, P.: Molecular pathology of well-differentiated thyroid carcinomas. Virchows Arch, 2005, 447 : 787-93
55. Thompson, L. D., Wieneke, J. A., Paal, E., Frommelt, R. A., Adair, C. F., Heffess, C. S.: A clinicopathologic study of minimally invasive follicular carcinoma of the thyroid gland with a review of the English literature. Cancer, 2001, 91 : 505-24
56. Vasko, V. V., Gaudart, J., Allasia, C., Savchenko, V., Di Cristofaro, J., Saji, M., Ringel, M. D., De Micco, C.: Thyroid follicular adenomas may display features of follicular carcinoma and follicular variant of papillary carcinoma. Eur J Endocrinol, 2004, 151 : 779-86
57. Vitagliano, D., Portella, G., Troncone, G., Francione, A., Rossi, C., Bruno, A., Giorgini, A., Coluzzi, S., Nappi, T. C., Rothstein, J. L., Pasquinelli, R., Chiappetta, G., Terracciano, D., Macchia, V., Melillo, R. M., Fusco, A., Santoro, M.: Thyroid targeting of the N-ras(Gln61Lys) oncogene in transgenic mice results in follicular tumors that progress to poorly differentiated carcinomas. Oncogene, 2006, 25 : 5467-74
58. Volante, M., Collini, P., Nikiforov, Y. E., Sakamoto, A., Kakudo, K., Katoh, R., Lloyd, R. V., LiVolsi, V. A., Papotti, M., Sobrinho-Simoes, M., Bussolati, G., Rosai, J.: Poorly differentiated thyroid carcinoma: the Turin proposal for the use of uniform diagnostic criteria and an algorithmic diagnostic approach. Am J Surg Pathol, 2007, 31 : 1256-64
59. Volante, M., Landolfi, S., Chiusa, L., Palestini, N., Motta, M., Codegone, A., Torchio, B., Papotti, M. G.: Poorly differentiated carcinomas of the thyroid with trabecular, insular, and solid patterns: a clinicopathologic study of 183 patients. Cancer, 2004, 100 : 950-7
60. Williams, E. D.: Guest Editorial: Two Proposals Regarding the Terminology of Thyroid Tumors. Int J Surg Pathol, 2000, 8 : 181-183
61. Zhu, Z., Gandhi, M., Nikiforova, M. N., Fischer, A. H., Nikiforov, Y. E.: Molecular profile and clinical-pathologic features of the follicular variant of papillary thyroid carcinoma. An unusually high prevalence of ras mutations. Am J Clin Pathol, 2003, 120 : 71-7
Labels
Anatomical pathology Forensic medical examiner ToxicologyArticle was published in
Czecho-Slovak Pathology

2008 Issue 4
-
All articles in this issue
- What is New in Pathology of the Thyroid Gland?
- Rafting in the Membrane. A Lesson Learnt from Lymphoproliferative Disorders
- Cutaneous Squamous Cell Carcinoma of Different Grades: Variation of the Expression of CD10
- Expression of Galectin-3, Cytokeratin 19, Neural Cell Adhesion Molecule and E-cadherin in Certain Variants of Papillary Thyroid Carcinoma
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Cutaneous Squamous Cell Carcinoma of Different Grades: Variation of the Expression of CD10
- What is New in Pathology of the Thyroid Gland?
- Rafting in the Membrane. A Lesson Learnt from Lymphoproliferative Disorders
- Expression of Galectin-3, Cytokeratin 19, Neural Cell Adhesion Molecule and E-cadherin in Certain Variants of Papillary Thyroid Carcinoma
